那位朋友能告诉我测高温α-淀粉酶的活力(固体的)计算公式呢?
在测原料奶掺淀粉酶的实验中需要向待检样中加入点淀粉液,然后再加入碘酒,观察反应颜色来判断是否掺有淀粉,但这里的淀粉液是怎么配的呀,是有标准的吧,请大家帮帮忙,谢谢!![img]http://img.foodmate.net/bbs/static/image/smiley/default/handshake.gif[/img]
在测原料奶掺淀粉酶的实验中需要向待检样中加入点淀粉液,然后再加入碘酒,观察反应颜色来判断是否掺有淀粉,但这里的淀粉液是怎么配的呀,是有标准的吧,请大家帮帮忙,谢谢!![img]http://img.foodmate.net/bbs/static/image/smiley/default/handshake.gif[/img]
α-淀粉酶活性是衡量小麦穗发芽的一个生理指标,为此提出了对小麦α-淀粉酶活性的快速测定方法的研究。α-淀粉酶活性的测定方法有多种,本文仅探讨了常用的3,5-二硝基水杨酸法和凝胶扩散法。结果表明,两种方法的测定结果差异不显著,而且两者呈显著正相关;从变异系数上看,后者的变异程度较低,其精度较高;从误差来源上看,前者引起误差的因素较后者多;后者较为简便快速,准确度较高,重复性较好,可用于大批量样品的分析。关键词: 小麦, α-淀粉酶活性, 3,5-二硝基水杨酸法,凝胶扩散法1 材料和方法1.1 材料和试剂(1)萌芽的小麦:取当年小麦种子,按小麦萌发试验培养,两天后用于测验.(2)1%淀粉溶液.(3)0.4N NaOH.(4)pH5.6的柠檬酸缓冲液:A. 称取柠檬酸20.01克,溶解后稀释至1升;B.称取柠檬酸钠29.41克,溶解后稀释至1升。取A液13.7毫升与B液26.3毫升混匀,即为pH5.6的缓冲液.(5)3,5-二硝基水杨酸: 精确称取3,5-二硝基水杨酸1克溶于20毫升1N氢氧化钠中,加入50毫升蒸馏水,再加入30克酒石酸钾钠,待溶解后,用蒸馏水稀释至100毫升,盖紧瓶塞,勿使二氧化碳进入.(6)麦芽糖标准液:称取麦芽糖0.100克溶于少量蒸馏水中,仔细移入100ml容量瓶中,用蒸馏水稀释至刻度.(7)α_淀粉酶提取缓冲液:20mmol/L醋酸钠(2.7216g/L),1mmol/L氯化钙(0.11099g/L),pH 5.5.(8)%5(V/V)碘—碘化钾溶液:1.95gKI+0.65gI2溶解在100毫升蒸馏水中.(9)α_淀粉酶36.18u/mg (Sigma公司):逐级稀释10, 2.5,0.625 ,0.15625,0.03906, 0.009765mg/mL系列标准液.(10)20%冰乙酸,琼脂糖,可溶性淀粉.1.2 方法1.2.1 3.5一二硝基水杨酸测定法酶液提取从五个培养皿的发芽小麦中,各随机称取1克于研钵中,加少许α_淀粉酶提取缓冲液,研磨至匀浆,倒入离心杯中,于4000rpm离心10分钟,取上清液并并定容至25ml,即为酶提取液,备用。α_淀粉酶活性测定(1)取试管,注明对照管,测定器,每样品三个重复.(2)于每试管中各加酶液1ml,加70℃恒温水浴中加热15分钟,此期间β_淀粉酶受热钝化(3)每管中各加入1毫升pH5.06的柠檬酸缓冲液.(4)对照管中加入4毫升0.4NnaOH.(5)测定管与对照管置40℃水浴中保温10分钟,再向各管加入40℃下预热的淀粉溶液2毫升摇匀,立即放入40℃水浴中准确保温5分钟取出,向各测定管迅速加入4毫升0.4N的氢氧化钠,以终止酶活动.麦芽糖测定取以上各管中酶作用后的溶液及对照管中溶液各2毫升,分别放入25毫升试管中,再加2毫升3,5-二硝基水杨酸,混匀,置水浴中5分钟,冷却后定容至25毫升,混匀,用分光光度计在520nm波长下进行比色记录消光值,取麦芽糖标准液(1ml/mg)0,0.2,0.6 ,1.0,1.4,1.8,2.0ml。按上述同样方法比色后,将测得的消光值与麦芽糖标准液进行直线回归后,代入求得样品的麦芽糖含量,并换算成每克种子α_淀粉酶的活力单位。1.2.2 凝胶扩散测定法凝胶板制备取一长方形优质玻璃,除一宽边外,其余三边边缘各边一条透明胶片,再在上面盖一同等大小玻璃,两块玻璃两侧用夹子固定,放温箱中预热50-60℃,取三角烧杯,加30毫升α-淀粉酶提取缓冲液,0.36克琼脂糖和0.30克可溶性淀粉(作反应底物),在电炉上加热煮沸至透明后,冷却至70℃左右,将预热的玻璃胶片框架斜放在桌面上30℃,用预热的移液管吸取凝胶液,从玻璃架高一端空隙中均匀注入,直至其流遍整个胶片表面为止,不能有气泡。用量约25毫升冷却后形成凝胶板,贮存在4℃冰箱备用。α_淀粉酶活性测定取出预制冷藏的凝胶板,揭开上面一块玻璃,用塑料打孔器在凝胶板上每隔一定距离打一个1.33毫米的孔,用微量移释管向每孔内注入提取液。上述1.2.1制得的酶液于70℃水浴加热15分钟后钝化β-淀粉酶后备用。同时,在每块凝胶板孔中加入淀粉酶系列标准液(重复两次)。将凝胶板置10℃恒温箱中反应24小时后,取出,将胶板浸入I-KI溶液中染色5min,加入冰乙酸酸化终止反应。用蒸馏水淋洗3min,洗净染色液,由于加α_淀粉酶孔周围淀粉被分解,因而染色后出现未能染色的圆。未与α-淀粉酶反应的呈蓝色,用直径测量仪测圆直径。用α_淀粉酶标准液浓度对数与褪色圈直径直线回归,计算每克样品含α-淀粉酶活力单位数。2 结果和分析2.1 两种方法标准曲线2.1.1 麦芽糖标准曲线麦芽糖标准液含量越高,比色后记录的OD值越大,麦芽糖标准液比色后,测得的OD值(x)与麦芽糖浓度(y)进行直线回归,结果为:y=1.0240x+0.0897,r=0.9998,相关系数极显著,表明麦芽糖标准液含量与消光值呈直线关系,通过此直线方程可进一步测得酶活性;即将各样品的消光值代入回归方程,求得样品麦芽糖含量,然后计算可得每克种子的α_淀粉酶活力。2.1.2 α-淀粉酶标准曲线α_淀粉酶标准液浓度越高,其褪色圈直径越大,5个样品的褪色圈直径也有明显差异。将α-淀粉酶标样所测得褪色圈直径(x)与α-淀粉酶浓度对数(y)进行直线回归。结果为:y=2.4659x-3.8994, r=0.9860,相关系数极显著,表明褪色圈直径与淀粉酶标准液的浓度对数呈直线关系,通过此直线方程可进一步测得酶活性,即将各样品的褪色圈直径代入回归方程,求得各样品的α_淀粉酶浓度,然后换算成每克种子中α_淀粉酶的活力单位。2.2 两种方法测定结果比较对5个样品的淀粉酶活性,用两种方法测定,并记录了测定结果(表1)。表1 3,5-二硝基水杨酸法和凝胶扩散法结果 样品 3,5-二硝基水杨酸法 凝胶扩散法 消光值 酶活性 (u/g) 直径 酶活性(cm) (u/g) 1 0.1010 2.191.20 4.03 2 0.1580 6.701.35 6.72 3 0.1460 5.241.27 5.06 4 0.1667 6.961.45 7.14 5 0.1477 5.481.28 5.86对两组样本进行t测验,测定结果为:t=1.2855, t0.05=2.0776,|t|r0.05,表明两种结果相关系数显著,即两种方法从其中之一测定结果可以推算出另一方法的测定结果。2.3 两种方法的精度比较表2 两种方法变异数分析结果 方法 平均数(u/g) 标准差(u/g) 变异系数CV(%) 3,5-二硝基水杨酸法 5.314 [
请做过淀粉含量检测的朋友提供一下信息吧.这个国标里提到的 高峰氏淀粉酶在哪里买阿?购买的型号\大致的价格?按照国标的配置,这个淀粉酶加了三氯甲烷后大概可以保存多久呢.?
药典胰淀粉酶的测定中2000年版的和2005年版的标准检测所用的碘液浓度分别是0.1mol/L和0.05mol/L,为什么变化这么大呢,检测出来的结果差距也很大,用2000版的测得10万单位的酶活用2005年版才测得5万,而且我发现用2005年版的话空白减样很难控制在2.0-4.0mL之间,谁知道现在测胰酶最新版是哪个版吗,用的碘浓度是0.1的还是0.05的?
最近在看国标方法,发现在奶粉检测方面,所有的前处理都使用了淀粉酶水解,问同事说不水解结果不对的,可是为什么不对没有人能说清楚!请问有人知道吗?谢谢!
做一个抗生素的消化破坏试验,液相检测,样品在PH4.0缓冲盐溶液中加入适量淀粉酶消化2小时,样品中含量一定量和油脂,觉得淀粉酶和油脂对检测有影响,主要表现为:直接取消化液离心,过滤进样,结果压力从13MPa上升到15MPa,第二针甚至直接基线超出检测范围,平顶20分钟也没有见降下来过.如何除去水相中的淀粉酶和油脂,待测成分溶于水.同时不知道是不是油脂起到了离子对的作用,待测成分的保留时间比文献中介绍的长很多.
热稳定α-淀粉酶与α-淀粉酶是指同一物质吗?
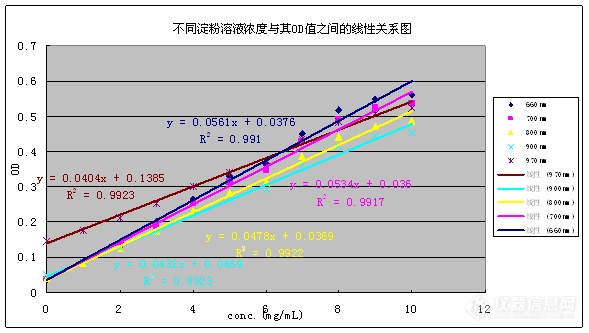
[align=center][b]使用酶标仪测定α-淀粉酶抑制率方法的研究[/b][/align][align=left][b]1.实验原理[/b][/align][align=left] 淀粉的消化主要有α-淀粉酶与α-葡萄糖苷酶的参与,α-淀粉酶水解α-1,4-连接键,消化的产物主要有麦芽糖、麦芽三糖、α-糊精,这些物质的进一步消化要在小肠上靠α-葡萄糖苷酶进行,α-葡萄糖苷酶主要包含麦芽-葡糖淀粉酶与蔗糖-异麦芽糖酶,α-葡萄糖苷酶水解的产物是葡萄糖。因此,通过抑制淀粉酶或葡萄糖苷酶的活性,阻碍食物中碳水化合物的水解与消化,减少糖分的吸收,以达到控制体内血糖浓度水平。[/align][align=left] 本实验是针对淀粉酶水解淀粉溶液而导致溶液中浑浊度的变化,测定溶液吸光度值的变化,以抑制剂阿卡波糖作为参照标准,抑制淀粉酶的能力以阿卡波糖当量来表达。[/align][align=left][b]2.实验方法与数据处理[/b] 将空白、样品或标准抑制剂Acarbose(阿卡波糖)与α-淀粉酶溶液混合均匀,37℃保温孵育15min,然后再加入淀粉溶液,快速振荡后在660nm迅速开始测定,利用酶标仪配备软件记录吸光度OD,初始吸光度值记为f1,以后每隔一段时间测定一个点,吸光度分别记为f1, f2 …,抑制剂作用下衰减曲线下的积分面积,扣除无抑制剂的空白曲线下面积,得出抑制剂的曲线下净面积(Net AUC)。衰退曲线下面积AUC可以近似看作各梯形面积之和,可以表达为:AUC=0.5×(f[sub]1[/sub]+f[sub]2[/sub])×ΔT+0.5×(f[sub]2[/sub]+f[sub]3[/sub])×ΔT+...+0.5×(f[sub]x[/sub]+f[sub]x+1[/sub])×ΔT+...+0.5×(f[sub]n-1[/sub] +f[sub]n[/sub])×ΔT=0.5×[2×(f[sub]1[/sub] +f[sub]2[/sub] +...+ f[sub]n-1[/sub] +f[sub]n[/sub])-f[sub]1[/sub] -f[sub]n[/sub]]×ΔT其中f[sub]n[/sub]代表第n个测定点时的吸光度,ΔT为相邻两个测定点之间的时间间隔,因本实验测定方法中ΔT设定为2min,一共有61测定点,因此该公式可以简化为:AUC=2×(f[sub]2[/sub]+f[sub]3[/sub]+...+f[sub]60[/sub])+ f[sub]1[/sub] + f[sub]61[/sub]以Acarbose当量μmol Acarbose equivalent/g (μmol AE/g)表达。[/align][align=left][b]3.试剂溶液的制备3.1 磷酸盐缓冲溶液3.1.1 CaCl[sub]2[/sub]溶液[/b]准确称取CaCl[sub]2[/sub]2H[sub]2[/sub]O粉末0.25g溶于100 mL ddH[sub]2[/sub]O,即为CaCl[sub]2[/sub]溶液2500mg/L。[b]3.1.2缓冲溶液工作液[/b]分别称取8.9g Na[sub]2[/sub]HPO[sub]4[/sub]2H[sub]2[/sub]O与6.9g NaH[sub]2[/sub]PO[sub]4[/sub]H[sub]2[/sub]O于1000 mL容量瓶中,再量取CaCl[sub]2[/sub]溶液20 mL,混合后用ddH[sub]2[/sub]O定容至1000 mL,这样得到0.1M,pH 6.9的缓冲溶液,冰箱下贮存。[b]3.2 玉米淀粉溶液[/b]玉米淀粉储备液:准确称取约1.0000g大米淀粉,加入50mL缓冲液,磁力搅拌数分钟后置于78℃左右水浴10分钟,于磁力搅拌器中搅拌自然冷却至室温,即为2%的淀粉溶液(20mg/mL);玉米淀粉工作液:将储备液用缓冲溶液依次分别稀释至1.0-10mg/mL的工作液。[b]3.3 α-淀粉酶溶液[/b]准确称取α-淀粉酶固体粉末(23U/mg)40mg,用缓冲溶液定容至10 mL,即为4mg /mL的α-淀粉酶储备液,再依次稀释至0.2、0.1、0.05、0.04、0.025 mg /mL的α-淀粉酶工作液。[b]3.4 Acarbose标准溶液的配制[/b]0.1g acarbose定容到100 mL磷酸缓冲液中,得到1mg /mL贮备液,然后用磷酸缓冲溶液依次稀释成的工作液0.01、0.02、0.03、0.04、0.05 mg /mL。[b]4.研究步骤[/b][/align][align=left][b]4.1 淀粉溶液的线性范围[/b] 由于本实验是对样品中浑浊度的变化来进行,而对浑浊度的测量不像紫外-可见分光光度计那样有理想的波长以及会出现明显的特征峰,根据文献大多数浑浊度的测量波长在620-700nm之间。为了确定玉米淀粉溶液的线性,我们选择玉米淀粉溶液的浓度在0-10mg/mL,波长选择660、700、800、900、970nm进行比较。使用玉米淀粉工作液0-10mg/mL,分别在660nm、700nm、800nm、900nm、970nm波长下测定其吸光度,重复测定3次。不同波长下淀粉溶液浓度与其OD值之间的线性关系图如下:[/align][align=left][img=,589,333]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171420555396_7331_1613776_3.png!w589x333.jpg[/img][/align][align=left][table][tr][td][align=center]波长/nm[/align][/td][td][align=center]线性相关系数R[sup]2[/sup][/align][/td][td][align=center]线性斜率[/align][/td][td][align=center]空白OD值[/align][/td][td][align=center]LOD检测限[/align][/td][td][align=center]LOQ定量限[/align][/td][/tr][tr][td][align=center]660[/align][/td][td][align=center]0.9910[/align][/td][td][align=center]0.0561[/align][/td][td][align=center]0.038±0.001[/align][/td][td][align=center]0.048[/align][/td][td][align=center]0.159[/align][/td][/tr][tr][td][align=center]700[/align][/td][td][align=center]0.9917[/align][/td][td][align=center]0.0534[/align][/td][td][align=center]0.038±0.001[/align][/td][td][align=center]0.052[/align][/td][td][align=center]0.174[/align][/td][/tr][tr][td][align=center]800[/align][/td][td][align=center]0.9922[/align][/td][td][align=center]0.0478[/align][/td][td][align=center]0.041±0.002[/align][/td][td][align=center]0.093[/align][/td][td][align=center]0.310[/align][/td][/tr][tr][td][align=center]900[/align][/td][td][align=center]0.9923[/align][/td][td][align=center]0.0432[/align][/td][td][align=center]0.051±0.002[/align][/td][td][align=center]0.108[/align][/td][td][align=center]0.361[/align][/td][/tr][tr][td][align=center]970[/align][/td][td][align=center]0.9923[/align][/td][td][align=center]0.0404[/align][/td][td][align=center]0.145±0.002[/align][/td][td][align=center]0.138[/align][/td][td][align=center]0.458[/align][/td][/tr][/table]从上图及上表中可以知道,玉米淀粉浓度在0-10mg/mL时的线性关系均较好,相关系数均在0.99以上。虽然线性相关系数较低,但在波长660nm下的线性斜率高于其他波长下的线性斜率,且LOD检测限与LOQ定量限均是最小,因此选择波长660nm作为测定波长。[/align][align=left][b]4.2 淀粉酶的活力[/b] 将20μL的缓冲溶液与20μL的不同浓度α-淀粉酶溶液混合均匀,37℃保温孵育15min,然后再加入60μL的2%淀粉溶液,快速振荡后在660nm迅速开始测定其吸光度值。以不同浓度的淀粉酶浓度0.4、0.2、0.1、0.05、0.04、0.025 mg /mL,底物选择20mg/mL的淀粉溶液进行试验,在660nm下测定其吸光度值的变化曲线。660nm下其吸光度值的衰退曲线图:[/align][align=left][img=,672,359]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171423163167_2471_1613776_3.png!w672x359.jpg[/img][/align][align=left]从上图,在660nm波长下,不同淀粉酶浓度使淀粉溶液的吸光度下降,而且淀粉酶浓度越大,吸光度下降的越快。AUC与淀粉酶浓度成负相关关系,随着酶浓度的增大,曲线下面积AUC逐渐减小。[/align][align=left][b]4.3 抑制剂阿卡波糖活力[/b] 采用不同浓度的阿卡波糖浓度0.01、0.02、0.03、0.04、0.05 mg /mL分别进行试验(n=3),淀粉溶液的浓度选择20mg/mL,淀粉酶浓度选择0.2mg /mL。通过试验,各个不同浓度的阿卡波糖抑制曲线图如下:[/align][align=left][img=,687,390]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171426550249_8100_1613776_3.png!w687x390.jpg[/img][img=,668,320]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171426580379_7253_1613776_3.png!w668x320.jpg[/img][/align][align=left]从上图看出,阿卡波糖浓度 在0.01-0.05 mg /mL之间与其曲线下净面积Net AUC的线性较好,相关系数R[sup]2[/sup]=0.9972。[/align][align=left][b]4.4 线性研究[/b] 以不同浓度的阿卡波糖0.01、0.02、0.03、0.04、0.05、0.06、0.07mg /mL分别进行试验,淀粉溶液的浓度选择20mg/mL,淀粉酶浓度选择0.2mg /mL。通过试验,各个不同浓度的阿卡波糖抑制曲线图如下:[/align][align=left][img=,690,359]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171427557847_1976_1613776_3.png!w690x359.jpg[/img][/align][align=left]不同浓度的阿卡波糖与其曲线下净面积Net AUC的线性关系图如下(重复试验7次):[/align][align=left][img=,690,359]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171427580179_2403_1613776_3.png!w690x359.jpg[/img][/align][align=left][table][tr][td][align=center]n[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][td][align=center]7[/align][/td][td][align=center]av[/align][/td][td][align=center]SD[/align][/td][td][align=center]%RSD[/align][/td][/tr][tr][td][align=center]R[sup]2[/sup][/align][/td][td][align=center]0.9909[/align][/td][td][align=center]0.9806[/align][/td][td][align=center]0.9788[/align][/td][td][align=center]0.9942[/align][/td][td][align=center]0.9934[/align][/td][td][align=center]0.991[/align][/td][td][align=center]0.9932[/align][/td][td][align=center]0.9889[/align][/td][td][align=center]0.0064[/align][/td][td][align=center]0.6477[/align][/td][/tr][tr][td][align=center]SLOPE[/align][/td][td][align=center]4433.9[/align][/td][td][align=center]4850.1[/align][/td][td][align=center]4500[/align][/td][td][align=center]4219.3[/align][/td][td][align=center]5675.1[/align][/td][td][align=center]4468[/align][/td][td][align=center]5110.9[/align][/td][td][align=center]4751[/align][/td][td][align=center]503.27[/align][/td][td][align=center]10.593[/align][/td][/tr][/table]从上表看出,不同浓度的阿卡波糖与其曲线下净面积Net AUC之间的线性相关系数R[sup]2[/sup]在0.9889±0.0064之间,相对标准偏差0.65%;斜率在4751±503.3之间,相对标准偏差10.6%。[/align][align=left][b]4.5 提取溶剂的影响[/b]对提取溶剂(丙酮:乙醇:水的混合溶剂)进行研究,即以提取溶剂代替缓冲溶液进行试验,并与缓冲溶液进行比较。[/align][align=left][img=,609,340]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171437196510_7149_1613776_3.png!w609x340.jpg[/img][/align][align=left]其中:BLK——20μL缓冲溶液+20μL淀粉酶+60μL淀粉;BLK1——20μL提取溶剂+20μL淀粉酶+60μL淀粉;Emp——40μL缓冲溶液+60μL淀粉;Emp1——40μL提取溶剂+60μL淀粉。[/align][align=left]通过对提取溶剂稀释10、100、1000、10000倍后再进行同样试验(如下图):[/align][align=left][img=,657,362]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171438035079_1244_1613776_3.png!w657x362.jpg[/img][/align][align=left]从图上看出,通过对提取溶剂稀释10、100、1000、10000倍后试验,基本对测定无影响。[/align][align=left][b][b]4.6 样品检测[/b][/b][/align][align=left][b] 将[/b]样品提取液代替阿卡波糖加入到淀粉酶溶液中,37℃保温孵育15min,然后再加入淀粉溶液,快速振荡后在660nm迅速开始测定。通过计算得出样品中的AE(阿卡波糖当量)。也可以通过比较抑制率IC50,来判断样品中的淀粉酶抑制率强弱。[/align][align=left][b]5.小结[/b] 通过以上对α-淀粉酶抑制率试验方法进行研究,实验表明,该方法适用于样品中α-淀粉酶抑制率的筛选。[/align][align=left]注意事项:[/align][align=left]1. 标准溶液或者样品与淀粉酶溶液混合后需在37℃保温孵育15min,再加入淀粉溶液;[/align][align=left]2. 加入淀粉溶液让后需要快速振荡后在660nm迅速开始测定;[/align][align=left][b]6.参考文献[/b]1. LEE WAH KOH, LIN LING WONG, YING YAN LOO, STEFAN KASAPIS, AND DEJIAN HUANG. J. Agric. Food Chem. 2010, 58, 148-1542. ALVIN ENG KIAT LOO AND DEJIAN HUANG. J. Agric. Food Chem. 2007, 55, 9805-98103. Elena Lo Piparo, Holger Scheib,Nathalie Frei, Gary Williamson, Martin Grigorov, and Chieh Jason Chou. J. Med. Chem. 2008, 51, 3555-35614. TOSHIRO MATSUI, TAKASHI TANAKA, SATOMI TAMURA, ASAMI TOSHIMA,KEI TAMAYA,YUJI MIYATA,KAZUNARI TANAKA, AND KIYOSHI MATSUMOTO. J. Agric. Food Chem. 2007, 55, 99-105[/align]
米饭中淀粉酶解率怎么测?
最近有几批蜂蜜原料,我用试管目光测定法和分光光度法测定蜂蜜中的淀粉酶的酶值相差很大。试管目光测定法测定结果为10多一点,而分光光度法测定的结果却是25,这是为什么啊?辈做过愿意赐教的啊?目光比色发(试管发)(一)原理 1.淀粉酶能将淀粉水解为精糊.麦芽糖,最终分解为葡萄糖.水解条件要求条件pH5.3,温度为40℃时淀粉酶作用活力最高,其反应式为: 2.淀粉与碘作用生成蓝色化合物,所以试管中的试剂空白为蓝色.如果样液仍然是蓝色,那么说明试验中加入的淀粉被蜂蜜中的淀粉酶水解为葡萄糖. 3.淀粉酶值系指1g蜂蜜中所含淀粉酶,在一定条件下可以转化1%淀粉溶液的体积(mL).(二) 试剂 (1)NaOH溶液(0.05mol/L) 称取2.0g氢氧化钠溶解于1000mL 经煮沸冷却后的水中. (2)NaCl溶液(0.1mol/L) 称取0.59g氯化钠溶解于100mL水中. (3)CH3COOH溶液(0.02mol/L) 吸取 1.0mL冰醋酸,加入800mL水中. (4)淀粉溶液(1.0%) 准确称取1.0g可溶性淀粉于烧杯中,加入少量水使成薄浆,加入60mL煮沸蒸馏水,在搅拌下煮沸1~2min,使淀粉溶液呈透明,稍冷,用水将淀粉溶液移入200mL容量瓶中.冷却后用水稀解至刻度,摇均.次溶液临时配制.其pH为4.8~5.5检查此溶液时,吸取0.2mL淀粉溶液,用蒸馏水稀解至30mL,加人0.1mol/L(1/2 I2)溶液,,应呈纯蓝色. (5)1/2 I2溶液(0.1moL/L) 称取13.0g在升华的碘和18.0g碘化钾,溶于100mL水中,并用水稀释至1000mL,摇均,储存于棕色具塞玻璃瓶中. (6)酚酞指示剂 1%乙醇溶液.(三)操作方法 称取10.0g试样,溶解于50~70mL水中,加入酚酞指示剂4滴,用0.05mol/L NaOH溶液中和至中性.将此溶液移入100mL容量瓶中,用水稀释至刻度,混均. 取大小相同的试管12个,做好序号标记,安表7-5分别顺序加入蜂蜜试样溶液.蒸馏水. 0.02mol/LCH3COOH溶液. 0.1mol/L NaCl溶液和1%淀粉溶液.摇均,立刻将所有试管同时放入水浴中,使试管液面在水浴下面约为2.5cm,在此温度下放置1h. 取出后立即将所有的试管同时放入冰水浴冷却. 随即在每一试管中加入1滴0.1mol/L(1/2I2)溶液,摇均后立即观察(必要时再多加1滴碘溶液后观察).此时各试管的颜色顺序,由黄色经红色.紫红色至蓝色. 根据紫红色试管的号数由表7-5查的被测样品的淀粉酶值. 说明:本法所用蒸馏水均需煮沸后冷却. 表7-5 蜂蜜中淀粉酶值表 试管序号 试样溶液 蒸馏水 0.02mol/L CH3COOH 0.1mol/L NaCl 1%淀粉液 总体积 /mL 淀粉酶值 1 10 4.0 0.5 0.5 1.0 16 1.0 2 10 2.5 0.5 0.5 2.5 16 2.5 3 10 0.0 0.5 0.5 5.0 16 5.0 4 7.7 2.3 0.5 0.5 5.0 16 6.5 5 6.0 4.0 0.5 0.5 5.0 16 8.3 6 4.6 5.4 0.5 0.5 5.0 16 10.9 7 3.6 6.4 0.5 0.5 5.0 16 13.9 8 2.8 7.2 0.5 0.5 5.0 16 17.9 9 2.1 7.9 0.5 0.5 5.0 16 23.8 10 1.7 8.3 0.5 0.5 5.0 16 29.8 11 1.8 3.7 0.5 0.5 5.0 16 38.5 12 1.0 9.0 0.5 0.5 5.0 16 50.0 分光光度法是按照GB/T 18932.16--2003的方法做的啊。分光光度法见附件 [em09509][~165803~]
请问各位老师,α-淀粉酶溶解之后应该是个什么现象,悬浊液?还是还有固体颗粒状的东西呢,在做5009.82的时候遇到这个问题了,我们溶解出来是含有固体颗粒的沉淀的,结果做出来比标示值大了200%怎么做都降不下来,不知道是不是淀粉酶的原因,求各位老师指导一下??????
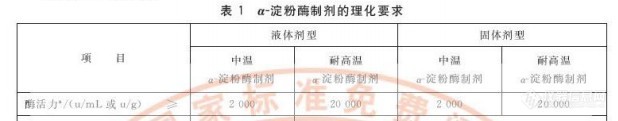
http://ng1.17img.cn/bbsfiles/images/2011/11/201111041426_328516_1638724_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/11/201111041445_328518_1638724_3.jpg其中,耐高温淀粉酶活力是液化1mg是否有错误,应该与中温一样,是1g底物。如果没有错的话是不是说耐高温酶1min内可以液化20000mg的可溶性淀粉?
在不溶性膳食纤维的测定中,会用到的α-淀粉酶的性状,有人知道不?正常的α-淀粉酶是不是有一股臭脚丫的味道?知道的请回个贴吧,谢谢![em0808]
我用试管法测定蜂蜜中的淀粉酶活性和用分管光度计法测定蜂蜜中的淀粉酶活性,数值差别在2倍左右。不知为什么?
麦芽糖淀粉酶最适温度ph是多少?
山药富含淀粉酶、多酚氧化酶等成分,有助于增强脾胃的消化吸收能力,既可炖煮或炒制,也可制成山药粥或山药糕。
食品的膳食纤维检测中,两种酶(淀粉酶和葡萄糖苷酶各多加了50ul)多加了,会怎样?
各位大侠,蜂王浆中含有淀粉酶吗?谢谢!
蜂蜜中淀粉酶值——分光光度法测定,最后结果处理公式中X = 300/t, 不明白这个300从何而来?求助!急盼!在此先谢了!
GB/T5009。88-2008酶重量法测膳食纤维用的淀粉酶、蛋白酶、葡萄糖苷酶的活性怎么测?
淀粉酶活性代表了蜂蜜的哪些特性?对人体有何益处?望老师不吝赐教
各位:最近公司需求检测奶粉中的维生素B1,B2,B6,参照的是GB 5413.11,GB 5413.12,GB 5413.13—2010中的方法。其中需要配制一种混合酶溶液,具体操作如下:混合酶溶液:称取2.345 g 木瓜蛋白酶(活力单位≥600 U/g)、1.175 g 淀粉酶(活力单位≥4000 U/g)和1.000 g 酸性磷酸酶(活力单位≥4000 U/g),用水定容至50 mL。临用前配制。想咨询的是其中的木瓜蛋白酶、 淀粉酶及酸性磷酸酶应该买哪一种的,如果各位有做过的话,麻烦赐教。最好能告知:供应商及对应的货号。万分感谢!
[align=center]【我们不一YOUNG】淀粉的测定--酶水解法[/align](一) 原理[img]https://ng1.17img.cn/bbsfiles/images/2024/07/202407261509074564_753_1615838_3.png[/img](二)适用范围及特点 因为淀粉酶有严格的选择性、只水解淀粉而不会水解其他多糖,水解后通过过滤可除去其他多糖。所以该法不受半纤维素、多缩戊糖、果胶质等多糖的干扰,适合于这类多糖含量高的样品,分析结果准确可靠,但操作复杂费时。(三)说明与讨论酶水解开始要使淀粉糊化 将烧杯置沸水浴上加热15分钟,冷至60℃以下,然后再加入20mL淀粉酶溶液,在55—60℃保温1小时,并不时搅拌。 取1滴此液于白色点滴板上,加1滴碘液应不呈蓝色,若呈蓝色,再加热糊化,冷却至60℃以下,再加20mL淀粉酶溶液,继续保温,直至酶解液加碘液后不呈蓝色为止,加热至沸使酶失活,冷却后移入250mL容量瓶中,加水定容。混匀后过滤,弃去初滤液,收集滤液备用。淀粉糊化——淀粉吸水溶胀,破坏晶格结构,变成粘度很大的淀粉糊,使其易被淀粉酶作用。糊化 = α-化糊化度又称α-化度酶水解未糊化淀粉速度:酶水解糊化淀粉速度= 1:20000 方便快餐食品经α-化后,复水性强,好消化。 方便面检测项目中有α-化度的测定。淀粉α化度的测定原理:已糊化的淀粉,在淀粉糖化酶的作用下,可水解为还原糖, α化度越高,即糊化的的淀粉越多,水解后生成的糖越多。先将样品充分糊化,经淀粉糖化酶水解后,用碘量法测糖含量。以此作为标准,糊化程度为100%。然后另取样品,不糊化,用淀粉糖化酶直接水解,用同样方法测定糖含量,通过计算可求出被测样品的相对糊化程度,即样品的α化度。
各位前辈,有没有知道如如何用电位差测定法(Potentiometry)测定蜂蜜中的淀粉酶?目前我们公司是用试管目光测定法测得酶值,有批产品我公司测得酶值为10,但是德国方面用电位差测定法(Potentiometry)测得的酶值是30多。哪位高人能不能指点一下啊?另外,同一批产品我们用分光光度法测得的酶值却是20几,为什么试管目光测定法和分光光度法测得的结果会有这么大的差距?跪求高人指点!!!!![em09509]
[size=16px][color=#333333]点击链接查看更多:[url]https://www.woyaoce.cn/service/info-39502.html[/url]服务背景[/color][/size]淀粉是高分子碳水化合物,是由葡萄糖分子聚合而成的多糖,淀粉的基本构成单位为α-D-吡喃葡萄糖。淀粉的应用广泛,其中变性淀粉是重点,变性淀粉是指利用物理、化学或酶的手段改变原淀粉的分子结构和理化性质,从而产生新的性能与用途的淀粉或淀粉衍生物。淀粉检测范围纯淀粉、豌豆淀粉、木薯淀粉、玉米淀粉、大米淀粉、甘薯淀粉、土豆淀粉、地瓜淀粉、酸解淀粉、氧化淀粉、交联淀粉、酯化淀粉、醚化淀粉、接枝淀粉、酶处理淀粉、酸变性淀粉、预糊化淀粉、功能性淀粉、淀粉制品等。[size=16px][color=#333333]检测内容[/color][/size]淀粉检测项目成分检测、淀粉含量检测、感官检测、膳食纤维检测、水分检测、漂白剂检测、细度检测、明矾检测、粘度检测、蛋白质检测、灰分检测、二氧化硫检测、微生物检测、白度检测、重金属检测、色度检测、氰化物检测等。[size=16px][color=#333333]检测标准[/color][/size][table][tr][td]产品名称[/td][td]检测项目[/td][td]检测标准[/td][/tr][tr][td]淀粉[/td][td]淀粉分类[/td][td]GB/T 8887-2021[/td][/tr][tr][td]淀粉[/td][td]预糊化淀粉[/td][td]GB/T 38573-2020[/td][/tr][tr][td]淀粉[/td][td]食用玉米淀粉[/td][td]GB/T 8885-2017[/td][/tr][tr][td]淀粉[/td][td]食用小麦淀粉[/td][td]GB/T 8883-2017[/td][/tr][/table][size=16px][color=#333333]我们的优势[/color][/size]淀粉检测流程1、沟通需求:了解待检测项目,确定检测范围;2、报价:根据检测项目及检测需求进行报价;3、签约:签订合同及保密协议,开始检测;4、完成检测:检测周期会根据样品及其检测项目/方法会有所变动,具体可咨询检测顾问;5、出具检测报告,进行后期服务;
请问有哪位知道要怎样才能找到白沙糖和食用玉米淀粉的标准检测方法呢??急需啊??
淀粉乳检测和淀粉PH值检测不知道有没有国家标准,有哪位高手知道,请告知![em20]
哪位有淀粉中二氧化硫含量检测标准?