[font=&]检测100万IU/g维生素A醋酸酯原液,用5009.82检测,检测到维生素A是一半左右,是大部分维生素A醋酸酯在检测过程中不能转换成维生素A吗[/font]
大家依据GB5413.9-2010做乳粉中维生素D的检测的时,维生素D待测液净化的时候用的什么设备?是制备色谱仪?还是进化萃取小柱?大家是否能提供点信息?万分感谢!制备色谱仪或是萃取小柱用的什么牌子?
发现现在制定国标的似乎都是一帮猪,那么简单的维生素检测,用液相色谱简单得不得了,却偏偏要用微生物法来做,用微生物法也罢,明明ISO的标准很成熟,他妈的搬过来的时候却偏偏要改一下,他妈的改的却偏偏是关键,改得就乱七八糟做不出来,再说现在这实验室检测维生素有谁会有美国时间花个N天去检测啊,报的是微生物法检测恐怕用的都是色谱法吧
请教各位前辈 有没有人做过GB5413.11 婴幼儿食品和乳品中维生素B1的测定》, 最近检测大米中的维生素B1 按照这个标准做,回收率很低,还不到10%? 有没有做过这方面项目的高手 指点一二?
我们现在做维生素的检测,遇到以下几个问题,希望高手门能给于解答。1.标液出峰的问题:我们现在配的是混标(VA、VD两种、VE三种)维生素A是完全没有问题,但是VD,VE这5个峰有点分离效果不太好,浓度低时这5个峰是完全可以分开的,但是一旦样品中这5种物质一高就会有部份重叠了。2.加标准回收的问题,现在只是用空白做加标皂化后回收率都只有20%,请问一下是哪里出了问题?3.做这些维生素的有没有什么地方要特别的注意的
1. 前言“3·15”晚会曝光了部分企业未经保健食品许可,使用普通食品许可证违法生产经营儿童鱼肝油。此类产品被消费者购作儿童食品,极可能对我们的儿童造成严重影响和不良后果。鱼肝油中的维生素A和维生素D,作为其质量衡量的标准,我国药典和国家标准已有严格的方法检测。默克密理博致力于标准分析方法的重现和稳定性保证,为广大用户提供相应的分析试剂、色谱柱耗材。2. HPLC方法和试剂CHP2010 维生素A、D测定法:色谱柱:Purospher STAR Si 5um 250*4.6mm(货号:1.50357.0001,高纯硅胶,高柱效)流动相:99.7% 正己烷(HPLC级别,货号:1.04391.4008) 3.0% 异丙醇(HPLC级别,货号:1.01040.4008)流速:1.0 mL/min 柱温:25℃检测:UV325nm 进样量:10μLGB 54139-2010 维生素A的测定:色谱柱:Purospher STAR LP C18 5um 250*4.6mm(货号:1.56200.0008,高纯硅胶,高柱效)流动相:甲醇(HPLC级别,货号:1.06007.4008)流速:1.0 mL/min 柱温:35℃±1℃检测:UV325nm 进样量:20μLGB 54139-2010 维生素D待测液的净化:色谱柱:Purospher STAR Si 5um 150*4.6mm(货号:1.50356.0001,高纯硅胶,高柱效)流动相:50% 环己烷(HPLC级别,货号:1.02827.2500) 50% 正己烷(HPLC级别,货号:1.04391.4008) 0.8%异丙醇(HPLC级别,货号:1.01040.4008)流速:1.0 mL/min 柱温:35℃±1℃检测:UV264nm 进样量:500μLGB 54139-2010 维生素D测定液的测定:色谱柱:Purospher STAR C18 5um 250*4.6mm(货号:1.51456.0001,高纯硅胶,高柱效)流动相:甲醇(HPLC级别,货号:1.06007.4008)流速:1.0 mL/min 柱温:35℃±1℃检测:UV264nm 进样量:100μL参考标准:1. CHP2010维生素A、D测定法;2.《GB 54139-2010 婴幼儿食品和乳品中维生素A、D、E 的测定》
检测维生素A时总是出现标品的出峰时间比样品的出峰时间晚2分钟左右,样品最后出来的图谱分析中只有一个最大峰的分析值,其他小峰都没有分析结果,是哪里什么问题?
[color=#444444]有检测血清中维生素的吗[/color][color=#444444]?[/color][color=#444444]讨论讨论[/color][color=#444444]![/color][color=#444444]你们都用什么方法[/color][color=#444444]?[/color]
我马上要做奶粉中维生素ADE了,想请大家帮个忙。为什么在检测中维生素D中用的是硅胶柱,而且流动相是环己烷和正己烷,我要是换成反相色谱柱,用甲醇做流动相可以吗?前处理还有简单的方法看见吗?谢谢各位了!非常着急!
请问下各位老师,维生素C检测使用液相色谱是否有标准参考,谢谢!
最近研究维生素C钙的有关物质,液相检测方法摸索很久都不能确定,目前查阅到的仅仅为EP药典中维生素C的液相检测方法,采用的是氨基柱,磷酸盐缓冲液与乙腈(25:75)。采用该色谱条件,柱子不耐用氨基柱容易坏,而且样品检测重复性差。本人的疑惑是维生素C钠在EP标准中有关物质检查的色谱条件与维生素C是一样的,而维生素C钙有关物质这项是缺项。是不是说明维生素C钙与维生素C钠和维生素C不一样?不能参考它们的液相条件检测?是因为钙离子比较特殊不能像钠离子一样进入色谱系统?
维生素C又叫抗坏血酸(Ascorbicid),广泛存在于植物组织中,新鲜的水果、蔬菜中含量较多。是一种水溶性小分子生物活性物质,也是人体需要量最大的一种维生素。维生素C具有还原性(其结构式如图1),可以与许多氧化剂发生氧化还原反应,因此可以利用其还原性测定维生素C的含量。目前食品中测定维生素C含量的方法主要有碘量法,是利用维生素C的氧化还原性为基础的一种氧化还原方法。冈其酸度不易把握,碘需要标定且易挥发,而Vc不易稳定保存,使测定结果易出现偏差,且这种方法不适合微量分析;国标GB/T6195-1986是采用2,6一二氯靛酚滴定法。利用样品溶液由蓝色转变为粉红色来辨别其滴定终点的到达。但是多数水果、蔬菜样品其提取液都具有一定的色泽而导致滴定终点不明显,使测定准确度降低。另外还有荧光光谱分析法 J、紫外一可见分光度法、色谱法、电化学法等,这些方法都存在着一定的局限性,如操作过程复杂,所用试剂不稳定,速度慢、背景¨干扰大。近年来,建立的测定Vc的其他方法还有催化动力学和光度法相结合的方法,及VC传感器测定方法,固定pH滴定法等。 该论文将对蔬菜、水果常用的维生素C含量的检测方法进行综述、比较。 图1 维生素C的结构式1原子吸收分光光度法利用原子吸收分光光度法问接测定维生素C的含量,是利用维生素C可以与一些金属离子发生氧化还原反应,通过测定反应掉的金属离子的量,进而间接计算出维生素c的含量。1.1以银离子作为氧化剂的间接原子吸收分光光度法以银离子作为氧化剂的间接原子吸收分光光度法,是利用维生素C分子中的有二烯醇基具强还原性,可被硝酸银氧化为去氢维生素C,同时产生黑色银沉淀(反应式如图2)。 图2维生素C与银离子反应的反应式 沉淀经离心分离后,将分离得到的沉淀用硝酸溶解后,再利用原子吸收分光光度计测定银离子的含量,从而接测得维生素C含量,具体测定方法如下: 配制一系列浓度的维生素C标准溶液,依次吸取一定量的维生素C标准溶液置于10mL离心管中,分别加入2mL(1mg/mL) Ag+标准溶液,然后加水使总体积为4mL,摇匀,在室温下避光放置35min离心分离弃去上清液,用2mL超纯水洗涤沉淀3次,然后用l:1的浓硝酸3mL溶解沉淀,移入50mL的容量瓶中,加水稀释至刻度。喷入空气-乙炔火焰分别测定其吸光度,以维生素C标准溶液的浓度为横坐标,以测得的吸光度值为纵坐标绘制标准曲线。最后将处理过的待测样按上述方法测定其维生素C含量。 上述方法巾维生素C标准溶液及样品的配制都是利用2%的柠檬酸作为溶剂,并在棕色瓶中保存,原因是维生素C在溶液中不稳定,遇氧气、光、热、碱性物质易受破坏,而在适当的酸性条件下比较稳定,用2%的柠檬酸溶液来配制维生素C标准溶液,减缓了维生素C被氧化的速度,同时消除了一定外界因素的十扰,使得测定结果比较稳定。1.2 以铜离子作为氧化剂的间接原子吸收分光光度法文献中报道了以铜离子作为氧化剂的间接原子吸收分光光度法。该方法也是利用维生素C在酸性介质中维生素C可将Cu2+定量的还原为Cu+,然后Cu+与SCN-反应生成CuSCN沉淀,在高速离心机下有效地分离出CuSCN沉淀,洗涤后再经浓硝酸溶解,用原子吸收法测定沉淀中的含铜量,即可推知样品中维生素C的含量。具体测定方法如下: 分别吸取1mL配制的含一定量维生素C的标准溶液(随配随用)(分别含维生素C 50、100、200、300、400、500 µg)和样品提取液,依次放置于已编号的15mL离心管中,各加入1mLCuSO4饱和溶液、1mL浓度为2%硫氰酸铵溶液、0.5mL盐酸-醋酸钠缓冲液和0.5 mL饱和NaCl溶液充分混和,稍后离心分离,弃去上层清液,小心地用少量水洗涤沉淀2~3次(注意每次用水不能超过1 mL),加入0.5mL硝酸溶解后,转移至lO0mL的容量瓶中加水定容至刻度线,摇匀。分别用原子吸收分光光度计测定其含铜量,由所得的维生素C含量的标准曲线,可以得到相应样品的试验结果。 该方法所得的试验结果相对标准偏差RSD在5%以内加标回收率在96.56%~100.67%,其精密度和准确度均达到痕量分析要求。此方法的线性相关系数R=O 9989,表明相关性很好。2紫外可见分光光度法利用紫外分光光度法测定维生素C的含量是基于维生素c在紫外光区有特征吸收,但是因为维生素C结构中具有不饱和键,具有还原性,不易稳定存在,直接测定误差较大。所以在利用紫外分光光度法测定时,维生素标准溶液和待测样的配制条件非常重要。曾国富,黄玉英研究发现,维生索C在CTAB-C5H11OH-H2O微乳液体系中非常稳定,它存在于微乳液滴膜的内侧,与渗透进入液滴膜外侧的溶液氧接触的机会极少,该体系能极大地提高维生素C的稳定性。 郑京平等利用维生素C具有对紫外产生吸收和对碱稳定的特性,建立了紫外分光光度快速测定水果、蔬菜维生素c的新方法。根据维生素C具有对紫外产生吸收和对碱不稳定的特性,于波长243nm处测定样品溶液与碱处理样品两者吸光度之差,通过查校准曲线,即可计算样品巾维生素C的含量。此法操作简单、快速准确、重现性好,结果令人满意。特别适合含深色样品的测定。实验结果表明该方法简单易行,结果准确、灵敏度高,检出限低,可快速测定水果、蔬菜中维生素C,值得推广应用。 张立科等介绍了在0~450µg/mL线性范围内,以cu2+作催化剂,以溶解氧将还原型维生素C氧化为在246.0 nm处无吸收的氧化型Vc,实现了样品各紫外干扰成分的本底校正,建立了种测定果蔬Vc的新方法。该方法中维生素C破坏条件的选择尤为重要,确定条件为:Cu用量为30 g,反应温度为70℃,反应时间为20min,加热条件下,反应速度快,无需加掩蔽剂。方法简便、快速、准确,测定了香蕉、西红柿等果蔬中的VC含量,结果令人满意。经多次实验得出该方法RsD在0.32%~0.89%之间,实际测定了香蕉、西红柿等样品中的VC的含量,检出限为0.2791g/mL,加标回收率在97.16%~100.18%之间 。3高效液相色谱法前面介绍的方法由于在使用中有一定的限制,操作复杂、前处理较麻烦。因此在使用中有较大的局限性,目的已逐渐被高效液相色谱法所取代。HPLC法具有检测速度快、操作简单、实验结果可靠等特点。 王艳颖,姜国斌等采用HYPERSIL-C8fz谱柱、浓度0.1%的草酸作流动相的高效液相色谱法,分析了草莓中的维生素c含量,取得了理想的效果。HPLC检测条件如下: 流动相0.1%草酸溶液,流速1.0 mL/min;检测波长254 nm,进样量5µL,柱箱温度3O℃。该方法分析中受样品中其他杂质的影响较小。测定草莓中维生素C的含量,回收率为97.4%~102.1%,说明该方法具有所需试剂少、稳定、操作简便等特点。精密度实验的相对标准偏差小于3%,说明该方法重复性和再现性都是比较高的。 陈昌云等采用0.05 mol/L磷酸二氢钾缓冲液:甲醇=80:20(v/v)作流动相。流速为1.0 mL/min,二极管阵列检测器,检测波长为254 nm。测定蜜柚中维生素C含量在质量浓度为20~100mg/L范围内有良好的线性关系,方法回收率为92.4%~107.5%,相对标准偏差小于2%。4 结语测定维生素C含量方法很多,各种方法各有优缺点,因为维生素C自身的不稳定,导致了很多方法测定结果误差较大,所以对维生素C稳定存在条件的探索非常重要。高效液相色谱法因为测定较准确、灵敏度高、选择性好,有较好的发展前景,是目前发展较快的一种方法。
[b][font=宋体]解答:[/font][/b][font=宋体]维生素主要分为水溶性维生素和脂溶性维生素两大类,基本都可以用液相色谱法检测,下面分别进行介绍。[/font][font=宋体]([/font]1[font=宋体])水溶性维生素的检测[/font][font=宋体]由于水溶性维生素(主要是[/font]B[font=宋体]族维生素和维生素[/font]C[font=宋体])易溶于水,极性较强,很难直接在如[/font]C[sub]18[/sub][font=宋体]等反相柱上保留。因此该类物质分析一般有两种方式:一是用含[/font]NH[sub]2[/sub][font=宋体]等极性键合相的正相色谱柱,如图[/font]6-24[font=宋体]的[/font]HILLIC[font=宋体]模式;二是在反相色谱(如[/font]C[sub]18[/sub][font=宋体]、[/font]C[sub]8[/sub][font=宋体]等)流动相中添加离子对缓冲试剂(如[/font]Na[sub]3[/sub]PO[sub]4[/sub][font=宋体]、[/font]KH[sub]2[/sub]PO[sub]4[/sub][font=宋体]、己烷磺酸盐等)增加其保留时间,见图[/font]6-25[font=宋体]。[/font][align=center][img=,465,269]https://ng1.17img.cn/bbsfiles/images/2021/03/202103231425192145_3285_3389662_3.jpg!w465x269.jpg[/img][/align][align=center][i][font=宋体]图[/font]6-24 HILIC[font=宋体]模式色谱柱分离水溶性维生素的色谱图[/font][/i][/align][align=center][i]1—[font=宋体]烟酰胺;[/font]2—[font=宋体]维生素[/font]B[sub]7[/sub][font=宋体];[/font]3—[font=宋体]维生素[/font]B[sub]6[/sub][font=宋体];[/font]4—[font=宋体]维生素[/font]C[font=宋体];[/font]5—[font=宋体]维生素[/font]B[sub]12[/sub][font=宋体];[/font]6—[font=宋体]维生素[/font]B[sub]1[/sub][/i][/align][align=center][img=,428,242]https://ng1.17img.cn/bbsfiles/images/2021/03/202103231425367458_9741_3389662_3.jpg!w428x242.jpg[/img][/align][align=center][i][font=宋体]图[/font]6-25 C18[font=宋体]柱分离水溶性维生素色谱图[/font][/i][/align][align=center][i]1—[font=宋体]维生素[/font]B[sub]1[/sub][font=宋体];[/font]2—[font=宋体]维生素[/font]C[font=宋体];[/font]3—[font=宋体]烟酸;[/font]4—[font=宋体]维生素[/font]B[sub]6[/sub][font=宋体];[/font]5—[font=宋体]泛酸;[/font]6—[font=宋体]叶酸;[/font]7—[font=宋体]维生素[/font]B[sub]12[/sub][font=宋体];[/font]8—[font=宋体]维生素[/font]B[sub]2[/sub][/i][/align][font=宋体]([/font]2[font=宋体])脂溶性维生素的[/font]HPLC[font=宋体]检测[/font][font=宋体]脂溶性维生素(维生素[/font]A[font=宋体]、[/font]D[font=宋体]、[/font]E[font=宋体]等)极性较弱,可以直接用[/font]C[sub]18[/sub][font=宋体]、[/font]C[sub]8[/sub][font=宋体]等反相色谱柱分离。需要注意的是,维生素[/font]E[font=宋体](生育酚)共有[/font]α[font=宋体]、[/font]β[font=宋体]、[/font]γ[font=宋体]、[/font]δ[font=宋体]四种结构类型,[/font]C[sub]18[/sub][font=宋体]等反相柱很难将这四种完全分开,而硅胶、二醇基([/font]Diol[font=宋体])等正相柱能很好地分离这四种结构,见图[/font]6-26[font=宋体]。[/font][align=center][img=,403,187]https://ng1.17img.cn/bbsfiles/images/2021/03/202103231425477785_8072_3389662_3.jpg!w403x187.jpg[/img][/align][align=center][i][font=宋体]图[/font]6-26[font=宋体]维生素[/font]E[font=宋体]在二醇基色谱柱上的色谱图[/font][/i][/align][align=center][i]1—α-[font=宋体]维生素[/font]E[font=宋体];[/font]2—β-[font=宋体]维生素[/font]E[font=宋体];[/font]3—γ-[font=宋体]维生素[/font]E[font=宋体];[/font]4—δ-[font=宋体]维生素[/font]E[/i][/align][font='微软雅黑','sans-serif'][color=black][back=white]领取更多《实战宝典》请进:[url]http://instrument-vip.mikecrm.com/2bbmrpI[/url][/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white] [/back][/color][/font]
一、保健食品中脂溶性维生素分析方法概况 保健食品中添加有维生素A、维生素D、维生素E、维生素K和b-胡萝卜素,一般情况下后两者使用相对较少 。鉴于脂溶性维生素的特点和样品基质情况,样品一般需要在皂化后经有机溶剂提取后测定。 1.维生素A 一般添加视黄醇醋酸酯和视黄醇棕榈酸酯两者之一或两种均添加。通常情况下成分复杂的样品需采用皂化反应后测定其中的视黄醇。成分相对简单的片剂和胶囊样品可采用溶剂提取直接测定视黄醇醋酸酯或视黄醇棕榈酸酯。奶粉等产品可以使用胰酶或蛋白酶处理,溶剂提取后测定视黄醇醋酸酯或视黄醇棕榈酸酯。 2.维生素E 一般情况下添加的是a-维生素E。成分相对简单的样品可采用溶剂提取直接测定。多数样品需要在皂化反应后测定其中的维生素E。 同时分析维生素E 4种结构并包括内标物,可使用如下正相柱: (1)Nucleosil-NH2 4.6×250mm, 5μm,正己烷:二恶烷=85:15,295nm (2)Zorbax SIL 4.6×250mm, 5μm,正己烷:二恶烷:异丙醇=985:10:5,295nm (3) Lichrosorb-NH2 4.0×250mm,5μm,正己烷:异丙醇=99:1,295nm (4) YMC-Pac A-600 (NH2),3μm,正己烷:异丙醇=98:2 Ex:290nm Em:325nm 3.维生素D 一般情况下添加的是维生素D2和维生素D3中之一。目前维生素D的分析尚不如维生素A和维生素E成熟,主要原因为含量低,前处理过程损失多,与维生素E较难分离。现在采取的方法是采用乙腈+甲醇+水=25+75+4作为流动相,根据样品中维生素D的情况,选择维生素D2和维生素D3互为内标。维生素D的分析对于色谱柱的要求较高,一般来讲250mm长度的Zobax SB-C18 比较适合分析要求。 4.b-胡萝卜素 b-胡萝卜素一般出现在植物性保健食品中,分析方法相对成熟。目前我们将维生素E、番茄红素和b-胡萝卜素通过采用不同的波长达到一次性分析的目的。样品采用二氯甲烷进行提取,分析过程需要加入抗氧化剂BHT对组分进行保护。 流动相为甲醇:乙腈=50:50 色谱柱:Supelcosil RP C18 5.α-胡萝卜素 α-胡萝卜素目前也出现在保健食品中已有应用,初步将其与b-胡萝卜素一同分析。样品采用丙酮进行提取。 流动相为甲醇:甲基叔丁基醚:水=310:76:14 色谱柱:Symmetry C18 检测波长:450nm 二.保健食品中水溶性维生素分析方法概况 目前建立并推广了一套的系统分析方法,通过选用多波长离子对高效液相色谱分析可以解决维生素B1、维生素B6、烟酸、烟酰胺、维生素C的分析。生物素、泛酸、叶酸需采用单独的高效液相色谱分析条件。维生素B2采用荧光分光光度法分析。 1.维生素B1(盐酸硫胺、硝酸硫胺) 分析维生素B1可采用盐酸苯海拉明作为内标。样品采用甲醇+水+磷酸提取。 流动相为硫酸月桂酯钠溶液(5g/530mL):乙腈:磷酸=530:470:0.4 色谱柱:m-Bondapak C18或TSK Gel-C18 检测波长:260nm 2.维生素B1(呋喃硫胺) 有报道,呋喃硫胺是维生素B1的活性结构,在韩国、日本等产品中使用呋喃硫胺与盐酸硫胺、硝酸硫胺的色谱行为有较大区别。 流动相为甲醇:水:乙酸:PigB6=450:530:20:20 色谱柱:m-Bondapak C18 检测波长:280nm 3.维生素B6(吡哆醇)、烟酸、烟酰胺 分析维生素B6、烟酸、烟酰胺可采用愈创木酚甘油醚作为内标。样品采用甲醇+水+磷酸提取。 流动相为1-癸烷磺酸钠溶液(1.22g/850mL):乙腈:磷酸=850:150:0.4 色谱柱:m-Bondapak C18或TSK Gel-C18 在维生素类保健食品中烟酸应用极少,基本上添加的均为烟酰胺。 检测波长:280nm 功能性饮料中添加的咖啡因和苯甲酸也可以同时检测。根据大量实验认为液体类样品应使用TSK Gel-C18,固体样品两者皆可。 4.维生素C 除颜色较深、含量较低、天然植物干制品外,一般样品中的维生素C均可以采用碘溶液滴定法进行测定。利用高效液相色谱法测定维生素C可利用维生素B6(吡哆醇)、烟酸、烟酰胺流动相体系,因维生素C色谱保留时间较短,可以将降低其中乙腈的比例至5%。提取溶剂尽可能使用水,以避免在前面出现倒峰影响定量结果的准确。 检测波长:254nm 5.维生素B2 有关维生素B2的色谱分析方法有报道,但在实际样品分析过程中因保留时间较短且与其它峰难以较好分离,故采用将其转化为光黄素后进行荧光分光光度法分析。 6.泛酸(维生素B3) 泛酸采用液相色谱分析法进行检测,样品用水提取即可。 流动相:0.02M磷酸二氢钾溶液:乙腈=95:5,pH=3.0 色谱柱: m- Bondapak C18 300mm 检测波长:200nm 7.生物素 生物素的分析正在初步摸索阶段,目前采用pH=3.5 0.25M磷酸盐缓冲溶液:甲醇=77:23的流动相,检测波长200nm。 目前的需要解决的问题是保留时间较长,大约在30min左右;此外灵敏度较低。 8.叶酸 叶酸一般使用弱碱性水溶液提取,为保证提取效果可以在50℃水浴中加热10min。 流动相:磷酸二氢钾缓冲溶液:甲醇=460:40,pH=6.0 色谱柱: m- Bondapak C18 300mm 检测波长:280nm 叶酸的研究方向:通过大量实际样品检测研究,发现在虫草等天然产物中存在与叶酸色谱保留时间完全一致的物质;不少样品中叶酸含量较低,拟采用固相萃取等技术作为前处理手段。 9.维生素B12 维生素B12的化学分析目前还是一个难题,对于含量较高,组成简单的原料和添加剂进行高效液相色笱单的原料和添加剂进行高效液相色失杂的多种维生素样品的分析方法正在摸索之中。 维生素B12的研究进展:虽然维生素B12有3个特征波长,但样品在不经处理的情况下也很难分析;在溶液中钴胺素很容易出现氰钴胺素、甲钴胺素、羟钴胺素等几种形式共存的现象。为避免出现上述问题,更好地去除样品中的干扰杂质并对样品中的维生素B12进行富集,目前采用加入表面活性物质、盐析、有机溶剂萃取等方法去除杂质,再通过固相萃取法进行富集的手段。 三、类维生素分析方法概况 1.肉碱(维生素BT) 肉碱若采用分光光度法检测比较繁杂,高效液相色谱法测定相对简单。利用高效液相色谱法测定肉碱同样利用维生素B6(吡哆醇)、烟酸、烟酰胺流动相体系,因肉碱色谱保留时间虽比维生素C长但相对仍较短,因此流动相可以同维生素C一样。提取溶剂尽可能使用水或pH=5~6的水,以避免在前面出现倒峰影响定量结果的准确。 检测波长:210nm 2.辅酶Q10 对于维生素类样品中辅酶Q10的检测采用液相色谱分析法。样品中辅酶Q10使用正己烷作为提取溶剂。 色谱柱:TSK Gel-C18 流动相:乙腈+四氢呋喃+水=55+40+5 检测波长:280nm 3.肌醇 对于维生素类样品中肌醇的检测建立了一套衍生化-气相色谱分析法。样品中肌醇经过提取,彻底去除水分后进行衍生化,正己烷提取后进行气相色谱分析。 衍生化试剂:三甲基氯硅烷:六甲基二硅氨烷:二甲基甲酰胺=1:2:8 色谱柱:BP-5弹性石英毛细管柱, 25m×0.32mm 色谱条件:载气 50mL/min 尾吹气 50 mL/min 氢气 40 mL/min 空气 500 mL/min 分流比 1:50 四、需要解决的问题及展望 1.解决样品前处理技术 (1)不少油性胶囊样品中加入了水溶性维生素,如何应用前处理手段解决提取、净化问题。 (2)对于含量较低的样品如何应用固相萃取等手段。 (3)对于目前原料微囊化制作技术如何应对。 2.解决色谱多组分分析技术 在目前现有的多组分分析技术的基础上,如何能将维生素B1并入维生素B6系列之中或创建新的流动相体系,再囊括维生素B2和叶酸等是今后研究的重要方面。 3. 解决分析过程快速化 在目前大量样品检测的基础上应归纳总结出样品前处理方法指南,确定样品组成和前处理方法之间的关系。
大家有人做过维生素B12的检测么?是乳品还是保健品还是其他?咨询一下前处理方法,看到国标GB/T 5009.217-2008 保健食品中维生素B12的测定 中有推荐HLB小柱和免疫亲和柱,有木有这两种都试过的,分别用的是哪家的啊,比较好奇,维生素B12免疫亲和柱貌似有的不多。。。

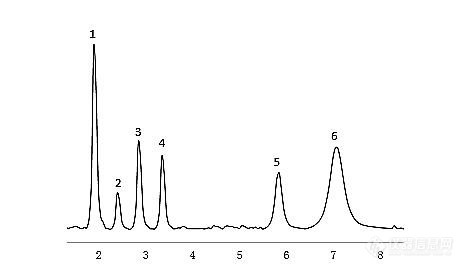
仪器: LC-100高效液相色谱仪色谱柱: SHOEDEX C18-120-5, 4.6*250mm, 5um流动相: 甲醇 流速: 1mL/min检测波长:326nm;7.5min后264nm,10.5min后285nm进样量: 10uL柱温: 28℃ http://ng1.17img.cn/bbsfiles/images/2015/06/201506110949_549816_1635904_3.png 按照出峰顺序依次为 VA, VD3, VE注意事项:维生素A乙酸酯需保存在棕色瓶中,溶液配好后尽快检测 VA,1微克/毫升;VD3,5微克/毫升;VE,0.1微克/毫升
在做乳制品维生素A含量检测时发现新国标中色谱条件里柱温是20℃,之前旧国标里是35℃,想询问一下大家,柱温对含量检测的影响,谢谢
各位大侠:有没有使用GB 5413.12-2010检测乳粉中维生素B2的?请问你们使用的酸性磷酸酶的那个厂家的?用多少酶活单位的?
[em0910]在药品检测中,维生素E的检测方法,以及选用的色谱柱?毛细柱还是用填充柱,柱子的填料。

蜂蜜的化学成分丰富、复杂,除了65%-80%的糖以外,还含有多种氨基酸、维生素和酚酸黄酮等活性成分。蜂蜜的标准中并没有关于维生素检测的方法,文献资料中也未查到。试验前处理:称取蜂蜜样品约15克于锥形瓶中,加入30mL 0.1mol/L盐酸,充分摇匀,盖上瓶塞,直接放入高压灭菌锅内,在121℃下保持30min,冷却后取出,用乙酸钠调节pH至4.0左右,加入2mL混合酶(蛋白酶+淀粉酶+酸性磷酸酶),放置到37℃的恒温培养箱中过夜。将酶解后的样液转移到50mL容量瓶中,用纯水定容。定容后的样液转移到离心管中,3500r/min离心8min,取上清液用0.45um滤头过滤,滤液待上机。标准曲线:称取一定量维生素B2的标准品,用纯水配置标准系列工作标液。色谱条件:液相:Waters 2695,配荧光检测器 2475色谱柱:Waters XBridge C18柱(5um,250mm×4.6mm)流动相:甲醇:酸水(pH=4.5)=35:65酸水用氨水、乙酸、三乙胺调节到pH为4.5流速:0.75ml/min (柱压高)进样量:20uL检测波长:激发波长462nm,发射波长522nm 维生素B2的标准曲线:标准曲线相关系数达到三个9http://ng1.17img.cn/bbsfiles/images/2014/12/201412291323_529830_1694946_3.jpghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412291323_529831_1694946_3.jpg标准品色谱图http://ng1.17img.cn/bbsfiles/images/2014/12/201412291324_529832_1694946_3.jpg样品色谱图http://ng1.17img.cn/bbsfiles/images/2014/12/201412291324_529833_1694946_3.jpg注意事项:在整个样品前处理过程中,都需要避光操作。
用超高效液相检测维生素B族常用的检测条件有哪些啊?谢谢大家了!
哪位大侠用紫外分光检测过新鲜的蓝莓等水果中的维生素C的含量吗?我查到的文献中用氢氧化钠破坏维生素C测得到吸光值与未破坏时测得的差值,即为还原型维C的含量。但是我做的时候在243nm测吸光值,用氢氧化钠破坏维生素C测得到吸光值比未破坏的还要大,是什么原因呢?

乳粉中维生素C的检测:维生素C:又名抗坏血酸,是一种水溶性维生素。检测依据:GB5413.18-2010检测原理:维生素C在活性炭存在下氧化成脱氢抗坏血酸,它与邻苯二铵反应生成荧光物质,于发射波长350nm,激发波长430nm用荧光光度计测定其荧光强度,其荧光强度与维生素C浓度成正比,外标法定量。所需要的试剂:1.实验用水均为去离子水2.偏磷酸—乙酸溶液:称取15g偏磷酸和40ml 36%乙酸于100ml水中,溶解后稀释至500ml备用。2.偏磷酸—乙酸溶液:称取15g偏磷酸和40ml 36%乙酸于100ml水中,溶解后稀释至500ml备用。3.酸性活性炭:80—120目,称取粉状活性炭约200g,加入1L 10%盐酸,加热至沸腾,真空过滤,取下结块于一个大烧杯中,用清水洗至滤液中无铁离子为止,在110℃~120℃烘箱中干燥约10小时后使用。检验铁离子的方法:普鲁士蓝反应,将20g/L亚铁氰化钾与1%盐酸等量混合,将上述滤液滴入,如有铁离子则产生蓝色沉淀。4.乙酸钠溶液:500g三水乙酸钠,并稀释至1L。5.硼酸—乙酸钠:3g硼酸,用乙酸钠溶液(药品4)溶解并稀释至100ml,临用前配置。6.邻苯二铵:40mg邻苯二铵,用睡溶解并稀释至100ml,临用前配制。7.维生素C标准溶液(100ug/ml):称取0.05g维生素C标准品,用偏磷酸—乙酸溶液溶解并定容至50ml,临用前配制。样品处理:1.称取5g乳粉试样,用偏磷酸—乙酸溶液溶解定容至100ml,定容至100ml准确吸取10ml维生素C标准溶液用偏磷酸—乙酸溶液稀释并定容至100ml2.将上述试样转至放有2g酸性活性炭的250ml三角烧瓶中,剧烈振荡过滤(弃去约5ml最初滤液),即为试样和标准溶液的滤液。http://ng1.17img.cn/bbsfiles/images/2011/12/201112181747_339215_2366837_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/12/201112181744_339210_2366837_3.jpg3.[font='宋体'
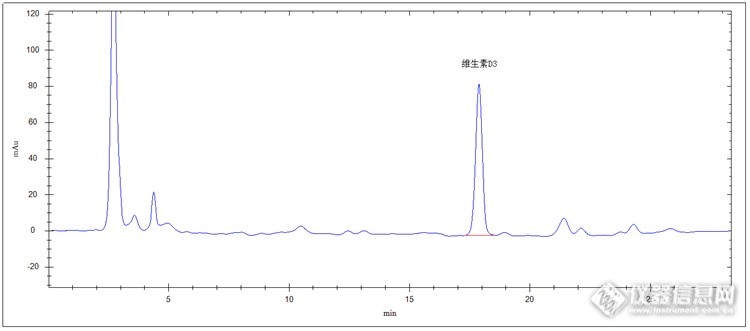
HPLC检测钙片中维生素D3 维生素D3是维生素D族中的成员,在人体内生理功能骨胳组织矿质化(硬化)过程中起着非常重要的作用。具体如下:提高肌体对钙、磷等矿物质更完全吸收,促使血液中钙、磷水平达到饱和程度;促进骨骼钙化,牙齿健全,身体成长;通过肠壁、肾小管等增加磷的更完全吸收;维持血液中柠檬酸盐的正常水平;阻止氨基酸的损失。 维生素D3主要用于预防和治疗维生素D缺乏症,促进身体机理更加健康发展。广泛适应于多种临床病症治疗,主要用于儿科、妇产科、骨科、内科、糖尿病专科、风湿病专科、放射科等。 维生素D3是钙片的主要药物成分,是钙片药效的主导者。下面介绍钙片中维生素D3高效液相色谱法检测。试样制备 对照品溶液的制备:精密称取维生素D3对照品25mg,置于100mL棕色容量瓶中,加异辛烷80mL,常温超声处理1分钟使完全溶解,加异辛烷至刻度,摇匀,冲氮密塞,避光,0℃以下保存,备用。 供试品溶液的制备:精密称取钙片25mg,置于100mL棕色容量瓶中,加三甲基戊烷80mL,常温超声处理1分钟使完全溶解,加三甲基戊烷稀释至刻度,摇匀,0.45um微膜滤过,待测。色谱条件检测器:紫外检测器色谱柱:pGrandsil-STC C18,4.6 X 250mm,5µm流动相:甲醇-水(95:5)检测波长:264nm流速:1.0mL/min柱温:室温进样量:10ul 标准品色谱图:http://ng1.17img.cn/bbsfiles/images/2014/11/201411301654_525280_2498430_3.png 钙片样品色谱图:http://ng1.17img.cn/bbsfiles/images/2014/11/201411301654_525281_2498430_3.png 该方法检测钙片中维生素D3,方便、准确,前处理简单,非常适合该药物检测。该方法并可作为其它样品中(如食品、药品、饲料、某种水质等)维生素D3及维生素D族其它成员检测的参考方法。
用液相做饲料中维生素A的检测,发现标样与样品出峰时间不一样,(使用的是直接提取法)标样出峰时间为3min,样品出峰时间为4分钟,标样是维生素A纯品,样品可能是维生素A的醋酸酯,有没有什么办法可以让两者的出峰时间一致呢?以前试过用皂化回流的方法,没有出现出峰时间不符合的相像,请问大家做饲料中维生素A的时候是如何操作的,有没有试过出现我的这种情况呢?
菜鸟问一下:想做维生素检测,不知道用液相能做几种维生素的分析请高手指点急盼谢谢
我们公司正在开展乳粉中维生素A、E的检验工作,但是按照最新的国标方法出现以下几个问题,希望各位指点一下1、看到别的方法上无水乙醇需去醛处理,我们用的色谱纯的乙醇还用处理吗?2、其他方法上有用乙醚萃取的,而我们用的是石油醚是否对结果有影响?3、其他方法上有用乙醚萃取的,乙醚需检测是否含过氧化物,石油醚是否用检测?4、最重要的是我们用国标液相法做完后,回收率一直在40%多,做已知含量的样品,检出值也是原值的40%左右。我们完全按国标方法做的,不知什么原因,望做过的大侠们指点!
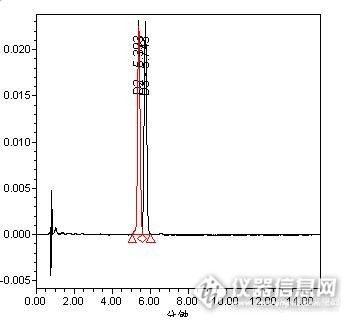
维生素A、维生素D(D2和D3)和维生素E是机体维持正常代谢和机能必需的脂溶性维生素。维生素A具有促进机体生长、维持表皮完整、生殖、骨骼及视觉等功能;维生素D(主要包括D2和D3),它们对哺乳动物有促进钙磷代谢及成骨作用;维生素E又称为生育酚,具有促进生育、抗衰老的作用。由于这3种维生素在外界环境中不稳定,很容易受光、氧等影响而被氧化破坏,因此科研工作者一直在努力寻找合适的测定方法来得到准确、重现性好的结果。 迪马科技用户采用超高效液相色谱法,DAD检测器成功实现维生素A、D、E的分离、测定,具有分析时间短,分析结果准确,重现性好的特点。UPLC色谱分析条件*:色谱柱:Endeavorsil C18 50 × 2.1 mm, 1.8 μm(Cat.#.:87002)流动相:A:20 mmol/L三乙胺水溶液,B:甲醇 A:B=4:96流速:0.3 mL/min柱温:35 ℃检测器:DADhttp://ng1.17img.cn/bbsfiles/images/2013/04/201304181555_435961_708_3.jpg维生素A、E色谱图*以上实验数据来源于北京市疾病预防控制中心http://ng1.17img.cn/bbsfiles/images/2013/04/201304181557_435963_708_3.jpg维生素D色谱图*以上实验数据来源于北京市疾病预防控制中心UPLC法检测维生素A、D、E相关产品信息:货号名称规格样品前处理37177针头式过滤器 Nylon[size=16p
维生素A检测中加抗坏血酸的作用是防止维生素A 的氧化,但是抗坏血酸要求现用现配,是什么原因?上网查了一下说因为它易氧化,不稳定。是什么原理让它防止维生素A 的氧化呢?
[color=#444444]各位大神,大家检测维生素D用的是食品国标法还是药典法?如用的国标,买的是二维液相吗?可以具体指导下吗?[/color]