关注 | 这一地方在注册审批和检验检测方面建立应急机制
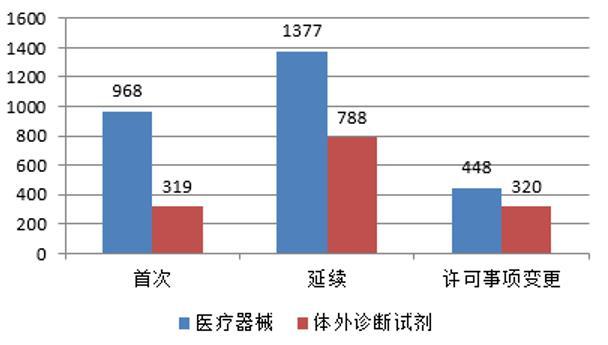
湖北省市场监督管理局 湖北省药品监督管理局关于做好新冠疫情防控药品医疗器械促产保供工作的公告为深入贯彻落实党中央、国务院决策部署和省委、省政府工作要求,全力支持疫情防控药品和医疗器械企业做好当前阶段促产保供工作,制定若干政策措施,现公告如下:一、优化行政许可审批。为新冠疫情防控药械企业开辟绿色通道,对抗疫药品、医疗器械企业涉及的复产、扩产的相关申请,实行随到随审、快速审批。对于不涉及现场检查和技术审评的申请事项,受理后当天办结。二、容缺受理申报资料。对于质量安全没有实质性影响的申请事项,实行容缺受理,允许材料补正和审批同时进行。对于变更原料药供应商、变更生产场地、改变直接接触药品的包装材料等需要稳定性考察,但短期内难以完成的申请事项,实行附条件承诺许可。三、简化现场检查程序。对于疫情防控药械新建、改扩建生产线、委托生产、停产后复产的注册、许可类事项现场检查,优先安排,加快办理,结合风险研判和日常监管情况,可采取先远程视频、后现场检查的方式,确保产品安全,尽快投放市场。四、开通应急检验通道。省药检院、省器械院成立新冠疫情防控产品应急检验工作组,开通24小时应急检验检测通道,坚持随到随检,并提供检验检测和咨询服务。对于新冠防护类医疗器械,鼓励企业开展自检,不能自检的项目委托省器械院检验,以提高检验效率。五、助推抗原试剂产品投产上市。鼓励和支持我省具备相应生产能力的医疗器械生产企业受托生产抗原试剂,对省外抗原试剂产品落户湖北事项,如不需现场检查,实行24小时办结制。六、加快新冠防护类医疗器械注册。对于新冠防护类医疗器械的变更注册予以减免现场核查。对于首次注册的产品注册过程中各类验证资料,通过线上咨询服务、实地指导、专家辅导等形式,加快企业申报进度。对于首次注册产品体系核查予以优先安排,加快产品上市进程。七、维护市场主体合法权益。各药械生产经营企业,不得借疫情防控之机大幅提高药品和医疗器械价格 不得捏造、散布涨价信息,囤积居奇,哄抬价格 不得相互串通,操纵市场价格 不得生产经营假劣药品和医疗器械,损害其他经营者或消费者的合法权益。市场监管部门、药品监管部门将全面加强巡查检查,严厉打击药品、医疗器械生产经营中的各类违法行为。请广大人民群众和社会各界予以监督,若发现有关违法行为,请保存好相关证据并拨打“12315”热线进行投诉举报。为了满足人民群众疫情期间短缺紧急用药需求,在保障质量前提下,终端零售药店采取的有关保供应急措施,各级市场监管部门需依法依规采取审慎监管政策。八、建立应急促产保供服务机制。省市场监管局、省药监局联合成立工作专班,建立联络机制,设立药械保供联络员,与企业点对点联系,加强沟通、跟进指导,开展质量、技术、品牌帮扶。对于重点保供企业,做到专班包联、精准帮扶,主动帮企业解决新冠防治药械注册生产经营活动中遇到的困难和问题。对于保供企业中涉及国家层面的有关事项,省市场监管局、省药监局加大向国家市场监督管理总局、国家药监局争取支持力度,第一时间为本省企业提供政策优惠和技术指导。此公告所涉及相关支持政策,限于疫情防控应急阶段使用。省市场监督管理局 省药品监督管理局2022年12月20日