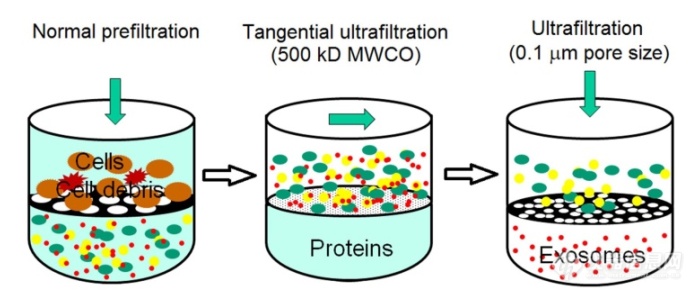
[align=center][font='times new roman'][size=18px][color=#000000]新型[/color][/size][/font][font='times new roman'][size=18px][color=#000000]外泌体分离方法[/color][/size][/font][/align][align=left][font='times new roman'][size=16px]肿瘤细胞来源的外泌体在分子水平上促进肿瘤的进展、侵袭和转移。因此,在探索细胞间信号传导,分析功能分子成分(蛋白质、[/size][/font][font='times new roman'][size=16px]mRNA[/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px]microRNA[/size][/font][font='times new roman'][size=16px])前需要有效的检测和分离肿瘤源性外泌体的能力,这可能为癌症诊断和预后提供关键信息。[/size][/font][/align][align=left][font='times new roman'][color=#000000]1[/color][/font][font='times new roman'][color=#000000]基于尺寸排阻的外泌体分离技术[/color][/font][/align][align=left][font='times new roman'][size=16px]外泌体是直径在[/size][/font][font='times new roman'][size=16px]30-200 nm[/size][/font][font='times new roman'][size=16px]的囊泡,其尺寸小于绝大部分的细胞外囊泡,因此,基于这一特性,可利用具有限制相对分子量或大小的过滤器来分离外泌体。目前,最常用的基于尺寸的外泌体分离技术就是超滤离心法。该方法是一种基于悬浮颗粒或聚合物大小的外泌体分离技术,小于膜孔径的物质会通过过滤膜,大于膜孔径的物质被截留在膜上。超滤法比[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]速度更快,且不需要特殊的设备,已有研究表明该方法可以成功从[/size][/font][font='times new roman'][size=16px]0.5 mL[/size][/font][font='times new roman'][size=16px]尿液中分离外泌体。[/size][/font][/align][font='times new roman'][size=16px]目前已经开发了一种适合无细胞样品的商用外泌体分离试剂盒,兼具外泌体分离和[/size][/font][font='times new roman'][size=16px]RNA[/size][/font][font='times new roman'][size=16px]提取的功能。如图所示,该试剂盒利用注射过滤器双层膜结构,当样品通过两层膜时,较大的细胞外囊泡(如凋亡小体和微囊泡)被保留在上层膜上,而外泌体捕获在下层膜上。与[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]和外泌体沉淀法相比,超滤法从尿液中获得的外泌体[/size][/font][font='times new roman'][size=16px]RNA[/size][/font][font='times new roman'][size=16px]产量最高。该方法的主要缺点在于分离的外泌体容易堵塞过滤膜,导致分离效率下降。此外,该方法可能会导致囊泡的变形和破裂,影响下游分析的结果。[/size][/font][font='times new roman'][size=16px]另一种基于尺寸的外泌体分离方法是尺寸排除色谱法[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]SEC[/size][/font][font='times new roman'][size=16px])[/size][/font][font='times new roman'][size=16px]。该方法利用多孔固定相将悬浮颗粒和聚合物按照大小进行分类[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]流体动力半径小的物质能够通过孔隙,而流体动力半径较大的物质会被截留在孔隙上。[/size][/font][font='times new roman'][size=16px]此外,[/size][/font][font='times new roman'][size=16px]该方法结合其他方法使用可取得更好的效果[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]例如,与单纯的超滤法或[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]相比,该方法分离的外泌体[/size][/font][font='times new roman'][size=16px]结合[/size][/font][font='times new roman'][size=16px]后续超速离心可以[/size][/font][font='times new roman'][size=16px]提高[/size][/font][font='times new roman'][size=16px]尿外泌体[/size][/font][font='times new roman'][size=16px]的捕获效率[/size][/font][font='times new roman'][size=16px],从而有利于寻找肾脏疾病生物标志物。该方法分离外泌体[/size][/font][font='times new roman'][size=16px]主要[/size][/font][font='times new roman'][size=16px]缺点在于干扰物多[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]孔隙极易堵塞,导致色谱柱重复率低,分离效率较低。[/size][/font][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108012209419773_3887_5111497_3.png[/img][/align][align=center][font='times new roman']图[/font][font='times new roman']1-3[/font][font='times new roman'] [/font][font='times new roman']连续过滤原理图[/font][font='times new roman'][size=13px][68][/size][/font][/align][align=center][font='times new roman']Figure [/font][font='times new roman']1-[/font][font='times new roman']3[/font][font='times new roman'] [/font][font='times new roman']Schematic illustration of sequential filtration[/font][font='times new roman'][size=13px][68][/size][/font][/align][align=center][/align][font='times new roman'][color=#000000]2[/color][/font][font='times new roman'][color=#000000]基于聚合物沉淀的分离技术[/color][/font][font='times new roman'][size=16px]聚合物沉淀[/size][/font][font='times new roman'][size=16px]技术是通过添加水性聚合物使外泌体溶解度或分散性改变,减少外泌体的水合作用,使外泌体沉淀以达到分离的技术。通常使用分子量为[/size][/font][font='times new roman'][size=16px]8000 Da[/size][/font][font='times new roman'][size=16px]的聚乙二醇([/size][/font][font='times new roman'][size=16px]PEG[/size][/font][font='times new roman'][size=16px])与样品共孵育,[/size][/font][font='times new roman'][size=16px]4[/size][/font][font='times new roman'][size=16px]℃过夜后,用低速离心或过滤法分离含有外泌体的沉淀物。目前,已开发了一系列聚合物沉淀试剂盒可用于体液和培养基中外泌体的分离。聚合物沉淀分离外泌体的方法易于使用、回收率高,且不需要专门的设备。该方法的主要缺点在于容易引入蛋白质和聚合物材料等其他污染物,使得提取的外泌体纯度较低。[/size][/font][font='times new roman'][size=14px][color=#000000]3[/color][/size][/font][font='times new roman'][size=14px][color=#000000] [/color][/size][/font][font='times new roman'][size=14px][color=#000000]基于免疫亲和的分离技术[/color][/size][/font][font='times new roman'][size=16px]外泌体磷脂双层膜中含有丰富的蛋白质和受体,如[/size][/font][font='times new roman'][size=16px]CD81[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]CD63[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]TSG101[/size][/font][font='times new roman'][size=16px]、上皮细胞粘附分子等,利用这些受体与配体之间的相互作用,使外泌体与特殊设计的磁性颗粒之间建立免疫亲和作用,可用于外泌体的分离富集。例如,[/size][/font][font='times new roman'][size=16px]Zarovni[/size][/font][font='times new roman'][size=16px]等报道了一种基于微孔板的酶联免疫吸附试验([/size][/font][font='times new roman'][size=16px]ELISA[/size][/font][font='times new roman'][size=16px])用于捕获和定量检测外泌体。尽管与[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]产量相当,但是该方法具有快速、易于使用和与常规设备兼容的优势。该报道继续开发了一种基于磁免疫捕获的外泌体分离试剂盒用于从细胞培养基和生物液中分离外泌体,其质量和纯度均优于其他技术。此外,这种方法对样品的初始体积没有要求,可以很容易地缩小或增大样品容量。而该技术主要缺点在于缺乏最佳的外泌体标志物。此外,随着肿瘤的进展,肿瘤抗原表达和调节的异质性可能导致低估和假阴性,并且有些抗原表位可能被阻断或掩蔽。[/size][/font]
大家好,新手科研小白,想求助大家SEC分离外泌体需要采购的仪器有哪些,暂定是用血清外泌体
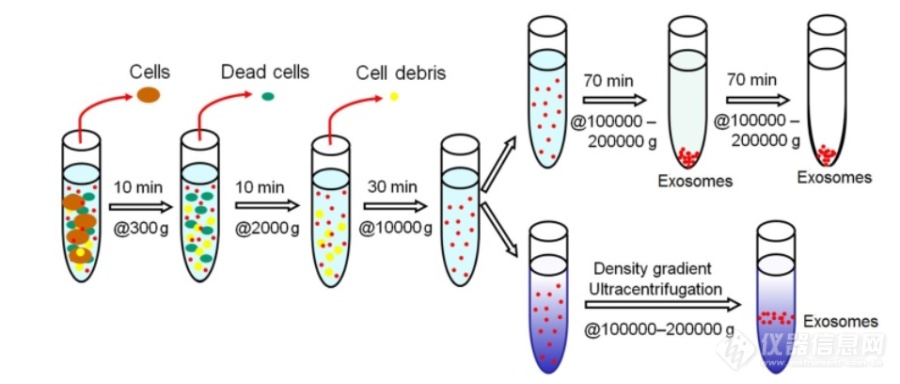
[font='times new roman'][size=18px][color=#000000]基于超速离心的外泌体分离技术[/color][/size][/font][align=left][font='times new roman'][size=16px]超速离心法([/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px])是目前外泌体分离的“金标准”,大约[/size][/font][font='times new roman'][size=16px]56%[/size][/font][font='times new roman'][size=16px]的实验人员使用这种技术分离外泌体。目前[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]包括差速超速离心和密度梯度超速离心。差速超速离心分离外泌体的方法主要受颗粒的大小、密度和形状的影响,基于颗粒的沉降速率不同,通过施加离心力,样品可以根据它们的物理性质被分离。在相同的颗粒密度下,大颗粒的沉积速度比小颗粒快,因此,更小的颗粒,如外泌体,可以通过一系列连续增加的旋转速度分离出来,具体步骤如图所示。首先用[/size][/font][font='times new roman'][size=16px]300 g[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]2000 g[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]10000 g[/size][/font][font='times new roman'][size=16px]的转速分别去除培养基中的细胞、坏死细胞和细胞碎片,上清液继续进行[/size][/font][font='times new roman'][size=16px]100,000 g 70[/size][/font][font='times new roman'][size=16px]分钟的超速离心,沉淀部分重悬在磷酸盐([/size][/font][font='times new roman'][size=16px]PBS[/size][/font][font='times new roman'][size=16px])缓冲液中进行另一轮[/size][/font][font='times new roman'][size=16px]100,000 g[/size][/font][font='times new roman'][size=16px]超速离心,最后,将得到的外泌体重悬于[/size][/font][font='times new roman'][size=16px]PBS[/size][/font][font='times new roman'][size=16px]缓冲液中以作下一步分析。[/size][/font][/align][align=left][font='times new roman'][size=16px]密度梯度离心[/size][/font][font='times new roman'][size=16px]法将待测生物样品添加到自上而下密度逐步增大的溶液中,在超速离心之后,这些外泌体就会移动到对应密度梯度层的底部(外泌体的密度介于[/size][/font][font='times new roman'][size=16px]1.10-1.21 g/mL[/size][/font][font='times new roman'][size=16px])。密度梯度离心法获得的外泌体具有更好的完整性和生物活性。此外,由于[/size][/font][font='times new roman'][size=16px]外泌体[/size][/font][font='times new roman'][size=16px]与胞外囊泡的大小存在重叠且外泌体存在异质性,差速超速离心分离得到的外泌体纯度和效率均较低,而密度梯度离心法使密度相对较低的外泌体漂浮,进一步净化了外泌体。[/size][/font][/align][font='times new roman'][size=16px]虽然[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]是目前最常用的方法,但它也存在一些缺点:它是一种劳动密集型、耗时的方法(通常持续[/size][/font][font='times new roman'][size=16px]5-10 h[/size][/font][font='times new roman'][size=16px]),需要大量的样品和昂贵的专用设备。聚集的蛋白质和核蛋白颗粒污染使得分离的外泌体的效率和纯度相对较低。此[/size][/font][font='times new roman'][size=16px][color=#000000]外,[/color][/size][/font][font='times new roman'][size=16px]分离过程中需要超高的离心力,这可能会导致外泌体的形态和组成发生变化。[/size][/font][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108012208553147_7986_5111497_3.png[/img][/align][align=center][font='times new roman']图[/font][font='times new roman'] 1 [/font][font='times new roman']用差速超离心法分离外泌体示意图[/font][/align]
请问专家:HPLC的紫外检测器能否分离顺反异构体(沸点高,且很接近)?若能,选择何种柱子?谢谢。
高效液相色谱法分离/蒸发光散射和紫外检测法 测定天麻中天麻甙含量 魏 泱 丁明玉* 李红霞 (清华大学化学系,北京,100084) 关键词 高效液相色谱法;蒸发光散射检测法;紫外检测法;天麻;天麻甙 中图分类号 O658 天麻(Gastrodia elata Blume)系兰科多年生寄生植物,用于治疗头昏,眩晕,肢体麻木等症。冯孝章等 [1]和周俊等 [2]分离并鉴定出天麻的活性成分有天麻甙(对羟甲基苯 b-D-吡喃葡萄糖甙,亦称天麻素)、 天麻甙元(对羟基苯甲醇)等.其中天麻甙为主要成分。之后的一些药理实验[3]也证实了这一点. 在测定天麻甙含量的方法中, 高效液相色谱法(HPLC)采用得最多. 正相HPLC[4]和反相HPLC[5]都可用于天麻及其制剂中天麻甙的分离,通常采用紫外检测法,检测波长在220 nm或270 nm处. 蒸发光散射检测器(ELSD)作为一种半通用型质量检测器,可用于检测类酯[6]、糖[7]等物质. 近年来,它在对天然药物的检测方面应用也越来越多,如对人参皂甙[8]、银杏内酯[9]的检测。HPLC/ELSD测定天麻甙尚未见报道. 1.实验与方法 1.1仪器与试剂 HP1100高效液相色谱仪(美国Hewlett Packard公司产品)配有四元梯度泵、二极管阵列检测器(DAD)和化学工作站. 另配有Alltech 500 ELSD(美国Alltech公司产品). 天麻甙为分析纯,购自中国药品生物制品检定所;对羟基苯甲醇和对羟基苯甲醛为分析纯,购自Sigma公司;甲醇为色谱纯,其他试剂均为国产分析纯试剂. 流动相使用前用0.45 mm滤膜过滤. 天麻原药材购自四川省,并经中国中医研究院鉴定. 1.2 色谱条件 ELSD和DAD检测均使用同样的色谱条件. 色谱柱: Zorbax RX-SIL (4.6 mm i. d. ´ 25 cm, 5 mm)硅胶柱,HP公司产品;配有预柱Micro Pak SI-5 (4 mm i. d. ´ 4 cm, 5 mm)硅胶柱,Parker公司产品. 流动相:正己烷/甲醇/乙酸乙酯(体积比6:3:2),流速0.8 mL/min;进样量20 mL;ELSD参数:漂移管温度65 ℃,氮气流速1.55 L/min;DAD检测波长270 nm。 1.3 样品处理 天麻干燥块茎粉碎后,准确称取100 g. 用70%的乙醇水溶液热回流3次,每次回流后再用超声提取. 提取液过滤后经浓缩得浓缩液. 浓缩液用甲醇稀释至适当浓度,放入冰箱冷冻。澄清液经0.45 mm滤膜过滤后直接进行HPLC分析。 1.4 标准溶液的配制 分别称取89.0 mg和21.3 mg的天麻甙溶于100 mL甲醇中配制成两个储备液. 使用前以甲醇稀释成适当浓度的工作溶液. 2. 结果与讨论 2.1 天麻甙的分离 天麻的乙醇提取物中成分很多. 当流动相正己烷/甲醇/乙酸乙酯的体积比为5:3:2时,从DAD检测的色谱图来看,各种物质已经得到了较好的分离,但从ELSD检测色谱图上发现,天麻甙峰左侧有肩峰,说明有弱极性物质与天麻甙分离不完全,只是该物质在270 nm处无紫外吸收。增大正己烷比例,当正己烷/甲醇/乙酸乙酯的体积比达6:3:2时,无论从DAD检测结果〔图1(B)〕,还是ELSD检测结果〔图2(B)〕来看,提取物中的天麻甙与其他成分完全分离。从图1(B)可知,天麻提取物中的天麻甙元和对羟基苯甲醛与其后相邻的其他组分的分离不完全,因为本文的重点是比较ELSD和DAD检测天麻甙,故未对其它组分的分离条件进行优化。继续增大正己烷比例,各组分之间的分离度可进一步提高,但将导致分析时间过长。天麻甙也可以使用反相条件进行分离. 由于反相条件下,流动相中含水较多,ELSD工作时需要较高的漂移管温度和氮气气速,从而降低天麻甙的检测灵敏度. 故我们选用正相色谱条件来分离天麻甙. 天麻甙元和对羟基苯甲醛的挥发性较大, 即使在正相色谱条件下,也不能被ELSD检测. Fig.1 The chromatograms of the standards(A) and ethanol extracts of Gastrodia elata Blume.(B) detected by DAD 1. 4-hydroxybenzyl alcohol 2. 4-hydroxybenzaldehyde 3. Gastrodin. Fig.2 The chromatograms of the standards(A) and ethanol extracts of Gastrodia elata Blume.(B) detected by ELSD 1. Gastrodin 2.unknown. 3.2 ELSD条件优化 通过改变漂移管温度和氮气流速,选定在较小噪音水平上产生最大检测响应值的条件为:漂移管温度65 ℃,氮气流速1.55 L/min。 3.3 线性关系考察 将贮备液稀释配成21.3-890 mg/L的一系列浓度,依次进样20 mL,根据ELSD和DAD测得的峰面积对相应的标准溶液浓度进行线性回归。将最小浓度的标准溶液再逐级稀释,依次进样20 mL,计算当信噪比为3时,对应的标准溶液的浓度以确定检出下限。结果见表1. Table 1 Some parameters of gastrodin for quantitative analysis by ELSD and DAD Detector Linear range /(mg L-1) Calibration curve Calibration coefficient (r) Detection limit / (mg L-1) ELSD 21.3~890 Y=-56720.51+2534.46X 0.998 3.0 DAD 21.3~890 Y=-89.31+4.75X 0.999 1.0 3.4 天麻样品的测定 同一份样品重复进样5次,用ELSD和DAD测定其峰面积,取5次测定平均值计算样品中天麻甙含量. 在样品溶液中加入已知量的天麻甙标准溶液,测定回收率. 结果见表2. Table 2 Determination results of gastrodin in Gastrodia elata Blume by ELSD and DAD Detector Mass fraction (%) Recovery (%) RSD (%) ELSD 1.39 104.22 2.79 DAD 1.21 97.65 2.99 3.5 ELSD和DAD检测的比较 ELSD和DAD作为两种不同类型的检测器,其适用范围不尽相同. DAD所能检测的物质必须具有紫外吸收,而所采用的流动相应当在检测波长下无紫外吸收. 对于无紫外吸收的物质,可以通过衍生化的方法接上生色团. ELSD要求被测物比流动相难于挥发,对于一些半挥发性的物质,其检测灵敏度很低。同时,应当尽量避免使用高沸点的溶剂作为流动相. 对于一些分离中常加入的添加剂,如乙酸盐,磷酸盐等,ELSD检测时应用易挥发的盐来代替. 使用DAD和ELSD同时检测, 可以获得更多的物质信息, 且可以获得更准确的定量结果.
[b][font=宋体]问题描述:两种待测物质,用紫外检测器两个峰的分离度只有[/font]1.2[font=宋体],而用[/font][font=宋体]蒸发光散射检测器分离度却可以达到[/font]1.6[font=宋体]以上,这是为什么呢?[/font][font=宋体]解答:[/font][/b][font=宋体]([/font]1[font=宋体])主要跟检测器的灵敏度、采集频率等响应有关系:蒸发光散射检测器是蒸发后散射,响应速度快;而紫外检测器是要等待测物完全流过流通池,响应要慢一些。换言之,同样的流速,紫外检测器上的峰要圆钝一些,蒸发光散射检测器要尖锐一些,所以体现出的分离度就不一样。[/font][font=宋体]([/font]2[font=宋体])检测器不同,灵敏度就不同(对于符合正态分布的少量物质相应较高),管路连接方式、死体积等不同(即柱后效应),可能会对分离度有不同程度的影响。[/font][font='微软雅黑','sans-serif'][color=black][back=white]领取更多《实战宝典》请进:[url]http://instrument-vip.mikecrm.com/2bbmrpI[/url][/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white] [/back][/color][/font]
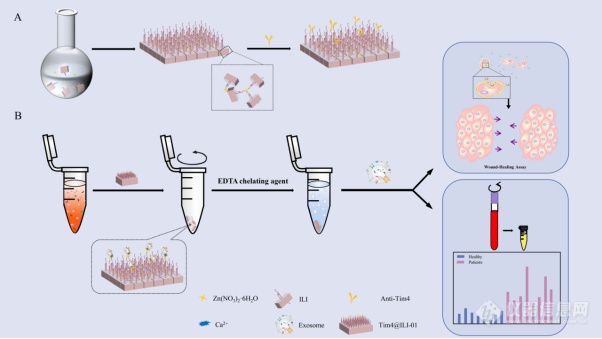
[align=center][font='times new roman'][size=21px][color=#000000]Tim4@ILI-01[/color][/size][/font][font='times new roman'][size=21px][color=#000000]免疫亲和材料用于外[/color][/size][/font][font='times new roman'][size=21px][color=#000000]泌[/color][/size][/font][font='times new roman'][size=21px][color=#000000]体的分离富集[/color][/size][/font][/align][align=left][font='times new roman'][size=20px][color=#000000]引言[/color][/size][/font][/align][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体作为重要的信息载体,参与肿瘤的发生、进展、转移和化疗耐药等过程,近年来受到人们的广泛关注。外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体携带大量的遗传物质,已成为液体活检最理想的分析目标。外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体也是目前最有前途的非侵入性诊断和预后的生物标志物之一。为了进一步提高外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的临床应用价值,开发高效的分离技术具有重要的意义。目前,[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]是外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体分离的金标准。然而,这种方法需要繁琐的过程,并且具有耗时长([/size][/font][font='times new roman'][size=16px] 10 h[/size][/font][font='times new roman'][size=16px]),捕获效率低([/size][/font][font='times new roman'][size=16px]5[/size][/font][font='times new roman'][size=16px]%至[/size][/font][font='times new roman'][size=16px]25[/size][/font][font='times new roman'][size=16px]%)和重现性差的缺点。基于聚合物的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体分离试剂盒是通过添加聚合沉淀物以获得大量外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的方法。尽管该方法快速简便,但其他非外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体污染物也可能共沉淀。因此,捕获的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体纯度相对较低。基于微流体的分离技术是利用外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的固有特征来捕获外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体。但是,该技术不仅需要大量的临床样本,而且处理能力低也会影响后续的下游分析。最近,开发了一种基于抗体的亲和技术以提高外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的富集效率。例如,[/size][/font][font='times new roman'][size=16px]Boriachek[/size][/font][font='times new roman'][size=16px]等人设计了一种使用[/size][/font][font='times new roman'][size=16px]CD63[/size][/font][font='times new roman'][size=16px]抗体功能化的载金氧化铁纳米颗粒([/size][/font][font='times new roman'][size=16px]Au-NP Fe[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]O[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]NC[/size][/font][font='times new roman'][size=16px])用于分离和检测外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体。将[/size][/font][font='times new roman'][size=16px]Au-NP Fe[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]O[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]NC[/size][/font][font='times new roman'][size=16px]材料分离得到的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体进一步识别胎盘碱性磷酸酶([/size][/font][font='times new roman'][size=16px]PLAP[/size][/font][font='times new roman'][size=16px])修饰的丝网印刷电极后,可以特异性检测出胎盘细胞分泌的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体。该方法可用于检测各种临床疾病的特定外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体群体,尤其是妊娠并发症。然而,这些方法难以同时实现外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的高效捕获和无损释放,这极大地限制了外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体生物学功能研究和在临床诊断中的应用。[/size][/font][font='times new roman'][size=16px]为了实现外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的临床价值,开发一种快速,有效且无损的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体分离方法具有重要的意义。金属有机框架材料作为一种特殊的多孔材料,因其具有高比表面积、良好的稳定性、较低的密度以及可调节的表面性能而引起人们的广泛关注。而基于抗体的免疫亲和捕获法具有灵敏度高、特异性好、且分离效率高等特点,在外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的分离富集方面具有很好的应用前景。将两者结合制备一种新的分离方法,实现外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的捕获和无损释放,为外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的下游临床诊断和检测提供强大的技术支持。[/size][/font][align=left][font='calibri'][size=29px]原理[/size][/font][/align][font='times new roman'][size=16px]本[/size][/font][font='times new roman'][size=16px]研究[/size][/font][font='times new roman'][size=16px]设计合成了一种[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料用于分离富集外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体。该分离方法具有处理时间短、非特异性粘附率低、捕获效率高以及无损释放外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体等基本特征。如图所示,首先利用阳离子[/size][/font][font='times new roman'][size=16px]ILI[/size][/font][font='times new roman'][size=16px]作为有机配体,制备强亲水性的[/size][/font][font='times new roman'][size=16px]ILI-01 MOFs[/size][/font][font='times new roman'][size=16px]薄[/size][/font][font='times new roman'][size=16px]片作为捕获外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的基质材料。[/size][/font][font='times new roman'][size=16px]ILI[/size][/font][font='times new roman'][size=16px]-01 MOFs[/size][/font][font='times new roman'][size=16px]材料固有的亲水性能有效降低外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体分离过程中的非特异性细胞粘附。此外,由于[/size][/font][font='times new roman'][size=16px]ILI[/size][/font][font='times new roman'][size=16px]-01 MOFs[/size][/font][font='times new roman'][size=16px]薄片上[/size][/font][font='times new roman'][size=16px]富含[/size][/font][font='times new roman'][size=16px]羧基,可以提高亲和力抗体的后续偶联效率,从而大大提高外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的捕获效率。在此,我们选择了针对外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体膜上磷脂酰丝氨酸([/size][/font][font='times new roman'][size=16px]PS[/size][/font][font='times new roman'][size=16px])受体的新型[/size][/font][font='times new roman'][size=16px]Tim4[/size][/font][font='times new roman'][size=16px]抗体。已经证明[/size][/font][font='times new roman'][size=16px]Tim4[/size][/font][font='times new roman'][size=16px]蛋白分子与[/size][/font][font='times new roman'][size=16px]PS[/size][/font][font='times new roman'][size=16px]分子之间的特定相互作用可以有效地将外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体从样品中分离出来,并且两者的结合存在[/size][/font][font='times new roman'][size=16px]Ca2+[/size][/font][font='times new roman'][size=16px]依赖特性,在中性条件下通过添加螯合剂可以轻易洗脱和回收外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体。因此,开发的[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料可以实现无损捕获和释放完整的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体,为后续临床诊断和治疗奠定了坚实的基础。[/size][/font][table][tr][td][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108012212485795_1809_5111497_3.png[/img][/align][/td][/tr][/table][align=center][font='times new roman']图[/font][font='times new roman']1 [/font][font='times new roman'] Tim4@ILI-01[/font][font='times new roman']免疫亲和薄片[/font][/align][font='times new roman'][size=18px][color=#000000]与常规外[/color][/size][/font][font='times new roman'][size=18px][color=#000000]泌[/color][/size][/font][font='times new roman'][size=18px][color=#000000]体分离方法的比较[/color][/size][/font][font='times new roman'][size=16px]进一步将所制备的[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料与金标准“[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]”进行比较。如[/size][/font][font='times new roman'][size=16px]图[/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px]所示,[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]分离到的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的大小分布明显[/size][/font][font='times new roman'][size=16px]更宽[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]而[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料捕获的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体显示出[/size][/font][font='times new roman'][size=16px]较[/size][/font][font='times new roman'][size=16px]窄的大小分布。此外,通过[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料捕获的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的[/size][/font][font='times new roman'][size=16px]众数[/size][/font][font='times new roman'][size=16px]和平均大小均明显小于[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]捕获的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体。进一步比较[/size][/font][font='times new roman'][size=16px]了两种方法的捕获颗粒数和蛋白含量,[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料富集法[/size][/font][font='times new roman'][size=16px]分离得到的[/size][/font][font='times new roman'][size=16px]颗粒数和蛋白含量分别比[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]高[/size][/font][font='times new roman'][size=16px]5.2[/size][/font][font='times new roman'][size=16px]倍和[/size][/font][font='times new roman'][size=16px]2.4[/size][/font][font='times new roman'][size=16px]倍[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]之前的研究表明,[/size][/font][font='times new roman'][size=16px]颗粒[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]蛋白比与外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体样品的纯度呈正相关[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]而[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料捕获的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体颗粒[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]蛋白[/size][/font][font='times new roman'][size=16px]比值[/size][/font][font='times new roman'][size=16px]比[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]高[/size][/font][font='times new roman'][size=16px]6.7[/size][/font][font='times new roman'][size=16px]倍。因此,基于[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料的富集法可以产生更多纯度更高的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]显示[/size][/font][font='times new roman'][size=16px]出明显[/size][/font][font='times new roman'][size=16px]的优势。[/size][/font][table][tr][td][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108012212488549_9401_5111497_3.jpeg[/img][/align][/td][/tr][/table][align=center][font='times new roman']图[/font][font='times new roman']2 [/font][font='times new roman']比较[/font][font='times new roman']Tim4@ILI-01[/font][font='times new roman']免疫亲和材料和[/font][font='times new roman']UC[/font][font='times new roman']分离的外[/font][font='times new roman']泌[/font][font='times new roman']体:([/font][font='times new roman']A[/font][font='times new roman'])[/font][font='times new roman']UC[/font][font='times new roman']分离的外[/font][font='times new roman']泌[/font][font='times new roman']体大小分布;([/font][font='times new roman']B[/font][font='times new roman'])众数和平均大小;([/font][font='times new roman']C[/font][font='times new roman'])颗粒计数和总蛋白量;([/font][font='times new roman']D[/font][font='times new roman'])颗粒数与总蛋白质量的比率[/font][/align][font='times new roman'][size=16px]进一步采用[/size][/font][font='times new roman'][size=16px]Western blotting[/size][/font][font='times new roman'][size=16px]对上述结果进行验证。如图[/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px]所示,[/size][/font][font='times new roman'][size=16px]通过[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和材料[/size][/font][font='times new roman'][size=16px]富集的外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体表面[/size][/font][font='times new roman'][size=16px]HSP70[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]CD63[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]TSG101[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]CD81[/size][/font][font='times new roman'][size=16px]的蛋白量分别比[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]富集的[/size][/font][font='times new roman'][size=16px]高[/size][/font][font='times new roman'][size=16px]4.8[/size][/font][font='times new roman'][size=16px]倍、[/size][/font][font='times new roman'][size=16px]2.9[/size][/font][font='times new roman'][size=16px]倍、[/size][/font][font='times new roman'][size=16px]1.9[/size][/font][font='times new roman'][size=16px]倍、[/size][/font][font='times new roman'][size=16px]1.5[/size][/font][font='times new roman'][size=16px]倍[/size][/font][font='times new roman'][size=16px]。以上结果可表明[/size][/font][font='times new roman'][size=16px]所建立的[/size][/font][font='times new roman'][size=16px]基于[/size][/font][font='times new roman'][size=16px]Tim4@ILI-01[/size][/font][font='times new roman'][size=16px]免疫亲和[/size][/font][font='times new roman'][size=16px]材料[/size][/font][font='times new roman'][size=16px]富集法优于传统的[/size][/font][font='times new roman'][size=16px]UC[/size][/font][font='times new roman'][size=16px]法[/size][/font][font='times new roman'][size=16px]。[/size][/font][table][tr][td][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108012212491547_9181_5111497_3.jpeg[/img][/align][/td][/tr][/table][align=center][font='times new roman']图[/font][font='times new roman'] 3[/font][font='times new roman']比较[/font][font='times new roman']Tim4@ILI-01[/font][font='times new roman']免疫亲和材料富集法和[/font][font='times new roman']UC[/font][font='times new roman']分离的外[/font][font='times new roman']泌[/font][font='times new roman']体:([/font][font='times new roman']A[/font][font='times new roman'])外[/font][font='times new roman']泌[/font][font='times new roman']体标记蛋白的[/font][font='times new roman']Western blotting[/font][font='times new roman']结果;([/font][font='times new roman']B[/font][font='times new roman'])蛋白质含量的比较[/font][/align]
[align=center][size=21px]紫外检测器的[/size][size=21px]应用[/size][size=21px]及畅想[/size][/align][size=18px] 紫外检测器应用很广,在很多检测设备里都有运用,用到不同的检测现场及检测领域。 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]紫外检测器,是[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]应用最多的一款检测器,具有灵敏度高、选择性好、精密度、准确度高等多种优良特性,广泛应用在食品检测、药品检测、环境检测、水质检测、石化、化妆品、生命科学等领域。 紫外分光光度计,这种仪器核心部件其实也是一款紫外检测器,不同之处是[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]紫外检测器检测池是流通池,可对流过的样品进行连续检测。紫外分光光度计检测池是比色皿,检测时需要把样品装到比色皿中,然后放到检测池检测,它只能一次一次单独检测,检测数据也只是每一个样品单独的数据。当然现在也有人把这个比色皿做成了一个类似流通池的部件(比色皿有一个进液口一个出液口),用一个泵连续不断的给比色皿中输送样品,这样其实和[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]紫外检测器的功能也差不多了,只是灵敏度、精密度等指标会差一些。 这两种检测器的特点都是检测时,在某一时刻只能选择一个检测波长,某一时刻到检测器的样品只能是单一的样品才能检测,混合样品只能通过前处理或色谱柱分离后检测,检测有一定局限性。 环境检测设备中也有用到紫外检测器的,比如黑碳仪,紫外分析仪,高温紫外分析仪等在线检测设备中都是采样紫外检测器检测的。像紫外分析仪这种仪器可实时检测环境样气中的NO、NO2、SO2、NH3等气体浓度。要知道这几种气体的检测波长可不是一个固定的,而且在某一个组分的检测波长下可能还会有别的组分对检测干扰,检测难度也是挺大的。他们采用一种叫差分法的方法,经过一系列运算、处理,最终实现了较快速、灵敏、准确、稳定的检测。 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]中还有一种紫外检测器,二极管阵列检测器,这种检测器采样三维立体色谱图检测,也能同时检测较复杂的样品,检测效果和环境检测设备检测的类似。但这种仪器具有结构复杂、造价高、灵敏度低等特点,应用也是具有一定局限性。 用的多了就会有一点想法。大家是不是可以把环境检测设备这种紫外检测器原理也应用到[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]紫外检测器呢,也采用差分处理方法处理。虽然这种方法不会对所有样品都适用,但最起码对某些样品会适用,对于那些如样品较多、种类较固定、通过前处理或色谱柱难分离的样品的用户,如果有这么一款仪器,对于他们来说会非常适用非常受欢迎。 这种技术在[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]紫外检测器及其它领域仪器中可能已经有应用或研究,希望早日成熟,广泛推广。[/size]
大家好,我想检测一下气体的紫外吸收谱线,现在手上有UV-1700紫外-可见分光光度计一台,可是苦于没有好的气体池,想问一下用红外分光光度计的HF-11气体池可以不?天津港东给的CaF2窗片的参数为:透过波长7800-1100cmˉ¹ ,(1-9um)透过率大于90%。从此资料来看不能用于紫外检测 但是在岛津给的资料里CaF2窗片的透过领域为0.13~12.0um,没有给具体的透过率。 想问一下CaF2窗片能否用于紫外检测,大家有没有做过气体的紫外分析,用的什么气体池,请指教,谢谢。
建立了水产品肌肉组织中螺旋霉素、替米考星、泰乐菌素、北里霉素同时测定的超高效液相色谱一紫外检测(UPLC—TUV)方法。样品经乙腈提取后,浓缩至近干,用4% NaC1溶解残渣,正己烷除脂,经固相萃取小柱净化,乙腈洗脱;以乙腈一25 mmo~L磷酸二氢铵(pH 2.5,含10% 乙腈)为流动相,以ACQUITYUPLC BEH Cl8为分离柱,柱温为45℃,流速为0.3 mL/min,紫外检测。方法在0.100~20.0 mg/L范围内呈线性相关,螺旋霉素、替米考星、泰乐菌素和北里霉素的相关系数分别为0.998 7、0.999 3、0.999 4和0.998 0。平均回收率为70%~102%,相对标准偏差为2.9%~11.2% ,螺旋霉素、替米考星、泰乐菌素和北里霉素的检出限分别为25、25、50、75 kg。方法满足水产品肌肉组织中螺旋霉素、替米考星、泰乐菌素和北里霉素的残留量测定。
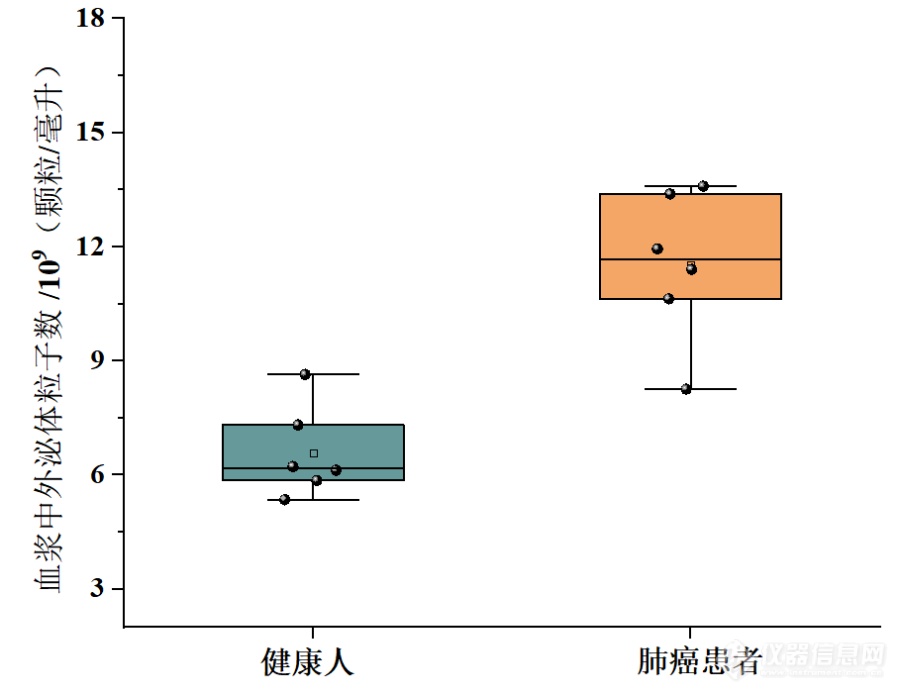
[align=center][font='times new roman'][size=16px]血浆外泌体[/size][/font][font='times new roman'][size=16px]在肺癌诊断中的应用[/size][/font][/align][font='times new roman'][size=16px]引言[/size][/font][font='宋体']外泌体作为重要的信息载体,参与肿瘤的发生、进展、转移和化疗耐药等过程,外泌体携带大量的遗传物质,已成为液体活检最理想的分析目标。外泌体也是目前最有前途的非侵入性诊断和预后的生物标志物之一。目前,超速离心法是外泌体分离的金标准。为了实现外泌体的临床价值,本研究以超速离心法富集了人血浆中的外泌体,并对健康人及肺腺癌患者的血浆样品做了区分,用于下游的肺癌诊断[/font][font='宋体']。[/font][align=left][font='times new roman'][size=16px]血浆外泌体用于肺癌诊断的策略[/size][/font][/align]肺癌仍然是世界范围内癌症相关死亡的主要诱因,因为大多数患者被诊断时均为晚期。因此,我们初步评估了超速离心法富集外泌体用于肺癌诊断的潜在适用性。我们收集了6名健康捐赠者和6名肺癌患者的血浆样本。利用超速离心法富集1 mL血浆样本中的外泌体,对比健康捐赠者和肺癌患者的血浆外泌体,结合数据分析,评估血浆外泌体在监测肺癌诊断方面潜在的适用性。[align=left][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px]血浆中外泌体表征[/size][/font][/align]测试了超速离心法对复杂血浆样品的适用性。首先,利用纳米颗粒示踪分析对超速离心法得到的血浆外泌体进行了表征。如图(a)所示, 纳米颗粒示踪分析显示分离的外泌体粒径分布同样较窄,平均粒径为128.8 nm。与细胞上清样品类似,Western blot方法验证了分离外泌体的有效性。如图(b)所示,经富集后,典型的低丰度外泌体标记物同样得到了有效检测。以上结果证明,超速离心法能[img]" style="max-width: 100% max-height: 100% [/img]够成功的用于血浆中外泌体的富集。[align=center][font='黑体'][size=14px]图[/size][/font][font='黑体'][size=14px] (a)重悬液中血浆外泌体的[/size][/font][font='黑体'][size=14px]纳米颗粒示踪分析技术[/size][/font][font='黑体'][size=14px]表征,(b)[/size][/font][font='黑体'][size=14px]Western blot方法[/size][/font][font='黑体'][size=14px]表征血浆[/size][/font][font='黑体'][size=14px]外泌体标记物HSC70、TSG101、CD63和CD9[/size][/font][font='黑体'][size=14px]蛋白条带[/size][/font][/align][align=left][font='times new roman'][size=16px]血浆外泌体用于肺癌[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]诊断[/size][/font][/align][font='宋体']我[/font]们收集了6名健康捐赠者和6名肺癌患者的血浆样本。利用超速离心法富集血浆样本中的外泌体。采用纳米颗粒示踪分析技术对血浆外泌体标进行表征。如图所示,与健康对照组相比,肺癌患者的血浆外泌体显著上调。对比健康捐赠者和肺癌患者的血浆外泌体,结合数据分析,证明血浆外泌体在监测肺癌诊断方面具有潜在的适用性。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310171534194891_9083_6197575_3.png[/img][font='黑体'][size=14px]图[/size][/font][font='黑体'][size=14px] [/size][/font][font='黑体'][size=14px]健康人与肺癌患者血浆中外泌体的[/size][/font][font='黑体'][size=14px]纳米颗粒示踪分析[/size][/font][font='黑体'][size=14px]技术[/size][/font][font='黑体'][size=14px]表征[/size][/font][/align][align=left][font='黑体'][size=18px]小结[/size][/font][/align]超速离心法可以高效、特异性地从人血浆中富集、纯化外泌体,在此我们评估了超速离心法在复杂血浆样品中的适用性。肺癌是全球癌症相关死亡的主要原因,因为在原发癌症扩散之前进行早期诊断具有挑战性。以6例肺癌患者(6例健康供者为对照)的人血浆为样本,进一步研究超速离心法富集外泌体在肺癌筛查和诊断中的应用。这些结果证实了血浆外泌体在肺癌筛查和监测中的应用潜力。
[align=center][size=18px]高分辨分离分析新技术在食品安全检测领域的应用进展[/size][/align][size=18px][font=&]前言[/font][font=&]食品安全与质量对全球经济、人类健康和国土安全至关重要。然而,由于食品种类的多样性及化学成分的复杂性,微生物病原体、重金属、食品添加剂、生物毒素、农/兽药,甚至食品包装材料微塑料成分等多种痕量污染物的快速鉴别成为现代社会食品安全分析的一大挑战。除了食品化学污染外,食品还面临着非法掺假、降解变质等,虽然传统技术(如色谱分析法、光谱分析法等)可以实现食品中目标化合物的检测,但繁琐的样品前处理过程(分离、提取、净化、富集等)已不适用于当代食品检测学中对风险物质的快速高通量筛查。[/font][font=&]因此,针对复杂化学混合物中分子离子的筛选,离子迁移谱(IMS)作为一种快速分离技术,新增了一维离子淌度信息——碰撞横截面积,其测量与气态离子的大小、形状和所带电荷有关,不受样品基质影响,检测信噪比也有所提高,因此能够有效分辨同分异构体、多电荷态物质等。同时高分辨MS作为分析复杂样品的常用设备,具有在原子和分子水平上进行多组分分析的优点,且各种类型的离子碰撞解离技术极大地扩展了MS在食品分析方面的应用。一方面,质谱数据库的构建以及机器学习算法程序的应用,大大提高了食品中未知风险成分的高分辨筛查与预测能力 另一方面,敞开式离子化质谱法(AMS)作为传统MS的一个重要的创新突破,是一种快速有效的复杂样品直接分析方法,因此成为高通量定性分析、无损反应监测的绝佳选择。[/font][font=&]高分辨MS作为实验室仪器在分析应用领域有着较大发展,但也存在体积庞大、价格昂贵、操作复杂、不能随时移动等局限性,因此无法在食品环境污染、食品风险因子、突发应急监测等需要进行现场快速检测的领域得到有效应用。目前质谱仪器正向高效率、便携化、可视化方面发展,出现了微型质谱仪。未来开发无需样品前处理、可由非专业人员操作、具备高分辨分离分析性能的微型质谱仪,对满足原位、实时、无损的食品现场快检十分重要。[/font][font=&]本文重点概述了近十年高分辨分离分析技术在食品安全领域的最新进展与应用,分别通过在线质谱耦合技术、高分辨筛查技术以及微型质谱仪3大领域展开介绍,并对食品安全检测新装置的前景进行了展望。[/font][font=&]1、 在线质谱耦合技术[/font][font=&]MS是在线过程优化和智能控制的基本仪器,在线质谱法的优势是能够表征化学反应过程,如化学产物和杂质的形成以及底物的消耗,在线质谱技术作为一种高灵敏检测技术,已由推测化学反应机理研究逐渐向痕量物质的实时快速检测和准确定量方面应用。为了实现各种设备与质谱的在线联用,最关键的问题是在两个设备之间开发合适的接口,以解决大气压气流对质谱检测器造成的真空冲击。目前MS已实现与色谱分离技术(例如超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]、[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]、毛细管电泳、超临界流体色谱)串联,但涉及富集提取-色谱分离-质谱检测的耗时过程。然而,随着IMS与AMS的出现与发展,在线质谱法有了新的可供选择的耦合方式,并已有成功应用于小型化设备现场分析的案例。[/font][font=&]1.1 离子迁移谱法[/font][font=&]1.1.1 漂移管离子迁移谱法[/font][font=&]1.1.2 吸入离子迁移谱法[/font][font=&]1.1.3 场不对称形离子迁移谱法[/font][font=&]1.1.4 行波离子迁移谱法[/font][font=&]1.1.5 捕获离子迁移谱法[/font][font=&]1.2 敞开式离子化质谱法[/font][font=&]1.2.1 喷雾电离[/font][font=&]1.2.2 电场电离[/font][font=&]1.2.3 光电离[/font][font=&]1.2.4 热电离[/font][font=&]2、高分辨筛查技术[/font][font=&]高分辨筛查技术一般分为靶向筛查和非靶向筛查,靶向筛查可减少一定干扰离子的存在,但不适合在复杂食品样品中发现潜在风险化合物 非靶向筛查可获得样本所有离子的碎片信息,更适合复杂样本的高通量筛查分析。但由于样品制备、有机溶剂、采集方法和数据分析等差异,不同高分辨MS用于筛查风险物质的方法准确性存在很大差异。因此,构建高质量质谱数据库,尽可能去除不同仪器与实验操作的干扰,减少对参考标准品的依赖,对未知化合物的有效筛查至关重要。[/font][font=&]2.1 质谱数据库[/font][font=&]2.2 质谱预测[/font][font=&]3 、微型质谱仪[/font][font=&]微型质谱仪在保留完整质谱功能的同时,去除了繁琐的样品前处理过程,具有更低的功耗特性,也更具有价格优势。为了适应现场监测的便携性,分析仪器的小型化与AMS分离技术的结合已经成为许多科学领域的关注点,让大多数样品在现场电离,更适用于非专业操作者使用。与实验室大型质谱仪要求的高真空系统相比,微型质谱仪既可以耦合非敞开式电离源,也可以耦合敞开式电离源。因此真空系统和大气压接口的设计成为各种类型微型质谱仪研制的关键。[/font][font=&]总结与展望[/font][font=&]随着多种MS新技术的发展,数据库以及机器预测范围的大幅增加,未来研制出具备高分辨分离分析性能、集在线质谱耦合技术与高分辨筛查技术于一身的微型质谱仪十分可能。虽然微型质谱仪已在食品安全、消费品安全、公共安全等多个领域取得了很大进展,但仍然存在许多挑战,包括:[/font][font=&](a)非均相样品的采样与分析 [/font][font=&](b)复杂样品成分导致的离子抑制影响定量准确性 、(c)大气压气流对质谱检测器造成的真空冲击 [/font][font=&](d)检测受到温度、湿度、样品接触面积等因素影响较大。[/font][font=&]以上干扰均可能导致食品风险控制中假阳性结果的出现。因此,研发新型高选择性表面功能化改性材料,定向偶联到厘米级电离芯片上,实现微型质谱仪富集-分离-电离的一体化,可有效消除基质干扰,提高原位检测的准确性。同时,研制具有稳定梯度压力分布的小型多级真空系统以及低气压下的高效离子传输与聚焦技术,对实现快速、稳定、高灵敏、高分辨率的小型原位装置十分必要。[/font][/size]
请问:有没有用于[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]的紫外检测器,可以介绍一下吗?另外请教有关气体密度天平的详细知识!!!!!!!!
各位好! 我用液相色谱紫外检测器做甜蜜素的检测,仪器条件是紫外检测器,ODS3柱子,流动相乙腈:水(70:30),检测波长314nm,但是做标准品200ppm都没看到出峰,不知道哪位大侠可以指教一下呢?谢谢了!
分析者对待测离子应有一些一般信息,首先应了解待测化合物的分子结构和性质以及样品的基体情况,如无机还是有机离子,离子的电荷数,是酸还是碱,亲水还是疏水,是否为表面活性化合物等。待测离子的疏水性和水合能是决定选用何种分离方式的主要因素。水合能高和疏水性弱的离子,如Cl-或K+,最好用HPIC分离。水合能低和疏水性强的离子,如高氯酸(ClO4-)或四丁基铵,最好用亲水性强的离子交换分离柱或MPIC分离。有一定疏水性也有明显水合能的pKa值在1与7之间的离子,如乙酸盐或丙酸盐,最好用HPICE分离。有些离子,既可用阴离子交换分离,也可用阳离子交换分离,如氨基酸,生物碱和过渡金属等。很多离子可用多种检测方式。例如测定过渡金属时,可用单柱法直接用电导或脉冲安培检测器,也可用柱后衍生反应,使金属离子与PAR或其它显色剂作用,再用UV/VIS检测。一般的规律是:对无紫外或可见吸收以及强离解的酸和碱,最好用电导检测器;具有电化学活性和弱离解的离子,最好用安培检测器;对离子本身或通过柱后反应后生成的络合物在紫外可见有吸收或能产生荧光的离子和化合物,最好用UV/VIS或荧光检测器。若对所要解决的问题有几种方案可选择,分析方案的确定主要由基体的类型、选择性、过程的复杂程度以及是否经济来决定。表1和2总结了对各种类型离子可选用的分离方式和检测方式。 离子色谱柱填料的发展推动了离子色谱应用的快速发展,对多种离子分析方法的开发提供了多种可能性。特别应提出的是在pH 0-14的水溶液和100%有机溶剂(反相高效液相色谱用有机溶剂)中稳定的亲水性高效高容量柱填料的商品化,使得离子交换分离的应用范围更加扩大。常见的在水溶液中以离子形态存在的离子,包括无机和有机离子,以弱酸的盐(Na2CO3/NaHCO3, KOH、NaOH)或强酸(H2SO4、甲基磺酸、HNO3、HCl)为流动相,阴离子交换或阳离子交换分离,电导检测,已是成熟的方法,有成熟的色谱条件可参照。对近中性的水可溶的有机“大”分子(相对常见的小分子而言),若待测化合物为弱酸,则由于弱酸在强碱性溶液中会以阴离子形态存在,因此选用较强的碱为流动相,阴离子交换分离;若待测化合物为弱碱,则由于在强酸性溶液中会以阳离子形态存在,选用较强的酸作流动相,阳离子交换分离;若待测离子的疏水性较强,由于与固定相之间的吸附作用而使保留时间较长或峰拖尾,则可在流动相中加入适量有机溶剂,减弱吸附,缩短保留时间、改善峰形和选择性。对该类化合物的分离也可选用离子对色谱分离,但流动相中一般含有较复杂的离子对试剂。 此外,对弱保留离子可选用高容量柱和弱淋洗液以增强保留,对强保留离子则反之。表1,2列出了离子色谱中常用的两种主要检测器:电化学检测器(包括电导和安培)和光学检测器。在水溶液中以离子形态存在的离子,即较强的酸或碱,应选用电导检测。具有对紫外或可见光有吸收基团或经柱后衍生反应后(IC中较少用柱前衍生)生成有吸光基团的化合物,选用光学检测器。具有在外加电压下可发生氧化或还原反应基团的化合物,可选用直流安培或脉冲安培检测。对一些复杂样品,为了一次进样得到较多的信息,可将两种或三种检测器串联使用。
[color=#333333]质谱检测属于体外检测的什么类型?[/color]
分析者对待测离子应有一些一般信息,首先应了解待测化合物的分子结构和性质以及样品的基体情况,如无机还是有机离子,离子的电荷数,是酸还是碱,亲水还是疏水,是否为表面活性化合物等。待测离子的疏水性和水合能是决定选用何种分离方式的主要因素。水合能高和疏水性弱的离子,如Cl-或K,最好用HPIC分离。水合能低和疏水性强的离子,如高氯酸(ClO4-)或四丁基铵,最好用亲水性强的离子交换分离柱或MPIC分离。有一定疏水性也有明显水合能的pKa值在1与7之间的离子,如乙酸盐或丙酸盐,最好用HPICE分离。有些离子,既可用阴离子交换分离,也可用阳离子交换分离,如氨基酸,生物碱和过渡金属等。 很多离子可用多种检测方式。例如测定过渡金属时,可用单柱法直接用电导或脉冲安培检测器,也可用柱后衍生反应,使金属离子与PAR或其它显色剂作用,再用UV/VIS检测。一般的规律是:对无紫外或可见吸收以及强离解的酸和碱,最好用电导检测器;具有电化学活性和弱离解的离子,最好用安培检测器;对离子本身或通过柱后反应后生成的络合物在紫外可见有吸收或能产生荧光的离子和化合物,最好用UV/VIS或荧光检测器。若对所要解决的问题有几种方案可选择,分析方案的确定主要由基体的类型、选择性、过程的复杂程度以及是否经济来决定。表1和2总结了对各种类型离子可选用的分离方式和检测方式。 离子色谱柱填料的发展推动了离子色谱应用的快速发展,对多种离子分析方法的开发提供了多种可能性。特别应提出的是在pH0-14的水溶液和100%有机溶剂(反相高效液相色谱用有机溶剂)中稳定的亲水性高效高容量柱填料的商品化,使得离子交换分离的应用范围更加扩大。常见的在水溶液中以离子形态存在的离子,包括无机和有机离子,以弱酸的盐(Na2CO3/NaHCO3,KOH、NaOH)或强酸(H2SO4、甲基磺酸、HNO3、HCl)为流动相,阴离子交换或阳离子交换分离,电导检测,已是成熟的方法,有成熟的色谱条件可参照。对近中性的水可溶的有机“大”分子(相对常见的小分子而言),若待测化合物为弱酸,则由于弱酸在强碱性溶液中会以阴离子形态存在,因此选用较强的碱为流动相,阴离子交换分离;若待测化合物为弱碱,则由于在强酸性溶液中会以阳离子形态存在,选用较强的酸作流动相,阳离子交换分离;若待测离子的疏水性较强,由于与固定相之间的吸附作用而使保留时间较长或峰拖尾,则可在流动相中加入适量有机溶剂,减弱吸附,缩短保留时间、改善峰形和选择性。对该类化合物的分离也可选用离子对色谱分离,但流动相中一般含有较复杂的离子对试剂。此外,对弱保留离子可选用高容量柱和弱淋洗液以增强保留,对强保留离子则反之。离子色谱中常用的两种主要检测器:电化学检测器(包括电导和安培)和光学检测器。在水溶液中以离子形态存在的离子,即较强的酸或碱,应选用电导检测。具有对紫外或可见光有吸收基团或经柱后衍生反应后(IC中较少用柱前衍生)生成有吸光基团的化合物,选用光学检测器。具有在外加电压下可发生氧化或还原反应基团的化合物,可选用直流安培或脉冲安培检测。对一些复杂样品,为了一次进样得到较多的信息,可将两种或三种检测器串联使用。(中国分析仪器网)

水质中农药残留检测与分离 为了我们身体健康和生活美好,对这些农药残留的检测是非常必要的,也是现在水质检测所必须的,是国标强制要求的。下面我们就介绍下水质中残留农药呋喃丹、甲萘威的检测方法,高效液相色谱法。实验部分原理:试样经提纯、净化、浓缩、定容、微膜过滤,后进样,经C18高效液相色谱柱分离,紫外检测器检测,根据色谱峰的保留时间定性,外标法定量计算。仪器:高效液相色谱仪(紫外检测器);旋转蒸发仪;超纯水机;试剂:呋喃丹标准品溶液,甲萘威标准品溶液,二氯甲烷,甲醇(色谱纯),丙酮,乙酸乙酯,环己烷,氯化钠,无水硫酸钠,硫代硫酸钠色谱条件:色谱柱:Venusil XBP C18高效液相色谱柱;流动相:甲醇:水=60:40;流速:1.0ml/min;检测波长:280nm;柱温:35℃;进样量:20ul。色谱图:如果使用该方法,同时检测呋喃丹、甲萘威,色谱图如下:http://ng1.17img.cn/bbsfiles/images/2013/09/201309151717_464490_2369266_3.png在这个色谱条件下,呋喃丹、甲萘威的分离度达到2.25,完全分离,效果非常好。 小结:高效液相色谱法,紫外检测器检测呋喃丹、甲萘威,重现性、稳定性好,准确度高。 建议:多组分测定时,如果等度洗脱可以达到分离效果,尽量采用等度洗脱。等度洗脱配置相对简单,操作相对方便,重现性、稳定性相对好,准确度相对高。
玉米赤霉醇:盲目追求增重的危害· 什么是玉米赤霉醇 玉米赤霉醇又名“右环十四酮酚”,商品名字“畜大壮”,是玉米赤霉菌在生长过程中产生的次生代谢产物玉米赤霉烯酮的还原产物,属于雷索酸内酯类非甾体类同化激素。它是一种皮埋增重剂。· 食品中为什么会残留玉米赤霉醇玉米赤霉醇能直接或间接作用于脑下垂体和胰脏,提高体内生长激素和胰岛素水平,促进动物机体蛋白质的合成,提高饲料利用率,从而产生促增重作用。由于玉米赤霉醇作为牛羊增重剂效果好,经济回报高,部分违法者在畜禽养殖过程中使用玉米赤霉醇,导致玉米赤霉醇可能会残留在各种食用组织(如牛羊肉、动物肝脏、肾脏和血液等)中。· 玉米赤霉醇有哪些危害 玉米赤霉醇及其代谢产物具有雌激素类物质的生物活性,对促性腺激素结合受体、体外肝脏激素结合受体均有抑制作用。雌激素类物质的残留会引起人体性激素机能紊乱及影响第二性征的正常发育,在外部条件诱导下,可能致癌。玉米赤霉醇排出动物体外后,还可经饮水和食物造成二次污染及环境污染。· 玉米赤霉醇的检测方法 目前,玉米赤霉醇残留量的主要检测标准是推荐性国家标准GB/T 21982-2008《动物源食品中玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮和赤霉烯酮残留量检测方法,液相色谱-质谱/质谱法》,另外还有3个是农业部公告方法:农业部1025号公告-3-2008《动物性食品中玉米赤霉醇残留检测酶联免疫吸附法和气相色谱-质谱法》、农业部1025号公告-19-2008《动物源性食品中玉米赤霉醇类 药物残留检测 液相色谱-串联质谱法》和农业部1077号公告-6-2008《水产品中玉米赤霉醇类残留量的测定液相色谱-串联质谱法》。南京科捷高效液相色谱:LC600高效液相色谱仪(梯度配置) P600宝石恒流泵 2台UV600紫外检测器 1台7725i六通进样阀 1只进口C18柱 150x4.6 5u 1根WS600色谱工作站 1套主要特点:1 智能化---状态智能监测系统,人性化更强 2 自动化---自动控制及反馈功能,操作更便捷 3 网络化---多台仪器网络接口链接,平台更先进 4 高精度,高稳定性----全数字化信号系统有效的提高了仪器精度; 各部件长寿命的设计标准以及低能耗的运行有效地保证了仪器的稳定性
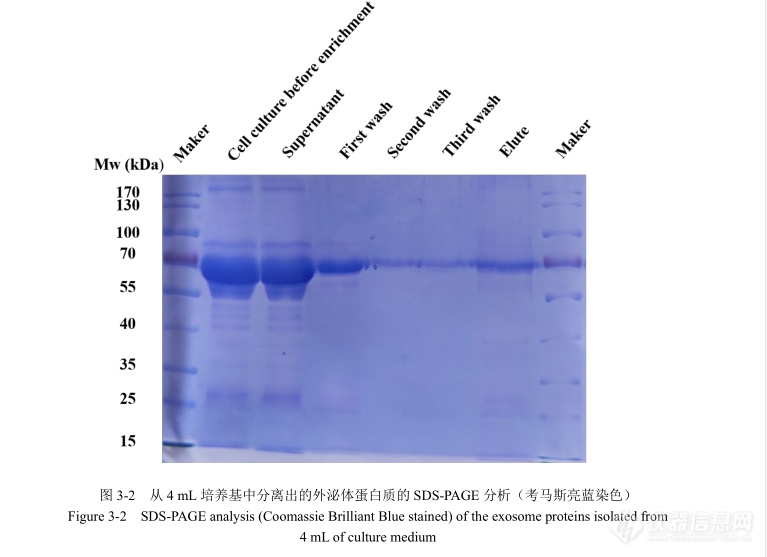
[align=center][font='times new roman'][size=18px][b]细胞培养[/b][/size][/font][font='times new roman'][size=18px][b]、[/b][/size][/font][font='times new roman'][size=18px][b]外泌体分离方法[/b][/size][/font][font='times new roman'][size=18px][b]及表征[/b][/size][/font][/align][font='times new roman'][size=16px]1 [/size][/font][font='times new roman'][size=16px]细胞复苏[/size][/font][font='times new roman'][size=16px]于[/size][/font][font='times new roman'][size=16px]-80°C [/size][/font][font='times new roman'][size=16px]低温冰箱中取出冻存的人乳腺癌细胞[/size][/font][font='times new roman'][size=16px] MCF-7[/size][/font][font='times new roman'][size=16px],马上放入[/size][/font][font='times new roman'][size=16px] 37°C [/size][/font][font='times new roman'][size=16px]水浴锅中。待冻存管中的冰全部融化后,以[/size][/font][font='times new roman'][size=16px] 1000 rpm [/size][/font][font='times new roman'][size=16px]的转速离心[/size][/font][font='times new roman'][size=16px] 5 min [/size][/font][font='times new roman'][size=16px]后转移至超净工作台中,去除上清液并加入[/size][/font][font='times new roman'][size=16px] 1 mL [/size][/font][font='times new roman'][size=16px]的新鲜培养基,轻轻吹打使其混和均匀,将混匀后的细胞悬液转移到培养瓶中,再加入适量的培养基,放入[/size][/font][font='times new roman'][size=16px] 37°C[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]5% CO [/size][/font][font='times new roman'][size=16px]恒温培养箱中培养。培养过夜的细胞贴壁后去除旧培养基,加入适量的[/size][/font][font='times new roman'][size=16px] PBS [/size][/font][font='times new roman'][size=16px]缓冲溶液清洗细胞表面,再重新加入适量的新鲜培养基继续培养至覆盖表面[/size][/font][font='times new roman'][size=16px] 80%[/size][/font][font='times new roman'][size=16px]左右。[/size][/font][font='times new roman'][size=16px]2 [/size][/font][font='times new roman'][size=16px]细胞传代[/size][/font][font='times new roman'][size=16px]取培养至覆盖培养皿表面[/size][/font][font='times new roman'][size=16px] 80%[/size][/font][font='times new roman'][size=16px]的细胞,去除培养基,取适量的[/size][/font][font='times new roman'][size=16px] PBS [/size][/font][font='times new roman'][size=16px]缓冲溶液清洗细胞表面,将[/size][/font][font='times new roman'][size=16px] PBS [/size][/font][font='times new roman'][size=16px]吸出后加入[/size][/font][font='times new roman'][size=16px] 0.25%[/size][/font][font='times new roman'][size=16px]的胰蛋白酶,置于[/size][/font][font='times new roman'][size=16px] 37°C [/size][/font][font='times new roman'][size=16px]的环境下消化。在倒置显微镜下观察,当发现细胞收缩相互分离时,加入新鲜培养基,缓慢吹打使细胞脱落,悬浮于培养基中。取细胞悬液[/size][/font][font='times new roman'][size=16px] 1000 rpm [/size][/font][font='times new roman'][size=16px]离心[/size][/font][font='times new roman'][size=16px] 5 min[/size][/font][font='times new roman'][size=16px],再次加入适量新鲜培养基混匀后传至新的培养皿中,放入[/size][/font][font='times new roman'][size=16px] 37°C[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]5% CO 2 [/size][/font][font='times new roman'][size=16px]恒温培养箱中培养。传代后的细胞一部分用于培养基收集,分离外泌体,另一部分冻存后备用。[/size][/font][font='times new roman'][size=16px]3 [/size][/font][font='times new roman'][size=16px]含外泌体培养基收集[/size][/font][font='times new roman'][size=16px]首先,将胎牛血清[/size][/font][font='times new roman'][size=16px] FBS [/size][/font][font='times new roman'][size=16px]于[/size][/font][font='times new roman'][size=16px] 100,000 g[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]4°C [/size][/font][font='times new roman'][size=16px]条件下超速离心[/size][/font][font='times new roman'][size=16px] 70 min[/size][/font][font='times new roman'][size=16px],得到去除外泌体的培养血清。[/size][/font][font='times new roman'][size=16px]在本研究中,将细胞[/size][/font][font='times new roman'][size=16px] MCF-7 [/size][/font][font='times new roman'][size=16px]接种到一个[/size][/font][font='times new roman'][size=16px] 150 mm [/size][/font][font='times new roman'][size=16px]的培养皿中,加入[/size][/font][font='times new roman'][size=16px] 30 mL [/size][/font][font='times new roman'][size=16px]含[/size][/font][font='times new roman'][size=16px] 10%[/size][/font][font='times new roman'][size=16px]无外泌体[/size][/font][font='times new roman'][size=16px] FBS [/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px] DMEM [/size][/font][font='times new roman'][size=16px]培养基,置于[/size][/font][font='times new roman'][size=16px] 5% CO 2 [/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px] 37°C [/size][/font][font='times new roman'][size=16px]培养箱中培养。待细胞生长达到覆盖培养皿[/size][/font][font='times new roman'][size=16px] 80%[/size][/font][font='times new roman'][size=16px]以上时,收集细胞培养基。将细胞培养基于[/size][/font][font='times new roman'][size=16px] 300 g [/size][/font][font='times new roman'][size=16px]离心[/size][/font][font='times new roman'][size=16px] 10 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]2000 g[/size][/font][font='times new roman'][size=16px]离心[/size][/font][font='times new roman'][size=16px] 20 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]10000 g [/size][/font][font='times new roman'][size=16px]离心[/size][/font][font='times new roman'][size=16px] 30 min[/size][/font][font='times new roman'][size=16px],并用[/size][/font][font='times new roman'][size=16px] 0.22 μm [/size][/font][font='times new roman'][size=16px]过滤器去除细胞、细胞碎片和较大的细胞外囊泡,所得上清液即为待测细胞培养基样品。[/size][/font][font='times new roman'][size=16px]4 [/size][/font][font='times new roman'][size=16px]外泌体的分离[/size][/font][font='times new roman'][size=16px]取[/size][/font][font='times new roman'][size=16px] 4 mL [/size][/font][font='times new roman'][size=16px]上述细胞培养基分离过滤,上清液加入[/size][/font][font='times new roman'][size=16px] 1 mL [/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]响应聚合物[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]抗体复活物溶液,[/size][/font][font='times new roman'][size=16px]4°C [/size][/font][font='times new roman'][size=16px]下温和振摇[/size][/font][font='times new roman'][size=16px] 1 h[/size][/font][font='times new roman'][size=16px]。然后加入[/size][/font][font='times new roman'][size=16px] 1%[/size][/font][font='times new roman'][size=16px]氨水调节[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]至[/size][/font][font='times new roman'][size=16px] 7.5[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]3000 r/min [/size][/font][font='times new roman'][size=16px]离心[/size][/font][font='times new roman'][size=16px] 10 min[/size][/font][font='times new roman'][size=16px],去除上清,得到捕获有外泌体的[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]响应聚合物沉淀。向沉淀中加入[/size][/font][font='times new roman'][size=16px] 400 μL [/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px] PBS [/size][/font][font='times new roman'][size=16px]缓冲液,重复洗涤[/size][/font][font='times new roman'][size=16px] 3 [/size][/font][font='times new roman'][size=16px]次,加入[/size][/font][font='times new roman'][size=16px] 5 mg [/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px] α-[/size][/font][font='times new roman'][size=16px]环糊精于[/size][/font][font='times new roman'][size=16px] 4°C [/size][/font][font='times new roman'][size=16px]孵育[/size][/font][font='times new roman'][size=16px] 1 h[/size][/font][font='times new roman'][size=16px],以取代[/size][/font][font='times new roman'][size=16px] β-[/size][/font][font='times new roman'][size=16px]环糊精抗体[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]外泌体复合物。调节[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]至[/size][/font][font='times new roman'][size=16px] 7.5[/size][/font][font='times new roman'][size=16px],离心取上清,[/size][/font][font='times new roman'][size=16px]4°C [/size][/font][font='times new roman'][size=16px]保存备用。[/size][/font][font='times new roman'][size=16px]5 [/size][/font][font='times new roman'][size=16px]外泌体蛋白质提取和[/size][/font][font='times new roman'][size=16px] Western Blot[/size][/font][font='times new roman'][size=16px]取富集有外泌体的样品溶液,加入等体积的[/size][/font][font='times new roman'][size=16px] RIPA [/size][/font][font='times new roman'][size=16px]裂解液(含有[/size][/font][font='times new roman'][size=16px] 1%[/size][/font][font='times new roman'][size=16px]的蛋白酶抑制剂),每隔[/size][/font][font='times new roman'][size=16px] 5 min [/size][/font][font='times new roman'][size=16px]振摇一次,冰浴下裂解[/size][/font][font='times new roman'][size=16px] 30 min[/size][/font][font='times new roman'][size=16px]。然后加入[/size][/font][font='times new roman'][size=16px] Loading buffer[/size][/font][font='times new roman'][size=16px],煮沸[/size][/font][font='times new roman'][size=16px] 5 min[/size][/font][font='times new roman'][size=16px],将裂解的蛋白质样品置于[/size][/font][font='times new roman'][size=16px]-20°C [/size][/font][font='times new roman'][size=16px]冰箱中保存备用。[/size][/font][font='times new roman'][size=16px]SDS-PAGE [/size][/font][font='times new roman'][size=16px]电泳:[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]1[/size][/font][font='times new roman'][size=16px])实验试剂的配制[/size][/font][font='times new roman'][size=16px]1×[/size][/font][font='times new roman'][size=16px]电泳缓冲液:称取[/size][/font][font='times new roman'][size=16px] 14.4 g [/size][/font][font='times new roman'][size=16px]甘氨酸,[/size][/font][font='times new roman'][size=16px]3 g Tris[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]1 g SDS[/size][/font][font='times new roman'][size=16px],加入去离子水,搅拌溶解,定容至[/size][/font][font='times new roman'][size=16px] 1000 mL[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]1×[/size][/font][font='times new roman'][size=16px]转膜液:称取[/size][/font][font='times new roman'][size=16px] 14.4 g [/size][/font][font='times new roman'][size=16px]甘氨酸,[/size][/font][font='times new roman'][size=16px]3 g Tris[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]150 mL [/size][/font][font='times new roman'][size=16px]甲醇,加入去离子水,搅拌溶解,定容至[/size][/font][font='times new roman'][size=16px] 1000 mL[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]2[/size][/font][font='times new roman'][size=16px])丙烯酰胺凝胶的配制与加样[/size][/font][font='times new roman'][size=16px]将制胶玻璃板、制胶器和电泳槽清洗干净,待其干燥后固定,待用;配制[/size][/font][font='times new roman'][size=16px] 10%[/size][/font][font='times new roman'][size=16px]的下层分离胶:向烧杯中依次加入[/size][/font][font='times new roman'][size=16px] 2.7 mL [/size][/font][font='times new roman'][size=16px]去离子水,[/size][/font][font='times new roman'][size=16px]3.3 mL 30%[/size][/font][font='times new roman'][size=16px]丙烯酰胺,[/size][/font][font='times new roman'][size=16px]3.8 mL Tris-HCl[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]0.1 mL 10% SDS[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]0.1 mL 10% AP[/size][/font][font='times new roman'][size=16px],搅拌均匀后加入[/size][/font][font='times new roman'][size=16px] 0.004 mL TEMED[/size][/font][font='times new roman'][size=16px]。将上述溶液混合均匀后,小心倒入玻璃板缝隙,注意避免出现气泡,灌入分离胶后在上面加入[/size][/font][font='times new roman'][size=16px] 1-2 mL[/size][/font][font='times new roman'][size=16px]超纯水,室温下静置[/size][/font][font='times new roman'][size=16px] 40 min[/size][/font][font='times new roman'][size=16px]。待其凝固后去除上层水,配置[/size][/font][font='times new roman'][size=16px] 5%[/size][/font][font='times new roman'][size=16px]浓缩胶。方法如下:向烧杯中依次加入[/size][/font][font='times new roman'][size=16px] 2.7 mL [/size][/font][font='times new roman'][size=16px]去离子水,[/size][/font][font='times new roman'][size=16px]0.67 mL 30%[/size][/font][font='times new roman'][size=16px]丙烯酰胺,[/size][/font][font='times new roman'][size=16px]0.5 mL Tris-HCl[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]0.04 mL 10%SDS[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]0.04 mL 10% AP[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]0.004 mL TEMED[/size][/font][font='times new roman'][size=16px],混合均匀后倒入玻璃板,立即插入梳子。待上层胶凝固后小心取出玻璃板上的梳子,注意不要破坏加样孔,向电泳槽中加入足量电泳液,用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸取[/size][/font][font='times new roman'][size=16px] 10 μL [/size][/font][font='times new roman'][size=16px]处理后的样品至加样孔中,准备电泳。[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]3[/size][/font][font='times new roman'][size=16px])电泳与转模[/size][/font][font='times new roman'][size=16px]连接电源,设置初始电压为[/size][/font][font='times new roman'][size=16px] 80 V[/size][/font][font='times new roman'][size=16px],当样品跑至浓缩胶与分离胶界面时将电压调至[/size][/font][font='times new roman'][size=16px]120 V[/size][/font][font='times new roman'][size=16px],直至样品跑至分离胶的底部,停止电泳。待电泳完成后,拆除玻璃板,取下凝胶并转移至转膜夹上,按顺序组装好转膜夹后放入转膜槽中,加入配好的转膜液,冰浴下[/size][/font][font='times new roman'][size=16px] 250 mA [/size][/font][font='times new roman'][size=16px]转膜[/size][/font][font='times new roman'][size=16px] 1 h[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]([/size][/font][font='times new roman'][size=16px]4[/size][/font][font='times new roman'][size=16px])封闭、抗体孵育及显色[/size][/font][font='times new roman'][size=16px]转膜结束后,将膜放入含[/size][/font][font='times new roman'][size=16px]5% BSA[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]TBST[/size][/font][font='times new roman'][size=16px]溶液中室温下封闭[/size][/font][font='times new roman'][size=16px]1 h[/size][/font][font='times new roman'][size=16px]。用配好的一抗[/size][/font][font='times new roman'][size=16px]4°C[/size][/font][font='times new roman'][size=16px]孵育过夜,[/size][/font][font='times new roman'][size=16px]TBST [/size][/font][font='times new roman'][size=16px]溶液清洗[/size][/font][font='times new roman'][size=16px] 3 [/size][/font][font='times new roman'][size=16px]次,每次[/size][/font][font='times new roman'][size=16px] 10 min[/size][/font][font='times new roman'][size=16px],用配好的二抗室温孵育[/size][/font][font='times new roman'][size=16px] 1 h[/size][/font][font='times new roman'][size=16px],再次用[/size][/font][font='times new roman'][size=16px] TBST[/size][/font][font='times new roman'][size=16px]溶液清洗[/size][/font][font='times new roman'][size=16px] 3 [/size][/font][font='times new roman'][size=16px]次,每次[/size][/font][font='times new roman'][size=16px] 10 min[/size][/font][font='times new roman'][size=16px]。[/size][/font][font='times new roman'][size=16px]将漂洗后的膜与[/size][/font][font='times new roman'][size=16px] ECL [/size][/font][font='times new roman'][size=16px]发光液孵育,置于凝胶成像仪的托盘中,调整合适位置,用[/size][/font][font='times new roman'][size=16px]BIO-RAD [/size][/font][font='times new roman'][size=16px]凝胶成像仪显影。[/size][/font][font='times new roman'][size=16px]5 SDS-PAGE [/size][/font][font='times new roman'][size=16px]与免疫印迹分析[/size][/font][font='times new roman'][size=16px]首先将细胞培养液、[/size][/font][font='times new roman'][size=16px]pH [/size][/font][font='times new roman'][size=16px]响应聚合物[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]抗体复合物分离外泌体后的上清液、一次洗涤、[/size][/font][font='times new roman'][size=16px]二次洗涤、三次洗涤上清液以及外泌体洗脱液分别裂解后,用[/size][/font][font='times new roman'][size=16px] 10%[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px] SDS-PAGE [/size][/font][font='times new roman'][size=16px]分离,[/size][/font][font='times new roman'][size=16px]待样品电泳至分离胶底部时,取出分离胶用考马斯亮蓝染色[/size][/font][font='times new roman'][size=16px] 1 h[/size][/font][font='times new roman'][size=16px],蒸馏水洗涤[/size][/font][font='times new roman'][size=16px] 3 [/size][/font][font='times new roman'][size=16px]次后用[/size][/font][font='times new roman'][size=16px]脱色液脱色,结果如图[/size][/font][font='times new roman'][size=16px] 3-2 [/size][/font][font='times new roman'][size=16px]所示。通过对比图中[/size][/font][font='times new roman'][size=16px] Elute [/size][/font][font='times new roman'][size=16px]泳道及其它泳道可以明显看出分[/size][/font][font='times new roman'][size=16px]离后的外泌体样品([/size][/font][font='times new roman'][size=16px]Elute[/size][/font][font='times new roman'][size=16px])在[/size][/font][font='times new roman'][size=16px] 70 kDa [/size][/font][font='times new roman'][size=16px]处大量杂蛋白质的含量明显降低。[/size][/font][img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009031730326990_4791_3890113_3.png[/img][font='times new roman'][size=16px]将外泌体标志性蛋白质[/size][/font][font='times new roman'][size=16px] CD9[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]CD81[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]TSG101[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]HSC70 [/size][/font][font='times new roman'][size=16px]抗体均按[/size][/font][font='times new roman'][size=16px] 1:500 [/size][/font][font='times new roman'][size=16px]稀释,[/size][/font][font='times new roman'][size=16px]HRP-[/size][/font][font='times new roman'][size=16px]羊抗兔抗体以[/size][/font][font='times new roman'][size=16px] 1:10000 [/size][/font][font='times new roman'][size=16px]稀释后用于免疫印迹试验。实验结果如图[/size][/font][font='times new roman'][size=16px] 3-3 [/size][/font][font='times new roman'][size=16px]所示,外泌体标志[/size][/font][font='times new roman'][size=16px]性蛋白质[/size][/font][font='times new roman'][size=16px] CD9[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]CD81[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]TSG101 [/size][/font][font='times new roman'][size=16px]和[/size][/font][font='times new roman'][size=16px] HSC70 [/size][/font][font='times new roman'][size=16px]的含量均明显高于分离富集前及分离后上清[/size][/font][font='times new roman'][size=16px]液中的含量,证明外泌体已被成功地分离。[/size][/font][img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009031730329705_8638_3890113_3.png[/img][font='times new roman'][size=16px]6 [/size][/font][font='times new roman'][size=16px]外泌体回收率测试[/size][/font][font='times new roman'][size=16px]取[/size][/font][font='times new roman'][size=16px] 50 mL [/size][/font][font='times new roman'][size=16px]的细胞培养基样品,在[/size][/font][font='times new roman'][size=16px] 100,000 g [/size][/font][font='times new roman'][size=16px]超速离心[/size][/font][font='times new roman'][size=16px] 70 min [/size][/font][font='times new roman'][size=16px]后,所得外泌体用[/size][/font][font='times new roman'][size=16px] 200 μL[/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px] PBS [/size][/font][font='times new roman'][size=16px]重悬,取[/size][/font][font='times new roman'][size=16px] 10 μL [/size][/font][font='times new roman'][size=16px]加入[/size][/font][font='times new roman'][size=16px] 1 mL PBS [/size][/font][font='times new roman'][size=16px]稀释,作为外泌体回收率测试标准品。[/size][/font][font='times new roman'][size=16px]取[/size][/font][font='times new roman'][size=16px] 1 mL [/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]响应聚合物[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]抗体复合物溶液加入[/size][/font][font='times new roman'][size=16px] 10 μL [/size][/font][font='times new roman'][size=16px]外泌体回收率测试标准品,[/size][/font][font='times new roman'][size=16px]在[/size][/font][font='times new roman'][size=16px] 4°C [/size][/font][font='times new roman'][size=16px]下分别孵育[/size][/font][font='times new roman'][size=16px] 5 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]10 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]15 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]30 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]60 min[/size][/font][font='times new roman'][size=16px],调节[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]至[/size][/font][font='times new roman'][size=16px] 7.5 [/size][/font][font='times new roman'][size=16px]使聚合物[/size][/font][font='times new roman'][size=16px]析出后离心,[/size][/font][font='times new roman'][size=16px]400 μL PBS [/size][/font][font='times new roman'][size=16px]洗涤三次,调节[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]至[/size][/font][font='times new roman'][size=16px] 6.5 [/size][/font][font='times new roman'][size=16px]使聚合物溶解后加入[/size][/font][font='times new roman'][size=16px] α-[/size][/font][font='times new roman'][size=16px]环糊精取代[/size][/font][font='times new roman'][size=16px]后孵育[/size][/font][font='times new roman'][size=16px] 1 h[/size][/font][font='times new roman'][size=16px],再次调节[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]至[/size][/font][font='times new roman'][size=16px] 7.5 [/size][/font][font='times new roman'][size=16px]使聚合物析出后离心,[/size][/font][font='times new roman'][size=16px]NTA [/size][/font][font='times new roman'][size=16px]法测试上清中外泌体的浓度,[/size][/font][font='times new roman'][size=16px]并计算外泌体标准品的回收率。[/size][/font][font='times new roman'][size=16px]外泌体回收率测试标准品浓度为[/size][/font][font='times new roman'][size=16px] 2.86e+08±3.27e+06 particles/mL[/size][/font][font='times new roman'][size=16px],外泌体颗粒直径[/size][/font][font='times new roman'][size=16px]主要集中在[/size][/font][font='times new roman'][size=16px] 100-200 nm[/size][/font][font='times new roman'][size=16px](图[/size][/font][font='times new roman'][size=16px] 3-4[/size][/font][font='times new roman'][size=16px])。当[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]响应聚合物[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]抗体复合物材料分别与外泌体标准[/size][/font][font='times new roman'][size=16px]品孵育[/size][/font][font='times new roman'][size=16px] 5 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]10 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]15 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]30 min[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]60 min [/size][/font][font='times new roman'][size=16px]后,用[/size][/font][font='times new roman'][size=16px] NTA [/size][/font][font='times new roman'][size=16px]法测试分离后外泌体的浓[/size][/font][font='times new roman'][size=16px]度。如图[/size][/font][font='times new roman'][size=16px] 3-5 [/size][/font][font='times new roman'][size=16px]所示,当孵育时间为[/size][/font][font='times new roman'][size=16px] 30 min [/size][/font][font='times new roman'][size=16px]时外泌体回收率即可达[/size][/font][font='times new roman'][size=16px] 80.4±2.9%[/size][/font][font='times new roman'][size=16px],孵育时间[/size][/font][font='times new roman'][size=16px]继续增加至[/size][/font][font='times new roman'][size=16px] 60 min[/size][/font][font='times new roman'][size=16px],外泌体回收率可达[/size][/font][font='times new roman'][size=16px] 87.0±4.6%[/size][/font][font='times new roman'][size=16px]。[/size][/font][img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009031730330451_3400_3890113_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009031730332967_7620_3890113_3.png[/img][font='times new roman'][size=16px]7 [/size][/font][font='times new roman'][size=16px]血清样品中外泌体的分离[/size][/font][font='times new roman'][size=16px]进一步将[/size][/font][font='times new roman'][size=16px] pH [/size][/font][font='times new roman'][size=16px]响应聚合物[/size][/font][font='times new roman'][size=16px]-[/size][/font][font='times new roman'][size=16px]抗体复合物材料用于人血清中外泌体的分离。取[/size][/font][font='times new roman'][size=16px] 1 mL [/size][/font][font='times new roman'][size=16px]的[/size][/font][font='times new roman'][size=16px]血清样品用[/size][/font][font='times new roman'][size=16px] 0.22 μm [/size][/font][font='times new roman'][size=16px]滤膜过滤,按上述培养基样品的分离法获得血清中外泌体。[/size][/font][font='times new roman'][size=16px]WesternBlot [/size][/font][font='times new roman'][size=16px]结果如图[/size][/font][font='times new roman'][size=16px] 3-6 [/size][/font][font='times new roman'][size=16px]所示,经分离后外泌体标志性蛋白质[/size][/font][font='times new roman'][size=16px] CD9[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]CD81[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]TSG101[/size][/font][font='times new roman'][size=16px]、[/size][/font][font='times new roman'][size=16px]HSC70[/size][/font][font='times new roman'][size=16px]含量均明显高于分离前及分离后上清液中的含量,证明了该方法在血清外泌体的分离中同样取得了较好效果。[/size][/font][img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009031730333478_7214_3890113_3.png[/img]
一直存在一个争论:带紫外检测器的液相是否可以代替紫外分光光度计。最近查了一写资料,对两者进行比较:1 从光学精密度来比较:分光光度计的高,而紫外检测器的低,具体低多少,俺还想再做进一步的试验。2 从信号稳定性来比较:分光光度计的低,紫外检测器的高,具体相差多少,也要进行数据比较。3 从光学能量角度来比较:分光光度计的高,而紫外检测器的低。 也许还有很多别的指标可以比较,有待大家一起讨论。
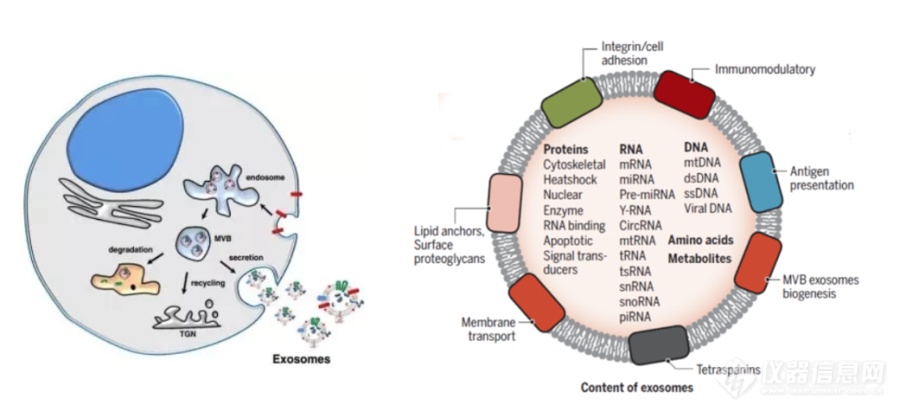
[align=center][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]富集及在肿瘤诊断中的作用[/size][/font][/align]外泌体是直径30-200 nm,由细胞内陷产生的具有磷脂双分子层结构的细胞外小囊泡,是细胞间通讯的重要介质。此外,由于其易于获取、高度稳定且在体液中广泛分布,外泌体已成为液体活检中最有前途的生物标志物[font='宋体']。[/font][align=left][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的生发与分布[/size][/font][/align]外泌体是具有磷脂双分子层结构的细胞外小囊泡,它携带原始母细胞重要的物质信息,能够反应原始细胞的一些重要信息。随着研究的深入,已有研究证实外泌体是通过细胞内陷产生的胞外囊泡,如图1-1所示,它是起源于细胞内吞系统中的多囊泡内体,通过出芽、内陷、多泡体形成和分泌等形成的一种具有磷脂双分子层结构的小泡,形态呈球形、扁形或杯状小体,直径为30-200 nm。此外,外泌体的分布非常广泛,几乎分布在所有的体液中,如血液,尿液,乳汁,汗液等。携带活性生物分子(蛋白质、核酸和脂质等)和他们的母细胞有相似的特征,这可能适用于正常细胞和病理细胞的鉴别。特别是,外泌体膜蛋白的水平与癌症的动态密切相关,从而为癌症诊断和治疗提供了新的机会预后。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310171529195086_7813_6197418_3.png[/img][align=center][font='黑体'][size=14px]图1.[/size][/font][font='黑体'][size=14px]1 外[/size][/font][font='黑体'][size=14px]泌[/size][/font][font='黑体'][size=14px]体的生发与组成[/size][/font][/align][align=left][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的通讯作用[/size][/font][/align]外泌体含有多种生物活性物质,这些被包裹的生物大分子可以在靶细胞中发挥一系列作用,是细胞间接通讯的重要媒介。外泌体与靶细胞间的信息传递主要通过三条途径实现:受体-配体相互作用;质膜直接融合;吞噬作用内吞。外泌体的生物学功能包括物质传递、信息交流、细胞增殖分化、血管生成、免疫调节等,在肿瘤发生发展、侵袭、转移、预后等过程中起重要的调控作用。肿瘤细胞较正常细胞分泌更多的外泌体,来源母细胞不同,所分泌的外泌体量与成分也不同。其次,由于其具有磷脂双分子层结构,生物学相对稳定,难于降解。外泌体的一个关键功能是将其内含物从供体细胞转运到受体细胞,使受体细胞的基因和表型修饰[font='宋体']。[/font][align=left][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的富集方法[/size][/font][/align]由于外泌体丰度相对较低且大分子干扰,高质量外泌体的分离仍然具有挑战性。基于不同的分离机制,已经提了各种分离方法。作为金标准的超速离心法在外泌体的分离中使用最广泛。其他策略,如免疫亲和的富集方法,微流控芯片等,这些方法大多依赖于抗体和适配体。分离的外泌体的质量和纯度受限于外泌体表面抗原等活性分子的缺失,失活和降解,并且不适合大规模捕获应用。[align=left][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体与肿瘤[/size][/font][/align]肿瘤发病机制复杂,早期诊断困难,病程进展快,是严重威胁人类生命和社会发展的重大公共卫生问题。外泌体是由细胞分泌产生的纳米级囊泡,在肿瘤的发生发展、诊断和治疗方面发挥着重要作用。外泌体携带多种肿瘤相关因子,可以作为治疗靶点。外泌体以其天然的物质转运特性、相对较小的分子结构、优良的生物相容性及免疫原性低可避免被单核吞噬系统吞噬,可作为优良的药物载体,允许它们穿过生理病理屏障将其携带的物质递送到下面的组织。基于这些特性,越来越多的人关注外泌体在疾病特别是靶向治疗领域的研究[font='宋体']。[/font]
[size=3][b]DAD检测器可以分离手性异构体吗[/b][/size]最近做一个化学药,发现其有手性异构体,老板要求检测是否存在,又不给专门买手性柱。原来都是用DAD检测器判断峰的纯度,不知道能不能分辨出手性异构体?如果不行,还有什么其他的方法吗?
分析者对待测离子应有一些一般信息,首先应了解待测化合物的分子结构和性质以及样品的基体情况,如无机还是有机离子,离子的电荷数,是酸还是碱,亲水还是疏水,是否为表面活性化合物等。待测离子的疏水性和水合能是决定选用何种分离方式的主要因素。水合能高和疏水性弱的离子,如Cl-或K+,最好用HPIC分离。水合能低和疏水性强的离子,如高氯酸(ClO4-)或四丁基铵,最好用亲水性强的离子交换分离柱或MPIC分离。有一定疏水性也有明显水合能的pKa值在1与7之间的离子,如乙酸盐或丙酸盐,最好用HPICE分离。有些离子,既可用阴离子交换分离,也可用阳离子交换分离,如氨基酸,生物碱和过渡金属等。很多离子可用多种检测方式。例如测定过渡金属时,可用单柱法直接用电导或脉冲安培检测器,也可用柱后衍生反应,使金属离子与PAR或其它显色剂作用,再用UV/VIS检测。一般的规律是:对无紫外或可见吸收以及强离解的酸和碱,最好用电导检测器;具有电化学活性和弱离解的离子,最好用安培检测器;对离子本身或通过柱后反应后生成的络合物在紫外可见有吸收或能产生荧光的离子和化合物,最好用UV/VIS或荧光检测器。若对所要解决的问题有几种方案可选择,分析方案的确定主要由基体的类型、选择性、过程的复杂程度以及是否经济来决定。 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱填料的发展推动了[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]应用的快速发展,对多种离子分析方法的开发提供了多种可能性。特别应提出的是在pH 0-14的水溶液和100%有机溶剂(反相高效液相色谱用有机溶剂)中稳定的亲水性高效高容量柱填料的商品化,使得离子交换分离的应用范围更加扩大。常见的在水溶液中以离子形态存在的离子,包括无机和有机离子,以弱酸的盐(Na2CO3/NaHCO3, KOH、NaOH)或强酸(H2SO4、甲基磺酸、HNO3、HCl)为流动相,阴离子交换或阳离子交换分离,电导检测,已是成熟的方法,有成熟的色谱条件可参照。对近中性的水可溶的有机“大”分子(相对常见的小分子而言),若待测化合物为弱酸,则由于弱酸在强碱性溶液中会以阴离子形态存在,因此选用较强的碱为流动相,阴离子交换分离;若待测化合物为弱碱,则由于在强酸性溶液中会以阳离子形态存在,选用较强的酸作流动相,阳离子交换分离;若待测离子的疏水性较强,由于与固定相之间的吸附作用而使保留时间较长或峰拖尾,则可在流动相中加入适量有机溶剂,减弱吸附,缩短保留时间、改善峰形和选择性。对该类化合物的分离也可选用离子对色谱分离,但流动相中一般含有较复杂的离子对试剂。此外,对弱保留离子可选用高容量柱和弱淋洗液以增强保留,对强保留离子则反之。[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]中常用的两种主要检测器:电化学检测器(包括电导和安培)和光学检测器。在水溶液中以离子形态存在的离子,即较强的酸或碱,应选用电导检测。具有对紫外或可见光有吸收基团或经柱后衍生反应后(IC中较少用柱前衍生)生成有吸光基团的化合物,选用光学检测器。具有在外加电压下可发生氧化或还原反应基团的化合物,可选用直流安培或脉冲安培检测。对一些复杂样品,为了一次进样得到较多的信息,可将两种或三种检测器串联使用。
[size=3]分析者对待测离子应有一些一般信息,首先应了解待测化合物的分子结构和性质以及样品的基体情况,如无机还是有机离子,离子的电荷数,是酸还是碱,亲水还是疏水,是否为表面活性化合物等。待测离子的疏水性和水合能是决定选用何种分离方式的主要因素。水合能高和疏水性弱的离子,如Cl-或K+,最好用 HPIC分离。水合能低和疏水性强的离子,如高氯酸(ClO4-)或四丁基铵,最好用亲水性强的离子交换分离柱或MPIC分离。有一定疏水性也有明显水合能的pKa值在1与7之间的离子,如乙酸盐或丙酸盐,最好用HPICE分离。有些离子,既可用阴离子交换分离,也可用阳离子交换分离,如氨基酸,生物碱和过渡金属等。 很多离子可用多种检测方式。例如测定过渡金属时,可用单柱法直接用电导或脉冲安培检测器,也可用柱后衍生反应,使金属离子与 PAR或其它显色剂作用,再用UV/VIS检测。一般的规律是:对无紫外或可见吸收以及强离解的酸和碱,最好用电导检测器 具有电化学活性和弱离解的离子,最好用安培检测器 对离子本身或通过柱后反应后生成的络合物在紫外可见有吸收或能产生荧光的离子和化合物,最好用UV/VIS或荧光检测器。若对所要解决的问题有几种方案可选择,分析方案的确定主要由基体的类型、选择性、过程的复杂程度以及是否经济来决定。表1和2总结了对各种类型离子可选用的分离方式和检测方式。 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱填料的发展推动了[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]应用的快速发展,对多种离子分析方法的开发提供了多种可能性。特别应提出的是在pH 0-14的水溶液和100%有机溶剂(反相高效液相色谱用有机溶剂)中稳定的亲水性高效高容量柱填料的商品化,使得离子交换分离的应用范围更加扩大。常见的在水溶液中以离子形态存在的离子,包括无机和有机离子,以弱酸的盐(Na2CO3/NaHCO3, KOH、NaOH)或强酸(H2SO4、甲基磺酸、HNO3、HCl)为流动相,阴离子交换或阳离子交换分离,电导检测,已是成熟的方法,有成熟的色谱条件可参照。对近中性的水可溶的有机“大”分子(相对常见的小分子而言),若待测化合物为弱酸,则由于弱酸在强碱性溶液中会以阴离子形态存在,因此选用较强的碱为流动相,阴离子交换分离 若待测化合物为弱碱,则由于在强酸性溶液中会以阳离子形态存在,选用较强的酸作流动相,阳离子交换分离 若待测离子的疏水性较强,由于与固定相之间的吸附作用而使保留时间较长或峰拖尾,则可在流动相中加入适量有机溶剂,减弱吸附,缩短保留时间、改善峰形和选择性。对该类化合物的分离也可选用离子对色谱分离,但流动相中一般含有较复杂的离子对试剂。此外,对弱保留离子可选用高容量柱和弱淋洗液以增强保留,对强保留离子则反之。在水溶液中以离子形态存在的离子,即较强的酸或碱,应选用电导检测。具有对紫外或可见光有吸收基团或经柱后衍生反应后(IC中较少用柱前衍生)生成有吸光基团的化合物,选用光学检测器。具有在外加电压下可发生氧化或还原反应基团的化合物,可选用直流安培或脉冲安培检测。对一些复杂样品,为了一次进样得到较多的信息,可将两种或三种检测器串联使用。[/size]
[b][font=宋体]一、纳米流式检测技术的原理[/font][/b][font=宋体] [/font][font=宋体][font=宋体]纳米流式检测技术的原理主要基于纳米流式检测仪([/font][font=Calibri]Flow NanoAnalyzer[/font][font=宋体],[/font][font=Calibri]FNA[/font][font=宋体])。这种技术能够覆盖传统流式细胞仪在[/font][font=Calibri]200[/font][font=宋体]纳米以下粒径检测的盲区,包括纳米颗粒以及亚细胞结构、细菌、病毒、外泌体等天然生物纳米颗粒的表征。其检测原理是利用流体聚焦和激光聚焦技术,减小探测区体积、延长被测颗粒穿越激光探测区的时间、降低散射背景、提高激光功率等措施,实现[/font][font=Calibri]200[/font][font=宋体]纳米以下颗粒的检测。[/font][/font][font=宋体] [/font][font=宋体]纳米流式检测技术的工作原理是:当被测颗粒通过激光检测区时,颗粒被激光照射产生散射光和荧光信号。通过一系列光学元件收集并分离散射光和各波段的荧光信号,经过电学系统中的信号转换和数据处理,获得样品的各种理化信息。其中,散射光信号可以用来表征颗粒的大小和粒度,染色后的荧光可以用来表征细胞内特定蛋白的表达水平、细胞的生理状态和分裂周期等。通过对检测到的颗粒进行计数,可以实现颗粒浓度的无标样定量检测。[/font][font=宋体] [/font][font=宋体]总之,纳米流式检测技术结合了流式细胞术和纳米技术,具有高灵敏度、高分辨率和高通量等优点,为生物医学研究提供了新的工具,有助于深入研究和了解生物纳米颗粒的特性和功能。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]二、纳米流式检测技术的应用[/font][/b][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]1[/font][font=宋体])肿瘤诊断[/font][/font][font=宋体] [/font][font=宋体][font=宋体]纳米流式检测技术可以对肿瘤细胞进行快速、敏感的检测,并且可以在单细胞水平上进行分析,从而实现早期肿瘤诊断。同时,纳米流式检测还可以检测循环肿瘤细胞([/font][font=Calibri]CTC[/font][font=宋体]),这是一种正在被广泛研究的肿瘤诊断手段,可以极大地提升肿瘤治疗成功的概率。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]2[/font][font=宋体])细胞免疫学[/font][/font][font=宋体] [/font][font=宋体]纳米流式检测技术可以通过检测细胞表面和内部的特定蛋白质、抗原或基因,实现对细胞的免疫学分析。这种方法可以在单个细胞水平上对细胞进行分类和排序,同时也可以在细胞群体中进行比较分析。这对于了解免疫系统的正常和异常状态,以及研究免疫治疗等方面都有着重要的意义。[/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]3[/font][font=宋体])病毒学研究[/font][/font][font=宋体] [/font][font=宋体][font=宋体]病毒是一种纳米尺度的微生物,纳米流式检测技术可以用于病毒的检测和计数,包括流感病毒、[/font][font=Calibri]HIV[/font][font=宋体]病毒、疱疹病毒等。这种技术还可以用于病毒分型和病毒载量测定等方面。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]4[/font][font=宋体])生物分子检测[/font][/font][font=宋体] [/font][font=宋体]纳米流式检测技术可以用于生物分子的检测,包括蛋白质、核酸、糖类等。这种技术可以用于生物标志物的检测和诊断,以及生物分子相互作用的研究。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]三、总结[/b][/font][font=宋体] [/font][font=宋体]纳米流式检测技术是一种应用前景广阔的单细胞分析技术。它具有高灵敏度、高通量、高精度的特点,能够针对不同细胞类型和样品进行分析和检测。随着技术不断发展和完善,纳米流式检测技术将有望在医疗诊断、新药开发等领域得到更广泛的应用。[/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以查看义翘神州[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测服务[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=Calibri] [/font]
分析者对待测离子应有一些一般信息,首先应了解待测化合物的分子结构和性质以及样品的基体情况,如无机还是有机离子,离子的电荷数,是酸还是碱,亲水还是疏水,是否为表面活性化合物等。待测离子的疏水性和水合能是决定选用何种分离方式的主要因素。水合能高和疏水性弱的离子,如Cl-或K+,最好用HPIC分离。水合能低和疏水性强的离子,如高氯酸(ClO4-)或四丁基铵,最好用亲水性强的离子交换分离柱或MPIC分离。有一定疏水性也有明显水合能的pKa值在1与7之间的离子,如乙酸盐或丙酸盐,最好用HPICE分离。有些离子,既可用阴离子交换分离,也可用阳离子交换分离,如氨基酸,生物碱和过渡金属等。 很多离子可用多种检测方式。例如测定过渡金属时,可用单柱法直接用电导或脉冲安培检测器,也可用柱后衍生反应,使金属离子与PAR或其它显色剂作用,再用UV/VIS检测。一般的规律是:对无紫外或可见吸收以及强离解的酸和碱,最好用电导检测器;具有电化学活性和弱离解的离子,最好用安培检测器;对离子本身或通过柱后反应后生成的络合物在紫外可见有吸收或能产生荧光的离子和化合物,最好用UV/VIS或荧光检测器。若对所要解决的问题有几种方案可选择,分析方案的确定主要由基体的类型、选择性、过程的复杂程度以及是否经济来决定。表1和2总结了对各种类型离子可选用的分离方式和检测方式。 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱填料的发展推动了[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]应用的快速发展,对多种离子分析方法的开发提供了多种可能性。特别应提出的是在pH 0-14的水溶液和100%有机溶剂(反相高效液相色谱用有机溶剂)中稳定的亲水性高效高容量柱填料的商品化,使得离子交换分离的应用范围更加扩大。常见的在水溶液中以离子形态存在的离子,包括无机和有机离子,以弱酸的盐(Na2CO3/NaHCO3, KOH、NaOH)或强酸(H2SO4、甲基磺酸、HNO3、HCl)为流动相,阴离子交换或阳离子交换分离,电导检测,已是成熟的方法,有成熟的色谱条件可参照。对近中性的水可溶的有机“大”分子(相对常见的小分子而言),若待测化合物为弱酸,则由于弱酸在强碱性溶液中会以阴离子形态存在,因此选用较强的碱为流动相,阴离子交换分离;若待测化合物为弱碱,则由于在强酸性溶液中会以阳离子形态存在,选用较强的酸作流动相,阳离子交换分离;若待测离子的疏水性较强,由于与固定相之间的吸附作用而使保留时间较长或峰拖尾,则可在流动相中加入适量有机溶剂,减弱吸附,缩短保留时间、改善峰形和选择性。对该类化合物的分离也可选用离子对色谱分离,但流动相中一般含有较复杂的离子对试剂。此外,对弱保留离子可选用高容量柱和弱淋洗液以增强保留,对强保留离子则反之。表1,2列出了[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]中常用的两种主要检测器:电化学检测器(包括电导和安培)和光学检测器。在水溶液中以离子形态存在的离子,即较强的酸或碱,应选用电导检测。具有对紫外或可见光有吸收基团或经柱后衍生反应后(IC中较少用柱前衍生)生成有吸光基团的化合物,选用光学检测器。具有在外加电压下可发生氧化或还原反应基团的化合物,可选用直流安培或脉冲安培检测。对一些复杂样品,为了一次进样得到较多的信息,可将两种或三种检测器串联使用。
各位老师好,液相色谱的分离效果主要在于色谱柱,可是为什么在不同的检测器上看两个相同的峰分离度会不同呢?如看紫外两个峰的分离度只有1.2,而ELSD上两个峰的分离度却达到1.6以上。这是为什么呢?
[b][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]分离方式和检测方式的选择[/b]分析者对待测离子应有一些一般信息,首先应了解待测化合物的分子结构和性质以及样品的基体情况,如无机还是有机离子,离子的电荷数,是酸还是碱,亲水还是疏水,是否为表面活性化合物等。待测离子的疏水性和水合能是决定选用何种分离方式的主要因素。水合能高和疏水性弱的离子,如Cl-或K+,最好用HPIC分离。水合能低和疏水性强的离子,如高氯酸(ClO4-)或四丁基铵,最好用亲水性强的离子交换分离柱或MPIC分离。有一定疏水性也有明显水合能的pKa值在1与7之间的离子,如乙酸盐或丙酸盐,最好用HPICE分离。有些离子,既可用阴离子交换分离,也可用阳离子交换分离,如氨基酸,生物碱和过渡金属等。 很多离子可用多种检测方式。例如测定过渡金属时,可用单柱法直接用电导或脉冲安培检测器,也可用柱后衍生反应,使金属离子与PAR或其它显色剂作用,再用UV/VIS检测。一般的规律是:对无紫外或可见吸收以及强离解的酸和碱,最好用电导检测器;具有电化学活性和弱离解的离子,最好用安培检测器;对离子本身或通过柱后反应后生成的络合物在紫外可见有吸收或能产生荧光的离子和化合物,最好用UV/VIS或荧光检测器。若对所要解决的问题有几种方案可选择,分析方案的确定主要由基体的类型、选择性、过程的复杂程度以及是否经济来决定。表1和2总结了对各种类型离子可选用的分离方式和检测方式。 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]柱填料的发展推动了[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]应用的快速发展,对多种离子分析方法的开发提供了多种可能性。特别应提出的是在pH 0-14的水溶液和100%有机溶剂(反相高效液相色谱用有机溶剂)中稳定的亲水性高效高容量柱填料的商品化,使得离子交换分离的应用范围更加扩大。常见的在水溶液中以离子形态存在的离子,包括无机和有机离子,以弱酸的盐(Na2CO3/NaHCO3, KOH、NaOH)或强酸(H2SO4、甲基磺酸、HNO3、HCl)为流动相,阴离子交换或阳离子交换分离,电导检测,已是成熟的方法,有成熟的色谱条件可参照。对近中性的水可溶的有机“大”分子(相对常见的小分子而言),若待测化合物为弱酸,则由于弱酸在强碱性溶液中会以阴离子形态存在,因此选用较强的碱为流动相,阴离子交换分离;若待测化合物为弱碱,则由于在强酸性溶液中会以阳离子形态存在,选用较强的酸作流动相,阳离子交换分离;若待测离子的疏水性较强,由于与固定相之间的吸附作用而使保留时间较长或峰拖尾,则可在流动相中加入适量有机溶剂,减弱吸附,缩短保留时间、改善峰形和选择性。对该类化合物的分离也可选用离子对色谱分离,但流动相中一般含有较复杂的离子对试剂。此外,对弱保留离子可选用高容量柱和弱淋洗液以增强保留,对强保留离子则反之。在水溶液中以离子形态存在的离子,即较强的酸或碱,应选用电导检测。具有对紫外或可见光有吸收基团或经柱后衍生反应后(IC中较少用柱前衍生)生成有吸光基团的化合物,选用光学检测器。具有在外加电压下可发生氧化或还原反应基团的化合物,可选用直流安培或脉冲安培检测。对一些复杂样品,为了一次进样得到较多的信息,可将两种或三种检测器串联使用。资料来源:www.zyzwtp.com
[color=#444444]求助各位大侠!木糖中的胶体如何分离检测![/color]