罗卓雅 中国药典2010版药用辅料概述
我已经上传到资料中心,认证会员免积分下载,非认证会员下载需1分。该书是由英国药学出版社和美国药学会共同编辑出版的《药用辅料手册》是一本影响全球制剂工业的权威之作。该书拥有国际上辅料业著名专家20人组成的学术指导委员会,各国的执笔人员达到100人之多。该书涵盖辅料的基本工艺性质、物理化学性质、稳定性、配伍相容性、生物学特性以及相关的安全性和法规许可的咨询信息,甚至详细的参考文献等,其对我国药学、食品、化妆品领域的研究人员来说是一本极具参考价值的实用参考书。 该书共83MB,为PDF格式。由于文件较大为方便下载共12个压缩分卷。药用辅料手册(第4版)[1]part1 http://www.instrument.com.cn/download/shtml/036350.shtml药用辅料手册(第4版)[1]part2 http://www.instrument.com.cn/download/shtml/036363.shtml药用辅料手册(第4版)[1]part3 http://www.instrument.com.cn/download/shtml/036365.shtml药用辅料手册(第4版)[1]part4 http://www.instrument.com.cn/download/shtml/036366.shtml药用辅料手册(第4版)[1]part5 http://www.instrument.com.cn/download/shtml/036370.shtml药用辅料手册(第4版)[1]part6 http://www.instrument.com.cn/download/shtml/036371.shtml药用辅料手册(第4版)[1]part7 http://www.instrument.com.cn/download/shtml/036372.shtml药用辅料手册(第4版)[1]part8 http://www.instrument.com.cn/download/shtml/036373.shtml药用辅料手册(第4版)[1]part9http://www.instrument.com.cn/download/shtml/036375.shtml药用辅料手册(第4版)[1]part10 http://www.instrument.com.cn/download/shtml/036377.shtml药用辅料手册(第4版)[1]part11http://www.instrument.com.cn/download/shtml/036378.shtml药用辅料手册(第4版)[1]part12 http://www.instrument.com.cn/download/shtml/036379.shtml
请问有谁知道药用辅料——包衣剂有国家标准吗?各企业有自己的企业标准,他们的依据是什么呢?
2010年版《中国药典》二部辅料收载品种132个,其中新增品种DL-苹果酸、富马酸、明胶空心胶囊、大豆磷脂、蛋黄卵磷脂等均应用液相色谱法检查有关物质;胆固醇、麦芽糖等新增品种均应用液相色谱法测定含量。作为现代药品检验重要的检测手段,液相色谱技术在药用辅料检验中也发挥着重要作用。从《中国药典》的修订中可以看出,随着我国药用辅料品种迅速增加及药用辅料的检测标准逐渐完善,结果精准、操作简便的液相色谱法得到广泛应用和发展。紫外检测器(UVD)用于检测具有特定吸收波长,并在该波长下响应值与浓度成正比的物质。大部分药用辅料如醇类、酮类、酯类、酚类等都具有紫外吸收性质,因此用紫外检测器的高效液相色谱(HPLC-UV)法在药用辅料检测中应用最为广泛。刘雁鸣指出,苯甲醇是注射剂中常用的抑菌剂,但过量苯甲醇可对人体产生毒副作用,如静脉注射刺激性、鞘内注射神经毒性、过敏反应等不良反应。有专家建议用紫外检测器的高效液相色谱法测定野木瓜注射液中苯甲醇的含量,此种方法测得苯甲醇在线性范围内线性关系良好,且操作简便、准确、重复性好,为芳香醇类辅料应用此法检测提供了参考。另外,柠檬黄、苋菜红等是常用的人工合成色素,主要用作胶囊壳和糖衣的着色剂。原来的标准采用三氯化钛滴定法测定含量,操作繁琐费时,测定结果误差较大。有报道用紫外检测器测定药用辅料柠檬黄,测得结果线性范围宽,样品处理简单,试验方法灵敏度高、专属性强,试验结果准确可靠,提高了检验效率。可用于药用辅料色素的含量测定,为含芳香结构的色素辅料测定提供了参考。晒晒你原来测过的那些辅料项目,都测过哪些?http://simg.instrument.com.cn/bbs/images/default/em09511.gif
[b] 2017年中国药科大学药用辅料及仿创药物研发评价中心招聘启事[/b] 中国药科大学位于江苏省南京市,为教育部直属、国家“211工程”重点建设高校,是一所历史悠久、特色鲜明、在药学界享有盛誉的全国重点大学。为提升我国制药行业整体水平,保障药品安全性和有效性,加快科研成果向企业转化速度,中国药科大学于2016年9月成立中国药科大学药用辅料及仿创药物研发评价中心,主要致力于药用辅料、创新型药物、高端制剂的研究开发和药品一致性评价研究,因中心发展需要,现公开招聘[b]药分项目负责人[/b]、[b]研发QA[/b]各一人。一、岗位性质 非事业编制人事代理二、工作地点 中国药科大学玄武校区三、岗位要求 从事药物分析相关工作三年以上四、简历投递 请将应聘材料发送至邮箱yleicpu@126.com
药用辅料目录[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=57365]药用辅料目录[/url]
[em0801]讲义主要内容:一、辅料概述二、药用辅料基本技术要求三、制剂中对药用辅料的要求四、改剂型过程中药用辅料使用需要注意的问题五、处方中辅料变更的基本原则六、小结[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=108450]药用辅料在技术审评中的评价要点[/url]
药用辅料汇总表(有文号)[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=137171]药用辅料汇总表(有文号)[/url]
来源:医药经济报 药用辅料界的全球变革进程越来越快。在前不久国际药用辅料协会(IPEC)召开的2007年研讨会上,除了一如既往地强调辅料的重要作用之外,“监管”、“规范”以更高的频率被提及。 研讨会的中心议题是“药用辅料供应商与大型制药公司之间必须更加紧密地合作来共同降低药品生产成本、推动制药技术创新,同时要尽快融入新的辅料监管环境”。围绕这一中心议题,研讨会重点探讨了药用辅料安全性、辅料新规定的影响以及当前主要市场辅料监管状况。而围绕这三项内容进行的变革,将影响到2007年全球辅料行业的发展进程。 加强生产过程的安全性 近年来,制药公司一直在锲而不舍地寻找药物的新剂型及规格,以确保这些新剂型的临床治疗作用不会打折扣。同时,随着市场需求不断增加、生命健康产业规模的壮大,制药行业自身也存在往更深层次、更大范围发展的要求,因此,开发新辅料、规范辅料行业变得越来越迫切。国际药用辅料协会一直在呼吁全球主要的辅料生产地区加强监管,前不久还来到中国敦促成立相关工作机构以加强对中国辅料行业的监督。 如今,欧洲已经开始实施药用辅料的GMP生产质量管理规范,要求辅料生产商必须按照GMP规范来生产。欧洲业内人士认为,之所以实行药用辅料GMP规范,是为了用更高的安全标准来提高药物使用的安全性,除此之外,进行适当的监管不仅可以提高欧洲厂家的竞争力,对世界各地的药用辅料生产商来说也可以起到带动作用。 欧洲业内人士还指出,生产商乃至整个欧洲药用辅料领域需要一段时间来适应GMP规范,当下要做的应该是想办法避免新规定的出台给辅料供应商们增加不必要的负担。实际上,国际药用辅料协会已经提供了专门针对药用辅料的GMP指南,这份可操作的权威性文件不仅能帮助辅料生产商达到日益严格的要求,而且为制药公司与辅料生产商之间的合作提供了法规上的约束和帮助,以确保所使用辅料的安全性。 考验制药公司的杂质问题 对药用辅料生产商来说,除了要对GMP有所心理准备之外,还将面临涉及生产过程中的一项新规定:药品中基因毒性杂质的含量应控制在可接受的限值水平之内。根据新规定,当人们每天摄入的基因毒性杂质的TTC值(即毒性物质限量)低于1.5微克时,这种基因毒性杂质的水平可以被接受;在某些情况下(比如短期接触时),较高的TTC值也许仍然可以被接受。 有业内人士认为,这对药用辅料生产商来说绝对是一大挑战,说不定还将成为行业优胜劣汰的重要参数之一。 《基因毒性杂质限制指南》已于今年1月1日起开始实施。虽然它并非专门针对药用辅料,但监管部门在审批新药上市之前,将会将根据这条新规定来对药用辅料中的基因毒性杂质进行毒理学评价。 由于辅料的常规合成过程只有在使用反应材料的提前下才能得以实施,而这些反应材料具有潜在的基因毒性,在某些情况下,辅料中存在基因毒性杂质也就不可避免。《基因毒性杂质限制指南》的主要起草人在这次IPEC研讨会上表示:“在制药行业,有相当比例的合成产品可能含有基因毒性杂质,这自然成为一个较大的监管问题,同时也是关系到人体健康的一个问题。要对这种基因毒性杂质的危害进行定量的分析难度很大,《指南》可以为评价基因毒性杂质提供较清楚明了的参考。” 而如果制药公司从一开始就意识到了基因毒性杂质的重要性,它们也就会相应地提高处理这一问题的技术水平。至于新规定是否将给制药公司增加负担,《基因毒性杂质限制指南》主要起草人的态度是乐观的,“不认为这一新的指南将会对制药公司的经营业绩产生负面的影响”。 积极作用慢慢显现 有一种观点认为,在新法规出台后,不可避免地将减少当前使用的辅料的种类。不过,也有另一种持反对态度的观点认为,药用辅料的质量、规格等将由此得到更大程度的提高以及扩展,已经有许多制药公司正在研究《指南》,并与辅料生产商展开了比从前更深层次、更大范围的合作与交流。 业内人士认为,这种制药公司和辅料生产商合作新貌的出现具有积极的意义,一个显而易见的结果就是可以改变药品生产中的大量资源浪费的诟病。一直以来,制药行业的生产要素并没有得到持续改进和优化,久而久之导致在生产某些产品时的浪费现象高达50%,设备利用率甚至低到了15%;然而,大多数制药公司消耗在生产上的费用占到了全部费用的25%,几乎与研发费用的投入持平。可以说,虽然制药公司生产出了合格的高质量产品,但却是付出了高昂的代价取得的。制药行业的创新成果正在减少,运行成本却在不断上升,因此,大量资源浪费与这种背景所形成的矛盾将日渐深刻。《指南》一旦能够在制药企业和辅料生产商之间成功地发挥出作用,必将有助于更合理配置制药资源,优化行业结构。 业内人士还对前景进行了展望:“随着对剂型、关键性产品、生产要素和质量特性的理解加深,贯彻好Q8(制剂开发)、Q9(风险管理)和Q10(质量体系指南)等文件,与此同时生产出新型药用辅料,从而取得更好的生产结果,为病人提供更加有效的药品。” 欧洲需要向日美看齐 到目前为止,欧洲虽然规定制药公司必须提交制剂、原料药的主文件,但对药用辅料却没有作出这样的硬性规定。国际药用辅料协会欧洲监管事务委员会主席Carl Mroz提到了日本的作法。日本近来修改了1948年制定的药事法,要求制药公司必须向监管部门提交药物的辅料主文件(EMF)。 Carl Mroz认为欧洲也应该推行这种做法,因为欧洲一向缺乏辅料主文件的管理漏洞已经引起了行业的热论。Carl Mroz在研讨会上声讨了这种弊端:“我们希望建立一种机制,让新型辅料以更快的速度进入欧洲市场。不推出新的辅料,制药公司的创新激情就会泯灭。试问,如果制药公司打算开发含有新型辅料的新给药系统,却由于缺乏这种新辅料的相关数据的支持和参考,相信有再伟大的设想也不敢贸然着手开发的。在一定程度上,这已经阻碍了欧洲开发新辅料、新药物的进程。” Carl Mroz称,日本和美国已经推行了EMF模式,欧洲为了保持其制药的综合实力,未来能在向中国、俄罗斯这样的新兴药物市场占据一席之地,应该尽快地推行辅料EMF模式。 可以明显感觉到,近几年全球辅料行业有一股以监管为主要变革力量的潜流在涌动着。一方面,全球新药研发后继乏力使得一部分研发注意力转向发掘药用辅料;另一方面,制药领域内生性发展要求使得对药用辅料行业的监管日渐严格。在今后的若干年里,“迎头赶上”将是药用辅料行业发展的精神状态。
涂家生 药用辅料收载分析
药用辅料 盐酸 测 汞有限量吗?望老师不吝赐教
http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gif生物制药用途的药用辅料讲座时间:2014年7月31日 14:30 主讲人:杨铸 在生物制药领域,拥有超过十年的药用辅料研究,过程工艺支持,行业分析,市场营销以及并购的经验。http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gif【简介】 介绍生物制药用途的药用辅料,在上游细胞培养,下游蛋白纯化,生物药制剂等生产过程中,产品的特性以及发挥的作用。介绍生物制药药用辅料的法规行业现况。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名并参会用户有机会获得100元京东卡一张哦~3、报名截止时间:2014年7月31 日 14:00 4、报名参会:http://simg.instrument.com.cn/meeting/images/20100414/baoming.jpg

[center]口服固体制剂药用辅料[/center][img]http://ng1.17img.cn/bbsfiles/images/2009/04/200904020727_141847_1626679_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/04/200904020728_141848_1626679_3.jpg[/img][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=141849]口服固体制剂药用辅料[/url]
药品中大多数都是辅料,各个辅料在药品中充当着不同的角色,最常用的辅料有哪些呢?其在成药中扮演着什么角色呢?欢迎讨论!回帖格式如下:=============================药品名1:剂型:辅料:各辅料性质及作用:是否可被其他辅料替换:=============================药品名2:剂型:辅料:各辅料性质及作用:是否可被其他辅料替换:=============================药品名3:剂型:辅料:各辅料性质及作用:是否可被其他辅料替换:...=============================
Pharmacopeial Discussion Group Sign-Off Document AttributeJPEPUSPDefinition+++Legend: + will adopt and implement - will not stipulate.Nonharmonized attributes: Packaging and storage, Heavy metals, Limit of fluoride, Iron.Specific local attributes: Identification C (EP), Lead (USP), Description (JP)CaHPO4• 2H2O Phosphoric acid, calcium salt (1:1). Calcium phosphate, Dihydrate (1:1) [7789-77-7].USP药用辅料:磷酸氢钙的质量标准
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=145825]药用辅料生产质量管理规范.rar[/url]
药用辅料玉米淀粉氧化物质的测定,用硫代硫酸钠滴定液滴定至蓝色消失,消耗硫代硫酸钠滴定液不得过1.4ml,但是整个过程都没有颜色变化,是什么原因?
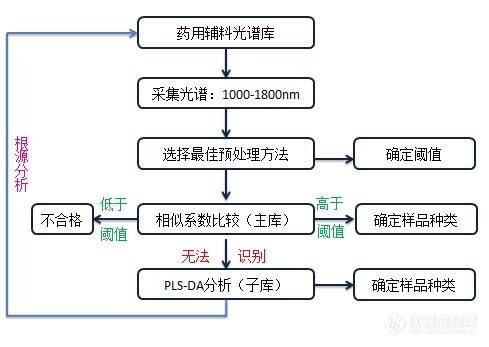
[align=center][b]sup-NIR分析仪在药用辅料快速识别体系建立中的应用研究[/b][/align][align=center]研究生:孙巧凤[/align][align=center]导师:臧恒昌教授[/align][b]摘要目的:[/b]药用原辅料是药品生产过程中的基础物质,也是药品质量的关键影响因素。我国药品生产质量管理规范要求采取核对或检验等适当的措施,确认每一包装内的原辅料正确无误,给制药企业带来了巨大的挑战。近几年国家提出了实行药品与药用原辅料和包装材料关联审批,在政策放宽的情况下,如何低成本、准确而快速的监管原辅料是一个十分关键的问题。欧盟的近红外草案规定当近红外方法应用于原辅料的放行时,可以被称为主要方法,这说明[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术对于原辅料质量快速评价具有强有力的优势。通过对药用原辅料建立[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]快速分析体系,将有效的推动国产[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]服务于药品生产行业,为广大人民群众的用药安全提供保障。[b]方法:[/b]本实验采用sup-NIR1520对17种不同的药用辅料进行光谱采集,并利用化学计量学方法建立了辅料的快速识别体系,药用辅料数据库建立的方法主要利用光谱间的相关系数值以及偏最小二乘判别分析定性分析方法,数据库的验证结果证明了sup-NIR分析仪在药用辅料定性方面应用的可行性。在建立的PLS-DA模型中发现此仪器不仅可以用于不同种药用辅料之间的快速识别,还可以应用于同种辅料不同型号的样品快速识别。[b]关键词:[/b][url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术;sup-NIR分析仪;药用原辅料[align=center]Research on the establishment of rapid identification systemof pharmaceutical excipients with sup-NIR analyzer[/align][align=center]Graduatestudent: Qiaofeng Sun[/align][align=center] Supervisor: Hengchang Zang[/align][align=left][b]Abstract Objective[/b]: Pharmaceutical excipients and raw materials arethe basic substances in the production of drugs, and they are the keyinfluencing factors of quality of medicine. GMP requires that appropriatemeasures should be taken to confirm that the materials in each package arecorrect, which has brought great challenges to the pharmaceutical companies. Inrecent years, The State has proposed the associated examination and approval ofdrugs and pharmaceutical excipients and raw materials and packaging materials.Under such circumstances, how to supervise raw and excipients materialsaccurately, quickly is a key technical issue. How to supervise the rawmaterials and excipients with low cost, accurate and fast is a key issue. TheEU's near-infrared draft stipulates that when near-infrared methods are appliedto the release of raw materials and excipients, it can be called the mainmethod, which indicates that NIRS has strong advantages for the qualityevaluation of raw materials and excipients. The establishment of a rapidanalysis system for near-infrared spectroscopy of pharmaceutical raw materialsand excipients will effectively promote domestic portable near-infraredspectrometers to serve the pharmaceutical industry and provide security for thepeople's drug safety. [b]Methods:[/b]In this experiment, 17 kinds of different pharmaceuticalexcipients were collected by sup-NIR1520, and rapid identification database forexcipients was established by chemometrics methods. The method of building thedatabase mainly used the correlation coefficient values and the PLS-DAqualitative analysis method, and the validation results of the database provedthe feasibility of the sup-NIR analyzer in the qualitative application ofpharmaceutical excipients. From the PLS-DA models, it was found that thisinstrument can be used not only for fast identification among differentpharmaceutical excipients, but also for the same kind of excipients ofdifferent types.[/align][align=left][b]Key words:[/b] Near infraredspectroscopy sup-NIR analyzer pharmaceutical excipients and raw materials[/align][b]1 材料1.1 仪器与软件[/b]Sup- NIR1520型[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析仪(聚光科技有限公司)工作温度是5-35 ℃,工作湿度是(5-85)%,工作压力为(86-116)kPa;采用带TEC温控系统的InGaAs检测器;光纤漫反射探头;参比盒;RIMP光谱采集及处理软件;MATLAB 2015a数据处理软件。[b]1.2 样品[/b]17种药用辅料均为药厂生产中使用的辅料,质量均符合药典规定标准。17种药用辅料,每种10个批次,共170批样品。[b]2 方法2.1[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的采集[/b]样品不经预处理,室温条件为20-25 ℃,采用光纤漫反射探头直接采集样品光谱,不同位置重复采集3次光谱,取平均;波长范围为1000-1800nm;扫描次数30次;分辨率为11 nm;以白板作为参比。[b]2.2 辅料识别体系的建立[/b]利用每种辅料7张光谱的内部相关系数确定每种辅料的阈值,以此相关系数阈值为辅料一级识别体系的判断依据,对验证集进行预测,依据相关系数的阈值判断样品的归属,归属多个种类的利用PLS-DA继续分析。建立辅料识别体系的主要策略如图2-1:[align=center][img=,489,347]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251725504841_7871_3389662_3.png!w489x347.jpg[/img][/align][align=center]图2-1 辅料识别体系技术路线图[/align][align=center]2.3样品集的划分[/align]采用Kennard-Stone method(KS法)分别将17种辅料划分为校正集和验证集,其中每种辅料取7个批次作为校正集,3个批次作为辅料识别体系的验证样品,即119个样品为校正集,51个样品作为验证集;其中校正集中,每类辅料的7个光谱取平均作为辅料识别体系的标准图谱。2.4 一级识别体系的建立[b][/b]2.4.1预处理方法的选择本研究考察了标准归一化法、多元散射校正、一阶导数、二阶导数,并根据识别体系的识别率和拒绝率确定最佳预处理方法。[b][/b]2.4.2阈值的确立根据每种辅料的内部相关系数值大小确定此种辅料的阈值,主要规则如下:若同类别的相关系数均大于0.97,为了增大识别体系的准确率,以不同种类间的一般阈值0.97为此类辅料的阈值;若辅料内部出现小于0.97的相关系数值,则以最小值作为此类辅料的判别阈值。[b][/b]2.4.3 结果分析一级识别体系主要是以相关系数值作为判断标准,将17张标准图谱作为一级识别体系的基础,以每种辅料的阈值作为体系的判断种类归属的依据。验证样品首先与标准图谱计算相关系数进行初步判断。[b][/b]2.5二级识别体系的建立某些辅料因结构相似等因素干扰导致无法直接用一级识别体系直接正确判断,存在一个以上大于阈值的相关系数值,则将所有大于阈值的辅料的7张原始光谱导出与内部的3个验证样品进行PLS-DA定性分析并最终归类。并将其建立成PLS-DA判别分析的二级识别体系。[b][/b]2.6识别体系的外部验证按照建立识别体系时相同的方法采集得到外部验证样品光谱,利用外部验证集对辅料识别体系的准确性进行验证,观察该数据库对于外来样品的识别和拒绝情况。[b][/b]3实验结果3.1 样品的原始光谱采用sup-NIR1520光谱仪采集的170批药用辅料的原始光谱图如图2-2所示. 由原始光谱图可以看出不同的辅料光谱之间是存在差异的但同时也存在光谱的重叠。所以需要借助化学计量学方法对其进行光谱矩阵进行数据运算。[align=center][img=,491,240]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251736087373_5680_3389662_3.png!w491x240.jpg[/img][/align][align=center]图2-2 辅料样品的原始光谱图[/align][b]3.2 样品集的划分结果[/b]将样品划分为119个校正集和51个验证集,划分结果见表2-1。校正集119个样品中包括17种样品,每种样品7张光谱,其原始光谱如图2-3-a所示。同样验证集样品包括17种辅料,每种3张验证光谱,其原始光谱如图2-3-b。将119张光谱每7张取平均,每种样品保留一张平均后的光谱作为一级识别体系的标准谱图。标准谱图如图2-4所示。[align=center][img=,575,542]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251736463497_6475_3389662_3.png!w575x542.jpg[/img][/align][align=center][img=,517,297]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251737193350_8509_3389662_3.png!w517x297.jpg[/img][/align]3.3 一级识别体系的建立[b][/b]3.3.1 预处理方法的选择结果样品辅料均为固体粉末,其颗粒大小的不规则性可能会因为影响光程而引入噪音,除此之外,还包括仪器、人为等因素带来的干扰,会使[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]包含一些非样品自身性质的无关信息,为了减少或消除其他因素带来的干扰,采用化学计量学方法对光谱数据进行预处理。首先考察了SNV与MSC预处理方法对光谱矩阵相关系数的影响,具体结果如表2-2所示,由表中数据可知,随机挑出三种辅料的光谱经过SNV和MSC预处理后,三种辅料内部的相关系数以及与验证集的相关系数均不变,通过计算得知这两种预处理方法对于相关系数的影响不大,因此其他辅料没有进行SNV和MSC预处理的考察。导数预处理可以去除基线漂移和背景的干扰,放大光谱间的差异,本研究考察了FD、SD以及不同的平滑窗口宽度对于识别体系识别率与拒绝率的影响,选出最佳的预处理方法以及最佳平滑窗口宽度。识别体系对于自身样品的识别率均为100 %,而拒绝率经过不同的预处理后结果不同,整体考虑FD预处理后的拒绝率最高,因此选择FD作为光谱的最佳预处理方法。由于导数运算的同时会增大噪声的影响,因此应同时进行平滑处理,而不同的窗口宽度产生的平滑效果不同,本研究同时考察了不同窗口宽度的平滑效果,以17种辅料综合考虑来看,当平滑窗口宽度为13时,数据库的识别率和拒绝率最大,因此选FD+SG 13点平滑为最佳预处理方法。[b][/b]3.3.2 阈值的确立本研究是以光谱矩阵中的相关系数值为判断指标,因此每种辅料内部的相关系数阈值的确定十分重要,为了确保阈值的准确可靠,我们用以下两种规则确定阈值:若同类别的相关系数均大于0.97,为了增加识别体系的准确率,以不同种类间的一般阈值0.97为此类辅料的阈值,以甘露醇类辅料为例,如表2-2所示,甘露醇类内的相关系数值均大于0.98,为保证识别体系的验证准确率,以0.97为此类辅料的阈值,相同情况的其他种类的辅料均以0.97为阈值;若辅料内部出现小于0.97的相关系数值,则以最小值作为此类辅料的判别阈值。以十二烷基硫酸钠为例,如表2-3所示为十二烷基硫酸钠相关系数结果,此时阈值选为0.96。相同情况的其他辅料均以最小值为阈值。根据以上两种原则计算出的所有辅料的阈值见表2-4。[align=center][img=,608,428]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251738094300_1550_3389662_3.png!w608x428.jpg[/img][/align][align=center][img=,582,264]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251738082012_8458_3389662_3.png!w582x264.jpg[/img][/align]3.3.3 结果分析将辅料的标准谱图以及验证集样品光谱图经FD+SG 13点平滑预处理,根据2.4中的阈值进行一级识别体系的判别,经过预处理后的谱图见图2-5,计算预处理后的验证集样品与17种辅料的标准谱图之间的相关系数,根据阈值进行辅料种类的归属,此时的验证属于库内验证。一级识别体系的验证存在两种情况,一种是仅有一个相关系数值大于阈值此时可以正确归属该辅料,如图2-6所示为第4个验证样品与17种辅料的相关系数值,横坐标为辅料的编号,纵坐标为相关系数值。从图中看出此验证样品仅与第四个辅料之间的相关系数大于阈值,因此可将其正确的归类为第四种辅料甘露醇。另一种情况是同时出现多个两个或以上的数值大于阈值,此时会出现辅料归属的不确定性。如图2-7所示,第25个验证样品同时与硬脂酸镁和十二烷基硫酸钠相匹配,一级识别体系无法正确判断,应进一步分析。其他验证样品利用相同的原理进行验证。最终的验证结果显示,微晶纤维素类样品PH101、PH102,淀粉类样品糊精、CMS、预胶化淀粉及玉米淀粉,硬脂酸镁及十二烷基硫酸钠三大类样品间因其结构相似无法正确判断,而除此之外的其他样品均能成功识别和拒绝。因此需根据上述三类样品建立PLS-DA定性分析模型,作为识别体系的子库。[align=center][img=,538,603]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251739356596_6435_3389662_3.png!w538x603.jpg[/img][/align][align=center][img=,501,294]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251739346185_9267_3389662_3.png!w501x294.jpg[/img][/align][b]3.4二级识别体系的建立[/b]二级子库的建立是为了将一级识别体系识别中不确定种类的的样品进行进一步的定性分析,子库的建立采用的是PLS-DA定性分析方法。由一级识别体系的验证结果可知共有三大类的样品由于结构相似相关系数值无法正确区分,现根据上述情况建立了三个独立的PLS-DA模型作为一级识别体系的补充。[b]3.4.1淀粉类样品PLS-DA模型的建立[/b]首先将一级识别体系中的玉米淀粉、糊精、预胶化淀粉、CMS的28张原始光谱调出作为定性模型的校正集,将一级识别体系验证集中易混淆的12个样品挑出作为模型的验证集。用上述40个批次的样品建立模型。利用原始光谱建立的PLS-DA模型如图2-8所示,图中后半部分为验证样品,校正集和验证集的识别率拒绝率均为100%,说明利用此方法能将四类辅料完全分开。[align=center][img=,502,266]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251740551806_2263_3389662_3.png!w502x266.jpg[/img][/align][b]3.4.2PH101和PH102辅料PLS-DA模型的建立[/b]PH101和PH102是不同型号的同一种辅料,都属于微晶纤维素,因此结构十分相似,难以区分。利用PLS-DA模型不经预处理即可将两种样品分开,模型的校正集是两种辅料的14张校正光谱图,验证集6个样品。如图2-9所示,图中的红色虚线为PLS-DA生成的判别线,线上方为一类,线下方为另一类。模型校正集和验证集的识别率以及拒绝率均为100%。[align=center][img=,485,281]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251742494590_6583_3389662_3.png!w485x281.jpg[/img][/align][b]3.4.3硬脂酸镁和十二烷基硫酸钠PLS-DA模型的建立[/b]硬脂酸镁与十二烷基硫酸钠在相关系数法判别时也无法正确分开,两种辅料可能是由于结构或者包装等其他因素导致一些相似的特征出现,同样利用PLS-DA模型判别两种辅料,在导入原始光谱时即可完全分开,模型的校正集是两种辅料的14张校正光谱图,验证集6个样品,模型结果见图2-10,模型校正集和验证集的识别率拒绝率均为100%[align=center][img=,509,271]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251744222873_6541_3389662_3.png!w509x271.jpg[/img][/align][b]3.4.4 二级识别体系结果分析[/b]由以上三个定性模型可知,在一级识别体系中无法正确判断的样品均能在不经预处理的条件下利用PLS-DA方法正确区分,识别率和拒绝率均为100 %,说明将相关系数法和PLS-DA法相结合判断药用辅料的种类是可行的,模型结果见表2-5。另一方面说明了sup-NIR1520分析仪可以用来区分这些辅料,实现定性判别的作用。[align=center][img=,528,168]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251745073638_3095_3389662_3.png!w528x168.jpg[/img][/align][b]3.5辅料识别体系的外部验证[/b]由上述结果可知,建立的识别体系在快速识别药用辅料方面是可行的,为了进一步证明此识别体系的准确性和可靠性,设计外部验证集考察模型对于外来辅料的识别能力。[b]3.5.1外部验证光谱图[/b]在相同条件下采集了60个不同种类和批次的样品光谱作为识别体系的外部验证集,样品的原始光谱及预处理后的光谱见图2-11。样品集的验证流程与识别体系内部验证相同,先利用预处理后的相关系数值进行初步判断,如果相关系数值很高的样品再利用PLS-DA模型验证。根据验证结果分为三类具体描述。[align=center][img=,505,260]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251742510972_5235_3389662_3.png!w505x260.jpg[/img][/align][b]3.5.2相关系数直接判别[/b]由一级识别体系直接判断出的验证样品共17个,即与17种辅料的相关系数值中仅有一个值大于阈值,表2-6种列举了其中8个样品的相关系数结果,其中表头中的数字表示验证样品的编号。[align=center][img=,562,543]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251746036984_3446_3389662_3.png!w562x543.jpg[/img][/align][b]3.5.3PLS-DA判别[/b]共有19个验证样品的相关系数值与两种及以上的辅料相似,因此需利用建立的二级识别体系进行进一步的验证,PLS-DA结果显示19个样品均能正确归属种类。表2-7为其中8个验证样品的相关系数结果。其中第10个、16个、25个外部验证样品的PLS-DA分析结果见图2-12、图2-13、图2-14,图中的灰色圆圈代表验证样品,由结果可知利用PLS-DA均能正确识别。[align=center][img=,566,561]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251746386429_3985_3389662_3.png!w566x561.jpg[/img][/align][align=center][img=,490,747]http://ng1.17img.cn/bbsfiles/images/2018/07/201807251742232524_3277_3389662_3.png!w490x747.jpg[/img][/align][b]3.5.4不属于识别体系内的样品[/b]由于外部验证集的范围并不完全在识别体系范围内,所以会出现相关系数值均低于所有阈值的现象,此种情况说明该验证样品不属于识别体系内的任何一种辅料。由检测数据可以看出,24个验证样品均能被识别体系正确拒绝,拒绝率达到100%。由以上三种情况可知,外部验证集的60个样品均能被此识别体系正确的识别和拒绝,再次证明了识别体系的准确性和可靠性,既说明了此方法可以准确的应用到辅料的快速识别,又说明了sup-NIR1520分析仪在辅料定性识别应用中的可行性。[b]4讨论和结论[/b]本实验采用sup-NIR1520分析仪对17种不同的药用辅料进行光谱采集,并利用化学计量学方法建立了17种辅料的快速识别库,证明了sup-NIR1520分析仪在药用辅料定性方面应用的可行性。此自主研发的仪器不仅可以用于不同种药用辅料之间的快速识别,还可以应用于同种辅料不同型号的样品快速识别如PH101和PH102,识别率和拒绝率均达到100%。[align=center][b]参考文献[/b][/align] 王动民, 纪俊敏, 高洪智. 多元散射校正预处理波段对[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]定标模型的影响. 光谱学与光谱分析, 2014, 34(9):2387-2390. BrownC D, Vegamontoto L, Wentzell P D. Derivative Preprocessing and OptimalCorrections for Baseline Drift in Multivariate Calibration. AppliedSpectroscopy, 2000, 54(7):1055-1068.
质量标准是质量控制实验室(QC)所有工作的源头,有了质量标准QC才能开展工作,依据质量标准对样品检验。但针对于工厂的质量标准(原辅料)的运作,个人认为应该工厂有一个组织或者机构来运作这件事,包括质量标准的起草、变更、撤销等整个生命周期。这个组织应该包括生产部(技术部)、质量部、采购物流部和注册部(也应包含牵涉到其他部门)。质量标准(原辅料)的起草阶段,生产部(技术部)提出物料的特性需求,质量部提出技术可行性需求,注册部提出注册可行性需求,形成不低中国药典的内控标准,采购物流部根据此要求和供应商签订质量协议。质量部的质量控制部门(QC)根据质量标准和牵涉到的药典起草检验操作规程和检验原始记录,在这点上需要注意的是:1.一定要根据质量标准的来源起草检验操作规程,比如说:“砷盐”是根据日本药典检验的,那么所用的试液的配方、方法和试验装置都要采用日本药典的收录的,要注意药典间的区别;2.根据中国药典检验的,一定要符合药典凡例和附录的要求,举个例子:干燥失重测定法(附录ⅧL)的取样量一般是约1g(0.9 g~1.1 g),而炽灼残渣检查法(附录ⅧN)的取样量则一般是1.0g(0.95g~1.05 g),这样的差别还比较多,要注意细节;3.还要注意符合“中国药品检验标准操作规范”的要求(不强制),就拿干燥失重测定法(附录ⅧL)(2010版)举例,对仪器的要求,烘箱的温控精度要求是±0.1℃,分析天平的最小分度是0.1mg,对操作的要求,干燥失重在1.0%以下的品种可只做一份,1.0%以上的品种应同时做平行试验两份,还有一些细节要求,我不具体列出来了;4.质量标准中有模糊描述的,在检验操作规程中应尽量细化,如中国药典第180页收录的“头孢西丁钠”其比旋度项的描述是“取本品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含10mg的溶液”,具体操作时,取多少样品合适,没有规定,所以在检验操作规程中应根据比旋管的大小,写明取用的样品量,同时注明用什么型号(等级)的天平称量,避免不同人员间操作的随意性。5.在起草检验原始记录时,要注意所使用试剂、试液、仪器设备、标准品的可追溯性,一定尽量详细描述实验过程,以便与复核记录和OOS/OOT时的追踪。质量标准(原辅料)的变更阶段,由需要变更的部门提出变更申请,审批后,召开变更会议,各部门对此变更进行评估,变更后有必要的话进行CAPA的跟踪,同时通知各相关部门进行相关文件的修改,比如采购物流部根据新的质量标准和供应商签订新的质量协议;质量部门根据新的质量标准去做物料的复验(有可能会不合格)。质量标准的起草的撤销阶段,由需要撤销的部门提出撤销申请,审批后,召开撤销会议,各部门对此撤销进行评估,撤销后有必要的话进行CAPA的跟踪,同时通知各相关部门进行相关文件的修改。以上是个人对质量标准(原辅料)的一点浅薄看法,欢迎拍砖讨论。
USP方法下的[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]检测药用辅料聚维酮中铅Pb的验证方法,我看文件都没有具体指出,但是有的项目系统适用性,专属性,检出限,有的是多了精密度和中间精密度,请问一下各位老师,这种不同的物质里面的铅Pb为什么验证项目会有不同呢

【专家讲座】:HPLC在2015年版药典药用辅料中的应用【讲座时间】:2016年03月29日 10:00【主讲人】:龙珍 赛默飞液相色谱应用工程师,博士,在赛默飞一直致力于液相色谱方面的应用方法开发,主要应用方向为液相色谱在制药行业中的应用,积累有丰富的分析经验。【会议简介】本次讲座涵盖强紫外吸收、弱紫外吸收和无紫外吸收药用辅料的分离解决方案。讲座内容涉及大量2015版药典新增药用辅料品种的介绍,如三氯蔗糖、海藻糖、氯化钾、氯化钠、PEG、吐温和没食子酸等。介绍的方案包括检测器、检测器参数(如波长,温度等)、色谱柱、流动相、色谱图、线性范围、LOD和LOQ等。对于本次讲座没有提及的药用辅料,网友均可在答疑环节与讲座老师讨论。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名,通过审核后即可参会。2、报名并参会用户有机会获得100元手机充值卡一张哦~3、报名截止时间:2016年03月29日 9:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/17825、报名及参会咨询:QQ群—171692483http://ng1.17img.cn/bbsfiles/images/2017/01/201701191700_667146_2507958_3.jpg
盐酸是药物辅料,我最近发现几家公司盐酸含量测定方法却不一样,比如指示剂,有的用甲基红、有的用甲基橙、有的用溴甲酚绿、有的用酚酞。都是用氢氧化钠标准溶液滴定。我查阅法规:国家药典2010版用甲基红,国家标准《GB 320-2006 工业用合成盐酸》和《GB 1897-2008 食品添加剂 盐酸》和化工行业标准《HG/T 2778-2009 高纯盐酸》用溴甲酚绿,电力行业标准《DL 422.2-91 工业盐酸含量的测定——容量法》用甲基橙,酚酞的使用没有找到法规依据。请问:①药用辅料比如盐酸的检测方法必须按照国家药典方法检测吗,可以用国家标准或行业标准吗?②没有法规依据的检测方法,比如使用酚酞检测,是不是要做药用辅料的方法验证,并报主管部门备案?③电力行业标准是否适应化工行业和化工制药的检测标准。

【专家讲座】:HPLC在2015年版药典药用辅料中的应用【讲座时间】:2016年03月29日 10:00【主讲人】:龙珍 赛默飞液相色谱应用工程师,博士,在赛默飞一直致力于液相色谱方面的应用方法开发,主要应用方向为液相色谱在制药行业中的应用,积累有丰富的分析经验。【会议简介】本次讲座涵盖强紫外吸收、弱紫外吸收和无紫外吸收药用辅料的分离解决方案。讲座内容涉及大量2015版药典新增药用辅料品种的介绍,如三氯蔗糖、海藻糖、氯化钾、氯化钠、PEG、吐温和没食子酸等。介绍的方案包括检测器、检测器参数(如波长,温度等)、色谱柱、流动相、色谱图、线性范围、LOD和LOQ等。对于本次讲座没有提及的药用辅料,网友均可在答疑环节与讲座老师讨论。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名,通过审核后即可参会。2、报名并参会用户有机会获得100元手机充值卡一张哦~3、报名截止时间:2016年03月29日 9:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/17825、报名及参会咨询:QQ群—171692483http://ng1.17img.cn/bbsfiles/images/2017/01/201701191700_667148_2507958_3.jpg
谁有食用菌原辅料pH值测定标准?
版友求助:聚乙烯醇(药用辅料)的残留溶剂测定中,为什么供试溶液中检测出内标物(丙酮)的峰面积会变小?
“从医药企业角度来说,如果国家监管力度能够持续加强,并有所作为,最值得关注的应该是企业现在的实际生产与药典标准之间的差距,这个差距不仅是检验结果与检验方法与药典规定的差距,而是在全体系全系统上是否有差距。”杨涛进一步分析指出,中药企业一定要关注对二氧化硫、重金属、农药残留等检测的限度控制;化学药企必须关注杂质的定性与定量测定方法的研究,这一课必须补。 辅料生变,标准之争 在2015版药典中,关于药用辅料的相关规定是其中的重要变化,包括辅料品种增加和辅料独立成卷,由此可以看出国家对药用辅料的重视。 杨涛表示,一直以来,我国药品辅料管理始终是监管的薄弱环节,但是药品的稳定性、安全性、吸收度等都与辅料密切相关,业界经常听说为什么企业与辉瑞等跨国药企用的是同一厂家供应的阿奇霉素原料,做出来的阿奇霉素片效果就是有差异,这里面辅料的原因一定是重要的一个。 其实,我国辅料存在的问题主要是“小、散、乱”,这些企业没有强大的研发能力支撑,技术弱、规模小,条件差,质量管理体系欠缺。而且,国家对辅料企业重视不够且监管不力,即使监管,由于缺乏国家完善的标准与措施,往往难以凑效。 “由于我国在制剂监管时对于辅料的检查没有作为重点进行,企业为了降低成本就会钻空子,使用无资质企业生产的辅料来代替药用辅料。”杨涛表示,中国药用辅料企业必须发愤图强,从研发、技术、质量各方面提升自己,清楚认识到药用辅料是药品的一部分,关系重大。 相比较辅料,对于制药企业来说,药品标准更值得关注。在每一次新的药典制定时,有些药企会成为某个药品质量标准的起草者或参与制定者,而成为标准的起草者或参与者,对于企业来说显然是有不少好处的。三流企业卖产品,二流企业卖品牌,一流企业定标准、定规则。企业参与制定标准这是没有坏处的,也是必须的,一个专利创新药研发出来,只有原研企业才有资格制定这个标准,其他人没有办法制定,当然对一些老药标准提升,各个企业都有权利做提升标准研究,就看企业有没有这个能力 杨涛更直白地指出了这一点:企业参与制定药品标准,就如同参与制定游戏规则一样,其不仅对这一标准的理解更加深入与透彻,而且制定的标准都是依据自己企业的实际情况进行的。标准制定后,其他企业要想达到这一标准,必定需要更多的努力,甚至要重新研究,费时费力,还要增加投资。 另外,目前有观点指出,在新版药典出台后,可能对于一些品种的市场走势会有影响。事实上,按照以往的经验来看,药典的实施基本上对市场的影响面和深度不会太大。不过,需要引起重视的是,药典已经成为各个国家药品监管中的最重要的一个政策文件,随着药典的更新,未来的作用会进一步体现。 “希望在5年之后,国家出台的2020版中国药典,能够更全面、更具体、指导性与操作性更强。”杨涛认为,只有这样,才能真正的提升我国制药水平和监管水平,进而提升我国医药产业的整体竞争力。
原研药和仿制药的疗效应该是等同的。但由于仿制药的原料药和辅料来源、辅料种类和配比不可能和原研药完全一致,因而仿制药和原研药之间仍有可能存在疗效和安全方面的差异。近红外快速可以快速分析辅料的来源、辅料种类和配比,从而提高我国仿制药质量,可使仿制药内在品质趋近于原研药。不知道我这个想法可行否?1.建模集样品预处理建模集样品预处理主要包括建模集中异常样品的剔除及建模集样品的选取1)异常样品的剔除方法剔除建模集中异常样品的准则,通常有基于预测浓度残差、基于重构光谱残差以及杠杆值与学生T检验等标准。2)建模集样品的选取方法建模集样品的选择有常规选择和计算机识别两种方法。常见的建模集样品挑选方法较多,如含量梯度法、Kennard-Stone法、SPXY法。2.建模集光谱预处理建模集光谱预处理研究主要包括两个方面:一是谱图预处理;二是波长选择。1)谱图预处理常用的光谱预处理方法有数据增强变换、平滑、导数、光散射校正、傅里叶变换等。近几年,小波变换、正交信号校正和净分析信号等一些新方法正在得到发展和应用。2)波长选择波长选择方法主要有相关系数法、无信息变量的消除法(Uninformative Variables elimination, UVE)、遗传算法(Genetic Algorithm, GA)。其中,GA是应用较为广泛的一种波长选取方式。3.近红外光谱定量分析红外光谱分析中建立定量分析校正模型的方法可分为两大类:线性和非线性常见的多元线性校正方法有:主成分回归(PCR)、偏最小二乘回归(PLS),PLS是目前近红外光谱定量分析中主流的线性多元校正建模方法。非线性校正方法主要有:支持向量机(SVM)、人工神经网络方法(ANN)、局部权重回归(LWR)方法。SVM能较好地解决对于神经网络的训练比较致命的一些问题,即小样本、高维数,以及局部极小点问题。4评价近红外光谱分析模型性能的基本参数均方根校正误差RMSEC(Root Mean Squared Error of Calibration)建模过程评价模型拟合的效果。交互验证标准差SECV(Standard Error of Cross Validation)PRESS(Prediction Residual Squared Sum)——预测残差平方和5模型评价根据ICH指导原则,从专属性、线性、重现性和准确性对模型进行验证。数据处理由TQ Analyst光谱数据处理软件(Version8.5,美国Thermo Fisher公司)和Matlab(matlab2012a,美国Math Works公司)软件完成。(1)样品的收集 选择足够多且有代表性的样品组成建模样品集(2)参比值(理化指标)的测定 收集完样品后,运用标准方法测定建模样品集中各个样品的组成或性质,(3)近红外光谱的采集 样品准备好了后,就可以用高精密度、高分辨率的仪器与规范一致的测试条件,以及尽可能宽的谱区来扫描样品光谱了(4)模型的建立与优化 模型的建立即“信息的关联”过程。(5)模型的验证 用验证集样品对所建模型是否适合分析待测样品进行验证,如果不适合则需要返回修正与优化模型;通过反复的验证与优化,直至模型与样品相适配为止(6)模型建立好后,如果有未知样品需要测定,则在与建模光谱相同的条件下扫描待测样品的近红外光谱后,运用已经建立的数学模型即可计算出未知样品待测量的近红外预测值了(7)若模型应用于分析其他新的样品或者在另一台仪器上应用,则模型需要适配性检验,并可能进行模型的修正、传递等工作。以上内容参考书籍《近红外光谱分析技术及其在现代农业中的应用》张小超等|电子工业出版社;《化学计量学方法与分析光谱分析技术》褚小立|化学工业出版社;《近红外光谱法快速分析药品》胡昌勤等|化学工业出版社。希望大家给出意见,讨论下有没有应用价值,期待听到你们的声音
药用辅料中傅立叶红外可以具体测哪些项目?望老师不吝赐教
手上接到一个检测环氧乙烷和二氧六环的药用辅料聚山梨酯80,刚开始觉得不就做气相嘛,应该挺简单的,结果问题出在环氧乙烷上了,我们先看一下百度的结果“环氧乙烷是一种有机化合物,化学式是C2H4O,是一种有毒的致癌物质,以前被用来制造杀菌剂。环氧乙烷易燃易爆,不易长途运输,因此有强烈的地域性。被广泛地应用于洗涤,制药,印染等行业。在化工相关产业可作为清洁剂的起始剂。”从这上面可以看到这东西不好买,最后还是从某公司购买到了,用个保温壶装的,里面塞了两个冰袋,一回来马上冰箱-20℃冻着。环氧乙烷沸点(℃):10.4。也就是说在室温下环氧乙烷就气化了,取样是个大问题。 先来一张标准物质的真容,一个小钢瓶保护着,里面是一个玻璃瓶,在10.4℃以下是透明液体。http://ng1.17img.cn/bbsfiles/images/2017/10/201210091041073309_01_1610699_3.jpg再附个在中检院标化所下载的说明书http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647816_1610699_3.jpg这个标准物质是做医疗器械的,但是也只能买到这个了,按照说明书的方法,先冻好注射器。http://ng1.17img.cn/bbsfiles/images/2017/10/201210091047089148_01_0_3.jpg拿个大脸盘,里面盛满冰块冰袋,水温基本能保持在0~4℃间,有利于等会取样。把玻璃瓶轻轻从钢瓶里敲出来,拿一个小烧杯装着冰水,玻璃瓶泡里面,当时操作的场景没人帮拍下来,遗憾了。http://ng1.17img.cn/bbsfiles/images/2017/10/201210091050436429_01_0_3.jpg做好以上工作,就是正式取样了,这个过程没拍照,看文字好了。大家也可以看10版药典二部1246页。1.精密称定空20ml顶空瓶+盖子和垫子重量;2.取旋蒸6小时的聚乙二醇400 10ml到20ml顶空瓶中,精密称取重量后,密封顶空瓶,冰浴里降温;3.把环氧乙烷标准溶液从冰浴中取出倒置,用冰冻过的1ml注射器扎入玻璃瓶口的橡胶垫,迅速抽吸0.3ml的液体,马上扎入20ml顶空瓶中,摇匀,冰浴中静置约5分钟左右。(难点:注射器扎入玻璃瓶时针头过短,必须倒置玻璃瓶;由于离开了水浴,在抽吸环氧乙烷时会感觉的到推杆有个往后的力,这应该是环氧乙烷气化的作用,在针头抽离玻璃瓶时会有液体从针头喷射而出,气化后压力太大了,所以在抽离后应在往后抽一段空气,避免液体喷射;在扎入顶空瓶时应找准橡胶塞迅速全部打进顶空瓶中,我在操作时扎入不是很准,射到瓶口旁边了,操作了两次才够量,所以必须在毒气柜中操作)4.把顶空瓶取出,擦干冰水,精密称取瓶重。质量减质量即可算出环氧乙烷的浓度(g/g),作为环氧乙烷对照品贮备液。此操作忽略了温度对称重的影响,大家可以讨论一下。5.再把顶空瓶打开,精密称取冷的贮备液1g到50ml量瓶中。(为什么又要把顶空瓶打开呢,因为聚乙二醇400很粘稠,用注射器根本吸不出来,这也可能是药典在这一步为什么是要求取1g而不是1ml;50ml量瓶也必须先称空瓶,加40ml聚乙二醇400后的重量,称取贮备液后的重量,用于计算浓度g/g)6.取上一步的溶液1g到装有30ml超纯水的50ml量瓶中,计算出浓度g/ml。作为环氧乙烷对照品。7.其他步骤按药典方法操作。 操作过程中的一些经验跟大家分享一下:第一步本来也是按药典的方法用100ml量瓶的,结果发现在环氧乙烷转移的过程中气化比较快,所以想出了把它移入密封的顶空瓶中,效果不错。转移稀释时药典是取1g、10g,因为在第一步时比药典的浓度浓了10倍,所以接下来得两步都是取1g即可。 上机因为气相出故障,先把样品冻冰箱了。http://ng1.17img.cn/bbsfiles/images/2012/10/201210091149_395450_1610699_3.jpg维护空气泵后,气相终于正常工作了。先介绍一下我的仪器条件。顶空进样器(安捷伦7694E) 平衡温度:70℃,定量环:80℃,传输管:70℃ 平衡时间:40min进样口温度:150℃ 分流比5:1 FID温度:250℃ 流速:4ml/min色谱柱:DB-624 30m*530μm*3μm 程序升温:40℃ 保持3min,10℃ /min到180℃ ,30℃ /min到230保持10min系统适用性试验结果:乙醛峰和环氧乙烷峰分离度为4.78,大于2.0,二氧六环峰信噪比为7.5,峰高大于噪音5倍,满足药典要求。下图是系统适用性试验的图谱,其他的图谱就不上了,在计算时用的是标准加入法,我的未检出。http://simg.instrument.com.cn/bbs/images/brow/em09510.gifhttp://ng1.17img.cn/bbsfiles/images/2012/10/201210101651_395727_1610699_3.jpg
总局关于征求药包材和药用辅料关联审评审批申报资料要求(征求意见稿)意见的公告(2016年第3号) 2016年01月12日 为贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),简化药品审批程序,将直接接触药品的包装材料和容器(以下简称药包材)、药用辅料由单独审批改为在审批药品注册申请时一并审评审批,食品药品监管总局组织起草了《药包材和药用辅料关联审评审批申报资料要求(征求意见稿)》(适用新申报的药包材和药用辅料),现向社会公开征求意见。请将修改意见于2016年2月15日前通过电子邮件反馈至食品药品监管总局(药品化妆品注册管理司)。 联系人:胡音 电子邮箱:huyin@cfda.gov.cn 特此公告。 附件:药包材和药用辅料关联审评审批申报资料要求(征求意见稿)食品药品监管总局2016年1月7日http://www.sfda.gov.cn/directory/web/fileTypeImages/icon_doc.gif2016年第3号公告附件.doc