最近做一个化药仿制项目。现在相对原研厂家生产的参比制剂进行X射线衍射,原研厂家产品,主药占到70%以上,另外还有3种辅料。是否将这个片剂,研碎,进行X粉末衍射?辅料是不是会有很大干扰?这种干扰与其在产品中的比例直接相关吗?做这个的目的,是想测定原研产品中主药的晶型,然后,我们仿制它的时候,就可以购买与它一致的原料药,进行研究开发。所以,我们也会送检市售2-3种原料药的X衍射。问题是,上述取原研产品制剂研碎进行测定,与后期取市售原料药进行检测,是否能从图谱上比对出原料药的晶型差别?没有接触过X衍射,请大家赐教。
制剂中聚山梨酯 80检测,有做过的朋友分享一下你们的检测过程好吗?
有没有谁有比较好的检测酶抑制剂抑制效率的方法,也就是测Ki值的方法?谢谢
最近做一个化药仿制项目。现在相对原研厂家生产的参比制剂进行X射线衍射,原研厂家产品,主药占到70%以上,另外还有3种辅料。是否将这个片剂,研碎,进行X粉末衍射?辅料是不是会有很大干扰?这种干扰与其在产品中的比例直接相关吗?做这个的目的,是想测定原研产品中主药的晶型,然后,我们仿制它的时候,就可以购买与它一致的原料药,进行研究开发。所以,我们也会送检市售2-3种原料药的X衍射。问题是,上述取原研产品制剂研碎进行测定,与后期取市售原料药进行检测,是否能从图谱上比对出原料药的晶型差别?没有接触过X衍射,请大家赐教。
中药制剂是祖国医学伟大宝库的组成部分,有关中药制剂的化学分析,除有效成分结构已清楚的外,很多还有待深入分析,因此如何采取科学的分析方法与手段,以辩证唯物主义的理论来指导中药制剂的分析,也是中西药结合的一种尝试。本文根据近年来中药制剂的分析实践,试图归纳一般的分析程序、操作方法,并结合一些常用中草制剂的分析实例作为说明。目前国内生产的中药制剂或中西结合的制剂为数很多,其中一些制剂经过多年的临床应用肯定了它的疗效,但对这些中药制剂的化学成分的认识还很不够,由于以往对天然药物(包括中草药)的研究,其主要内容和方法是有机化学的,着眼于化学的分离结构测定,构型确定,化学合成等。而中药制剂的研究对象则着眼于制剂的临床应用和药效,重点在于阐明制剂中的化学成分与疗效关系的研究。其任务就是寻找并认识具有治疗作用的物质基础。目前的中药制剂有两种类型:1、已经提纯为单体,在根就单体的理化性质、药理作用、临床用途做成一定形式的制剂如长春新碱、喜树碱、穿心莲内酯等;2、采用溶媒方法提取其中的有效部位,然后根据临床用途做成制剂如丹参注射剂、大蒜注射剂、复方阴阳莲等。而中药制剂的分析主要是以后一种制剂为对象。鉴于当前中药制剂的化学成分多数为一直成分(其结构与理化常熟均为已知)因此还存在一个怎样尽快的去识别一个已知成分的问题,关于已知成分的早期识别问题将另列专节进行讨论。
化学仿制药口服固体制剂一致性评价 复核检验技术指南 (征求意见稿)一、前言[color=windowtext]为规范仿制药一致性评价复核检验工作,根据《关于发布化学药品仿制药质量和疗效一致性评价申报资料要求(试行)的通告》(国家食品药品监督管理总局通告2016年第120号)和药品检验机构注册检验相关要求,特制定本技术指南。该指南适用于化学药品口服固体制剂仿制药一致性评价复核检验工作,未尽事宜参照相关管理规定和技术指导原则。[/color]二、复核内容及要求(一)品种信息概述[color=windowtext]完整、清晰的表述[/color]产品名称、历史沿革、临床信息及不良反应、批准文号及上市情况、近三年生产状况等,以及本品理化性质、生物药剂学分类、处方组成、生产工艺和过程控制、辅料与包装材料、稳定性总结等内容。企业申报资料中相应内容[color=windowtext]是否完整全面。[/color] (二)参比制剂的复核1. 参比制剂的选择明确参比制剂的选择是否与[color=windowtext]国家食品药品监督管理[/color]总局公布的参比制剂一致,如不一致,应详细说明理由。应全面、准确表述参比制剂基本信息,包括企业名称、批号、规格、获取渠道及相应凭证等。2. 参比制剂的质量考察申报资料中参比制剂的质量考察是否充分,复核检验的结果与企业上报结果是否一致。3. 参比制剂的溶出曲线申报资料中参比制剂的溶出曲线考察方法是否合理、资料是否全面,复核检验的结果与企业上报结果是否一致。企业是否进行了参比制剂的批内和批间均一性考察;是否存在不稳定的情况,企业是否进行了考察并予以说明。对于涉及改规格、改剂型、改盐基的药品,根据[color=windowtext]国家食品药品监督管理总局[/color]发布的“三改品种”评价一般考虑的相关要求,也需进行参比制剂的溶出曲线复核。(三)体外评价复核1. 关键质量属性考察申报资料中企业提供的质量标准与现行标准相比是否有所修订,包括提供的拟定注册标准、企业内控标准等,特别是本次评价中涉及处方工艺改变的品种,申报标准中是否规定了关键质量属性的质控项目,其项目设定、检测方法是否合理,结果是否准确,复核检验的结果与企业上报结果是否一致。应重点关注申报资料中的杂质谱研究,按照《关于发布化学药品仿制药质量和疗效一致性评价申报资料要求(试行)的通告》([color=windowtext]国家食品药品监督管理总局通告[/color]2016年第120号)中相关要求,评价杂质谱研究是否充分、合理。应将申报标准与国内外药典标准、进口注册标准及现行标准列表比较。2. 体外溶出研究溶出曲线复核检验前,应按照[color=windowtext]国家食品药品监督管理总[/color]局公布的《药物溶出度仪机械验证指导原则》的要求,对试验用溶出度仪进行机械及性能验证,并给出验证报告。申报资料中企业是否提供了试验用溶出仪的机械验证报告。溶出方法与检测方法的设计是否科学、合理,方法学考察数据是否完整、准确,复核检验的结果与企业上报结果是否一致。企业是否按照申报资料的要求,考察了同一批次的样品在不同溶出仪器上溶出曲线的差异,以及仿制制剂3批样品溶出行为的批内均一性(n=12粒、片/批)和批间均一性(n=3批),复核检验的结果与企业上报结果是否一致。企业是否按照[color=windowtext]国家食品药品监督管理总局[/color]公布的《普通口服固体制剂溶出曲线测定与比较指导原则》要求,比较了仿制制剂与参比制剂的溶出曲线相似性,复核检验的结果与企业上报结果是否一致。3. 结论通过对仿制制剂与参比制剂关键质量属性和体外溶出试验结果的分析,做出本品体外评价的结论。(四)结果报告[b] [/b]结果报告包括:(1)三批产品按企业申报标准检验的全检报告;(2)复核报告。复核报告的格式模板详见附件。三、报告说明为便于技术审评和统计,应按照规定的格式整理相关资料,并撰写复核报告,不同品种的复核内容可能有所不同,但其格式和项目编号不能改变,可在具体项目下注明“无相关复核内容”或“不适用”,对特殊品种增加的研究内容可在“其他需要说明的问题”项下列出。附件:复核报告(格式模板)附件[align=center]×××(品名)复核报告(格式模板)[/align][align=center] [/align]申报单位:申报日期:复核单位:报告日期:一、摘要(600字以内)二、品种信息1.基本信息2.药物特性三、参比制剂的复核1.参比制剂的选择2.参比制剂的质量考察3.参比制剂的溶出曲线四、体外评价复核1.关键质量属性考察2.体外溶出复核3.结论五、复核意见六、其他需要说明的问题七、参考文献及相关实验数据食品药品监管总局办公厅2017年4月28日
看到一篇新闻说益母草制剂等9个批次产品不合格,我想了解一下,益母草制剂算是天然药吗?益母草制剂和益母草膏应该如何检测?处理样品的时候有没有什么要注意的?
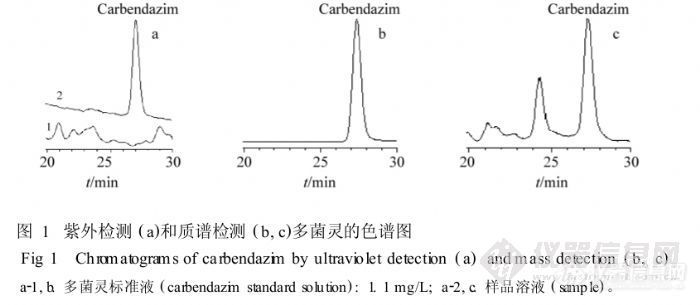
【作者】 吴永江; 朱炜; 程翼宇;【Author】 Wu Yongjiang,Zhu Wei,Cheng Yiyu~(Department of Chinese Medicine Science & Engineering,College of Pharmaceutical Sciences,Zhejiang University,Hangzhou 310027)【机构】 浙江大学中药科学与工程学系; 浙江大学中药科学与工程学系 杭州310027; 杭州310027;【摘要】 用高效液相色谱-质谱联用法定量检测铁皮石斛、西洋参药材及其制剂中的多菌灵残留。在酸性条件下以甲醇提取中药材和制剂中的残留多菌灵,分析色谱柱为D iamonsil C18(4.6 mm i.d.×250 mm,5μm),以4%四氢呋喃水溶液-甲醇梯度洗脱,采用选择离子监测模式,以m/z192为检测定量离子。多菌灵出峰时间在27 m in左右,线性范围为0.22~33 ng,相关系数0.9993;方法检出限为0.015 mg/L;定量限为0.022mg/L;平均回收率在95.6%以上。该方法灵敏、准确、可靠,定量范围宽,耐用性强,可作为中药中多菌灵残留的可靠检测方法。http://ng1.17img.cn/bbsfiles/images/2012/07/201207301504_380571_2379123_3.jpg
有做中药检测的没,讨论一下中药检测前处理怎么做的,草药类型的,不是口服液或者药片制剂等成品
为什么DAD检测器需要扣参比波长而VWD检测器不需要扣参比呢?
各位大侠,我用紫外检测器做烟嘧磺隆和吡嘧磺隆农药样品, 标样都没有问题,出峰很好。但是将农药制剂稀释后进样,完全没有峰了。也将标样直接添到制剂中再稀释,但是仍然没有峰出来。用液质质进样,该样品吡嘧磺隆是没有问题的,烟嘧磺隆也能出峰但有一定干扰,请教一下,液相紫外检测器做不出该农药样品这到底是什么问题呢?
制剂生产质量检测为什么不用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]量取
各位大侠,请问农药残留检测与农药制剂的成分含量分析检测有什么区别?在前处理方法、仪器条件上的差别大吗?谢谢了。
HPLC法,C18柱,检测凝胶制剂。但是做不了几针,柱压高了,峰形也不好。凝胶堵在柱子里了,有什么办法可以排除凝胶的干扰。 谢谢http://simg.instrument.com.cn/bbs/images/brow/emyc1010.gif
采用正相方法,流动相为正庚烷:乙醇:乙醇胺600:400:1,以乙醇作为稀释剂,对制剂中的异构体进行分析方法研究,先配制原料的供试品溶液,在配制制剂的供试品溶液,两者浓度相同都是1mg/ml,但是检出结果为原料异构体检出为0.057%,制剂检出为0.023%,起初怀疑是制剂未提取出来,然后对制剂的超声提取增大时间(15分钟,20分钟,30分钟、45分钟和1小时)结果:制剂检出为0.023%,所以超声时间不影响。然后继续更换稀释剂为甲醇,结果:原料异构体检出为0.05%,制剂检出为0.02%,对比乙醇作为稀释剂无变化。继续更换DMSO5ml溶解后+流动相稀释至刻度,结果DMSO与流动相分层,继续更换为乙醇5ml溶解后+流动相稀释至刻度,结果原料异构体检出为0.04%,制剂检出为0.02%。后续是一点头绪也没有了,有没有大神指导一下啊!!!!!!
甜味抑制剂"2-(4-甲氧基苯氧基)-丙酸钠"如何检测?用HPLC可以检测,用GC或GCMS如何检测,如何衍生化?先酸化吗?在衍生化?
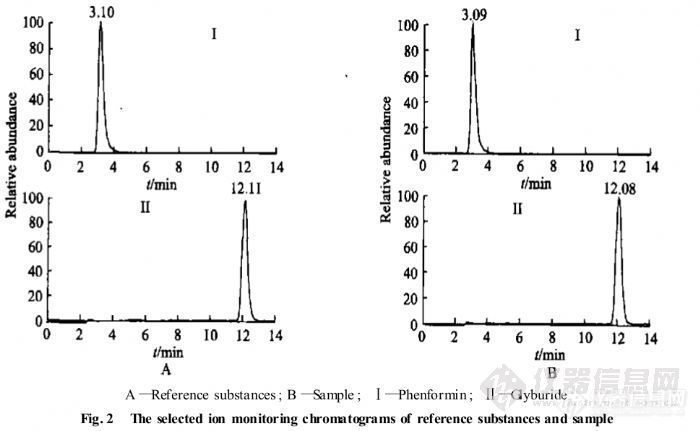
【作者】 董宇; 孔璋; 钟大放;【Author】 DONG Yu, KONG Zhang, ZHONG Da-fang(Laboratory of Drug Metabolism and Phamacokinetics,Shenyang Pharmaceutical University,Shenyang 110016, China)【机构】 沈阳药科大学药物代谢与药物动力学实验室; 沈阳药科大学药物代谢与药物动力学实验室 辽宁沈阳110016; 辽宁沈阳110016; 辽宁沈阳110016;【摘要】 目的建立检测中药降糖制剂中非法掺入的苯乙双胍和格列本脲专属性方法 ,并对若干市售药品进行检测。方法采用液相色谱 离子阱质谱联用法。选用DiamonsilC18柱 ,以乙腈 水 甲酸(V∶V∶V =6 0 0∶4 0 0∶0 1)为流动相 ,对中药降糖制剂的提取液进行液相色谱 离子阱质谱分析。通过与对照品的色谱及质谱行为相比较 ,对中药降糖制剂中非法掺入的合成降糖药进行定性鉴别。结果在 4种受试中药降糖制剂中 ,2种被检测到同时掺有苯乙双胍和格列本脲 ,1种被检测到掺有格列本脲。结论该方法选择性强 ,灵敏度高 ,可作为分析检测非法中药降糖制剂的有效方法 http://ng1.17img.cn/bbsfiles/images/2012/07/201207301530_380586_2379123_3.jpg
[size=12px]点击链接链接查看更多:[url]https://www.woyaoce.cn/service/info-18244.html[/url]酶制剂是指从生物中提取的具有酶特性的一类物质,主要作用是催化食品加工过程中各种化学反应,改进食品加工方法。其应用领域遍及轻工、食品、化工、医药、农业以及能源、环境保护等方面。对于酶制剂,广州工业微生物检测中心拥有丰富的检测经验、先进的实验室设备及权威的检测能力。用户或商家在选购或生产时,可把样品送到检测中心进行检验,以确保酶制剂质量可靠。[color=#777777] [/color][/size][table][tr][td=1,1,56][size=12px][font=Times, serif] [/font][font=宋体]产品类型[/font][font=Times, serif] [/font][/size][/td][td=1,1,125][align=center][font=宋体][size=12px]检测项目[/size][/font][/align][/td][td][align=center][font=宋体][size=12px]检测标准[/size][/font][/align][/td][td=1,1,0][size=12px][/size][/td][/tr][tr][td=1,2,56][align=center][size=12px][font=Times, serif] [/font]酶制剂[font=Times, serif] [/font][/size][/align][/td][td=1,2,125][align=center][size=12px][font=Times, serif] α[/font]-淀粉酶、[font=Times, serif] [/font][/size][/align][align=center][size=12px]糖化酶、[font=Times, serif] [/font][/size][/align][align=center][size=12px]糖化酶、[/size][/align][align=center][size=12px]蛋白酶、[/size][/align][align=center][size=12px][font=Times, serif]SOD[/font]活力、[/size][/align][align=center][size=12px]纤维素酶、[/size][/align][align=center][size=12px]脂肪酶、[/size][/align][align=center][size=12px]木聚糖酶、[/size][/align][align=center][size=12px]果胶酶、[/size][/align][align=center][size=12px][font=Times, serif]β-[/font]葡聚糖酶[/size][/align][/td][td=1,2][align=center][size=12px][font=Times, serif]GB 8275[/font]-[font=Times, serif]2009 2.2[/font]食品添加剂[font=Times, serif]α[/font]-淀粉酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]QB 1805.1[/font]-[font=Times, serif]1993[/font]工业用[font=Times, serif]α[/font]-淀粉酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]GB/T 24401-2009α[/font]-淀粉酶制剂[/size][/align][align=center][size=12px][font=Times, serif]GB 8276[/font]-[font=Times, serif]2006 2.2[/font]食品添加剂糖化酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]QB 1805.2[/font]-[font=Times, serif]1993[/font]工业用糖化酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]QB 1805.31993[/font]工业用蛋白酶制剂[font=Times, serif]([/font]第二法 紫外分光光度法[font=Times, serif])[/font][/size][/align][align=center][size=12px][font=Times, serif]GB/T 23527-2009[/font]蛋白酶的测定[/size][/align][align=center][size=12px][font=Times, serif] GB/T 5009.171-2003[/font]保健食品中超氧化物歧化酶的活性第一法[font=Times, serif] [/font][/size][/align][align=center][size=12px][font=Times, serif]QB 2583[/font]-[font=Times, serif]2003[/font]工业用纤维素酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]GB/T 23881-2009[/font]饲用纤维素酶活性的测定 滤纸法[/size][/align][align=center][size=12px][font=Times, serif]QB 1805.4[/font]-[font=Times, serif]1993[/font]工业用脂肪酶制剂活力测定[/size][/align][align=center][size=12px][font=Times, serif]GB/T 23535-2009[/font]脂肪酶的测定[/size][/align][align=center][size=12px][font=Times, serif]GB/T 23874-2009[/font]饲料添加剂木聚糖酶活力测定[/size][/align][align=center][size=12px]分光光度法[/size][/align][align=center][size=12px][font=Times, serif]QB 1502-92[/font]食品添加剂 果胶酶制剂[/size][/align][align=center][size=12px][font=Times, serif]NY/T 911-2004[/font]饲料添加剂[font=Times, serif]β-[/font]葡聚糖酶的测定 分光光度法[/size][/align][/td][td=1,1,0][size=12px][/size][/td][/tr][tr][td=1,1,0][size=12px][/size][/td][/tr][/table]
前面发了很多关于2010版方法分析三七、人参、红参、西洋参制剂的谱图,为方便大家查看和对照现已整理成谱图集,这是第一次出现专门针对人参皂苷分析的谱图集,希望对大家有用,请大家在附件中下载。
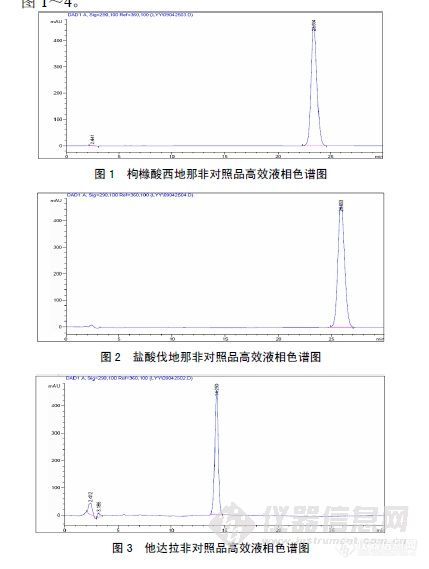
作者:倪晨;陈汀波;梁远园;王倩;(广东广州中医药大学;)摘要:目的建立快速、准确的检测中药保健品中非法添加磷酸二酯酶5(PDE5)抑制剂的方法。方法采用高效液相色谱法(HPLC)检测,DiamonsilC18色谱柱;流动相:乙腈-0.05mol·L-1三乙胺(用磷酸调PH至6.0)=40:60,流速1.0mL·min-1,检测波长290nm。结果该保健酒中未检出PDE5抑制剂:枸橼酸西地那非、盐酸伐地那非、他达拉非。结论该方法灵敏度高,重复性好,可用于PDE5抑制剂的定性检查。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208131450_383525_1606903_3.jpg
【网络讲座】:2015版中国药典新增中药制剂的HPLC检测【讲座时间】:2016年08月04日 14:00【主讲人】:封娇 女,高级化学应用工程师,现任大连依利特分析仪器有限公司产品经理,主要研究方向为液相色谱仪相关产品的研制、评测,以及应用方法开发。支持公司HPLC应用色谱图集的编撰,多次作为主要技术人员参与2015版中国药典国家药典委培训会和HPLC检测实例验证工作。拥有丰富的液相色谱应用方法开发经验,具备较高的专业技术水平和理论基础。【会议简介】《中国药典》2015年版由第十届药典委员会执行委员会全体会议审议通过,于2015年6月5日经国家食品药品监督管理总局批准颁布。本版药典在2010年版基础上,更加完善药典标准体系的建设,整体提升质量控制的要求,显著增加收载品种,严格加强质量控制,进一步扩大了先进、成熟检测技术的应用,特别是HPLC技术的应用更加广泛与突出。针对《中国药典》2015年版的新增品目,特别是新增中药制剂的HPLC检测,大连依利特分析仪器有限公司在与国家药典委合作开展2010年版《中国药典》一部HPLC验证基础上,又进行了大量验证实验,并对HPLC检测方法的样品前处理优化、色谱条件优化和系统适用性验证进行深入研究,与此同时,加深理解《中国药典》2015年版的科学性、权威性以及先进性的理念与思想。届时将与广大《中国药典》2015年版读者与相关工作者一起分享新增中药制剂HPLC检测的实际操作经验和技巧,并例举相关检测实例进行详细解析。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名截止时间:2016年08月04日 13:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/20395、报名及参会咨询:QQ群—290101720,扫码入群“色谱”http://ng1.17img.cn/bbsfiles/images/2017/01/201701191700_668119_2507958_3.gif
【网络讲座】:2015版中国药典新增中药制剂的HPLC检测【讲座时间】:2016年08月04日 14:00【主讲人】:封娇 女,高级化学应用工程师,现任大连依利特分析仪器有限公司产品经理,主要研究方向为液相色谱仪相关产品的研制、评测,以及应用方法开发。支持公司HPLC应用色谱图集的编撰,多次作为主要技术人员参与2015版中国药典国家药典委培训会和HPLC检测实例验证工作。拥有丰富的液相色谱应用方法开发经验,具备较高的专业技术水平和理论基础。【会议简介】 《中国药典》2015年版由第十届药典委员会执行委员会全体会议审议通过,于2015年6月5日经国家食品药品监督管理总局批准颁布。本版药典在2010年版基础上,更加完善药典标准体系的建设,整体提升质量控制的要求,显著增加收载品种,严格加强质量控制,进一步扩大了先进、成熟检测技术的应用,特别是HPLC技术的应用更加广泛与突出。 针对《中国药典》2015年版的新增品目,特别是新增中药制剂的HPLC检测,大连依利特分析仪器有限公司在与国家药典委合作开展2010年版《中国药典》一部HPLC验证基础上,又进行了大量验证实验,并对HPLC检测方法的样品前处理优化、色谱条件优化和系统适用性验证进行深入研究,与此同时,加深理解《中国药典》2015年版的科学性、权威性以及先进性的理念与思想。届时将与广大《中国药典》2015年版读者与相关工作者一起分享新增中药制剂HPLC检测的实际操作经验和技巧,并例举相关检测实例进行详细解析。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名截止时间:2016年08月04日 13:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/20395、报名及参会咨询:QQ群—290101720,扫码入群“色谱”http://ng1.17img.cn/bbsfiles/images/2017/01/201701191700_668105_2507958_3.gif
为贯彻《中华人民共和国环境保护法》《中华人民共和国水污染防治法》《中华人民共和国大气污染防治法》《中华人民共和国土壤污染防治法》《中华人民共和国固体废物污染环境防治法》《中华人民共和国噪声污染防治法》《排污许可管理条例》等法律法规,改善生态环境质量,指导和规范中药、生物药品制品、化学药品制剂制造业排污单位自行监测工作,制定本标准。本标准规定了中药、生物药品制品、化学药品制剂制造业排污单位自行监测的一般要求、监测方案制定、信息记录和报告的基本内容及要求。本标准为首次发布。[align=center][url=https://www.mee.gov.cn/ywgz/fgbz/bz/bzwb/jcffbz/202205/W020220517430324464462.pdf]排污单位自行监测技术指南 中药、生物药品制品、化学药品制剂制造业(HJ 1256—2022)[/url][/align]
固体制剂生产用的纯化水需不需要检测的啊?比如配制包衣液用的水,不都是车间直接取用的吗?如果检测,需要检哪些指标呢?
火焰[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原吸[/color][/url]测钠钾可以不加电离抵制剂氯化铯吗?今天首次检测,使用的是玻璃容量瓶。结果试了一下分析纯的氯化铯,空白吸光度值太高(测的溶剂1%盐酸的吸光度值低),估计是纯度不够,一般需要买什么级别的,优级纯还是光谱纯?另外不加氯化铯直接测可以吗,GB 5413.21-2010 食品安全国家标准 婴幼儿食品和乳品中钙、铁、锌、钠、钾、镁、铜和锰的测定,看这个标准是没有加氯化铯检测,GB 5009.91-2017 食品安全国家标准 食品中钾、钠的测定,这个标准又有加氯化铯。
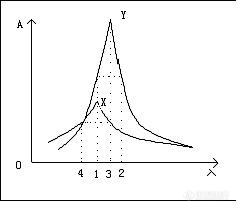
[color=#00008B][B]这几天看到大家对参比波长和检测波长出现比较多的疑问,故整理下帖子,供板油们参考[/B]:[/color]是用紫外可见分光光度计进行全扫描,然后选择最大吸收的波长,如果有几个最大吸收波长的时候,选择杂质峰较少的波长做测定波长。检测波长不是参比波长,只有很少物质测定需要用到参比波长,参比波长主要起到消除噪音的影响选择参比波长的依据是被测样品在参比波长处没有吸收,参比波长应尽可能的接近检测波长。说白了,参比波长就是空白对照的作用如果把参比波长值设成检测波长,样品在紫外光下无吸收。参比波长应设在样品没有吸收的地方,且越靠近样品的检测波长越好。选择参比波长是为了更好的消除噪音的影响。一般参比波长的选择依据是样品在参比波长没有吸收,同时跟检测波长相差不是太大,应尽量靠近,以便消除干扰物质的影响。就象做紫外分光光度计的实验,选择参比溶液一样,为了消除空白溶液中物质的干扰。下面是一个关于参比波长选择的例子:例:X和Y是两种吸光物质的吸收曲线,现采用双波长吸光光度法对它们进行分别测定。如图所示如何选择参比波长及测量波长。(1) 测量X时,Y可视为干扰物质。则选择l1作为测量波长,l2作为参比波长,因为l1和l2两处Y的吸光度相等,可以用以消除Y对X的干扰。 (2) 测量Y时,X可视为干扰物质。则选择l3作为测量波长,l4作为参比波长,因为l3和l4两处X的吸光度相等,可以用以消除X对Y的干扰。 [IMG]http://ng1.17img.cn/bbsfiles/images/2017/01/201701191651_625565_1600062_3.jpg[/IMG]如果你的检测器可以设参比波长,应该是dad或者mwd 检测器。这类检测器的。检测的不是你实际设的波长,比如你设的234,16nm .450,80.表示检测器检到的从226-242nm的紫外吸收图,再平均得到一个数据,参比设置也类似,然后2个相减,就是工作站上显示得到峰高和峰面积。如果你的样品刚好在234nm,吸收最强,你可以设到234,2nm.(资料上一般写频宽宽度设置是最大吸收峰的半峰宽的宽度) 如果你的样品在410-530nm有紫外吸收,你可以把参比设的更高,或者干脆不设参比。
之前用原吸火焰测钾、钠,按行业标准规定的方法,加5%CsCl作为抗电离剂。现想用ICP-MS测试,因相关的行标还未发布,所以请教各位有经验的老师,ICP-MS测钾、钠需要加电离抑制剂吗?
客户反馈用我们的C18色谱柱做复方丹参片的检测,保留时间与我们实验室之前做的结果不一致,提前了很多,当时建议客户冲洗仪器,多平衡,重新安排实验,注意流动相的设置,但是客户说安排了,还是一样的结果,后来让客户把柱子寄回来,实验室安排验证试验,结果与客户的大相径庭,但是与实验室之前的还是一样的。验证实验充分说明了色谱柱没有问题,实验还是需要客户自己重新安排再试试。http://ng1.17img.cn/bbsfiles/images/2016/05/201605031743_592163_1987954_3.pnghttp://ng1.17img.cn/bbsfiles/images/2016/05/201605031743_592164_1987954_3.png
[b][i][u]用722G可见分光光度计检测铂溶液中的铂含量[/u][/i][/b]被检测铂溶液中含有显色剂(250mg/l氯化亚锡)、铂(0-10ug/ml)、以及盐酸(0.5M)的混合物。请问参比溶液是否可以选用显色剂(250mg/l氯化亚锡和0.5M盐酸的混合溶液?是否直接用这个参比溶液进行调零?还需要用二次蒸馏水调零吗?谢谢
(一)中药制剂化学成分的多样性与复杂性: 1.任何一种中药的化学成分都十分复杂,包括各类型的有机和无机化合物,由几味以至几十味药组成的复杂中药制剂所含成分更为复杂; 2.中药制剂化学成分可以是不同类别的,如生物碱,黄酮等,在相同类别的成分中可能含有性质相近的多种同系物; 3.中药制剂中所含成分的含量高低差别很大,含量高者可达百分之几十,低者可至千成分之几; 4.有些化学成分还会相互影响,含量发生较大变化,给质量分析增加难度。 (二)中药制剂原料药材质量的差别 1.原料药材的品种,规格,产地,生长环境,药用部位,采收季节,加工方法等均会影响药材中有效成分的含量,从而影响中药制剂的质量和临床疗效。 2.炮制方法的影响中药材经加工炮制后,其化学成分,性味,药理作用等方面都会发生一定的变化,为了保证中药制剂的质量,药材应严格遵守中药炮制规范,对炮制工艺,成品质量都要严格把关,才能保证中药制剂质量稳定,可靠。 (三)以中医药理论为指导原则,评价中药制剂质量 1.中药制剂的组方原则有君,臣,佐,使之分,在进行质量分析时,首先进行组方分析,按功能主治分出君,臣,佐,使药味,选择合适的化学成分为指标来评价中药制剂的质量。医学教育网搜集整理 2.由于中药成分的复杂性,药理作用的多方面性,难于以某个或某些成分的含量评价中药制剂质量。目前多根据制剂中单味药有效成分的特性建立控制制剂中某味药质和量的检测方法,随方分析主药或药群的有效成分,进行质量评价。 3.在检测成分上也要注意中医临床功能主治与现代药理学相结合进行研究 (四)中药制剂工艺及辅料的特殊性 1.同一种中药制剂,由于不同生产厂家生产工艺上的差别,将会影响到制剂中化学成分的含量。 2.中药制剂的剂型种类繁多,制备方法各异,工艺较为复杂,很多在单味中药鲜品中存在的化学成分,经过炮制或制备工艺中经加热处理后,结构发生变化,已不复存在或含量甚微,有些则在制备过程中因挥发,分解,沉淀等原因使质量分析更加困难。 3.中药制剂所用辅料各式各样,如蜂蜜,蜂蜡,糯米粉,植物油,铅丹等都可作为辅料,这些辅料的存在,则对质量分析均有一定的影响,需选择合适的方法,将其干扰排除,才能获得准确的分析结果。 (五)中药制剂杂质来源的多途径性 中药制剂的杂质来源要比化学制剂复杂的多, 1.由生产过程中带入的; 2.药材中非药用部位及未除净的泥沙;药材中所含的重金属及残留农药; 3.包装,保管不当所产生的霉变,走油,泛糖,虫蛀等产生的杂质; 4.洗涤原料的水质二次污染等途径均可混入杂质。所以中药制剂易含有较高的重金属,砷盐,残留农药等杂质。 (六)中药制剂有效成分的非单一性 1.中药制剂产生的疗效不是某单一成分作用的结果,也不是某些成分简单作用的加和,是各成分之间的协同作用。用一种成分衡量其质量优劣有失偏颇,某单一成分的含量高低并不一定与其临床作用效果具有简单的线性关系,检测任何一种活性成分均不能反映它所体现的整体疗效。 2.研究复方中药制剂的物质基础,应用灵敏可靠的分析仪器,测定多种有效成分,才能更加科学,客观地评价中药制剂质量。