还在为元素杂质担心吗?微波消解系统助力药品质量控制
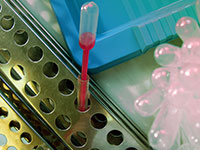
微波消解系统助力药品质量控制由于药品中的元素杂质不仅构成患者的毒理学风险,而且可能影响药物产品的质量和功效。因此,元素杂质分析在药物开发和质量控制中起着重要作用。与药品质量控制相关的法规有哪些? 国际人用药品注册技术协调会(ICH) 在ICH 指导手册中 Q3D生效以前,重金属分析采用的是硫化物沉淀法,是根据 USP, Ph.Eur.2.4.8 规定中的限制测试。这项超过100 年的旧版操作规程是不明确的,而且不能确定具体的量化结果。终于经过这么久的发展后,在相关的法律法规中,过时的湿法化学分析已逐步被现代仪器分析取代。由于 ICP-OES 和 ICP-MS 的使用,随之相关的样品前处理技术,例如微波辅助消解,目前已成为定量元素分析的主流前处理方式。自 2014 年 12 月起,ICH 指导手册中 Q3D 步骤 4 生效,并且市场中的所有产品都必须遵循遵循该步骤(从 2018 年 1 月开始,新的提案已提交并且已获批准)。指导手册中根据元素杂质的毒性和它们在药物中产生毒性的可能性,将其分为四类 – 1, 2A, 2B 和 3,并且详细说明了元素的种类,剂型(口服,注射以及吸入)以及允许日常接触量(PDE)。值得注意的是,等级1中的Cd、Pb、As、Hg 和等级2中的Co、V、Ni 是人体致毒物,所含 PDE 较低。对于这些元素,即使这些金属没有人为添加,也必须进行风险分析,以防超过其 PDE。根据评估结果,定义一个合理的控制策略,从没有任何分析到定期研究,再到最终成品的理性测试。 美国药典-USP2015年12月,USP 232章节中元素杂质—限制和233章节元素杂质—规程正式生效,并在 2018年1月,取代了所有对旧版USP的引用。232章节中所规定的限制完全符合ICH Q3D的要求。对于膳食补充剂而言,USP章节从2013年8月开始正式生效,它参考了 USP关于全元素污染物的分析规程,自 2018 年1月起开始执行。欧洲药典-Ph.Eur.欧洲药典委员会决定重新逐字修订Ph. Eur. chapter5.20中的ICH Q3D指导方针,自 2018年1月开始,欧盟市场上的所有现有产品都需考虑此问题。2020版中国药典2020版中国药典,9102药品杂质分析指导原则,无机杂质参照ICH Q3D进行研究,并确定检查项目。为什么以上法规都对元素杂质含量进行了限定?元素杂质可能会存在于原料药、辅料、制剂中的催化剂或环境污染物中。这些杂质可能是自然生成的,也可能是人为加入或不可逆引入的(例如与生产设备的相互反应)。当我们知道元素杂质有产生的可能性时,就必须保证杂质符合指定的限度。要注意的是,砷、镉、铅和汞在自然中普遍存在,所以我们在采用基于风险的控制策略时必须包括对这四种元素的考虑。不论采用何种方式,由于元素杂质并不给患者提供任何治疗益处,在药品中的水平应被控制在可接受限度以内。 微波消解技术成为元素杂质定量的技术 由于2020版中国药典、美国药典(USP 和),欧洲药典(Ph。Eur。5.20)和国际协调会议(ICH Q3D)的新规定,使用ICP—OES或ICP—MS与可靠的样品制备技术(例如基于加压消解腔(PDC)的超级微波消解仪)已成为元素杂质定量的技术。例如易挥发元素铂元素Os,已知Os在某些活性药物成分(API)的生产链中被用作催化剂。样品基质的消化主要是通过氧化无机酸(例如HNO3)来完成的,这将在确定Os痕迹时引起问题。原因是在这种条件下,Os元素形成了不同种类的挥发性氧化物,导致了Os的失控。四氧化锇不仅具有高度挥发性,还可通过吸入、食入和皮肤接触从而产生剧毒。 安东帕Multiwave 7000可一次性消解所有类型的样品。针对不同元素的特性,您可以根据待测的元素选择压力密封样品管或密闭石英管,同时也可以根据所需样品的处理量、样品量、样品体积和反应混合物等进行支架选择。如上图所示,不仅可选择石英管用来应对Os元素易挥发的状况,同时使用压力样品密封管对其他样品进行消解。满足所有药典,完美助力药品质量控制!