核酸提取(核酸的分离与纯化)主要是指将核酸与蛋白质、多糖、脂肪等生物大分子物质分开,但在分离核酸时,应保证核酸分子一级结构的完整性,并排除其他分子污染。核酸提取方法一般包括细胞裂解、酶处理、核酸与其他生物大分子物质分离、核酸纯化等几个主要步骤,而每一步骤又可由多种不同的方法单独或联合实现。操作过程中首先通过物理、化学或酶解作用裂解细胞,使核酸释放出来,并去除与核酸结合的蛋白质以及多糖、脂肪类等生物大分子的过程。在此基础上,沉淀核酸、去除盐类和有机试剂等杂质,从而得到纯化的核酸。核酸提取仪是应用配套的核酸提取试剂来自动完成样本核酸的提取工作的仪器。在传统的手工核酸提取过程中通常采用离心澄清的方法,操作时费时费力。近年来,出现了磁珠分离技术,利用磁珠在一定条件下对核酸具有很强亲和力的特点,吸附核酸。当条件改变时,磁珠又可以与其吸附的核酸分离,从而得到纯化的核酸。这种方法简便、高效、易于操作,是目前核酸提取仪采用的主要方法。具体来说,磁珠法提取核酸是通过细胞裂解液裂解细胞,从细胞中游离出来的核酸分子被特异的吸附到磁性颗粒表面,而蛋白质等杂质不被吸附而留在溶液中。反应一定时间之后,再在磁场作用下,使磁性颗粒与液体分开,回收颗粒(即磁珠-DNA 混合物),再用洗脱液洗脱即可以得到纯净的DNA。磁珠法不需要离心、不需要加入多种试剂,操作简单,符合核酸自动化提取要求,是未来核酸纯化方法发展的一个重要方向。
问题描述:核酸提取方式主要有哪些?有何差异?解答:[align=left][font=宋体][color=black]目前主流的核酸提取方法有煮沸裂解法、苯酚氯仿抽提法、离心柱法、磁珠法,接下来介绍这几个方法的原理、优劣势及适用场景。[/color][/font][/align][align=left][font=宋体][color=black]([/color][/font][font='Times New Roman','serif'][color=black]1[/color][/font][font=宋体][color=black])煮沸裂解法:原理是通过加热使细胞膜破裂,充分暴露核酸,核酸可溶解于上层水溶液中,通过高速离心沉淀变性蛋白质和细胞碎片,上清液即为核酸粗提液。此方法的操作相对简单,成本低,但由于是粗提,成分比较复杂,有时可能带来一定的体系干扰或者裂解不充分的情况,一般用于细菌定性鉴定时使用。[/color][/font][/align][align=left][font=宋体][color=black]([/color][/font][font='Times New Roman','serif'][color=black]2[/color][/font][font=宋体][color=black])苯酚氯仿抽提法:原理是苯酚和氯仿抽提除去蛋白和多糖类杂质,获得相对较为纯净的基因组核酸。成本比较低廉。缺点是试剂毒性较大,长时间操作对人员健康有较大影响。试剂需要自行配制,批次间差异显著。提取效率相对较低,不适宜少量或者微量操作。一般用于大量核酸样本的抽提。[/color][/font][/align][align=left][font=宋体][color=black]([/color][/font][font='Times New Roman','serif'][color=black]3[/color][/font][font=宋体][color=black])离心柱法:原理是利用裂解液促使细胞破碎,使细胞中的核酸释放出来,利用柱子中的载体吸附提纯核酸。它的优点是比传统的酚氯法提取纯度高、毒性低,有利于[/color][/font][font='Times New Roman','serif'][color=black]RNA[/color][/font][font=宋体][color=black]保护,而且能进行微量操作,价格较低。缺点是不便于高通量、自动化操作,对实验室设备和人员的操作技能要求较高。目前应用广泛,常用于细菌、病毒、动物组织等多种样本的核酸提取[/color][/font][sup][font='Times New Roman','serif'][color=black][13][/color][/font][/sup][font=宋体][color=black]。[/color][/font][/align][align=left][font=宋体][color=black]([/color][/font][font='Times New Roman','serif'][color=black]4[/color][/font][font=宋体][color=black])磁珠法:与离心柱的操作原理基本相同,利用交换吸附材料吸附核酸,从而将核酸和蛋白质等细胞中其他物质分离。优点是能够实现自动化、高通量操作,配合核酸自动提取仪使用,操作简单、用时短,核酸纯度高、浓度大,可广泛用应用于血液、动物组织、食品、病原微生物等样本中的[/color][/font][font='Times New Roman','serif'][color=black]DNA[/color][/font][font=宋体][color=black]和[/color][/font][font='Times New Roman','serif'][color=black]RNA[/color][/font][font=宋体][color=black]分离,但超高通量样本同时进行时,可能存在一定的污染风险。[/color][/font][/align]以上内容来自仪器信息网《PCR实战宝典》
核酸蛋白检测仪是层析分析的主要装置,核酸蛋白检测仪配上层析柱、恒流泵、部分收集器、层析谱分析系统(根据需要选配)和电脑打印设备即构成一套完整的核酸蛋白检测仪分离层析系统。它是当今从事生命科学研究、药物测定、化工、食品科学及医学研究等行业的现代分析实验仪器。核酸蛋白检测仪分析系统广泛用于工业、农业、科研和大专院校的科学研究和教学实验。其原理是根据物质(样品)对紫外光有明显吸收的特征,实现对样品成份含量比对分析,以便进行样品蛋白、核酸物质识别检测和含量测定。在生化分析、环保科学、食品研究、毒理研究、新药开发等领域中对核酸、蛋白检测、纯化和提取提供了一种独特的分析手段。
核酸提取仪有两种分类分类方式,一种是按用途进行分类,另一种是按照应用试剂的不同进行分类。(1)按照用途分类:一类是自动液体工作站,自动液体工作站是功能非常强大的设备,液体分液、吸液等自动完成,甚至可以整合扩展、检测等仪器设备,实现标本提取、扩增、检测全自动化。提取核酸只是其功能的一个应用,不太适合常规实验室提取核酸,一般都应用在单一类标本并且一次提取标本量非常大(至少96个,一般几百个)的实验需求上。自动工作站的平台建立及平台的运作,需要比较大的资金。另一类是小型的自动化仪器,小型的自动化仪器是通过运行结构的特殊设计来达到自动提取核酸的目的,可以在任何实验室得到应用,最近几年有很多机型陆续投放市场。(2)根据应用的试剂不同分类:一类是应用磁珠法试剂的仪器,另一类是应用离心柱法试剂的仪器。应用磁珠法的自动核酸提取仪操作简便,容易自动化,是目前市场上的主流,如QAGEN、Lab-Aid 820等仪器。与传统的手工操作相比核酸提取仪的优势:核酸提取仪一般具有以下的特点:(1) 无交叉污染:仪器部件未接触到生物学样本;(2) 自动化系统:每次提取工作,操作者只需要做好安装工作,布置好孔板(提供提取所需要的试剂).提取整个过程都不需要人为的帮助,仪器自动完成;(3)提取控制:在提取过程中,如果操作者需要,该系统允许您对提取过程进行控制。

[img=,257,264]http://ng1.17img.cn/bbsfiles/images/2017/06/201706301258_01_3194653_3.png[/img]Aurora全自动核酸提取系统采用专利SCODA( Synchro-nous Coefficient of Drag Alteration)电泳DNA操作技术,从具有挑战性的样品中浓缩和纯化DNA.SCODA根据DNA的物理特性选取长的带电聚合物(而非通过其其化学性质或化合物亲合力分离DNA).因此,系统可提供卓越的污染物排斥.此外,Aurora系统可从单一样本中提取高达100倍浓度,从几百分子到100微克的DNA.可高效稳定地纯化提取核酸和蛋白,尤其适合珍贵样品、低生物质低丰度样品、土壤、环境等各类型难提取样品的提取. 产品特征电泳纯化高分子量DNA的提取低生物量和严重抑制样品处理样品成本为零,适合低通量样品处理宏基因组学/NGS/光学测绘/单分子测序应用应用领域生命科学研究土壤与环境农业生物技术法医学 技术参数样品处理时间:2-4小时,样品盐度60%DNA / RNA片段大小: 500 nt RNA,300 bp - 50 kb DNA,可扩展到1Mb污染物抑制: 10-50,000X2产量: 60 uL 该系统避免了研磨、匀浆等传统方法的费力、耗时、低效等诸多缺点,通过非机械过程直接从环境样品,细胞提取物,或带电泳插头的琼脂糖中回收完整的高纯大片段DNA。DNA提取缓冲液、DNA凝胶柱可用于进行后续的克隆,归档,光学标测,或PCR、测序等遗传分析。系统可从至多5毫升稀释裂解液或洗出液中提取核酸,回收低生物质样品包括沉积物,土壤,苔原,和水样中的微量核酸。系统还可净化商业试剂盒受污染洗脱液,提高样品利用率,并无缝对接到现有的工作流程中.
你们在对样本中的核酸提取时,都使用的什么仪器去进行的提取?
想买个核酸提取仪,做动植物组织DNA荧光定量PCR检测,有什么好的仪器,国产进口都可以,请用过的推荐下。谢谢
单位计划采购自动核酸提取仪,听几个进口厂家推介了,得出来的观点相悖,特求助高人指点一二。到底是滤膜法好还是磁珠法好?是否为真正的全自动怎样去区分?高通量与否怎样鉴定?
出售赛默飞核酸提取仪kingfisher prime,仪器未使用过。开机正常。有意义私聊。[img=,690,920]https://ng1.17img.cn/bbsfiles/images/2022/11/202211120846072310_5286_4092743_3.png[/img]
问题描述:核酸提取中裂解液的使用量为多少合适?解答:[align=left][font=宋体]裂解液的用量原则是确保能彻底裂解样品,同时使裂解体系中核酸的浓度适中。浓度过低,将导致沉淀效率低,影响得率;浓度过高,去除杂质的过程复杂且不彻底,导致纯度下降。另外,裂解液的用量是以样品中蛋白质的含量为基准的,而不是以核酸含量为基准,这一点务必牢记。[/font][/align]以上内容来自仪器信息网《PCR实战宝典》
核酸质谱检测原理
[size=16px][color=#ff0000][b][url=https://www.instrument.com.cn/job/position-88822.html]立即投递该职位[/url][/b][/color][/size][b]职位名称:[/b]核酸提取试剂盒研发员-苏州市[b]职位描述/要求:[/b]岗位职责:负责针对各种临床样本的核酸提取试剂的开发和优化;配合磁珠进行核酸提取试剂盒的开发和优化;如游离DNA提取试剂盒、RNA提取试剂盒、[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]纯化试剂盒、DNA片段筛选试剂盒等。岗位要求:拥有相关学科的大专/硕士或博士学位,如生物技术、分子生物学等。至少1年以上核酸提取的开发经验,熟悉相关实验操作和技术原理。[b]公司介绍:[/b] 未名环诊是国内成立最早的环境分子诊断企业,以北京大学研究成果和团队基础,研发基于污水流行病学的大数据监测评估技术,开创了污水毒情监测业务,为各级政府提供毒情监测和溯源服务。为全国行业龙头,细分领域市场占有率超60%。与公安部、18个省级公安厅、200多个地市级公安局合作,为我国公安禁毒事业做出了巨大贡献和技术突破。 企业的发展目标为以城市生活污水为载体,不断挖掘污水中蕴含的城市大...[url=https://www.instrument.com.cn/job/position-88822.html]查看全部[/url][align=center][img=,178,176]https://ng1.17img.cn/bbsfiles/images/2021/08/202108160948175602_3528_5026484_3.png!w178x176.jpg[/img][/align][align=center]扫描二维码,关注[b][color=#ff0000]“仪职派”[/color][/b]公众号[/align][align=center][b]即可获取高薪职位[/b][/align]
试验原理:煮沸法是根据Holmex和Quigley(1985)的方法改进而成的。在基因工程中, DNA 分子的切割是由限制性内切酶 来完成的。限制性内切酶 能识别特定的 DNA 序列,在一定的条件下切断双链 DNA 。限制性内切酶的作用效率是受多方面因素影响的,如反应温度,缓冲体系,离子种类与浓度, DNA 的纯度和甲基化程度等。对 DNA 进行酶切时,首先要选择适合的缓冲液。对于单酶切,应选用该酶的最适缓冲液;对于双酶切或三酶切,应选用一种能使所有酶都充分作用的缓冲液。 DNA 的纯度对于酶切的效果的影响也很大,因为蛋白质、酚、氯仿、 SDS 等杂质都会抑制限制性内切酶的活性。琼脂 糖凝胶电泳是分离,鉴定和纯化 DNA 的常规方法。利用低浓度的荧光嵌入染料 - 溴化乙锭进行染色,可确定 DNA 在凝胶中的位置。如有必要,还可以从凝胶中 回收 DNA 条带,用于各种克隆操作。琼脂 糖凝胶的分辨能力要比聚丙烯酰胺凝胶低,但其分离范围较广。用各种浓度的琼脂糖凝胶可以分离长度为 200bp 至近 50kbp 的 DNA 。长度 100kb 或更大的 DNA ,可以通过电场方向呈周期性变化的脉冲电场凝胶电泳进行分离。在基因工程的常规操作中,琼脂糖凝胶电泳应用最为广泛。它通常采用水平电泳装置,在强度和方向恒定的电场下进行电泳。 DNA 分子在凝胶缓冲液(一般为碱性)中带负电荷,在电场中由负极向正极迁移。 DNA 分子迁移的速率受分子大小,构象。电场强度和方向,碱基组成,温度和嵌入染料等因素的影响。实验准备:1、70% 乙醇( -20 ℃)及无水乙醇( -20 ℃)2、STET 缓冲液(pH8.0 )( 8% 蔗糖, 0.5%Triton, 50mmol/L EDTA ,,10mmol/L Tris )3、1.2M 氯化钠4、TE 缓冲液(10mmol/L Tris -HCl, 1mmol/L EDTA )5、STET:0.1mol/L NaCl,10mmol/L TrisCl(pH8.0),1mmol/L EDTA(pH8.0),5%Triton X-10(其他同碱裂解法)试验步骤:1、无菌操作台上取1.5ml培养菌体置于离心管 (Eppendorf管)中,微量离心机 上10000rpm离心1min,或者以4000rpm离心5-10min,弃上清液,倒扣于干净的吸水纸上吸干。2、将菌体沉淀悬浮于350μl STET缓冲溶液中, 涡旋使其混匀。3、加入25μl新配制的溶菌酶溶液(10mg/ml,用10mmol/L Tris.Cl(pH8.0)配制), 涡旋振荡大概3秒钟。4、将eppendorf管放入沸水浴 中,40秒后立即取出。5、微量离心机 上以4℃,12000rmp离心10min。6、用无菌牙签从eppendorf管中挑去细菌碎片。7、在上清中加入40μl 5mol/L乙酸钠(pH5.2)和420μl异丙醇,振荡混匀,于室温放置5min。8、微量离心机上以4℃,12 000rmp离心5min,回收核酸沉淀。小心吸去上清液,将离心管 倒置于一张纸巾上,以使所有液体流出。再将附于管壁的液滴除尽。(可参考裂解法中的做法)。9、加入1ml70%乙醇,以4℃,12 000rmp离心2min。轻轻地吸去上清,这一步操作要格外小心,有时沉淀块贴壁不紧,去除管壁上形成的所有乙醇液滴,室温下放置,直至乙醇挥发完全,管内无可见的液体为止(大概需要2-5min)。10、用50μl无DNA酶的胰RNA酶(20μg/ml)的TE(pH8.0)溶解核酸,稍加振荡即可,贮存于-20℃。注意事项:1、大肠杆菌可从固体培养基上挑取单个菌落直接进行煮沸法提取质粒DNA。2、添加溶菌酶一定要有限度,浓度过高细菌裂解效果反而不好,有时不同溶菌酶也能溶菌。3、提取的质粒DNA中会含有RNA,但RNA并不干扰进一步实验,如限制性内切酶消化,亚克隆及连接反应等。4、试验步骤中的细菌沉淀和核酸沉淀中去除上清液时,一定要除尽。5、用 70% 的乙醇溶液洗涤核酸沉淀时一定要十分谨慎,防止将核酸同洗液一起倒掉。6、实验过程中所用的器皿和吸头 都要进行高压灭菌。7、当从表达内切核酸酶 A的大肠杆菌株(endA+株,如HB101 )中小量制粒DNA时,建议不用煮沸法。因为煮沸步骤不能完全灭活内切核酸酶 A,在Mg2+存在下温育(V中用限制酶时)质粒DNA可被降解。若要避免这一问题可以在用70%乙醇洗涤一步前增加一步用酚/氯仿进行抽提。8、如果要通过限酶切割反应来分析DNA,可取1μlDNA溶液加到另一个含8μl水的微量离心管内,加1μl 10x限制酶缓冲液和1单位所需限制酶,在适宜温度温育1-2h。将剩余的DNA贮存于-20℃。通过凝胶电泳分析经限制酸消化的DNA段。如果小量制备的DNA不被限制酶切开,很有可能在收获细菌的步骤中未能很好地去除所有上清液体。这种情况下,可用酚:氯仿抽提DNA终产物,然后用乙醇重新沉淀 DNA,通常,用5-10倍过量的酶(特别是并不昂贵的酶)在100-200μl 体积中进行消化,可以克服限制酶切割反应遇到切割反应遇到的困难。消化后, 加0. 1 体积3mol/L乙酸钠(pH5.2)和2倍体积乙醇沉淀DNA。
1、核酸抽提原理 简单地讲,核酸抽提包含样品的裂解和纯化两大步骤。裂解是使样品中的核酸游离在裂解体系中的过程,纯化则是使核酸与裂解体系中的其它成分,如蛋白质、盐及其它杂质彻底分离的过程。 经典的裂解液几乎都含有去污剂 (如 SDS、Triton X-100、NP-40、Tween 20 等) 和盐 (如Tris、EDTA、NaCl 等)。盐的作用,除了提供一个合适的裂解环境 (如 Tris),还包括抑制样品中的核酸酶在裂解过程中对核酸的破坏(如 EDTA)、维持核酸结构的稳定 (如 NaCl)等。去污剂则是通过使蛋白质变性,破坏膜结构及解开与核酸相连接的蛋白质,从而实现核酸游离在裂解体系中。裂解体系中还可能加入蛋白酶;利用蛋白酶将蛋白质消化成小的片段,促进核酸与蛋白质的分开,同时,也便于后面的纯化操作以及获得更纯的核酸。也有直接使用高浓度的蛋白质变性剂 (如GIT、GuHCl 等) 裂解的,该方法已经成为了 RNA 抽提的主流,却不是基因组 DNA 抽提的主流。 最常用的纯化方法,一是PC 抽提 + 醇沉淀,二是介质纯化。第一种方法是利用 PC对裂解体系进行反复抽提以去除蛋白质,实现核酸与蛋白质的分离;再用醇将核酸沉淀下来,实现核酸与盐的分离。第二种方法则是利用某些固项介质,在某些特定的条件下,选择性地吸附核酸,而不吸附蛋白质及盐的特点,实现核酸与蛋白质及盐的分离。高盐沉淀去除蛋白质是第一种纯化方法的一个变体,省略了 PC操作的麻烦。当然,也有不纯化的抽提方法,但是用途多局限于简单的 PCR。其它杂质 – 如多糖、多酚等 -的去除,基本上都是在这两种方法的基础上,通过增加一些特别的试剂,或者增加一些额外的步骤来实现的。2、了解你的实验样品 如果你研究某个实验样品,并且要抽提它的核酸,以下的信息一定要先行收集:该样品的核酸含量、酶含量、特殊杂质含量。如果你对样品的特点一无所知,当样品稍微有一点复杂时,抽提核酸的实验就会碰到许多问题。以血液为例,如果你不知道鸟的血液中有核细胞的含量是人血的千倍左右,而使用人血一样的起始量去抽提鸟血的基因组 DNA,怎么可能成功?失败了又怎么知道原因所在?同时,只有对实验样品有所了解,才能正确选择裂解方法。 绝大部分情况下,使用新鲜样品可以获得最好的结果。对一些杂质含量高的样品,如果使用新鲜样品抽提基因组 DNA 是碰到杂质残留过大的问题,可以试一下 -20C保存一天后再抽提的对策,可能会有意想不到的效果。样品如果因为某些原因必须先行保存,也要先简化一下样品:血液最好只保存有核细胞;将样品分割后保存,避免反复冻融。如果实验室不具备合适的保存条件,将样品先裂解后再保存,是一个不错的选择。3、裂解方法的评价 含蛋白酶的裂解方法,可以认为是抽提基因组 DNA 的首选。裂解包括膜蛋白的游离和与基因组 DNA相连接的蛋白质的游离。蛋白酶的作用是使蛋白质变小,故而对蛋白质的游离有巨大的促进作用;同时,巨大的基因组 DNA是很容易“缠”住大分子的东西的,蛋白质被蛋白酶消化变小后,则不容易被基因组 DNA“缠”住,有利于蛋白质在纯化操作中的去除,使最终获得的基因组 DNA 的纯度更高。另外一个思路是,如果基因组 DNA 与蛋白质“缠”在一起,在纯化的过程中有两种可能:如果基因组 DNA 的特性占优势,则纯化时以 DNA的形式被保留下来,导致蛋白质的残留;如果蛋白质的特性占优势,则纯化时以蛋白质的形式被去除,导致 DNA 的损失。有些样品,如肌肉,即使是RNA 抽提,也强烈建议使用含蛋白酶的裂解液 (或者在操作中的某个时候使用蛋白酶消化蛋白质),原因在于这些样品中的蛋白质,是非常难以去除的。该方法是获得最大得率和最高纯度的基础。 不使用蛋白酶的去污剂裂解方法,仍然在细胞基因组 DNA抽提方面有优势,尤其是当得率和纯度要求不是最高,而经济性及操作简单很重要时。控制好裂解液/样品的比例是该方法成功的关键。该方法结合高盐沉淀,可以实现最简单的操作,但纯度及得率的稳定性可能会比用 PC 抽提的差一些。 高浓度蛋白质变性剂 (如 GIT、GuHCl 等)的裂解方法,是抽提 RNA 的首选。总 RNA 的抽提,最重要的是快速裂解细胞膜,至于与基因组 DNA 相连接的蛋白质的裂解以及基因组与蛋白质“缠”住的问题,因为都不会对以后的纯化产生大的影响,可以不考虑。高浓度蛋白质变性剂能快速破坏细胞膜,进而迅速抑制住细胞内的 RNA酶,从而确保了 RNA 的完整性。除了极少量不适用该方法的样品 – 主要是植物,其它绝大部分样品的 RNA的抽提,都可以以高浓度的蛋白质变性剂为基础的。该方法也可用于基因组 DNA 抽提,非常快速简单,但纯度不是很高。 含 CTAB的裂解液,几乎成为富含多糖的样品,如细菌、植物的基因组 DNA 抽提的首选裂解方法。该方法成功与否与两个因素有关:一是 CTAB的质量,二是洗涤的彻底程度。CTAB 的质量对裂解效率有很大的影响,而且,似乎还说不清楚原因,因为即使是同一公司生产的纯度一样的CTAB,批号不同,效果就可能差别很大。洗涤去除 CTAB 要比其它的盐难一些,同时, CTAB的少量残留也会对酶活性有巨大影响,所以洗涤是否彻底也是该方法成功与否的关键。裂解时的温度,多使用65C;但如果发现降解严重或者得率太低,可以试一下 37C – 45C 这个相对低温的区域。 SDS碱裂解法是质粒抽提的首选裂解方法,具有快速、得率高、几乎无基因组 DNA污染的特点。控制好裂解液/菌体的比例和操作的温和是该方法成功的关键。蛋白质的沉淀效率在 4C 会更好一些,所以,加入溶液 III 后在 4C静置一段时间以及采用 4C 离心去蛋白质,都可以提高质量。该方法不一定要使用 PC 纯化,但结合 PC 纯化,可以获得纯度很高的质粒。RNA的去除可以靠在溶液 I 中加入 RNase A (100ug/ml) 或者在最后的溶解液中加入 RNase A (25 ug/ml)来实现。总的感觉是,在溶液 I 中使用 RNase A,RNA 的残留少一些。不过,经典沉淀几乎没有办法彻底去除 RNA 残留。另外,对大质粒(50 kb 以上),该方法可能会有问题。 PCR模板的简易裂解方法,也是使用面很广的一类方法。该方法的特点是无须纯化,样品被裂解后即可直接取裂解液用于PCR,非常快速。也正因为不纯化,所以,假阴性 (即没有扩增出来的阳性)比例也比较高。该方法最简单的裂解液就是水,复杂一点的就会含有一些不会抑制后续的 PCR 反应,而且能提高裂解效率,甚至还可能部分消除样品内抑制PCR 反应杂质的东西,如 Triton X-100、甲酰胺等。再复杂一点的就会含有诸如 Chelex 100之类的能吸附部分杂质的介质。操作也非常简单,多使用温度的变化来实现样品的裂解,如煮沸、或者高温-低温的多次循环等。该方法最适合从一大堆样品中找出阳性样品,但却不适合用于判断某一个样品是阳性还是阴性。降低样品使用量可以提高阳性率,因为样品量的降低,同时意味着 PCR 的抑制物量的降低。 选择了合适的裂解液,下一步就是要控制好样品与裂解液的比例。这个问题非常重要,但却没有获得足够的重视。严肃的参考资料,都应该会提供一个简单的比例,如1ml 裂解液可以用于 T mg 组织或者 C个细胞;我的建议是,你的样品量绝对要小于资料所提供的。起始样品用多大,并没有具体的说法。如果不是样品量有限,则以能抽提出满足数次成功实验所需的核酸量,作为决定样品起始量的基础,会比较合理的。不要因为 1ml 裂解液可以抽提 100mg 样品,就一定使用 100mg样品。裂解液的用量,表面上与抽提的结果 (纯度及得率)没有关系,然而,在实际操作中,对结果是有比较大的影响的。裂解液的用量原则是:确保能彻底裂解样品,同时使裂解体系中核酸的浓度适中。浓度过低,将导致沉淀效率低,影响得率;浓度过高,去除杂质的过程复杂且不彻底,导致纯度下降。另外,裂解液的用量是以样品中蛋白质的含量为基准的,而不是以核酸含量为基准,这一点务必牢记。4、纯化方法 评价 PC 抽提/醇沉淀方法,是一个永不过时的方法。稳定、可靠、经济、方便。PC抽提可以彻底去除蛋白质,醇沉淀可以去除盐,对于一般的干净的样品 (杂质为蛋白质),该方法完全可以获得高质量的核酸。虽然每次 PC抽提都会损失一部分核酸(因为不可能将水相全部移取),以及低浓度核酸的醇沉淀效率低,但这些问题都可以靠操作的调整而得以解决或者减少影响。该方法的最大的问题是不适合大规模抽提。 PC抽提是去除蛋白质的一个非常有效的手段。苯酚能使蛋白质变性,变性后的蛋白质从水相中被析出,处于苯酚中或者苯酚/水相之间。PC抽提的关键是,一要混匀彻底,二要用量足够。彻底混匀,才能确保苯酚与蛋白质的充分接触,使蛋白质完全变性。许多人总是担心混匀的剧烈程度是否会对核酸,尤其是基因组 DNA 造成破坏,实际上大可不必如此小心。剧烈的混匀操作,是会部分打断大分子的基因组 DNA,但该破坏作用不会强烈到 DNA变成 10kb 以内的小片段。手剧烈晃动混匀后,基因组 DNA 的片段,大部分会大于 20kb,这个大小,除了一些特别的要求外,对 PCR和酶切,都是完全适用的。如果要求的片段非常大,如构建文库用,则不能使用剧烈的混匀方法,而只能来回温和颠倒混匀 –此时的关键是:裂解液的比例要足够大,使体系不要太粘稠。用量要足够,是因为苯酚去除蛋白质是有一定的饱和度的。超过了该饱和度,裂解体系中的蛋白质不会被一次去除,必须靠多次抽提,方可
核酸纯化柱(微/小提)http://www.biocomma.cn/images/2mlxiaoti.jpg核酸纯化小提柱产品组成外管医疗级PP,2ml,耐受酸碱和大部分的有机溶剂,收集离心试剂。内管医疗级PP,耐受酸碱和大部分的有机溶剂,底部鲁尔接口设计,方便试剂流出。筛板特殊纤维材料,在高速离心过程中,支撑硅胶膜,保证硅胶膜的完整性,耐受酸碱和大部分的有机溶剂,厚度仅为0.3mm,孔径50um,致孔,孔隙率只有不到百分之二十,相比市场上同类产品,比面积小,静电小,DNA吸附极大降低。硅胶膜孔径1um,高盐低pH值选择性吸附DNA、RNA,低盐高pH值释放DNA、RNA压圈医疗级PP,固定筛板与硅胶膜。核酸纯化微提柱http://www.biocomma.cn/images/2mlweiti.jpg产品组成外管医疗级PP,2ml,耐受酸碱和大部分的有机溶剂,用来收集离心液。内管医疗级PP,耐受酸碱和大部分的有机溶剂,底部鲁尔接口设计,方便离心液收集。装配位(这里指装配硅胶膜、筛板和压圈处)1直径为7.4mm,与市场上核酸小量提取同等规格。装配位2,直径为5.4mm,此处为微量核酸提取装配位,面积为小量提取装配位的一半。筛板特殊纤维材料,在高速离心过程中,支撑硅胶膜,保证硅胶膜的完整性,耐受酸碱和大部分的有机溶剂,厚度仅为0.3-0.5mm,孔径50um,孔隙率只有不到百分之二十,相比市场上同类产品,比面积小,静电小,DNA吸附极低。硅胶膜孔径1um,高盐低pH值选择性吸附DNA、RNA,低盐高pH值释放DNA、RNA压圈医疗级PP,固定筛板与硅胶膜。CommaPrep™核酸微提/小提柱可用在核酸提取过程(见图1)中过柱结合、洗涤、洗脱步骤中http://www.biocomma.cn/images/nucleic-2.jpg 图1 核酸提取过程核酸吸附量:核酸纯化小提柱:0-20ug核酸纯化微提柱:0-10ug规格:2ml离心管+吸附柱 适用范围:核酸提取原理是在特定溶液环境下(高盐、低pH)使核酸吸附在固相介质(硅胶膜)上,洗涤去除杂质后,再改 变溶液环境使DN A溶解到纯水或TE中。DNA提取:核酸提取柱用于基因组DNA抽提,不需要使用平衡液。抽提缓冲液,或者结合液中需要胍盐(如硫氰酸胍等) 辅助DNA吸附到膜上。RNA提取:裂解液建议使用含有硫氰酸胍(异硫氰酸胍)可以抑制RNA酶活性,保证RNA酶完整性;可以配合Trizol使用,样品经Trizo裂解后,氯仿分相去除蛋白等杂质,取上层过柱,然后70%乙醇洗涤,即可得到纯净的RNA。【注意事项】 1.上柱前溶液的PH值应小于7;2.洗涤液中的乙醇浓度不得低于50%,一般55%--80%之间。3.最后洗脱,可以用去离子水或者TE(10 mmol/LTris-Cl,1 mmol/L EDTA (pH8.0))。如果长期保存DNA,建议使用TE。定购信息Cat#品名离心柱规格提取量包装DNAK1001CommaPrep™质粒小提纯化柱2ml0-20μg100套/包DNAK1004CommaPrep™琼脂糖凝胶回收纯化柱2ml0-10μg100套/包DNAK1007CommaPrep™ 核酸纯化柱(微小提)2ml0-10μg100套/包DNAK1008CommaPrep™基因组小提纯化柱2ml0-20μg100套/包DNAK1009CommaPrep™RNA小提纯化柱2ml0-20μg100套/包DNAK1002CommaPrep™质粒中提纯化柱15ml0-100μg20套/包DNAK1003CommaPrep™质粒大提纯化柱50ml0-500μg10套/包定制
索氏提取器的原理 从固体物质中萃取化合物的一种方法是,用溶剂将固体长期浸润而将所需要的物质浸出来,即长期浸出法。此法花费时间长.溶剂用量大、效率不高。在实验室多采用脂肪提取器(索氏提取器)来提取、脂肪提取器就是利用溶剂回流及虹吸原理,使固体物质连续不断地被纯溶剂萃取,既节约溶利萃取效率又高。萃取前先将固体物质研碎,以增加固液接触的面积。然后将固体物质放在滤纸套1内,置于提取器2中,提取器的下端勺盛有溶剂的圆底烧瓶相连,上面接回流冷凝管。加热园底烧瓶,使溶剂沸腾,蒸气通过提取器的支管3上升,被冷凝后滴入提取器中,溶剂和固体接触进行萃取,当溶剂面超过虹吸管4的最高处时,含有萃取物的溶剂虹吸回烧瓶,因而萃取出一部分物质,如此重复,使固体物质不断为纯的溶剂所苹取、将萃取出的物质富集在烧瓶中。
在索氏提取器中,经典的莫过于根据索氏抽提原理、用重量法来测定脂肪含量。 抽提法是测定粗脂肪含量*普遍的方法,抽提法利用重量法的原理,即先将样品溶于脂肪溶剂中,然后利用索氏提取器将脂肪循环抽提,*后再测出抽提前后仪器的重量差,即脂肪的重量。抽提法需要严格的实验过程,如果过程没有掌握好,很可能严重影响到脂肪的*后含量。下面,我们主要来看看用索氏抽提法测定脂肪时应该注意的事项。 (1)样品应干燥后研细,装样品的滤纸筒一定要紧密,不能往外漏样品,否则重做。 (2)放入滤纸筒的高度不能超过回流弯管,否则乙醚不易穿透样品,脂肪不能全部提出,造成误差。 (3)碰到含多量糖及糊精的样品,要先以冷水处理,等其干燥后联通滤纸一起放入提取器内。 (4)提取时水浴温度不能过高,一般使乙醚刚开始沸腾即可(约45℃左右)。回流速度以每8-12次/时为宜。 (5)所用乙醚必须是无水乙醚,如含有水分则可能将样品中的糖以及无机物抽出,造成误差。 (6)用于样品测定脂肪,可按下式计算原来样品脂肪的含量. 脂肪(﹪)=( W1-W0)/W*(100-A) 脂肪(%)= 物的耐盐性得到不同程度提高。其中Zhang和Blumwald(2001)、Zhang等(2001)报告的转AtNHX1基因番茄可耐200mmol/L的氯化钠,并把吸收的钠盐积累在叶片中,而果实的品质不受影响。这些研究预示着在提高植物耐盐性方面,离子的选择吸收和跨膜运输的基因工程是植物耐盐性种质改良的有效途径。 A-100克样品水分的含量(克). (7)冷凝管上端*好连接一个氯化钙干燥管,这样不仅可以防止空气中水分进入,而且还可以避免乙醚挥发在空气中,这样可防止实验室微小环境空气的污染。如无此装置,塞一团干脱脂棉球亦可。 (8)如果没有无水乙醚可以自己制备,制备方法如下:在1000毫升乙醚中,加入无水石膏50克,振摇数次,静置1 0小时以上蒸馏,收集35℃以下的馏液,即可应用。 (9)将提取瓶放在烘箱内干燥时,瓶口向一侧倾斜45℃放置使挥发物乙醚易与空气形成对流,这样干燥迅速。 (10)样品及醚提出物在烘箱内烘干时间不要过长,因为一些很不饱和的脂肪酸,容易在加热过程中被氧化成不溶于乙醚的物质;中等不饱和脂肪酸,受热容易被氧化而增加重量.在没有真空干燥箱的条件下,可以在100-105℃干燥1.5-3小时。 (11)如果没有乙醚或无水乙醚时,可以用石油醚提取,石油醚沸点30-60℃为好。 (12)使用挥发乙醚或石油醚时,切忌用直接火加热。应用电热套电水浴,电灯泡等.
在测定亚硝时,5009.33中使用了硼砂作为亚硝提取剂,不知这样用的原理?
质粒提取柱(大中/硅胶膜)CommaAffin™质粒中提柱http://www.biocomma.cn/images/nucleic-11.jpg产品组成外管医疗级PP,15ml,耐受酸碱和大部分的 有机溶剂 ,用来收集离心液。内管医疗级PP,耐受酸碱和大部分的 有机溶剂 ,底部鲁尔接口设计,方便离心液收集。直径11.0mm筛板特殊 纤维材料 ,在高速离心过程中,支撑硅胶膜,保证硅胶膜的完整性,耐受酸碱和大部分的 有机溶剂 ,厚度仅为0.3-0.5mm,孔径50um,孔隙率只有不到百分之二十,相比市场上同类产品,比面积小,静电小,DNA吸附极低。硅胶膜孔径1um,高盐低pH值选择性吸附DNA、RNA,低盐高pH值释放DNA、RNA压圈医疗级PP,固定筛板与硅胶膜。CommaAffin™质粒大提柱http://www.biocomma.cn/images/nucleic-3.jpg产品组成外管医疗级PP,50ml,耐受酸碱和大部分的 有机溶剂 ,用来收集离心液。内管医疗级PP,耐受酸碱和大部分的 有机溶剂 ,底部鲁尔接口设计,方便离心液收集。直径24.0mm筛板特殊 纤维材料 ,在高速离心过程中,支撑硅胶膜,保证硅胶膜的完整性,耐受酸碱和大部分的 有机溶剂 ,厚度仅为0.3-0.5mm,孔径50um,孔隙率只有不到百分之二十,相比市场上同类产品,比面积小,静电小,DNA吸附极低。硅胶膜孔径1um,高盐低pH值选择性吸附DNA、RNA,低盐高pH值释放DNA、RNA压圈医疗级PP,固定筛板与硅胶膜。CommaAffin™核酸中/大提柱可用在核酸提取过程(见图1)中过柱结合、洗涤、洗脱步骤中核酸吸附量:CommaAffin™质粒中提柱:0-100ug 规格:15ml离心管+吸附柱CommaAffin™质粒大提柱:0-500ug 规格:50ml离心管+吸附柱 http://www.biocomma.cn/images/nucleic-7.jpg 图1 质粒提取过程适用范围:核酸提取原理是在特定溶液环境下(高盐、低pH)使核酸吸附在固相介质(硅胶膜)上,洗涤去除杂质后,再改 变溶液环境使DN A溶解到纯水或TE中。质粒DNA提取:抽提缓冲液,或者结合液中需要胍盐(如硫氰酸胍等) 辅助DNA吸附到膜上。【注意事项】 1.上柱前溶液的PH值应小于7;2.洗涤液中的乙醇浓度不得低于50%,一般55%--80%之间。3.最后洗脱,可以用去离子水或者TE(10 mmol/LTris-Cl,1 mmol/L EDTA (pH8.0))。如果长期保存DNA,建议使用TE。订购信息Cat#品名柱管规格包装004407质粒中提过滤管20ml50套/包004410质粒中提过滤管30ml50套/包004416质粒大提过滤管60ml20套/包
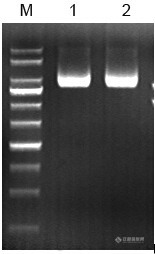
利用硅胶膜法提取纯化质粒DNA摘要:系统的阐述了质粒核酸提取过程中针对裂解和核酸纯化两大关键步骤的研究,重点介绍了利用硅胶膜法提取纯化核酸,以及在实验过程中的一些经验。关键词:硅胶膜法;纯化;质粒DNA一、前言随着分子生物学技术的发展,核酸的分子生物学技术成为了药物研发、遗传病和感染性疾病的诊断、基因研究及物种鉴定等的常用研究手段之一。然而,核酸提取质量是进行下游一系列研究的关键,因此提取的方法会直接影响后续实验。细菌质粒是一类双链闭合环状的DNA,大小范围从1kb至200kb以上不等。各种质粒都是存在于细胞质中、独立于细胞染色体之外的自主复制的遗传成份。质粒已成为目前最常用的基因克隆的载体分子,重要的条件是可获得大量纯化的质粒DNA分子。硅胶膜法是一种应用最为广泛的提取纯化质粒DNA的方法,因硅基质材料可特异吸附核酸DNA,使用方便、快捷,不需要使用有毒溶剂如酚、氯仿等,使得提取质粒核酸像过滤一样简单。二、实验部分2.1 原理硅基质材料吸附核酸的原理主要利用DNA在高盐低pH值环境下与硅基质材料相结合,在低盐高pH值环境下与硅基质材料脱离的特征。其机理是带负电荷的DNA和带正电的二氧化硅粒子之间有很强的亲和力。在高浓度盐离子的作用下,盐离子打破水中的氢和二氧化硅上带负电荷的氧离子间的氢键,DNA与硅基质紧密结合,洗涤除去其他杂质;再用低离子强度的TE缓冲液或蒸馏水洗脱结合的DNA分子,机理是当盐被清除后,再水化的硅基质破坏了基质和DNA之间的吸引力,因而DNA从硅基质上被洗脱下来。2.2 主要试剂溶液Ⅰ:50mM葡萄糖,25mM Tris-HCl(pH 8.0),10mM EDTA(pH 8.0)。溶液Ⅱ:0.2NNaOH,1% SDS。溶液Ⅲ:醋酸钾(KAc)缓冲液,pH 4.8。漂洗液:60mM 乙酸钾、10mM Tris-HCl (pH 7.5) 、60% 乙醇TE:10mMTris-HCl(pH 8.0),1mM EDTA(pH 8.0)。2.3 主要步骤该步骤采用CommaPrePTM的质粒小提纯化柱。http://ng1.17img.cn/bbsfiles/images/2015/07/201507171513_556042_3310_3.jpgCommaPrep™核酸小提柱可用在核酸提取过程中过柱结合、洗涤、洗脱步骤中http://ng1.17img.cn/bbsfiles/images/2015/07/201507171516_556043_3310_3.jpg1. 取1.5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000 rpm 离心1 min, 尽量吸除上清。 (注意:应根据所培养菌体的浓度与质粒的拷贝数,确定收集的菌液量。菌量过大可能导致溶菌不充分,纯化时会影响质粒纯度菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。2. 将细菌沉淀重悬于100uL溶液Ⅰ中,移液器或涡旋振荡器彻底悬浮细菌沉淀,使菌体分 散混匀。 (注意:如果有未彻底混匀的菌块,会影响裂解,导致提取量和纯度偏低。并且溶液Ⅰ中 要加入适量的RNA酶)3. 向离心管中加入200uL溶液Ⅱ,温和地上下翻转数次,并将离心管放置于冰上2-3min,使细胞膜裂解。(注意:温和地混合,不要剧烈震荡,以免污染基因组DNA。此时菌液应变得清亮,如果未变得清亮,可能由于菌体过多,裂解不彻底,应减少菌体量。)4. 加入150uL溶液Ⅲ,立即将管温和颠倒数次混匀,见白色絮状沉淀。12000rpm, 离心2分钟。 (注意:加入溶液Ⅲ后,要立即将管温和颠倒,避免产生局部沉淀。如果上清液中存在沉淀,可再一次离心。溶液Ⅲ为中和溶液,此时质粒DNA复性,染色体和蛋白质不可逆变性,形成不可溶复合物。)5. 吸取上清至吸附柱(内管)中(吸附柱在离心管中),尽量不要吸出沉淀,12000rpm,离心30秒。弃去废液,将吸附柱重新放入一个新的离心管中。6. 加入750uL的漂洗液(漂洗液要在实验前加入无水乙醇)12000rpm离心,1min。取出 DNA结合柱,弃废液,重新插入DNA结合柱到离心管中。7. 用500uL漂洗液重复冲洗过程。12000rpm离心,1min。(注意:重复一次可以增加质粒的回收效率。)8. 转移DNA结合柱到1个新的1.5mL离心管中,加入60uL的无核酸酶的水到DNA结合柱中,洗脱质粒DNA,室温条件下,12000rpm离心,1min。 (注意:不要转入DNA结合柱中的漂洗液,如果混有,就需要12000rpm离心,1min。洗脱缓冲液体积不少于50uL,体积小会影响回收效率。 洗脱液的pH值对于洗脱效率有很大的影响,若用水洗脱应保证pH值在7.0-8.5范围内, pH小于7会降低洗脱效率。如果长期保存DNA,洗脱液建议使用TE。)9. 加入100uL的无核酸酶水到结合柱中,洗脱质粒DNA,离心12000rpm,1min。(注意:重复一次,增加洗脱效率。)10.洗脱DNA后,从1.5mL离心管中取出DNA结合柱并废弃。11.取2uLDNA进行电泳,检测DNA质量。12.将纯化的DNA溶液于-20℃中。三、实验结果图为质粒DNA(10kb)的凝胶电泳图,说明提取效果较好。http://ng1.17img.cn/bbsfiles/images/2015/07/201507171525_556044_3310_3.jpg
[align=center]SHS[font=DengXian]静态顶空提取的适应范围,原理和操作[/font][/align][font=DengXian]高挥发性香气成分的筛选。高挥发性香气组分的定量。例如乙醛、二甲基硫醚、乙醇、丁二酮、乙酸乙酯,丁酸乙酯等,也比较适合香精香料中的残留溶剂的检测,例如乙醇、二氯甲烷、丙酮、苯系列等的检测。特别是基质不能直接进样的香精或香气样品的易挥发性香气组分的测定,例如含动植物油脂的咸味香精,含辛酸癸酸甘油酯([/font]ODO[font=DengXian])样品等,固体基质中易挥发性香气组分的筛选或测定。各种蜡质、香波、沐浴露、洗衣粉、肥皂、各种食品材料、饮料、牙膏、口香糖、香辛料、植物或植物提取物、烟叶、水果制品等样品的易挥发组分的测定。[/font][font=DengXian]静态顶空提取基本原理和操作:[/font][font=DengXian]静态顶空处理样品可能是最简单的香精或香气样品准备方法。原理也比较简单。是将待测样品放置在一可以恒温密封容器中,通过加热升温使挥发性组分从样品基体中挥发出来,在气液(或气固)两相中达到平衡后,直接抽取顶部气体进行[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]质谱分析,从而测定香精或有香气的样品中挥发性香气组分的成分和含量。[/font]

[size=18px]创安盛交通生产核酸亭,核酸站,核酸舱,移动方舱,核酸工作站,[b][url=http://www.gongjiaozhanting.com]核酸检测亭[/url][/b],核酸检测站,核酸采样亭,核酸采样站厂家定制。欢迎来到创安盛www.gongjiaozhanting.com来电咨询,让您更好的了解产品。马卡龙般的清新配色、饱满圆润的憨厚外形、舒适安全的封闭舱体,小小的核酸采样亭,不仅为医务人员提供更好的工作环境,也给前来检测的居民带来更多便利。采样亭在疫情之后,还能转换成其他公服设施,继续为城市服务。近日从西城区了解到,新一代核酸采样亭“西城盒子”正式亮相,该批次共有62座“西城盒子”将陆续投放西城区街头。采样亭别出心裁 “城市家具”品质再提升在金融街购物中心一旁的凉爽树荫下,一座浅绿色的“大盒子”静静伫立。开关启动,遮阳板通过电动液压杆缓缓翻开,形成遮阳挡雨的棚架,遮阳板下的操作台,可以摆放多种用具。[img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/08/202208252043079113_5880_5806756_3.jpg!w690x517.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/08/202208252043232695_6623_5806756_3.jpg!w690x517.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/08/202208252043382232_7794_5806756_3.jpg!w690x517.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/08/202208252043507204_2781_5806756_3.jpg!w690x517.jpg[/img][img=,690,625]https://ng1.17img.cn/bbsfiles/images/2022/08/202208252043512515_6258_5806756_3.jpg!w690x625.jpg[/img]采样点通过窗口形式提供服务,采样人员每完成一次采样后随即进行消毒。在排队等候区,工作人员指引市民完成核酸码登记,没有核酸码的市民可用身份证进行现场登记。在公园,人民医院新设的便民核酸采样亭前,一些外卖小哥正在等候采样。“以前是要到医院里才能采样,现在在公园里辟出区域进行核酸采样,就不用和就医人员一起了,方便了不少。”外卖小哥说,以往总要等上个十多分钟,现在只要三五分钟就能完成采样。“我们医院也保留了核酸采样窗口,主要服务就医患者,在公园新设的采样点,也是为了方便复工复产人员、外卖骑手和有需求的居民。[/size]
问题描述:为了保证分离核酸的完整性和纯度,在实验过程中应注意哪些?解答:[align=left][font=宋体][color=black]尽量简化操作步骤,缩短提取过程,以减少各种有害因素对核酸的破坏;减少化学因素(酶、[/color][/font][font='Times New Roman','serif'][color=black]PH[/color][/font][font=宋体][color=black])对核酸的降解,提取核酸过程中所用枪头、容器等与核酸直接接触的实验用具应保证无酶,避免核酸被酶解。为避免过酸、过碱对核酸链中磷酸二酯键的破坏,操作多在[/color][/font][font='Times New Roman','serif'][color=black]pH[/color][/font][font=宋体][color=black]为[/color][/font][font='Times New Roman','serif'][color=black]4.0-10.0[/color][/font][font=宋体][color=black]的条件下进行;减少物理因素对核酸的降解,物理降解因素主要是机械剪切力,其次是高温。[/color][/font][/align]以上内容来自仪器信息网《PCR实战宝典》
[size=3]选择材料及预处理 以蛋白质和结构与功能为基础,从分子水平上认识生命现象,已经成为现代生物学发展的主要方向,研究蛋白质,首先要得到高度纯化并具有生物活性的目的物质。蛋白质的制备工作涉及物理、化学和生物等各方面知识,但基本原理不外乎两方面。一是得用混合物中几个组分分配率的差别,把它们分配到可用机械方法分离的两个或几个物相中,如盐析,有机溶剂提取,层析和结晶等;二是将混合物置于单一物相中,通过物理力场的作用使各组分分配于来同区域而达到分离目的,如电泳,超速离心,超滤等。在所有这些方法的应用中必须注意保存生物大分子的完整性,防止酸、硷、高温,剧烈机械作用而导致所提物质生物活性的丧失。蛋白质的制备一般分为以下四个阶段:选择材料和预处理,细胞的破碎及细胞器的分离,提取和纯化,浓细、干燥和保存。 微生物、植物和动物都可做为制备蛋白质的原材料,所选用的材料主要依据实验目的来确定。对于微生物,应注意它的生长期,在微生物的对数生长期,酶和核酸的含量较高,可以获得高产量,以微生物为材料时有两种情况:(1)得用微生物菌体分泌到培养基中的代谢产物和胞外酶等;(2)利用菌体含有的生化物质,如蛋白质、核酸和胞内酶等。植物材料必须经过去壳,脱脂并注意植物品种和生长发育状况不同,其中所含生物大分子的量变化很大,另外与季节性关系密切。对动物组织,必须选择有效成份含量丰富的脏器组织为原材料,先进行绞碎、脱脂等处理。另外,对预处理好的材料,若不立即进行实验,应冷冻保存,对于易分解的生物大分子应选用新鲜材料制备。 蛋白质的分离纯化 一,蛋白质(包括酶)的提取 大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。 (一)水溶液提取法 稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。提取的温度要视有效成份性质而定。一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。下面着重讨论提取液的pH值和盐浓度的选择。[/size]
细菌DNA的提取2006-10-24 17:19这里提供的是由Marmur于1961年建立,经Dale等人简化和发展,此方法略加修改后可用于其他细菌种类。主要原理是:采用去垢剂破碎细菌细胞,酚-氯仿萃取蛋白,使用核糖核酸酶和蛋白酶K进行进一步的纯化,所提取的DNA无RNA和蛋白质污染,可用于限制性内切酶消化,分子克隆。⑴材料①20倍SSC缓冲液:3mol/l NaCl; 0.3mol/l 醋酸钠;pH 7.0(高压灭菌后,4摄氏度保存可长期使用)②酚/氯仿(1:1):一般市售的酚需要重蒸处理,市售的酚常含有杂质而呈粉色和淡黄色,需要重蒸二次,收集沸点160℃部分,小瓶分装,瓶内空腔充氮气,-20℃密封保存,以免氧化,用前从冰箱中取出,68℃蒸馏水饱和,加入8—羟基喹啉(100g酚加0.1g),酚变为黄色。8—羟基喹啉是抗氧化剂,并能部分抑制核糖核酸酶,含8—羟基喹啉的酚用等体积1.0mol/L pH 8.0Tris 缓冲液抽提,再用0.1mol/L pH 8.0含0.2%β-巯基乙醇的Tris缓冲液抽提数次,酚溶液的pH应大于7.6。此酚溶液在平衡缓冲液覆盖下4℃可保存一个月,纯化和制备酚溶液都要带手套,以免损伤皮肤。③核糖核酸酶:无DNA酶污染,将胰RNA酶(RNA酶A)溶于10mmol/LTris-Cl(pH 7.5)15mmol/L Nacl 溶液中,浓度为10mg/ml.于100℃加热15分钟,缓慢冷却至室温,分装后于-20℃保存。④蛋白酶K ⑤TES缓冲液:10mmol/L Tris-HCl, pH 8.0; 10mmol/L NaCl;1mmol/l EDTA⑵方法①取单菌落接种于5mlLB培养液中,37℃振荡培养过夜。(使用试管)②将上述菌液接种于200mlLB培养液中,37℃振荡培养过夜。(使用500ml或1000ml三角瓶)③离心,收集沉淀(5000r/m,10分钟)④将沉淀悬浮于20ml 20倍SSC缓冲液中,混匀。⑤加入200mg SDS,室温下振荡过夜,使细菌细胞充分裂解,裂解液呈粘稠状⑥加入等体积的酚/氯仿溶液,温和地混匀,细心地回收上层水相(注意不要触及二相之界面),重复萃取三次⑦加入2倍体积无水乙醇,此时可见到絮状DNA沉淀或用玻璃棒绕取收集⑧将DNA溶于15ml 2倍SSC溶液中,加入核糖核酸酶(最终浓度50ug/ml),37℃保温1小时⑨加入蛋白酶K(50ug/ml),继续保温1小时⑩加入等体积苯酚萃取一次,在回收的水相中加入2.5倍体积的无水乙醇,-20℃静止过夜25000g,4℃,离心15分钟,收集沉淀,用-20℃无水乙醇洗涤一次;将DNA在真空干燥器中抽干,溶于10mlTES缓冲液中,4℃保存备用。⑶说明①本方法可用于其他种类细菌,但是溶菌条件需略加修改,对革兰氏阳性菌(如葡萄球菌),在SDS处理前需要使用溶菌酶裂解细胞壁,对于另外一些细菌(如分枝杆菌),在加入SDS后,将溶液加温至65℃是可取的。②一些种类的细菌含大量核酸酶,去垢剂不能完全抑制其活性,用TES缓冲液代替SSC缓冲液可通过EDTA的作用抑制核酸酶活性,必须注意的是,TES缓冲液离子强度较低,在加入乙醇之前需用醋酸钠调节DNA溶液的离子强度(醋酸钠的最终浓度为0.3mol/L)③DNA溶液中残留少量酚和氯仿,可在乙醇沉淀之前用水饱和乙醚萃取去除④比较纯净的DNA溶液的A260/A280及A260/A235大于1.7
问题描述:核酸洗涤过程中应注意什么?解答:[font=宋体]洗涤对于整个提取过程来说,也是非常重要的。洗涤,首先一定要将沉淀悬浮起来;第二就是要控制一定的时间,尤其是当核酸沉淀比较大时[/font][font='Times New Roman','serif'] ([/font][font=宋体]使核酸沉淀最终蓬松[/font][font='Times New Roman','serif'])[/font][font=宋体];第三是少量多次;第四则是去上清要彻底。大部分资料中的操作基本上都是[/font][font='Times New Roman','serif']“[/font][font=宋体]倒掉上清后倒置在吸水纸上片刻[/font][font='Times New Roman','serif']”[/font][font=宋体],这一说法,对于质量好的离心管,如果离心管是经过硅化的,因为液体几乎不挂壁,所以上清可以去除得非常彻底;好的离心管,即使没有经过硅化,残留量也非常少,也没有什么问题;差的离心管,液体挂壁非常可观,其残留量多到会影响后续的实验。避免液体残余的一个好方法,就是倒掉液体后再短暂离心,将残液用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]吸出。还有需大家牢记的是,残液中都含有上一步操作中的杂质,其残留量与混匀程度、核酸沉淀的大小都有关。挥发时去掉的是乙醇,杂质是不会被挥发去除的。这步,切忌不要用手甩,这样容易将核酸甩掉。另外,核酸沉淀的大小及裂解液的裂解能力也决定了洗涤的强度。沉淀越大,裂解液的裂解能力越强,洗涤越要彻底:放置时间相对要长一点,洗涤次数也要考虑增加。[/font]以上内容来自仪器信息网《PCR实战宝典》
2022年新冠疫情来势汹汹,做核酸成为许多人的日常,核酸检测实验也成为许多生物实验人的日常。核酸检测实验过程复杂,病毒灭活是非常重要的一步,其中,水浴锅作为常见的恒温仪器,在病毒灭活中发挥着重要作用。[img=,630,]https://pic1.zhimg.com/80/v2-e8a3063325978b82ec93ba0bb143a178_720w.jpg[/img][b][i]一、哪个实验步骤能用到水浴锅?[/i][/b]核酸检测过程复杂,包括信息录入、核酸提取、[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]基因扩增[/color][/url]、结果分析等环节。核酸样本收集之后,首先要做的就是将样本中的病毒进行灭活,灭活之后才能开启信息录入、核酸提取等一系列的环节。经研究人员测试发现,新冠病毒对紫外线和热敏感,只需高温就可以把新型冠状病毒灭活。目前,国家卫健委相关指南就要求,在提取样本核酸前需将样本置于56℃以上以灭活病毒。因此,将病毒样品放入56℃的恒温水槽或是水浴锅中,高温消毒30分钟以上,成为新冠病毒灭活的常用方法。[img=,623,]https://pic2.zhimg.com/80/v2-5cb88675f34cdc6a354f242c10bb2679_720w.jpg[/img][b][i]二、力辰水浴锅的优势有哪些?[/i][/b]疫情反复突增,核酸检测任务量大且紧急,缩短实验时间,提升检测效率成为各生物实验室的亟需解决的痛点之一。力辰数显恒温水浴锅,控温精准、升温迅速、性能稳定,可以有效缩短预热时间,精准控制加热温度,适用于实验室[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]核酸检测的病毒灭菌环节。[img=,625,]https://pic1.zhimg.com/80/v2-4746ea8d3c01f1bf78f7097bd45b94a0_720w.jpg[/img][b]1、微电脑控温仪表、PT100温度传感器,控温准确[/b]力辰数显恒温水浴锅采用抗振动、稳定性好、准确度高、耐高压的PT100温度传感器,同时使用数显控温仪表,按键控制,能做到准确控温。从控温精度来看,力辰水浴锅的温度范围在室温+5℃-100℃之间,控温精度≤±1℃,部分机型可做到≤±0.5℃的控温精度,充分满足用户精准控温需求。[img=,588,]https://pic4.zhimg.com/80/v2-fa2d2ed62ded9533223366a99f5c7ccb_720w.jpg[/img][b]2、大功率变压器,升温快、受热均匀[/b]机身内部设有大功率变压配套电路板,可控硅控制,配套不锈钢加热管,升温速度快。容积3-38L的水浴锅,由室温升至沸点(100℃)均小于70分钟。同时部分型号配备磁力搅拌功能,边加热边搅拌,使受热更均匀,能有效缩短实验时间,提升实验效率。[img=,602,]https://pic2.zhimg.com/80/v2-e2358e4366ba4e4495eb331b077ec195_720w.jpg[/img][b]3、可拆卸式锅盖,适配多种规格容器、保温性能高[/b]锅盖采用可拆卸式,能适配多种规格容器,保温性能好,有效保证温度精准性,确保样本处在稳定的恒温环境中;同时采用耐高温塑料,使用寿命长,节约实验室成本。[img=,619,]https://pic2.zhimg.com/80/v2-4e01da7de94c634a57134b428b0e845d_720w.jpg[/img][b]4、冷轧钢外壳、304不锈钢内胆,耐腐蚀性强、易清洗[/b]外壳采用冷轧钢,防生锈、防静电;内胆使用优质304不锈钢,一次性冲压成型,耐腐蚀,易清理消毒,杜绝病毒的残留。[img=,616,]https://pic3.zhimg.com/80/v2-d1b917968d59035122412f8b341f8162_720w.jpg[/img]在生物和制药行业,水浴锅是必备的实验仪器。核酸检测、疫苗研制等需要灭活病毒的实验,其他需要培养微生物的实验等等,都需要水浴锅提供恒温环境;除此之外,水浴锅可以结合旋转蒸发器、真空冷冻干燥箱等仪器,进行多功能化学反应作业及药物储存,用途十分广泛。【参考文献】张沁欣,赵庆顺.(2020).病毒核酸提取前的高温灭活过程显著降低可检出病毒核酸模板量.[ChinaXiv:202002.00034]
[font=宋体][font=宋体]在生物细胞的世界里,膜蛋白是一个不可或缺的角色。它们不仅参与细胞的识别、信号转导和物质运输等重要功能,还成为了药物研发的重要靶点。动物细胞的膜脂主要有[/font][font=Calibri]9[/font][font=宋体]种,而膜蛋白的种类繁多,虽然多数膜蛋白分子数量较少,但它们赋予了细胞膜至关重要的生物学功能。[/font][/font][font=宋体]根据与脂分子的结合方式和分离难易程度,膜蛋白主要分为外在膜蛋白和内在膜蛋白两大类。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体])外在膜蛋白为水溶性蛋白,通过离子键或其它较弱的键与膜表面的蛋白质分子或脂分子结合。因此,通过改变溶液的离子强度或提高温度,就可以轻松地从膜上分离出来,而不会破坏膜的结构。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体])内在膜蛋白与膜结合非常紧密,一般只有用去垢剂[/font][font=Calibri](detergent)[/font][font=宋体]使其膜解后才可分离出来。[/font][/font][b][font=宋体]膜蛋白提取方法:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1)[/font][font=宋体]膜蛋白色谱[/font][font=Calibri](Chromatography of Membrane Protein,CMP)[/font][font=宋体]:[/font][font=Calibri]CMP[/font][font=宋体]分离强疏水性蛋白、多肽混合物的层析系统,一般有去垢剂(如[/font][font=Calibri]SDS[/font][font=宋体])溶解膜蛋白后形成[/font][font=Calibri]SDS-[/font][font=宋体]融膜蛋白,并由羟基磷灰石为固定相的柱子分离纯化。羟基磷灰石柱具有阴离子磷酸基团([/font][font=Calibri]P-[/font][font=宋体]端),又具有阳离子钙([/font][font=Calibri]C-[/font][font=宋体]端),与固定相结合主要决定于膜蛋白的大小、[/font][font=Calibri]SDS[/font][font=宋体]结合量。利用原子散射法研究[/font][font=Calibri]cAMP[/font][font=宋体]的分离机制发现,样品与[/font][font=Calibri]SDS[/font][font=宋体]结合后在离子交换柱上存在[/font][font=Calibri]SDS[/font][font=宋体]分子、带电荷氨基酸与固定相中带电离子间的交换,从而达到分级分离的目的。[/font][/font][font=宋体][font=Calibri]2)[/font][font=宋体]顺序抽提法:根据细胞蛋白溶解性的差异,用具有不同溶解能力的蛋白溶解液进行抽提的方法。用[/font][font=Calibri]Tris[/font][font=宋体]碱溶液裂解细胞提取高溶解性蛋白;把未溶解的沉淀用标准液溶解提取高疏水性蛋白;最后用含复合表面活性剂的蛋白溶解液,可以再次抽提前两次抽提后不能溶解的膜蛋白。[/font][/font][font=宋体][font=Calibri]3)[/font][font=宋体]离心蛋白提取法([/font][font=Calibri]centrifugal protein extraction[/font][font=宋体])[/font][/font][font=宋体]原理:高渗的蛋白裂解液让细胞溶胀破裂后,超高速离心[/font][font=宋体][font=Calibri]4)detergent-based[/font][font=宋体]:提取时先用裂解液裂解胞膜(选用不同的去污试剂是关键),梯度离心分离细胞器[/font][font=Calibri](ER)[/font][font=宋体],然后分级抽提方法。例如,去掉细胞器之后的[/font][font=Calibri]DEBRIS[/font][font=宋体]就是核膜,再裂解得到核膜蛋白。而膜蛋白是裂胞膜时不溶的部分。[/font][/font][font=宋体]总的感受:细胞的量要很充足。之后的定性鉴定常用的方法有双向免疫扩散、免疫电泳及聚丙稀酰胺凝胶电泳等。纯化蛋白质浓度的定量测定可用双缩脲法、酚试剂法或紫外光吸收法定量鉴定膜蛋白,方便迅速。[/font][font=宋体] [/font][font=宋体]除了上述的提取方法,还有其他一些方法可以用于提取膜蛋白。例如,可以采用超声波破碎法或反复冻融法来破坏生物膜的结构,从而使膜蛋白释放出来。此外,还可以使用一些特殊的分离技术,如超离心或凝胶电泳,来分离和纯化膜蛋白。[/font][font=宋体] [/font][font=宋体]值得注意的是,不同的膜蛋白具有不同的性质和稳定性,因此需要采用不同的提取方法。在选择提取方法时,需要考虑的因素包括目标膜蛋白的分子量、溶解度、稳定性以及生物膜的组成和性质等。[/font][font=宋体] [/font][font=宋体]总之,提取和纯化膜蛋白是一项具有挑战性的任务,需要综合考虑多种因素。通过对不同方法的了解和比较,我们可以根据实际需求选择合适的方法来提取和纯化目标膜蛋白,为进一步的研究和应用奠定基础。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein][b]多次跨膜蛋白开发技术平台[/b][/url],详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[b][font=宋体]一、质粒提取的原理:[/font][/b][font=宋体] [/font][font=宋体][font=宋体]质粒是细胞内的一种环状的小分子[/font][font=Calibri]DNA[/font][font=宋体],是进行[/font][font=Calibri]DNA[/font][font=宋体]重组的常用载体。作为一个具有自身复制起点的复制单位独立于细胞的主染色体之外,质粒[/font][font=Calibri]DNA[/font][font=宋体]上携带了部分的基因信息,经过基因表达后使其宿主细胞表现相应的性状。在[/font][font=Calibri]DNA[/font][font=宋体]重组中,质粒或经过改造后的质粒载体可通过连接外源基因构成重组体。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]从宿主细胞中提取质粒[/font][font=Calibri]DNA[/font][font=宋体],是[/font][font=Calibri]DNA[/font][font=宋体]重组技术中最基础的实验技能。分离质粒[/font][font=Calibri]DNA[/font][font=宋体]有三个步骤:培养细菌使质粒扩增,收集和裂解细菌,分离和纯化质粒[/font][font=Calibri]DNA[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]在质粒提取过程中,由于机械力、酸碱度、试剂等的原因,可能使质粒[/font][font=Calibri]DNA[/font][font=宋体]链发生断裂。所以,多数质粒粗提取物中含有三种构型的质粒:共价闭合环状[/font][font=Calibri]DNA[/font][font=宋体]([/font][font=Calibri]cccDNA[/font][font=宋体]): 质粒的两条链没有断裂;超螺旋开环[/font][font=Calibri]DNA[/font][font=宋体]([/font][font=Calibri]ocDNA[/font][font=宋体]): 质粒的一条链断裂;松弛的环状分子线形[/font][font=Calibri]DNA[/font][font=宋体]([/font][font=Calibri]lDNA[/font][font=宋体]): 质粒的两条链均断裂;线性分子质粒[/font][font=Calibri]DNA[/font][font=宋体]的分子构型 。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]质粒[/font][font=Calibri]DNA[/font][font=宋体]琼脂塘凝胶电泳模式图可分为:松弛线性的[/font][font=Calibri]DNA[/font][font=宋体]; 松弛开环的[/font][font=Calibri]OC[/font][font=宋体]构型; 超螺旋的[/font][font=Calibri]SC[/font][font=宋体]构型。由于琼脂糖中加有嵌入型染料溴化乙锭,因此,在紫外线照射下[/font][font=Calibri]DNA[/font][font=宋体]电泳带成橘黄色。 道中的[/font][font=Calibri]SC DNA[/font][font=宋体]走在最前沿,[/font][font=Calibri]OC DNA[/font][font=宋体]则位于凝胶的最后边;道中的[/font][font=Calibri]L DNA [/font][font=宋体]是经核酸内切限制酶切割质粒之后产生的,它在凝胶中的位置介于[/font][font=Calibri]OC DNA [/font][font=宋体]和 [/font][font=Calibri]SC DNA [/font][font=宋体]之间。[/font][/font][font=宋体] [/font][font=宋体][b]二、质粒提取方法[/b][/font][font=宋体] [/font][font=宋体][font=宋体]质粒[/font][font=Calibri]DNA[/font][font=宋体]的提取方法主要有碱裂解法、煮沸法、酚氯仿裂解法。跟据不同的实验目的和仪器设备择取不同的实验方案。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]三、质粒提取的常见问题[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]时间控制问题[/font][/font][font=宋体] [/font][font=宋体][font=宋体]裂解时间太长,加入溶液[/font][font=Calibri]P2[/font][font=宋体]后裂解时间不应超过[/font][font=Calibri]5 [/font][font=宋体]分钟;吸附时间不够;溶解时间不够都会导致质粒[/font][font=Calibri]DNA[/font][font=宋体]提取实验失败。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]大肠杆菌老化[/font][/font][font=宋体] [/font][font=宋体]建议涂布平板培养后,重新挑选新菌落进行液体培养。[/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]质粒拷贝数低[/font][/font][font=宋体] [/font][font=宋体][font=宋体]由于使用低拷贝数载体引起的质粒[/font][font=Calibri]DNA [/font][font=宋体]提取量低,可更换具体相同功能的高拷贝数载体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]溶液使用不当[/font][/font][font=宋体] [/font][font=宋体][font=宋体]溶液[/font][font=Calibri]P2[/font][font=宋体]、[/font][font=Calibri]P3 [/font][font=宋体]在温度较低时可能出现浑浊,应置于[/font][font=Calibri]37[/font][font=宋体]℃保温片刻直至溶解为清亮的溶液,才能使用。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5.[/font][font=宋体]吸附柱过载[/font][/font][font=宋体] [/font][font=宋体][font=宋体]不同产品中吸附柱吸附能力不同,如果需要提取的质粒量很大,请分多次提取。若用富集培养基,例如[/font][font=Calibri]TB [/font][font=宋体]或者 ×[/font][font=Calibri]YT [/font][font=宋体]菌液体积必须减少;若质粒或宿主菌是非常高的拷贝数或生长率,则需调整[/font][font=Calibri]LB [/font][font=宋体]培养液体积。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6.[/font][font=宋体]质粒未全部溶解[/font][/font][font=宋体] [/font][font=宋体]洗脱溶解质粒时,可适当加温或延长溶解时间。[/font][font=宋体] [/font][font=宋体][font=Calibri]7.[/font][font=宋体]乙醇残留[/font][/font][font=宋体] [/font][font=宋体]漂洗液洗涤后应离心尽量去除残留液体,树脂型试剂盒漂洗后应晾干树脂,再加入洗脱缓冲液。[/font][font=宋体] [/font][font=宋体][font=Calibri]8.[/font][font=宋体]洗脱液加入位置不正确[/font][/font][font=宋体] [/font][font=宋体]洗脱液应加在硅胶膜中心部位以确保洗脱液会完全覆盖硅胶膜的表面达到最大洗脱效率。[/font][font=宋体] [/font][font=宋体][font=Calibri]9.[/font][font=宋体]洗脱液不合适[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]DNA [/font][font=宋体]只在低盐溶液中才能被洗脱。洗脱效率取决于[/font][font=Calibri]pH [/font][font=宋体]值。最大洗脱效率在[/font][font=Calibri]pH7.0[/font][font=宋体]~ [/font][font=Calibri]8.5 [/font][font=宋体]间。当用水洗脱时确保其 [/font][font=Calibri]pH [/font][font=宋体]值在此范围内,如果[/font][font=Calibri]pH [/font][font=宋体]过低可能性导致洗脱量低。洗脱时将灭菌蒸馏水或洗脱缓冲液加暖至 [/font][font=Calibri]60 [/font][font=宋体]℃后使用有利于提高洗脱效率。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]10.[/font][font=宋体]洗脱体积太小[/font][/font][font=宋体] [/font][font=宋体]洗脱体积对来回收率有一定影响。随着洗脱体积的增大回收率增高,但产品浓度降低。为了得到较高的回收率可以增大洗脱体积[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州能够提供快速、高通量、高品质以及个性化的[url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]质粒[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]DNA[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]制备服务[/b][/url]。不仅满足实验室研究人员的小量质粒[/font][font=Calibri]DNA[/font][font=宋体]制备需求,也可为生物工业用户和医药公司等提供大规模的质粒[/font][font=Calibri]DNA[/font][font=宋体]制备服务。义翘神州升级改造后的质粒[/font][font=Calibri]DNA[/font][font=宋体]制备平台,采用[/font][font=Calibri]GMP[/font][font=宋体]级别的生产线,对过程和最终产品的严格管控,确保了最终产品质量符合客户需求。义翘神州可以提供从μ[/font][font=Calibri]g[/font][font=宋体]级别,[/font][font=Calibri]mg[/font][font=宋体]级别至[/font][font=Calibri]g[/font][font=宋体]级别不同规模的科研级和工业级别的质粒生产服务,满足不同的需求。详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/plasmid-dna-preparation-service[/font][/font]
核 酸 的 定量测定在生物分析化学中是一个十分重要的课题川.利用核酸对小分子荧光探针的荧光增强或碎灭作用来研究小分子探针和DNA的相互作用或进行核酸的定量分析,方法比较简单,应用较广Ir1.我们观察到阳离子荧光染料甲苯胺蓝与DNA相互作用时,荧光被碎灭.基于此原理,建立了高灵敏荧光分光光度法测定DNA和RNA的新方法.所用试剂简单、操作简便,且受背景荧光干扰小.