关于固定污染源低浓度颗粒物测定方法标准,你应该知道的几件事
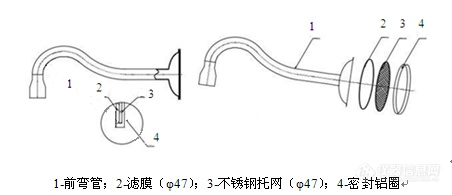
p span style=" color: rgb(0, 112, 192) " 为什么要针对低浓度颗粒物测定制定一个新标准? /span /p p 目前,许多地方已根据政府工作报告中提出的“推进燃煤电厂低浓度排放改造”要求,确定了相关规定,明确颗粒物排放不得高于 10 mg/m3,某些省份规定不得高于 5 mg/m3。 /p p 我国现阶段颗粒物监测方法采用GB/T16157-1996《固定污染源排气中颗粒物测定与气态污染物采样方法》,在颗粒物浓度较低、烟气湿度较大的情况下,此方法易造成监测结果不准确,主要原因是:(1)沉积在采样嘴及采样管前段的颗粒物无法回收,导致结果偏低 (2)在湿烟气情况下长时间采样容易造成滤筒纤维损失或破损,产生的误差降低颗粒物采样准确度。 /p p 为解决这些问题,满足现行污染源排放的监测需求,总站制定了《固定污染源废气 低浓度颗粒物测定 重量法》标准。 /p p span style=" color: rgb(0, 112, 192) " 低浓度颗粒物方法标准的技术路线是什么? /span /p p 标准的技术路线为“烟道内过滤-恒温恒湿平衡-整体称重”。 /p p 烟道内过滤,就是在烟道或烟囱内对颗粒物进行等速采样,并将颗粒物截留在位于烟道或烟囱内的过滤介质上的方法。目前国际上主要有烟道内过滤和烟道外过滤两种方式,和烟道内过滤比,烟道外过滤存在仪器结构复杂,方法检出限高,现场工作量较大的缺点。 /p p 恒温恒湿平衡,就是样品在采样前后要在温度20± 1℃、湿度50± 5% RH的状况下稳定后称量,和以往的冷却干燥称量方式相比,恒温恒湿平衡可以有效减少称量波动,提高称量的稳定性。 /p p 整体称重,就是将滤膜封装在金属采样头内采样,并将采样头整体在采样前后进行称量的方式。这种方式能有效避免滤膜破损,并保证沉积在采样嘴及采样管前段的样品得到回收。 /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201707/insimg/c5fe7ff7-4aee-43fc-9f79-1fb023f4b0ec.jpg" title=" 微信图片_20170706105924.png" / /p p style=" text-align: center " 整体式采样头结构图 /p p span style=" color: rgb(0, 112, 192) " 这个标准的方法检出限是多少? /span /p p 当采样体积为 1 m3(标准状态下的干废气)时,本标准方法检出限为 1.0 mg/m3。 /p p span style=" color: rgb(0, 112, 192) " 什么是测量系列? /span /p p 本标准提出了测量系列的概念,测量系列指在工况基本相同、污染处理设施保持稳定运行的条件下,在同一采样平面内进行的一系列测量。也即是说,测量系列内的样品,采集时的锅炉和污染处理设施运行是基本相同的。 /p p span style=" color: rgb(0, 112, 192) " 什么是全程序空白?它有什么意义? /span /p p 本标准提出了全程序空白的概念,全程序空白指除采样过程中采样嘴背对气流不采集废气外,其它操作与实际样品操作完全相同获得的样品。 /p p 采样全程序空白时,采样嘴应背对废气气流方向,采样管在烟道中放置时间和移动方式与实际采样相同。全程序空白应在每次测量系列过程中进行一次,并保证至少一天一次。为防止在采集全程序空白过程中空气或废气进入采样系统,必须断开采样管与采样器主机的连接,密封采样管末端接口。 /p p 全程序空白是一种质控措施,是衡量样品在测定过程中是否受到污染的一种手段。任何低于全程序空白增重的样品均无效。全程序空白增重除以对应测量系列的平均体积不应超过排放限值的10%。另外,颗粒物浓度低于方法检出限时,对应的全程序空白增重应不高于 0.5 mg,失重应不多于 0.5 mg。 /p p span style=" color: rgb(0, 112, 192) " 什么是同步双样?同步双样的意义是什么? /span /p p 本标准提出了同步双样的概念,可作为衡量测定是否准确的一种质控措施。同步双样是指固定污染源颗粒物测量过程中,使用同一测量系列(使用同一采样孔采样时)或在同一时间使用两个对称的测量系列(使用不同的采样孔时)得到的两个样品。 /p p 也就是说,同步双样的两个样品在采集过程中的任何时刻均处于大致相同的位置(同一采样孔)或烟气状态基本相同、对于烟道采样平面基本对称的位置(不同采样孔)。 /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201707/insimg/632eeb9a-5c45-4487-9709-3c4efa06f35d.jpg" title=" 微信图片_20170706105930.jpg" / /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201707/insimg/3746759c-aebf-4554-acf4-fc2c9109524d.jpg" title=" 微信图片_20170706105934.jpg" / /p p style=" text-align: center " strong 采样头现场安装 /strong /p