下列哪类物质是酵母菌细胞壁主要的成分()。 A、甘露聚糖 B、脂质 C、无机盐 D、蛋白质
大家在做食包材或者药包材中氯乙烯单体检测时用的什么型号的柱子呢?效果如何?
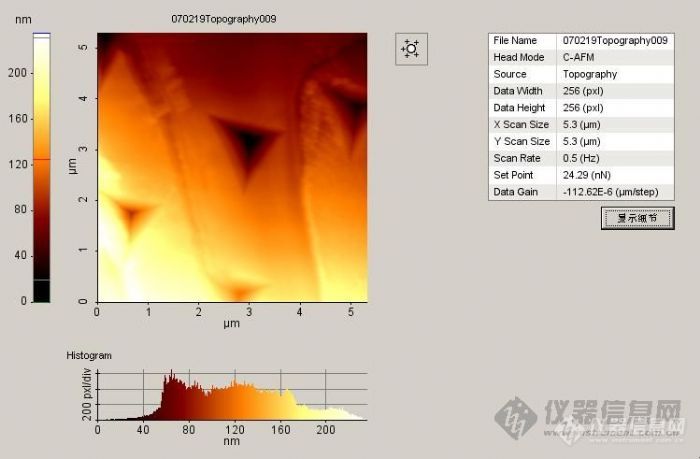
近期做成了木材细胞壁纳米压痕图片,大家欣赏下^_^[img]http://ng1.17img.cn/bbsfiles/images/2007/07/200707061511_57364_1615676_3.jpg[/img]
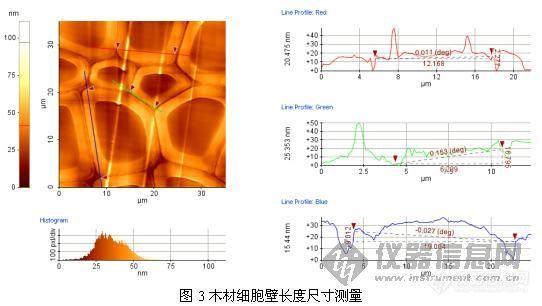
原子力显微镜(AFM)是我们学校新进的大型仪器设备之一。与光学显微镜及电子显微镜不同,AFM可利用微小探针“摸索”样品表面来获得信息。其成像原理决定了它具备其他显微技术所不具有的优点:受工作环境限制较少,可以在真空、气相、液相和电化学的环境下操作;可以对导体、半导体、绝缘体等多种样品成像,样品制备简单,且对样品的破坏性较小;具有原子级高分辨率,可得到观测表面的三维立体图像,并能获得探针与样品相互作用的信息。AFM可以观察许多不同材料的原子级别的高分辨表面形貌与结构,是一种新型的表面结构分析仪器。它的出现使人类在认识和改造自然方面进入一个新的层次,已被广泛应用于高分子材料、生物学以及生命科学等领域。近年来,研究人员也开始将这种新型的表面分析技术应用于木材微观结构的研究。这为人们进一步认识和了解木材微观世界,提供了一种有效的分析手段。目前在木材科学与技术领域内的研究内容主要包括两个方面:一方面是材料表面形貌、相结构的表征,在微米、纳米的范围内获取图像。另一方面是木质材料细胞壁的力学性能,如硬度、弹性模量和屈服强度的测量。我是实验室参加工程师培训的人员之一,由于课题的需要,我尝试利用AFM技术对杨木木纤维形态尺寸特性进行了测量,具体测量与分析方法如下:1材料与方法1. 1 试样制备试材为速生杨木,切削成横截面尺寸为5 mm×1 mm×5-8mm的木片,再用Spurr树脂进行包埋,然后用超薄切片机(LKB-2188,瑞典)进行表面抛光。1.2 测试方法测量时,将用双面胶固定在钢制样品垫上,再放置在原子力显微镜(AFM XE-100型,PSIA公司)的样品台上(磁铁固定)进行扫描。AFM主要参数设定如下:接触模式,扫描速度和扫描力分别为0.5Hz和1.08nN。2 图像处理图像扫描后还需要通过原子力显微镜配套软件(XEI 1.5)进行数据处理与分析。得到原始的形貌像之后,图像处理主要步骤如下:第一步是斜度校正(Slope Correction ),为的是消除样品倾斜或弯曲(极小程度)造成的图像失真。通过软件的拉平(Flatten )功能可以方便地消除x, y方向的图像倾斜。第二步是消除噪声,保证图像的真实性。第三步根据需要还可以对图像进行滤波、放大、灰度转换、改变像素以及切面、输出3D图像等操作图。处理图像结束后得到了相对真实的表面形貌图,再直接进行分析。图1是一组木材横切表面斜度校正处理前后的表面形貌图。3 杨木细胞壁特征参数测量杨木细胞壁特征参数测量是通过原子力显微镜配套软件(XEI 1.5)来实现的。测量原理与方法见图所示。其中图2和图3分别为AFM扫描的杨木表面形貌图及细胞壁厚度、长度尺寸测试图。通过测量可知,所测杨木细胞横截面的壁厚尺寸为1.026-4.082μm;壁长为2.195-21.004μm。这与前人的研究结论相一致。这说明原子力显微镜完全可以在微/纳米尺度下对木材的细胞形态特征进行测量。http://ng1.17img.cn/bbsfiles/images/2009/01/200901081623_128216_1615676_3.jpghttp://ng1.17img.cn/bbsfiles/images/2009/01/200901081625_128217_1615676_3.jpghttp://ng1.17img.cn/bbsfiles/images/2009/01/200901081627_128220_1615676_3.jpg
目前血细胞分析仪检测原理包括电学和光学两种,电学包括电阻抗法和射频电导法,光法包括激光散射法和分光光度法。电阻抗法根据Coulter原理及血细胞非传导的性质,以电解质溶液中悬浮的血细胞在通过计数小孔时引起的电阻变化进行检测为基础,进行血细胞计数和体积测定。当有细胞通过小孔时,由于电阻增加,于瞬间引起电压变化及通过脉冲。细胞体积越大,脉冲振幅越高,细胞数量越多,脉冲数量也越多。脉冲信号经过:放大、阈值调节、甄别、整形、计数而得出细胞技术结果。电阻抗法可准确量出细胞(或类似颗粒)的大小,是三分类血液分析仪的主要应用原理,并与光学检测原理组合应用于五分类血液分析仪中。激光散射法应用了流式细胞术检测原理及细胞通过激光束被照射时,产生与细胞特征相应的各种角度的散射光。对经信号检测器接受的散射光信息进行综合分析,即可准确区分正常类型的细胞。激光散射法在区别体积相同而类型不同的细胞特征时,比电阻抗法分群更加准确。故激光散射法已成为现代五分类血液分析仪的主要检测原理之一。射频电导法是用高频电磁探针渗入细胞膜脂质可测定细胞的导电性,提供细胞内部化学成分、细胞核和细胞质、颗粒成分等特征信息。射频电流是每秒变化大于10000次的高频交流电磁波,能够通过细胞壁。分光光度法是所有类型的血细胞分析仪检测血红蛋白的原理,它利用血红蛋白与溶血剂在特定波长下比色,吸光度的变化与液体中血红蛋白含量成比例。
[size=3][font=Times New Roman]求美国丙烯腈单体检测标准 U.S.FDA CFR 21 181.32 or 180.22里面只有一些技术指标,有具体的标准方法,可就是没找着,哪位兄弟帮帮忙。“[color=blue][font=Arial]Gas-Solid Chromatographic Procedure for Determining Acrylonitrile Monomer in Acrylonitrile-Containing Polymers and Food Simulating Solvents[/font][/color]”[font=Arial][color=blue]“Determination of β-Dodecyl-mercaptopropionitrile in NR–16R Aqueous Extracts”[/color] and [color=blue]“Measurement of β-(2-Hdroxyethylmercapto) Propionitrile in Heptane Food-Simulating Solvent,”谢谢了[/color][/font][/font][/size]
[size=3][font=Times New Roman]求美国丙烯腈单体检测标准,食品接触材料的。U.S.FDA CFR 21 181.32 or 180.22里面只有一些技术指标,有具体的标准方法,可就是没找着,哪位兄弟帮帮忙。“[/font][color=blue][font=Arial]Gas-Solid Chromatographic Procedure for Determining Acrylonitrile Monomer in Acrylonitrile-Containing Polymers and Food Simulating Solvents[/font][/color][/size][size=3][font=Times New Roman]”[/font][color=blue][font=Arial]“Determination of β-Dodecyl-mercaptopropionitrile in NR–16R Aqueous Extracts”[/font] and [/color][color=blue][size=3]“Measurement of β-(2-Hdroxyethylmercapto) Propionitrile in Heptane Food-Simulating Solvent,”谢谢了[/size][/color][/size]
[align=center][font='calibri'][size=13px]生乳体细胞检测[/size][/font][/align]1、 [size=18px]生乳体细胞检测目的及意义[/size][size=18px]体细胞数的英文是Somatic Cell Count , 缩写为SCC是指出现在正常牛奶中少量的动物身体细胞。以每毫升牛奶中的体细胞数表示,通常以千个计数。体细胞( scc ) 的组成,白细胞 (即巨噬细胞、嗜中性白细胞和淋巴细胞)和上皮细胞。[/size][size=18px]体细胞(SCC)越低牛奶质量越高SCC越高对原奶质量的影响越大,并对牛奶的保质期和乳制品如酸奶、奶酪等的产量、质量、风味等产生极大的不利影响。因此各国都将体细胞数作为牛奶质量标准中最重要的指标之一。[/size]2、 [size=18px]检测原理[/size][size=18px]采用荧光染色自动镜检原理,染色剂外无需额外的化学试剂;干粉式染色剂无需要样品稀释液。排除液体染色剂挥发的影响;体细胞检测范围1-1000万,建议有效计数范围为5万以上。[/size]3、 [size=18px]操作过程[/size][align=left][size=18px]第一步:充分搅拌后在取样瓶中用 100ul 的[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]抽取 [/size][size=18px]100ul [/size][size=18px]奶[/size][size=18px],[/size][size=18px]加入到染色瓶中;第二步:把加入奶样后的染色剂瓶放置在搅拌器上,按 2 秒,松 [/size][size=18px]2 [/size][size=18px]秒,共搅拌 [/size][size=18px]10 [/size][size=18px]次, 静止 [/size][size=18px]2 [/size][size=18px]分钟让它充分染色,然后再放在搅拌器上按压搅拌 [/size][size=18px]3 [/size][size=18px]次。第三步:打开盖子,用另外一个[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]取样出 8ul 奶样在检测板半圆孔处缓慢排出,无需排气, 让样品慢慢渗过去,然后静置 [/size][size=18px]30 [/size][size=18px]秒,直至对面直线处充满样品。[/size][/align][align=left]4、 [size=18px]注意事项[/size][/align][align=left][size=18px]1、开机时,先接电源,打开机器,最后开平板,避免第二步自检不成功[/size][/align][align=left][size=18px]2、在进行检测时,若点击按钮没有反应,则机器可能进入了仿真模式,若出现 [/size][/align][align=left][size=18px]这种情况,可返回自检界面,调整箭头所指模式即可。[/size][/align][align=left]3、 [size=18px]仪器使用较长时间后,会出现卡顿现象,这种情况下可以清除以往检测数据,点击参数选项,进入页面。[/size][/align][align=left][size=18px]4、仪器使用时,请勿在平板上下载游戏,视频等占内存的软件,避免出现卡顿现象。 [/size][/align][align=left][size=18px]5[/size][size=18px]、仪器使用结束后,关机时请先关闭平板,再关闭机器,最后拔下电源。[/size][/align]
有用HPLC做丙烯酸单体检测的吗,因为标准中需要用到0.1%的磷酸溶液,有位同事说,进两针就要把磷酸溶液换成水相冲一下,然后再用磷酸溶液相,否则容易堵单向阀。不知磷酸溶液(色谱纯磷酸配制,不是磷酸缓冲盐)真的这么难用吗?有没有其他可以测丙烯酸更好的办法呢,对系统保护更好点的。谢谢大侠们。
请问TLC类型很多,我在做放线菌的细胞壁成分分析,需要测定糖型,氨基酸,DAP(二氨基庚二酸),我应该采用哪种型号的TLC呢?
[font=宋体][font=宋体]在生物学和医学研究中,细胞增殖是一个关键过程,对于理解生命活动的基本规律以及疾病的发病机理具有重要意义。随着科技的发展,流式细胞仪作为一种高效、灵敏的分析工具,广泛应用于细胞增殖的检测。流式细胞仪通过快速分析单个细胞,可以对细胞周期、细胞增殖活性、细胞凋亡等多个方面进行研究。本文将探讨流式细胞仪在检测细胞增殖方面的主要方法,包括但不限于溴脱氧尿苷([/font][font=Calibri]BrdU[/font][font=宋体])掺入法、细胞周期蛋白检测法以及细胞大小分析法等,以期为读者提供全面的技术应用概览。流式细胞仪检测细胞增殖方法:[/font][/font][b][font=宋体][font=Calibri]1[/font][font=宋体]、[/font][font=Calibri]3H[/font][font=宋体](氚离子)掺入法[/font][/font][/b][font=宋体][font=宋体]原理:是在细胞[/font][font=Calibri]DNA[/font][font=宋体]合成时,用[/font][font=Calibri]3H[/font][font=宋体]脱氧胸腺嘧啶核苷代替普通的脱氧胸腺嘧啶核苷掺入新合成的[/font][font=Calibri]DNA[/font][font=宋体]中,增殖的细胞因为掺入[/font][font=Calibri]3H[/font][font=宋体]而具有放射性,通过定量检测样品细胞的放射性大小而反映细胞的增值活性[/font][/font][font=宋体][font=宋体]缺点:[/font][font=Calibri]1[/font][font=宋体])使用的是具有放射性的同位素,操作较为复杂,同时需要采取放射性保护措施 [/font][font=Calibri]2[/font][font=宋体])低比例高活跃增殖和高比例低活跃增殖可能得到的是相同的结果,用此方法无法进行鉴别 [/font][font=Calibri]3[/font][font=宋体])此方法无法进一步得到具有活性的增值细胞用于下一步的研究 [/font][font=Calibri]4[/font][font=宋体]) 此方法时间较短,无法检测加入前细胞的增殖情况,而且检测到放射性只能说明细胞[/font][font=Calibri]DNA[/font][font=宋体]合成,而不能提供合成[/font][font=Calibri]DNA[/font][font=宋体]的细胞是否进入增殖阶段的信息[/font][/font][b][font=宋体][font=Calibri]2[/font][font=宋体]、相对计数法[/font][/font][/b][font=宋体]原理:将对照组和各实验组控制在相同条件下直接计数然后比较计数结果得到增殖结论[/font][font=宋体]注意点:[/font][font=宋体][font=宋体]对照组与实验组每种细胞所加浓度必须相同,每组至少设置[/font][font=Calibri]3[/font][font=宋体]个复孔,这样每个孔可以得到[/font][font=Calibri]1[/font][font=宋体]个细胞数,将[/font][font=Calibri]3[/font][font=宋体]个复孔取平均值后就是这个组的结果。如果同时需要得到每孔目标细胞增殖后的绝对参数,在每孔细胞中加入[/font][font=Calibri]1*105PE[/font][font=宋体]标记的人工微球作为内参[/font][/font][font=宋体] [/font][font=宋体][font=宋体]收集各组的细胞于[/font][font=Calibri]EP[/font][font=宋体]管中,注意必须尽量将各组的所有细胞都收集起来。标记需要计数细胞的标志表型的荧光素偶联抗体,[/font][font=Calibri]4[/font][font=宋体]℃静置[/font][font=Calibri]30min[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PBS[/font][font=宋体]洗涤一次,洗去游离的抗体[/font][/font][b][font=宋体][font=Calibri]3[/font][font=宋体]、示踪染料标记法[/font][/font][/b][font=宋体][font=宋体]示踪染料与细胞结合的方式:[/font][font=Calibri]1[/font][font=宋体])能够与细胞内的蛋白质上的氨基发生非特异性的共价结合 [/font][font=Calibri]2[/font][font=宋体])能够非特异性地嵌入细胞膜的脂质双分子层中与细胞发生非共价性结合[/font][/font][font=宋体] [/font][font=宋体][font=宋体]原理:示踪染料的荧光信号都很强,当细胞分裂时,母细胞内的染料会被平均分配到子细胞中,细胞荧光信号会被减弱一半,所以通过检测减弱的、发射示踪染料荧光信号的细胞比例就可以判断细胞增殖的强弱。当荧光强度减弱到标记时的[/font][font=Calibri]1/2[/font][font=宋体]以及以下的细胞都是增殖后的细胞,这些细胞所占比例越高则代表细胞增殖越活跃[/font][/font][font=宋体] [/font][font=宋体]标记方法:[/font][font=宋体][font=宋体]①纯化增殖反应的目标细胞,将细胞的浓度调整为[/font][font=Calibri]1*106/ml[/font][font=宋体],加入[/font][font=Calibri]CFSE[/font][font=宋体],其标记浓度为[/font][font=Calibri]5[/font][font=宋体]微摩尔[/font][font=Calibri]/[/font][font=宋体]升。置于[/font][font=Calibri]37[/font][font=宋体]℃水浴中标记[/font][font=Calibri]15min[/font][font=宋体],在标记过程中每隔一段时间混匀细胞一次[/font][/font][font=宋体] [/font][font=宋体][font=宋体]②加入预冷、含有血清的培养基终止标记,在[/font][font=Calibri]4[/font][font=宋体]℃冰箱中静置[/font][font=Calibri]5min[/font][font=宋体],离心沉淀[/font][/font][font=宋体] [/font][font=宋体][font=宋体]③用培养基再洗涤一次,尽量洗净未结合的游离的[/font][font=Calibri]CFSE[/font][font=宋体],然后将目标细胞静置在增殖体系中[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]4[/font][font=宋体]、[/font][font=Calibri]BrdU[/font][font=宋体]和[/font][font=Calibri]EdU[/font][font=宋体]掺入法[/font][/font][/b][font=宋体][font=Calibri]BrdU[/font][font=宋体]:[/font][font=Calibri]5-[/font][font=宋体]溴脱氧尿嘧啶核苷是胸腺嘧啶核苷的类似物,其特点是胸腺嘧啶环上[/font][font=Calibri]5[/font][font=宋体]位[/font][font=Calibri]C[/font][font=宋体]连接的甲基被溴取代,在细胞增殖[/font][font=Calibri]DNA[/font][font=宋体]合成时可以与内源性的胸腺嘧啶核苷竞争掺入到新合成的[/font][font=Calibri]DNA[/font][font=宋体]中,而[/font][font=Calibri]BrdU[/font][font=宋体]抗体可以特异性的识别[/font][font=Calibri]BrdU[/font][font=宋体],不与胸腺嘧啶核苷结合,所以可以用于检测细胞增殖[/font][/font][font=宋体][font=宋体]适用范围:适用于体内检测目标细胞的增殖,一般将[/font][font=Calibri]BrdU[/font][font=宋体]掺入小鼠的应用水中或经腹腔注射,经过一段时间后,取出目标细胞制成单细胞悬液然后用多聚甲醛固定细胞,后用打孔剂皂苷在细胞膜上打孔,最后标记荧光素偶联抗[/font][font=Calibri]BrdU[/font][font=宋体]抗体,目标细胞的[/font][font=Calibri]BrdU[/font][font=宋体]阳性细胞就是增殖的细胞,阳性比例越高,增殖越活跃。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]5[/font][font=宋体]、其他方法[/font][/font][/b][font=宋体][font=宋体]细胞周期法检测细胞增殖:流式细胞术能够检测细胞内[/font][font=Calibri]DNA[/font][font=宋体]的含量,所以可以检测细胞周期。处于[/font][font=Calibri]S[/font][font=宋体]期的细胞,[/font][font=Calibri]DNA[/font][font=宋体]的量处于二倍体和四倍体之间[/font][font=Calibri] [/font][font=宋体]处于[/font][font=Calibri]G2/M[/font][font=宋体]期时,[/font][font=Calibri]DNA[/font][font=宋体]量为四倍体。处于[/font][font=Calibri]S[/font][font=宋体]期和[/font][font=Calibri]G2/M[/font][font=宋体]期的细胞比例越高说明细胞增殖越活跃[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PCNA[/font][font=宋体]检测细胞增殖:[/font][font=Calibri]PCNA[/font][font=宋体](增殖细胞核抗原),在细胞核合成且只存在于细胞核内,是[/font][font=Calibri]DNA[/font][font=宋体]聚合酶的辅助蛋白,所以与细胞[/font][font=Calibri]DNA[/font][font=宋体]的合成关系密切,是反映细胞增殖状态的良好指标[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Ki-67[/font][font=宋体]检测细胞增殖:是一种与细胞增殖特异相关的核抗原[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]CD71[/font][font=宋体]检测细胞增殖:是转铁蛋白受体,表达于细胞的表面,该受体广泛表达于各种恶性肿瘤细胞表面,正常细胞表达较少,与肿瘤细胞的增殖密切相关[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],更多关于流式细胞仪检测细胞增殖详情欢迎咨询,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
如何检测牛奶中的体细胞数? 1.检测牛奶体细胞数的必要性 1.1牛奶体细胞数和乳品质量关系密切; 1.2牛奶体细胞数反映奶牛健康盒科学养殖水平; 1.3牛奶体细胞数发出疾病防控信号,利于及时行动减少损失; 1.4改善我国乳制品的出口现状。 2. 检测原理 采用荧光染色自动镜检原理,呲除染色剂外无需额外的化学试剂;干粉式染色剂不需要样品稀释液。排除液体染色剂挥发的影响;体细胞检测范围0-200万个/mL; 3. 仪器、耗材准备 仪器:国产HLD-SCC 800 牛奶体细胞计数仪、水浴锅、5-50μl移液枪、20-200μl移液枪、试管架、涡旋仪; 耗材:体细胞试剂、枪头; 4. 操作步骤 检测流程分为取样、样本处理、加样、上机检测、结果判读五个步骤。4.1取样奶样应为 8 小时内挤出的鲜奶,冻藏奶样需温浴后方可检测。 4.2样本处理取出体细胞计数片和装有染色剂的离心管。用移液枪取 100ul奶样加到有干燥试剂的离心管中,吹打混匀 8-10 次,静置 3min,再次对样本吹打混匀 8-10 次;4.3加样将混匀的样本使用移液枪吸取8ul在芯片的进样口完成注样(注样后 15min内应完成检测)。4.4上机检测将已经注样的体细胞计数片插入仪器检测孔中,点击检测,仪器进入检测流程、确认通道界面,选择要检测的通道点击下一步即可进入检测;https://ng1.17img.cn/bbsfiles/images/2024/09/202409061007223251_1309_6198252_3.png[font='calibri']图 1 检测状态4.5结果判读https://ng1.17img.cn/bbsfiles/images/2024/09/202409061007226577_7174_6198252_3.png图 2检测结果整体操作流程示意图如下图3所示:https://ng1.17img.cn/bbsfiles/images/2024/09/202409061007224054_6384_6198252_3.png图 3整体操作流程示意图 检测完成后点击“返回”返回主界面;点击“继续”,进入提示界面,进行下一次的检测;点击“打印”,打印此次结果。 5. 检测结果 检测样本:生鲜乳样本状态:正常序号样品1(万个/毫升)样品2(万个/毫升)样品3(万个/毫升)样品4(万个/毫升)样品5(万个/毫升)流式细胞仪参考值[font='microsoft yahei ui']51.5043.9044.8053.8029.90154.9440.8549.3650.9733.40252.4839.7148.1346.5534.553[align=center]52.6739.8146.9051.4233.59452.8641.8945.6749.0531.39平均值53.2440.5747.5249.5033.23STD[/td] 0.99 0.89 1.38 1.92 1.15 cv1.86%2.18%2.89%3.88%3.46% 由上表的CV值可以看出,该仪器检测同一样品重复性好、准确率高; 6. 注意事项 6.1使用原厂配置的适配器,并有效接地; 6.2仪器有松动和掉落时,请勿使用并联系售后支持; 6.3不在倾斜、振动及不稳定的环境下使用仪器; 6.4请勿使仪器进入水份; 6.5移动仪器需先拔出插头; 6.6仪器与周围墙面应留有不小于 5cm 的间隙便于散热; 6.7不要在仪器表面堆放其他物品; 6.8处理潜在污染物时,应做好个人防护,并按要求处理样品和检测后的卡片,并定期清洁并消毒仪器。

维权声明:本文为gl19860312原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。 本实验室主要工作就是:微生物发酵与代谢调控 、蛋白的分离纯化 、生物材料的研发与生产( 化妆品 、面膜、人工血管 、人工骨................)http://ng1.17img.cn/bbsfiles/images/2010/12/201012061858_264950_2019107_3.jpg啤酒酵母细胞自溶技术破壁研究摘要:研究了PH、温度、食盐浓度三个因素对啤酒酵母细胞破壁的影响,确定出最佳的自溶法破壁条件 。进而为分离啤酒废酵母中的有效活性成分奠定了基础。关键词:啤酒酵母;破壁;自溶The Research of Autolysis on the Beer Yeast Cells wallAbstract:This paper researched the condition of autolysis on the waste yeast cells wall with three factors (pH 、Temperature 、Salt density) and determined the best condition based on autolysis. And build basis for separating the activity forms from beer waste yeasts.Key words: The beer yeast; Breaking Cells wall; Autolysis引言啤酒酵母(S.csrsviside)属于真菌门酵母属,多数为单细胞微生物,细胞呈圆形或卵圆形,革兰氏染色呈阳性G+。啤酒酵母细胞是由细胞壁、细胞膜、液泡、颗粒和线粒体等部分组成,细胞年幼的时候细胞壁很薄,所以不明显;细胞年老时,细胞壁较厚。啤酒酵母细胞内不但含有丰富的蛋白质、维生素、葡聚糖及甘露聚糖等营养及保健成分,可作为食用单细胞蛋白,此外还含有辅酶I、细胞色素,卵磷脂、RNA,,这些物质或其降解产物及衍生物如氨基酸制剂和核苷酸及核酸制剂等在生物化学、医药及保健食品中最有重要的作用。由于啤酒废酵母价格便宜,因此可利用啤酒废酵母来提取、制备这些物质。啤酒废酵母(waste brewer's yeast)是啤酒生产的副产物,是指啤酒酿造后沉降的酵母泥,主要是由大量的弱细胞和死细胞组成。在啤酒生产过程中,每生产 100吨啤酒大约有1-1.5吨废酵母 (以干重计)产生。传统的处理方法,是弃置不用或作为饲料处理,直接排放到河流湖泊中,将造成环境污染,同时也是对财富的浪费;因其具有坚韧的细胞壁和特有的酵母臭,适口性差,不易消化和吸收,故烘干作为饲料用的经济效益不高。充分利用啤酒废酵母可以有效地减轻污染,实现资源的二次转化,也可产生巨大的经济效益,如开发酵母抽提物。 为了增加酵母抽提物产量国内外同行做出不同努力,开展了有些研究。目前关于啤酒酵母破壁的研究很多,大体可归纳为:化学破壁(酸解、碱解)、物理破壁(液体剪 切、固体剪切等)、生物破壁(酶解、自溶)。其中,化学破壁不仅会造成一些营养成分的破坏,而且为有效成分的提取增加困难;物理破壁虽然方法简单、成本低,能完好保存营养成分,但其破壁效果较差;生物破壁中的酶解法会增加提取成本,故均不能大规模广泛的应用。而采用自溶法进行细胞破壁是一种简便易行的操作过程,通过确定啤酒酵母细胞最适合的自溶条件,可以建立一套利用酵母细胞生产酵母抽提物的工艺和方法,旨在为啤酒酵母的综合利用寻求一种新的方法,为工业化生产提供理论基础和实践指导。1.4实验方法 工艺流程 啤酒废酵母(保藏)—— 活化、两次斜面培养—— 接种、平板划线——摇瓶培养——取对数期的酵母细胞——做稀释梯度——做影响因素(温度、食盐浓度、pH并固定时间60分钟)的实验-——做正交试验——镜检(血球计数法)——计算啤酒酵母细胞的破碎率——得到自溶的最佳工艺参数1.5啤酒废酵母自溶条件的确定酵母自溶的实质是酵母细胞内的蛋白质在自身蛋白酶的作用下,降解为游离的氨基酸,那么,一切影响酶促反应的因素均影响酵母细胞的自溶,如自溶温度、食盐浓度、pH值、自溶时间等。自溶法是以存在酶活性的新鲜活酵母为原料,利用酵母细胞本身的酶系,在一定条件下,将酵母体内的糖类物质、蛋白质和核酸分解为还原糖、氨基酸、肤类、核昔酸等小分子物质并从酵母细胞内抽提出来的一种方法。利用自溶法生产的酵母抽提物,蛋白质分解率高,游离氨基酸含量高,风味好,成本较低,但呈味核昔酸含量低.目前,欧美及我国所生产的酵母抽提物绝大部分都是采用这种方法。[font=仿宋_GB2
摘要:细胞凋亡与坏死是两种完全不同的细胞凋亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以将二者区别开来。细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。一、细胞凋亡的形态学检测根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。1. 光学显微镜和倒置显微镜(1) 未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。贴壁细胞出现皱缩、变圆、脱落。(2) 染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态。2. 荧光显微镜和共聚焦激光扫描显微镜一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种染料与 DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376278_small.jpg3 透射电子显微镜观察结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376295_small.jpg二、磷脂酰丝氨酸外翻分析(Annexin V法)磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中(图3)。Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376296_small.jpg方法1. 悬浮细胞的染色:将正常培养和诱导凋亡的悬浮细胞(0.5~1×106)用PBS洗2次,加入100 ul Binding Buffer和FITC标记的Annexin-V(20ug/ml)10 ul,室温避光30 min,再加入PI(50 ug/ml)5 ul,避光反应5 min后,加入400 ul Binding Buffer,立即用FACScan进行流式细胞术定量检测(一般不超过1 h), 同时以不加AnnexinV-FITC及PI的一管作为阴性对照。2. 贴壁培养的细胞染色:先用0.25%的胰酶消化,洗涤、染色和分析同悬浮细胞。3. 爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察。结果 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376298_small.jpg http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376300_small.jpg
关于生乳中体细胞检测,目前主流的有流式细胞仪法,电子显微镜法,粘度测定法,电导率法等技术,你用的哪种方法?
[font=宋体]流式细胞术,作为一种先进的生物技术,已经在生物医学研究中占据了举足轻重的地位。这种技术以其高精度、高速度以及多参数同时检测的能力,广泛应用于细胞生物学、免疫学、肿瘤学等多个领域。流式细胞术不仅可以对单个细胞进行多参数定量分析和分选,还能够对细胞内部的蛋白质、核酸、细胞受体以及细胞表面抗原等进行检测。因此,它在疾病诊断、药物筛选、细胞功能研究等方面具有广泛的应用前景。本文将对流式细胞术的检测原理、应用领域以及发展前景进行详细介绍,旨在为读者提供对这一技术全面而深入的了解。流式细胞术可以检测什么?下面是具体检测信息及应用:[/font][font=宋体] [/font][b][font=宋体][font=Calibri]1.[/font][font=宋体]细胞表型检测[/font][/font][/b][font=宋体]免疫细胞表型是流式细胞术最突出应用。[/font][font=宋体][font=宋体]通过检测免疫细胞群的表面或细胞内标志物,对其进行鉴定和表征。流式细胞术能够精确鉴定和分类免疫细胞群,例如[/font] [font=Calibri]T [/font][font=宋体]细胞、[/font][font=Calibri]B [/font][font=宋体]细胞、[/font][font=Calibri]NK [/font][font=宋体]细胞、树突状细胞、单核细胞、巨噬细胞、血小板和粒细胞等。[/font][/font][font=宋体] [/font][font=宋体]研究人员可以识别和量化异质群体中的各种免疫细胞亚群。[/font][font=宋体] [/font][font=宋体][font=宋体]临床医生可以诊断和监测各种血液系统疾病、进行免疫免疫评估([/font][font=Calibri]8[/font][font=宋体]大类免疫细胞构成与肿瘤预后)。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=Calibri]2.[/font][font=宋体]细胞活力检测[/font][/font][/b][font=宋体] [/font][font=宋体]流式细胞术能够定量测量群体内和体外培养的活细胞和非活细胞。[/font][font=宋体] [/font][font=宋体]通过使用选择性标记活细胞或死细胞的荧光染料,流式细胞术可以提供精确可靠的活力测定,有助于确定细胞活力百分比。[/font][font=宋体] [/font][font=宋体]流式细胞术可以根据特定的标志物或染料区分活细胞、凋亡细胞和坏死细胞,从而更详细地了解细胞的健康和状态。通过将活力染料与细胞表面抗原、细胞内蛋白或功能测定的标记物相结合,研究人员可以在特定细胞类型或实验条件下获得有关细胞活力及其发生机制的全面信息。[/font][font=宋体] [/font][font=宋体]最常用的活性检测染料[/font][font=宋体] [/font][font=宋体][font=宋体]死细胞:碘化丙啶([/font] [font=Calibri]propidium iodide[/font][font=宋体],[/font][font=Calibri]PI[/font][font=宋体])和[/font][font=Calibri]7-AAD[/font][font=宋体],与[/font][font=Calibri]DNA[/font][font=宋体]结合,但只能进入膜受损的细胞,使死细胞发出荧光。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]凋亡细胞:[/font][font=Calibri]annexin V[/font][font=宋体]:对磷脂酰丝氨酸具有强结合亲和力的蛋白质,在细胞凋亡的早期阶段暴露在质膜的外表面[/font][font=Calibri]annexin V+PI[/font][font=宋体]是常用区分凋亡细胞和坏死细胞的组合。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]活细胞:[/font][font=Calibri]calcein AM[/font][font=宋体]、[/font][font=Calibri]CFDA[/font][font=宋体]([/font][font=Calibri]carboxyfluorescein diacetate[/font][font=宋体])、[/font][font=Calibri]FDA [/font][font=宋体]([/font][font=Calibri]fluorescein diacetate[/font][font=宋体]) :进入活细胞,但只有在与细胞内酶相互作用时才会发出荧光[/font][/font][font=宋体] [/font][font=宋体][font=宋体]细胞体内增殖:[/font][font=Calibri]CFSE(CFDA-SE)[/font][font=宋体]穿透细胞膜,在活细胞内与胞内蛋白共价结合,水解后释放出绿色荧光。在细胞分裂增殖过程中,它的荧光强度会随着细胞的分裂而逐级递减,标记荧光可平均分配至两个子代细胞中,因此其荧光强度是亲代细胞的一半,根据这一特性,它可被用于检测细胞增殖,细胞周期的估算及细胞分裂等方面。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]3.[/font][font=宋体]细胞周期分析[/font][/font][/b][font=宋体] [/font][font=宋体]从流式细胞术的早期开始,细胞周期分析就成为有价值的应用。[/font][font=宋体] [/font][font=宋体]原理是基于荧光和核酸的量之间的关系。[/font][font=宋体] [/font][font=宋体][font=宋体]常用核酸结合染料:碘化丙啶([/font][font=Calibri]PI[/font][font=宋体]),[/font][font=Calibri]Hoechst[/font][font=宋体],[/font][font=Calibri]DAPI[/font][font=宋体],[/font][font=Calibri]7-AAD[/font][font=宋体],溴化乙锭等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术细胞周期分可以有很多方面的应用,例如,[/font][font=Calibri]DNA/Ki67[/font][font=宋体]测定可以将表型选择与细胞周期分析相结合,用于监测[/font][font=Calibri]p53[/font][font=宋体]细胞周期停滞,评估抗癌活,多药耐药性等。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]4.[/font][font=宋体]离子通道测定[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]钙作为关键的第二信使,在许多细胞信号通路中起着至关重要的作用。它在免疫细胞活化中尤为重要,包括[/font][font=Calibri]T[/font][font=宋体]细胞、[/font][font=Calibri]B[/font][font=宋体]细胞和[/font][font=Calibri]NK[/font][font=宋体]细胞。[/font][/font][font=宋体]此外,钙信号传导还参与肥大细胞脱颗粒、神经元兴奋性、突触传递和神经递质释放至关重要。[/font][font=宋体] [/font][font=宋体][font=宋体]细胞脱颗粒的早期测量值是通过使用钙离子载体[/font][font=Calibri]A23187[/font][font=宋体]的流式细胞术确定的。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]常用荧光染料:[/font][font=Calibri]fluo-3 [/font][font=宋体]和[/font][font=Calibri]indo-1[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]虽然[/font][font=Calibri]Ca2+[/font][font=宋体]通道测量是最常见的应用之一,但其他离子如镁、钾、钠和氢也可以使用流式细胞术进行监测。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]5.[/font][font=宋体]细胞功能检测[/font][/font][/b][font=宋体]最早的检测是细胞酯酶。[/font][font=宋体] [/font][font=宋体][font=宋体]使用响应氧化态变化的活性染料检测粒细胞的氧化电位。例如,氢乙啶([/font][font=Calibri]hydroethidine[/font][font=宋体])用于中性粒细胞呼吸爆发。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]二乙酸二氯荧光素([/font][font=Calibri]dichlorofluorescein diacetate[/font][font=宋体]),已被用于吞噬细胞功能研究。[/font][/font][font=宋体] [/font][font=宋体]效应细胞杀伤功能,是流式细胞术的另外一个重要应用。[/font][font=宋体] [/font][font=宋体]细胞因子是免疫细胞功能的重要执行分子,对科学研究,免疫细胞治疗,临床诊疗都及其关键。基于流式细胞术开发的多重细胞因子检测,已经有广泛应用。[/font][font=宋体] [/font][b][font=宋体][font=Calibri]6.[/font][font=宋体]蛋白质工程[/font][/font][/b][font=宋体] [/font][font=宋体]流式细胞术和分选传统上不是蛋白质工程中最常用的技术之一。然而,近年来,在该领域的应用越来越多。[/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术被用于酶学蛋白质研究,包括细胞色素[/font][font=Calibri]P450[/font][font=宋体]、葡萄糖氧化酶、几丁质酶、纤维素酶、过氧化物酶、酯酶、转移酶、β半乳糖苷酶、硫代内酯酶等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]蛋白质工程,包括在基因水平上引入突变(随机或特异性),以创建由数千到数百万个单个蛋白质变体组成的文库(如上图),使用流式细胞术[/font] [font=宋体]每天能够分析多达[/font] [font=Calibri]10^8[/font][font=宋体]–[/font][font=Calibri]10^9 [/font][font=宋体]个克隆,并对具有所需特性的克隆进行分类。[/font][/font][b][font=宋体] [/font][font=宋体][font=Calibri]7.[/font][font=宋体]哺乳动物细胞和细菌细胞分选[/font][/font][/b][font=宋体] [/font][font=宋体]细胞分选是流式细胞的重要应用之一,哺乳动物细胞相对成熟,不做赘述。细菌细胞方面的应用,也逐渐开始建立。[/font][font=宋体] [/font][font=宋体]与耗时的传统琼脂铺板检测方法相比,流式分选可以快速检测和分选悬浮液中的单个细菌细胞。[/font][font=宋体] [/font][font=宋体]尽管细胞分选仪具有高性能,但它们在微生物学中的应用一直受到限制。[/font][font=宋体] [/font][font=宋体]这主要是由于微生物体积小,因此很难将它们与培养基中的细胞碎片或背景颗粒区分开来。另一个潜在的问题是,通常没有细菌菌株特有的抗体。[/font][font=宋体] [/font][font=宋体][font=宋体]限制细胞分选仪在细菌检测和分选中的适用性的其他因素主要与分选仪硬件功能本身有关,在流式细胞术仪器的早期,数量有限的激光器和检测器,限制一次只能使用一种或两种荧光染料。随着最新仪器的发展,多激光器和检测起的仪器被开发:包括赛默飞世尔的[/font][font=Calibri]Bigfoot[/font][font=宋体]光谱细胞分选仪,[/font][font=Calibri]BD FACSAria III[/font][font=宋体]分选仪,索尼[/font][font=Calibri]MA900[/font][font=宋体]细胞分选仪和贝克曼库尔特的[/font][font=Calibri]MoFlo Astrios EQ[/font][font=宋体]等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]此外,部分致病性细菌,需要在[/font][font=Calibri]BSL2[/font][font=宋体]以上的实验环境下进行,现在部分流式细胞术带有[/font][font=Calibri]BSL 2 hood[/font][font=宋体]。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]8.[/font][font=宋体]液滴微流体[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]液滴微流体是一个相对较新的领域,专注于皮升体积中含有细胞或[/font][font=Calibri]DNA[/font][font=宋体]的离散液滴的形成,操作和分析,应用于生物学、化学、材料科学和医学。[/font][/font][font=宋体] [/font][font=宋体]在生物学中,液滴微流体可实现单细胞分析、生物分子的高通量筛选、细胞异质性研究和药物发现。[/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞术分析是研究单细胞的强大技术,可提供有关各种参数的宝贵信息。然而,它的测量仅限于直接连接到细胞的分子,例如表面或细胞内标记物,限制研究由细胞分泌或由[/font][font=Calibri]DNA[/font][font=宋体]分子产生但不物理附的分子。液滴微流体提供了一种克服这一限制的新方法。将细胞或[/font][font=Calibri]DNA[/font][font=宋体]封装在单个液滴中会产生离散的区室,从而能够分析由封装实体释放或产生的化合物。[/font][/font][b][font=宋体] [/font][font=宋体][font=Calibri]9.[/font][font=宋体]下一代生物制剂[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]生物制药已经占据了药物市场的重要份额,包括治疗性蛋白质([/font][font=Calibri]65%[/font][font=宋体]),疫苗([/font][font=Calibri]20%[/font][font=宋体])等。通过测序([/font][font=Calibri]NGS[/font][font=宋体])进行单[/font][font=Calibri]B[/font][font=宋体]细胞库分析和克隆扩增鉴定,直接从人类幸存者克隆免疫球蛋白基因,分离出高亲和力中和抗体,加快了单克隆抗体药物的研发,然而,这种方法比较昂贵,且依旧需要后续的功能验证等。新策略可使用流式细胞术、[/font][font=Calibri]MACS[/font][font=宋体]或微流体将单细胞分离与功能筛选相结合,降低开发成本并消除失败的候选药物,是流式细胞术新的应用开发方向。[/font][/font][font=宋体] [/font][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],拥有[/font][font=宋体][font=宋体]①具有 [/font][font=Calibri]20,000 [/font][font=宋体]次以上流式抗体筛选鉴定经验及多年流式诊断抗体研发经验,在实验方案设计、样品制备、数据分析等方面确保科学性、准确性和可靠性[/font][font=Calibri] [/font][/font][font=宋体][font=宋体]②拥有 [/font][font=Calibri]1,000 [/font][font=宋体]余株自产精品流式抗体,覆盖细胞膜、胞内、核内及分泌抗原;[/font][/font][font=宋体][font=宋体]③自产 [/font][font=Calibri]Annexin V/7-AAD [/font][font=宋体]凋亡检测试剂盒,并储备多种流式检测常用试剂,大大节约购买试剂的等待时间和实际费用;[/font][/font][font=宋体][font=宋体]④可以提供近 [/font][font=Calibri]200 [/font][font=宋体]种细胞系选择,省去细胞样本寄送过程中的风险,并可以免费提供健康人外周血细胞对照品。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font][font=Calibri] [/font]
植物细胞原生质体制制备与融合2006-11-20 17:14植物细胞原生质体制制备与融合1、原生质体常现的杂交育种由于物种间难以逾越的天然屏障而举步维艰。科学家们受细胞全能性理论及组织培养成功的启示,逐渐将眼光转向细胞融合,试图用这种崭 图3-2新的手段冲破自然界的禁钢。1937年michel率先实施植物细胞融合的试验。如何去除坚韧的细胞'接成了牛物学工作者必须解决的首要难题。196O年该领域终于出现了重大突破。由英国诺丁汉大学Cocking教授领导的小组率先利用真菌纤维素酶,成功地制备出了大量具有高度活性可再生的番茄幼根细胞原生质体,开辟了原生质体融合研究的新阶段。植物细胞原生质体是指那些已去除全部细胞壁的细胞。2、原生质体制备(1)取材与除菌 为了让制得的原生质体一般都生活力较强,再生与分生比例较高。常用的外植体包括:种子根。子叶、下胚轴、胚细胞、花粉母细胞、悬浮培养细胞和嫩叶。对外植体的除菌要因材而异。悬浮培养细胞一般无需除菌。对较脏的外植体往往要先用肥皂水清洗再以清水洗2~3次,然后浸人 70%酒精消毒后,再放进 3%次氯酸钠处理。最后用无菌水漂洗数次,并用无菌滤纸吸干。(2)酶解 现以叶片为例说明如何制备植物原生质体。①配制酶解反应液:反应液应是一种PH值在5·5~5·8的缓冲液,内合纤维素酶0.3%~3.0%以及渗透压稳定剂、细胞膜保护剂和表面活性剂等,②酶解:除菌后的叶片 撕去下表皮 切块放人反应液 不时轻摇 (条件25℃~30℃,2~4h)反应液转绿。反应液转绿是酶解成功的一项重要指标,说明已有不少原生质体游离在反应液中。经镜检确认后应及时终止反应,避免脆弱的原生质体受到更多的损害。(3) 分离 在反应液中除了大量的原生质体外,尚有一些残留的组织块和破碎的细胞。为了取得高纯度的原生质体就必需进行原生质体的分离。可选取200~400目的不锈钢网或尼龙布j叭i过滤除渣,也可采用低速离心法或比重漂浮法直接获取原生质体。(4) 洗涤刚分离得到的原生质体往往还含有酶及其他不利于原生质体培养。再生的试剂,应以新的渗透压稳定剂或原生质体培养液离心洗涤2~4次。 (5) 鉴定 只有经过鉴定确认已获得原生质体后才能进行下阶段的细胞融合工作。由于已去除全部或大部分细胞壁,此时植物细胞呈圆形。如果把它放人低渗溶液中,则很容易胀破。也。'厂月荧光增白剂染色后置紫外显微镜下观察,残留的细胞壁呈现明显荧光。通过以上观测,基本上可判别是否原生质体及其百分中 此外,尚可借助台盼蓝活细胞染色、胞质环流观察以及测定人、作用、呼吸作用等参数定量检测原生质体的活力。4、 原生质体的融合(1)化学法诱导融合 化学法诱导融合无需贵重仪器,试剂易于得到,因此一直是细胞融合的主要方法。尤其是聚乙二醇(PEG)纳合成钙高pH诱导融合法已成为化学法诱导细胞融合的主流。以下简介此方法(在无菌条件下进行):按比例混合双亲原生质体-----滴加 PEG溶液,摇匀,静置----滴加高钙高pH值溶液,摇匀,静置-----滴加原生质体培养液洗涤数次-----离心获得原生质体细胞团一筛选、再生杂合细胞。(2)物理法诱导融合 1979年Senda等发明了微电极法诱导细胞融合。1981年Zi。。mann等提出了改进的平行电极法,现简介如下:将双亲本原生质体以适当的溶液悬浮混合后,插入微电极,接通一定的交变电场。原生质体极化后顺着电场排列成紧密接触的珍珠串状。此时瞬间施以适当强度的电脉冲,则使原生质体质膜被击穿而发生融合。电激融合不使用有毒害作用的试剂,作用条件比较温和,而且基本上是同步发生融合。只要条件摸索适当,亦可获得较高的融合率。上述操作实际上是供体与受体原生质体对等融合的方法。由于双方各具几万对基因,要筛选得到符合需要且能稳定传代的杂合细胞是相当困难的。最近,有人提出以X射线、伽玛射线。纺锤体毒素或染色体浓缩剂等对供体原生质体进行前处理。轻剂量处理可造成染色体不同程度的丢失、失活、断裂和损伤,融合后实现仅有少数染色体甚至是DNA片段的转移;致死量处理后合u可能产生没再仅体万染色体w划她旋余种。利用这种价值不对称融合方法,大大提高了融合体的生存率和可利用率。经过上述融合处理后再生的细胞株将可能出现以下几种类型.2) 亲本双方的细胞核和细胞质能融洽地合为一体,发育成为完全的杂合植株。这种例子不多。3) 融合细胞由一方细胞核与另一方细胞质构成,可能发育为核质异源的植株。亲缘关系越远的物种,某个亲本的染色体被丢失的现象就越严重。 4) 融合细胞由双方胞质及一方核或再附加少量他方染色体或DNA片段构成。④原生质体融合后两个细胞核尚未融合时就过早地被新出现的细胞壁分开。以后它们各自分生长成嵌合植株。5、 杂合体的鉴别与筛选双亲本原生质体经融合处理后产生的杂合细胞,一般要经含有渗透压稳定剂的原生质体培养基培养(液体或固体),再生出细胞壁后转移到合适的培养基中。待长出愈伤组织后按常规方法诱导其长芽、生根、成苗。在此过程中可对是否杂合细胞或植株进行鉴别与筛选。 (1) 杂合细胞的显微镜鉴别 根据以下特征可以在显微镜下直接识别杂合细胞:若一方细胞大,另一方细胞小,则大。小细胞融合的就是杂合细胞;若~方细胞基本无色,另一方为绿色,则自绿色结合的细胞是杂合细胞;如果双方原生质体在特殊显微镜下或双方经不同染料着色后可见不同的特征,则可作为识别杂合的标志;发现h述杂合细胞后可借助显微操作仪在显微镜下直接取出,移置再牛培养基培养。(2)以互补法筛选杂合细胞 显微鉴别法虽然比较可信,但实验者有时会受到仪器的限制,工作进度慢且未知其能否存活与个长 遗传互补法则可弥补以上不足。 遗传互补法的前提是获得各种遗传突变细胞株系。白化互补:不同基山叨的白化突变株出aBxAh,可互补为绿色细胞株AaBb。生长互补:甲细胞株缺外源激素A不能生长,乙细胞株需要提供外源激素B才能生长,则甲株与乙株融合,杂合细胞在不含激素A、B的选择培养基上可能生长。抗性互补筛选:假如某个细胞株具某种抗性(抗青霉素)另一个细胞株具另一种抗性(如抗卡那霉素),则它们的杂合株将可在含上述两种抗生素的培养基上再生与分裂。这种筛选方式即所谓的抗性互补筛选。代谢互补筛选:根据碘代乙酚胺能抑制细胞代谢的特点,用它处理受体原生质体,只有融合后的供体细胞质才能使细胞活性得到恢复,等等。 (3)采用细胞与分子生物学的方法鉴别杂合体 经细胞融合后长出的愈伤组织或植株,可进行染色体核型分析、染色体显带分析、同功酶分析以及更为精细的核酸分子杂交、限制性内切酶片段长度多态性(RFLP,见8.2.2.2)和随机扩增多态性DNA(RAPD)分析,以确定其是否结合了双亲本的遗传素质。(4)根据融合处理后再生长出的植株的形态特征进行鉴别质。
植物细胞原生质体制制备与融合1、原生质体常现的杂交育种由于物种间难以逾越的天然屏障而举步维艰。科学家们受细胞全能性理论及组织培养成功的启示,逐渐将眼光转向细胞融合,试图用这种崭 图3-2新的手段冲破自然界的禁钢。1937年michel率先实施植物细胞融合的试验。如何去除坚韧的细胞'接成了牛物学工作者必须解决的首要难题。196O年该领域终于出现了重大突破。由英国诺丁汉大学Cocking教授领导的小组率先利用真菌纤维素酶,成功地制备出了大量具有高度活性可再生的番茄幼根细胞原生质体,开辟了原生质体融合研究的新阶段。植物细胞原生质体是指那些已去除全部细胞壁的细胞。2、原生质体制备(1)取材与除菌 为了让制得的原生质体一般都生活力较强,再生与分生比例较高。常用的外植体包括:种子根。子叶、下胚轴、胚细胞、花粉母细胞、悬浮培养细胞和嫩叶。对外植体的除菌要因材而异。悬浮培养细胞一般无需除菌。对较脏的外植体往往要先用肥皂水清洗再以清水洗2~3次,然后浸人 70%酒精消毒后,再放进 3%次氯酸钠处理。最后用无菌水漂洗数次,并用无菌滤纸吸干。(2)酶解 现以叶片为例说明如何制备植物原生质体。①配制酶解反应液:反应液应是一种PH值在5·5~5·8的缓冲液,内合纤维素酶0.3%~3.0%以及渗透压稳定剂、细胞膜保护剂和表面活性剂等,②酶解:除菌后的叶片 撕去下表皮 切块放人反应液 不时轻摇 (条件25℃~30℃,2~4h)反应液转绿。反应液转绿是酶解成功的一项重要指标,说明已有不少原生质体游离在反应液中。经镜检确认后应及时终止反应,避免脆弱的原生质体受到更多的损害。(3) 分离 在反应液中除了大量的原生质体外,尚有一些残留的组织块和破碎的细胞。为了取得高纯度的原生质体就必需进行原生质体的分离。可选取200~400目的不锈钢网或尼龙布j叭i过滤除渣,也可采用低速离心法或比重漂浮法直接获取原生质体。(4) 洗涤刚分离得到的原生质体往往还含有酶及其他不利于原生质体培养。再生的试剂,应以新的渗透压稳定剂或原生质体培养液离心洗涤2~4次。 (5) 鉴定 只有经过鉴定确认已获得原生质体后才能进行下阶段的细胞融合工作。由于已去除全部或大部分细胞壁,此时植物细胞呈圆形。如果把它放人低渗溶液中,则很容易胀破。也。'厂月荧光增白剂染色后置紫外显微镜下观察,残留的细胞壁呈现明显荧光。通过以上观测,基本上可判别是否原生质体及其百分中 此外,尚可借助台盼蓝活细胞染色、胞质环流观察以及测定人、作用、呼吸作用等参数定量检测原生质体的活力。4、 原生质体的融合(1)化学法诱导融合 化学法诱导融合无需贵重仪器,试剂易于得到,因此一直是细胞融合的主要方法。尤其是聚乙二醇(PEG)纳合成钙高pH诱导融合法已成为化学法诱导细胞融合的主流。以下简介此方法(在无菌条件下进行):按比例混合双亲原生质体-----滴加 PEG溶液,摇匀,静置----滴加高钙高pH值溶液,摇匀,静置-----滴加原生质体培养液洗涤数次-----离心获得原生质体细胞团一筛选、再生杂合细胞。(2)物理法诱导融合 1979年Senda等发明了微电极法诱导细胞融合。1981年Zi。。mann等提出了改进的平行电极法,现简介如下:将双亲本原生质体以适当的溶液悬浮混合后,插入微电极,接通一定的交变电场。原生质体极化后顺着电场排列成紧密接触的珍珠串状。此时瞬间施以适当强度的电脉冲,则使原生质体质膜被击穿而发生融合。电激融合不使用有毒害作用的试剂,作用条件比较温和,而且基本上是同步发生融合。只要条件摸索适当,亦可获得较高的融合率。上述操作实际上是供体与受体原生质体对等融合的方法。由于双方各具几万对基因,要筛选得到符合需要且能稳定传代的杂合细胞是相当困难的。最近,有人提出以X射线、伽玛射线。纺锤体毒素或染色体浓缩剂等对供体原生质体进行前处理。轻剂量处理可造成染色体不同程度的丢失、失活、断裂和损伤,融合后实现仅有少数染色体甚至是DNA片段的转移;致死量处理后合u可能产生没再仅体万染色体w划她旋余种。利用这种价值不对称融合方法,大大提高了融合体的生存率和可利用率。经过上述融合处理后再生的细胞株将可能出现以下几种类型.2) 亲本双方的细胞核和细胞质能融洽地合为一体,发育成为完全的杂合植株。这种例子不多。3) 融合细胞由一方细胞核与另一方细胞质构成,可能发育为核质异源的植株。亲缘关系越远的物种,某个亲本的染色体被丢失的现象就越严重。 4) 融合细胞由双方胞质及一方核或再附加少量他方染色体或DNA片段构成。④原生质体融合后两个细胞核尚未融合时就过早地被新出现的细胞壁分开。以后它们各自分生长成嵌合植株。5、 杂合体的鉴别与筛选双亲本原生质体经融合处理后产生的杂合细胞,一般要经含有渗透压稳定剂的原生质体培养基培养(液体或固体),再生出细胞壁后转移到合适的培养基中。待长出愈伤组织后按常规方法诱导其长芽、生根、成苗。在此过程中可对是否杂合细胞或植株进行鉴别与筛选。 (1) 杂合细胞的显微镜鉴别 根据以下特征可以在显微镜下直接识别杂合细胞:若一方细胞大,另一方细胞小,则大。小细胞融合的就是杂合细胞;若~方细胞基本无色,另一方为绿色,则自绿色结合的细胞是杂合细胞;如果双方原生质体在特殊显微镜下或双方经不同染料着色后可见不同的特征,则可作为识别杂合的标志;发现h述杂合细胞后可借助显微操作仪在显微镜下直接取出,移置再牛培养基培养。(2)以互补法筛选杂合细胞 显微鉴别法虽然比较可信,但实验者有时会受到仪器的限制,工作进度慢且未知其能否存活与个长 遗传互补法则可弥补以上不足。 遗传互补法的前提是获得各种遗传突变细胞株系。白化互补:不同基山叨的白化突变株出aBxAh,可互补为绿色细胞株AaBb。生长互补:甲细胞株缺外源激素A不能生长,乙细胞株需要提供外源激素B才能生长,则甲株与乙株融合,杂合细胞在不含激素A、B的选择培养基上可能生长。抗性互补筛选:假如某个细胞株具某种抗性(抗青霉素)另一个细胞株具另一种抗性(如抗卡那霉素),则它们的杂合株将可在含上述两种抗生素的培养基上再生与分裂。这种筛选方式即所谓的抗性互补筛选。代谢互补筛选:根据碘代乙酚胺能抑制细胞代谢的特点,用它处理受体原生质体,只有融合后的供体细胞质才能使细胞活性得到恢复,等等。 (3)采用细胞与分子生物学的方法鉴别杂合体 经细胞融合后长出的愈伤组织或植株,可进行染色体核型分析、染色体显带分析、同功酶分析以及更为精细的核酸分子杂交、限制性内切酶片段长度多态性(RFLP,见8.2.2.2)和随机扩增多态性DNA(RAPD)分析,以确定其是否结合了双亲本的遗传素质。(4)根据融合处理后再生长出的植株的形态特征进行鉴别质。
你检测体细胞了吗,用的啥仪器,啥方法???
[b][font=宋体][font=宋体]细胞周期[/font][font=Calibri]cell cycle [/font][/font][/b][font=宋体]是指从一次细胞分裂形成子细胞开始到下一次细胞分裂形成子细胞为止所经历的过程,它反映了细胞增殖的速度。在临床上,有很多研究证明,细胞周期分析对人肿瘤的诊断预后具有很高的价值。[/font][font=宋体] [/font][font=宋体][font=宋体]一个完整的细胞周期包含间期和分裂期([/font][font=Calibri]M[/font][font=宋体]期)两个阶段,间期又分为[/font][font=Calibri]DNA[/font][font=宋体]合成前期([/font][font=Calibri]G1[/font][font=宋体]期)、[/font][font=Calibri]DNA[/font][font=宋体]合成期([/font][font=Calibri]S[/font][font=宋体]期)和[/font][font=Calibri]DNA[/font][font=宋体]合成后期([/font][font=Calibri]G2[/font][font=宋体]期),处于不同时期的细胞的[/font][font=Calibri]DNA [/font][font=宋体]含量存在差异。一般认为,[/font][font=Calibri]G 1 [/font][font=宋体]期细胞具有增殖活性,参与细胞周期循环,是二倍体细胞;[/font][font=Calibri]S [/font][font=宋体]期细胞,[/font][font=Calibri]DNA [/font][font=宋体]含量逐渐增加,从二倍体变成四倍体,随后进入 [/font][font=Calibri]G 2 [/font][font=宋体]期,最终进入 [/font][font=Calibri]M [/font][font=宋体]期。检测细胞周期常用的方法是检测[/font][font=Calibri]DNA[/font][font=宋体]含量,可以选择能与[/font][font=Calibri]DNA[/font][font=宋体]结合的荧光染料(如[/font][font=Calibri]PI[/font][font=宋体]等),再根据细胞各个时期[/font][font=Calibri]DNA[/font][font=宋体]含量不同从而荧光强度不同的方法,分析各个阶段的细胞比例。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=宋体]流式细胞仪[/font][font=Calibri]PI[/font][font=宋体]染色法检测细胞周期的原理[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]由于细胞周期各时相的[/font][font=Calibri]DNA[/font][font=宋体]不同[/font][font=Calibri],[/font][font=宋体]通常正常细胞的[/font][font=Calibri]G1/G0[/font][font=宋体]期具有二倍体细胞的[/font][font=Calibri]DNA[/font][font=宋体]含量[/font][font=Calibri](2N),[/font][font=宋体]而[/font][font=Calibri]G2/M[/font][font=宋体]期具有四倍体细胞[/font][font=Calibri]DNA[/font][font=宋体]含量[/font][font=Calibri](4N),[/font][font=宋体]而[/font][font=Calibri]S[/font][font=宋体]期的[/font][font=Calibri]DNA [/font][font=宋体]含量介于二倍体和四倍体之间。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]PI[/font][font=宋体](碘化丙啶)为插入性核酸荧光染料,能选择性嵌入核酸[/font][font=Calibri]DNA[/font][font=宋体]和[/font][font=Calibri]RNA[/font][font=宋体]双螺旋的碱基之间与之结合,结合量与[/font][font=Calibri]DNA[/font][font=宋体]的含量成正比关系,其荧光强度直接能反映细胞内[/font][font=Calibri]DNA[/font][font=宋体]含量。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]因此[/font][font=Calibri],[/font][font=宋体]通过流式细胞仪[/font][font=Calibri]PI[/font][font=宋体]染色法对细胞内[/font][font=Calibri]DNA[/font][font=宋体]含量进行检测时[/font][font=Calibri],[/font][font=宋体]可以将细胞周期各时相区分为[/font][font=Calibri]G1/G0 [/font][font=宋体]期[/font][font=Calibri],S [/font][font=宋体]期和[/font][font=Calibri]G2/M [/font][font=宋体]期[/font][font=Calibri],[/font][font=宋体]获得的流式直方图对应的各细胞周期可通过特殊软件计算各时相的细胞百分率。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]通过定量测定[/font] [font=Calibri]DNA [/font][font=宋体]含量来分析细胞周期是流式细胞术最早的应用之一。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]流式细胞周期([/font][font=Calibri]cell cycle[/font][font=宋体])检测结果分析常用的流式细胞术分析细胞周期的方法是依据细胞[/font][font=Calibri]DNA[/font][font=宋体]含量(横坐标)来分析的:[/font][font=Calibri]G0[/font][font=宋体]期:静止期,有丝分裂完成后,脱离细胞周期暂时停止分裂的一个阶段,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量保持二倍体;[/font][font=Calibri]G1[/font][font=宋体]期:[/font][font=Calibri]DNA[/font][font=宋体]合成前期,从有丝分裂到[/font][font=Calibri]DNA[/font][font=宋体]复制前的一段时期,此期主要合成[/font][font=Calibri]RNA[/font][font=宋体]和核糖体,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量保持二倍体;[/font][font=Calibri]S[/font][font=宋体]期:[/font][font=Calibri]DNA[/font][font=宋体]合成期,在此期,合成[/font][font=Calibri]DNA[/font][font=宋体]及组蛋白,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量介于[/font][font=Calibri]G1[/font][font=宋体]期与[/font][font=Calibri]G2[/font][font=宋体]期之间;[/font][font=Calibri]G2[/font][font=宋体]期:[/font][font=Calibri]DNA[/font][font=宋体]合成后期,是有丝分裂的准备期,合成[/font][font=Calibri]RNA[/font][font=宋体]及蛋白质,[/font][font=Calibri]DNA[/font][font=宋体]合成终止,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量为四倍体;[/font][font=Calibri]M[/font][font=宋体]期:细胞分裂期,胞内[/font][font=Calibri]DNA[/font][font=宋体]含量为四倍体;[/font][/font][font=宋体] [/font][b][font=宋体]流式细胞检测正常范围[/font][/b][font=宋体]流式细胞检测的正常范围通常依赖于被检测细胞或生物粒子的类型以及所测参数的性质。一般而言,正常的细胞数量、细胞大小、细胞形态、细胞内物质的浓度和分布等参数都在一定的范围内。这些正常范围通常是通过对比大量健康个体或样本的流式细胞检测结果而得出的。例如,正常血细胞的计数和比例,各种免疫细胞的分布,以及细胞内的荧光强度等,都有相应的正常范围。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],同时还提供完善的[url=https://cn.sinobiological.com/services/platform/facs-b-cell-sorting][b]流式单[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/platform/facs-b-cell-sorting][b]B[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/platform/facs-b-cell-sorting][b]细胞分选平台[/b][/url],详情关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][font=宋体][font=Calibri]https://cn.sinobiological.com/services/platform/facs-b-cell-sorting[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
最近在考察固体检测器的信息采集时间,看到有的帖子提曝光时间,有的帖子提积分时间,我觉得有点歧义,按理说固体检测器应该按照信号的强弱自动调整曝光时间,以满足信号采集。也就是说相对应的积分时间也会延长。但是,曝光时间和积分时间是同时进行计算的么?还是实际就是一个意思?还望高人指点!谢谢!
气体检测仪是一种气体泄露浓度检测的仪器仪表工具,主要是指便携式/手持式气体检测仪。主要利用气体传感器来检测环境中存在的气体种类,气体传感器是用来检测气体的成份和含量的传感器。 有害气体检测仪选用原则: 1、明确检测目的,选择仪器类别 简而言之,有害气体的检测有两个目的,第一是测爆,第二是测毒。所谓测爆是检测危险场所可燃气含量,超标报警,以避免爆炸事故的发生;测毒是检测危险场所有毒气体含量,超标报警,以避免工作人员中毒。测爆的范围是0~100%LEL,测毒的范围是0~几十(或几百)ppm,两者相差很大。 危险场所有害气体有三种情况,第一、无毒(或低毒)可燃,第二、不燃有毒,第三、可燃有毒。前两种情况容易确定,第一测爆,第二测毒,第三种情况如果有人员暴露测毒,如无人员暴露可测爆。 测爆选择可燃气体检测仪,测毒选择有毒气体检测仪。 2、明确检测用途选择仪器种类(便携式或固定式) 生产或贮存岗位长期运行的泄漏检测选用固定式检测仪;其他象检修检测、应急检测、进入检测和巡回检测等选用便携式(或袖珍式)仪器。 3、明确检测对象,择优选择仪器型号仪器型号包含了生产厂家、功能指标和检测原理三项主要内容,选择仪器型号时要考虑以下几点原则: ①生产厂家讲诚信、信誉好、生产的质量有保证,通过了ISO9002质量体系认证,具有技术监督部门颁发的CMC生产许可证,具有消防、防爆合格证。 ②选择的型号产品功能指标要符合国标GB12358-90,GB15322-94,GB16808-1997等标准的要求。 ③仪器的检测原理要适应检测对象和检测环境的要求。
谁知道能够快速判断出甲基丙烯酸甲酯的方法,还有其他的一些单体的方法,有的请回复!!!!
[align=center][size=24px]流式细胞仪监测适配体与靶细胞的结合[/size][/align][align=center]肖书棋 18122884967[/align][align=center][/align]本次说明是基于核酸适配体能与靶标进行特异性结合的原理,利用流式细胞仪监测适配体与靶细胞的结合状况,还能比较不同适配体与靶细胞之间的结合强度的比较;本次所使用的流式分析仪是BD FACSAria III。[font='times new roman'][size=16px]1.原理介绍:[/size][/font][font='times new roman'][size=16px]1.1核酸适配体:[/size][/font]核酸适配体(Aptamer,Apt):是一段寡核苷酸序列(ssDNA或RNA),是利用指数富集的系统进化技术(the Systematic Evolution of Ligands by Exponential Enrichment,SELEX)在多样寡核苷酸序列的文库中,进行体外筛选得到。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026239049_1528_5413603_3.jpeg[/img][/align][align=center][size=13px]Aptamer结合靶标原理[/size][size=13px]图[/size][/align]如图所示,在合适的缓冲液环境下,单链寡核苷酸序列具有弯曲以及折叠成特定的三级空间结构的能力,该结构可以与靶分子特异性结合,SELEX技术就是应用该原理来进行选择的。将信息量巨大且随机的的寡核苷酸文库与靶标孵育,经过多轮的优胜劣汰和PCR扩增,最后得到能与靶标高亲和力性结合的寡核苷酸序列,即核酸适配体(Aptamer)。由于核酸适配体具有靶向特异性的特点,因此应用广泛;那么如何监测适配体靶向细胞亲和力的方法,就需要用到流式细胞术进行表征。[font='times new roman'][size=16px]1.2流式细胞仪原理:[/size][/font]流式细胞术能够快速检测细胞或者生物颗粒的特征,其检测灵敏,能够定性或者定量分析颗粒的参数,还具有细胞分选的功能,功能强大,分析参数多,实用性较强。流式细胞仪(flow cytometer,FCM)的设计应用了光学、细胞化学、电子学等技术,拥有较强大的细胞及微粒分析功能,在临床医学、免疫学、微生物学等等研究领域发挥着巨大的作用。流式分析可以检测细胞表面颗粒复杂程度、核酸以及蛋白质的含量、细胞表面积或者细胞表面的抗体、细胞受体等等,在多种研究领域起到重要作用。在本研究中应用流式分析细胞荧光强度的基本步骤原理是:(1)制备成单细胞悬液:将待测细胞预处理进行荧光标记后制成单细胞悬液,通过气压将流式管中的细胞悬液通过管道压进流动室,同时喷出的鞘液将细胞包裹,形成圆形的鞘流,细胞在鞘液的包被下单行排列,依次通过流动室检测区域。(2)形成光散射:激发光源侧向垂直射向单个细胞,含有荧光的细胞形成两种光:①前向散射光(forward scatter, FSC):激光束照射细胞时,光束偏移量较小(10°以内),散射至前方,可用于检测细胞等粒子的表面信息,颗粒体积越大,信号越强。②侧向散射光(side scatter,SSC)激光束照射颗粒,产生偏移角度为直角的散射光,可反应细胞内含物的信息。(3)光信号转化成电信号:光信号导入到计算机中,依次形成电信号,再转化为数字信息。应用FlowJo软件处理数据,可以获得相应的散点图、直方图等形式,便于直观分析。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026241158_6946_5413603_3.jpeg[/img][/align][align=center][font='times new roman'][size=13px]流式分析基本原理图[/size][/font][/align][font='times new roman'][size=16px]2.分析步骤:[/size][/font][font='times new roman'][size=16px]2.1细胞预处理:[/size][/font]通过流式分析预处理,可以使细胞在特定的环境,与带有FAM荧光的适配体进行特异性结合,通过平行实验使细胞与不同的适配体文库进行标记,最终表征其荧光强度,进行亲和力的分析与比较。如表所示,流式分析条件为:[align=center][size=13px]流式细胞分析条件探寻[/size][/align][table][tr][td][align=center][size=13px][color=#000000]孵育时条件[/color][/size][/align][/td][td][size=13px][color=#000000]孵育时体积[/color][/size][/td][td=2,1][align=center][size=13px][color=#000000]孵育时浓度[/color][/size][/align][align=center][size=13px][color=#000000]细胞浓[/color][/size][size=13px][color=#000000]度 [/color][/size][size=13px][color=#000000]单链DNA浓度[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]第二次洗涤用液[/color][/size][/align][/td][/tr][tr][td][align=center][size=13px][color=#000000]4 ℃,30 min,BB,摇晃[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]500 μL[/color][/size][/align][/td][td][size=13px][color=#000000]2.5×10^6个/mL[/color][/size][/td][td][align=center][size=13px][color=#000000]125 nM[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]PBS x 2[/color][/size][/align][/td][/tr][/table]流式分析的大致步骤为:消化细胞、细胞与文库孵育、润洗重悬、上样分析。最终确定,初始的细胞悬液浓度为5×10[font='times new roman'][size=16px]6[/size][/font] 个/mL,初始文库的浓度为250 nM;孵育时体系的总体积为250 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL,适配体浓度为125 nM,环境为4 ℃、30 min,震荡。最后上样的细胞悬液体积为500 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。[align=left][font='times new roman'][size=16px]2.1.1材料准备:[/size][/font][/align][align=center][size=13px] 流式分析主要仪器与试剂[/size][/align][table][tr][td][align=center]名称[/align][/td][td][align=center]规格/型号[/align][/td][td][align=center]作用[/align][/td][/tr][tr][td][align=center]流式细胞仪[/align][/td][td][align=center]FACSAria III[/align][/td][td][align=center]对细胞进行流式分析[/align][/td][/tr][tr][td][align=center]可调式混匀仪[/align][/td][td][align=center]MX-S[/align][/td][td][align=center]混悬适配体悬液[/align][/td][/tr][tr][td][align=center]震荡仪[/align][/td][td][align=center]MX-M[/align][/td][td][align=center]震荡孵育体系,防止细胞贴壁[/align][/td][/tr][tr][td][align=center]制冷恒温金属浴[/align][/td][td][align=center]HX-20L[/align][/td][td][align=center]热击适配体,使核酸变性恢复到自由的无规则卷曲状态[/align][/td][/tr][tr][td][align=center]显微镜[/align][/td][td][align=center]DMI1[/align][/td][td][align=center]观察细胞[/align][/td][/tr][tr][td][align=center]水浴氮吹仪[/align][/td][td][align=center]FY-DCY12S[/align][/td][td][align=center]加热试剂[/align][/td][/tr][tr][td][align=center]电子天平[/align][/td][td][align=center]JA2003[/align][/td][td][align=center]称量药品[/align][/td][/tr][tr][td][align=center]离心管[/align][/td][td][align=center]15 mL×10、50mL×10[/align][/td][td][align=center]分装试剂,装载需离心的细胞[/align][/td][/tr][tr][td][align=center]低吸附离心管[/align][/td][td][align=center]2 mL×20[/align][/td][td][align=center]装适配体悬液,减少适配体与细胞在管壁上的吸附[/align][/td][/tr][tr][td][align=center]一次性使用吸管[/align][/td][td][align=center]3 mL×20[/align][/td][td][align=center]方便地吸取PBS[/align][/td][/tr][tr][td][align=center]细胞刮刀[/align][/td][td][align=center]3010×1[/align][/td][td][align=center]刮下贴壁生长的细胞[/align][/td][/tr][tr][td][align=center]PBS[/align][/td][td][align=center]50 mL×2[/align][/td][td][align=center]ScienCell[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]无酶无菌水[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]溶解适配体文库[/align][/td][/tr][tr][td][align=center]DMEM高糖培养基[/align][/td][td][align=center]50 mL[/align][/td][td][align=center]停止消化[/align][/td][/tr][tr][td][align=center]细胞[/align][/td][td][align=center]>5×10[font='times new roman'][size=16px]6[/size][/font]个[/align][/td][td][align=center]作为目的细胞进行流式表征[/align][/td][/tr][/table]①配置Binding buffer(结合缓冲液BB):配置10 g/L BSA:称量0.1g BSA,溶于10 mL Washing Buffer,过膜;取上述溶液5 mL,加入到445 mL Washing Buffer中;再加入500 L鲑精DNA,混匀。②将U盘格式化,提前打开制冰机和金属浴(95℃);③37℃水浴:将无酶消化液、ECM、PBS(1)放入37℃水浴。④4℃冰敷:向泡沫盒中加碎冰,离心管架、温度计,准备4℃孵育环境,放入PBS和BB预冷。⑤打开显微镜(酒精擦拭载物台)。⑥打开离心机:120 g,1 min,25℃。[align=left][font='times new roman'][size=16px]2.1.2[/size][/font][font='times new roman'][size=16px]计数和文库预处理[/size][/font][/align](1)细胞计数(20倍或者40倍显微镜):①采用直接计数法,在显微镜中随机选择五个点进行计数取平均值,根据视野的面积以及T75培养瓶面积计算细胞总数,推出公式:Y为总细胞数;X为视野中细胞平均数;Y=27886.12X(20倍镜下)/Y=111111.11X(40倍镜下)。为了保证流式有足够的细胞,需要保证细胞总数>5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。②计算BB体积:V=Y/(2×10[font='times new roman'][size=16px]7[/size][/font])mL,用V体积的BB重悬细胞沉淀,可获得细胞浓度为5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的初始细胞悬液。(2)文库预处理:①将粉末状适配体文库进行离心:4000 r,5 min,4℃;使适配体粉末聚集在离心管底部,防止打开离心管时干粉状适配体飞出。②按照说明用一定体积的无酶无菌水溶解适配体,使适配体母液浓度在5 M。③取100 L母液,并加入900 LBB,使适配体浓度在500 nM。④再去上述液体500 L,并用BB稀释至浓度为250 nM,最终得到250 nM的适配体文库悬液。⑤95℃热击3 min,热击后放在泡沫盒中冰敷。[align=left][font='times new roman'][size=16px]2.1.3[/size][/font][font='times new roman'][size=16px]细胞处理[/size][/font][/align](1)消化:①PBS(37℃)润洗3次。②无酶消化液3 mL,消化9 min(等待期间准备好孵育用离心管;确认离心机参数为:120 rcf,1 min,25 ℃),吹打细胞使其从培养瓶表面脱落。直接转移至15mL离心管中,吹打混匀约20次(吹散细胞团,分离成单个细胞)。③显微镜观察确认细胞均从培养瓶上脱落,加入2-3 mL ECM至培养瓶中润洗,然后转移至上述离心管中,吹打终止消化。④离心:120 rcf,1 min,25℃。(等待期间各加入250 L待测文库至低吸附离心管中,注意要快速,吸取之前需要先混悬文库)。⑤离心之后小心倒出,用枪吸出剩下的ECM,加入2V L BB,重悬吸打混匀,获得5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[align=left][font='times new roman'][size=16px]2.1.4[/size][/font][font='times new roman'][size=16px]细胞与文库结合[/size][/font][/align]①孵育:分别加入250 μL上述细胞悬液至250 μL ssDNA文库中,进行孵育:4℃,30 min,打开摇床第二格。②等待期间离心机调至4℃;用密封袋装好洁净的1000 L枪头准备流式上样用;2.2.2.5 润洗重悬细胞①取出孵育好的体系,进行离心:4℃,120 g,1 min(等待期间准备好4℃ PBS)。②倒掉上清液,用枪头小心吸出管口残留的上清液,每管加500 L PBS(4℃)用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸打重悬约20次。③再次离心4℃,120 g,1 min。④第二次重悬:重复①-③步骤。⑤每管加入500 L PBS重悬,忽略实验损失,最后得到理论细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[font='times new roman'][size=16px]2.2[/size][/font][font='times new roman'][size=16px]送样分析[/size][/font]FAM荧光染色较弱,在预处理之后应尽快进行流式分析,流式分析上样程序复杂,需要正确进行开机,测样,关机的步骤,才能够得到准确的数据。[align=left](1)准备工作:[/align][align=left]准备1000 mL[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url],1000 mL 洁净枪头,流式管,质控微球。[/align][align=left]①开启液流系统:由上至下打开流式细胞仪开关;再开启计算机,打开FACSDiva软件,在“Cytometer仪器框”中确认流式细胞仪已与电脑连接,启动液流之前,确认液流系统水平,进行补充鞘液、去离子水、乙醇以及漂水,并清空废液。[/align][align=left]在“Cytometer”菜单中,点击“Fluidics Startup(启动液流系统)”,按照提示进行操作:确定气路和液路是从乙醇桶连接到了鞘液桶上:将蓝色液路管接到过滤器下方,透明气路管接到鞘液桶上;确定闭合的喷嘴是在流动检测池上。[/align][align=left]②将70 m的喷嘴放入装有超纯水的烧杯中,超声30 s,用无尘纸蘸干;抽出闭合的喷嘴;插入70 m的喷嘴(红圈朝上)。[/align][align=left]③点击“×steam”,开启液流,出现水滴状,调整使上端横线位于第二个或者第三个水滴的尾部,下端横线位于第三个或者第四个液滴的中部,调整好后关闭液流。[/align][align=left](2)做质控:[/align][align=left]①用CS&T微球,用之前一定将微球甩匀(保证取出的微球呈均匀体系)用涡旋震荡;取一支洁净的流式管加入333 L的鞘液,再加一滴微球(用之前用混悬仪混匀,正常的微球为浑浊状)。[/align][align=left]②打开液流系统,在“Cytometer”菜单下点击“CST”;展开Setup Control窗口:在Characterize菜单中中选择“Check Performence”;在Configuration流式设置中:喷嘴的大小:选择70m,点击左下角“set configuration”,再点击“OK”。[/align][align=left]③选择微球的Lot ID:与微球瓶身上编号对应:10549。[/align][align=left]④敲弹准备好的微球悬液使其混匀,进行上样,打开液流;确认激发光源没问题即可关掉页面并关掉液流。[/align][align=left](3)上样:[/align][align=left]①新建样品,并勾选FITC、SSC、FSC的H、A、W、log数据项。[/align][align=left]②作图:建立散点图,横坐标为FSC-H,纵坐标为SSC-H;再建立一个图:横坐标:FITC-H,纵坐标为:Count。[/align][align=left]③打开液流至3,选择对应样品;吹打混匀并放置样品,点击“LOAD”上样。调整FSC和SSC的电压,使散点图的中的点都集中在所圈的门中。(若散点偏右,则FSC电压过大,调整FSC电压使其变小,若散点偏上,则调整SSC使其变小。)当调整合适时点击“RECORD”记录数据。[/align][align=left]④计数完毕,调低流速,点击“unload”,选择第二个样品并重复第③步。[/align][align=left]⑤上样完毕之后,保存数据。[/align][align=left](4)关机步骤:[/align][align=left]①上一管clean液,高速冲2 min;再上一管去离子水,高速冲5 min;关闭液流,检查液路系统。[/align][align=left]②在“Cytometer”菜单中,选择“shutdown”,根据指示操作:取下70 m的喷嘴,超声清洗,安装闭合喷嘴(红色点朝上)。[/align][align=left]③把液路和气路连接到乙醇桶上,用乙醇冲洗(先拔气路再拔液路)。[/align][align=left]④装一管clean液,清洗上样针和流动池。[/align][align=left]完成上述步骤之后即可关闭界面。[/align][align=left][/align][font='times new roman'][size=16px]2.3数据处理:[/size][/font]将原始数据用Flowjo软件进行处理,得到散点图以及荧光强度直方图,接下来通过举例来说明数据如何分析:(1) 散点图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026242555_5228_5413603_3.jpeg[/img][size=13px]数据处理分析散点图[/size][/align]该图为散点图,可以看出大体分为两个集团,散点图有两个集团说明体系中有两种细胞粒子,并且在该图片的左下角粒子较少,说明细胞碎片较少,在预处理时较好地保护了细胞的完整性。散点图中可以区分出整个上样的体系中主要含有两种大小的细胞颗粒,在预处理的过程中,无酶消化液的消化能力较弱,并且细胞团密度较大,细胞间黏连较多,在最后孵育结束用PBS进行重悬的时候仍然能够肉眼可见有白色细微絮状物。FSC值越大,代表颗粒的体积越大;SSC值越大,代表颗粒内部的复杂程度越高。故可初步判断,G1门中的颗粒为未消化完全的细胞团,而G2门中的颗粒为分散的单个细胞。(2) 直方图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026243736_5071_5413603_3.jpeg[/img][size=13px]数据处理分析直方图[/size][/align]图中为G2门选中的样品的荧光强度,该图中有两个峰,横坐标10[font='times new roman'][size=16px]2[/size][/font]附近所产生的荧光峰可以判定是残留的细胞碎片,可视为背景值,横坐标10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]附近的峰代表四个适配体分别与细胞结合所产生的荧光强度,SYL3C-Aptamer结合偏移量最大,荧光较强,且高荧光事件次数较多,说明SYL3C-Aptamer与单个细胞的结合能力最强,并且G2门中的颗粒大多数为消化完全的单个细胞,呈现出较好的特异性。总之,该组结果对比体现出,单个细胞靶点较多,适配体与单个细胞结合能力较高,通过荧光强度波峰的偏移所反映的适配体与细胞特异性结合能力的大小依次为SYL3C-Aptamer>EP166-Aptamer>CA2-Aptamer>ARC1172-Aptamer。同时,由图中可以看出:10th-ssDNA pool与SYL3C-Aptamer在10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]荧光强度波峰较高,说明二者与单个细胞的结合能力较好,结合位点较多,呈现良好的特异性和亲和性。SYL3-Aptamer荧光波峰明显右移,与单个细胞的结合位点较多。[font='times new roman'][size=16px]三、总结[/size][/font]本次说明旨在利用带荧光的适配体靶向特异性结合目的细胞的原理,利用流式细胞仪监测适配体结合靶细胞能力的强弱,同时还可以应用于不同适配体靶向同一种细胞的结合能力强弱的比较。进一步利用流式细胞仪,还可以测定适配体的Kd值;还可以根据预处理的条件不同,与对照组比较,来测定适配体靶向细胞的受体是位于细胞膜表面还是细胞内,从而进一步测定适配体的生物学稳定性。同时,流式细胞仪还有很多方面的应用,例如鉴定细菌、检测细胞凋亡等,一些抗体-细胞复合物的结合情况也能够由流式细胞仪来进行监测。 在进行流式上样的过程中,预处理、上样以及数据处理阶段都有需要注意的细节,例如:本次所使用的细胞为贴壁生长的内皮细胞,故在细胞预处理时需要先消化细胞;在进行上样前,需要将样品进行吸打混匀,以免细胞沉积在流式管底部,导致未吸取到样品;在应用流式细胞仪的过程中,使用前的维护、质控流程十分重要,该流程会直接影响所得数据的稳定性;不同的流式细胞仪的维护程序稍有不同,本次说明中的使用方法只适用于BD FACSAria III,流式细胞仪具有强大的分析功能,其在细胞研究中具有重要的作用。[align=left][/align][align=left][/align][align=left][/align][align=left][/align]
【线上讲座233期】实时细胞分析技术在肿瘤研究和病毒抗体疫苗检测中的应用 主讲人:周尧 活动时间:2013年10月9日-10月19日 热烈欢迎 周尧 老师光临生命科学仪器版面进行讲座!http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif引言实时无标记细胞分析技术(RTCA, Real Time cell Analysis)是艾森生物全球独有的专利核心技术,该技术采用特殊工艺,将微电极列阵整合在细胞培养板的每个细胞生长孔底部,用以构建实时、动态、定量跟踪细胞形态和增殖分化改变的细胞阻抗检测传感系统。该技术可广泛应用于生物活性因子测定、细胞增殖检测、大规模抗肿瘤药物筛选、细胞毒性检测等研究。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif提要一、 实时细胞分析技术原理 1.传统终点检测与实时无标记动态检测 2. 实时细胞分析技术原理 3. 实时细胞分析技术优势二、 实时细胞分析技术平台产品简介三、 实时细胞分析技术在肿瘤、药物细胞毒性检测领域的应用 1.RTCA实时动态细胞毒性检测 2.肿瘤与微环境之间的相互作用RTCA实时动态检测 四、 实时细胞分析技术在病毒、细胞毒素、中和抗体及疫苗检测与评估领域的应用 1.RTCA实时动态检测病毒Cytopathic Eff ect效应 2.RTCA实时定量检测病毒侵染效力及评估中和抗体效价http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif提问时间:2013年10月09日--10月19日答疑时间: 2013年10月09日--10月19日特邀佳宾:生命科学仪器版面版主、专家以及同行们参与人员:仪器论坛全体注册用户活动细则:1、请大家就ATR技术知识的相关问题进行提问,直接回复本帖子即可,自即日起提问截至日期2013年10月19日2、凡积极参与且有自己的观点或言论的都有积分奖励(1-50分不等),提问的也有奖励在活动期间我们将评选出20名积极参与奖和5名精彩问答奖。3、提问格式:为了规范大家的提问格式,请按下面的规则来提问 :周尧老师您好!我有以下问题想请教,http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif说明:本讲座内容仅用于个人学习,请勿用于商业用途,由此引发的法律纠纷本人概不负责。虽然讲座的内容主要是对知识与经验的讲解、整理和总结,但是也凝聚着笔者大量心血,版权归tianzhen老师和仪器信息网所有。本讲座是根据笔者对资料的理解写的,理解片面、错误之处肯定是有,欢迎大家指正。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif
一、气体检测仪的用途:气体检测仪是专用的安全、防护检测仪器,用来检测化学品作业场所或设备内部空气中的可燃或有毒气体和蒸气含量并超限报警。主要有以下几方面的应用:(1)泄漏检测:设备管道现场可燃或有毒气体和蒸气泄漏检测报警,设备管道运行检漏。(2)检修检测:设备检修置换后检测残留可燃或有毒气体和蒸气,特别是动火前检测更为重要。(3)应急检测:生产现场出现异常情况或者处理事故时,为了安全和卫生要对可燃或有毒气体和蒸气进行检测。(4)进入检测:工作人员进入可燃和有毒物质隔离操作间,进入危险场所的下水沟、电缆沟或设备内操作时,要检测可燃和有毒气体或液体蒸气。(5)巡回检测:安全卫生检查时,要检测可燃和有毒气体或液体蒸气。 危险化学品要加强安全管理,完善安全措施、控制事故隐患。但是,不可能达到绝对安全,仍然会出现万有一失的情况。因此,事故隐患的检测报警,在危险化学品场所可燃和有毒气体或液体(蒸气)检测报警,是非常必要的。对避免和控制事故具有重要意义。二、气体检测仪的分类:(1)按检测气体可分为:可燃气体检测仪 (便携式可燃气体检测仪)和有毒气体检测仪(便携式有毒气体检测仪)。① 可燃气体检测仪(简称测爆仪,) 一般为催化燃烧式检测原理,可检测多种可燃气体或蒸气。 ②有毒气体检测仪一般为电化学式检测原理,根据选配传感器的不同可检测多种有毒气体,如CO、H2S、NO、NO2、CL2、HCN、NH3、PH3等多种有毒有机化合物。一氧化碳报警器 ,一氧化碳检测仪,t40,co检测探头,co检测仪,co报警器,一氧化碳报警仪,一氧化碳监测仪,一氧化碳探测器,一氧化碳检测报警仪 (2)按采样方式可分为:气体检测仪;扩散式气体检测仪。二、气体检测仪的分类:(1)按检测气体可分为:可燃气体检测仪 (便携式可燃气体检测仪)和有毒气体检测仪(便携式有毒气体检测仪)。① 可燃气体检测仪(简称测爆仪,) 一般为催化燃烧式检测原理,可检测多种可燃气体或蒸气。 ②有毒气体检测仪一般为电化学式检测原理,根据选配传感器的不同可检测多种有毒气体,如CO、H2S、NO、NO2、CL2、HCN、NH3、PH3等多种有毒有机化合物。三、可燃气体报警器器,气体检测仪选用原则 可燃气体检测仪,可燃气体探测器,可燃气体报警仪,测爆仪,可燃气体报警控制器,可燃气体检测报警器,可燃气体报警装置,可燃气体报警器,可燃气体检测器,可燃气体测爆仪,可燃气体检测报警仪(1)明确检测目的,选择仪器类别 简而言之,气体的检测有两个目的,第一是测爆,第二是测毒。所谓测爆是检测危险场所可燃气含量,超标报警,以避免爆炸事故的发生;测毒是检测危险场所有毒气体含量,超标报警,以避免工作人员中毒。测爆的范围是0~100%LEL,测毒的范围是0~几十(或几百)ppm,两者相差很大。 危险场所可燃及有毒气体有三种情况,第一、无毒(或低毒)可燃,第二、不燃有毒,第三、可燃有毒。前两种情况容易确定,第一测爆,第二测毒,第三种情况如果有人员暴露测毒,如无人员暴露可测爆。 测爆选择可燃气体检测报警仪,测毒选择有毒气体检测报警仪。 (2)明确检测用途选择仪器种类(便携式或固定式) 生产或贮存岗位长期运行的泄漏检测选用固定式气体报警器;其他象检修检测、应急检测、进入检测和巡回检测等选用便携式气体检测仪。 中国专业生产煤气报警器 可燃气体报警器 便携式可燃气体检测仪
需要残余单体数据,请问应该咨询哪里代检?因为需要尽可能可靠的数据,是不是国家部门的好些,又应该找哪里呢?一无所知,还请大家帮忙,先谢!
对于各类不同的生产场合和检测要求,选择合适的气体检测仪是每一个从事安全和卫生工作的人员都必须十分注意的。这里我们将就一些具体情况做一介绍,供大家参考。 确认所要检测气体种类和浓度范围: 每一个生产部门所遇到的气体种类都是不同的。在选择气体检测仪时就要考虑到所有可能发生的情况。如果甲烷和其它毒性较小的烷烃类居多,选择LEL检测仪无疑是最为合适的。这不仅是因为LEL检测仪原理简单,应用较广,同时它还具有维修、校准方便的特点。如果存在一氧化碳、硫化氢等有毒气体,就要优先选择一个特定气体检测仪才能保证工人的安全。如果更多的是有机有毒有害气体,考虑到其可能引起人员中毒的浓度较低,比如芳香烃、卤代烃、氨(胺)、醚、醇、脂等等,就应当选择前章介绍的光离子化检测仪,而绝对不要使用LEL检测器应付,因为这可能会导致人员伤亡。 如果气体种类覆盖了以上几类气体,选择一个复合式气体检测仪可能会达到事半功倍的效果。 确定使用场合: 工业环境的不同,选择气体检测仪种类也不同。 A)固定式气体检测议: 这是在工业装置上和生产过程中使用较多的检测仪。它可以安装在特定的检测点上对特定的气体泄漏进行检测。固定式检测器一般为两体式,有传感器和变送组成的检测头为一体安装在检测现场,有电路、电源和显示报警装置组成的二次仪表为一体安装在安全场所,便于监视。它的检测原理同前节所述,只是在工艺和技术上更适合于固定检测所要求的连续、长时间稳定等特点。它们同样要根据现场气体的种类和浓度加以选择,同时还要注意将它们安装在特定气体最可能泄漏的部位,比如要根据气体的比重选择传感器安装的最有效的高度等等。 B)便携式气体检测仪: 由于便携式仪器操作方便,体积小巧,可以携带至不同的生产部位,电化学检测仪采用碱性电池供电,可连续使用1000小时 新型LEL检测仪、PID和复合式仪器采用可充电池(有些已采用无记忆的镰氢或鲤离子电池),使得它们一般可以连续工作近12小时,所以,作为这类仪器在各类工厂和卫生部门的应用越来越广。 如果是在开放的场合,比如敞开的工作车间使用这类仪器作为安全报警,可以使用随身佩戴的扩散式气体检测仪,因为它可以连续、实时、准确地显示现场的有毒有害气体的浓度。这类的新型仪器有的还配有振动警报附件以避免在嘈杂环境中听不到声音报警,并安装计算机芯片来记录峰值、STEL(15分钟短期暴露水平)和TWA(8小时统计权重平均值)为工人健康和安全提供具体的指导。 如果是进入密闭空间,比如反应罐、储料罐或容器、下水道或其它地下管道、地下设施、农业密闭粮仓、铁路罐车、船运货舱、隧道等工作场合,在人员进入之前,就必须进行检测,而且要在密闭空间外进行检测。此时,就必须选择带有内置采样泵的多气体检测仪。因为密闭空间中不同部位(上、中、下)的气体分布和气体种类有很大的不同。比如:一般意义上的可燃气体的比重较轻,它们大部分分布于密闭空间的上讯一氧化碳和空气的比重差不多,一般分布于密闭空间的中慨而象硫化氢等较重气体则存在于密闭空间的下部(如图所示)。同时,氧气浓度也是必须要检测的种类之一。另外,如果考虑到罐内可能的有机物质的挥发和泄漏,一个可以检测有机气体的检测仪也是需要的。因此一个完整的密闭空间气体检测仪应当是一个具有内置泵吸功能以便可以非接触、分部位检测具有多气体检测功能以检测不同空间分布的危险气体,包括无机气体和有机气侬具有氧检测功能防止缺氧或富辄体积小巧,不影响工人工作的便携式仪器。只有这样才能保证进入密闭空间的工作人员的绝对安全。 另外,进入密闭空间后,还要对其中的气体成分进行连续不断的检测,以避免由于人员进入、突发泄漏、温度等变化引起挥发性有机物或其它有毒有害气体的浓度变化。 如果用于应急事故、检漏和巡视,应当使用泵吸式、响应时间短、灵敏度和分辨率较高的仪器,这样可以很容易判断泄漏点的方位。 在进行工业卫生检测和健康调查的情况时,具有数据记录和统计计算以及可以联接计算机等功能的仪器应用起来就非常方便。来源:气体检测网
可燃气体检测仪探头安装高度1、可燃气体检测仪探头选点应选择阀门、管道接口、出气口或易泄漏处附近方圆1米的范围内, 尽可能靠近,但不要影响其它设备操作,同时尽量避免高温、高湿环境。探头用于大面积气体检测时可采用10~12平方米一个探头布置,也可达到检测报警效果。探头安装方式可采用房顶吊装、墙壁安装或抱管安装,应确保安装牢固可靠,同时应考虑便于维护、标定。可燃气体检测仪探头安装高度2、检测氢气、天然气、城市煤气等比重小于空气的气体时,采用距屋顶1米左右安装;检测液化石油气等比重大于空气的气体时,采用距地面1.5~2米左右安装。探头布线应采用三芯屏蔽电缆,单根线径大于1平方毫米,接线时屏蔽层必须接地。
[b]新上讲座:牛奶中细菌和体细胞检测技术举行时间:2017-12-15 10:00立即免费报名:[/b][url]http://www.instrument.com.cn/webinar/meeting_2925.html[/url][b][/b]主讲人:罗海峰,理学博士 福斯中国应用技术部经理 有10多年近红外应用和开发经验, 主要负责原料奶检测及乳制品加工过程的方案的推广和应用。[b]主要内容:[/b][color=black]1. 为什么检测牛奶中的细菌数和体细胞数?2. 细菌数和体细胞数的指标反映了牛奶中的什么问题?3. 是否可以同时获得牛奶细菌数和体细胞数,并快速获得检测结果?3. 总体细胞数的检测和体细胞分型计数;4. 福斯相应的解决方案。[/color]