由于ICP-MS需要用很高纯度的化学试剂,公司买了亚沸点酸纯化器用来纯化电子级别的化学试剂,发现纯化氢氟酸时,常常纯化出来很高浓度的砷。这是怎么回事呢?怎么样能去除呢?请高手指点下啊,小女子万分感激!
想采购一台酸纯化器,提纯盐酸、硝酸,请大家推荐品牌,谢谢。
大家在做金属元素的前处理时,硝酸、氢氟酸等都是用的哪个厂家的,是否使用了酸纯化器,你觉得酸纯化器有必要吗?
什么品牌的酸纯化器好,我们单位想购买1台,请大家赐教!
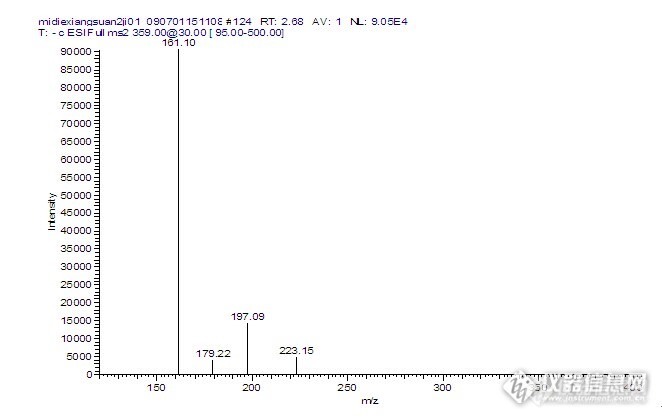
1 迷迭香酸的纯化方法1.1 NK109树脂的预处理新树脂均残留少量低聚物、有机物及有害离子,故使用前根据应用需要,必须进行不同深度的预处理。装柱前清洗设备及管道,以防有害物对树脂的污染。树脂装填后,以5%盐酸溶液浸泡24 h,水洗呈中性,放净水。以5%NaOH溶液浸泡24 h,水洗呈中性,放净水。用树脂体积0.5倍的丙酮、甲醇或乙醇浸泡24 h。用2倍柱体积(BV)丙酮、甲醇或乙醇,以2 BV/h的流速通过树脂层,并浸泡10h。用丙酮、甲醇或乙醇,以2 BV/h的流速通过树脂层,洗至流出液加水几乎不呈混浊状。并以水洗净丙酮、甲醇或乙醇。用2 BV的5%盐酸溶液,以4 BV/h ~ 6 BV/h的流速通过树脂层,并浸泡4h,而后用水以同样流速洗至出水pH中性,即可使用。树脂连续运行不必再进行预处理,停运前要充分解吸,以水洗净,并以丙酮浸泡以免细菌在树脂中繁殖。1.2 大孔吸附树脂NK109纯化迷迭香酸采用NK109型大孔吸附树脂精制迷迭香酸的最佳工艺条件:上柱浓度838.6 mg/L、上柱流速为2.0柱体积/小时(BV/h)为最佳吸附条件,乙酸乙酯作为洗脱液,采用1.0柱体积/小时(BV/h)的洗脱液流速,对迷迭香酸进行纯化。1.3 液-质联用对纯化后迷迭香酸制品定性液相条件:Model 1090高效液相色谱仪,LCQ Advantage Max质谱仪,色谱柱:Hypersil GOLD C18 5μ 100×2.1 mm,流动相:蒸馏水:乙腈为40:60(V/V),检测波长为280 nm,自动进样,体积流量:0.10 mL/min。质谱条件:ESI离子源,负离子模式。气帘气流量15 psi,电喷雾电压4200 V,离子源温度500℃,辅助雾化气30 psi,干燥气60 psi,分子量检测范围280~1000。2迷迭香酸的纯化结果2.1迷迭香酸的纯化制品采用1.2所述NK109型大孔吸附树脂精制迷迭香酸的最佳工艺条件对迷迭香酸进行纯化后得到纯度为90%的迷迭香酸。[size=14.0p

国产酸纯化器,2014年新型酸纯化器,有图有真相!国产中的高大上!可以排除废液,可视液位,绝对的使用方便,真正的高大上!经实践证明,产出的酸与merck的一样好! 可以满足ICP、ICP-MS极低的检测限需要及苛刻的分析应用。 这下再也不用担心高纯酸不够用了。 走过、路过、千万别忘了围观哦!http://simg.instrument.com.cn/bbs/images/default/em09502.gifhttp://simg.instrument.com.cn/bbs/images/default/em09502.gifhttp://ng1.17img.cn/bbsfiles/images/2014/07/201407090959_505983_2890345_3.jpg
国产酸上icp-ms背景有点高,进口的酸用下来成本太高,想买一台酸纯化蒸馏仪来自己纯化,大家有用过的推荐一下
实验室进了一台[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url],同行推荐必须要配一台酸蒸馏纯化器,避免由于酸纯度不够引起的结果偏差;请问各位高手是否有此必要,如有必要,买哪家的比较合适,国产的能不能满足要求。同行推荐的那款要七八万呢,是进口的。

国产酸纯化器,2014年新型酸纯化器,有图有真相!国产中的高大上!可以排除废液,可视液位,绝对的使用方便,真正的高大上!走过、路过、千万别忘了围观哦!http://simg.instrument.com.cn/bbs/images/default/em09502.gifhttp://simg.instrument.com.cn/bbs/images/default/em09502.gifhttp://simg.instrument.com.cn/bbs/images/default/em09502.gifhttp://ng1.17img.cn/bbsfiles/images/2014/07/201407070944_505658_2890345_3.jpg
大家好,实验室里的酸杂质好像有点多,空白较高,听仪器厂家说可以用酸纯化蒸一下就可以,这东西实用么?

,分享一张酸纯化的照片http://ng1.17img.cn/bbsfiles/images/2016/10/201610302254_615362_0_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/10/201610302254_615362_0_3.jpg
去药店买的双氧水是3%浓度的,请问可以用酸纯化器提高其浓度吗?
各位老师,单位领导想要换一台[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url],不知酸纯化器是不是一定要配?哪个厂家的比较好,价格还便宜一些?国产的也行。
我们单位的纯水机一直提示要换纯化柱,一直没有换、、、最近报了计划买纯水机和纯化柱、、、哪个划算点呢?
本人主要测痕量元素,用了几种硝酸后发现,国药的硝酸铅含量很低,能满足日常使用。但是铬含量依然不够理想(7ml消化定容到25ml后接近5个ppb,),但已属国产酸中最好的(个人认为),后来买了默克优级纯硝酸,发现铬的本底极低,甚至可以忽略不计,但价格有点贵。不适合大批量检验。 下面切入正题,我们单位正在报明年的设备采购计划,所以我想买一台酸纯化系统,但是对品牌,不太了解,而且对其实际使用效果尚存疑惑,是否真的能将一些元素含量降低到零点零几个ppb,若真有那种效果,就很物有所值了。 请使用过、或略有了解的朋友不吝赐教啊,说说品牌和实际效果,只说一句半句的也行,确实很需要“酸纯化”相关的信息!
[color=#333333]该文建立了大孔树脂-高速逆流色谱分离中药材地黄中有效成分毛蕊花糖苷的方法。考察了4种大孔树脂对地黄粗提物中毛蕊花糖苷的静态吸附与解吸情况,其中D101大孔树脂对目标成分的吸附率与解吸率最理想,实验结果表明体积分数为10%的乙醇洗脱得到的毛蕊花糖苷含量最高,目标成分含量从4.9%提高到32.6%。最后,部分纯化的样品(165 mg)采用高速逆流色谱进一步纯化,两相溶剂系统由乙酸乙酯-正丁醇-水(1∶4∶5,v/v/v)组成,分离得到45 mg纯度为96%的毛蕊花糖苷。 [/color]
化学试剂的纯化 在化学分析、仪器分析、无机制备、有机合成以及其他的科学实验工作中经常会遇到所用的化学试剂纯度不够,或买不到所需纯度的化学试剂,这就需要在实验室自己对现有的化学试剂进行纯化,以便得到所需纯度的化学试剂。实验室中常用的纯化化学试剂的方法有:蒸馏和精馏、重结晶、萃取、区域熔融和色谱分离等等,下面将分别加以简单介绍。 蒸馏和精馏 蒸馏和精馏是一种使用广泛的纯化方法,根据液体混合物中液体和蒸汽之间混合组分的分配差别进行纯化,是纯化挥发性和半挥发性化学试剂的第一选择。 蒸馏和精馏的实际应用 蒸馏和精馏主要用于液体、或是加热可成为液体的化学试剂,特别是用于有机化学试剂的纯化。在蒸馏或精馏之前,有时可加入某些化学试剂,与欲纯化的化学试剂中的杂质发生化学反应,生成沸点更高(或更低)的物质,在蒸馏或精馏是更容易除去。 在蒸馏或精馏时,往往是除去最初馏出的馏分和最后剩下的馏分,两头除去的越多,得到的化学试剂纯度就越高,但产率越低。 下面介绍几个用蒸馏或精馏方法纯化的化学试剂: 1. 盐酸的提纯: (1)除去一般杂质的盐酸 用三次离子交换水将一级盐酸按盐酸:水=7:3的体积比稀释(或按1:1稀释,按此比例稀释仅得到浓度为6N的盐酸)。将此盐酸1.5升装入2升的石英或硬质玻璃蒸馏瓶中,用可调变压器调节加热器,控制馏速为200毫升/小时,弃去前段馏出液150ml,取中段馏出液1升,所得的纯盐酸浓度为6.5-7.5N,铁、铝、钙、镁、铜、铅、锌、钴、镍、锰、铬、锡的含量在5′10-6--2′10-7%以下。 (2)除去砷的盐酸 用三次离子交换水将一级盐酸按7:3的体积比稀释,加入适量氧化剂(按体积加入2.5%硝酸或2.5%过氧化氢或高锰酸钾0.3克/1.5升)。将此盐酸1.5升装入2升的石英或硬质玻璃蒸馏瓶中,放置15分钟后,以100毫升/小时的馏速进行蒸馏。弃去前段馏出液150毫升,取中段馏出液1升备用。砷的含量在1′10-6%以下。 2. 硝酸的提纯 于2升硬质玻璃蒸馏器中,放入1.5升硝酸(一级品),在石墨电炉上借可调变压器调节电炉温度进行蒸馏,馏速为200-400毫升/小时,弃去初馏份150毫升,收集中间馏份1升。 将上述得到的中间馏份2升,放入3升石英蒸馏器中。将石英蒸馏器固定在石蜡浴中进行蒸馏,借可调变压器控制馏速为100毫升/小时。弃去初馏份150毫升,收集中间馏份1600毫升。铁、铝、钙、镁、铜、铅、锌、钴、镍、锰、铬、锡的含量在2′10-7%以下。
乙酸乙酯沸点77.06℃,折光率1.372 3,相对密度0.9003。乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。
常用有机试剂的纯化-丙酮 沸点56.2℃,折光率1.358 8,相对密度0.789 9。 普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有: ⑴于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。 ⑵将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加入3.6mL1mol/L氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。常用有机溶剂的纯化-四氢呋喃 沸点67℃(64.5℃),折光率1.405 0,相对密度0.889 2。 四氢呋喃与水能混溶,并常含有少量水分及过氧化物。如要制得无水四氢呋喃,可用氢化铝锂在隔绝潮气下回流(通常1000mL约需2~4g氢化铝锂)除去其中的水和过氧化物,然后蒸馏,收集66℃的馏分(蒸馏时不要蒸干,将剩余少量残液即倒出)。精制后的液体加入钠丝并应在氮气氛中保存。 处理四氢呋喃时,应先用小量进行试验,在确定其中只有少量水和过氧化物,作用不致过于激烈时,方可进行纯化。 四氢呋喃中的过氧化物可用酸化的碘化钾溶液来检验。如过氧化物较多,应另行处理为宜。常用有机溶剂的纯化-二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。 二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。常用有机溶剂的纯化-吡啶 沸点115.5℃,折光率1.509 5,相对密度0.981 9。 分析纯的吡啶含有少量水分,可供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。 常用有机溶剂的纯化-石油醚 石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。 石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。 常用有机溶剂的纯化-甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。 普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。 为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。常用有机溶剂的纯化-乙酸乙酯 沸点77.06℃,折光率1.372 3,相对密度0.900 3。 乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。常用有机溶剂的纯化-乙醚 沸点34.51℃,折光率1.352 6,相对密度0.713 78。普通乙醚常含有2%乙醇和0.5%水。久藏的乙醚常含有少量过氧化物 过氧化物的检验和除去:在干净和试管中放入2~3滴浓硫酸,1mL2%碘化钾溶液(若碘化钾溶液已被空气氧化,可用稀亚硫酸钠溶液滴到黄色消失)和1~2滴淀粉溶液,混合均匀后加入乙醚,出现蓝色即表示有过氧化物存在。除去过氧化物可用新配制的硫酸亚铁稀溶液(配制方法是FeSO4?H2O60g,100mL水和6mL浓硫酸)。将100mL乙醚和10mL新配制的硫酸亚铁溶液放在分液漏斗中洗数次,至无过氧化物为止。 醇和水的检验和除去:乙醚中放入少许高锰酸钾粉末和一粒氢氧化钠。放置后,氢氧化钠表面附有棕色树脂,即证明有醇存在。水的存在用无水硫酸铜检验。先用无水氯化钙除去大部分水,再经金属钠干燥。其方法是:将100mL乙醚放在干燥锥形瓶中,加入20~25g无水氯化钙,瓶口用软木塞塞紧,放置一天以上,并间断摇动,然后蒸馏,收集33~37℃的馏分。用压钠机将1g金属钠直接压成钠丝放于盛乙醚的瓶中,用带有氯化钙干燥管的软木塞塞住。或在木塞中插一末端拉成毛细管的玻璃管,这样,既可防止潮气浸入,又可使产生的气体逸出。放置至无气泡发生即可使用;放置后,若钠丝表面已变黄变粗时,须再蒸一次,然后再压入钠丝。
常用有机试剂的纯化-丙酮 沸点56.2℃,折光率1.358 8,相对密度0.789 9。普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有:⑴于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。⑵将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加入3.6mL1mol/L氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。常用有机溶剂的纯化-四氢呋喃 沸点67℃(64.5℃),折光率1.405 0,相对密度0.889 2。四氢呋喃与水能混溶,并常含有少量水分及过氧化物。如要制得无水四氢呋喃,可用氢化铝锂在隔绝潮气下回流(通常1000mL约需2~4g氢化铝锂)除去其中的水和过氧化物,然后蒸馏,收集66℃的馏分(蒸馏时不要蒸干,将剩余少量残液即倒出)。精制后的液体加入钠丝并应在氮气氛中保存。处理四氢呋喃时,应先用小量进行试验,在确定其中只有少量水和过氧化物,作用不致过于激烈时,方可进行纯化。四氢呋喃中的过氧化物可用酸化的碘化钾溶液来检验。如过氧化物较多,应另行处理为宜。常用有机溶剂的纯化-二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏 ,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。常用有机溶剂的纯化-吡啶 沸点115.5℃,折光率1.509 5,相对密度0.981 9。分析纯的吡啶含有少量水分,可供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。常用有机溶剂的纯化-石油醚 石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。常用有机溶剂的纯化-甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。常用有机溶剂的纯化-乙酸乙酯 沸点77.06℃,折光率1.372 3,相对密度0.900 3。乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。常用有机溶剂的纯化-乙醚 沸点34.51℃,折光率1.352 6,相对密度0.713 78。普通乙醚常含有2%乙醇和0.5%水。久藏的乙醚常含有少量过氧化物过氧化物的检验和除去:在干净和试管中放入2~3滴浓硫酸,1mL2%碘化钾溶液(若碘化钾溶液已被空气氧化,可用稀亚硫酸钠溶液滴到黄色消失)和1~2滴淀粉溶液,混合均匀后加入乙醚,出现蓝色即表示有过氧化物存在。除去过氧化物可用新配制的硫酸亚铁稀溶液(配制方法是FeSO4?H2O60g,100mL水和6mL浓硫酸)。将100mL乙醚和10mL新配制的硫酸亚铁溶液放在分液漏斗中洗数次,至无过氧化物为止。醇和水的检验和除去:乙醚中放入少许高锰酸钾粉末和一粒氢氧化钠。放置后,氢氧化钠表面附有棕色树脂,即证明有醇存在。水的存在用无水硫酸铜检验。先用无水氯化钙除去大部分水,再经金属钠干燥。其方法是:将100mL乙醚放在干燥锥形瓶中,加入20~25g无水氯化钙,瓶口用软木塞塞紧,放置一天以上,并间断摇动,然后蒸馏,收集33~37℃的馏分。用压钠机将1g金属钠直接压成钠丝放于盛乙醚的瓶中,用带有氯化钙干燥管的软木塞塞住。或在木塞中插一末端拉成毛细管的玻璃管,这样,既可防止潮气浸入,又可使产生的气体逸出。放置至无气泡发生即可使用;放置后,若钠丝表面已变黄变粗时,须再蒸一次,然后再压入钠丝。
[font=宋体][font=宋体]真核蛋白表达系统是一种广泛应用的蛋白表达方式,通常利用酵母、昆虫或哺乳动物细胞作为宿主。这种表达系统所生成的蛋白与目标[/font][font=Calibri]DNA[/font][font=宋体]具有极高的相似性,能诱导高效蛋白表达。那么,在实施真核蛋白表达时,有哪些关键的纯化步骤呢?接下来,我们将详细解析这一过程。[/font][/font][font=宋体] [/font][font=宋体]首先,我们要明确真核蛋白表达的纯化步骤是至关重要的环节。这些步骤不仅关系到最终产品的纯度和产量,还直接影响其生物活性和应用价值。因此,选择合适的纯化方法对于整个实验的成功至关重要。[/font][font=宋体] [/font][b][font=宋体]真核蛋白表达及纯化步骤主要有以下几个方面:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、重组质粒构建:将目的基因克隆进表达载体,常见的方法包括限制性切酶切割,基因合成等,根据连接酶说明,进行线性载体和目的基因片段的酶联,最后对质粒测序做好验证;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、蛋白诱导表达:普适条件下查看蛋白是否表达,若不表达,更换载体,表达菌株等方法查看是否表达,如果表达,继续实验;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、蛋白表达部位分析:分析蛋白是可溶性还是不溶性的表达,即在超声后上清表达还是沉淀表达;是否与你的目标蛋白表达部位相同,相同进行后续蛋白表达条件优化;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、蛋白表达优化:优化诱导[/font][font=Calibri]IPTG[/font][font=宋体]浓度、诱导温度,进行放大培养;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、蛋白纯化:根据目标蛋白的性质进行样本处理,然后进行亲和纯化,获取目的蛋白。[/font][/font][font=宋体] [/font][font=宋体][b]真核表达系统的选择与应用[/b][/font][font=宋体]酵母蛋白表达系统[/font][font=宋体]酵母真核蛋白表达系统有甲醇酵母表达系统,酿酒酵母表达系统,裂殖酵母表达系统以及克鲁维酸酵母表达系统等,其中最早应用于基因工程的酵母是酿酒酵母,但现在运用最广泛的酵母表达系统还是甲醇酵母表达系统中的毕赤酵母真核蛋白表达系统。[/font][font=宋体] [/font][font=宋体]哺乳动物细胞表达系统[/font][font=宋体][font=宋体]哺乳动物细胞表达系统是真核表达系统中唯一可以表达复杂蛋白的系统,它能够指导真核表达蛋白进行正确折叠,提供复杂的[/font][font=Calibri]N[/font][font=宋体]型糖基化和准确的[/font][font=Calibri]O[/font][font=宋体]型糖基化等多种翻译后加工功能,所以它和昆虫酵母系统比较更具有发展潜力,哺乳动物细胞真核表达的蛋白与天然真核表达蛋白的结构、糖基化类型和方式几乎相同且能正确组装成多亚基蛋白[/font][font=Calibri],[/font][font=宋体]但成本较高也一定程度上减缓了它的发展速度。哺乳动物细胞表达系统主要是通过改造宿主细胞来提高外源蛋白的表达效率,常用的宿主细胞有[/font][font=Calibri]CHO[/font][font=宋体]、[/font][font=Calibri]COS[/font][font=宋体]、[/font][font=Calibri]BHK[/font][font=宋体]、[/font][font=Calibri]SP2 /0N[/font][font=宋体]等,哺乳动物转染方法[/font][font=Calibri]*[/font][font=宋体]有脂质体转染法,电穿孔法以及病毒转染等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques][b]蛋白纯化技术[/b][/url]:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-techniques[/font][/font][font=Calibri] [/font]
跪求强酸性阳离子交换树脂分离纯化黑曲霉发酵液中的柠檬酸方法,使用仪器核酸蛋白检测仪(波长多少?)实验步骤?实验所用洗脱剂?洗脱下来之后怎么检测柠檬酸含量?如何证明是柠檬酸?如何侧柠檬酸含量?。。。无语无助ing。。。目前在用280纳米核酸蛋白检测仪,恒流泵,记录仪,百分之一氨水洗脱,,下一步如何测柠檬酸含量啊啊啊啊,,,,,
溶剂纯化系统http://www.zhonghuida.com/imageRepository/367772f9-d0a6-4513-ad18-97358b20c4ff.png产品特点 新型醇和胺类溶剂干燥柱及过滤设计 各种配置和尺寸 取代传统热蒸馏除水方法 完全避免蒸汽间交叉污染 可隔绝空气提取超干燥和无氧溶剂 可同时接收所有溶剂 顶部空出通风位置 可集成手套箱 带可移动支架及阻燃柜 标准 5 加仑溶剂储存罐采用惯用的防泄漏螺 旋盖子和 Swagelok 快速拆卸阀,便于操作和溶剂续装。系统通过一个可伸缩夹子接地,防止静电危害,保证安全操作环境。系统纯化柱处理容量为 800L,柱子可以再生或者更换。可选择台式、可移动式和固定式几种型号。http://www.zhonghuida.com/imageRepository/67eb511e-fa32-476d-aea6-601ddeaa72e9.gif 在低氮压力下,溶剂从储液罐中被迫进入分别装有活性铝(activated alumina)及铜(Copper)的纯化圆管进行除氧脱水,并通过过滤器除去微小颗粒。处理后的溶剂会排到已抽真空并被氮洗涤过的玻璃器皿中。 每种溶剂包含两条纯化圆管,不锈钢,经压力测试,可净化800升溶剂(再生程序需要之前)。技术参数材料框架材料:铝 处理方法:阳极化抛光 管件材料:304 不锈钢接头和阀门:Swagelok 不锈钢泄漏率氦质谱仪法未检测到有泄漏分配器不锈钢 24/40-14/20-29/24-Luer Lock 针型阀通风可选排风管气体参数内部气体压力:5 PSI 惰性气体:N2 – Ar 气体连接:只需一个气体供应点,可同时分配给不同溶剂纯化柱参数纯化柱材料:依溶剂不同而不同微粒过滤:纯化柱配备 7micron 不锈钢微粒过滤器净化能力:吸水能力为 5%重量含量 最终水氧含量水平:低PPM 级可净化溶剂芳香和脂肪族碳氢化合物:戊烷,己烷,环己烷,正庚烷,甲苯,苯 醚类:乙醚,四氢呋喃,二甲醚 含氯溶剂:二氯甲烷,氯仿,氯苯 胺类溶剂:三乙胺,吡啶,二异丙基乙基胺 醇:甲醇,乙醇其他通用溶剂:乙腈,DMF,DMSO,丙酮 其他定制溶剂阀门导向阀门:每种溶剂皆有 五通阀门以控制溶剂、气体和真空 安全阀门:歧管在外露铝质框架内,包含真空显示表,调节器及安全阀,避免玻璃器皿过分受压计量阀门:利用 计量阀门来控制输出流量 对比内容 传统蒸馏新型溶剂纯化系统纯化结果(正己烷中的水)20PPM1PPm使用安全性需要加热沸腾,有危险无须加热,密闭安全使用便利性较复杂简便,易掌握纯化所需时间几小时几分钟综合使用成本较高较低
[font=宋体][b]蛋白纯化的原理:[/b][/font][font=宋体]不同的重组蛋白具有不同的氨基酸序列和空间结构,导致其物理、化学和生物学特性存在差异。我们也可以根据目标蛋白与其他蛋白和裂解液的性质差异设计合理的蛋白纯化方案。[/font][font=宋体] [/font][font=宋体][font=宋体]大多数的纯化方案需要不止一步才能达到理想的纯度水平。该过程中的每一步都会造成一定的产品损失,假设每一步的获得率为[/font][font=Calibri]80%[/font][font=宋体]。因此,建议尽可能减少纯化步骤。起始原料的选择是纯化过程设计的关键。[/font][/font][font=宋体] [/font][font=宋体]在背景信息、检测方法和样品规格都已到位的情况下,可以考虑采用三阶段纯化策略。纯化分为捕获、中度纯化和精细纯化三个阶段,每个阶段都有特定的目标。捕获阶段的目标是分离、浓缩和稳定目标产物。[/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]蛋白纯化实际操作:[/font][/b][font=宋体] [/font][font=宋体]理想情况下,最终的纯化过程包括样品制备,其中包括在需要时进行萃取和澄清,然后进行上述三个阶段的纯化。步骤的数量始终取决于所需的纯度和蛋白的预期用途。[/font][font=宋体] [/font][font=宋体][font=宋体]分析纯化通常利用三个特性来分离蛋白。首先,蛋白可以通过[/font][font=Calibri]pH[/font][font=宋体]梯度凝胶或离子交换柱,根据其等电点进行纯化。其次,根据蛋白大小或分子量,可以通过体积排除色谱法分离或通过[/font][font=Calibri]SDS-PAGE([/font][font=宋体]十二烷基硫酸钠[/font][font=Calibri]-[/font][font=宋体]聚丙烯酰胺凝胶电泳[/font][font=Calibri])[/font][font=宋体]分析。通常采用[/font][font=Calibri]2D-PAGE[/font][font=宋体]对蛋白进行纯化,然后进行肽质量指纹图谱分析,以确定蛋白的特性。这对于实现科学目的非常有用,目前蛋白的检测限非常低,纳克级的蛋白足以用于分析。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]如何应用纯化原则:[/b][/font][font=宋体]①纯化技术的选择和组合:[/font][font=宋体]这种组合的目的是发展出一条最快的方法来获得所需纯度的产品。对于任何色谱分离来说,不同的技术在回收率、分辨率、速度和容量方面的表现都各不相同。我们可以对一种技术进行优化,使其专注于其中一个参数;例如分辨率要在速度和容量两个参数之间达到最佳。[/font][font=宋体] [/font][font=宋体]分辨率是通过技术的选择和色谱基质产生窄峰的效率来实现的。一般来说,此时目标蛋白和杂质具有非常相似的性质,分辨率是最难实现的。[/font][font=宋体] [/font][font=宋体][font=宋体]②标签蛋白的纯化[/font][font=Calibri]:[/font][/font][font=宋体][font=宋体]在蛋白中添加标签可以使蛋白具有它本来不具有的结合亲和力。通常重组蛋白是混合物中唯一具有这种亲和力的蛋白,有助于蛋白分离。最常见的标签是对镍或钴离子有亲和力的组氨酸标签([/font][font=Calibri]His[/font][font=宋体]标签)。因此,我们通过将镍离子或钴离子固定在树脂上,可以创建与组氨酸标签蛋白特异性结合的亲和介质。[/font][/font][font=宋体] [/font][font=宋体]③评估纯化产量:[/font][font=宋体][font=宋体]通常使用[/font][font=Calibri]SDS PAGE[/font][font=宋体]监测纯化过程中的不同步骤。这一方法只能粗略地测量混合物中不同蛋白的量,并且无法区分具有相似分子量的蛋白。为了评估多步纯化的过程,必须将特定蛋白的量与总蛋白的量进行比较。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]蛋白表达纯化实验中注意事项有哪些?[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]选择表达载体时,要根据所表达蛋白的最终应用考虑。如为方便纯化,可选择融合表达;如为获得天然蛋白,可选择非融合表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]融合表达时在选择外源[/font][font=Calibri]DNA[/font][font=宋体]同载体分子连接反应时,对转录和转译过程中密码结构的阅读不能发生干扰。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]菌液[/font][font=Calibri]OD[/font][font=宋体]值要小于[/font][font=Calibri]1[/font][font=宋体],否则细胞太浓太老,不易破碎,且质粒易丢失。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]诱导时间最好做一个梯度,不同蛋白诱导时间需摸索。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5. [/font][font=宋体]诱导温度适当摸索。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6. IPTG[/font][font=宋体]浓度:一般在[/font][font=Calibri]1 mM [/font][font=宋体]以内,可适当摸索。[/font][/font][font=宋体] [/font][font=宋体]7. [/font][font=宋体]超声条件可视实际情况改变,只要使菌体裂解充分即可,即菌液清亮不粘稠。[/font][font=宋体][b]义翘神州提供[/b][url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]原核蛋白纯化服务[/b][/url][b],服务内容包括:[/b][/font][font=宋体]①基因合成及密码子优化[/font][font=宋体]②载体构建[/font][font=宋体]③表达鉴定和可溶性分析[/font][font=宋体][font=宋体]④放大表达和[/font][font=Calibri]1-2[/font][font=宋体]步纯化[/font][/font][font=宋体]⑤大量表达及纯化[/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/e-coli-protein-expression-service[/font][/font]
[font=宋体]重组蛋白的纯化是生物学研究中的重要技术。为了研究蛋白的特定功能和结构,研究人员必须将重组蛋白从生物体中分离并纯化。蛋白纯化方法主要利用不同重组蛋白之间的相似性和差异性。可以根据蛋白之间的相似性去除非蛋白物质,然后根据蛋白之间的差异分离纯化目标重组蛋白。在蛋白纯化的过程中,我们可能会遇到一些问题。让我们一起来看看这些问题,并探讨相应的解决方案吧![/font][font=宋体] [/font][b][font=宋体]蛋白纯化过程中的七大常见问题详解:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]通过 [/font][font=Calibri]His [/font][font=宋体]标签纯化的蛋白,杂带比较多,如何改进?[/font][/font][font=宋体] [/font][font=宋体]①若纯化的是上清液,蛋白酶可能会对目的蛋白产生部分降解作用。为改善此情况,可尝试加入多种蛋白酶抑制剂。[/font][font=宋体] [/font][font=宋体]②为降低杂蛋白与镍柱的亲和力,可提高杂蛋白与镍柱结合起始咪唑浓度。[/font][font=宋体] [/font][font=宋体][font=宋体]③若杂蛋白与目的蛋白结合,可在超声处理前加入适量的去垢剂(如[/font][font=Calibri]1%-2% Tritonx-100[/font][font=宋体]),以消除此现象。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]镍柱使用中出现棕色是怎么回事[/font][font=Calibri]?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]当使用镍柱时出现棕色,这主要是由于缓冲液中的[/font] [font=Calibri]DTT [/font][font=宋体]引起的。[/font][font=Calibri]DTT [/font][font=宋体]对镍柱的颜色和纯化效率有很大的影响。在碱性缓冲液条件下,镍离子会被 [/font][font=Calibri]DTT [/font][font=宋体]还原生成棕色的沉淀。因此,所有的镍柱生产商都强调要尽量避免 [/font][font=Calibri]DTT [/font][font=宋体]的参与。一般来说,镍柱的耐受性小于 [/font][font=Calibri]5mM DTT[/font][font=宋体],推荐缓冲液中不要超过 [/font][font=Calibri]2mM DTT[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]镍柱堵了怎么办?[/font][/font][font=宋体] [/font][font=宋体]①样品处理:在样品中可能存在细胞碎片或其他杂颗粒,这些杂质可能会导致柱子堵塞。因此,在将样品加载到柱子上之前,必须对样品进行高速离心处理,以确保只加载纯净的样品。[/font][font=宋体][font=宋体]②加入蛋白酶抑制剂:如果在纯化上清液时发现蛋白变性,产生了絮状物,应立即加入[/font][font=Calibri]1-2mM DTT[/font][font=宋体],以避免变性导致的蛋白质聚集。加入[/font][font=Calibri]DTT[/font][font=宋体]的操作应在冰浴中进行。如果加入[/font][font=Calibri]DTT[/font][font=宋体]后问题仍未解决,可以进一步加入尿素以变性蛋白质,使其在变性环境下稳定。[/font][/font][font=宋体][font=宋体]③调整料液比:样品处理时的料液比不要太小,否则黏度大或导致蛋白析出或变性。料液比在[/font][font=Calibri]1/10-1/15[/font][font=宋体]之间较为适宜。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]纯化过程中,蛋白出现了浑浊,怎么办?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]在纯化过程中,如果蛋白出现浑浊,可能是由于蛋白处于不稳定的环境中或其本身不稳定所导致的。因此,需要检查缓冲体系是否正确以及环境是否低温。此外,为了提高蛋白的稳定性,可以在缓冲液中加入还原剂[/font][font=Calibri]DTT[/font][font=宋体]。另一种解决方案是加入肌氨酸钠,这可以迅速使蛋白变性并消除浑浊现象。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5. [/font][font=宋体]没能纯化到带 [/font][font=Calibri]His [/font][font=宋体]标签的蛋白,蛋白都流穿了(未挂柱)?[/font][/font][font=宋体] [/font][font=宋体]①超声功率问题:[/font][font=宋体]超声功率过大可能导致蛋白炭化,而过小则可能使蛋白没有充分释放。[/font][font=宋体]策略:尝试调整超声功率,并在超声处理前加入适量的溶菌酶。[/font][font=宋体] [/font][font=宋体]②样品及结合缓冲液问题:[/font][font=宋体][font=宋体]样品或结合缓冲液的[/font][font=Calibri]pH[/font][font=宋体]值不正确,或缓冲液中的成分(如[/font][font=Calibri]EDTA[/font][font=宋体])可能影响蛋白的结合。[/font][/font][font=宋体][font=宋体]策略:检测样品和结合缓冲液的[/font][font=Calibri]pH[/font][font=宋体]值以及成分,确保它们是正确的和适合的。[/font][/font][font=宋体] [/font][font=宋体]③组氨酸标签暴露问题:[/font][font=宋体]如果组氨酸标签没有完全暴露,将影响蛋白与镍柱的结合。[/font][font=宋体][font=宋体]策略:在变性条件下(如使用[/font][font=Calibri]8M[/font][font=宋体]脲,[/font][font=Calibri]6M[/font][font=宋体]盐酸胍,[/font][font=Calibri]1%SDS[/font][font=宋体]),并加入[/font][font=Calibri]1-2mMDTT[/font][font=宋体]进行纯化。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]④[/font][font=Calibri]His[/font][font=宋体]标签丢失问题:[/font][/font][font=宋体][font=Calibri]His[/font][font=宋体]标签丢失可能是由于蛋白在纯化过程中发生了降解或脱落。[/font][/font][font=宋体][font=宋体]策略[/font][font=Calibri]1[/font][font=宋体]:通过[/font][font=Calibri]WB[/font][font=宋体]或[/font][font=Calibri]anti-his[/font][font=宋体]抗体检查[/font][font=Calibri]His[/font][font=宋体]标签是否存在,检查上游构建是否正确,并尝试改变[/font][font=Calibri]His-tag[/font][font=宋体]的位置([/font][font=Calibri]C-terminal[/font][font=宋体]或[/font][font=Calibri]N-terminal[/font][font=宋体]),必要时增加[/font][font=Calibri]His[/font][font=宋体]标签的数量。[/font][/font][font=宋体][font=宋体]策略[/font][font=Calibri]2[/font][font=宋体]:孵育时间不足可能导致蛋白未能充分结合。降低流速并增加孵育时间可能有助于提高蛋白的结合效率。[/font][/font][font=宋体][font=宋体]策略[/font][font=Calibri]3[/font][font=宋体]:不同的金属离子可能对蛋白与镍柱的结合产生影响。尝试改变螯合的金属离子,寻找到最佳的结合金属离子。例如,[/font][font=Calibri]Ni2+[/font][font=宋体]通常是首选的金属离子用于从宿主细胞蛋白中纯化大多数组氨酸[/font][font=Calibri]6[/font][font=宋体]标记的重组蛋白质。但是,有些蛋白可能更适合使用其他金属离子进行纯化而非[/font][font=Calibri]Ni2+[/font][font=宋体]。可以通过[/font][font=Calibri]Hitrap IMACHP[/font][font=宋体]来筛选不同的金属离子。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6. [/font][font=宋体]蛋白挂在柱子上洗脱不下来[/font][font=Calibri],[/font][font=宋体]怎么解决?[/font][/font][font=宋体] [/font][font=宋体]①洗脱条件太温和:[/font][font=宋体]如果洗脱条件过于温和,可能导致组氨酸标记的蛋白质仍然与柱子结合,因为结合力较强。[/font][font=宋体][font=宋体]策略:尝试增加咪唑的梯度洗脱,或者降低[/font][font=Calibri]pH[/font][font=宋体]来找出最佳的洗脱条件。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]②降低[/font][font=Calibri]pH[/font][font=宋体]方法洗脱的问题:[/font][/font][font=宋体][font=宋体]如果使用降低[/font][font=Calibri]pH[/font][font=宋体]的方法进行洗脱,但[/font][font=Calibri]pH[/font][font=宋体]值过低可能会导致镍离子脱落。[/font][/font][font=宋体]策略:改变洗脱方法,使用咪唑竞争性洗脱。[/font][font=宋体] [/font][font=宋体]③蛋白已沉淀在柱上的问题:[/font][font=宋体]有时蛋白可能已经沉淀在柱上。[/font][font=宋体][font=宋体]策略:减少上样量和孵育的时间,尝试使用去污剂(如[/font][font=Calibri]1%-2% Tritonx-100[/font][font=宋体])或改变[/font][font=Calibri]NaCl[/font][font=宋体]的浓度。还可以在变性条件下进行洗脱(如使用[/font][font=Calibri]8M[/font][font=宋体]脲或[/font][font=Calibri]6M [/font][font=宋体]盐酸胍),最终也可以在洗脱[/font][font=Calibri]Buffer[/font][font=宋体]中加入[/font][font=Calibri]2mMDTT[/font][font=宋体]或者[/font][font=Calibri]0.5%[/font][font=宋体]肌氨酸钠进行洗脱。[/font][/font][font=宋体] [/font][font=宋体]④非特异性疏水或其他相互反应的问题:[/font][font=宋体]可能是由于非特异性疏水或其他相互反应导致蛋白挂在柱子上。[/font][font=宋体][font=宋体]策略:在洗脱缓冲液中加入非离子去污剂(如[/font][font=Calibri]2% Triton X-100[/font][font=宋体])或者增加[/font][font=Calibri]NaCl[/font][font=宋体]的浓度。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7. [/font][font=宋体]如何处理样品,可使其初步提纯(如何洗去蛋白的自身带)?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]1[/font][font=宋体])上清样品处理,要加入去污剂,蛋白酶抑制剂,还原剂,还要注意温度及超声破碎的参数。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]2[/font][font=宋体])去大肠杆菌自身带(两条 [/font][font=Calibri]30KD-40KD[/font][font=宋体])可用非变性缓冲液超声悬浮(加入去垢剂),离心 [/font][font=Calibri]6000r/min,30min,10[/font][font=宋体]℃。(若效果不够可继续上述步骤)。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]3[/font][font=宋体])大肠杆菌包涵体的洗涤,可用包涵体洗液多洗几遍,也可用 [/font][font=Calibri]1M/2M/4M/8M [/font][font=宋体]尿素逐步溶解,可选取其中纯度最佳的。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]4[/font][font=宋体])可用硫酸铵沉淀法,初步提纯。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多关于[url=https://cn.sinobiological.com/resource/protein-review/protein-purification][b]蛋白[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-purification][b]纯化[/b][/url]相关问题的可以查看[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font][font=宋体] [/font][font=宋体] [/font]
谁知分离纯化绿原酸用什么树脂比较好??
最近在做氨基酸的提取,得到的溶液中有混合氨基酸、寡糖、寡肽等小分子极性成分,现在想纯化氨基酸,不知道该怎么办,求助各位高手,谢谢! PS:以后打算上工艺的,希望大虾们提供些工业上能用的,多谢!拜托!
常用有机溶剂的纯化-丙酮 沸点56.2℃,折光率1.358 8,相对密度0.789 9。 普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有: ⑴于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。⑵将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加3.6mL1mol/L氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。常用有机溶剂的纯化-四氢呋喃 沸点67℃(64.5℃),折光率1.405 0,相对密度0.889 2。四氢呋喃与水能混溶,并常含有少量水分及过氧化物。如要制得无水四氢呋喃,可用氢化铝锂在隔绝潮气下回流(通常1000mL约需2~4g氢化铝锂)除去其中的水和过氧化物,然后蒸馏,收集66℃的馏分蒸馏时不要蒸干,将剩余少量残液即倒出)。精制后的液体加入钠丝并应在氮气氛中保存。处理四氢呋喃时,应先用小量进行试验,在确定其中只有少量水和过氧化物,作用不致过于激烈时,方可进行纯化。四氢呋喃中的过氧化物可用酸化的碘化钾溶液来检验。如过氧化物较多,应另行处理为宜。常用有机溶剂的纯化-二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏 ,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。常用有机溶剂的纯化-吡啶沸点115.5℃,折光率1.509 5,相对密度0.981 9。分析纯的吡啶含有少量水分,可供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。常用有机溶剂的纯化-石油醚石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。常用有机溶剂的纯化-甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。 常用有机溶剂的纯化-乙酸乙酯沸点77.06℃,折光率1.372 3,相对密度0.900 3。乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。常用有机溶剂的纯化-乙醚沸点34.51℃,折光率1.352 6,相对密度0.713 78。普通乙醚常含有2%乙醇和0.5%水。久藏的乙醚常含有少量过氧化物过氧化物的检验和除去:在干净和试管中放入2~3滴浓硫酸,1mL2%碘化钾溶液(若碘化钾溶液已被空气氧化,可用稀亚硫酸钠溶液滴到黄色消失)和1~2滴淀粉溶液,混合均匀后加入乙醚,出现蓝色即表示有过氧化物存在。除去过氧化物可用新配制的硫酸亚铁稀溶液(配制方法是FeSO4?H2O60g,100mL水和6mL浓硫酸)。将100mL乙醚和10mL新配制的硫酸亚铁溶液放在分液漏斗中洗数次,至无过氧化物为止。醇和水的检验和除去:乙醚中放入少许高锰酸钾粉末和一粒氢氧化钠。放置后,氢氧化钠表面附有棕色树脂,即证明有醇存在。水的存在用无水硫酸铜检验。先用无水氯化钙除去大部分水,再经金属钠干燥。其方法是:将100mL乙醚放在干燥锥形瓶中,加入20~25g无水氯化钙,瓶口用软木塞塞紧,放置一天以上,并间断摇动,然后蒸馏,收集33~37℃的馏分。用压钠机将1g金属钠直接压成钠丝放于盛乙醚的瓶中,用带有氯化钙干燥管的软木塞塞住。或在木塞中插一末端拉成毛细管的玻璃管,这样,既可防止潮气浸入,又可使产生的气体逸出。放置至无气泡发生即可使用;放置后,若钠丝表面已变黄变粗时,须再蒸一次,然后再压入钠丝。
大肠杆菌表达蛋白以可溶和不溶两种形式存在,需要不同的纯化策略。现在,许多蛋白质正在被发现而事先并不知道它们的功能,这些自然需要将蛋白质纯化出来后,进行进一步的研究来获得。分析蛋白质的方法学现已极大的简化和改进。必须承认,表达蛋白纯化比起DNA克隆和操作来是更具有艺术性的,尽管DNA序列具有异乎寻常的多样性(因而它是唯一适合遗传物质的),但它却有标准的物理化学性质,而每一种蛋白质则有它自己的由氨基酸序列决定的物理化学性质(因而它具有执行众多生物学功能的用途)。正是蛋白质间的这些物理性质上的差异使它们得以能进行纯化但这也意味着需要对每一种待纯化的蛋白质研发一套新的方法。所幸的是,尽管存在这种固有的困难,但现已有多种方法可以利用,蛋白质纯化策略也已实际可行。目前,待研究蛋白或酶的基因的获得已是相当普遍的事。可诱导表达系统特别是Studier等发展的以噬菌体T7RNA聚合酶为基础的表达系统的出现使人们能近乎常规地获得过表达(overexpression),表达水平可达细胞蛋白的2%以上,有些甚至高达50%.(一)试剂准备采用T7· Tag Affinity Purification Kit1. T7·Tag抗体琼脂。2. B/W缓冲液:4.29mM Na2HPO4,1.47 mM KH2PO4,2.7 mM KCl,3. 0.137mM NaCl,1%吐温-20,pH7.3。4. 洗脱缓冲液: 0.1M柠檬酸,pH2.2。5. 中和缓冲液:2M Tris,pH10.4.6. PEG 20000.(二)操作步骤1.100ml 含重组表达质粒的菌体诱导后,离心5000g×5min,弃上清,收获菌体,用10ml预冷的B/W缓冲液重悬。2. 重悬液于冰上超声处理,直至样品不再粘稠,4℃离心 14000g×30min,取上清液,0.45μm膜抽滤后作为样品液。3. 将结合T7·Tag抗体的琼脂充分悬起,平衡至室温,装入层析柱中。4. B/W缓冲液平衡后样品液过柱。5. 10ml B/W缓冲液过柱,洗去未结合蛋白。6. 用5ml洗脱缓冲液过柱,每次1ml,洗脱液用含150μl中和缓冲液的离心管收集,混匀后置于冰上,直接SDS-PAGE分析。7. 将洗脱下来的蛋白放入透析袋中,双蒸水透析24hr,中间换液数次。8. 用PEG 20000浓缩蛋白。(三)注意事项蛋白在过层析柱前,要0.45μm膜抽滤,否则几次纯化后,柱子中会有不溶物。
皂苷纯化中使用乙酸乙酯,但是后来说是不能使用乙酸乙酯,搜索也没找到原因,这个国家是有什么要求吗?具体指标多少啊?