蛋白质免疫亲和活性浓度绝对测量方法的建立
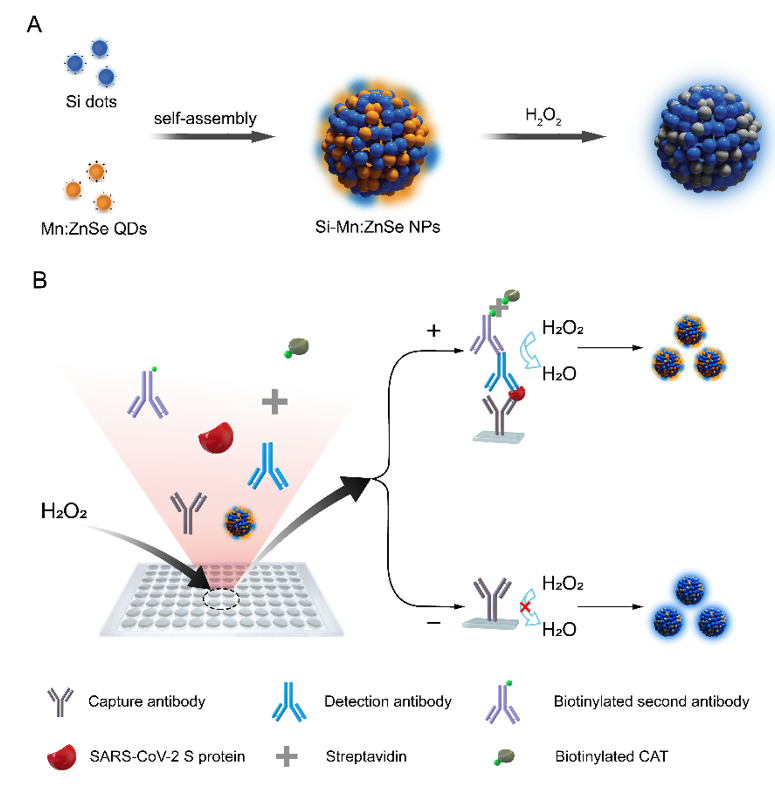
p style=" margin-top: 10px margin-bottom: 10px line-height: 1.75em text-align: left text-indent: 2em " span style=" text-indent: 2em " 近期,中国计量科学研究院武利庆及其合作者杨屹、苏萍等发表系列文章(Anal.Bioanal.Chem. 412(2020)2777-2784、Talanta 178(2018)78-84、Microchem. J. 157(2020)104954),介绍了基于表面等离子共振光谱法和数字ELISA的蛋白质免疫亲和活性浓度绝对测量方法。 /span br/ /p p style=" text-indent: 2em margin-top: 10px margin-bottom: 10px line-height: 1.75em " 蛋白质是一类重要的生物大分子,免疫分析是其常用的定量分析手段,在测量和质控中不仅关心目标蛋白的含量,更为关注它的活性与功能,其量值的准确对于保证人民大众健康与安全具有重要意义。活性浓度测量手段的匮乏限制了蛋白质产品活性量值的质控与标准的建立。 /p p style=" text-indent: 2em margin-top: 10px margin-bottom: 10px line-height: 1.75em " 针对这一难题,作者以G2-EPSPS、人肌红蛋白为例,通过表面等离子共振,在部分传质限制条件下,通过扩散速率等测定直接计算出可被抗体识别的目标蛋白浓度,即免疫亲和活性浓度;或采用寡聚核酸标记抗体,借助邻位连接技术和数字PCR技术,以数字ELISA的方式直接测定样本中目标蛋白的免疫亲和活性浓度。两种方法均无需外部标准品,是一种绝对测量手段。 /p p style=" text-indent: 2em margin-top: 10px margin-bottom: 10px line-height: 1.75em " & nbsp /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 600px height: 241px " src=" https://img1.17img.cn/17img/images/202010/uepic/06042747-02ad-460f-82a4-752c907691ff.jpg" title=" 图片1.png" alt=" 图片1.png" width=" 600" height=" 241" border=" 0" vspace=" 0" / /p p style=" margin-top: 10px margin-bottom: 10px line-height: 1.75em text-indent: 0em text-align: center " 图1 基于表面等离子共振技术的蛋白免疫活性浓度测定原理图 span style=" text-align: center text-indent: 0em " & nbsp /span /p p style=" text-align: center" img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/202010/uepic/82c05090-1aa2-4789-9467-c4fd8c632095.jpg" title=" 图片2.png" alt=" 图片2.png" / /p p style=" margin-top: 10px margin-bottom: 10px line-height: 1.75em text-indent: 0em text-align: center " 图2 基于数字ELISA技术的蛋白免疫活性浓度测定原理图 /p p style=" text-indent: 2em margin-top: 10px margin-bottom: 10px line-height: 1.75em " & nbsp /p p style=" text-indent: 2em margin-top: 10px margin-bottom: 10px line-height: 1.75em " 蛋白质免疫亲和活性浓度的绝对测定将有助于准确表征蛋白质与其抗体之间的相互作用,保证免疫分析的准确可靠,同时有助于蛋白质产品的活性量值的质控与标准的建立。 /p p style=" text-indent: 2em margin-top: 10px margin-bottom: 10px line-height: 1.75em " 2020年11月10-12日,中国计量科学研究院和国际计量局拟联合举办第三届 “药物及诊断试剂研发与质控——测量与标准,质量与安全(TD-MSQS 2020)” 国际研讨会,以期进一步促进该领域的学术交流和技术发展,提升企业的研发水平和产品质量。本次会议将在南京市政府的支持下,在江苏省南京市举行。 /p p style=" text-indent: 2em margin-top: 10px margin-bottom: 10px line-height: 1.75em " 本次会议可通过官方网站 a href=" http://tdmsqs.ncrm.org.cn" target=" _blank" http://tdmsqs.ncrm.org.cn /a 注册或扫描二维码注册,注册成功后请填写参会回执发送至会议邮箱pptd@nim.ac.cn。 /p p style=" text-align: center" img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/202010/uepic/c475b4b8-ad00-4d02-bdea-04a9663c0909.jpg" title=" 图片5.png" alt=" 图片5.png" / /p p style=" margin-top: 10px margin-bottom: 10px line-height: 1.75em text-indent: 0em text-align: center " 欢迎各位专家、同仁报名参会! /p p style=" text-indent: 2em margin-top: 10px margin-bottom: 10px line-height: 1.75em " 更多信息请关注会议官方网站: a href=" http://tdmsqs.ncrm.org.cn。" _src=" http://tdmsqs.ncrm.org.cn。" http://tdmsqs.ncrm.org.cn。 /a /p p style=" text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " strong 学者简介: /strong /span /p p style=" text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 武利庆,研究员,中国计量科学研究院前沿计量科学中心蛋白质室主任 /span /p p style=" text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 杨屹,教授,北京化工大学化学学院 /span /p p style=" text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 苏萍,副教授,北京化工大学化学学院 /span /p