测试秘籍丨原子力显微镜(AFM)
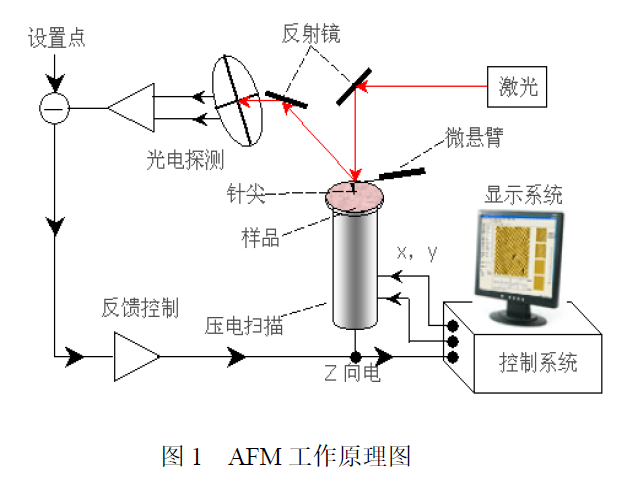
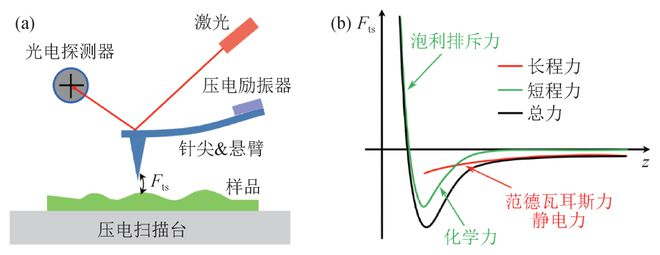
原子力显微镜(Atomic Force Microscopy,AFM)是一种具有原子级别高分辨率的新型表面分析仪器,它不但能像扫描隧道显微镜(STM)那样观察导体和半导体材料的表面现象,而且能用来观察诸如玻璃、陶瓷等非导体表面的微观结构,还可以在气体、水和油中无损伤地直接观察物体,大大地拓展了显微技术在生命科学、物理、化学、材料科学和表面科学等领域中的应用,具有广阔的应用前景。1 原子力显微镜的工作原理1.1 基本原理AFM 进行表面分析的基本原理如下:AFM 中有一由氮化硅片或硅片制成的对微弱力极敏感的弹性臂,微悬臂顶端有一硅或碳纳米管等材料制成的微小针尖,控制这一针尖,使其扫描待测样品的表面,这一过程是由压电陶瓷三维扫描器驱动的。当针尖与样品表面原子做相对运动时,作用在样品与针尖之间的力会使微悬臂发生一定量的形变。通过光学或电学的方法检测微悬臂的形变,转化成为图像输出,即可用于样品表面分析。简单地说,原子力显微镜是通过分析样品表面与一个微弱力敏感元件之间的相互作用力来呈现材料表面结构的。1.2 工作模式(一)接触工作模式扫描时如果控制针尖一直与样品表面原子或分子接触,那么这种工作模式称为接触模式。在这一过程中,针尖原子与样品表面原子之间力的作用主要表现为是两者相接触原子间的互斥力(大小约为10-8-10-11 N)。接触模式下工作的原子力显微镜可得到稳定的、高分辨率的样品表面图像。但是这种工作模式也有它的不足之处:当研究易变形的样品(液体样品)、生物大分子等的时候,由于针尖与样品原子直接接触,会使样品表面的原子移动、粘附于针尖或者发生较大形变,从而造成样品损坏、污染针尖或者结果中出现假象。(二)非接触工作模式扫描时如果控制针尖一直不与样品表面的原子或分子接触,那么这种工作模式称为非接触模式。非接触工作模式下由于扫描样品时针尖始终在样品上方5-20 nm 距离范围内,针尖与样品间的距离较接触模式远,所以获得的样品表面图像分辨率相对接触模式较低。但正是这一距离也克服了接触模式的不足之处,不再会造成样品的损坏、针尖污染等问题,灵敏度也提高了。(三)间歇接触工作模式扫描时如果控制针尖间歇性的与样品表面的原子或分子接触,那么这种工作模式称为间歇接触模式,也称为轻敲模式,常通过振动来实现针尖与样品的间歇性接触。该模式下微悬臂的振动是由磁线圈产生的交流磁场直接激发的,针尖与样品表面原子作用力主要是垂直方向的,不再受横向力的影响。间歇接触工作模式集合了接触与非接触模式的优点,既减少了剪切力对样品表面的破坏,又适用于柔软的样品表面成像,因此特别适合于生物样品研究。2 原子力显微镜的组成AFM 的硬件系统由力检测部分、位置检测部分和反馈控制系统三部分组成。图1 所示为AFM 的工作原理图,从图中可以看出,AFM 就是通过集合以上三个系统来将样品的表面特性反映出来的:在AFM的工作系统中,使用由微小悬臂和针尖组成的力检测部分来感应样品与针尖间的作用力;当微悬臂受力形变时,照射在微悬臂末端的激光会发生一定程度的偏移,此偏移量反射到激光检测器的同时也会将信号传递给反馈控制系统;反馈控制系统根据接受的调节信号调节压电陶瓷三维扫描器的位置,最终通过显示系统将样品表面的形貌特征以图像的形式呈现出来。3 样品制备3.1 样品要求原子力显微镜研究对象可以是有机固体、聚合物以及生物大分子等,样品的载体选择范围很大,包括云母片、玻璃片、石墨、抛光硅片、二氧化硅和某些生物膜等,其中最常用的是新剥离的云母片,主要原因是其非常平整且容易处理。而抛光硅片最好要用浓硫酸与30%双氧水的7∶3 混合液在90 ℃下煮1h。利用电性能测试时需要导电性能良好的载体,如石墨或镀有金属的基片。试样的厚度,包括试样台的厚度,最大为10 mm。如果试样过重,有时会影响Scanner的动作,请不要放过重的试样。试样的大小以不大于试样台的大小(直径20 mm)为大致的标准。稍微大一点也没问题。但是,最大值约为40 mm。如果未固定好就进行测量可能产生移位。请固定好后再测定。3.2 样品制备粉末样品的制备:粉末样品的制备常用的是胶纸法,先把两面胶纸粘贴在样品座上,然后把粉末撒到胶纸上,吹去为粘贴在胶纸上的多余粉末即可。块状样品的制备:玻璃、陶瓷及晶体等固体样品需要抛光,注意固体样品表面的粗糙度。液体样品的制备:液体样品的浓度不能太高,否则粒子团聚会损伤针尖。(纳米颗粒:纳米粉末分散到溶剂中,越稀越好,然后涂于云母片或硅片上,手动滴涂或用旋涂机旋涂均可,并自然晾干)。4 原子力显微镜的应用4.1 在材料科学及化学中的应用目前,AFM 在材料科学中主要应用于材料的表面结构、表面重构现象以及表面的动态过程(例如扩散现象)等方面的研究,表面科学的中心内容是研究晶体表面的原子结构,例如从理论上推算出的金属表面结构往往不如实际复杂,借助原子力显微镜可以直观地观察材料的表面重构现象,有助于理论的进一步完善。4.1.1 在探测材料样貌方面的应用利用原子力显微镜来观测材料的样貌进行成像的时候,材料与探针之间出现相应作用力改变能够很好的反映出材料表面的三维图像。可以通过数值分析出材料表面的高低起伏情况,因此,在利用原子力显微镜对材料进行图像分析的时候,可以有效地发现材料表面的颗粒程度、粗糙程度、孔径分布以及孔的结构等。可以利用这种成像的方式把材料表面的情况形成三维图像进行模拟显示,促使形成的图像更加利于人们观察。4.1.2 在粉体材料中的应用在对粉体材料进行分析和研究的时候,可以利用原子力显微镜来逐渐分析原子或者分子中尺度,从而保证可以准确观测晶体以及非晶体的位置、形态、缺陷、聚能、空位以及不同力之间的相互作用。一般来说,粉体材料基本上都是使用在工业中的,但是现阶段有关于检测粉体材料的方法还是十分少的,研制样品也相对比较困难。原子力显微镜实际上是一种新兴的检测方式,具有操作方便、制样简单等特点。很多专家学者认为,人们使用化学方式研制出了SnS粉末,利用原子力显微镜把涂在硅基板上的材料进行成像,从图像上我们很容易发现此类材料具有分布均匀的特点,每一个大约15nm。4.1.3 在晶体材料中的应用专家学者经过不断研究和分析得到了很多晶体生长的模型,但是经过更加深入的分析和研究发现这些理论模型和实际情况是否相同还是具有一定差异,也逐渐成为学者讨论和研究的重点,所以人们希望通过显微镜来监测和观察生长过程。虽然,使用传统的显微镜已经观测出一定的成果,但是由于这些光学显微镜、激光全息干涉技术等存在分辨率不是十分高、实验条件不是很好以及放大不足等问题,使得研究过程出现很大困难,导致不能观测纳米级的分子等。原子力显微镜的发展,为科学家们研究纳米级分子或者原子提供了依据,也成为了专业人士研究晶体过程的重要方式。利用这种显微镜具有的能够在溶液中观察以及高分辨率等特点,可以保证科学家们能够很好的观测到晶体生长过程中的纳米级图像,从而不断分析和掌握材料的情况。4.2 在生物学中的应用AFM 能在气体、液体中无损伤地直接观察物体,可对生物分子在近生理条件下进行检测,是生命科学研究中的有力工具。目前,在生命科学中AFM 主要应用于对细胞、病毒、核酸、蛋白质等生物大分子的三维结构和动态结构信息进行研究。4.2.1 对细胞膜表面形态的研究细胞膜有重要的生理功能,它既使细胞维持稳定代谢的胞内环境,又能调节和选择物质进出细胞。AFM 能够观察到细胞膜表面的超微结构,因此它可以用来观察正常细胞与病变细胞的细胞膜,发现两者的异同,为临床病理诊断提供新的视角和方法。4.2.2 测定细胞弹性以及力学性质病变这一生理过程与细胞的形态和力学性质有关。细胞形态学的变化会影响和反映细胞性质、功能以及细胞微环境的改变。健康细胞与病理状态的细胞在机械性能上是完全不同的。抓住这一点,可以利用AFM 测量出的细胞弹性性质识别癌细胞,以及辅助诊断红细胞相关的各种疾病等,从细胞层面上对各种疾病进行早期诊断和治疗。4.2.3 检测活细胞间相互作用AFM 也可以对细胞间的相互作用进行观察。将一种细胞连接在AFM 扫面探针的尖端,使针尖功能化,对另一种单层排列的细胞进行扫描就可以进行细胞间相互作用的研究。4.2.4 观察动态生物过程AFM也是观察细胞生物过程非常有效的工具。研究痘病毒和活细胞,得到了痘病毒感染活细胞全过程的AFM 图。通过活着的细胞观察子代病毒颗粒,并用AFM 在水溶液环境中在分子水平分辩出有规则重复的烙铁状结构和准有序的环状结构。观察中发现: 在感染前后最初几小时,细胞并无显著变化 子代病毒粒子沿细胞骨架进入细胞内部,还有胞吐、病毒颗粒聚集等现象。通过AFM 图像可以看出哑铃状小泡逐渐形成、消失并在细胞膜表面形成凹陷的全过程。4.2.5 观察生物大分子之间相互作用在生物体内,DNA 与蛋白质间的相互作用有着同样举足轻重的地位。在转录、翻译的过程中,DNA 与特定的蛋白质如解旋酶、聚合酶、启动因子等的结合就决定着生命活动的开启。Gilmore 等利用AFM 以每500 ms 拍摄1 次的速度,清晰地观察到了蛋白质在DNA 上的结合情况。因此,AFM 可以真正帮助我们深入地“看到”生命活动的本质。4.2.6 测定细胞电学性质细胞不论在静止状态还是活动状态,都会产生与生命状态密切相关的、有规律的电现象,生物电信号包括静息电位和动作电位,其本质是离子的跨膜流动。因此,研究细胞的电生理学也成为了生命科学领域一个重要的分支。在AFM 系统中增加了导电模块,在迎春花细胞、酵母菌细胞等样品和探针之间加一个偏压,在扫描的过程中,同时获得样品的表面形貌和电流像,且在成像的同时检测探针和细胞样品之间的电流,得到样品表面形貌和局域电流分布及两者之间的对应关系,从而实现AFM 在纳米尺度上对细胞样品电学特性的分析检测。参考文献[1]高翔.原子力显微镜在材料成像中的应用[J].化工管理,2015(08):67.[2]王明友,王卓群,焦丽君.原子力显微镜在表面分析中的应用[J].邢台职业技术学院学报,2015,32(01):75-78.[3]万旻亿.原子力显微镜的核心技术与应用[J].科技资讯,2016,14(35):240-241.[4]鞠安,蒋雯,许阳,杨升,常宁,王鹏,顾宁.原子力显微镜在生命科学领域研究中的应用进展[J].东南大学学报(医学版),2015,34(05):807-812.