同位素稀释法中有正稀释和反稀释,其原理是什么?还有是双同位素稀释?望各位赐教.
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=15259]同位素稀释法的原理[/url]主要是介绍了同位素质谱稀释法的原理,好不容易找到的啊!希望对大家有用。[em09]
各位好,请教一下,有谁知道自动进样器的稀释功能的工作原理,多谢各位大侠了!
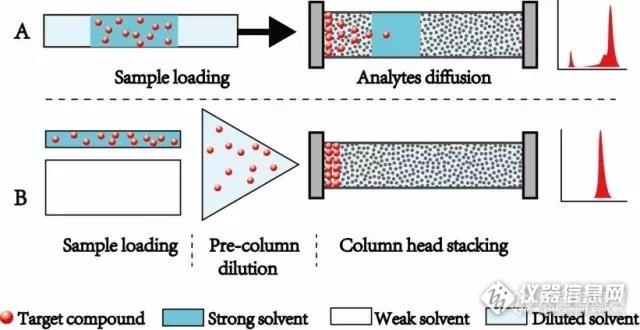
[b][i]液相色谱的饭量?是指进样量吗?液相色谱进样量不是20μL吗?还用问?[/i][/b]是的客官,题目问的就是“液相色谱的进样量能有多大?”但是,这个问题是不严谨的。因为问这样的问题就相当于问“人的饭量有多大”一样,没有答案——人的饭量跟具体某个人的身材、身体状况、喜不喜欢吃米饭有关,还跟这碗米饭怎么煮有关:一勺子没加水的干米可以噎死人,一比一加水煮成的饭能吃两碗,一比九对水煮成的稀饭吃三、四碗没问题。那对于液相色谱来说,进样量除了跟色谱柱的尺寸、柱效、目标物与色谱柱的匹配度、梯度初始比例有关,也跟样品怎么“煮”成的有关:以反相色谱为例, 100%有机相(强溶剂=干米),50%有机相(弱溶剂=水,50%有机相=饭)和10%有机相(稀饭)的进样量是不一样的!相同色谱柱,进样溶剂不同,允许进样量不同的根本原因是溶剂效应:溶剂效应本质是大体积的强溶剂携带着目标物进到色谱柱后将取代流动相形成一个独立的液段,这一液段对目标物有很强的携带能力,且强溶剂液段在色谱柱中几乎没有保留,最终目标物被强溶剂拖带拉宽,形成很长的前延峰,甚至有一部分目标物被强溶剂脱裂跟随其一起在死时间出峰(图1A)。如果有一个方法,可以把强溶剂快速稀释成弱溶剂,是不是可以提高进样量?岛津设计了一种新的在线稀释技术,其原理如图1B,配置如图2:[img=图1.在线稀释技术的原理,640,330]http://ng1.17img.cn/bbsfiles/images/2017/05/201705142050_01_3214098_3.jpg[/img] 图1.在线稀释技术的原理[img=,640,202]http://ng1.17img.cn/bbsfiles/images/2017/05/201705142050_02_3214098_3.jpg[/img]图2.在线稀释技术仪器配置在线稀释技术将强溶剂与高比例的弱溶剂通过高效混合器瞬间稀释成一个90-95%的弱溶剂,再注入到色谱柱,因为弱溶剂无法推动目标物往前移动,此时目标物将在柱头聚焦,待目标物全部聚焦在柱头,再提高强溶剂比例,使分析物分离得到尖锐对称的色谱峰。[b]那这个快速煮粥技术……不,这高大上的在线稀释技术有什么用?在线稀释技术的应用1——[b]大体积水的直接进样[/b][/b]在线稀释技术最初被应用在大体积水样的直接进样分析中:大部分的普通液相色谱柱是不允许100%水样直接进样的,因为其硅胶基质容易被水解离形成不可逆损坏。使用在线稀释技术可以在大体积水进样的同时加入小比例的有机相(5%或10%),使其在线形成液相色谱可接受的进样溶剂。图3为1mL水直接进样分析十种抗生素得到的色谱图,全程自动化运行,灵敏度高、精密度好。[b][img=,496,351]http://ng1.17img.cn/bbsfiles/images/2017/05/201705142118_01_3214098_3.jpg[/img][/b]图3. 大体积进样在线分析系统用于水中抗生素的直接检测[b]在线稀释技术的应用2——大体积有机相的直接进样[/b]大部分的样品前处理都包括强溶剂的萃取或强溶剂的洗脱定容为终结——因为强溶剂对目标物的溶解度高。然而大体积的强溶剂直接进样很容易噎死色谱柱。用我们的在线稀释技术可以完美解决:利用在线稀释大体积分析系统直接进样分析200μL乙腈白菜提取液中24种农残,得到色谱峰尖锐对称,方法精密度优异,灵敏度大大提高。图4为本系统与普通超高效液相色谱系统的谱图对比,可见左图200μL进样溶剂在普通超高效液相色谱系统有非常严重的溶剂效应,而在右图在线稀释大体积系统中峰型尖锐对称,灵敏度大大提高。[b][img=,640,233]http://ng1.17img.cn/bbsfiles/images/2017/05/201705142119_01_3214098_3.jpg[/img][/b]图4. 大体积进样分析系统用于白菜中多种农残的高灵敏检测;Qisheng Zhong, et al. Journal of Chromatography A, 2016, 1442, 53-61[b]在线稀释技术的应用3——双步稀释SPE-UHP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[/b]大体积进样量有可能会带来一个问题,即基质杂质增加,影响定量准确度。固相萃取SPE是一种有效的样品富集和除杂手段,广泛应用于食品、环境或生物样品的前处理。但手工操作的离线SPE存在操作繁琐复杂、耗时、重现性差等缺点,而在线SPE-HPLC可以部分解决以上问题。目前的在线SPE-HPLC系统一般分为两步进行,第一步是富集+除杂质,第二步是解吸+分离。见图5所示。该系统通常由两个流路连接一个六通阀组成,萃取柱连接在六通阀上。第一个流路(虚线部分)是提取和富集,另一个流路(实线部分)是样品的解吸和高效液相色谱分离。分析开始时,样品由自动进样器导入,随后被液相泵推动通过SPE柱完成目标物的富集(弱保留杂质流经SPE柱而无保留)。然后切换阀门,SPE柱被切换到两个色谱泵和色谱柱之间,流动相A和B兼任解吸液,将目标物从SPE柱上解析下来并随后进入色谱柱进行分离分析。[img=,640,303]http://ng1.17img.cn/bbsfiles/images/2017/05/201705142119_02_3214098_3.jpg[/img]图5.在线SPE系统常见的配置和流路构造然而,这个系统有几个缺点:首先解吸分离步骤中,SPE柱连在两个泵和色谱柱之间,这意味着只能耐受常压的SPE柱要承受和高效液相色谱柱相同的压力;其次,如果使用与这个SPE柱相匹配的常规色谱柱,通常直径为4.6mm,最优流量为1mL/min,超出了ESI源离子化承载的流量,因此需要通过降低流速或柱后分流等手段减少ESI负荷,最终导致方法灵敏度下降;第三,流动相A和B兼任解吸液和分离溶液,在大多数情况下,最佳解吸溶液与最佳流动相不是同种溶液,最终导致解吸效率下降或峰展宽;最后,样品为生物样品或高比例强溶剂萃取液时,在进样前需要用弱溶剂离线稀释,虽然离线稀释即耗时又间接减小了进样浓度,但非常有必要:一是将目标化合物与基质脱附(如药物与蛋白质的脱附);二,将高比例强溶剂稀释为高比例弱溶剂,以提高过柱过程中在萃取柱上的保留。为解决以上缺点,岛津设计了双步稀释SPE-UHP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS在线分析系统,其配置和流路设计见图6。[img=,640,411]http://ng1.17img.cn/bbsfiles/images/2017/05/201705142119_03_3214098_3.jpg[/img]图6. 双步稀释SPE-UHP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS在线分析系统的硬件配置和流路设计;专利号CN103940941B[b]这个系统有三个分析步骤:[/b](1)第一步是样品的稀释和提取。样品通过自动进样器直接注入系统,通过泵D稀释溶剂推送进入高效混合器1,样品被在线稀释为弱溶剂。然后稀释液加载到固相萃取柱完成目标物的富集及杂质的去除。(2)当富集除杂完成后,切换阀1,进行目标物的解吸和捕获。在这一步中,泵C推送最优的解吸液到固相萃取柱,目标物被解吸液解吸并移动经过500μL定量环,调整分析方法至绝大部分目标物捕集到定量环1中,切换定量阀进入第三步。(3)第三步是解吸液的柱前稀释,以及进行超高压的样品分离分析。柱前稀释的原理即为此前提到在线稀释,可即时将解吸液稀释为90%以上的弱溶剂,然后才进入超高压液相色谱柱。此时弱溶剂完全没有洗脱能力,因此目标物将在色谱柱头进行聚焦。之后改变有机相比例,实现梯度洗脱,得到尖锐的色谱峰形。在此过程中实现了解吸液的柱前稀释、超高压的色谱分离。此时超高压色谱柱使用的是最优流速,且无需分流,与质谱完美匹配,提高分析的灵敏度。[b]该在线系统相对于普通SPE-HPLC系统有以下优点:[/b](1)实现萃取前样品的在线稀释,免除离线稀释的手工误差;(2)破除分离色谱柱的局限性,可以使用UHPLC高压柱,分离条件与SPE萃取条件相互独立,与ESI质谱相匹配;(3)独立解吸泵推送解吸液:可以使用最优解吸条件,并具有解吸效率最高,解吸时间最短,解析液体积最小等优点;(4)解吸溶剂的截获&切换:在解吸条件最优的条件下,使用500 μL定量环(可随SPE尺寸调整),确保解析液全部被截获;定量环还起到压力过度作用,SPE柱不与UHPCL柱串联,全程处于低压状态;(5)大体积解吸溶液的在线稀释,实现柱头聚焦和有效UHPLC分离。我们用这个系统先后应用于植物提取液中三种植物激素和血浆样品中十种抗精神病药的直接检测,得到了满意的结果:(1)双步稀释SPE-UHP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS在线分析系统用于植物提取液中植物激素的直接检测[img=,640,210]http://ng1.17img.cn/bbsfiles/images/2017/05/201705142119_04_3214098_3.jpg[/img]图7. 双步稀释SPE-UHP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS在线分析系统用于植物提取液中三种植物激素的直接检测;Qisheng Zhong, et al. Journal of Chromatography A, 2014. 1359: 131-139.(2)双步稀释SPE-UHP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS在线分析系统用于血浆中十种抗精神病药的直接检测[img=,640,475]http://ng1.17img.cn/bbsfiles/images/2017/05/201705142120_02_3214098_3.jpg[/img]图8.双步稀释SPE-UHP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS在线分析系统用于血清中十种抗精神病药的直接检测; Qisheng Zhong, et al. Journal of Separation Science, 2016, 0,1-9.由以上应用实例我们可以看到,使用岛津独有的在线稀释技术,可以大大提高超液相色谱的饭量,不但能提高灵敏度,而且能够应用在在线分析系统,实现目标物的富集和杂质去除,得到满意的分析结果。(转载于:中国岛津)
这个问题我曾经提过。在“质谱讲座”的第32讲“同位素稀释[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]测量-同位素稀释质谱法的基本原理”部分的内容,即使用A3纸横打,也不能将内容打全,因为是你们的版面设计不允许,你们自己可以一试。因此,上一次你们的回答不令人满意。希望你们能将版面尽快重新调整。
在"[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]讲座”的第32讲“同位素稀释[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]测量-同位素稀释质谱法的基本原理”部分,在打印输出时,对A4纸,即使是“横向”打印,也不能将内容打全;而用A3纸打印时,又不允许;希望能将此部分内容重新设计一下版面,以便于打印。
一、实验目的了解稀释平板计数的原理,掌握涂抹平板培养法和混合平板培养法,认识细菌、放线菌、霉菌的菌落特征。二、实验原理 稀释平板计数是根据微生物在固体培养基上所形成的单个菌落,即是由一个单细胞繁殖而成这一培养特征设计的计数方法,即一个菌落代表一个单细胞。计数时,首先将待测样品制成均匀的系列稀释液,尽量使样品中的微生物细胞分散开,使成单个细胞存在(否则一个菌落就不只是代表一个细胞),再取一定稀释度、一定量的稀释液接种到平板中,使其均匀分布于平板中的培养基内。经培养后,由单个细胞生长繁殖形成菌落,统计菌落数目,即可计算出样品中的含菌数。此法所计算的菌数是培养基上长出来的菌落数,故又称活菌计数。一般用于某些成品检定(如杀虫菌剂等)、生物制品检验、土壤含菌量测定及食品、水源的污染程度的检验。三、实验器材 1.活材料:苏云金芽孢杆菌(Bacillus thuringiensis)菌剂。2.培养基:牛肉膏蛋白胨琼脂培养基(附录三、1)3.器材:90ml无菌水、9ml无菌水、无菌平皿、lml无菌吸管、天平、称样瓶、记号笔、玻璃刮铲等。四、实验方法 1.样品稀释液的制备 准确称取待测样品l0g,放入装有90ml无菌水并放有小玻璃珠的250ml三角瓶中,用手或置摇床上振荡20 min,使微生物细胞分散,静置20-30s,即成10-1稀释液;再用1ml无菌吸管,吸取10-1稀释液lml,移入装有9ml无菌水的试管中,吹吸3次,让菌液混合均匀,即成10-2稀释液;再换一支无菌吸管吸取10-2稀释液1 ml,移入装有9ml无菌水的试管中,也吹吸三次,即成l0-3稀释液;以此类推,连续稀释,制成10-4、10-5、10-6、10-7、10-8、10-9等一系列稀释菌液(图22-1)。图22-1 平板计数法中样品的稀释和稀释液的取样培养用稀释平板计数时,待测菌稀释度的选择应根据样品确定。样品中所含待测菌的数量多时,稀释度应高,反之则低。通常测定细菌菌剂含菌数时,采用10-7、10-8、10-9稀释度,测定土壤细菌数量时,采用10-4、10-5、10-6稀释度,测定放线菌数量时,采用l0-3、10-4、10-5稀释度,测定真菌数量时,采用10-2、10-3、10-4稀释度。2.平板接种培养 平板接种培养有混合平板培养法和涂抹平板培养法两种方法。 (1)混合平板培养法 将无菌平板编上10-7、10-8、10-9[fo
降低稀释的强度(如增加水相比例、调整pH等)或更换稀释剂为流动相,2、在保证检测灵敏度的前提下,降低进样量。3、增加峰形前延抑制器,峰形前延抑制器的设计原理是,在色谱柱前端引入一个大小合适的空腔,使样品到达色谱前被存留于空腔内的流动相(色谱柱平衡时流动相会充满空腔)稀释,使“样品溶剂”经稀释后更接近流动相的组成,实现“样品溶剂与流动相的组成接近”,并取代“用流动相溶解样品”的解决方案。
今天配溶液的时候和同事谈到了逐步稀释和一步稀释哪个好,同事们都说逐步稀释比一步稀释要好,逐步稀释误差比一步稀释要小,我不同意他们的说法,和他们挣了半天也没出结果。他们的观点是无论怎么样逐步稀释都比一步稀释准确,只是实际操作可能一步稀释简单一些,都不使用逐步稀释;我的观点是如果取同样体积的原液稀释100倍,一步稀释比逐步稀释要好一些,例如A:取1ml直接定容至100ml,B:取1ml先定容至10ml,再取1ml定容至10ml,我的观点就是A比B要准确一些,但是我同事都说B比A准确。C:取1ml定容至100ml,D:取10ml定容至100ml,再取10ml定容至100ml,这种情况我和我同事的观点都一样,D要比C准确一些。CD这种情况基本没什么可说的了,D就是比C准确,但是AB这种情况我还是坚持A要好一些,但是我没法用数据来说服他们,他们也找不到能让我心服口服的数据,有没有人能用数据来说一下AB哪个更好?我来说一下为什么我觉着A要比B准确吧。因为我觉着同样取1ml溶液,取一次的误差就是比取两次的误差要小,一步稀释定容至100ml在取样上只会产生一次误差;但是逐步稀释需要2次取样,会产生2次误差。有可能2次取样会产生正负互补,但是如果2次取样都是正正或者都是负负呢?如果一次取样的误差范围是±0.1,而2次取样的误差范围就有可能是±0.2了(数据是随便编的,但是2次取样误差范围一定会比1次取样要大),这种情况下还是一步稀释要准确一些。总体来说我的观点就是:如果取的母液容积一定,一步稀释要比逐步稀释准确,不管你稀释10倍、100倍还是1000倍。还有一点就是,通常说的稀释倍数不能超过100倍,我认为这个也是要看情况的,我还是上面的观点,如果你只有1ml的母液要稀释1000倍,直接取1ml定容至1000ml要比取1ml定容至10ml、再取10ml定容至1000ml(或其他逐步稀释的方法)要准确。如果母液充足,逐级稀释要比一步稀释准确。求大神用数据来支持或反驳我的观点,如能说服我改变观点,感激不尽!!!!!!!
大家讨论一下 稀释一倍与稀释两倍是否有什么区别?比如1mg/mL的溶液稀释一倍后的浓度为多少? 稀释两倍后的浓度为多少?
溶液怎样稀释分析化学,特别是精密的仪器分析,其检测范围往往是ppm\甚至是ppb级,这个就需要我们配置ppm甚至是ppb级的标准溶液。怎样配置标准溶液?这个问题是个问题。我要配置1ppb的铅标准溶液,国家标准物质为1g/L,首先吸取1毫升标准液于100毫升容量瓶中,加水定容,此时该储备液浓度为10mg/L,随后吸取该储备液1毫升,再次稀释到100毫升容量瓶中,此时的储备液浓度为0.1mg/L,随后吸取二次储备液0.25毫升,加入25毫升比色管中。此时的标准溶液浓度就是1ppb。此方法为逐级稀释的办法,该方法稳定性好,缺点是操作繁琐。第二种办法就是用移液枪小体积稀释,量取0.1微升的标准溶液,随后将其转移到100毫升的容量瓶中,加水定容。该方法简单快速,缺点是系统误差大,往往导致结果不准确。仪器分析每一次的移液误差传递到下一步将会从绝对误差转变为相对误差。在实际工作中,可以利用微量注射器或者移液枪,将1微升的液体稀释到1毫升的样品瓶中,或者1毫升的小离心管中,这样就可以稀释1000倍了。配置标准溶液的时候,不同的人有不同的爱好。有的人喜欢用移液枪,还有的人喜欢用移液管,方法不同,但是原理相同。一般来说移液管经过计量校准以后,其溯源性要好于移液枪。但是移液枪比移液管方便许多。我推荐还是使用移液管。有的人喜欢用容量瓶配置标准溶液,而有的人喜欢用比色管配置标准溶液。早些天去省局学习,一位做离子色谱的大哥,竟然对我说,他不知道比色管是什么东西,顿时我傻眼了!配置溶液的时候,有的人喜欢在小烧杯里溶解,随后转移到容量瓶中,然后反复清洗转移。这样做符合分析化学的基本原理,其缺点就是增加的一步过程中,容易引进污染;有的人喜欢直接将标准品放入容量瓶中,然后直接稀释,这样做方便,也不容易引进污染,其缺点就是容量瓶瓶口太小,容易撒到外面去。每一次转移和定容的过程中,都要把容量瓶摇匀,这样才能保证您的标准曲线做到4个9哦!今天您做到了吗?
溶液稀释是一步到位还是逐级稀释好,我们来讨论这个问题。这个问题实质是被稀释溶液取样的绝对误差对稀释后溶液浓度相对误差的贡献大小问题。如果注意到无论是体积还是质量,取样的时候都是产生的绝对误差就明白了。例如溶液稀释100倍,假设取样误差是0.02ml,:方式1:一步到位稀释,取1ml浓溶液稀释到100ml,那么会造成稀释后稀溶液浓度存在2%的相对误差。方式2:分2次逐级稀释,每次稀释10倍,每次要取10ml浓溶液,稀释到100ml,取样误差这时候仍然是0.02ml,那么每次带来的稀溶[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]对误差就只有千分之二。方式3:分2次的时候是每次取1ml,稀释到10ml,相对误差为4%(不考虑正负误差相消的情况)。从上面的实例我们可以得到如下结论1.逐级稀释并不一定比一步到位更好,需要通过计算来确定最终的相对误差。如果每次稀释后体积相同,逐级稀释比一步到位稀释会更好。2.取样大体积比小体积相对误差小,稀释的时候如果条件允许,尽量取大一点的体积来稀释;3.在稀释过程中,误差有正有负,逐级稀释可以带来正负误差相抵,使得最终误差会更小,而一步到位稀释没有这种正负误差相抵消的功能和作用。
这样能挣上金币吗?逐级稀释和一步稀释的比较在日常分析中常常需要对溶液进行稀释。我们知道由于稀释的过程中会产生一些随机误差,而且误差随着稀释倍数的增加误差也随之增加,所以有些标准里会有逐级稀释到多少多少浓度,或者是每次稀释倍数不能超过20倍的明确要求。可是在实际操作中,当需要较大的稀释倍数的情况下,逐级稀释显然是费时费事的。那么可不可以进行一步稀释呢?我的同事找我提出了这个问题,当然是想省事了。尤其因为大多水样的矿化度很高,大量稀释的需要是在所难免的。我个人认为在保证质量可靠的情况下是可以一步稀释的。我建议同事做一下比较。同事于是对同一个未知样品分别进行两级稀释和一步稀释作为两个样品,然后对两个稀释样品进行了钙离子和硫酸根离子含量测定。一步稀释方法:用1.00mL移液器吸取1.00mL原液样品定容到100mL。此溶液为A液。两级稀释方法:先用5.00mL移液器吸取100mL原液样品定容到100mL。再用10mL大肚移液管从一级稀释液中吸取10.00mL溶液定容到50mL。此溶液为B液。测定方法:电感耦合等离子发射光谱法测钙离子,离子色谱法测硫酸根。测定结果:A液B液均值相对偏差钙离子mg/L10.3810.4710.420.38%曲线方程y=117800x-1750 r=1.000000硫酸根mg/L10.1510.1210.140.20%曲线方程y= r=结论是显而易见的。我认为在实际操作中可以一步直接稀释100倍。有这个数据作依据,我说你这么做就是了。可这个同事却去找领导,希望领导肯定并支持这样做法。很可惜领导没有同意。所以这个同事不得不仍然重复着大量的稀释和大量的清洗工作。不能理解同事这样做法。除非这组数据是编出来的,要么就是对自己的操作水平没自信,不然为何自讨苦吃?[f
[font=微软雅黑][size=16px][color=#666666]问题:溶液稀释是一步到位还是逐级稀释好?[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]这个问题实质是被稀释溶液取样的绝对误差对稀释后溶液浓度相对误差的贡献大小问题。如果注意到无论是体积还是质量,取样的时候都是产生的绝对误差就明白了。[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]举例说明:溶液稀释100倍,假设取样误差是0.02ml,采取如下3种方式:[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]方式1:一步到位稀释,取1ml浓溶液稀释到100ml,那么会造成稀释后稀溶液浓度存在2%的相对误差。[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]方式2:分2次逐级稀释,每次稀释10倍,每次要取10ml浓溶液,稀释到100ml,取样误差这时候仍然是0.02ml,那么每次带来的稀溶[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]对误差就只有千分之二。[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]方式3:分2次的时候是每次取1ml,稀释到10ml,相对误差为4%(不考虑正负误差相消的情况)。[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]从上面的实例我们可以得到如下结论[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]1.逐级稀释并不一定比一步到位更好,需要通过计算来确定最终的相对误差。如果每次稀释后体积相同,逐级稀释比一步到位稀释会更好。[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]2.稀释取样大体积比小体积相对误差小,稀释的时候如果条件允许,尽量取大一点的体积来稀释;[/color][/size][/font][font=微软雅黑][size=16px][color=#666666]3.在稀释过程中,误差有正有负,逐级稀释可以带来正负误差相抵,使得最终误差会更小,而一步到位稀释没有这种正负误差相抵消的功能和作用。[/color][/size][/font]
用HC-3系列做微量硫时,在做模板的时候要稀释三个浓度,是应该取一个样先稀释一个浓度再推到一定的刻度再稀释一个浓度,再推到一个刻度稀释呢还是分别取三个样来稀释呢?
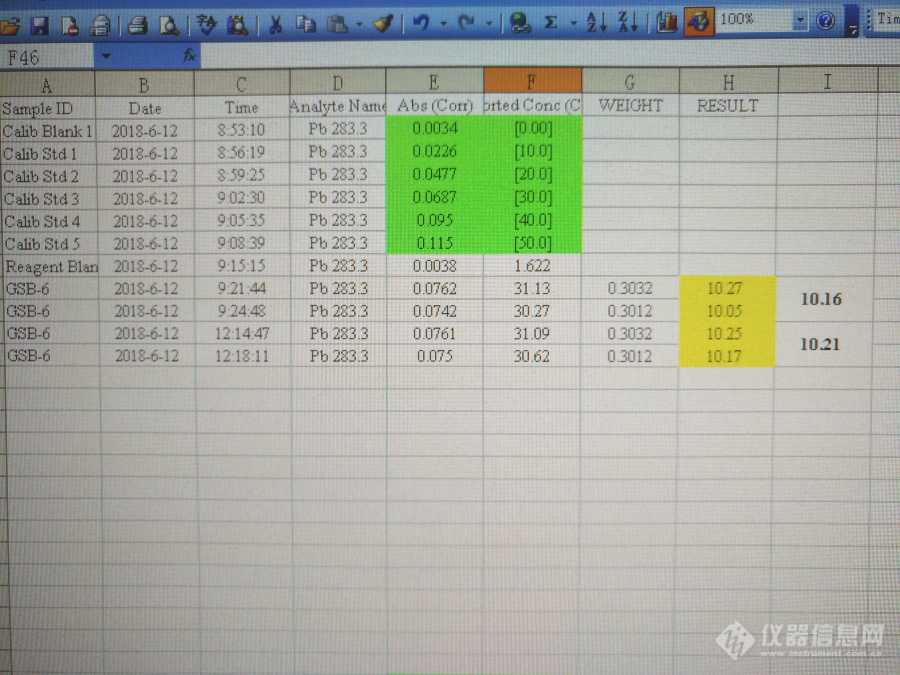
[align=center]前言[/align]自从用上了带有自动进样器的机子,感觉自己终于脱离了苦海。想当初,手持[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]往那小小的石墨管进样孔里面打样品溶液,啥也看不见,就象闭着眼睛一样,一下一下约摸着把那几微升样品溶液打进去!单说每天进几百枪的辛苦,能向谁述说?何况进样时擦碰刮蹭,导致测出来的数据昏天黑地,简直就是一场噩梦。现在有了它,一切便有了一个改观。而且,用上了自动进样器以后,我的测试数据也一天天地好了起来,而且连配制标液做标曲也可由它代劳了,于是对自动进样器这一神器感觉有点膜拜了。后来在论坛上看到安老师淡然谈到时说手动进样比自动进样更准确,我当时很不服气。然而,常言道:上的山多终遇虎。在一个偶然的情况下,我发现仪器自稀释与人工手动稀释有所差异,这才不再迷信盲从,于是有了下面的实验。1 方法与过程1.1 见图1.人工手动配制铅标准溶液系列:10ug/L、20ug/L、30ug/L、40ug/L、50ug/L,上机做校准曲线。标准物质GSB-6(菠菜)微波消解、赶酸定容后,再人工稀释4倍,上机测定。图1中红色方框内GSB-6的测定均值为10.16mg/kg,稍低(GSB-6的标值范围为11.1mg/kg±0.9mg/kg)。[align=center][img=,690,462]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021502561314_1930_2076515_3.jpg!w690x462.jpg[/img][/align][align=center]图1[/align][align=left]1.2 见图2 仪器自稀释配制铅标准溶液系列:12.5、25.0、37.5、50.0ug/L,做校准曲线。标准物质GSB-6(菠菜)与上述图1中所用为同一样品,即经微波消解后,再赶酸、定容,然后人工稀释4倍后,上机测定。图2中红色方框内GSB-6的测定均值为9.80mg/kg,明显低于图1中GSB-6的测定值。GSB-6(菠菜)的标值范围:11.1mg/kg±0.9mg/kg。[/align][align=center][img=,690,462]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021503378227_7192_2076515_3.jpg!w690x462.jpg[/img][/align][align=center]图2[/align][align=left] [/align][align=left]1.3 见图3 仪器自稀释配制铅标准溶液系列,12.5、25.0、37.5、50.0ug/L,做校准曲线。标准物质GSB-6(菠菜)经微波消解、赶酸定容后,再经仪器自稀释4倍后测定。图3中红色方框内GSB-6的测定值为12.31mg/kg,明显超过了标值上限。GSB-6(菠菜)的标值范围:11.1mg/kg±0.9mg/kg。[/align][align=center][img=,690,462]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021504049511_5133_2076515_3.jpg!w690x462.jpg[/img][/align][align=center]图3[/align][align=left]2 分析与讨论[/align][align=left]2.1 通过对比1.1与1.2可以看出,由仪器自稀释配制标液做标曲测出同一个样品GSB-6的铅含量低于人工配制标液做标曲的测定值。这表明这两种配制标液的方式不尽相同,仪器自稀释与人工手动稀释之间存在较大差异。[/align][align=left]图1中蓝色方框内为1.2中红色方框内GSB-6的测试数据代入1.1中校准方程进行计算,结果为10.21mg/kg,进入GSB-6的标值范围。[/align][align=left]图2中蓝色方框内为1.1中红色方框内GSB-6 的测试数据代入1.2中校准方程进行计算,结果为9.75mg/kg,明显低于GSB-6的标值下限。[/align][align=left]2.2 通过对比1.2与1.3可以看出,人工手动稀释GSB-6后的测定值显著低于仪器自稀释GSB-6后的测定值。由此可知仪器自稀释的取液量比人工手动偏大,将导致校准曲线的信号值偏高,而使测定值偏低,这一点从1.1与1.2的对比中得到印证。[/align][align=left]3 结论[/align][align=left]结论似乎就是一句话:仪器的自稀释不可靠啊!但是这样讲,未免太过武断。没有经过大量重复性的验证试验,没有看到大量重现性的验证结果,就这样简单地否定广大仪器公司殚精竭虑为我们制造出来的自动进样器不仅厂家不答应,广大自动进样器的忠实拥趸们也是不会答应的。实际上,就连本人也不愿意看到这样的结果。但是,这些数据毕竟是真实存在的现实。在这里,我只想提醒我们的同行,对此要留一个心眼。如果有不服的版友采用实验数据驳倒了我的结论,哪怕是把我体无完肤了,我心亦热。因为我真的很喜欢自动进样器![/align][align=left]谨以此文向安老师致意![/align][align=left] [/align]
从原理上说,测汞是不需要生成氩氢火焰的,直接对汞蒸汽进行检测,那么测汞时稀释,用盐酸定容比用水定容值大1.5倍,是什么原理呢?难道就是基体匹配?那问题来了,样品从微波下来的时候就是用水定容的,是否这一步就已经导致值偏小了呢?是否微波下来也应该用载流,即盐酸定容呢?因为氮氧化物会对测汞有影响,微波下来的汞赶酸不一定能全部将氮氧化物赶进,是否需要用盐酸去消耗掉多余的?
当前,许多高档仪器在石墨炉分析时其自动进样器均有一个自动稀释功能。 这种稀释功能的优点是:稀释比可随需要临时变换;解放了人工劳动力;尤其是当待测样品不多的时候很划算。 这种稀释功能的缺点是:要想得到理想的测试精度和重现性,受制于许多因素的影响,如下:(一)预设的母液和目标标液的浓度要适度。众所周知,自动稀释原理:主要是改变母液与稀释液的体积比例。举例:进样都是20微升,母液是40ppb(μg/L);如果要想得到20ppb的标液,则要取10微升母液和10微升的稀释液。如果想要得到10ppb的标液,则要取5微升母液和15微升的稀释液。如果要想得到2ppb的标液,则要取1微升的母液和19微升的稀释液;对于自动进样器而言,也许进样精度很高,但是吸入1微升溶液后能完整无损地再吐出来吗?这是一个未知数。究其原因与进样针的高度、进样针的洁净程度、样品的粘稠度和样品的重力有着很大的关系。如果母液选取得浓度过高的话,再加上使用基改液(等于再进一次样);这种稀释误差对于2ppb的目标标液的影响程度就可想而知啦!(二)进样针的高度的调整很重要。前面已经说过了,对于不同体积和结构的样品而言,进样针相对于石墨管底部的垂直高度的影响真的很关键。这是因为液珠的滴落的完整与否受制于下面这三个力的因素:(1)液珠的垂直向下的重力。这个重力越大下落的速度越快、也越完整。而这个重力的大小与液体样品的体积和比重有着很大的关系;体积越大、比重越大,滴落的越彻底。这就是前面所说的为何吸吐样品量不能过小,也就是母液不能选择浓度过高的根本原因了。(2)液珠向上的库伦吸引力。由于不同的样品的化学和物理性质不同,再加上进样针头的不洁净,以及过小的样品重力,均会造成施加于样品的吸引力的增加。我们能做到的只有合理地加大吸样量和时时保持进样针的清洁状态,严防挂液。(3)液珠表面的张力。由于不同的样品的密度和粘稠度不同,所以会影响液珠的滴落的完整与否。我们可以做这样一个小实验:用两根筷子分别同时沾上水和食用油,然后将筷子悬在空中,看看水和油谁先滴落下来?我想肯定是水吧?如果油珠悬浮在筷子头而不易滴落的话,此时找一张卡片或薄膜轻轻碰触油珠的底部,油珠立刻就会滴落下来了。所以进样针的针尖与石墨管底部的垂直距离的高低的效果就不言而喻了。(三)我对自动稀释功能应用场合的看法(1)如果本次分析的样品只有一两个,两三个;且是不常分析的元素,为了节省时间,可以使用自动稀释法。因为毕竟只要准备一个母液和一个稀释液即可,既省时又省力。(2)如果是大量的、经常测试的样品最好还是采用传统的人工配制的系列标液为妥,这样可以减少稀释误差。尤其是还要使用基体改进剂的情况下,自动进样器可能要往返吸吐2~3次,如此,无疑地加大了稀释误差。当然了,目前也有的仪器厂家的自动进样器可以做到将:吸吐样品→吸吐稀释液→吸吐基改液这三个步骤一气呵成地完成;这样可以减少上面谈到的“三力”的影响,其目的也就是减少稀释误差。例如:PE有一款机型以及日立的ZA3000就是属于这类的仪器。(3)不要盲目地迷信自动稀释功能。世间万物均有双重性,对于自动稀释功能而言也是如此。我遇到过个别仪器操作初学者,原本操作技术就不甚熟练,也不管分析的样品的数量多少,但却动辄非常喜欢使用稀释功能;结果分析出的结果的重现性参差不齐。当我给他建议后,他却反驳我说:“既然仪器有这个功能为啥不用?”我一时语塞。后经逐步了解才知道,其实他并不是对稀释功能有多么钟爱,而是一个字“懒”,嫌配制标液麻烦。 最后需要说明的是,发此贴并不是抵制使用仪器的自动稀释功能,而是想重点说明:要想正确使用稀释功能,必须首先了解这个功能的适应范围、各种特点以及操作要点。如此,才能得到满意的使用效果。
各位老师好,本人这几天参照gb/t20769做菠菜粉中农残,具体步骤如下:1.称取5.00g菠菜粉准确加入50ml乙腈匀浆提取2分钟后离心,再准确移取出25ml溶液,水浴旋蒸浓缩,然后净化。2.根据标准净化步骤进行净化,现象如下图3.净化液旋蒸浓缩近干后加入2ml甲醇,涡旋混匀,滤膜过滤上机检测。现在遇到的问题就是:一、2ml的甲醇待测样,颜色很深,呈墨绿色,这不是不是过柱效果不好?二、我的标曲浓度范围是1.75-44;菠菜样品有两个不同浓度,应该是一个高一个低,高浓度测得的结果为43,我认为这个浓度太高,应该稀释一倍让其位于标曲中间,数值才比较可靠,但是稀释一倍之后发现,稀释前和稀释后两个测到的数值居然是一样的;然后将低浓度(检测值为14)也稀释一倍之后再检测,发现低浓度稀释前后检测到的数值为13,变化不大。综上,这是什么原因引起的呢?请各位有经验老师指点一下,谢谢[img]https://ng1.17img.cn/bbsfiles/images/2022/06/202206091051346415_846_3972820_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2022/06/202206091051346444_2349_3972820_3.png[/img]
各位大侠:如题,请教样品稀释问题,可以一次稀释一千倍,从1微升稀释到1毫升吗?日常实验中从1毫升稀释成1升问题不大,但我现在想从1微升样品稀释成1毫升可以吗?样品误差会不会很大?
最近看见关于稀释仪的广告,觉得还不错,请问使用过的朋友,用起来怎么样,好使不,你们都使用过那些品牌?
各位大侠:如题,请教样品稀释问题,可以一次稀释一千倍,从1微升稀释到1毫升吗?日常实验中从1毫升稀释成1升问题不大,但我现在想从1微升样品稀释成1毫升可以吗?样品误差会不会很大?
如题:BOD稀释水必须在20℃环境下隔夜放置后使用么?隔夜放置的原理是什么?只要溶解氧达到8mg/L直接使用可否?
本人现在遇到一个问题:在配标准溶液时,是逐级稀释好还是一步稀释(都从母液中吸取,然后定容)好?要提供数学计算依据。这个与误差传递有关,但我不会计算,哪位高人帮帮小弟。谢谢!急等![color=red][size=4]calfstone老师就对这个问题发表自己的看法,详情请点击:[/size][/color][URL=http://www.instrument.com.cn/bbs/shtml/20080520/1269771/]标准溶液稀释中的不确定度分析-兼对逐级稀释还是一步稀释哪个好的回答[/URL]
稀释溶液时,稀释倍数多少合适?比如把一个溶液的浓度稀释一千倍,是先稀释一百倍,再稀释十倍,还是一次性稀释到一千倍呢?哪个方法比较合适,误差较小?或者稀释到更小的浓度是按百倍稀释还是其他方式稀释?有没有什么规定呢?
越来越多的仪器上安装自动稀释系统了。可是对于一些低沸点、易挥发的有机溶剂,自动稀释系统怎样保证稀释的精准度呢?
溶液稀释一次可以稀释多少倍数合理?理由是什么?大家讨论
稀释溶液时,稀释倍数多少合适?有无标准之类的说明,比如标液稀释1000倍,一次到位好还是二次逐级稀释好?
一、实验原理稀释平板测数是根据微生物在高度稀释条件下固体培养基上所形成的单个菌落是由一个单细胞繁殖而成这一培养特征设计的计数方法,即一个菌落代表一个单细胞。计数时,首先将待测样品制成均匀的繁殖稀释液,尽量使样品中的微生物细胞分散开,使其成单个细胞存在,否则一个菌落就不只是代表一个细胞,再取一定稀释度、一定量的稀释液接种到平板中,使其均匀分布于平板中的培养基内。经培养后,由单个细胞生长繁殖形成菌落,统计菌落数目,即可计算出样品中的含菌数。此记数方法所计算的菌数是培养基上长出来的菌落数,故又称活菌计数。一般用于某些产品检定,如根瘤菌剂等产品检定,生物制品检验,土壤含菌量测定及食品、水源的污染程度的检验。自然条件下,微生物常以群落状态存在,这种群落往往是不同种类微生物的混合体。为了研究某种微生物的特性或者要大量培养和使用某种微生物,必须从这些混杂的微生物群落中获得纯培养,这种获得纯培养的方法称为微生物的分离与纯化。在自然界中,土壤是微生物生活的良好环境,其中生活的微生物数量和种类都是极其丰富的,因此土壤是人类开发利用微生物资源的重要基地。土壤中的微生物数量、种类与土壤肥力有关,肥沃的土壤中多,贫瘠土壤中少。其生理类群则与土壤的其它理化性质,如通气、pH有关,例如在通气良好的菜园土中,好气性微生物占有绝对优势。本实验以菜园土为材料分离土壤中的好气性细菌,并进行数量测定。分离微生物时,一般是根据该微生物对营养、pH、氧气等要求的不同,供给它们适宜的生活条件,或加入某种抑制剂造成只利于该菌种生长,不利于其它菌种生长的环境,从而淘汰不需要的菌种。分离微生物常用的方法有稀释平板分离法和划线分离法,根据不同的材料,可以采用不同方法,其最终目的是要在培养基上出现欲分离微生物的单个菌落,必要时再对单个菌落进一步分离纯化。在用稀释平板分离微生物时,还可以同时测定待分离的微生物的数量。放线菌与细菌同属原核微生物,是重要的抗生素产生菌,在土壤中的数量仅次于细菌,尤其是在有机质丰富、透气性好的中性到微碱性土壤中的数量较多。本实验采用高氏一号琼脂培养基分离和计数菜园土中的放线菌。真菌在土壤中的数量次于细菌和放线菌,主要在有机质丰富、透气性好的偏酸性土壤中较多。分离土壤中的真菌并不难,但由于其菌落大,容易扩展,计数准确性较低。本实验采用加有氯霉素或庆大霉素和孟加拉红的马丁氏培养基分离及计数菜园土中的真菌。按一般资料介绍为链霉素,但此种抗生素要先配成一定浓度的溶液,且应于倒平板前才加入培养基中。在此培养基上,放线菌和细菌被氯霉素或庆大霉素和孟加拉红所抑制,但大多数真菌能够生存,且其菌落受孟加拉红的抑制而较小,从而避免了某些真菌的扩散蔓延而带来的数量上的误差。
各位老师,讨论一下,如果要稀释100倍的溶液,我用1ml检定过的[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]一步稀释准,还是用移液管每次稀释10倍逐步稀释准。请各位老师积极参与讨论,并给出解释。