谁能提供粗多糖检测方法的标准号,望老师不吝赐教
用《保健食品功效成分检测方法》的方法测口服液的粗多糖(按葡聚糖计算),得到的结果比理论值低几倍,且不稳定,个人认为出问题的主要是铜试剂沉淀葡聚糖这一步,求有遇到类似问题的朋友指导要点…
各位好,最近检测需要测紫甘薯中总糖、粗多糖和还原糖的含量,但我查了检测方法,都比较繁琐,方法复杂,而且容易产生干扰,不知那位高手测过,求易于操作、有效的检测方法。

[align=center]保健品中粗多糖含量的测定[/align]本文研究了苯酚-硫酸法检测不同基质的保健品中粗多糖的含量,论述了不同基质的前处理方法和经验。1 前言市场上常见的保健品多种多样,胶囊、口服液、药片等等。多糖含量作为保健品中的有效成分之一,越来越引起人们的关注。从药理学上讲,多糖具有抗肿瘤、抗病毒、增强免疫力、抗氧化、抗心血管疾病等。因为具有诸多功效,许多保健品生产公司也开发越来越多的含多糖保健品,通过在保健品中添加含有多糖的中药材或者海洋生物,从而使该保健品具有较高的多糖含量,增强其功效。不仅在胶囊、口服液等常规的保健品中添加含有多糖的成分,甚至在一些咖啡、饮料、食品中也添加含有多糖的组分,使其成为功能性的产品。多糖的含量对其功效的发挥至关重要,那么怎么准确、有效地检测出保健品中多糖的含量是一个重要的环节。保健品由于种类繁多,基质复杂,找到一种简单、有效的检测方法,能够检测出各种基质的保健品中多糖的含量具有重要的意义。本实验中采用了常见的苯酚-硫酸法检测保健品中粗多糖含量,选用乙醇提取以除去单糖、低聚糖、甙类及生物碱等干扰成分,然后用去离子水提取其中所含的多糖类成分。多糖在硫酸作用下,水解成单糖,并迅速生成糖醛衍生物与苯酚综合成有色化合物,用分光光度法测定其多糖含量。2 实验部分2.1 试剂95%乙醇 葡萄糖:优级纯;葡萄糖标准液:精确称取105℃干燥恒重的葡萄糖100 mg,置100 ml容量瓶中,加蒸馏水溶液解并稀释至刻度(可加几滴甲苯或几粒苯甲酸防腐)。此标准溶液1.00 ml含葡萄糖1.00 mg,储存于冰箱冷藏;苯酚;苯酚液:称取优级纯苯酚10.0 g,加水150 g ,置棕色瓶中备用,储存于冰箱;浓硫酸。2.2 仪器分光光度计。2.3 分析步骤2.3.1 样品预处理(1) 口服液等液体样品准确移取2.00~10.00 mL液体口服液试样,置于250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。(2)内容物为膏状的胶囊样品或者膏状类样品准确称取0.50~1.00 g膏状内容物或膏状样品,倘若其中含有油脂类辅料,加入乙醚或者石油醚脱脂,离心,弃去乙醚或者石油醚层。再用一定体积的水溶解,转移至250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。(3)内容物为粉状的胶囊样品或者粉状片剂、咖啡等准确称取0.10~0.50 g均质后的粉状样品,倘若其中含有脂肪类辅料,先加入一定体积的水,溶解粉状样品,再加入乙醚或者石油醚脱脂,离心,弃去乙醚或者石油醚层。将水层转移至250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。2.3.2 标准曲线的制备吸取葡萄糖标准液0.25 mL、0.50 mL、1.00 mL、1.50 mL、2.00 mL、2.50 mL,分别置于50 mL容量瓶中,加水定容。吸取上述溶液各2.00 mL,再加苯酚液1.00 mL,涡旋混合均匀,迅速沿管壁加入浓硫酸5.00 mL,摇晃后涡旋混合,放置5 min,置沸水浴中加热15 min,取出后冷却至室温,于490 nm处以水代替样品作参比测吸光度,绘制标准曲线。2.3.3 样品中多糖含量测定吸取2.00 mL样品液,置于10 ml容量瓶中,加水定容。吸取2.00 mL上述溶液,按标准曲线制备项下方法测定吸光度。另以2.00 mL水,同上操作做空白。查标准曲线得样品液中葡萄糖含量。2.3.4 液体样品分析结果的计算计算液体样品中酸性多糖的含量按式(1)或者(2)计算,分别以mg/mL或者mg/g表示。[img=,503,114]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709449978_4859_3246897_3.png[/img][sub] [/sub] 式中: X—保健品中酸性多糖含量(以葡萄糖计), mg/g或者mg/mL表示;A—从浓度-吸光度曲线上查得样品溶液的葡萄糖浓度,μg;B—从浓度-吸光度曲线上查得空白溶液的葡萄糖浓度,μg;V[sub]1[/sub]—多糖溶液总体积,mL,如按本方法为100 mL;V[sub]2[/sub]—移取多糖溶液的初始体积,mL,如按本方法为2 mL V[sub]3[/sub]—待测多糖浓度溶液的总体积,mL,如按本方法为10 mL;V[sub]4[/sub]—待测多糖溶液的移取体积,mL,如按本方法为2 mL m—保健品的称取质量,g;V[sub]0[/sub]—保健品的测试体积,mL;如两次测定符合允许差时,取两次测定结果的算术平均值作为结果,报告结果取三位有效数字。2.3.5 允许差同一样品的两次测定值之差不得超过两次测定平均值的10%。2.3.6 结果与分析(1)含油脂类样品脱脂与否的影响含有油脂类的保健品,脱脂前后采用上述方法进行酸性多糖含量测定时,多糖含量有一定的差别,未脱脂的样品进行多糖含量测定时,过滤过程十分缓慢,耗时长,多糖含量数据经常不平行,而且数值偏高。[align=center][img=,300,307]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230846_01_3246897_3.jpg[/img][/align][align=center]图1 乙醚脱脂[/align]样品经过乙醚脱脂后有明显的油脂层。[align=center][img=,300,296]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230846_02_3246897_3.jpg[/img][/align][align=center]图2 回流后的未脱脂样品[/align][align=center][img=,300,302]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230847_01_3246897_3.jpg[/img][/align][align=center]图3 回流后的脱脂样品[/align]通过比较图2和图3,脱脂后的样品溶液更加澄清,无论是过滤还是洗涤,反应更快速,洗涤效果也更好。相反,未脱脂的样品,整个容器壁上都黏附着脂肪、油脂层,即使离心后过滤,过滤速率也很差,滤液也很浑浊,如下图4所示。[align=center][img=,300,268]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230847_02_3246897_3.jpg[/img][/align][align=center]图4 脱脂前后滤液的比较[/align][align=left]没有脱脂的样品,油脂层包裹着含有单糖或者寡糖的乙醇溶液,不容易被乙醇洗涤干净,这部分残留的单糖或者寡糖导致结果偏高。因此,对相应的含油脂保健品提前进行脱脂后再检测多糖,不仅能减少操作的时间,还能获得更为准确的结果。 [/align][align=left](2)醇沉时间的影响[/align][align=left]对以含有大豆油辅料的胶囊内容物进行脱脂后沉淀粗多糖,对比了加入9倍95%乙醇后立即回流提取多糖和加入9倍95%乙醇后室温下静置1 h再回流提取多糖,结果显示,加入乙醇后立即回流提取多糖与静置1h后再回流检测出的多糖含量分别为41.69 mg/g、48.08mg/g。可以看出,室温下醇沉时间的增加可以使更多的粗多糖醇沉完全,检测含量增高。[/align][align=left](3) 苯酚硫酸法操作方法的影响[/align][align=left]苯酚硫酸法检测粗多糖含量最为常见,操作简单,适用于常规检测。在实验过程中发现,无论苯酚和浓硫酸的加入比例是1:5还是1:10,苯酚的体积分数是5%还是6%,在进行加入时最好是一个样品加完苯酚,混匀后,立即沿管壁加入浓硫酸,混匀后,再加另一个样品的苯酚和浓硫酸,这样显色更稳定。实验中发现,倘若对所有样品全加完苯酚混匀后,再统一加浓硫酸,显色及不稳定,标准曲线甚至不成线性。苯酚易挥发,长时间与空气接触也容易被氧化,造成结果不稳定。[/align][align=center][img=,300,287]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230848_01_3246897_3.jpg[/img][/align][align=center]图 5 苯酚-硫酸法检测多糖含量[/align][align=left]图5为苯酚硫酸法侧多糖含量的标准曲线和样品,采用了单个样品加完苯酚和浓硫酸后再加另一个样品的苯酚好浓硫酸,显色稳定有规律,经过分光光度计检测,线性良好,样品数据平行,能够有效避免苯酚-硫酸法重现性差这一缺点。[/align]3. 结论采用苯酚-硫酸法检测保健品中粗多糖含量时,针对各种基质进行相应的脱脂操作、增加回流前的醇沉时间、进行显色反应时加入苯酚后混匀立即加入浓硫酸,能够使检测的数据更可靠、稳定。
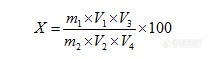
[align=center]保健食品中粗多糖的测定[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:胡志雄[/align]一、目的:对《保健食品功效成分检测方法》中粗多糖的测定方法(分光光度法)进行方法适用性验证。二、验证内容:方法适用性验证包括线性范围、重复性、回收率。三、验证方法:1 范围 本标准适用于灵芝破壁孢子粉中粗多糖的含量测定。2 规范性文件 《保健食品功效成分检测方法》3 原理 多糖经乙醇沉淀分离后,去除其他可溶性糖及杂质的干扰,再与苯酚-硫酸作用成橙红色化合物,其呈色强度与溶液中糖的浓度成正比,在485nm波长下比色定量。4 试剂和材料4.1 试剂实验室用水为双蒸馏水,所用试剂为分析纯级。4.1.1 无水乙醇(C[sub]2[/sub]H[sub]5[/sub]OH):分析纯。(来源:天津奥普升化工有限公司 批号:20161/19)4.1.2 葡萄糖([color=#333333]C[/color][sub]6[/sub][color=#333333]H[/color][sub]12[/sub][color=#333333]O[/color][sub]6[/sub]):分析纯(来源:上海金穗生物科技有限公司 批号:AS:9001-22-3 )4.1.3 苯酚([color=#333333]C[/color][sub][color=#333333]6[/color][/sub][color=#333333]H[/color][sub][color=#333333]6[/color][/sub][color=#333333]O[/color])(来源:天津市天力化学试剂有限公司 批号:20150408 )4.1.4 浓硫酸([color=#333333]H[/color][sub][color=#333333]2[/color][/sub][color=#333333]SO[/color][sub][color=#333333]4[/color][/sub])(比重1.84)(来源:上海沃凯生物技术有限公司 批号:20170301 )以上试剂符合检测要求4.2 试剂配制4.2.1 乙醇溶液(80%):取20.0mL水与80.0mL无水乙醇混匀。4.2.2 苯酚溶液(5%):称取精制苯酚5.0g,加水溶解并稀释至100mL,混匀。4.2.3 葡萄糖标准溶液:准确称取干燥至恒重的分析纯葡萄糖0.5000g,加水溶解并定容至50mL。4.2.4 葡萄糖标准使用液:吸取葡萄糖标准溶液1.0mL于100mL容量瓶中,以蒸馏水定容到刻度。5 仪器和设备 离心机:4000r/min、电子天平(万分之一)、 分光光度计、水浴锅、漩涡混合器等。 以上仪器符合检测要求6 试样处理 样品提取:称取混合均匀的固体样品1.0-2.0g,置于100mL容量瓶中,加水80mL左右,于沸水中加热1h,冷却至室温后补水至刻度,混匀后过滤,弃去初滤液,收集余下滤液供沉淀粗多糖。沉淀粗多糖:准确吸取上滤液5.0mL置于50mL离心管中,加入无水乙醇(4.1.1)20mL,混匀,于4℃冰箱静置4小时,以4000r/min离心5min,弃去上清液,残渣用80%乙醇(4.2.1)溶液5mL洗涤,离心后弃去上清液,反复操作3次,残渣用水溶解并定容至25mL。7 测定:准确吸取以上试液2.0mL于25mL比色管中,加入5%苯酚溶液(4.2.2)1.0mL,在漩涡混合器上混匀,小心加入浓硫酸(4.1.4)10mL,在漩涡混合器上小心混匀,置于沸水浴中2min,冷却至室温,用分光光度计在485nm波长处以试剂空白为参比,1cm比色皿测定吸光度值。从标准曲线上查出葡萄糖含量,计算样品中粗多糖含量。8. 公式试样粗多糖含量按下式进行计算。[align=center][img=,213,59]http://ng1.17img.cn/bbsfiles/images/2017/09/201709080848_01_2904018_3.png[/img][/align]式中:X—样品中粗多糖的含量,mg/100g; m[sub]1[/sub]—样品测定液中葡萄糖的质量,mg;m[sub]2[/sub]—样品质量,g; V[sub]1[/sub]—样品提取液总体积,mL;V[sub]3[/sub]—粗多糖溶液体积,mL; V[sub]4[/sub]—测定用样品液体积mL V[sub]2[/sub]—沉淀粗多糖所用样品提取液体积,mL。四、验证数据1.线性范围1.1 标准曲线绘制:准确吸取葡萄糖标准使用液(4.2.4)0mL、0.10mL、0.40mL、0.60mL、0.80mL、1.00mL置于25mL比色管中,补加水至2.0mL,加入5%苯酚溶液(4.2.2)1.0mL,在漩涡混合器上混匀,小心加入浓硫酸(4.1.4)10mL,在漩涡混合器上小心混匀,置于沸水浴中2min,冷却至室温,用分光光度计在485nm波长处以试剂空白为参比,1cm比色皿测定吸光度值。以葡萄糖质量(C)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线,进行线性回归,得回归方程:A=2.6991×C R[sup]2[/sup]为0.9996。[align=center][img=,626,65]http://ng1.17img.cn/bbsfiles/images/2017/09/201709080848_02_2904018_3.png[/img][/align][align=center][img=,488,290]http://ng1.17img.cn/bbsfiles/images/2017/09/201709080849_01_2904018_3.png[/img][color=#0000ff] [/color][/align]2 重复性称取6份试样按照上述处理方法进行试样处理,分别吸取适量样液进行比色,代入标准系列回归方程中求得样液中粗多糖浓度。[align=center][img=,621,101]http://ng1.17img.cn/bbsfiles/images/2017/09/201709080850_01_2904018_3.png[/img][/align]由上表可知,芝神堂牌富硒灵芝破壁孢子粉中硒测定的重复性均值为1.047g/100g,RSD值为0.738%,符合规定。3.回收率进行6组平行试验,同时进行加标试验,结果见下表:[align=center][img=,620,118]http://ng1.17img.cn/bbsfiles/images/2017/09/201709080851_01_2904018_3.png[/img][/align]由上表可以看出粗多糖测定的标准偏差为:0.738%; 加标回收在90%-120%之间[color=#0000ff]。[/color][color=#0000ff] [/color]综上所述:从线性、重复性、回收率测试结果可知,均符合方法要求。
最近测枸杞提取物中的枸杞多糖,结果不是很理想,请教各位有没有系统的枸杞多糖的检测方法啊?
求银耳多糖微生物检测怎么做10倍稀释,按照国标方法做10倍直接凝了,吸不上来,粘黏性太强了
检测多糖用什么展开剂和显色剂比较好我查了下文献 通常是用α萘酚的方法请问具体怎么配制和操作
苯酚-硫酸法是一种常用的检测粗多糖含量的方法,其原理是苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸起显色反应,在480-490 nm处有最大吸收值,吸收值与糖含量呈线性关系。此法是先用标准品多糖制作标准曲线后,再通过多糖的显色反应测定吸光度,然后根据其在曲线上的位置推算出多糖的浓度从而推算其含量。此法操作简单、快速、灵敏、重复性好,对每种多糖仅需制作一条标准曲线[1]。目前大家研究较多的、生物活性较高的一些真菌多糖,如香菇多糖、灵芝多糖、姬松茸多糖、猴头菇多糖、灰树花多糖等[2],在结构上大多是以β-(1→3)、β-(1→4)或β-(1→6)糖苷键连接的葡聚糖,另外,分子量也一般分布在十几万到几十万之间。因此,由北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证的《粗多糖含量的测定方法》中建议使用50万分子量的葡聚糖作为标准品[3]。为行业内粗多糖含量的测定统一了标准,使各企业之间多糖类产品更具有可比性。燕麦β-葡聚糖是一种β-(1→3)-(1→4)键接的线性葡聚糖,在结构、粘度等其他物理性质上与常见的植物和真菌多糖很相似,适合作为植物、真菌来源多糖含量测定的标准品。但由于多糖纯化困难,市面上不少葡聚糖纯度较低,不适合作为标准品。下面,我们来比较两种不同纯度的燕麦β-葡聚糖产品作为多糖标准品的区别。1 材料与方法1.1 实验材料高纯度燕麦β-葡聚糖PS-Con-Ⅰ由武汉百特纯大分子科技有限公司提供,纯度大于97%(其中,另外3%主要是结合水),低纯度燕麦β-葡聚糖由某食品研究所提供,纯度约50%,苯酚、浓硫酸均为化学纯。1.2 实验方法样品溶解:高纯度燕麦β-葡聚糖经70℃水浴,15min后完全溶解。低纯度燕麦β-葡聚糖70℃水浴,30min后仍有不溶物,升高溶解温度至90℃后继续溶解30min,仍有少量不溶物,过滤。溶液配制:配制0.1mg/ml葡聚糖标准溶液,50mg/ml苯酚溶液备用。标准曲线的制作:精密吸取葡聚糖标准液0.10,0.40, 0.80,1.20,1.60,2.00ml(分别相当于葡聚糖0.01,0.04,0.08,0.12,0.16,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,混匀,再加入浓硫酸5ml,混匀,沸水浴2分钟,混匀,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以A为横坐标,葡聚糖含量C为纵坐标绘制标准曲线。2 结果与分析2.1 样品溶解高纯度燕麦β-葡聚糖溶解速度较快,溶液澄清透明,说明此产品溶解性良好。低纯度燕麦β-葡聚糖难以溶解,且溶解1h后仍有不溶物存在,说明此产品溶解性差,杂质较多。 2.2 标准曲线下表为两种标准品分别配制不同葡聚糖浓度(含量)反应后得到的吸光值:葡聚糖含量(mg)0.010.040.080.120.162.00高纯度标样吸光值0.0530.0800.2000.2620.3530.450低纯度标样吸光值0.0010.0550.1130.1730.2400.320通过数据处理,得到标准曲线如下:高纯度燕麦β-葡聚糖 C=0.4657A-0.0068 (R=0.9955)低纯度燕麦β-葡聚糖 C=0.609A+0.0101(R=0.9985)比较这两个标准曲线发现,当待测样品吸光值一定,使用低纯度葡聚糖作为标准品得到的标准曲线计算葡聚糖含量值时,明显高于高纯度标准品。究其原因,低纯度葡聚糖所含杂质较多,在作为标准品时,部分杂质不能溶解,却计入了标准品葡聚糖总量,因此,使得结果偏高。另外,即使溶解的物质中,也有可能存在部分不能参加反应的蛋白等杂质,同样会造成结果偏高。由以上数据和分析可以得出,测定粗多糖含量不能使用低纯度葡聚糖作为标准品,应尽量选用高纯度葡聚糖标准品,按照国家建议方法和行业标准进行检测,这样才能保证各企业多糖系列产品在含量和纯度上的可比性,有利于规范企业行为和保健品市场。参考文献[1] 胡居吾,范青生,肖小年. 粗多糖测定方法的研究. 江西食品工业. 2005, 1[2] 李明元. 真菌粗多糖测定方法的研究. 食品研究与开发. 2007, 5[3] 粗多糖的测定方法. 北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证. 食品伙伴网[em0805]
苯酚-硫酸法是一种常用的检测粗多糖含量的方法,其原理是苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸起显色反应,在480-490 nm处有最大吸收值,吸收值与糖含量呈线性关系。此法是先用标准品多糖制作标准曲线后,再通过多糖的显色反应测定吸光度,然后根据其在曲线上的位置推算出多糖的浓度从而推算其含量。此法操作简单、快速、灵敏、重复性好,对每种多糖仅需制作一条标准曲线[1]。目前大家研究较多的、生物活性较高的一些真菌多糖,如香菇多糖、灵芝多糖、姬松茸多糖、猴头菇多糖、灰树花多糖等[2],在结构上大多是以β-(1→3)、β-(1→4)或β-(1→6)糖苷键连接的葡聚糖,另外,分子量也一般分布在十几万到几十万之间。因此,由北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证的《粗多糖含量的测定方法》中建议使用50万分子量的葡聚糖作为标准品[3]。为行业内粗多糖含量的测定统一了标准,使各企业之间多糖类产品更具有可比性。燕麦β-葡聚糖是一种β-(1→3)-(1→4)键接的线性葡聚糖,在结构、粘度等其他物理性质上与常见的植物和真菌多糖很相似,适合作为植物、真菌来源多糖含量测定的标准品。但由于多糖纯化困难,市面上不少葡聚糖纯度较低,不适合作为标准品。下面,我们来比较两种不同纯度的燕麦β-葡聚糖产品作为多糖标准品的区别。1 材料与方法1.1 实验材料高纯度燕麦β-葡聚糖PS-Con-Ⅰ由武汉百特纯大分子科技有限公司提供,纯度大于97%(其中,另外3%主要是结合水),低纯度燕麦β-葡聚糖由某食品研究所提供,纯度约50%,苯酚、浓硫酸均为化学纯。1.2 实验方法样品溶解:高纯度燕麦β-葡聚糖经70℃水浴,15min后完全溶解。低纯度燕麦β-葡聚糖70℃水浴,30min后仍有不溶物,升高溶解温度至90℃后继续溶解30min,仍有少量不溶物,过滤。溶液配制:配制0.1mg/ml葡聚糖标准溶液,50mg/ml苯酚溶液备用。标准曲线的制作:精密吸取葡聚糖标准液0.10,0.40, 0.80,1.20,1.60,2.00ml(分别相当于葡聚糖0.01,0.04,0.08,0.12,0.16,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,混匀,再加入浓硫酸5ml,混匀,沸水浴2分钟,混匀,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以A为横坐标,葡聚糖含量C为纵坐标绘制标准曲线。2 结果与分析2.1 样品溶解高纯度燕麦β-葡聚糖溶解速度较快,溶液澄清透明,说明此产品溶解性良好。低纯度燕麦β-葡聚糖难以溶解,且溶解1h后仍有不溶物存在,说明此产品溶解性差,杂质较多。 2.2 标准曲线下表为两种标准品分别配制不同葡聚糖浓度(含量)反应后得到的吸光值:葡聚糖含量(mg)0.010.040.080.120.162.00高纯度标样吸光值0.0530.0800.2000.2620.3530.450低纯度标样吸光值0.0010.0550.1130.1730.2400.320通过数据处理,得到标准曲线如下:高纯度燕麦β-葡聚糖 C=0.4657A-0.0068 (R=0.9955)低纯度燕麦β-葡聚糖 C=0.609A+0.0101(R=0.9985)比较这两个标准曲线发现,当待测样品吸光值一定,使用低纯度葡聚糖作为标准品得到的标准曲线计算葡聚糖含量值时,明显高于高纯度标准品。究其原因,低纯度葡聚糖所含杂质较多,在作为标准品时,部分杂质不能溶解,却计入了标准品葡聚糖总量,因此,使得结果偏高。另外,即使溶解的物质中,也有可能存在部分不能参加反应的蛋白等杂质,同样会造成结果偏高。由以上数据和分析可以得出,测定粗多糖含量不能使用低纯度葡聚糖作为标准品,应尽量选用高纯度葡聚糖标准品,按照国家建议方法和行业标准进行检测,这样才能保证各企业多糖系列产品在含量和纯度上的可比性,有利于规范企业行为和保健品市场。参考文献[1] 胡居吾,范青生,肖小年. 粗多糖测定方法的研究. 江西食品工业. 2005, 1[2] 李明元. 真菌粗多糖测定方法的研究. 食品研究与开发. 2007, 5[3] 粗多糖的测定方法. 北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证. 食品伙伴网
有版友做过粗多糖吗?样品处理大家都是怎么做的?尤其是在沉淀粗多糖的那一步,洗涤残渣,如何保证清洗干净,只是去掉上清液还是需要过滤?如果要过滤有需要用什么过滤呢?希望做过的版友来一起讨论一下!谢谢
我有一个多糖蛋白粉,波数 400-4000这边有机构可以帮忙检测么?以后量很多,可以合作。
[color=#444444]之前用水提醇沉法提了黄芪多糖,课题要求检测其水解后单糖组成及比例,目前做到单糖组成这一步。[/color][color=#444444]水解用的是三氟乙酸,要求完全水解,对比条件中最剧烈的条件是5M三氟乙酸,100度水解10h,但是就算是这个条件,我进[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]时依然检测不到文献中说到的理论应有单糖,甚至也检测不到多糖,请各位帮忙找找原因。[/color][color=#444444]说说之前做的,水解后我有氮气吹干,保存于-80℃冰箱,几个条件都考察完后一起冻干。[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]样品处理:75%乙腈和25%乙醇溶解水解后样品,离心,吸取上清。[/color][color=#444444]所用色谱柱:HILIC柱。[/color][color=#444444]后来也打了单质谱,依旧检测不出所需要的物质。[/color][color=#444444]不知道是哪一步出错了,请大家帮忙,多谢![/color]
全国范围能做[font=&][size=16px][color=#333131]黄芪多糖的生物活性检测的检测机构有哪些?[url=https://www.woyaoce.cn/helptest/detail-0a3fb37b3e3711582507a9b535f351a1.html]点击查看具体需求详情[/url][/color][/size][/font]
多糖类的糖可以不可以用ESI源[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]法来检测?比如猴头菇多糖其主要是分子量比较大的葡聚糖,可以用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]来检测吗?还是一直要用蒸发光检测器来检测?
请教,用液相检测多糖的方法及注意事项,谢谢!
单糖、多糖、聚合糖HPLC检测方法及实验数据理论目简述糖的分析在许多行业有着重要意义。现有许多不同的分析技术用于糖的分离和测定,它们包括化学分析、比色分析、纸色谱、薄层色谱、和高效液相色谱(HPLC) 等。考虑用HPLC测定糖的定性和定量分析具有快速、灵敏、样品处理简单等优点。从大量的文献报道和综述中可以看出,由于糖的特殊结构及它本身不含强紫外和荧光吸收的官能团,到目前为止还没有建立一个统一的HPLC方法来分析所有的单糖和低聚糖。对各种分离系统也不易比较,许多分离参数(洗脱形式、分析时间、复杂化台物分离情况和柱效率、柱稳定性和柱使用寿命)制约着糖的HPLC分离技术。目前有不同类型的柱子和检测器用于糖的分离和检测。一、分析糖色谱柱概述1.1 化学健合烷基柱在C18柱上用水作流动相对不衍生单、双、叁糖进行分组分离,糖的保留时间较短且分离效果不好。由于所有单糖结构相近很难分离,所以C18柱不适合于较复杂糖混台物的分析。为解决单糖类的分离采用衍生法可改变糖的局部结构, 在C18柱上基本分开。其方法有:糖先进行还原胺化再用异硫氰酸苯酯试剂进行衍生, 用l-苯-3甲基5-吡唑啉酮试剂衍生,等等衍生方法。1.2 阴,阳离子交换树脂阴离子交换柱以NaOH水溶液为流动相,糖在阴离子交换树脂上洗脱顺序为多元醇、单糖和低聚糖,但改变流动相组成或改变柱温可以改变保留顺序。阳离子交换柱阳离子交换树脂柱以4%~l0%交联磺化的聚苯乙烯一二乙烯基苯(PS/ DVB)共聚物为基质,树脂通常吸附Ca,Pb,Ag,Na ,H, 等金属离子为金属抗衡离子,以蒸馏水作流动相,在80-90℃温度下来分离糖。月旭科技目前以Xtimate®Sugar-Ca 型阳离子交换树脂柱,Xtimate® Sugar-H型阳离子交换树脂柱使用较广。钙型阳离子交换树脂柱,以纯水水溶液为流动相可分离蔗糖,果糖,葡萄糖,等或以含EDTA.Ca水溶液作流动相可分离单糖、双糖。氢型阳离子交换树脂柱应用也很多,以0.04 mol/L H3PO4水溶液或pH为2.5硫酸水溶液为流动相可分离乳糖、葡萄糖和果糖等,以H3PO4水溶液为流动相分离一些糖和有机酸。1.3 氨基健合硅胶柱氨基健合硅胶柱通常在室温下用乙腈一水作流动相,分离常见的单糖和低聚糖,糖出峰顺序为单糖、双糖和较高低聚糖,随着流动相中水含量的增加糖的保留时间减少,并且氨基柱柱子有较短的使用寿命,这是柱填料自身水解以及还原糖与氨基之间形成希夫碱,造成柱寿命降低。二、检测器概述用HPLC测糖,选择合适的检测器是很重要的,用于HPLC的检测器很多,根据样品中的糖的种类、含量和纯度来选择合适的检测器2.11 示差折光(RI)检测器RI检测器是HPLC测糖最常用的检测器,它具有稳定、易于操作,样品不被破坏和具有较好的灵敏度等优点。虽然RI检测器应用很广,但也存在一些缺点,它受温度和流动相组成的影响,不能使用梯度淋洗;对于糖含量较低的样品,RI检测器的灵敏度达不到要求。2.12 UV—VWD紫外检测器UV—VIS检测器在HPLC测糖中起着重要作用,它不需严格的温度控制,糖只在近紫外区190nm附近有吸收,UV检测器可用于未衍生糖的检测,但在此波长区, 流动相和样品中不能含有吸收的杂质,必须用超纯的流动相和较纯的样品,它的检测灵敏度与RI检测器相差不大。若采用衍生试剂与糖进行柱前或柱后衍生反应,生成具有强紫外或可见吸收的物质,可大大提高检测灵敏度。三、实验方案(化学健合相色谱柱)多糖衍生紫外检测器测定法。测定目标物质:混标:甘露糖,盐酸氨基葡萄糖,鼠李糖,葡萄糖,木糖,半乳糖, 阿拉伯糖,岩藻糖检测波长:254nm柱温:30℃流速:1ml/min进样量:20μl流动相配制:流动相A:乙腈。流动相B:50Mmol磷酸二氢钾缓冲液(精密称取磷酸二氢钾6.804g置于量瓶中加水溶解至1000ml,混匀后,用氢氧化钠溶液调节pH值为6.9)[
高效毛细管电泳仪对多糖进行检测,其中遇到的一个主要问题就是怎样使中性的多糖带上电?即使带上电能够分离了,不知效果怎么样??

灵芝子实体粗多糖提取及分析灵芝多糖具提高免疫力、抗氧化、抗肿瘤、安神、降血糖、消除放化疗副反应、除胃热、保肝解毒等功效。灵芝多糖是灵芝中最有效的成分之一,因此,也特别受到医药科技工作者的重视,研究报道也最多。现知灵芝多糖有广泛的药理活性,能提高机体免疫力,提高机体耐缺氧能力,消除自由基,抑制肿瘤、抗辐射,提高肝脏、骨髓、血液合成DNA、RNA、蛋白质能力,延长寿命,灵芝多糖还具有刺激宿主非特异性抗性、免疫特异反应以及抑制移植肿瘤生理活性的特性。材料实验所用材料购于市场,经鉴定为灵芝。前处理取灵芝子实体500g剪碎,用75%的乙醇回流脱酯2小时,反复三次,离心,上清液用旋转蒸发仪蒸除乙醇,得灵芝浸膏。提取灵芝残渣分别用pH=2的盐酸溶液、6%的尿素溶液、3%的三氯醋酸溶液室温提取24小时,透析,离心,上清液加入4倍85%乙醇醇析,得粗多糖FS。分级灵芝子实体经脱脂,分别用上述三种方法提取得粗多糖FS,对其中的FS水溶粗多糖进行乙醇分级。FS配成5%多糖溶液,搅拌滴加乙醇,使乙醇的浓度依次达到30%、50%、70%离心所得沉淀依次为FS-A、FS-B、FS-C。脱蛋白5%糖溶液,用链蛋白酶,按酶:蛋白=l:50取蛋白酶,加入糖溶液中,加少量二甲苯防腐,1%NaCI作激活剂,37度,保温24小时,按多糖液总体积1/4加入Sevgae试剂(氯仿:正丁醇=4[/size
检测和分离脂多糖中的 [font=宋体]脂阿拉伯甘露糖([/font][font='Times New Roman']LAM[/font][font=宋体])和脂甘露糖([/font][font='Times New Roman']LM[/font][font=宋体])这二种糖在紫外检测器有吸收吗?且一般选什么柱子?检测蛋白一般用什么柱子和检测器?[/font]
检测中药中的多糖,皂苷,黄酮,木脂素用什么液相色谱柱?
[color=#444444]各位大虾,小女子遇到一个比较棘手的问题:在[/color][color=#444444]GB/T18672[/color][color=#444444]标准[/color][color=#444444] [/color][color=#444444]枸杞子中多糖的检测中苯酚液的提纯。实验过程在[/color][color=#444444]172[/color][color=#444444]度时如用水进行冷却,在冷凝管口出现结晶,流出物不能接收到。若不用水进行冷凝的话,流出物颜色有变为黄色。不知道怎么解决这个问题?[/color]
能否请教下用液相色谱来检测多糖及多糖的氧化和还原态的方法?另外我对液相色谱仪的使用还不是特别了解,希望能知道更多有关仪器使用的方法和其需要的注意事项。谢谢!
[align=center][/align][font=宋体]一、原理[/font][font=宋体]1.[/font][font=宋体]多糖的分级与纯化[/font][font=宋体]多糖纯化的实质是将粗多糖中的杂质(包括蛋白质、色素、低聚糖、无机盐等非糖物质)除去而获得分子量和极性均一的多糖组分。比较常用的方法有:醇沉法、超滤法和柱层析法等。其中柱层析法应用比较普遍,多用于样品的精细分级,具有操作简单,重现性好的优点,但样品上样量小。用于多糖分离的柱层析主要有两类:一类是通过分子量大小进行分级的凝胶柱层析,如Sephadex G-100(200、50、25、10)、SepharoseCL-6B等系列;另一类是离子交换层析,是根据多糖所带电荷的性质不同选择相应的离子交换柱对多糖进行分级。如待分离的多糖带有负电荷,可选择阴离子型的DEAE-纤维素柱或DEAE-Sepharose柱进行分级,以获得均一的多糖组分。[/font][font=宋体]通过热水煮提方法提取的多糖,通常是混合物,且分子量不均一,其单糖组成、分子结构和聚合度往往不同,可通过柱层析的方法,对其进行分级以达纯化的目的。本实验中,采用[/font]DEAE-[font=宋体]纤维素柱层析的方法对中草药中水溶性粗多糖进行分级纯化,分离纯化出各级分多糖,[/font][font=宋体]为后续研究多糖的结构特征和生物活性奠定基础。[/font][font=宋体]2.[/font][font=宋体]苯酚—硫酸法[/font][font=宋体]游离的寡糖、多糖中的己糖或糖醛酸在浓硫酸的作用下,脱水生成糠醛,再与苯酚作用起显色反应,在一定范围内其颜色深浅与糖的含量成正比,吸收值与糖含量呈线性关系。且己糖在[/font]490 nm[font=宋体]处(戊糖及糖醛酸在[/font]480 nm[font=宋体])有最大吸收,故用比色法测定多糖含量。该法简单,快速,灵敏,且颜色持久,同一台设备同一光源仅需制作一条标准曲线。[/font][font=宋体] [/font][font=宋体]二、步骤[/font]1.[font=宋体]中草药水溶粗多糖的提取流程[/font][font=宋体]中草药粉末[/font][font=Symbol][/font][font=宋体]蒸馏水浸泡过夜[/font][font=Symbol][/font][font=宋体]超声[/font]/[font=宋体]微波[/font][font=Symbol][/font][font=宋体]水浴浸提[/font][font=Symbol][/font][font=宋体]过滤去除药渣[/font][font=Symbol][/font][font=宋体]定容[/font][font=Symbol][/font][font=宋体]多糖含量测定[/font][font=宋体]加等体积[/font]95%[font=宋体]乙醇[/font][font=Symbol][/font]4[font=宋体]℃冰箱过夜,醇沉多糖[/font][font=Symbol][/font]5000r/min[font=宋体]离心去上清液[/font][font=Symbol][/font][font=宋体]粗多糖[/font][font=Symbol][/font][font=宋体]脱蛋白[/font][font=Symbol][/font][font=宋体]脱色素[/font][font=Symbol][/font][font=宋体]透析[/font][font=Symbol][/font][font=宋体]浓缩[/font][font=Symbol][/font][font=宋体]冷冻干燥得水溶多糖[/font][font=Symbol][/font]DEAE-[font=宋体]纤维素色谱柱[/font][font=Symbol][/font][font=宋体]收集多糖组分[/font][font=Symbol][/font][font=宋体]测定每[/font]50s[font=宋体]洗脱液的[/font]OD[font=宋体]值[/font][font=Symbol][/font][font=宋体]绘制横坐标为管数与纵坐标为[/font]OD[font=宋体]值的洗脱曲线[/font][font=宋体]根据洗脱曲线收集多糖溶液[/font][font=Symbol][/font]4[font=宋体]℃无水乙醇醇沉过夜[/font][font=Symbol][/font][font=宋体]离心[/font][font=Symbol][/font][font=宋体]多糖沉淀[/font][font=Symbol][/font][font=宋体]常规干燥[/font][font=Symbol][/font][font=宋体]纯度鉴定[/font][font=Symbol][/font][font=宋体]纯多糖[/font]2.[font=宋体]脱蛋白[/font][font=宋体]由于粗多糖中含有一定量游离的和结合的蛋白,为保证多糖的纯度,必须将蛋白质脱去。常用的脱蛋白方法有[/font]Sevag[font=宋体]法、三氯乙酸法和蛋白酶法(如链蛋白酶、胰蛋白酶、木瓜蛋白酶)等。[/font][font=宋体]([/font]1[font=宋体])[/font]Sevag[font=宋体]法[/font][font=宋体]根据蛋白质在有机溶剂(如氯仿)中易发生变性析出的特点[/font][font=宋体],把多糖配制成[/font]5%[font=宋体]的糖液,然后按照[/font]1:3[font=宋体]的体积比加入[/font]Sevag[font=宋体]试剂(氯仿∶正丁醇[/font]=4[font=宋体]∶[/font]1[font=宋体]),混匀后剧烈振荡,静置分层后吸去水层与溶剂层交界处的变性蛋白质,重复操作多次,直到除尽蛋白质为止。[/font][font=宋体]([/font]2[font=宋体])三氯乙酸法[/font][font=宋体]将粗多糖配成[/font]5%[font=宋体]的糖液,加入[/font]30%[font=宋体]三氯乙酸溶液,使三氯乙酸终浓度为[/font]15%[font=宋体],在[/font]4℃[font=宋体]冰箱中放置过夜,离心弃去沉淀,得无蛋白的多糖溶液,再用[/font]1 mol/L NaOH[font=宋体]溶液中和至[/font]PH[font=宋体]为[/font]7[font=宋体]。[/font][font=宋体]([/font]3[font=宋体])蛋白酶法[/font][font=宋体]将粗多糖配成[/font]5%[font=宋体]的糖液,用酸碱调[/font]pH[font=宋体]至中性,加链蛋白酶[/font]0.5 L[font=宋体],放恒温箱中[/font]37℃[font=宋体]保温[/font]24 h[font=宋体]后,加热升温至[/font]80℃[font=宋体]使酶失活,离心,得无蛋白的多糖溶液。[/font]3.[font=宋体]脱色[/font][font=宋体]([/font]1[font=宋体])[/font] [font=宋体]活性炭法[/font][font=宋体]将脱蛋白后的多糖配成[/font]5%[font=宋体]的糖液,用[/font]NaOH[font=宋体]溶液调[/font]pH[font=宋体]为[/font]4.5[font=宋体],加入活性炭粉末,于[/font]80℃[font=宋体]保温[/font]2 h[font=宋体]后过滤。反复进行[/font]3[font=宋体]次,直到溶液颜色不再降低为止。[/font][font=宋体]([/font]2[font=宋体])过氧化氢法[/font][font=宋体]将脱蛋白后的多糖溶液,用浓氨水调至[/font]pH[font=宋体]为[/font]8.0[font=宋体],逐滴滴加[/font]20%H[sub]2[/sub]O[sub]2[/sub][font=宋体]至溶液为浅黄色,[/font]50℃[font=宋体]水浴,保温[/font]2 h[font=宋体]后过滤。[/font]4.[font=宋体]透析脱盐[/font][font=宋体]将脱蛋白、脱色后多糖配成[/font]5%[font=宋体]溶液,置于透析袋中,先用自来水逆向流水透析[/font]72 h[font=宋体]后,再用蒸馏水透析[/font]24 h[font=宋体],每[/font]4 h[font=宋体]换水一次。[/font]5.[font=宋体]干燥[/font][font=宋体]将脱蛋白、脱色、脱盐后的中草药多糖溶液,水浴[/font]80℃[font=宋体]浓缩至[/font]10 mL[font=宋体],加三倍体积的无水乙醇过夜,离心取沉淀,经无水乙醇、乙醚洗涤后,常规干燥得中草药去蛋白去色素的多糖。[/font]6.[font=宋体]多糖含量测定[/font][font=宋体]采用苯酚[/font]-[font=宋体]硫酸法测定样品中的多糖含量。绘制标准曲线,根据葡萄糖标准曲线和样品吸光值计算其糖含量。[/font][font=宋体]标准曲线的制作:准确称取[/font]105℃[font=宋体]干燥恒重的标准葡萄糖[/font]50 mg[font=宋体]定容于[/font]500 mL[font=宋体]容量瓶中,加水至刻度,用移液管分别吸取[/font]0[font=宋体]、[/font]0.1[font=宋体]、[/font]0.2[font=宋体]、[/font]0.3[font=宋体]、[/font]0.4[font=宋体]、[/font]0.5[font=宋体]、[/font]0.6[font=宋体]、[/font]0.7[font=宋体]、[/font]0.8[font=宋体]、[/font]0.9[font=宋体]、[/font]1.0 mL[font=宋体]转入试管中,各以蒸馏水补至[/font]1.0 mL[font=宋体],每个浓度重复四个平行。然后分别向每支试管中加入[/font]4%[font=宋体]苯酚试剂[/font]1mL[font=宋体]及浓硫酸[/font]2 mL[font=宋体],摇匀,沸水浴中煮沸[/font]10 min[font=宋体],冷却至室温,放置[/font]10 min[font=宋体]后在[/font]λ= 480 nm[font=宋体]处测定吸光值[/font]A[font=宋体]。以吸光值[/font]A[font=宋体]为纵坐标,糖含量[/font]C[font=宋体]为横坐标,得糖的标准曲线。[/font][font=宋体]样品溶液制备:精密称取水溶性粗多糖[/font]5 mg[font=宋体],先加[/font]10 mL[font=宋体]蒸馏水溶解,然后定容至[/font]50 mL[font=宋体]。[/font][font=宋体]样品含量测定:用移液管吸取样品液[/font]1.0 mL[font=宋体],加入[/font]4%[font=宋体]苯酚溶液[/font]1 mL[font=宋体]及浓硫酸[/font]2 mL[font=宋体],按上述方法进行操作,测其吸光值,以标准曲线计算样品糖含量[/font][font=宋体]按下式计算中草药多糖的质量浓度与得率。[/font] [img=,300,41]https://ng1.17img.cn/bbsfiles/images/2021/11/202111021041176368_5305_3528941_3.gif!w300x41.jpg[/img]7.[font=宋体]分级[/font][font=宋体]([/font]1[font=宋体])[/font] DEAE-[font=宋体]纤维素的预处理和装柱[/font][font=宋体]将[/font]DEAE-[font=宋体]纤维素用蒸馏水充分浸泡溶胀后,倾倒除去水分,再用[/font]0.5 M NaOH[font=宋体]溶液浸泡[/font]1 h[font=宋体],用蒸馏水反复洗涤至[/font]PH[font=宋体]等于[/font]7[font=宋体]。再用[/font]0.5 M[font=宋体]的[/font]HCl[font=宋体]溶液浸泡[/font]1 h[font=宋体],用蒸馏水洗至中性,真空清除气泡,备用。[/font][font=宋体]装柱时,先将[/font]DEAE-[font=宋体]纤维素沿着玻璃棒缓慢倒入,以防产生气泡。柱子装好后,依次用[/font]5[font=宋体]倍柱体积的蒸馏水、[/font]3[font=宋体]倍柱体积的[/font]1.0 M NaCl[font=宋体]和[/font]5[font=宋体]倍柱体积的蒸馏水进行平衡,流速设定为[/font]20 cm/ h[font=宋体]。[/font][font=宋体]([/font]2[font=宋体])水溶性粗多糖的离子交换柱层析的线性梯度洗脱[/font][font=宋体]称取[/font]50 mg[font=宋体]水溶性粗多糖,溶于[/font]5 mL[font=宋体]蒸馏水中,在已平衡好的[/font]DEAE-[font=宋体]纤维素离子交换柱([/font]1.5 × 14 cm[font=宋体],[/font]Cl[sup]-[/sup][font=宋体]型)上进行上样,先用[/font]100 mL[font=宋体]蒸馏水做流动相进行洗脱,再用[/font]0~1.0 M NaCl[font=宋体]溶液[/font]300 mL[font=宋体]进行线形梯度洗脱,流速[/font]1.0 mL/min[font=宋体],每个试管收集[/font]3 mL[font=宋体]洗脱液,苯酚—硫酸法测定洗脱液中相对的糖含量分布。[/font]8.[font=宋体]纯度鉴定[/font][font=宋体]([/font]1[font=宋体])高效液相色谱法[/font][font=宋体]采用高效液相色谱仪系统,[/font] 10A[font=宋体]检测器,[/font]CLASS-Vp[font=宋体]工作站,[/font]TSK-gel G-3000PWXL[font=宋体]不锈钢色谱柱([/font]7.8 × 300 mm)[font=宋体],柱温为[/font]40℃[font=宋体]。[/font][font=宋体]取各级多糖样品溶于[/font]0.7 M Na2SO4[font=宋体]溶液中,其多糖终浓度为[/font]2 mg/mL[font=宋体],上样[/font]20 μL[font=宋体],流动相为[/font]0.7 M Na2SO4[font=宋体]溶液,流速为[/font]0.5 mL/min[font=宋体]。[/font][font=宋体]([/font]2[font=宋体])紫外光谱分析[/font][font=宋体]将水溶性粗多糖各级分多糖样品配成[/font]0.1 mg/mL[font=宋体]的溶液,用[/font]752PC[font=宋体]型紫外可见分光光度计于[/font]200-400 nm[font=宋体]处扫描检测。[/font][font=宋体]([/font]3[font=宋体])旋光仪分析[/font][font=宋体]不同的多糖具有不同的比旋度,它们在不同浓度的乙醇中具有不同溶解度,所以,如同一多糖水溶液经不同浓度的乙醇沉淀所得的沉淀物,具有相同比旋度,则证明该多糖为均一组分。[/font][font=宋体]将评估多糖样品溶于水,成为近似半饱和溶液,置于磁力搅拌器上,在搅拌下加乙醇,使溶液中乙醇浓度达到[/font]20%[font=宋体],搅拌片刻,使沉淀完全,离心得沉淀。上清液中再继续滴加乙醇,使溶液中乙醇浓度达[/font]40%[font=宋体],所产生的沉淀再经离心。前后两次沉淀,分别干燥后在相同条件下测定其水溶液的比旋度。[/font][font=宋体]将[/font]10 mL5%[font=宋体]饱和糖液用国产[/font]WXG[font=Symbol]-[/font]6[font=宋体]型自动旋光仪,钠灯光源,以蒸馏水调零点,[/font]1dm[font=宋体]管室温下测定。[/font]
哪位有NY/T 1676—2008《食用菌中粗多糖含量的测定》标准?能发上来吗?谢了!
[align=left] 超声波浸提提取猴头菇粗多糖的研究[/align][align=left] 超声波提取技术是指以超声波辐射产生的机械振动效应、空化效应和热效应,引起机械搅拌、加速扩散溶解的一种利用外场介入的强化溶剂提取方法[sup][/sup]。“空化现象”产生巨大压力的会破坏原料细胞壁,加速提取物的溶出。“机械振动”和“热效应”使溶出成分进一步扩散,最终实现实现固--液萃取分离,具有时间短,效率高,成本低的特点。目前利用超声波提取猴头菇多糖的研究很多,也取得了较为理想的结果。柴军红[sup][/sup]等人采用超声波法提取猴头菇下脚料多糖,得率为9.56%;张素斌[sup][/sup]等人对比7种提取方法对猴头菇多糖得率的影响,结果表明:超声波与复合酶法的协同作用可使多糖提取率大为提高,达到15.59%。[/align][align=left]1 料液比对猴头菇多糖提取效果的影响[/align][align=left]猴头菇子实体粉碎成过20目筛,按重量的20倍、30倍、40倍加入蒸馏水,分别在超声波中提取15分钟,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后,取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]2 超声时间对猴头菇多糖提取效果的影响[/align][align=left] 称取等量的子实体粉末(2.00克),按重量的20倍加入蒸馏水,于超声波中分别提取10、15、20分钟,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后,取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]3 超声水浴温度对猴头菇多糖提取效果的影响[/align][align=left]称取同等量的子实体粉末(2.00克)三份,按重量的20倍加入蒸馏水,于,超声波的水浴温度分别为40℃、50℃、60℃中提取二次,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后,取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]4 正交试验[/align][align=left] 为进一步探讨浸提参数中的料液比、时间和浸提次数对子实体多糖的影响,进行3因素3水平的正交试验。[/align][align=left] 结果与讨论[/align][align=left]1、料液比对猴头菇多糖提取效果的影响[/align][align=left] 以猴头菇粉末为实验材料,在水浴温度为50℃、超声时间为20min的条件下,研究料液比对猴头菇粗多糖浸提效果的影响,实验结果如图1。由图1可知,当料液比为1:20时,猴头菇多糖浸出量较大;随着料液比加大,粗多糖提取率提高不显著,为了节约成本及提高效率,故选择料液比为1:20作为水浴浸提的最佳条件。[/align][align=left]表1 料液比对猴头菇粗多糖浸提的影响[/align][align=left]Table1 The effect of the mixture ratio on theextraction yield of [i]H. erinaceus[/i] polysaccharide [/align] [table=585][tr][td=1,1,130] 料液比[/td][td=1,1,68] 1:10[/td][td=1,1,80] 1:20[/td][td=1,1,70] 1:30[/td][td=1,1,89] 1:40[/td][td=1,1,80] 1:50[/td][td=1,1,68] 1:60[/td][/tr][tr][td=1,1,130] 第一次提取率(%)[/td][td=1,1,68] 14.78[/td][td=1,1,80] 15.86[/td][td=1,1,70] 15.41[/td][td=1,1,89] 15.41[/td][td=1,1,80] 15.67[/td][td=1,1,68] 15.28[/td][/tr][tr][td=1,1,130] 第一次提取率(%)[/td][td=1,1,68] 14.31[/td][td=1,1,80] 15.50[/td][td=1,1,70] 15.61[/td][td=1,1,89] 15.41[/td][td=1,1,80] 15.28[/td][td=1,1,68] 15.34[/td][/tr][tr][td=1,1,130] 第一次提取率(%)[/td][td=1,1,68] 14.29[/td][td=1,1,80] 15.41[/td][td=1,1,70] 15.54[/td][td=1,1,89] 15.41[/td][td=1,1,80] 15.19[/td][td=1,1,68] 15.19[/td][/tr][tr][td=1,1,130] 平均提取率(%)[/td][td=1,1,68] 14.46[/td][td=1,1,80] 15.59[/td][td=1,1,70] 15.52[/td][td=1,1,89] 15.41[/td][td=1,1,80] 15.38[/td][td=1,1,68] 15.27[/td][/tr][tr][td=1,1,130] 差异性显著分析[/td][td=1,1,68] Aa[/td][td=1,1,80] Bb[/td][td=1,1,70] Bb[/td][td=1,1,89] Bb[/td][td=1,1,80] Bb[/td][td=1,1,68] Bb[/td][/tr][/table][align=left][img=,564,337]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709458342_7981_2903169_3.png[/img][/align][align=left]图1 料液比对猴头菇粗多糖浸提的影响[/align][align=left] Fig1 The effect of solid-liquid ratio on theextraction yield of [i]H. erinaceus[/i] polysaccharide[/align][align=left][/align]2 水浴温度对猴头菇多糖提取效果的影响[align=left] 以剪碎后的猴头菇子实体为实验材料,在料液比为1:20、超声时间为20 min的条件下,研究温度对猴头菇粗多糖浸提效果的影响,实验结果如图2。由图2可知,当水浴温度为50℃时,猴头菇多糖浸出量较大;随着温度的升高,粗多糖提取率反而下降,这是因为提取温度过高时,粗多糖类化合物容易降解失活,故选择水浴温度为50℃作为水浴浸提的最佳条件。[/align][align=left]表2 温度对猴头菇粗多糖浸提的影响[/align][align=left]Table2 Theeffect of temperature on the extraction yield of hericium polysaccharide[/align] [table=527][tr][td=1,1,129] 温度(℃)[/td][td=1,1,69] 30[/td][td=1,1,81] 40[/td][td=1,1,75] 50[/td][td=1,1,91] 60[/td][td=1,1,81] 70[/td][/tr][tr][td=1,1,129] 第一次提取率(%)[/td][td=1,1,69] 9.89[/td][td=1,1,81] 12.09[/td][td=1,1,75] 15.56[/td][td=1,1,91] 14.04[/td][td=1,1,81] 11.7[/td][/tr][tr][td=1,1,129] 第一次提取率(%)[/td][td=1,1,69] 9.69[/td][td=1,1,81] 11.87[/td][td=1,1,75] 15.62[/td][td=1,1,91] 13.92[/td][td=1,1,81] 11.54[/td][/tr][tr][td=1,1,129] 第一次提取率(%)[/td][td=1,1,69] 9.79[/td][td=1,1,81] 11.98[/td][td=1,1,75] 15.59[/td][td=1,1,91] 13.98[/td][td=1,1,81] 11.62[/td][/tr][tr][td=1,1,129] 平均提取率(%)[/td][td=1,1,69] 9.79[/td][td=1,1,81] 11.98[/td][td=1,1,75] 15.59[/td][td=1,1,91] 13.98[/td][td=1,1,81] 11.62[/td][/tr][tr][td=1,1,129] 差异性显著分析[/td][td=1,1,69] Aa[/td][td=1,1,81] Bb[/td][td=1,1,75] Bb[/td][td=1,1,91] Bb[/td][td=1,1,81] Bb[/td][/tr][/table][align=left][/align] [table][tr][td=1,1,28] [/td][/tr][tr][td] [/td][td][img=,516,311]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709456949_597_2903169_3.png[/img][/td][/tr][/table][align=left][/align] 图2 温度对猴头菇粗多糖浸提的影响[align=left] Fig2 The effect of temperature on the extractionyield of hericium polysaccharide[/align][align=left]3 浸提时间对猴头菇多糖提取效果的影响[/align][align=left] 以剪碎后的猴头菇子实体为实验材料,在料液比为1:20、温度为50℃的条件下,研究浸提时间对猴头菇粗多糖浸提效果的影响,实验结果如图3。由图3可知,当浸提时间为20min时,猴头菇多糖浸出量较大;随着浸提时间的延长,粗多糖提取率反而下降,这是因为浸提时间过长时,粗多糖类化合物易降解失活,故选择浸提时间为20min作为水浴浸提的最佳条件。[/align][align=left]表3 超声时间对猴头菇粗多糖浸提的影响[/align][align=left]Table3 Theeffect of ultrasonic time on the extraction yield of [i]H. erinaceus[/i] polysaccharide[/align] [table=536][tr][td=1,1,132] 时间(min)[/td][td=1,1,67] 10[/td][td=1,1,80] 15[/td][td=1,1,89] 20[/td][td=1,1,89] 25[/td][td=1,1,80] 30[/td][/tr][tr][td=1,1,132] 第一次提取率(%)[/td][td=1,1,67] 13.94[/td][td=1,1,80] 14.87[/td][td=1,1,89] 15.68[/td][td=1,1,89] 15.61[/td][td=1,1,80] 15.58[/td][/tr][tr][td=1,1,132] 第二次提取率(%)[/td][td=1,1,67] 14.21[/td][td=1,1,80] 15.16[/td][td=1,1,89] 15.63[/td][td=1,1,89] 15.42[/td][td=1,1,80] 15.41[/td][/tr][tr][td=1,1,132] 第三次提取率(%)[/td][td=1,1,67] 14.18[/td][td=1,1,80] 15.09[/td][td=1,1,89] 15.46[/td][td=1,1,89] 15.68[/td][td=1,1,80] 15.39[/td][/tr][tr][td=1,1,132] 平均提取率(%)[/td][td=1,1,67] 14.11[/td][td=1,1,80] 15.04[/td][td=1,1,89] 15.59[/td][td=1,1,89] 15.57[/td][td=1,1,80] 15.46[/td][/tr][tr][td=1,1,132] 差异性显著分析[/td][td=1,1,67] Aa[/td][td=1,1,80] Bb[/td][td=1,1,89] Bb[/td][td=1,1,89] Bb[/td][td=1,1,80] Bb[/td][/tr][/table][align=left] [img=,539,343]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709458336_6635_2903169_3.png[/img] [/align][align=left] 图3 超声时间对猴头菇粗多糖浸提的影响[/align][align=left]Fig3 Theeffect of ultrasonic time on the extraction yield of hericium polysaccharide[/align][align=left]4 最佳条件下水浴提取法的多糖提取率[/align][align=left] 在最佳的因素下,进行了浸提取,结果见表4。 [/align][align=left] 表4 超声提取最优条件下多糖提取率[/align][align=left]Table4 Theextraction rate of polysaccharide under the optimum condition by ultrasonic[/align] [table=537][tr][td=1,1,124] 实验次数[/td][td=2,1,101] [align=center]多糖提取率(%)[/align] [/td][td=2,1,173] [align=center]平均提取率[/align] [align=center](%)[/align] [/td][td=2,1,132] [align=center] RSD(%)[/align] [/td][td=1,1,7] [/td][/tr][tr][td=2,1,131] [align=center]1[/align] [/td][td=2,1,101] [align=center][color=black]15.01[/color][/align] [/td][td=2,3,173] [align=center]15.13[/align] [/td][td=2,3,132] [align=center]0.76[/align] [/td][/tr][tr][td=2,1,131] [align=center]2[/align] [/td][td=2,1,101] [align=center][color=black]15.24[/color][/align] [/td][/tr][tr][td=2,1,131] [align=center]3[/align] [/td][td=2,1,101] [align=center][color=black]15.14[/color][/align] [/td][/tr][tr][td=1,1,124] [/td][td=1,1,7] [/td][td=1,1,93] [/td][td=1,1,7] [/td][td=1,1,166] [/td][td=1,1,7] [/td][td=1,1,125] [/td][td=1,1,7] [/td][/tr][/table][align=left][color=red] [/color]在最佳的超声波条件下:料液比为1:20、水浴温度:50℃、浸提时间:20分钟的条件下,进行三次平行实验,得到平均粗多糖提取率为15.13%,RSD符合要求。[/align][align=left]表5 L9(3[sup]3[/sup])正交实验结果及其分析[/align][align=left] Table5 Results and analysis of orthogonal experiment[/align][align=center] [table=558][tr][td=2,2,88] 实验号[/td][td=4,1,332] 因素[/td][td=1,1,138] 实验指标[/td][/tr][tr][td=1,1,78] [align=center]料液比A[/align] [/td][td=1,1,78] [align=center]时间B[/align] [/td][td=1,1,91] [align=center]温度C[/align] [/td][td=1,1,84] [align=center]误差[/align] [/td][td=1,1,138] [align=center]提取率[color=black](%)[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]1[/align] [/td][td=1,1,78] [align=center](1)1:20[/align] [/td][td=1,1,78] [align=center](1)10[/align] [/td][td=1,1,91] [align=center](1)30[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center][color=black]9.61[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]2[/align] [/td][td=1,1,78] [align=center](1)1:20[/align] [/td][td=1,1,78] [align=center](2)15[/align] [/td][td=1,1,91] [align=center](2)40[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center][color=black]12.24[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]3[/align] [/td][td=1,1,78] [align=center](1)1:20[/align] [/td][td=1,1,78] [align=center](3)20[/align] [/td][td=1,1,91] [align=center](3)50[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center]15.59[/align] [/td][/tr][tr][td=2,1,88] [align=center]4[/align] [/td][td=1,1,78] [align=center](2)1:30[/align] [/td][td=1,1,78] [align=center](1)10[/align] [/td][td=1,1,91] [align=center](2)40[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center][color=black]13.21[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]5[/align] [/td][td=1,1,78] (2)1:30[/td][td=1,1,78] [align=center](2)15[/align] [/td][td=1,1,91] [align=center](3)50[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center][color=black]15.52[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]6[/align] [/td][td=1,1,78] (2)1:30[/td][td=1,1,78] [align=center](3)20[/align] [/td][td=1,1,91] [align=center](1)30[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center][color=black]9.79[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]7[/align] [/td][td=1,1,78] [align=center](3)1:40[/align] [/td][td=1,1,78] [align=center](1)10[/align] [/td][td=1,1,91] [align=center](3)50[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center][color=black]14.11[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]8[/align] [/td][td=1,1,78] (3)1:40[/td][td=1,1,78] [align=center](2)15[/align] [/td][td=1,1,91] [align=center](1)30[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center][color=black]9.97[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]9[/align] [/td][td=1,1,78] (3)1:40[/td][td=1,1,78] [align=center](3)20[/align] [/td][td=1,1,91] [align=center](2)40[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center][color=black]11.98[/color][/align] [/td][/tr][tr][td=1,12,36] 总 糖[/td][td=1,1,51] K[sub]11[/sub][/td][td=1,1,78] [align=center][color=black]37.44[/color][/align] [/td][td=1,1,78] [align=center][color=black]36.93[/color][/align] [/td][td=1,1,91] [align=center][color=black]29.37[/color][/align] [/td][td=1,1,84] [align=center][color=black]37.11[/color][/align] [/td][td=1,12,138] [/td][/tr][tr][td=1,1,51] K[sub]12[/sub][/td][td=1,1,78] [align=center][color=black]38.52[/color][/align] [/td][td=1,1,78] [align=center][color=black]37.73[/color][/align] [/td][td=1,1,91] [align=center][color=black]37.43[/color][/align] [/td][td=1,1,84] [align=center][color=black]36.14[/color][/align] [/td][/tr][tr][td=1,1,51] K[sub]13[/sub][/td][td=1,1,78] [align=center][color=black]36.06[/color][/align] [/td][td=1,1,78] [align=center][color=black]37.36[/color][/align] [/td][td=1,1,91] [align=center][color=black]45.22[/color][/align] [/td][td=1,1,84] [align=center][color=black]38.77[/color][/align] [/td][/tr][tr][td=1,1,51] [align=center]k1[/align] [/td][td=1,1,78] [align=center][color=black]12.48[/color][/align] [/td][td=1,1,78] [align=center][color=black]12.3[/color][/align] [/td][td=1,1,91] [align=center][color=black]9.8[/color][/align] [/td][td=1,1,84] [align=center][color=black]12.4[/color][/align] [/td][/tr][tr][td=1,1,51] [align=center]k2[/align] [/td][td=1,1,78] [align=center][color=black]12.8[/color][/align] [/td][td=1,1,78] [align=center][color=black]12.6[/color][/align] [/td][td=1,1,91] [align=center][color=black]12.5[/color][/align] [/td][td=1,1,84] [align=center][color=black]12.0[/color][/align] [/td][/tr][tr][td=1,1,51] [align=center]k3[/align] [/td][td=1,1,78] [align=center][color=black]12.0[/color][/align] [/td][td=1,1,78] [align=center][color=black]12.5[/color][/align] [/td][td=1,1,91] [align=center][color=black]15.1[/color][/align] [/td][td=1,1,84] [align=center][color=black]12.9[/color][/align] [/td][/tr][tr][td=1,1,51] R[/td][td=1,1,78] [align=center][color=black]2.46[/color][/align] [/td][td=1,1,78] [align=center][color=black]0.8[/color][/align] [/td][td=1,1,91] [align=center][color=black]15.85[/color][/align] [/td][td=1,1,84] [align=center][color=black]2.63[/color][/align] [/td][/tr][tr][td=1,1,51] K[sub]21[/sub][sup]2[/sup][/td][td=1,1,78] [align=center][color=black]1401.754[/color][/align] [/td][td=1,1,78] [align=center][color=black]1363.825[/color][/align] [/td][td=1,1,91] [align=center][color=black]862.5969[/color][/align] [/td][td=1,1,84] [align=center][color=black]1377.152[/color][/align] [/td][/tr][tr][td=1,1,51] K[sub]22[/sub][sup]2[/sup][/td][td=1,1,78] [align=center][color=black]1483.79[/color][/align] [/td][td=1,1,78] [align=center][color=black]1423.553[/color][/align] [/td][td=1,1,91] [align=center][color=black]1401.0049[/color][/align] [/td][td=1,1,84] [align=center][color=black]1306.1[/color][/align] [/td][/tr][tr][td=1,1,51] K[sub]23[/sub][sup]2[/sup][/td][td=1,1,78] [align=center][color=black]1300.324[/color][/align] [/td][td=1,1,78] [align=center][color=black]1395.77[/color][/align] [/td][td=1,1,91] [align=center][color=black]2044.8484[/color][/align] [/td][td=1,1,84] [align=center][color=black]1503.113[/color][/align] [/td][/tr][tr][td=1,1,51] [align=center]Q[/align] [/td][td=1,1,78] [align=center][color=black]1395.289[/color][/align] [/td][td=1,1,78] [align=center][color=black]1394.382[/color][/align] [/td][td=1,1,91] [align=center][color=black]1436.150067[/color][/align] [/td][td=1,1,84] [align=center][color=black]1395.455[/color][/align] [/td][/tr][tr][td=1,1,51] [align=center]S[/align] [/td][td=1,1,78] [align=center][color=black]1.01[/color][/align] [/td][td=1,1,78] [align=center][color=black]0.11[/color][/align] [/td][td=1,1,91] [align=center][color=black]41.87[/color][/align] [/td][td=1,1,84] [align=center][color=black]1.18[/color][/align] [/td][/tr][/table][/align][align=left] 表6 正交试验方差分析表[/align][align=left] Table6 Analysis of variance table for orthogonalexperiment[/align][align=left][/align][align=center] [table=641][tr][td=1,1,131] 变异来源[/td][td=1,1,73] [align=center]平方和[/align] [/td][td=1,1,86] [align=center]自由度[/align] [/td][td=1,1,96] [align=center]均方[/align] [/td][td=1,1,86] [align=center]F值[/align] [/td][td=1,1,170] [align=center]显著水平[/align] [/td][/tr][tr][td=1,1,131] [align=center]料液比A[/align] [/td][td=1,1,73] [align=center][color=black]1.01[/color][/align] [/td][td=1,1,86] [align=center][color=black]2[/color][/align] [/td][td=1,1,96] [align=center][color=black]0.51[/color][/align] [/td][td=1,1,86] [align=center][color=black]0.86[/color][/align] [/td][td=1,4,170] [align=center] [/align] [align=center]F0.05(2,2)=19.0[/align] [/td][/tr][tr][td=1,1,131] [align=center]时间B[/align] [/td][td=1,1,73] [align=center][color=black]0.1[/color][/align] [/td][td=1,1,86] [align=center][color=black]2[/color][/align] [/td][td=1,1,96] [align=center][color=black]0.1[/color][/align] [/td][td=1,1,86] [align=center][color=black]0.09[/color][/align] [/td][/tr][tr][td=1,1,131] [align=center]温度C[/align] [/td][td=1,1,73] [align=center]41.9[/align] [/td][td=1,1,86] [align=center]2[/align] [/td][td=1,1,96] [align=center]20.9[/align] [/td][td=1,1,86] [align=center]35.51[/align] [/td][/tr][tr][td=1,1,131] [align=center]误差[/align] [/td][td=1,1,73] [align=center][color=black]1.2[/color][/align] [/td][td=1,1,86] [align=center][color=black]2[/color][/align] [/td][td=1,1,96] [align=center][color=black]0.6[/color][/align] [/td][td=1,1,86] [align=center][color=black] [/color][/align] [/td][/tr][tr][td=1,1,131] [align=center]总和[/align] [/td][td=1,1,73] [align=center][color=black]44.2[/color][/align] [/td][td=1,1,86] [align=center][color=black]8[/color][/align] [/td][td=1,1,96] [align=center][color=black] [/color][/align] [/td][td=1,1,86] [align=center] [/align] [/td][td=1,1,170] [/td][/tr][/table][/align][align=left] 从本试验的极差分析可知,对猴头菇多糖提取量的影响大小依次为浸提温度C、料液比A及浸提时间B。即在料液比为1:20, 浸提时间为20min,浸提温度为50℃,粗多糖浸出量最高。[/align][align=left][/align][align=left][/align][align=left][/align] [align=left][/align][align=left][/align]
建立采用高效液相色谱-蒸发光散射检测(HPLC-ELSD)法同时测定大枣多糖酸性条件下水解产物中阿拉伯糖和D-半乳糖含量的方法。实验结果表明:制备的样品中阿拉伯糖和D-半乳糖分离良好,阿拉伯糖和D-半乳糖分别在2.00~10.00 μg(r2 = 0.9957)和2.08~10.40 μg(r2 = 0.9903)范围内呈良好的线性关系;平均加样回收率分别为103.87%(RSD = 5.42%,n = 9)和93.04%(RSD = 4.90%,n = 9)。该方法稳定性和重复性好,可为大枣质量评价和控制提供参考。
多糖的分析是一个大问题啊!和大家讨论一下吧,经综合各种文献我认为多糖结构分析内容:要搞清1. 多糖的单糖组成(种类、比例)2. 每个单糖残基的D-、L-构型,吡喃环式或呋喃环式3. 羟基被取代情况(糖苷键的位置)4. 糖苷键及构型(α、β异头异构体)5. 重复单元方法:1、单糖组成:(对照品:葡萄糖、岩藻糖、半乳糖、甘露糖、木糖、阿拉伯糖、鼠李糖)a:水解: 纸层析薄层层析气相色谱(糖氰乙酸酯衍生物、糖醇乙酸酯)液相色谱(ZORBAX-NH2、HRC-NH2、RID)首选气相,灵敏度高,液相RSD、ELSD灵敏度低b:TFA酸解:气相色谱(乙酰化物)c:甲醇解:气相色谱(三甲基硅醚)2:高碘酸钠氧化和Smith降解a:每摩尔己糖基的高碘酸消耗量、甲酸释放量。(目的:判断可氧化糖基与不可氧化糖基之比例)b:Smith降解完全水解,气相分析,如有葡萄糖(表示有1-3键糖基)、甘油(有1-6或1-2糖基)、甲酸(有1-6糖基)Smith降解部分水解,说明主干糖苷键类型。3:甲基化分析(Hakrmor法)-支链分布多糖—甲基化—水解—还原得甲基化单糖醇—乙酰化得糖醇衍生物—GC-MS检测。 对照品 2,3,4,6-四甲基葡萄糖 糖苷键类型 1—2,4,6- 三甲基葡萄糖 1—32,3,4-三甲基葡萄糖 1—62,4-二甲基葡萄糖 1—3,6 4:IR图谱解析a:吡喃环式或呋喃环式α、β异头异构体5:1HNMR及13CNMR解析(构型)6:纯度检查:a: 紫外吸收光谱(280、260)b:电泳(琼脂糖电泳、聚丙烯酰胺凝胶、醋酸纤维素薄膜)c:薄层色谱(多糖不水解)7:X射线衍射,立体构型。好多啊!想和大家讨论讨论多糖的HPLC分析,我们试验室用的液相是C18柱,紫外检测器,做多糖含量及纯度检测,这样的装备够不够用呀?是不是做前必须衍生化或有其它方法,如用示差折射仪作检测器,是不是不需衍生化?多糖的HPLC分析,用得较多用HPGPC测分子量及分子量分布。一般纯多糖紫外吸收较弱,多用RID或ELSD。至于含量测定多用硫酸蒽酮比色或苯酚硫酸法。http://img.dxycdn.com/images_new/smiles/smile_angry.gif
刚接触GPC,公司也没有什么资料,只是保留了以前多糖分子量的谱图,以前测得多糖分子量几万,现在通过标曲再定量分子量只有几千,测灵芝多糖用什么色谱条件比较好啊,以前的要调PH,现在我查文献磷酸盐调PH检测也达不到之前的分子量,双蒸水走出峰是早了,但是分不开。色谱柱型号是Ultrahydrogel 120,Ultrahydrogel 250,Ultrahydrogel 500,三根色谱柱串联,流速是0.8ml/min.温度35度,2414示差检测器,求大神指导迷津。
[align=left] [/align][align=left] 微波浸提提取猴头菇粗多糖的研究[/align][align=left]微波法是通过微波辐射的热效应及产生的电磁波效应,使细胞内的温度升高压力增大,细胞壁破裂,使细胞内部的有效成分从细胞中释放出来的一种方法。微波提取操作简单高效,溶剂消耗少、节能安全、有效成分得率高、不产生噪音等特点,适合于热不稳定成分的提取,应用前景广阔。提取时应注意控制微波火力,避免液体溅出。赖谱富等人采用微波法提取大杯蕈菇柄多糖,得出优化工艺条件为:料液比1:25、微波时间8min、微波功率540w,该条件下大杯蕈菇柄多糖提取率和纯度相比传统热水浸提分别提高了57.7%和30.8%。[/align][align=left]1 料液比对猴头菇多糖提取效果的影响[/align][align=left]猴头菇子实体粉碎成过20目筛,按重量的20倍、30倍、40倍加入蒸馏水,分别在微波功率为140W的条件下提取10分钟,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后,取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]2 浸提时间对猴头菇多糖提取效果的影响[/align][align=left]称取等量的子实体粉末(2.00克),按重量的40倍加入蒸馏水,于微波功率为140W的条件下分别提取10、15、20分钟,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]3 浸提次数对猴头菇多糖提取效果的影响[/align][align=left]称取同等量的子实体粉末(2.00克)三份,按重量的20倍加入蒸馏水,于微波功率为140W的条件下提取10分钟,并分别提取1、2、3次,用3号玻璃坩埚过滤并洗涤残渣得清液,合并清液并定容至250mL,清液用超纯水再稀释10倍后,取1mL滤液测定多糖浓度,每个处理3个重复。[/align][align=left]4 正交试验[/align][align=left] 为进一步探讨浸提参数中的料液比、时间和浸提次数对子实体多糖的影响,进行3因素3水平的正交试验。[/align][align=left][/align][align=left][/align]单因素试验[align=left][/align]1 浸提时间对猴头菇多糖提取效果的影响[align=left][/align][align=left]以猴头菇粉末为实验材料,在预实验的基础上,确定料液比为1:40(料液比1:20时,微波浸提易使液体变干)、浸提次数为2次的条件下,研究浸提时间对猴头菇粗多糖浸提效果的影响,实验结果如图1。由图1可知,当浸提时间为10min时,猴头菇多糖浸出量较大;随着浸提时间的延长,粗多糖提取液易脱水焦化,故选择浸提时间为10min作为微波浸提的最佳条件。[/align][align=left][/align][align=left][/align] [table][tr][td=1,1,56] [/td][/tr][tr][td] [/td][td][img=,478,298]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709449783_6130_2903169_3.png[/img][/td][/tr][/table][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left] 图1 微波浸提时间对猴头菇粗多糖浸提的影响[/align][align=left][/align] Fig1 Theeffect of wave time on the extraction yield of [i]Hericium erinaceus[/i] polysaccharide[align=left][/align][align=left]2、料液比对猴头菇多糖提取效果的影响[/align][align=left][/align][align=left] 以猴头菇粉末为实验材料,微波功率为140W,在浸提次数为2次、微波提取时间为10 min的条件下,研究料液比对猴头菇粗多糖浸提效果的影响,实验结果如图2。由图2可知,当料液比为1:40时,猴头菇多糖浸出量较大;随着料液比加大,粗多糖提取率提高不显著,为了节约成本及提高效率,故选择料液比为1:40作为微波浸提的最佳条件。[/align][align=left][/align][img=,512,309]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709451218_402_2903169_3.png[/img] [align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align]图2料液比对猴头菇粗多糖浸提的影响[align=left]Fig2 The effect of solid-liquid ratio onthe extraction yield of [i]H. erinaceus [/i]polysaccharide[/align][align=left] [/align][align=left]3 、浸提次数对猴头菇多糖提取效果的影响[/align][align=left][/align][align=left] 以剪碎后的猴头菇子实体为实验材料,微波功率为140W,料液比为1:40、微波提取时间为10 min的条件下,研究浸提次数对猴头菇粗多糖浸提效果的影响,实验结果如图3。由图3可知, 随着浸提次数的增大,猴头菇多糖的提取率并没有增大,因此为了节约成本及提高提取效率,故采用浸提次数为2次作为微波浸提的最佳条件。[/align][align=left][img=,472,273]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709455498_206_2903169_3.png[/img] [/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left] [/align]图3 浸提次数对猴头菇粗多糖浸提的影响[align=left][/align] Fig3 Theeffect of extracting times on the extraction yield of [i]H. erinaceus[/i] polysaccharide[align=left][/align][align=left] 4、 单因素最佳条件下微波提取法的多糖提取率[/align][align=left] [/align] 表1 微波提取最优条件下多糖提取率[align=left][/align] Table1 Theextraction rate of polysaccharide under the optimum condition by wave[align=left][/align][align=center] [table=537][tr][td=1,1,124] 实验次数[/td][td=2,1,101] [align=center]多糖提取率(%)[/align] [/td][td=2,1,173] [align=center]平均提取率[/align] [align=center](%)[/align] [/td][td=2,1,132] [align=center] RSD(%)[/align] [/td][td=1,1,7] [/td][/tr][tr][td=2,1,131] [align=center]1[/align] [/td][td=2,1,101] [align=center][color=black]5.51[/color][/align] [/td][td=2,3,173] [align=center]5.51[/align] [/td][td=2,3,132] [align=center]1.3[/align] [/td][/tr][tr][td=2,1,131] [align=center]2[/align] [/td][td=2,1,101] [align=center][color=black]5.44[/color][/align] [/td][/tr][tr][td=2,1,131] [align=center]3[/align] [/td][td=2,1,101] [align=center][color=black]5.58[/color][/align] [/td][/tr][tr][td=1,1,124] [/td][td=1,1,7] [/td][td=1,1,93] [/td][td=1,1,7] [/td][td=1,1,166] [/td][td=1,1,7] [/td][td=1,1,125] [/td][td=1,1,7] [/td][/tr][/table][/align][align=left][/align][align=left][color=red] [/color]在最佳微波提取条件下:浸提时间:10分钟、料液比为1:40、浸提次数:2次的条件下,进行三次平行实验,得到平均粗多糖提取率为5.51%,RSD符合要求。[/align][align=left]2、 正交试验优化猴头菇粗多糖的提取条件[/align][align=left][/align][align=left] 为进一步探讨微波浸提工艺参数中的浸提时间(A)、料液比(B)、浸提次数(C)对猴头菇多糖得率的影响,分别选取浸提时间(A)、料液比(B)、浸提次数(C)的三个因子不同水平作为试验水平(见表2-10),以猴头菇粗多糖提取率为评价指标,选用L9(3[sup]3[/sup])正交表安排试验。试验结果如表2-11所示。[/align][align=left][/align]表2 正交试验因素水平表[align=left][/align]Table2 Factorsand levels of orthogonal experiment[align=left][/align][align=center] [table=532][tr][td=1,1,180] 因子[/td][td=1,1,101] [align=center]水平1[/align] [/td][td=1,1,119] [align=center]水平2[/align] [/td][td=1,1,132] [align=center]水平3[/align] [/td][/tr][tr][td=1,1,180] [align=center]浸提时间A[/align] [/td][td=1,1,101] [align=center]10min[/align] [/td][td=1,1,119] [align=center]15 min[/align] [/td][td=1,1,132] [align=center]20 min[/align] [/td][/tr][tr][td=1,1,180] [align=center]料液比B[/align] [/td][td=1,1,101] [align=center]1:20[/align] [/td][td=1,1,119] [align=center]1:30[/align] [/td][td=1,1,132] [align=center]1:40[/align] [/td][/tr][tr][td=1,1,180] [align=center]浸提次数C[/align] [/td][td=1,1,101] [align=center]1[/align] [/td][td=1,1,119] [align=center]2[/align] [/td][td=1,1,132] [align=center]3[/align] [/td][/tr][/table][/align][align=left][/align]表3 正交试验结果及分析[align=left][/align]Table3 Resultsof the orthogonal experiment[align=left][/align][align=center] [table=640][tr][td=2,2,88] 实验号[/td][td=4,1,414] 因素[/td][td=1,1,138] 实验指标[/td][/tr][tr][td=1,1,91] A(浸提时间)[/td][td=1,1,119] B(料液比)[/td][td=1,1,120] C(浸提次数)[/td][td=1,1,84] 误差[/td][td=1,1,138] [align=center][color=black]提取率[/color][color=black]%[/color][/align] [/td][/tr][tr][td=2,1,88] [align=center]1[/align] [/td][td=1,1,91] [align=center]1(10)[/align] [/td][td=1,1,119] [align=center]1(1:20)[/align] [/td][td=1,1,120] [align=center]1(1)[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center]42.0[/align] [/td][/tr][tr][td=2,1,88] [align=center]2[/align] [/td][td=1,1,91] [align=center]1(10)[/align] [/td][td=1,1,119] [align=center]2(1:30)[/align] [/td][td=1,1,120] [align=center]2(2)[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center]48.4[/align] [/td][/tr][tr][td=2,1,88] [align=center]3[/align] [/td][td=1,1,91] [align=center]1(10)[/align] [/td][td=1,1,119] [align=center]3(1:40)[/align] [/td][td=1,1,120] [align=center]3(3)[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center]47.2[/align] [/td][/tr][tr][td=2,1,88] [align=center]4[/align] [/td][td=1,1,91] [align=center]2(15)[/align] [/td][td=1,1,119] [align=center]1(1:20)[/align] [/td][td=1,1,120] [align=center]2(2)[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center]32.5[/align] [/td][/tr][tr][td=2,1,88] [align=center]5[/align] [/td][td=1,1,91] [align=center]2(15)[/align] [/td][td=1,1,119] [align=center]2(1:30)[/align] [/td][td=1,1,120] [align=center]3(3)[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center]31.4[/align] [/td][/tr][tr][td=2,1,88] [align=center]6[/align] [/td][td=1,1,91] [align=center]2(15)[/align] [/td][td=1,1,119] [align=center]3(1:40)[/align] [/td][td=1,1,120] [align=center]1(1)[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center]31.8[/align] [/td][/tr][tr][td=2,1,88] [align=center]7[/align] [/td][td=1,1,91] [align=center]3(20)[/align] [/td][td=1,1,119] [align=center]1(1:20)[/align] [/td][td=1,1,120] [align=center]3(3)[/align] [/td][td=1,1,84] [align=center]2[/align] [/td][td=1,1,138] [align=center]36.9[/align] [/td][/tr][tr][td=2,1,88] [align=center]8[/align] [/td][td=1,1,91] [align=center]3(20)[/align] [/td][td=1,1,119] [align=center]2(1:30)[/align] [/td][td=1,1,120] [align=center]1(1)[/align] [/td][td=1,1,84] [align=center]3[/align] [/td][td=1,1,138] [align=center]34.0[/align] [/td][/tr][tr][td=2,1,88] [align=center]9[/align] [/td][td=1,1,91] [align=center]3(20)[/align] [/td][td=1,1,119] [align=center]3(1:40)[/align] [/td][td=1,1,120] [align=center]2(2)[/align] [/td][td=1,1,84] [align=center]1[/align] [/td][td=1,1,138] [align=center]39.1[/align] [/td][/tr][tr][td=1,9,36] 总 糖[/td][td=1,1,51] K[sub]11[/sub][/td][td=1,1,91] [align=center]137.6[/align] [/td][td=1,1,119] [align=center]111.4[/align] [/td][td=1,1,120] [align=center]107.8[/align] [/td][td=1,1,84] [align=center]112.5[/align] [/td][td=1,9,138] [/td][/tr][tr][td=1,1,51] K[sub]12[/sub][/td][td=1,1,91] [align=center]95.7[/align] [/td][td=1,1,119] [align=center]113.8[/align] [/td][td=1,1,120] [align=center]120[/align] [/td][td=1,1,84] [align=center]117.1[/align] [/td][/tr][tr][td=1,1,51] K[sub]13[/sub][/td][td=1,1,91] [align=center]110[/align] [/td][td=1,1,119] [align=center]118.1[/align] [/td][td=1,1,120] [align=center]115.5[/align] [/td][td=1,1,84] [align=center]113.7[/align] [/td][/tr][tr][td=1,1,51] R[/td][td=1,1,91] [align=center]14.0[/align] [/td][td=1,1,119] [align=center]2.2[/align] [/td][td=1,1,120] [align=center]4.1[/align] [/td][td=1,1,84] [align=center]1.5[/align] [/td][/tr][tr][td=1,1,51] K[sub]21[/sub][sup]2[/sup][/td][td=1,1,91] [align=center]18933.76[/align] [/td][td=1,1,119] [align=center]12409.96[/align] [/td][td=1,1,120] [align=center]11620.84[/align] [/td][td=1,1,84] [align=center]12656.25[/align] [/td][/tr][tr][td=1,1,51] K[sub]22[/sub][sup]2[/sup][/td][td=1,1,91] [align=center]9158.49[/align] [/td][td=1,1,119] [align=center]12950.44[/align] [/td][td=1,1,120] [align=center]14400[/align] [/td][td=1,1,84] [align=center]13712.41[/align] [/td][/tr][tr][td=1,1,51] K[sub]23[/sub][sup]2[/sup][/td][td=1,1,91] [align=center]12100[/align] [/td][td=1,1,119] [align=center]13947.61[/align] [/td][td=1,1,120] [align=center]13340.25[/align] [/td][td=1,1,84] [align=center]12927.69[/align] [/td][/tr][tr][td=1,1,51] [align=center]Q[/align] [/td][td=1,1,91] [align=center]13397.41667[/align] [/td][td=1,1,119] [align=center]13102.67[/align] [/td][td=1,1,120] [align=center]13120.36333[/align] [/td][td=1,1,84] [align=center]13098.78[/align] [/td][/tr][tr][td=1,1,51] [align=center]S[/align] [/td][td=1,1,91] [align=center]302.4[/align] [/td][td=1,1,119] [align=center]7.7[/align] [/td][td=1,1,120] [align=center]25.4[/align] [/td][td=1,1,84] [align=center]3.8[/align] [/td][/tr][/table][/align][align=left][/align] 表4 正交试验方差分析表[align=left][/align]Table4 Analysisof variance table of orthogonal experiment[align=left][/align][align=center] [table=651][tr][td=1,1,133] 变异来源[/td][td=1,1,74] [align=center]平方和[/align] [/td][td=1,1,88] [align=center]自由度[/align] [/td][td=1,1,97] [align=center]均方[/align] [/td][td=1,1,88] [align=center]F值[/align] [/td][td=1,1,172] [align=center]显著水平[/align] [/td][/tr][tr][td=1,1,133] [align=center]浸提时间A[/align] [/td][td=1,1,74] [align=center]302.4[/align] [/td][td=1,1,88] [align=center]2[/align] [/td][td=1,1,97] [align=center]151.2[/align] [/td][td=1,1,88] [align=center]79.68[/align] [/td][td=1,4,172] [align=center] [/align] [align=center]F[sub]0.05[/sub](2,2)=19.0[/align] [/td][/tr][tr][td=1,1,133] [align=center]料液比B[/align] [/td][td=1,1,74] [align=center]7.7[/align] [/td][td=1,1,88] [align=center]2[/align] [/td][td=1,1,97] [align=center]3.8[/align] [/td][td=1,1,88] [align=center]2.02[/align] [/td][/tr][tr][td=1,1,133] [align=center]浸提次数C[/align] [/td][td=1,1,74] [align=center]25.4[/align] [/td][td=1,1,88] [align=center]2[/align] [/td][td=1,1,97] [align=center]12.7[/align] [/td][td=1,1,88] [align=center]6.69[/align] [/td][/tr][tr][td=1,1,133] [align=center]误差[/align] [/td][td=1,1,74] [align=center]3.8[/align] [/td][td=1,1,88] [align=center]2[/align] [/td][td=1,1,97] [align=center]1.9[/align] [/td][td=1,1,88] [align=center] [/align] [/td][/tr][tr][td=1,1,133] [align=center]总和[/align] [/td][td=1,1,74] [align=center]339.3[/align] [/td][td=1,1,88] [align=center]8[/align] [/td][td=1,1,97] [align=center] [/align] [/td][td=1,1,88] [align=center] [/align] [/td][td=1,1,172] [/td][/tr][/table][/align][align=left][/align][align=left] 从微波浸提试验的方差分析表4 可知,A因素浸提时间对猴头菇粗多糖的提取有显著影响。料液比及浸提次数为对猴头菇多糖提取的影响不显著,本着节约成本及节省时间的原则,对猴头菇子实体粗多糖微波浸提的最佳工艺条件为:A1B1C2,即在微波功率140W,浸提时间为10min、料液比为1:40、浸提次数为2时,粗多糖浸出量最高,提取率可达5.51%左右。[/align][align=left][/align][align=left][/align]