推荐厂家
暂无
暂无




 400-860-5168转3128
400-860-5168转3128
 留言咨询
留言咨询

 400-860-5168转4551
400-860-5168转4551
 留言咨询
留言咨询

 留言咨询
留言咨询



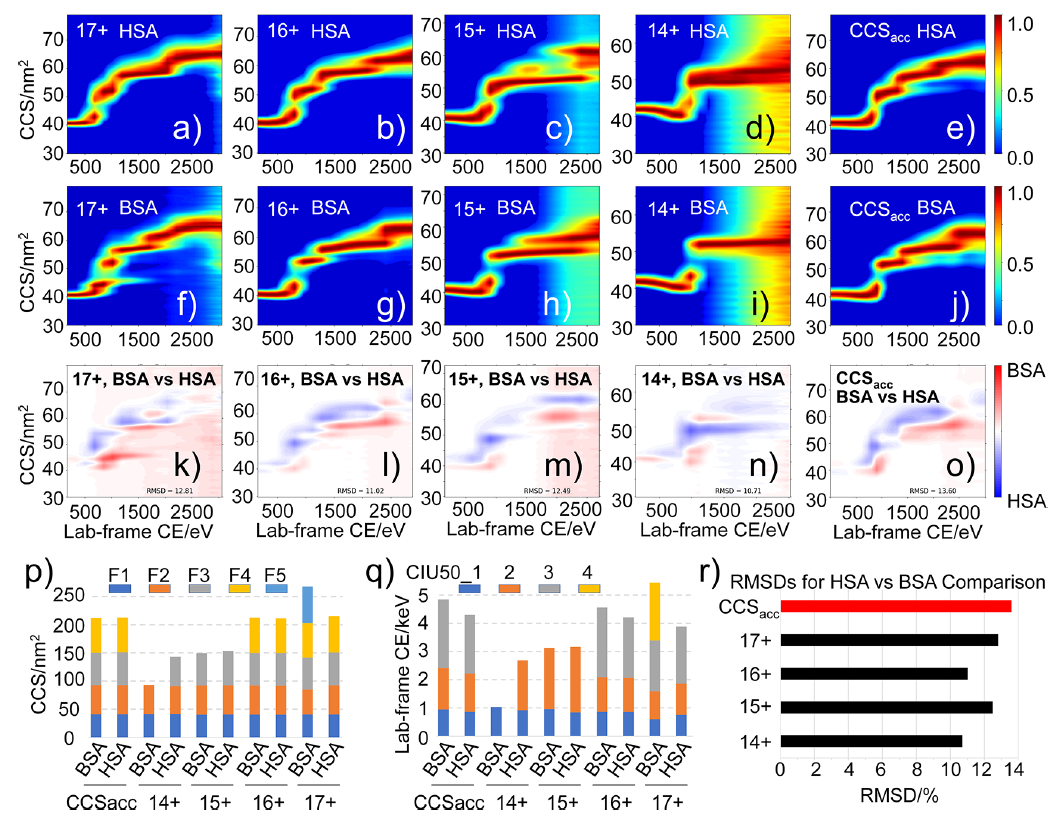
[b]使用声力研究蛋白去折叠[/b]单分子力谱(SMFS)技术是研究蛋白结构与蛋白去折叠中的生物力学性质的有力工具。SMFS能够为研究和药物开发提供有价值的信息。SMFS有助于揭示人类疾病病理的分子机制,而机制往往被认为与错误折叠的蛋白的形成和积聚有关,如阿茲海默症和帕金森氏症。然而现有的SMFS仪器缺少同时并行研究多个蛋白去折叠的功能,使得研究过程耗时很长。使用声波来对数以百计的生物分子施力并操控是非常理想的高通量研究方法。此案例中,声力谱学(AFS)是最新的用于研究蛋白去折叠的单分子操控方法。[img=,500,145]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021031435408_23_981_3.png!w690x201.jpg[/img]1 AFS检测蛋白去折叠的图解。蛋白一端栓住玻璃表面,另一端拴住聚苯乙烯微球。[img=,400,238]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021032257008_8827_981_3.png!w421x251.jpg[/img]2 对视野范围内被蛋白分子拴在玻璃表面的4.5 μm聚苯乙烯微球同时成像。物镜放大倍数为20x。AFS设备使用压电元件共振激发平面声阱穿过微流控芯片。共振波对与周围介质密度不同的微球施力,每个生物分子被单独地由微球拉伸(图1)。仪器可以实时并行操控视野范围内数以百计的微球,获得大量的数据以研究每个生物分子的随机与异质行为(图2)。在Yan Jie(NUS)的实验室的这项试点研究中,我们首次展示了AFS如何对蛋白施力并操控。实验对踝蛋白施力引发(去)折叠同时以高精确度记录蛋白的拉伸。踝蛋白属于机械敏感性大分子,在调控蛋白粘附于胞外基质中起作用。踝蛋白是细胞代谢过程和信号通路中的关键,并能够在力的作用下改变构象,在单分子生物物理学中备受关注。[img=,500,156]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021033524578_3892_981_3.png!w679x212.jpg[/img]3 使用AFS得到的单个踝蛋白分子的去折叠曲线,力变化速率为1 pN/s。轨迹在500 Hz下获得(彩色点),并平衡至50 Hz(黑色线)。3a 单个踝蛋白多次拉伸的力-距离曲线。3b 单个拉伸循环的力-距离曲线。3c 图3b中分子的时间-距离曲线。在这项研究中,连接了DNA的踝蛋白拴在聚苯乙烯微球和玻璃表面。启动声波后形成平面声阱,连接了踝蛋白的微球受到朝向声阱的力。实验中通过调节声波的振幅来改变力的大小。逐渐增加力的大小使得蛋白的结构域按顺序去折叠。实验循环进行拉伸与收缩的过程(力变化速率为1 pN/s)并同时以nm级的分辨率检测每个蛋白的拉伸长度(图3)。通过力-距离曲线(图3a)可以观察到单个踝蛋白的去折叠循环。将单个蛋白的去折叠轨迹叠加即可检测到单个结构域去折叠的发生,研究人员可以得到蛋白结构和蛋白去折叠自由能图谱信息。AFS仪器产生的超声并不会损害生物分子的结构完整性,因此蛋白可以连续去折叠和再折叠长达数小时,并能够得到单个蛋白多次去折叠和再折叠的曲线。相比于其他SMFS方法经过多次拉伸和收缩之后对蛋白造成光学损伤或力学损伤使得实验被迫终止,AFS能够获得更多的信息。图3b: 单个力-距离曲线中截取一小段,表示一个拉伸过程。将力从15 pN增加至19 pN,可以观察到4个去折叠过程,与蛋白的4个结构域相符合,拉伸长度为30 nm至100 nm。AFS的高分辨率检测功能可以很清晰地区分去折叠过程。AFS在x,y方向精度为2 nm,在z方向精度为4 nm(频率为25 Hz),可以大幅提高(去)折叠研究的精密程度。图3c: 图3b中分子的18秒范围内的时间-距离曲线。AFS可以检测短至毫秒级至长达10小时以上的事件,用于研究蛋白的热力学和动力学。通过检测踝蛋白的去折叠步骤并记录连续的高分辨率的去折叠轨迹,可以得出AFS如何用于研究蛋白去折叠。研究蛋白(去)折叠的详细机制能够在生物物理和生物医药领域产生突破性发现。今后的蛋白折叠以及蛋白相互作用的研究中,AFS的多分子并行操控功能将发挥重要作用,用户可以同时并行检测大量的蛋白分子。用户可以获得大量的实验数据,在不影响分辨率的同时对蛋白的机械性质数据作出分析。
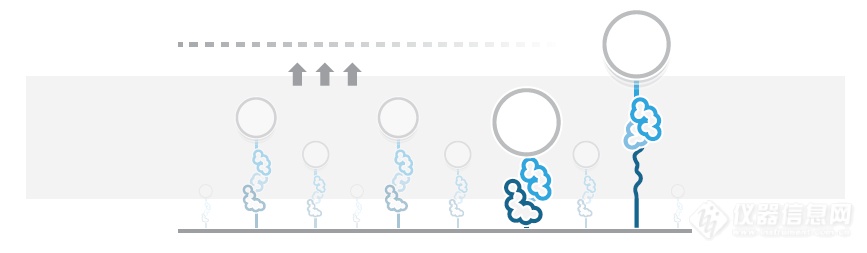
[b]研究多结构域蛋白阶段性去折叠[/b]很多生物大分子的功能与其构象和构象动力学密切相关,如蛋白质的生物功能需要其正确折叠成自然形态。错误折叠或者未折叠的蛋白会(部分)失活或者产生毒性,如错误折叠的蛋白与神经退行性疾病有关。研究蛋白如何正确折叠并改变构象以实现生物功能对理解其机制与疾病发生至关重要。单分子力谱(SMFS)是研究这些分子现象的理想工具,因为其具有独特的分离个体生物分子和实时观察构象变化及去折叠过程的功能。由于SMFS具有高敏感度和施加机械力的能力,可以直接操纵单个蛋白并通过测量其长度变化(亚nm级)观察构象改变。接下来我们使用LUMICKS开发的高分辨率光镊-荧光显微镜C-Trap演示了对钙调蛋白(CaM)的折叠过程的研究。[img=,500,110]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021105519876_1986_981_3.png!w690x153.jpg[/img][img=,218,200]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021106425366_604_981_3.png!w217x199.jpg[/img]1 多结构域蛋白的去折叠实验图解。具有3个结构域的蛋白通过DNA连接至两个被光所捕获的微球。2 通过改变光阱之间的距离可以对蛋白施力并检测断裂的发生。使用层流微流控和自动装载功能,N-端和C-端连接有DNA的单个CaM蛋白可被两个微球捕获(图1)。[img=,227,200]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021108116955_1942_981_3.png!w220x193.jpg[/img]3 10 mM Ca2+浓度下CaM的力-拉伸距离(蓝色)和力-收缩距离(红色)。拉伸与收缩的速度为100 nm/s。微球直径为1.0 μm,光阱的刚度为0.284 pN/nm。[img=,500,161]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021108223351_3734_981_3.png!w638x206.jpg[/img]4 10 mM Ca2+浓度下CaM的多个状态下的动态平衡。图为50 kHz(灰色)和200 kHz(红色)下记录的数据。在右侧直方图中可以看到两个清晰的峰即表现为蛋白最常处于的两个状态。第一个实验,在10 mM Ca2+条件下对CaM的机械拉伸与收缩行为进行了记录。首先对100 nm/s的速度下的拉伸与收缩的相关数据进行了记录(图3)。随着施加的力增加,可观察到两个去折叠的阶段,表现为力的突然下降,与两个螺旋-环-螺旋结构域的去折叠相符合。由此可以得出结论,基于C-Trap设备的力和距离的高分辨率(100 Hz时误差在0.2 pN以下和0.5nm以下),去折叠的发生可以用力谱的力-距离曲线来确定。这种测量非常适合用于比较正常蛋白与发生了改变或损伤的蛋白的折叠的相关数据。接下来研究光阱位置固定时CaM的折叠、去折叠的动态平衡,对蛋白长度的变化进行测量并确定中间态的转变(图4)。对CaM分子施加7.5 pN的力,可以观察到三种状态之间的波动,反映了螺旋-环-螺旋亚结构域的折叠和去折叠,波动的数据图像与之前的研究1,2相符(图4)。仪器所获得的稳定的高质量数据为蛋白的折叠和去折叠之间的动态转变的检测提供了大量有效的信息。通过这种方法可以对不同状态的驻留时间和转变动力学进行测量。这些信息使得我们对特定蛋白的折叠、去折叠过程产生进一步的了解。对折叠和去折叠的动力学以及构象改变的研究表现了一种突破性的生物学和生物物理学研究方法。使用C-Trap光镊-荧光技术可以观察到折叠和去折叠现象还有动态平衡,使得科研人员可以研究去折叠的中间态并获得蛋白的结构与功能信息。对蛋白折叠和构象的进一步研究仰仗于C-Trap的高敏感度和多通道荧光单分子FRET功能,通过检测FRET效率信号与力的波动的变化来进一步检测蛋白构象,可以得到蛋白的机械性质与结构之间的关系。[b][/b]
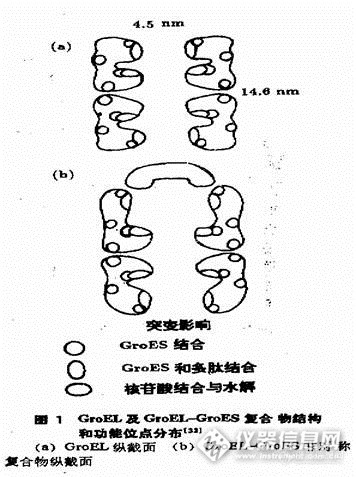
摘要:本文介绍了分子伴侣的基本概念,以及分子伴侣的几种主要类型;简要说明了蛋白质折叠的概念及特点;在此基础上,进一步阐述了分子伴侣的功能,并以GroEL和GroES为例简述了分子伴侣在蛋白质折叠过程中的作用机理。最后介绍了分子伴侣概念的延伸,及其研究意义和展望。关键词:分子伴侣 蛋白质折叠 折叠病 20世纪60年代,人们就发现了由于组成蛋白质的氨基酸错误可以导致分子病,后来人们发现,即使一级结构正常,蛋白质的二级结构乃至立体结构异常也可导致疾病,即蛋白质折叠病,如疯牛病、老年性痴呆、囊性纤维性炎等。蛋白质折叠病的发现激励人们去寻找蛋白质折叠的分子机理,近年来研究中发现,分子伴侣在在蛋白质折叠中起重要作用。1分子伴侣简介1.1分子伴侣的基本概念分子伴侣(Molecular Chaperone),也有人翻译为“分子伴娘”。1978年,Laskey等首先用“分子伴侣”描述核质素(nucleoplasmin)在核小体组装过程中的作用。1987年,Ellis将凡能促进蛋白质折叠和组装的蛋白质统称为分子伴侣。随后,Ellis等又提出了分子伴侣的基本概念:在蛋白质折叠和组装过程中,分子伴侣防止多肽链内或链间因疏水键等相互作用表面瞬间暴露而形成错误结构,并且还可以破坏已经形成的错误结构。分子伴侣本身不是折叠或组装产物的一部分。1.2分子伴侣的几个例子Nucleoplasmins:体内的一系列过程,如DNA复制,RNA转录与剪接,核小体或核糖体的装配,都涉及到带正电的蛋白质与带负电的核酸之间较强的离子键的相互作用。实验发现,这些过程都与Nucleoplasmin相类似的蛋白质的参与。Charperonin(Cpn):是指在细菌、线粒体、质体中发现的一类序列同源的Charperonins,该家族具有独特的双层7-9元环状结构的寡聚蛋白(Hemminngwen;cheng 1998),它们的作用是促进体内正常条件以及应急反应下的蛋白质折叠,这一过程需要ATP提供能量。Cpns包括细菌的GroEL、叶绿体的Rubisco亚基结合蛋白(RuSBP)与线粒体的热休克蛋白Hsp60。Stress-70家族:该家族首先在热休克反应中发现,并研究多年,近些年来,发现Stress-70也在蛋白质的折叠与装配过程中起作用,因而受到广泛关注。参与这些作用的Stress-70的成员有:E. coli的DnaK、酵母细胞质的Ssa1p和Ssa2p、内质网的Kar2p和线粒体的Ssc1p。哺乳动物细胞质的Hsp70蛋白和Prp73多肽识别蛋白、内质网的Bip。这些蛋白可被细胞内未折叠蛋白质的增多而诱导并识别靶分子,在其他热休克蛋白或细胞因子的参与下,水解ATP调节蛋白的构象或折叠状态。Stress-90家族:分子量在90ku左右,包括大肠杆菌胞