推荐厂家
暂无
暂无
[align=center]双歧杆菌高密度培养的补料培养基及补料方法[/align][align=center]季学猛[/align][align=center](南开大学 医学院, 天津 300071)[/align]摘 要:双歧杆菌在维护宿主健康方面具有重要作用,因此对其高密度培养条件的探索具有重要意义。目前,双歧杆菌的高密度培养主要受到培养基组分和培养条件的优化的影响。这里报道了一种用于双歧杆菌高密度培养的补料培养基及补料方法。该方法使用补料与碱泵耦合的方法进行补料,通过控制发酵培养基的pH值来调节补料培养基的补入量。此外,本研究还进行了补料培养基的优化实验,通过调整氢氧化钠和葡萄糖浓度的比例,比较了不同补料培养基的发酵性能。实验结果表明该补料培养基及补料方法适用于两歧双歧杆菌、青春双歧杆菌、动物双歧杆菌、长双歧杆菌等多种双歧杆菌,而且能够达到较高的活菌密度。本研究提出的补料培养基及补料方法可为双歧杆菌的高密度培养提供有效的解决方案。关键词:双歧杆菌;高密度培养;补料培养基;补料方法;碱泵耦合中图分类号:G482[color=gray] [/color]文献标识码:A[align=center]A supplementary culture medium and supplementation method for high-density cultivation of Bifidobacterium[/align]JI Xuemeng(School of Medicine, Nankai University, Tianjin 300071, China)Abstract: Bifidobacterium plays a significant role in maintaining host health, making the exploration of high-density cultivation conditions crucial. Currently, the high-density cultivation of Bifidobacterium is mainly influenced by the optimization of culture medium components and cultivation conditions. Here, we report a supplementary culture medium and supplementation method for high-density cultivation of Bifidobacterium. The method utilizes coupling of supplementation with an alkaline pump to control the supplementation rate of the culture medium by adjusting its pH value. Furthermore, optimization experiments of the supplementation culture medium were conducted by varying the ratio of sodium hydroxide to glucose concentrations, comparing the fermentation performance of different supplementation culture media. Experimental results demonstrate that this supplementation culture medium and supplementation method are applicable to various Bifidobacterium strains such as Bifidobacterium bifidum, Bifidobacterium adolescentis, Bifidobacterium animalis, and Bifidobacterium longum, achieving high viable cell densities. The proposed supplementation culture medium and supplementation method in this study offer an effective solution for high-density cultivation of Bifidobacterium.Key words: Bifidobacterium high-density cultivation supplementary culture medium supplementation method alkaline pump coupling双歧杆菌广泛分布于动物和人类的肠道中,已经发现双歧杆菌在维护宿主健康方面起着极其重要的作用,双歧杆菌作为益生菌的功能特性已经引起了越来越多的关注[sup][back=yellow][1-3][/back][/sup]。双歧杆菌的益生菌制剂有潜力通过选择和加强有益菌群来调节肠道微生物群的组成和微生物平衡,从而更有利于人体健康。双歧杆菌制剂已被报道能改善肥胖相关特征、缓解便秘和增强免疫力[sup][back=yellow][4-6][/back][/sup]。双歧杆菌已经成为国内外正在快速发展的微生态制剂中的主要菌种之一。努力探索双歧杆菌的高密度生长条件,对于提高该菌的生产效率和应用推广具有重要意义。双歧杆菌的高密度培养条件的摸索主要涉及培养基组分和培养条件的优化。目前,MRS培养基是最常用的双歧杆菌等乳酸菌培养基,被广泛地用于双歧杆菌的发酵中[sup][back=yellow][7][/back][/sup]。双歧杆菌的最适生长 pH 值在 6.0-7.0 之间[sup][back=yellow][8][/back][/sup],然而,由于双歧杆菌发酵过程中会产生有机酸等代谢副产物,导致培养过程中培养基的 pH 值不断地降低,限制细菌的生长[sup][back=yellow][9-11][/back][/sup]。为解除酸等代谢副产物对双歧杆菌生长的限制,一些创新型的发酵培养方法已经被提出,比如细胞周期培养、透析培养、细胞固定培养和嵌入法[sup][back=yellow][12-15][/back][/sup]。然而,这些方法在工业应用中受到了各种因素的限制。目前,分批的发酵罐内恒定pH培养方法仍然是主流,在发酵中通过添加碱性溶液来控制培养基的pH值,以减轻酸性生长抑制。在解除酸性生长抑制后,双歧杆菌的生长还受到渗透压和底物不足的限制[sup][back=yellow][16][/back][/sup]。许多营养物在高浓度下导致的高渗透压对细胞有抑制作用,而为了达到高细胞密度,又必须供给大量的营养物质。因此,为了双歧杆菌培养中有效地利用底物,必须优化培养过程以解决底物浓度和渗透压之间的矛盾。将浓缩营养物以与其消耗速率成比例地加入反应器中是一种有效的解决底物浓度和渗透压之间的矛盾的方法,为此产生了多种形式的补料喂养模型:间歇喂养,恒定喂养和指数喂养[sup][back=yellow][17-19][/back][/sup]。在间歇补料喂养中,通过周期性检查并补充生长基质中的葡萄糖含量达到稳定葡萄糖浓度的目的,然而,这种补料模型决定了必然需要大量人力。而且在对数生长阶段,细菌细胞快速消耗葡萄糖,因此在任何两个测量间隔期间可能发生底物缺乏,可能会导致补料不及时,进而影响细菌的生长。在恒定补料喂养中,饲料介质以恒定的流速持续添加到发酵培养基中。这种方法优点是减少了人力需求。但是,益生菌对葡萄糖的消耗速率不是恒定的,这就导致了低喂养速率可能导致细菌生长的底物不足,而高喂养速率会引起过量底物积累,也会抑制细菌生长。对于指数喂养模型,在益生菌前期生长阶段,指数喂养能够很好的耦合细菌对数生长。然而,在细菌对数生长后期,细菌生长速率趋缓,而流加速率继续指数增加会导致底物浓度迅速增加,进而对细菌菌株的生长能力造成不良影响。因此,指数喂养模型也不是合理的方法。综上所述,在益生菌菌株生长期间,这些方法均不能准确控制生长介质中的葡萄糖含量。目前,针对双歧杆菌等厌氧菌发酵过程中产酸,而且产酸与消耗的碳源成正比的特性[sup][back=yellow][20][/back][/sup],通过将补料与碱泵偶联,可实现了补碱的同时补加碳源。然而,补料与碱泵偶联对于发酵罐技术要求高,该技术仍没有在实验室和工厂中得到广泛推广。1? 补料系统的设计为克服现有技术中的缺陷,这里提出了一种用于双歧杆菌高密度培养的补料培养基及补料方法,技术方案如下:一种用于双歧杆菌高密度培养的补料培养基,该补料培养基包括质量比为1:10的氢氧化钠与葡萄糖。其中氢氧化钠浓度小于等于50 g/L,葡萄糖浓度小于等于500g/L。可减少补料培养基中氢氧化钠、葡萄糖和溶氧氧化还原反应产生的副产物浓度。为了减少补料培养基中氢氧化钠、葡萄糖和溶氧的氧化还原反应,配制补料培养基的水应尽可能减少溶氧。可通过高温灭菌、煮沸、通氮气或通二氧化碳的方法减少溶氧。氢氧化钠和葡萄糖溶液应分别进行灭菌后进行混合。使用所述的补料培养基的补料方法,需将补料培养基通过碱泵与发酵培养基连接,根据所述的发酵培养基的pH值控制所述的补料培养基的补入量即成。碱泵的流速为5-10mL/min;碱泵的每次开启时间小于等于30s;发酵培养基的pH值的检测周期为20s。补料培养基补入后发酵培养基的pH值与补入前发酵培养基的pH值之差小于等于0.1。用于双歧杆菌高密度培养的发酵的方法包括如下步骤:(1)将双歧杆菌种子液接种至发酵培养基中进行发酵;(2)将补料培养基通过碱泵与发酵培养基连接,根据所述的发酵培养基的pH值控制所述的补料培养基的补入量;(3)在发酵过程中,间隔1小时对发酵培养基取样,检测580nm-620nm下的吸光度值,并检测葡萄糖浓度与活菌数目,当吸光度值大于0.5且相邻2次取样的吸光度值相等或降低即为发酵结束。2? 补料培养基的优化制备如下5种补料培养基,其中氢氧化钠浓度(g/L)和葡萄糖浓度(g/L)比值分别为1:2、1:5、1:10、1:20、1:40,以比较发酵性能。发酵培养基组成如下:1000mL蒸馏水、14.3g大豆蛋白胨、16.7g酵母粉,10g葡萄糖,0.5g可溶性淀粉,1g氯化钠,1g磷酸氢二钾,1g磷酸二氢钾,0.01g FeSO4?7H2O,0.005g MnSO4,0.2gMgSO4,0.5g L-半胱氨酸,使用50g/L的氢氧化钠溶液调节pH至6.8;其中L-半胱氨酸配制为50g/L浓度,膜过滤除菌,在发酵培养基灭菌结束后再按照1/100(v/v)加入L-半胱氨酸。发酵罐通气孔中接入氮气,使得溶氧降至1mg/L以下;设置发酵参数:发酵温度设为37.0℃范围内,搅拌转速200r/min,培养基温度达到37.0℃后,在火焰圈的无菌环境下按照5%(v/v)的接种量加入种子液,同时,加入3滴消泡剂;开启发酵罐搅拌器,设置种子液加入后的培养基的当前pH值6.6为发酵设定pH值。补料设置参数:将补料培养基中碱泵利用软管连接,设置碱泵最大流速为10mL/min,设置碱液根据pH自动控制加入,设置碱泵启动参数为pH值小于6.55,设置每隔10秒测定一次pH值,设置每次碱泵开启时间15秒;发酵中,每隔3小时测OD,每隔5小时取样监测培养液葡萄糖浓度,检测到15小时。如[back=yellow]图1[/back]所示,发现在发酵前5小时,各补料培养基都可以维持葡萄糖浓度处于适宜双歧杆菌快速生长的浓度(灰色范围),而从发酵10小时开始,氢氧化钠浓度(g/L)和葡萄糖浓度(g/L)比值为1:2的补料出现了葡萄糖浓度的下降,说明该碱碳比例在发酵后期不足以满足双歧杆菌开始生长对碳源的需求。同样的,从发酵10小时开始,氢氧化钠浓度(g/L)和葡萄糖浓度(g/L)比值为1:40的补料出现了葡萄糖浓度的过高,说明该碱碳比例在发酵后期不足可能产生高渗透压,不适合双歧杆菌的生长。而氢氧化钠浓度(g/L)和葡萄糖浓度(g/L)比值1:5至1:20补料可以维持发酵过程中葡萄糖浓度的稳定。综合下来,我们发现了补料培养基中氢氧化钠浓度(C碱,g/L)和葡萄糖浓度(C料,g/L)的合适比值为1:5至1:20。[align=center][back=yellow]图1[/back] 不同配比的补料培养对发酵体系葡萄糖浓度的影响的柱状图[/align]3? 补料系统的应用实践3.1? 两歧双歧杆菌高密度培养如[back=yellow]图2[/back]所示,使用本方法,发酵体系中pH值始终保持在6.6±0.1,葡萄糖浓度始终维持在9-13g/L,发酵结束时,发酵液总体积达到4.9L,吸光度达到OD620 12.8,活菌密度最高达到 8.5±0.2 ×10[sup]9[/sup] cfu/mL。[back=yellow]图2[/back] 两歧双歧杆菌的高密度培养的曲线图3.2? 长双歧杆菌高密度培养如[back=yellow]图3[/back]所示,使用本方法,发酵体系中pH值始终保持在6.9±0.1,葡萄糖浓度始终维持在8.5-13g/L,发酵结束时,发酵液总体积达到4.4L,吸光度达到OD[sub]620[/sub] 9.2,活菌密度最高达到 6.4±0.2 ×10[sup]9[/sup] cfu/mL。[back=yellow]图3[/back] 长双歧杆菌的高密度培养的曲线图3.3? 青春双歧杆菌高密度培养如[back=yellow]图4[/back]所示,使用本方法,发酵体系中pH值始终保持在6.7±0.1,葡萄糖浓度始终维持在7-11g/L,发酵结束时,发酵液总体积达到4.6L,吸光度达到OD[sub]620[/sub] 15.3,活菌密度最高达到 1.2±0.1 ×10[sup]10[/sup] cfu/mL。[back=yellow]图4[/back] 青春双歧杆菌的高密度培养的曲线图3.4? 动物双歧杆菌的高密度培养如[back=yellow]图5[/back]所示,使用本方法,发酵体系中pH值始终保持在6.5±0.1,葡萄糖浓度始终维持在7-12g/L,发酵结束时,发酵液总体积达到4.2L,吸光度达到OD[sub]620[/sub] 20.5,活菌密度最高达到 1.7±0.1 ×10[sup]10[/sup] cfu/mL。[back=yellow]图5[/back] 动物双歧杆菌的高密度培养的曲线图4? 结语该研究提供了一种用于双歧杆菌高密度培养的补料培养基及补料方法,补料方法包括如下步骤:将补料培养基通过碱泵与发酵培养基连接,根据发酵培养基的pH值控制补料培养基的补入量即成。通过优化补料培养基及补料方法,无需发酵罐补料偶联技术便实现了根据pH值变化,利用碱泵自动补充碳源和碱液,实现了保持pH值和碳源浓度的稳定;该补料方法对发酵罐的设备技术要求低,操作简单,降低了发酵成本。参考文献(References):[1]杨硕,唐宗馨,段勃帆,陈禹含,郭欢新,孟祥晨.双歧杆菌及其制剂对炎症性肠病作用机制研究进展[J].食品科学,2023,44(05):275-281.[2]马岩,王中江,杨靖瑜,李哲,彭霞,单秀峰,李柏良,马微微.动物双歧杆菌乳亚种XLTG11对克林霉素诱导的抗生素相关性腹泻的改善作用[J].食品科学,2023,44(03):170-178.[3]李虔全,罗京,周江,刘亭,陈于彪,彭霞,杨建,胡闵山.孟鲁司特钠联合双歧杆菌四联活菌治疗儿童过敏性紫癜有效性Meta分析[J].海峡药学,2023,35(01):127-133.[4]石英,拉巴普尺,张丹瑛,翁书强,刘心怡,汪皓琪.双歧杆菌对高脂饮食诱导的C57BL/6小鼠非酒精性脂肪肝的影响[J].中国临床医学,2022,29(03):473-480.[5]陆敏,袁琳,胡娜,钟霄毓,姜逸,林敏,陆雄.双歧杆菌三联活菌对肥胖小鼠慢性低度炎症的影响[J].卫生研究,2022,51(05):797-802.DOI:10.19813/j.cnki.weishengyanjiu.2022.05.020.[6]李亦汉,王琳琳,赵建新,张灏,王刚,陈卫.两歧双歧杆菌CCFM1167通过提升肠道中乙酸水平以抑制炎症从而缓解便秘[J].食品与发酵工业,2023,49(06):35-41.DOI:10.13995/j.cnki.11-1802/ts.031238.[7]Umar Farooq. 小米膳食纤维作为主要碳源对益生菌生长和发酵过程中短链脂肪酸产量的影响研究[D].江南大学,2013.[8]杨玲,张栋,齐世华,马新颖,周帅康,艾连中,王世杰.两歧双歧杆菌TMC3115冻干菌粉生产工艺优化[J].乳业科学与技术,2021,44(05):12-17.DOI:10.15922/j.cnki.jdst.2021.05.003.[9]熊三玉. 两歧双歧杆菌驯化及培养条件优化的研究[D].中国海洋大学,2007.[10]冯诗诗. 长双歧杆菌F16的益生特性及其在酸浆豆腐制备中的应用[D].河南工业大学,2022.DOI:10.27791/d.cnki.ghegy.2022.000088.[11]武婷,郭帅,杨阳等. 动物双歧杆菌乳亚种Probio-M8在发酵山羊乳中的应用[C]//中国食品科学技术学会.第十七届益生菌与健康国际研讨会摘要集.[出版者不详],2022:149-150.DOI:10.26914/c.cnkihy.2022.018592.[12]赵春燕,张颖,王丹,刘臻.乳酸菌细胞固定化发酵的研究进展[J].中国酿造,2009(05):11-14.[13]李秀凉,雷虹,张龙丰,周东坡,平文祥.从L-乳酸菌酸菜发酵液中初步分离肽类抑菌物质[J].食品工业科技,2008(07):91-93.DOI:10.13386/j.issn1002-0306.2008.07.022.[14]邓鹏超. 乳酸菌的高密度培养及酸奶冻干发酵剂的研究[D].华中农业大学,2008.[15]于修鑑. 乳酸菌高密度培养及浓缩型发酵剂研究[D].南京工业大学,2004.[16]黄晓英. 传统发酵食品中具有抑菌特性乳酸菌的筛选、抑菌机理及其在泡菜发酵中的应用[D].西南民族大学,2022.DOI:10.27417/d.cnki.gxnmc.2022.000050.[17]彭海芬. 阿维拉霉素高产菌株的选育及其发酵条件优化[D].河南工业大学,2022.DOI:10.27791/d.cnki.ghegy.2022.000511.[18]吴斌.罗非鱼无乳链球菌SIP-pET32a基因工程菌高密度发酵工艺及SIP蛋白提取方及SIP蛋白提取方法研究[J].中国水产,2022(11):73-78.[19]熊华仪,陈曦,刘月锋,陈雄,李沛,王志.补料策略优化促进乳球菌HB03发酵合成Nisin[J/OL].食品科学:1-11[2023-05-18].http://kns.cnki.net/kcms/detail/11.2206.ts.20230428.1620.026.html[20]孙东霞,周子安,冯志合,胡修玉,祁光霞,董黎明.pH值调控柠檬酸污泥厌氧发酵产酸及碳源潜力研究[J].中国环境科学,2022,42(11):5198-5207.DOI:10.19674/j.cnki.issn1000-6923.20220620.001.收稿日期:2023-10-19 修改日期:第一作者简历:季学猛,硕士,实验师,研究方向为生物化工、机器学习;生物信息学。E-mail:jixuemeng@nankai.edu.cn。
培养结核杆菌的培养基,从性状上分主要有固体培养基、液体培养基、半流体培养基、固液双相培养基等类型,这些培养基各有特点。 1.1 固体培养基 最常用的是罗氏(Lownstein-Jenson,L-J)培养基,也是最具代表性的一种,其他的还有小川辰次(Tatsujiogawa)鸡蛋培养基和Middle brook 7H10、7H11等琼脂培养基等。在固体培养基中,由于可以直接观察菌落的形态并可做鉴别用,因此常用于临床标本的分离培养、鉴别、保存菌种及对抗结核药物的敏感性测定等方面,缺点是结核菌生长缓慢。 1.2 液体培养基 常用的有苏通(Sauton)培养基、Middle brook 7H9等液体培养基。结核杆菌在液体培养基中能够更广泛的接触营养成分,因此在液体中生长相对较快,主要在液体表面生长,搅动时下沉至管底,可获得大量的结核杆菌。主要缺点是:在对临床标本的收集、采样、运输方面有不利的一面;不能根据肉眼观察菌落形态;培养基污染机会多,影响结核杆菌的生长,污染时不易与结核杆菌鉴别,需涂片染色镜检判断结核杆菌是否生长。 1.3 半流体培养基 改良苏通半流体琼脂培养基是一种人工综合培养基,基质透明,呈半流体状态,生长的结核杆菌形成白色颗粒状菌落悬浮于培养基中段,便于观察。 1.4 固液双向培养基 Septi-Check AFB双相培养基是国外应用较早的一种培养基,采用BD专利式封闭式固液双相一体化培养基设计。液相为Middle brook 7H9分枝杆菌专用增菌培养基,可迅速繁殖分枝杆菌,固相为3种固体培养基平面:Middle brook 7H11和改良的L-J培养基用于及时将增菌肉汤内分枝杆菌进行分离纯化以获得单个菌落,巧克力琼脂用于早期发现污染菌,避免时间浪费。由于有液相作为基础,因此结核杆菌生长较快,也是一种非常有效的培养基。国内有用平菇制备的平菇双相培养基是利用平菇浸出液为基础,加小牛血清、琼脂等成分而配制的一种培养基,根据琼脂的量不同制成液相、固相培养基。在国内应用较少,主要特点是成本低,制备简单,适合于基层使用,有一定的研究价值。
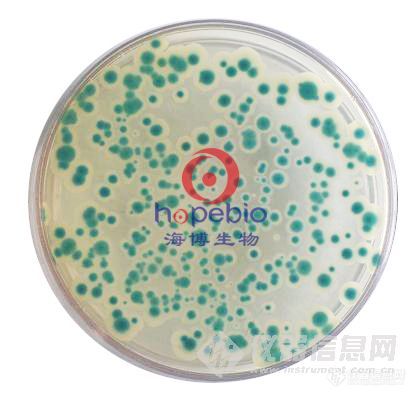
蜡样芽孢杆菌显色培养基Bacillus cereus Chromogenic Medium用途:用于蜡样芽孢杆菌的显色培养,蜡样芽孢杆菌显蓝绿色蜡样芽孢杆菌显色培养基是青岛海博生物公司改良的培养基,用于食品、水、乳制品和肉制品中蜡样芽孢杆菌的快速检测。蜡样芽孢杆菌显蓝绿色且菌落比较大,苏云金芽孢杆菌显蓝绿色,李斯特氏菌显深蓝色,菌落比较小,其它菌显黄色或无色,革兰氏阴性菌被抑制。 成份 (g/L) 特殊营养物质41.9 显色剂 0.5 抑菌成份 0.6琼脂 15.0 pH 7.0 ± 0.2 25 ℃ 此配方可以进行改良或增加营养成份以获得最佳的结果。 注意 此培养基仅供实验室使用。 用法 称取本品 11.6g 加入200ml蒸馏水,加热溶解并不停搅拌,煮沸不要超过1分钟。冷却至45-50℃时,倾入无菌平皿,备用。 贮存 制备好的平板可保存 2-5 天,应避免光线直接照射。干燥培养基应放置于阴暗干燥处, 保存温度 2-8 ℃,注意避光保存。 失效 干燥培养基超过保质期、结块和颜色变化都不能使用。 操作步骤 1、按国家标准、SN标准、FDA标准或其它方法制备样品液; 2、样品液在30±1℃增菌培养18-24小时; 3、取增菌液划线接种于蜡样芽孢杆菌显色培养基平板上,30±1℃培养18~24h。蜡样芽孢杆菌典型菌落为蓝绿色且菌落比较大。若24小时没有出现典型菌落,可延长培养至48小时。 4、对可疑蜡样芽孢杆菌可划线接种到营养琼脂平板上,30±1℃培养18-24小时,挑取单菌落做蜡样芽孢杆菌全套生化试验(本公司有生化鉴定管套装SHBG09 7种x2套/盒*5盒)






 400-622-8982
400-622-8982
 留言咨询
留言咨询

 400-622-8982
400-622-8982
 留言咨询
留言咨询

 400-622-8982
400-622-8982
 留言咨询
留言咨询


