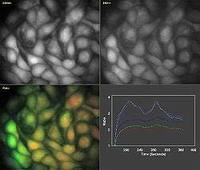
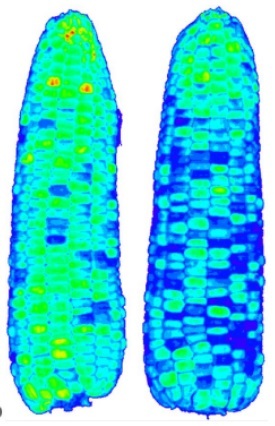
FluorCam便携式光合测量-荧光成像系统将气体交换测定功能和叶绿素荧光成像功能有机结合:既能够测定植物的光合速率、蒸腾速率、气孔导度等光合作用参数,全面衡量植物光合作用的强度和能力;又能够对植物的叶绿素荧光参数进行二维成像,反映光合作用过程中光系统对光能的吸收、传递、耗散、分配及光合特性的空间异质性。FluorCam便携式光合测量-荧光成像系统能够全面测定光合作用的过程(包括原初反应、电子传递、碳同化等阶段),充分了解光合作用的物质转化和能量交换,从而对光合作用进行完整评估和直观呈现。 应用领域植物光合生理研究、植物胁迫逆境研究、优质作物品种筛选、植物固碳研究、全球气候变化研究技术特点强强结合:全球首台野外便携式光合仪(1983年)和全球首部商用叶绿素荧光成像仪(1996年)均出在生产厂家。FluorCam便携式光合测量-荧光成像系统是数十年研发积累和技术经验的结晶——成熟耐用,值得信赖。 功能强大:荧光成像功能能够借助内置程序,自动测量Fv/Fm、NPQ、ΦPSII、qP、qN、Rfd、ETR等叶绿素荧光参数及对每个参数进行二维成像;光合仪能够自动测定同化速率(A)、蒸腾速率(E)、胞间CO2(Ci)、气孔导度(Gs)、叶片温度、光合有效辐射,运行光响应程序和CO2响应程序。配置灵活:可选配GFP荧光成像功能,用于转基因作物筛选和对植物个体水平的基因表达进行定位和分析。可选配OJIP快速荧光曲线测量模块,快速获取反映植物光能吸收、传递、转化、耗散及光合电子传递状况的26个JIP-test参数。可选配植物光谱及植被指数测量模块,轻松获取植物反射光谱曲线并直接获取NDVI、PRI等数十个反映植物色素含量、光能利用效率、健康状态的生理参数。可选配植物多酚-叶绿素测量模块,对色素含量进行测定,包括Chl叶绿素指数、Flav类黄酮指数、NBl氮平衡指数(Chl/Flav 比值)、Anth 花青素指数。 多使用场景:系统便携性强,非常适合长时间野外调查和大田试验,也可用于实验室、温室等可控环境下的基础研究,是植物学、农学研究的必备仪器。 技术参数1. 光合测量部分1.1 CO2测量范围:0-3000ppm1.2 CO2测量分辨率:1ppm1.3 CO2采用红外分析,差分开路测量系统,自动置零,自动气压和温度补偿1.4 H2O测量范围:0-75 mbar 1.5 H2O测量分辨率:0.1mbar1.6 PAR测量范围:0-3000 μmol m-2 s-1,余弦校正1.7 叶室温度:-5 - 50℃ 精度:±0.2℃1.8 叶片温度:-5 - 50℃ 1.9 空气泵流速:100 - 500ml / min1.10 CO2控制:由内部CO2供应系统提供,最高达2000ppm1.11 H2O控制:可高于或低于环境条件1.12 温度控制:由微型peltier元件控制,环境温度-10℃到+15℃,所有叶室自动调节1.13 PAR控制:RGB光源最大2400μmol m-2 s-1,LED白色光源最大2500μmol m-2 s-11.14 可选配多种带有光源的可控温叶室、叶夹1.15 显示:彩色WQVGA LCD触摸屏,480 x 272像素,尺寸95 x 53.9 mm,对角线长109mm1.16 数据存储:SD卡,最大兼容32G容量1.17 数据输出:Mini-B型USB接口,RS232九针D型接口,最大230400波特率PC通讯1.18 供电系统:内置12V 7.5AH锂离子电池,可持续工作至16小时,智能充电器1.19 尺寸:主机230×110×170mm,测量手柄300×80×75mm1.20 重量:主机4.1Kg,测量手柄0.8Kg1.21 操作环境:5到45℃2. 荧光成像部分2.1 测量参数:Fo, Fo’, Fs, Fm, Fm’, Fp, FtDn, FtLn, Fv, Fv'/ Fm',Fv/ Fm ,Fv',Ft,ΦPSII, NPQ_Dn, NPQ_Ln, Qp_Dn, Qp_Ln, qN, qP,QY, QY_Ln, Rfd, ETR等50多个叶绿素荧光参数,每个参数均可显示2维荧光彩色图像2.2 具备完备的自动测量程序(protocol),可自由对自动测量程序进行编辑Fv/Fm:测量参数包括Fo,Fm,Fv,QY等Kautsky诱导效应:Fo,Fp,Fv,Ft_Lss,QY,Rfd等荧光参数荧光淬灭分析:Fo,Fm,Fp,Fs,Fv,QY,ΦII,NPQ,Qp,Rfd,qL等50多个参数光响应曲线LC:Fo,Fm,QY,QY_Ln,ETR等荧光参数2.3 高分辨率TOMI-2 CCD传感器最高图像分辨率:1360×1024像素时间分辨率:在最高图像分辨率下可达每秒20帧A/D 转换分辨率:16位(65536灰度色阶)像元尺寸:6.45µ m×6.45µ m运行模式:1)动态视频模式,用于叶绿素荧光参数测量;2)快照模式,用于GFP等荧光蛋白和荧光染料测量通讯模式:千兆以太网2.4 高分辨率TOMI-2 CCD传感器(选配)2.5 成像面积:35mm×46 mm2.6 光源板:4块超亮LED光源板,每个光源板由5×5 LEDs阵列,尺寸4×4 cm2.7 测量光:620nm红光,持续时间10µ s–100µ s可调2.8 饱和光:标配白光,可选蓝光(455nm)或红光(620nm)白光:最高 3900 µ mol(photons)/m² .s 蓝光:最高 4900 µ mol(photons)/m² .s红光:最高 3800 µ mol(photons)/m² .s2.9 光化学光:标配白光,可选蓝光(455nm)或红光(620nm)白光:0–1000 µ mol(photons)/m² .s 蓝光:0–1400 µ mol(photons)/m² .s红光:0–800 µ mol(photons)/m² .s2.10 远红光:735nm,用于测量Fo’,4颗高能LED2.11 FluorCam叶绿素荧光成像分析软件功能:具Live(实况测试)、Protocols(实验程序选择定制)、Pre–processing(成像预处理)、Result(成像分析结果)等功能菜单2.12 客户定制实验程序协议(protocols):可设定时间(如测量光持续时间、光化学光持续时间、测量时间等)、光强(如不同光质光化学光强度、饱和光闪强度、调制测量光等),具备专用实验程序语言和脚本,用户也可利用Protocol菜单中的向导程序模版自由创建新的实验程序2.13 自动测量分析功能:选配,可设置一个实验程序(Protocol)自动无人值守循环成像测量,重复次数及间隔时间客户自定义,成像测量数据自动按时间日期存入计算机(带时间戳)2.14 成像预处理:程序软件可自动识别多个植物样品或多个区域,也可手动选择区域(Region of interest,ROI)。手动选区的形状可以是方形、圆形、任意多边形或扇形。软件可自动测量分析每个样品和选定区域的荧光动力学曲线及相应参数,样品或区域数量不受限制(1000)2.15 输出结果:高时间解析度荧光动态图、荧光动态变化视频、荧光参数Excel文件、直方图、不同参数成像图、不同ROI的荧光参数列表等 2.16 给光制度:静态或动态(窦式)2.17 CCD检测范围:400–1000nm 2.18 光谱响应:540nm处量子效率最高(70 %),400nm和650nm处转降50%2.19 读出噪音:低于12eRMS,典型10e2.20 满阱容量:大于70,000 e (unbinned) 2.21 Bios:固件可升级2.22 通讯方式:千兆以太网2.23 主机重量:1.8 kg 2.24 主机尺寸:21.5 cm×13.5 cm×13.5 cm2.25 叶夹:用于夹持测量叶片并进行暗适应2.26 支架系统:1)室内支架,可调整测量高度和角度,用于实验室内测量;2)三角支架(选配),防水防锈材料设计,满足测量稳定性,高度角度可调,最高测量高度1.5m,用于野外测量2.27 供电方式:1)90–240 V交流电,配有专用防电涌稳压电源;2)专用野外电池包(选配),一次充电可支持10小时以上不间断测量2.28 最大功率:200 W 应用案例1. 捷克帕拉茨基大学的研究人员使用FluorCam便携式光合测量-荧光成像系统测定了热激预处理前后感染白粉病的番茄的气体交换参数及叶绿素荧光参数(成像),发现热激处理不会显著影响中等抗性基因型番茄的白粉病抗性和光合响应,但会增加易感基因型的易感性(Prokopová et al., 2010)。 2. 葡萄牙阿威罗大学的科研人员研究发现松树对脂溃疡病菌感染在时间序列上的生理响应依赖于宿主的易感水平,而脱落酸的分解代谢在此过程中发挥着重要的作用(Amaral et al., 2021)。FluorCam便携式光合测量-荧光成像系统则被用来测定易感品种和抗性品种在感染过程中的光合表现。 3. 日本日本鹿儿岛大学农学院的科研人员使用FluorCam便携式光合测量-荧光成像系统研究了温度光照对百香果“夏日皇后”和“红星”光合特性的影响。发现两个品种的百香果在高温下的光合特性存在差异:“夏日皇后”在高温下受到了严重的伤害,而“红星”在高温下保持其蒸腾和NPQ值从而降低了高温胁迫的影响(Shimada et al., 2017)。 国内安装案例 参考文献1.Amaral, J., Correia, B., Escandón, M., Jesus, C., Serô dio, J., Valledor, L., Hancock, R.D., Dinis, L.-T., Gomez-Cadenas, A., Alves, A., et al. (2021). Temporal physiological response of pine to Fusarium circinatum infection is dependent on host susceptibility level: the role of ABA catabolism. Tree Physiology 41, 801–816. 2.Oliveira, D.C., Moreira, A.S.F.P., Isaias, R.M.S., Martini, V., and Rezende, U.C. (2017). Sink Status and Photosynthetic Rate of the Leaflet Galls Induced by Bystracoccus mataybae (Eriococcidae) on Matayba guianensis (Sapindaceae). Front. Plant Sci. 8, 1249. 3.Oliveira, T.M., Yahmed, J.B., Dutra, J., Maserti, B.E., Talon, M., Navarro, L., Ollitraut, P., da S. Gesteira, A., and Morillon, R. (2017). Better tolerance to water deficit in doubled diploid ‘Carrizo citrange’ compared to diploid seedlings is associated with more limited water consumption. Acta Physiol Plant 39, 1–13. 4.Porcar-Castell, A., Tyystjä rvi, E., Atherton, J., van der Tol, C., Flexas, J., Pfündel, E.E., Moreno, J., Frankenberg, C., and Berry, J.A. (2014). Linking chlorophyll a fluorescence to photosynthesis for remote sensing applications: mechanisms and challenges. Journal of Experimental Botany 65, 4065–4095. 5.Prokopová, J., Mieslerová, B., Hlavá&ccaron ková, V., Hlavinka, J., Lebeda, A., Nau&scaron , J., and &Scaron pundová, M. (2010). Changes in photosynthesis of Lycopersicon spp. plants induced by tomato powdery mildew infection in combination with heat shock pre-treatment. Physiological and Molecular Plant Pathology 74, 205–213. 6.Shimada, A., Kubo, T., Tominaga, S., and Yamamoto, M. (2017). Effect of Temperature on Photosynthesis Characteristics in the Passion Fruits ‘Summer Queen’ and ‘Ruby Star.’ The Hortic J 86, 194–199.
 留言咨询
留言咨询

 400-628-5299
400-628-5299
 留言咨询
留言咨询

 400-860-5168转3548
400-860-5168转3548
 留言咨询
留言咨询

 400-860-5168转3548
400-860-5168转3548
 留言咨询
留言咨询

 400-860-5168转6187
400-860-5168转6187
 留言咨询
留言咨询

 400-860-5168转3568
400-860-5168转3568
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 留言咨询
留言咨询
 400-860-5168转1345
400-860-5168转1345
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转0751
400-860-5168转0751
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询
 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转6119
400-860-5168转6119
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转2831
400-860-5168转2831
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转4032
400-860-5168转4032
 留言咨询
留言咨询

 留言咨询
留言咨询