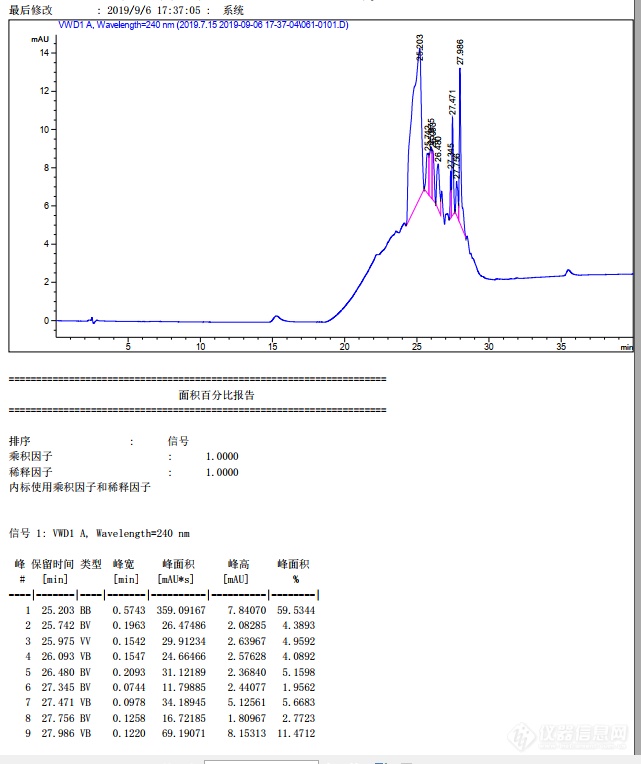
[img]https://simg.instrument.com.cn/bbs/images/default/em09509.gif[/img]各位大神我用的安捷伦的hplc,条件:C18柱,0-15min 25%甲醇+75% pH=2.5 磷酸缓冲溶液,15-25min 甲醇25%梯度增加到100%, 前面是正规条件,然后我又让继续以100%甲醇多跑了10min才结束的这一针,可是为什么25min后这么多乱七八糟峰。我之前以为是柱子脏,用1ml/min 100%甲醇冲洗了4-5h,才进的这一针磷酸盐缓冲溶液空白(图1),后来平衡后我又进了一针对苯二甲酸的标样(图2),之前看别的帖子说梯度洗脱是会出现鬼峰的,带着这些峰会对我的液相色谱数据有影响么?为啥就是跑不平![img=图1,641,764]https://ng1.17img.cn/bbsfiles/images/2019/09/201909062153573202_5320_3434948_3.png!w641x764.jpg[/img][img=图2,577,840]https://ng1.17img.cn/bbsfiles/images/2019/09/201909062153578600_5838_3434948_3.png!w577x840.jpg[/img]
液相色谱柱调查没开始就结束了
[b][font='Times New Roman'][font=宋体]解答:[/font][/font][/b][font=宋体][font=宋体]([/font]1[font=宋体])[/font][/font][font='Times New Roman'][font=宋体]如果使用的流动相不涉及缓冲盐、有机酸或无机酸等添加物,可以直接用纯有机相进行冲洗,并将液相色谱柱内充满有机相并封存[/font][/font][font=宋体]。[/font][font=宋体][font=宋体]([/font]2[font=宋体])[/font][/font][font='Times New Roman'][font=宋体]如果使用的流动相中含有缓冲盐、有机酸或无机酸等添加物(通常为反相色谱),则需用高比例的水相(如甲醇:水[/font]=90[font=宋体]:[/font][font=Times New Roman]10[/font][font=宋体])冲洗液相色谱柱[/font][font=Times New Roman]30min[/font][font=宋体]以上,然后用纯有机相冲洗液相色谱柱,并将液相色谱柱内充满有机相并封存。[/font][/font][font=微软雅黑][font=微软雅黑]领取更多《实战宝典》请进:[/font][/font][url=http://instrument-vip.mikecrm.com/2bbmrpI][u][font=微软雅黑][color=#0000ff]http://instrument-vip.mikecrm.com/2bbmrpI[/color][/font][/u][/url][font=微软雅黑] [/font]
请教各位高手,以前用手动进样器,试验完后用流动相、5%甲醇、甲醇清洗就可以了。但是现在的自动进样器,试验结束后,我该怎么清洗自动进样器,还是不用管
[font=微软雅黑][font=微软雅黑]实验结束后色谱柱清洗[/font][/font][font=微软雅黑][font=微软雅黑]如果使用的流动相不涉及缓冲盐、有机酸或无机酸等添加物,可以直接用纯有机相冲洗,并将色谱柱内充满有机相并封存。[/font][/font][font=微软雅黑][font=微软雅黑]如果使用的流动相含有缓冲盐、有机酸或无机酸等添加物,需要用高比例的水相(如甲醇:水[/font]=90:10)冲洗色谱柱30min以上,然后用纯有机相冲洗色谱柱,并将色谱柱内充满有机相并封存。[/font][font=微软雅黑][font=微软雅黑]以上摘自《[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]实战宝典》[/font][/font][font=微软雅黑][font=微软雅黑]有几个疑问需要咨询一下,恳请各位大神给予解答:[/font][/font][font=微软雅黑][font=微软雅黑]我使用的[/font][/font][font=微软雅黑][font=微软雅黑]色谱柱:[/font] C18[/font][font=微软雅黑] [/font][font=微软雅黑] [font=微软雅黑],[/font][/font][font=微软雅黑]1[/font][font=微软雅黑]50[/font][font=微软雅黑]m[/font][font=微软雅黑]mX4.6[/font][font=微软雅黑]m[/font][font=微软雅黑]m[/font][font=微软雅黑][font=微软雅黑][url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]型号:北京温分[/font][/font][font=微软雅黑]LC98I[/font][font=微软雅黑]1、上面提到的“冲洗”是需要将色谱柱出口端卸下,断开检测器吗?[/font][font=微软雅黑]2、高比例水相冲洗过后,纯有机相冲洗色谱柱,这个纯有机相冲洗有没有时间要求?[/font]
液相色谱清洗液 液相色谱的清洗液,也就是液相泵柱塞清洗液,大家一般采用10%的有机试剂。有人选择10%的甲醇水溶液,说甲醇水溶液接近流动相,粘度也小,更适应系统。有人用10%的异丙醇水溶液,说10%的异丙醇溶液粘度大,清洗能力强,更适合清洗。也有少数人用10%的乙醇水溶液,说乙醇毒性小,便宜,粘度也小,清洗能力也还不错。当然也有人采用纯净水,说纯净水更便宜,更环保。 大家都知道,液相泵柱塞清洗,主要是清洗柱塞往复运动带出的缓冲液(当然有时也要清洗流动相中的酸、碱性溶液),理论上采用纯净水就可以,但纯净水时间长了会有细菌滋生,污染系统。一般大家都会在纯净水中加入一定量的有机试剂,有机试剂一般加5-20%。5%以上的有机溶液具有较强的杀菌功能,20%以下的有机溶液,缓冲液不至于析出。至于加甲醇还是乙醇还是异丙醇、丙酮那就得看实际需要和实际情况了,各有优缺点。 当然这个清洗液远不止这些。如果是正向色谱,流动相是极性较弱的试剂,那样清洗液也尽量选择极性较弱的试剂,比如正己烷、正丁烷等。有时使用树脂填料类的色谱柱,清洗液中最好不要加有机试剂,用纯净水或在纯净水中加一点酸或碱。这个也得看具体要求和具体情况了。 所以液相色谱柱塞清洗液的选择有一些说法。我们常用的是反相色谱,清洗液一般采用10%的甲醇水溶液,10%的乙醇水溶液,10%的异丙醇水溶液,纯净水等。其它色谱法或色谱柱如有特殊需要,那就得特殊处理。这个得看具体要求和实际情况,折优选择。
原子荧光检测用的载流和还原剂用的试剂瓶,检测结束都是怎么清洗的呢??也需要用酸泡吗?
如何设置安捷伦1260[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱仪[/color][/url]序列结束后自动降低流速?手动进样
请教一下各位 如何清洗液相管路?
转自小木虫,作者:PAborall原文:(内部资料)Cleaning the LC System for Best Nanoelectrospray Sensitivity This is the cleaning procedure I used for my Nanoflow Proteomics Solution system to achieve the best sensitivity. The flush times are approximate and were dictated by my schedule more than any absolute requirement. Note: I cleaned my system for direct mode analysis and only the column/nanospray needle/MS were not included. I cleaned all 4 channels simultaneously. Even though only 2 channels are needed, but this would be optional. How long the system stays clean will probably depend on the samples run, but my system has maintained a low background for almost 2 months. Flushing was usually done at 4 uL/min to ensure sufficient backpressure and to aid in cleaning. When changing solvents, all channels were purged at 2500 uL/min for 2 minutes/channel Procedure: 1. Be sure to remove columns and MS from system.2. Flush B channel with hot water (about 60 deg) for 20 minutes to remove any acetonitrile polymer (optional: more important for older systems) 3. Flush with water at RT for 10 minutes. 4. Flush with !°cleaning solvent!± which consists of 2:25%:50% cyclohexane/acetontirile/isopropanol for 30-60 minutes. Note: this solvent mixture is used only for rinsing / steam cleaning and should not remain in the LC system for an extended period of time. It has been reported that cyclohexane may be harmful to the LC pump seals. Therefore, make sure to remove the solvent mixture from the system after the cleaning procedure is finished. 5. Flush all channels copiously with water on all channels for 30 minutes. 6. Flush with 20% nitric acid at a low flow ( 1 uL/min) for several hours. 7. Flush copiously with water (several hours). Note: Use a beaker for the water and be sure to change the water and the beaker several times in the first hour as there will be lots of nitric acid in the spargers. 8. Flush with 200 mM ammonium formate until the pH is close to neutral and then flush again with water. 9. Restore the normal solvents and stabilize the system. 译文:为使钠喷雾具备高灵敏度而进行的液相系统清洗下面是我为获得最高的灵敏度而对钠流蛋白质组学溶液系统的清洗步骤。 清洗的频率取决于已定的计划,而不是到了非清洗不可得的时候在洗注意:A 清洗的系统是单纯流路系统,需将色谱柱、钠升电喷雾、质谱隔离B 同时清洗4个通道,即使仅有2个通道在使用,这是可以随意选择的C 清洗的时间取决于所跑的样品,但我的系统已约2个月保持在低背压D 冲洗时,流速一般设在4ul/min以保证足够的背压和帮助清洗。当更换溶剂时,所有通道都要用2500ul/min保持2分钟以清除原溶剂步骤1、确保色谱柱/MS从系统中移走2、用热水(60度) 冲洗B通道20min ,以清除任何乙腈聚合物(建议:较老的系统很重要)3、用水冲洗RT10分钟4、用清洗溶剂((环己烷;乙腈;异丙醇)-25:25:50)冲洗30—60分钟 注意:此种清洗溶剂仅用于清水/蒸汽清洗,不应长时间滞留在液相系统里。据报道,环己烷对液相泵的密封系统有损害。因此,清洗完成后确保将清洗溶剂完全清除5、用水充分地冲洗所有通道30分钟6、用20%的硝酸低流速(<1ul/min )地冲洗数小时7、充分用水冲洗数小时注意:在第一个小时里, 用一大烧杯装水,并确保更换几次烧杯和水,因为有大量的硝酸在装置中8、用200 mM甲酸铵清洗,直至pH接近中性,然后再用水冲洗9、换用正常的溶剂,平衡系统
液相色谱管路如何清洗

[align=center] [b]勿以事小而不为:记液相色谱管路的更换和清洗[/b][/align][align=left] 世界那么大,我想去看看!连着周末,休息了几天,临时将液相色谱的测试工作全盘托付给了“邻家小妹”,“邻家小妹”也算是执证上岗,在这半年里也断断续续地操作着液相色谱,能够独立从事一些简单项目的分析工作,交给她还是比较放心的。[/align][align=left] 假期结束,继续工作。欠了几天的债,终究是要还的。早早的配制好流动相,准备大干一场,上机时却发现管路B中有黑乎乎的东西,顺着该管路往下看,发现放置该管路的流动相储液瓶中还剩有一部分残留的流动相,流动相已经变得非常混浊,而且还漂有一些白色絮状物。掐指一算,感觉要有大事发生,连忙招呼来“邻家小妹”询问情况。原来“邻家小妹”在周五的时候做了防腐剂的项目,用到了乙酸铵缓冲溶液,临下班前匆匆忙忙的清洗完色谱柱后就没有切换流动相进行管路的清洗,管路B对应的流动相正是乙酸铵缓冲溶液。缓冲盐的环境加上适宜的气候条件,助长了微生物的生长与繁殖,短短几天,管路和储液瓶中就出现了如此多的絮状物,见图1-2。[/align][align=center][img=,657,836]http://ng1.17img.cn/bbsfiles/images/2018/08/201808151445593541_6342_1669358_3.jpg!w657x836.jpg[/img][/align][align=left] 得想办法清理掉这些絮状物,否则在日后的使用过程中,这些絮状物会被流动相带入仪器内部,污染仪器及色谱柱,甚至造成仪器故障。由于过滤头一直放置于被污染的缓冲盐流动相中,因此首先将过滤头拆卸下来,用水冲洗后再依次用热水、10%的硝酸、热水和甲醇超声清洗,见图3。[/align][align=center][img=,690,388]http://ng1.17img.cn/bbsfiles/images/2018/08/201808151444058879_3405_1669358_3.jpg!w690x388.jpg[/img][/align][align=left] 过滤头的清洗比较容易操作,让人头疼的是如何清洗管路中的絮状物。由于絮状物几乎布满了整条管路,通过切割的方式已经行不通了;管路较长,内径又小,也找不到合适的器具伸进去进行清洗。无奈之下,还是选择尝试冲洗,而冲洗就需要有驱动力,让液体能够在管路中流动。利用液相色谱的泵压进行驱动肯定是不行的,会将絮状物带入仪器中,只能借助于外力了。 为了防止将絮状物冲洗到仪器中,首先需要断开管路与仪器的连接。顺藤摸瓜,找到管路与仪器最近的连接点——在线脱气机。脱气机在仪器内部,不拆外壳不方便操作,于是开始拆机,令人欣慰的是此次拆机只需拆掉脱气机一侧的外壳就行。脱气机与比例阀之间用不锈钢管路连接,虽然看不到污染的情况,但是一并也给拆下来进行清洗。简单的拆机过程见图4。 1、拔掉柱温箱与主机之间的连接线(建议拔线之前,切断主机电源); 2、卸掉色谱柱,移除相应的管路; 3、柱温箱往上提,卸掉柱温箱(柱温箱是依靠螺丝挂在主机上的); 4、拆卸外壳上的两颗螺丝,便可移去脱气机一侧的外壳(含有黑色垫片的三颗螺丝可以不用拆,该螺丝用于悬挂柱温箱); 5、松掉相应管路,拆卸管路与脱气机入口、脱气机出口和比例阀端的接头。[/align][align=center][img=,663,669]http://ng1.17img.cn/bbsfiles/images/2018/08/201808151447479308_4610_1669358_3.jpg!w663x669.jpg[/img][/align][align=left] 拆机结束后,将管路的一端放置于500mL锥形瓶中,从另一端注入液体进行冲洗。由于管路内径较小,洗瓶、洗耳球等都无法进行操作,最后选择采用30mL带针的注射器进行注射清洗,这种简单的清洗方式对较短的不锈钢管路还行,但是对较长的管路而言却是行不通的,冲洗了许久,只有少量的絮状物被冲洗出来。迫于无奈,还是决定先更换管路,再寻找更好的清洗方法。拆掉被污染的管路,并从实验室配件盒中找到了一段类似的管路(戴安[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]装机剩下的管路),对比了一下内径,基本一致,但是没有密封圈和接头,于是将原先的密封圈小心翼翼的拆卸下来重新安装在新的管路中,见图5。[/align][align=center][img=,674,562]http://ng1.17img.cn/bbsfiles/images/2018/08/201808151449469474_1836_1669358_3.jpg!w674x562.jpg[/img][/align][align=left] 新的管路先用水、甲醇进行冲洗,然后按照原先的布局装入仪器中,并接好过滤头,不接色谱柱,进行开机冲洗,一方面是检查接头是否有漏液;另一方面对在线脱气机进行冲洗。冲洗完仪器,利用标准溶液对仪器性能进行测试,防止脱气机内的絮状物被冲进仪器,对泵、比例阀、在线过滤器等产生危害,从而影响仪器性能。经测试,仪器压力、色谱图、重现性等都没有异常,接头处也没有发现漏液,于是重新固定管路,安装仪器外壳和柱温箱,并对新的管路进行标识,见图6。[/align][align=center][img=,484,579]http://ng1.17img.cn/bbsfiles/images/2018/08/201808151450562097_2521_1669358_3.jpg!w484x579.jpg[/img][/align][align=left] 到此为止,仪器已经可以正常使用,接下来就要想办法清洗被污染的管路。论坛中也有版友询问过此类污染物的清洗问题,但是未见有反馈,此次污染刚好做一个尝试。首先尝试用沸水清洗:将管路盘好放入1000mL烧杯中,管路和烧杯中注入超纯水,电炉上加热煮沸并保持一段时间,待冷却后再用装有热水的注射器进行冲洗,然而效果一般,清洗并不完全;然后尝试超声清洗:将管路盘好放入1000mL烧杯中,同样,管路和烧杯中注入预先加热的温水,在温水浴中进行超声清洗,超声清洗30min后可以明显看到管路中黑色物质在移动,看来是有效果了,用注射器冲洗后,许多絮状物被冲出了管外,但是还是有一些顽固污渍粘附在管壁上;最后,进行分段清洗,将有污渍的部分进入水中,边超声边清洗,经过多次清洗,已无肉眼可见污染物,(由于单人操作,清洗过程未能上图),清洗后的管路见图7。[/align][align=center][img=,690,349]http://ng1.17img.cn/bbsfiles/images/2018/08/201808151451573588_1882_1669358_3.jpg!w690x349.jpg[/img][/align][align=left] 由于仪器中使用了新的管路,该管路暂时也用不上,于是用空针筒将水吹至近干,然后用甲醇进行冲洗,再将甲醇吹至近干,放在50度烘箱中烘干后保存,防止在保存过程中残留的水会再次长菌。图8为此次管路更换和清洗过程中使用到得“作案工具”[/align][align=center][img=,690,336]http://ng1.17img.cn/bbsfiles/images/2018/08/201808151453184159_4930_1669358_3.jpg!w690x336.jpg[/img][/align][align=left]总结: 1、若想仪器用的好,维护保养很重要。仪器使用过程中,千万不要忽略或者省去一些看似不重要的步骤,例如流动相过滤、水相的更换、进样之前样品过滤膜等,等仪器出现故障之后,维修的成本和浪费的时间远大于平时的维护保养; 2、切割管路时建议不要用剪刀进行切割,实验室可以配置专业的切割工具; 3、含有缓冲盐的流动相一定要勤更换,用完之后一定要及时清洗管路,本次案例就是一个很好的教训。 4、此次管路的清洗过程还算顺利,如果有版友遇到类似问题,可以参考本文进行清洗。[/align]
求助:液相针座堵了,怎么清洗啊
液相小瓶如何清洗,有没简单的方法,我在版内没搜到,谢谢
各位老师好!请问一下waters液相,wash,seal wash ,purge分别用来清洗哪个部位的?感谢!
请问做高效液相时,用来进样的小瓶怎样清洗效果好啊?能否重复利用?
问个不专业的问题:液相进样瓶怎样清洗,各位大虾有什么好的方法吗?
丙酮进入液相色谱仪应该如何快速清洗?还有它对苯基柱有影响吗?
漫漫长假结束,你的液相色谱仪还能正常运行吗?当你看到你的液相色谱仪后,做的第一件事是什么呢?写下来,和大家一起分享吧!
钙型强酸性阳离子交换树脂为填充剂的色谱柱如何清洗和维护?液相色谱流动相是超纯水
有一段时间液质联用时发现谱图出现一个很大的杂峰,不接柱子单独扫描在这段是没有的,接上柱子就出现了,初步判定是柱子污染了,于是请教工程师,有液相色谱柱清洗方法,总结如下:分为下面步骤:1.50%乙腈水,流速0.2ml/min,25ml2.100%乙腈,流速0.2ml/min,25ml3.25%异丙醇:75%乙腈 0.2ml/min ,25ml4.100%异丙醇 ,0.2ml/min,25ml(带异丙醇冲洗时,流速需要降低,防止压力过高。必要时,流速可以再降低,但需要保证冲洗体积)。 建议用普通液相仪器进行冲洗,按以上步骤正冲,不接检测器,可以先冲洗1和2两步,冲洗后,用纯甲醇替换出乙腈,再上质谱测试一下。如果明显有改善,就不需要进行3和4步骤。如果还是有很多杂质峰干扰检测,可以重新把色谱柱安装到常规液相上,不接检测器,按照流程冲洗一遍。冲洗完毕后,用25mL乙腈(先低流速0.1ml/min,因为异丙醇粘度大,在色谱柱中容易使柱压升高。看压力平稳后,也就是异丙醇被逐渐替换除去,再增加流速到0.2ml/min,这是一个过程,需要注意压力不要骤然升高。)替换出异丙醇溶液,再接上检测器。用甲醇水过渡,平衡您的流动相后进标样测试峰型。试过之后,色谱柱有改善。
我公司[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]、液相小瓶都是一次使用,我想建一个清洁sop,大家帮帮忙,这个清洗程序应该怎样定。这些小瓶使用时用得也是常用溶剂,如甲醇、乙腈等
[size=3] 液相色谱所谓的柱后清洗和在线清洗功能是一回事吗,为什么要叫做柱后清洗,它们分别是怎么实现的,里面的结构是什么,平时如何操作。Agilent1200使用的10%异丙醇水溶液冲洗泵头是不是就是这种清洗形式,其他的厂家的液相如何呢。[/size]
请问高效液相柱(C18柱)是否最好每天都要清洗一下?请问怎么清洗?用什么溶液清洗?请问若是柱子抽干了怎么办?
原文来自:JANUARY 2003 LC[url=https://insevent.instrument.com.cn/t/Mp]gc[/url] NORTH AMERICA VOLUME 21 NUMBER 1 19,20,22,24,26http://www.chromatographyonline.com/反相高效液相色谱柱的清洗和再生(二)http://www.instrument.com.cn/bbs/shtml/20071105/1045750/反相高效液相色谱柱的清洗和再生(三)http://www.instrument.com.cn/bbs/shtml/20071105/1045752/[size=4]本文原是2年前让我的研究生左莹暑假特意翻译的,只是后来忘了。一个月前,在整理电脑资料中发现了这篇文献翻译,我重新校对,修整了一些错误,但仍可能会有些翻译不对的地方,或者语句不畅,请大家指正。[/size][color=#00008B]][color=#00FFFF][size=4]反相高效液相色谱柱的清洗和再生[/size][/color][/color] 这个月的“关注色谱柱”着眼于将一根污染的柱子回到或接近初始状态的实用方法。Ron Majors 会讨论硅胶基质或其它类型的反相柱子的清洗步骤。 反相液相色谱是迄今为止高效液相色谱法(HPLC)中使用最广泛的技术[1]。它的广泛使用是因为它能应用于大部分的非极性化合物、许多可电离的及离子化合物的分析。大部分用于反相色谱的固定相是亲水性的,因此分析物是通过其与固定相之间的亲水作用的程度来进行分离的,含有亲水组成的基团也有相似的保留行为。 表一列举了最常见的键合硅胶的固定相(1)。一些比较次等的固定相比如说一些混合固定相(例如:苯基-乙基),末端封尾和不封尾类型的,一些极性固定相同样属于硅胶键合。其它一些各种各样的填料同样也被用于反相液相色谱,包括聚合物,涂布有硅和铝的聚合物,涂有氧化锆的无机-有机杂化物和石墨化的碳。各种不同的固定相都有其自身的优点和缺点。表1 HPLC固定相中的使用比例*固定相 使用比例C1839C826CN**14.5苯基12C43.7亲水作用1.8C21.2C10.8其它0.8聚合物0.5* 来源于文献1** 包括正相色谱,因为正相与反相使用无法确定比例。 反相色谱柱由于可使用多种流动相和添加剂而得到了广泛的使用。其中使用添加剂的一些技术可改变或修饰填料表面。有时,这些添加试剂本身就会污染填料表面或键合相。 由于使用了亲水性的键合固定相,硅胶表层有了其他的化学特征。残余的硅羟基存在于所有的硅胶键合相的表层。图一描述了可能存在的不同类型的硅羟基(2)。由于是弱酸的特性,这些硅羟基会同某些分析物和基体化合物相互作用,尤其是同一些碱性化合物。因为硅羟基的Pka值大约是在4.5左右。电离可能发生在中间的pH值,因此存在其同阳离子产生静电作用的可能性。比较老的A型硅胶可能含有高浓度的金属离子(通常为100ppm,或更高),这些金属离子会在硅胶表面提供更强的酸性,同样还会和金属螯合化合物(3)相互作用。残留的硅羟基会在末端不封尾的键合硅胶和短链键合的固定相上(例如C2和C4固定相)造成较多的麻烦。 色谱柱的使用者必须清楚色谱柱固定相的表面特征和可能存在的分析物—固定相表面的相互作用,所以在使用和发展反相色谱方法时必须考虑可能存在的基体相互作用。比如一些非常疏水的材料如玉米油、特别芳香类材料和蜡可以附着在反相填料表层并改变填料层的特征。含有蛋白质的生物液体会吸附在填料表层,尽管分析者尽了最大的努力来保护高效液相色谱柱以防止外来物质对其的伤害,最终是,某些分析物-基体化合物还是会对固定相产生不利的影响。 当一根色谱柱被污染之后,它的色谱性征可能已经不同于未被污染的色谱柱了。被污染的色谱柱可能会表现出反压力的问题。对于一根被污染的色谱柱则必须通过清洗和再生将它恢复到原来的操作条件。“关注色谱柱”这部分将会讨论一些实用的方法来将色谱柱恢复或接近到初始状态。由于键合的硅胶柱是最常用的,所以我要着重讨论他们。在最后,我将会论述一些其他类型的反相色谱柱的清洗程序。 反相色谱柱中污染物是怎样的形成? 通常,样品基体里总是含有一些对分析者来说不感兴趣的化合物。盐类、脂质、含脂肪的化合物、腐殖酸、疏水性的蛋白质和其他的一些生物化合物就是在使用中能够接触到高效液相色谱柱的可能物质。这些物质可能会比所需分析的物质更强或更弱的保留能力。那些保留能力比较弱的化合物如盐类,将以死体积被洗脱出来。这些不希望发生的干扰可以通过检测器观察到,它表现为一些色谱峰、斑点、基线干扰,甚至是一些倒峰。如果样品基体组成在色谱柱中有强的保留性,且流动相组成本身就不强到足以使其洗脱出来,这些被吸附的、或是被吸收的化合物将会累积,通常是在经过多次进样之后堵塞在色谱柱的柱头。这种特征是在等度条件下观察得到的。中等保留能力的样品混合物可以被缓慢的洗脱出来,其表现为宽峰、基线干扰或基线漂移。 有时,这些吸附的样品组成达到了比较高的浓度,它们便表现为一种新的固定相。被分析物可与这些杂质作用并表现为新的分离机理。它可能会引起保留时间的变化和峰的拖尾。如果色谱柱受到了比较严重的污染,色谱柱的反压力会达到一个无法承受的高度,这将会使泵超压工作,在堵塞的位置引起柱的塌陷并产生中空。表2分析柱的柱体积柱的尺寸(mm*mm)死体积(mL)250 * 4.62.5150 * 4.6 1.5150 * 3.00.64150 * 2.10.2850 * 4.60.5030 * 4.60.3015 * 4.60.15反相高效液相色谱柱的清洗和再生(二)http://www.instrument.com.cn/bbs/shtml/20071105/1045750/反相高效液相色谱柱的清洗和再生(三)http://www.instrument.com.cn/bbs/shtml/20071105/1045752/
使用安捷伦高效液相色谱仪,进不同样品时进样针用什么溶液清洗 是用流动相洗还是甲醇洗呢?用甲醇的话是百分之多少的甲醇?我要测的是有机酸 做标准曲线时 进不同浓度的标准酸品之间进样针是否清洗 用什么清洗?
请问你们的液相,对自动进样器的清洗是怎么进行的啊,我的点了清洗之后怎么就清洗个大约5秒钟吧,时间也太短了吧[em0812] [em0812] [em0812]
[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]流动相不应含有任何腐蚀性物质,含有缓冲液的流动相不应保留在泵内,尤其是在停泵过夜或更长时间的情况下。如果将含缓冲液的流动相留在泵内,由于蒸发或泄漏,甚至只是由于溶液的静置,就可能析出盐的微细晶体,这些晶体将和上述固体微粒一样损坏密封环和柱塞等。因此,必须泵入纯水将泵充分清洗后,再换成适合于色谱柱保存和有利于泵维护的溶剂(对于反相键合硅胶固定相,可以是甲醇或甲醇-水)。
请问大家液相砂心过滤头怎么清洗啊,我看到液相保养上面说砂心过滤头要经常的清洗,可是我们的一次也没洗过,请问怎么清洗比较合理啊?
在使用液相时,你的柱塞杆清洗功能经常开吗?