应用速递:药物安全—缬沙坦制剂中亚硝胺杂质的测定
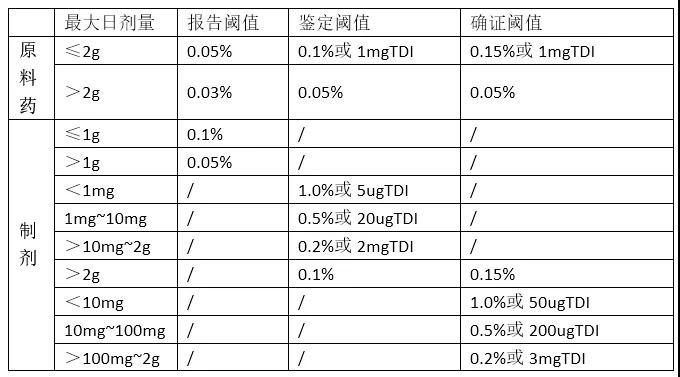
背景介绍缬沙坦是血管紧张素II受体阻滞剂(ARB)、联苯四氮唑结构的沙坦类化合物,用于各类轻中度高血压的治疗,尤其适用于ACE抑制剂不耐受的患者。2018年7月,药品监管部门首次在含有缬沙坦的产品中发现亚硝胺杂质——N二甲基亚硝胺(NDMA)。随后在沙坦类其他药物和雷尼替丁中都检测到各类亚硝胺杂质,例如N-二乙基亚硝胺(NDEA)、N-二异丙基亚硝胺(NDIPA)、N-乙基异丙基亚硝胺(NEIPA)和N-亚硝基二丁胺 (NDBA)。因此,对使用缬沙坦原料药的药品进行了全球召回,导致缬沙坦药品暂时短缺。 图1 N-亚硝胺的分子结构 根据世界卫生组织 (WHO) 的国际癌症研究机构 (IARC)的研究,大多数亚硝胺会对动物和人类具有致癌和遗传毒性。沙坦类药物大多含有四唑环,四唑环的形成需要亚硝酸钠;药物的生产设备、生产用试剂和溶剂(例如普通溶剂DMF中的二甲胺)也可能会带来污染,都有可能形成亚硝胺。欧洲药典 (Ph. Eur.) 委员会将 API 中亚硝胺的临时限值设定为低于 1 ppm,且于2020年底降至30 ppb。 低限值设定就需要使用灵敏度高和选择性好的分析方法。本应用参照美国FDA指南的方法进行优化,通过GC/MS/MS在EI源 MRM模式下痕量检测缬沙坦药品中的5种亚硝胺杂质 (NDMA、NDEA、NEIPA、NDIPA 和 NDBA),并根据USP要求进行方法学验证。 实验条件GC-MS/MS 方法检测不同的亚硝胺化合物,使用液体直接进样方式。与FDA方法相比,选择了膜厚更薄(0.5µm而不是1µm)的Supelcowax柱,符合USP通则中621色谱法的规定。色谱条件以及质谱条件见表1-3。 表1 色谱条件色谱柱SUPELCOWAX 10, 30 m x 0.25 mm I.D., 0.5µm (24284)检测器MS/MS进样口温度250℃柱温箱程序40℃保持0.5min,20℃/min至200℃, 60℃/min 至250℃保持3min载气及流速氦气,1.0mL/min衬管4 mm单径锥衬管带玻璃棉进样量2 µL进样模式脉冲不分流样品稀释剂二氯甲烷样品制备使用切片工具,取药片的四分之一放入15mL离心管,加入5mL二氯甲烷。将样品涡旋1分钟,并置于离心机中以4000 rpm离心2.5min。取二氯甲烷层上清液2mL,用0.45µm PVDF膜过滤。取续滤液0.5mL到2mL样品小瓶中并加盖。标准溶液二氯甲烷作为溶剂,配制得到浓度分别2.5、5.0、10、20、40、80、100ng/mL的5种亚硝胺(NDMA/NDEA/NEIPA/NDIPA/NDBA)校准溶液。 表2 质谱条件调谐自动调谐离子源及采集模式EI源,MRM碰撞气体氮气 @ 1.5mL/min淬灭气体氦气 @ 4.0mL/min 溶剂延迟7 min离子源温度230°C四极杆温度150°C电离电压70 eV驻留时间50 ms 表3 MRM 离子对参数列表峰化合物Transition保留时间1N二甲基亚硝胺MRM274→426.952N二甲基亚硝胺MRM174→446.9522N-二乙基亚硝胺MRM 1102→857.533N-二乙基亚硝胺MRM2102→567.5283N-乙基异丙基亚硝胺MRM1116→997.784N-乙基异丙基亚硝胺MRM271→567.7874N-二异丙基亚硝胺MRM1130→427.971N-二异丙基亚硝胺MRM2130→887.9765N-亚硝基二丁胺MRM1158→999.497N-亚硝基二丁胺MRM284→569.494 五种亚硝胺化合物在10分钟内完全分离,且目标峰与溶剂和基质杂质得到了很好的分离(图 2)。由于使用了0.5µm膜厚的色谱柱,与 FDA 方法相比,分离时间更短。图2:40 ng/mL系统适用性溶液色谱图,峰表见表3.实验得出:N-二乙基亚硝胺(NDEA)和N-二异丙基亚硝胺(NDIPA)的多反应监测MRM Transition最低检测限浓度为2.5ppb,如图3所示。图3 NDEA(上图)和 NDIPA(下图)最低检测限谱图 方法适用性经验证的 FDA-OTR 方法要求 40 ng/mL 标准品六次重复进样的 RSD%≤ 5%。 使用我们的方法,连续6次进样 40 ng/mL 的5种亚硝胺杂质,在两种 MRM 下的 RSD%远小于 5,如表4所示。化合物MRM1 RSD%MRM2 RSD% N二甲基亚硝胺1.81.3N-二乙基亚硝胺1.11.1N-乙基异丙基亚硝胺4.21.5N-二异丙基亚硝胺0.92.2N-亚硝基二丁胺4.33.0表4 40ng/mL 亚硝胺标准品连续六次进样的精密度此外,线性校准曲线的相关系数R2应≥ 0.998。本方法中五种亚硝胺杂质的两个 MRM都超过了这一标准(表 5)。杂质MRM 1MRM 2N二甲基亚硝胺0.99940.9995N-二乙基亚硝胺0.99910.9995N-乙基异丙基亚硝胺0.99950.9995N-二异丙基亚硝胺0.99960.9994N-亚硝基二丁胺0.99830.9981表5 两种MRM定量中两种亚硝胺的相关系数 (R2)缬沙坦制剂中亚硝酸胺的检测在药店购买的缬沙坦药品中加入亚硝胺杂质,浓度为10 ppb(NDBA为40 ppb),5种亚硝胺的回收率在94.5%~105.7%之间。(表6)。杂质10ppb回收率NDMA99 %NDEA103.5 %NEIPA94.5 %NDIPA103.9 %NDBA105.7 %表6缬沙坦药品中5种亚硝胺的加标回收率对于缬沙坦药品中5种亚硝胺的检测,OTR 方法的定量限 (LOQ) 范围是 8 – 40 ppb,本实验方法的 LOQ见表 7。 LOQ 是根据每种化合物校准曲线信噪比 (S/N) 为 10 浓度计算得出的,并且通过缬沙坦片剂的标准添加实验进行了验证。 检出限LOD是信噪比 (S/N) 为 3 的浓度计算得到 。杂质FDA方法 LOQ [ppb]本实验方法LOQ [ppb]NDMA133NDEA85NEIPA83NDIPA85NDBA4032表7 OTR和实验方法LOQ结果结论综上,参考FDA 建议方法,使用 SUPELCOWAX 色谱柱通过 GC-MS/MS在 MRM 模式下可以轻松实现亚硝胺杂质的测定。所有亚硝胺化合物之间以及与溶剂和基质峰的分离良好,满足所有系统适用性要求。 该方法已成功应用于缬沙坦药物中亚硝胺类杂质的分析。 相关产品描述货号链接SUPELCOWAX 10 气相毛细管柱30 m × 0.25 mm,0.50 μm24284 https://www.sigmaaldrich.cn/CN/zh/product/supelco/24284 SupraSolv GC-MS二氯甲烷 1.00668 https://www.sigmaaldrich.cn/CN/zh/product/mm/100668 N二甲基亚硝胺NDMA认证参考物质 5000 µg/mL甲醇溶液CRM40059 https://www.sigmaaldrich.cn/CN/zh/product/supelco/crm40059N-二乙基亚硝胺NDEA 认证参考物质 5000 µg/mL甲醇溶液40334 https://www.sigmaaldrich.cn/CN/zh/product/supelco/40334N-亚硝基二丁胺NDBA 分析标准品442685 https://www.sigmaaldrich.cn/CN/zh/product/supelco/442685 N-乙基异丙基亚硝胺NEIPA EP标准品Y0002262 https://www.sigmaaldrich.cn/CN/zh/product/supelco/y0002262N-二异丙基亚硝胺NDIPA EP 标准品Y0002263 https://www.sigmaaldrich.cn/CN/zh/product/supelco/y0002263