做吸附实验,模型污染物用硫酸铜配置,请问用[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]测铜离子浓度的话,标曲该怎么做,可以直接配置一系列不同浓度硫酸铜溶液做吗?
基本概况 硫酸铜(Copper sulphate) 硫酸铜及其溶液硫酸铜CuSO4(硫酸铜晶体:CuSO45H2O)分子量249.68 深蓝色大颗粒状结晶体或蓝色颗粒状结晶粉末。有毒,无臭,带有金属涩味。密度2.2844g/cm3。干燥空气中会缓慢风化。溶于水,水溶液呈弱酸性,不溶于乙醇。150℃以上将失去全部水结晶成为白色粉末状无水硫酸铜,650℃则分解成氧化铜和三氧化硫。无水硫酸铜有极强的吸水性,把它投入95%乙醇成含水有机物(即吸收水分)而恢复为蓝色结晶体。硫酸铜中的铜离子能破坏蛋白质的立体结构,使之变性。测定蛋白质浓度时常在蛋白质中加入碱,再加入硫酸铜溶液,此时溶液会变为紫色,这个反应被称为双缩脲反应。 应用领域 无机工业用于制造其他饲盐如氯化亚铜、氯化铜、焦磷酸铜、氧化亚铜、醋酸铜、碳酸铜等。染料和颜料工业用于制造含铜单偶氮染料如活性艳蓝、活性紫等。有机工业用作合成香料和染料中间体的催化剂,甲基丙烯酸甲酯的阻聚剂。涂料工业用作生产船底防污漆的杀菌剂。电镀工业用作全光亮酸性镀铜主盐和铜离子添加剂。印染工业用作媒染剂和精染布的助氧剂。农业上作为杀菌剂。
硫酸铜粉末的介电常数是10.3,那硫酸铜溶液呢?硫酸铜溶液的介电常数和溶液的浓度有关系吗?
请问硫酸铜溶液的介电常数跟浓度有关系吗?如果有,是跟溶度有什么关系呢?请高手告诉我一下~~谢谢啦~~
工业级硫酸铜的标准,五水硫酸铜含量在96-98%的标准,不是饲料级与电镀级的标准
在饱和的硫酸铜溶液中加入无水硫酸铜,那么无水硫酸铜会和溶液中的溶剂水反应生成蓝色胆矾,那么溶剂水减少了,就会有硫酸铜析出,这里析出的硫酸铜还会和水反应生成胆矾么?还是有什么限制?比如下面的例题:t℃时,硫酸铜的溶解度为25g.在100g t℃时的硫酸铜饱和溶液中加入1.6g无水硫酸铜粉末,若温度不变,则可析出胆矾_____g.这例题里,加入无水硫酸铜后,肯定会消耗原溶液中的水,那肯定会有硫酸铜析出,析出的硫酸铜又与水反应,会这样循环下去么?最后会出现什么情况?另外帮我解答一下这个例题.谢谢. [b]问题补充:[/b]还有个问题,因溶剂水被消耗析出的硫酸铜会与胆矾在一起么?
五水硫酸铜的作用?我现在遇到一个流动相,里面加了辛胺和五水硫酸铜。辛胺的作用我知道是个减尾剂,您们知道五水硫酸铜起什么作用啊?
本人需要标定一下硫酸铜溶液的精确浓度,有知道方法的大侠告诉我一下,深谢!
请问谁有GB 437-1993 硫酸铜和HG/T 2989-1993 硫酸铜,谢谢您!
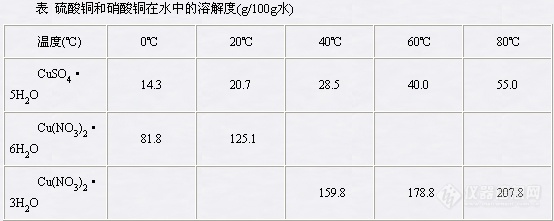
硫酸铜的制备目的原理实验目的1.练习和掌握加热、蒸发浓缩,常压过滤及减压过滤,重结晶等基本操作;2.了解由金属与酸作用制备盐的方法。实验原理纯铜不活泼,不能溶于非氧化性的酸中。但其氧化物在稀酸中却极易溶解。因此在工业上制备胆矾时,先把铜烧成氧化铜,然后与适当浓度的硫酸作用生成硫酸铜。本实验采用浓硝酸作氧化剂,以铜片与硫酸、浓硝酸作用来制备硫酸铜。溶液中生成硫酸铜外,还含有一定量的硝酸铜和其他一些可溶性或不溶性的杂质。不溶性杂质可过滤除去。利用硫酸铜和硝酸铜在水中溶解度的不同可将硫酸铜分离、提纯。[img]http://ng1.17img.cn/bbsfiles/images/2007/03/200703201311_45630_1632583_3.jpg[/img]由上表中数据可见,硝酸铜在水中的溶解度不论在高温或低温下都比硫酸铜大得多。因此,当热溶液冷却到一定温度时,硫酸铜首先达到过饱和而开始从溶液中结晶析出,随着温度的继续下降,硫酸铜不断从溶液中析出,硝酸铜则大部分仍留在溶液中,只有小部分随着硫酸铜析出。这小部分硝酸铜的其他一些可溶性杂质,可再经重结晶的方法而被除去,最后达到制得纯硫酸铜的目的。过程步骤一、铜片的净化称取4.5g剪细的铜片,放在蒸发皿中,加入10ml moldm-33,在小火上微热,以洗去铜片上的污物(注意不要加热太久,以免使铜过多地溶解在稀HNO3中,影响产率)。用倾析法除去酸液,并用水洗净铜片。如果用废铜屑为原料,应先放在蒸发皿中,以强火灼烧,至表面生成黑色CuO为止,自然冷却,再作粗CuSO45H2O的制备。二、五水硫酸铜的制备在通风柜中,往盛有铜片的蒸发皿中加入15ml 3moldm-3H2SO4,然后慢慢分批加入7ml浓硝酸组成的混酸(此过程应根据反应情况的不同而决定补加混酸的量)。待反应完全后(铜片近于全部溶解),趁热用倾析法将溶液转至一个小烧杯中,留下不溶性杂质,然后再将硫酸铜溶液转回到洗净的蒸发皿中,在水浴上缓慢加热,浓缩至表面有晶体膜出现为止。取下蒸发皿,使溶液逐渐冷却,析出蓝色的CuSO45H2O晶体。抽滤、称重。计算产率(以湿品计算,应不少于85%)。产品重量 g理论产量 g产率 %三、重结晶法提纯五水硫酸铜将上面制得粗CuSO45H2O晶体在台称上称出1g留作分析用,其余放在小烧杯中,按重量比CuSO45H2O∶H2O = 1∶3的比例加入纯水,加热搅拌,促使溶解。滴加2ml3%H2O2,将溶液加热,同时逐滴加入2moldm-3氨水(或0.5moldm-3NaOH)直到溶液pH = 4,再多滴1-2滴,加热片刻,静置使水解产物的Fe(OH)3沉降。用倾析法在普通漏斗上过滤,滤液流入洁净的蒸发皿中。在提纯后的滤液中,滴加1moldm-3H2SO4酸化,调节pH至1-2,然后在石棉网上加热、蒸发、浓缩至液面出现一层结晶膜时,即停止加热。以冷水冷却,结晶抽滤,取出结晶,放在两层滤纸中间挤压,以吸干水份,称量。计算产率。产品重量 g理论产量 g产品产率 %四、产品纯度检验
皮蛋,又叫松花蛋或者变蛋,它不仅能增进食欲,促进营养的消化吸收,还有清凉、降压等功效,因此受到不少人喜爱。近日,江西南昌一位业内人士向记者爆料,当地生产的皮蛋大多存在食品安全隐患。调查时了解到,南昌县很多厂家在制作皮蛋时都会选择添加硫酸铜。而且还是工业级的,据专家介绍,工业用硫酸铜和食用级硫酸铜最大区别在于,工业硫酸铜往往含有铅、砷、镉等有毒有害元素,因而不能用于食品加工。滥用硫酸铜 缩短加工周期据了解,如果使用工业硫酸铜浸泡皮蛋,往往是皮蛋制作时间越短,加硫酸铜的成分就越多,对人体的危害就越大。硫酸铜泡皮蛋,您还敢吃吗?
求推荐一款硫酸铜密度计,精度万分之一的。主要是血站用
中华人民共和国化工行业标准. 饲料级硫酸铜. HG 2932-1987(1997)谁有发给我啊.谢谢
用硫酸铜怎么配铜的标准曲线系列,和铜单质是一样的配法吗
老师,我急用GB4334.5-2000不锈钢硫酸-硫酸铜腐蚀试验方法,能帮我吗?
麻烦求助,[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]流动相[color=#ff6666]为 硫酸铜水溶液[/color] ,那[color=#ff0000]硫酸铜试剂[/color]需要购买[color=#ff0000]什么级别[/color]的?谢谢!
饲料添加剂硫酸铜中铅的测定采用直接加消酸溶解测定,未检测到铅值,可是客户却说其中含铅,大家有没有好方法解决?
在一论文上看到碱性硫酸铜,怎么配置啊配置啊,谢谢!!!
今天用原子荧光测定饲料级硫酸铜中的As,用硝酸-高氯酸消解,定容。之后用硫脲和抗坏血酸还原,以硼氢化钾作为反应液,5%盐酸作为载液测定,在测定过程中发现有黑色沉淀物产生,而且此物粘附在反应块和排废管进口处,难于清洗掉,这个东西是什么?另外各位同志在测定硫酸铜里的As是怎么测定的?测定一次清洗一次管路,实在很费神啊[em09504]
需做不锈钢管件的硫酸-硫酸铜晶间腐蚀实验,不知哪儿可以做,最好江苏省内。
请问--有谁知道怎样去除硫酸铜溶液的颜色?使硫酸铜溶液的颜色由蓝色变成无色透明的。
本人在做亚甲基蓝吸附实验中遇到一点困难,按照国标法来做,但是搞不懂为什么最后测出亚甲基蓝的吸光值要与标准了硫酸铜溶液的吸光值比较。希望有能人帮忙解决一下。
用分析纯的硫酸铜配置溶液,没什么用火焰[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]开测,和已知的浓度差别好大,往溶液里加点稀硝酸结果又会好些。测Cr的时候也会出现这个问题,但是测镍和钴又很正常。仪器用铜的标准液做曲线,线性很好。然后用标准液反推结果又没问题。这到底是什么原因啊?
硫酸铜中测砷,当加入硫脲后产生絮状物,样品经过过滤后上机,与载液反应产生黑色沉淀物,堵塞反应块,需要怎样处理才可测?

一、样品介绍 五水硫酸铜也被称作硫酸铜晶体。俗称蓝矾、胆矾。其化学式为CuSO·5H₂O(是纯净物),为蓝色晶体,其分子式的量为249.68。含水量36%。是硫酸铜吸水后形成的。五水合硫酸铜在常温常压下很稳定,不易潮解,在干燥空气中会逐渐风化,加热后会失去五个水。 本次试验,使用的是“南京大展TGA/DSC同步热分析仪”对五水硫酸铜不同阶段脱水温度及脱水量进行分析。二、仪器介绍1、差示扫描量热法(DSC) 物质在物理变化和化学变化过程中往往会伴随着热效应,放热和吸热现象反映了物质热焓的变化。差热分析仪就是测定在同一受热条件下,测量试样与参比物之间温差对温度或时间的函数关系。 差示扫描量热法(DSC)是在差热分析(DTA)的基础上发展起来的一种热分析技术。它是在程序控制温度的情况下,测量输出物质与参比物的功率差与温度关系的一种技术。简称DSC。 本次五水硫酸铜失水实验中,此方法可以测得硫酸铜不同脱水阶段的起始温度。2、热重法(TG) 热重法是在程序控制温度下,测量物质的质量变化与温度关系的一种技术,其基本原理是热天平。热重分析仪(TGA)是一种利用热重法检测物质温度-质量变化关系的仪器。热重法是在程序控温下,测量物质的质量随温度(或时间)的变化关系。 当被测物质在加热过程中有升华、汽化、分解出气体或失去结晶水时,被测的物质质量就会发生变化。这时热重曲线就不是直线而是有所下降。通过分析热重曲线,就可以知道被测物质在多少度时产生变化,并且根据失重量,可以计算失去了多少物质。 此方法可以测得本次实验五水硫酸铜不同阶段的失水百分比。http://ng1.17img.cn/bbsfiles/images/2013/09/201309242017_467115_2794594_3.jpg南京大展TGA/DSC同步热分析仪三、实验1、取样 取适量五水硫酸铜放置在铝坩埚中,稍微压实,以让其充分受热。另取一只空铝坩埚做参比。如下图所示: http
硫酸铜中铜含量的测定目的原理实验目的掌握用碘法测定铜的原理和方法。实验原理二价铜盐与碘化物发生下列反应:2 Cu2+ + 4 I- = 2 CuI↓ + I2 I2 + I- = I-3析出的I2再用Na2S2O3标准溶液滴定,由此可以计算出铜的含量。Cu2+与I-的反应是可逆的,为了促使反应实际上能趋于完全,必须加入过量的KI。但是由于CuI沉淀强烈地吸附I-3离子,会使测定结果偏低。如果加入KSCN,使CuI (Ksp = 5.06×10-12) 转化为溶解度更小的CuSCN ( Ksp = 4.8×10-15)CuI + SCN- = CuSCN↓+ I-这样不但可以释放出被吸附的I-3离子,而且反应时再生出来的I-离子可与未反应的Cu2+离子发生作用。在这种情况下,可以使用较少的KI而能使反应进行得更完全。但是KSCN只能在接近终点时加入,否则因为I2的量较多,会明显地为KSCN所还原而使结果偏低SCN- + 4 I2 + 4H2O = SO2-4 + 7 I- + ICN + 8H+为了防止铜盐水解,反应必须在酸性溶液中进行。酸度过低,Cu2+离子氧化I-离子的反应进行不完全,结果偏低,而且反应速度慢,终点拖长;酸度过高,则I-离子被空气氧化为I2的反应为Cu2+离子催化,使结果偏高。大量Cl-离子能与Cu2+离子结合,I-离子不易从Cu(Ⅱ)的氯络合物中将Cu(Ⅱ)定量地还原,因此最好用硫酸而不用盐酸(小量盐酸不干扰)。矿石或合金中的铜也可以用碘法测定。但必须设法防止其他能氧化I-离子的物质(如NO3-、Fe3+离子等)的干扰。防止的方法是加入掩蔽剂以掩蔽干扰离子(例如使Fe3+离子生成FeF63-络离子而掩蔽),或在测定前将它们分离除去。若有As(V)、Sb(V)存在,应将pH调至4,以免它们氧化I-离子。仪器药品0.05mol/dm3 Na2S2O3标准溶液,1mol/dm3 H2SO4溶液,10% KSCN溶液,10% KI溶液,1%淀粉熔液。过程步骤本步骤只能用于不含干扰性物质的试样。精确称取硫酸铜试样(每份质量相当于20-30ml 0.05mol/dm3 Na2S2O3溶液)于250ml碘量瓶中,加1mol/dm3H2SO4溶液3ml和水30ml使之溶解。加入10%KI溶液7-8ml,立即用Na2S2O3标准溶液滴定到呈浅黄色。然后加入1%淀粉溶液1ml,继续滴定到呈浅蓝色。再加入5ml 10%KSCN(可否用NH4SCN代替?)溶液,摇匀后溶液蓝色转深,再继续滴定到蓝色恰好消失,此时溶液为米色CuSCN悬浮液。由实验结果计算硫酸铜的含铜量。分析思考1 硫酸铜易溶于水,为什么溶解时要加硫酸?2 用碘法测定铜含量时,为什么要加入KSCN溶液?如果在酸化后立即加入KSCN溶液,会产生什么影响?3 已知φy(Cu2+/Cu+)= 0.158V,φy(I2/I-)= 0.54V,为什么本法中Cu2+离子却能使I-离子氧化为I2? 4 测定反应为什么一定要在弱酸性溶液中进行? 5 如果分析矿石或合金中的铜,应怎样分解试样?试液中含有的干扰性杂质如Fe3+、NO3-等离子,应如何消除它们的干扰? 6 如果用Na2S2O3标准溶液测定铜矿或铜合金中的铜,用什么基准物标定Na2S2O3溶液的浓度最好?
请问--有谁知道怎样去除硫酸铜溶液的颜色?使硫酸铜溶液的颜色由蓝色变成无色透明的。
请问:硫酸铜电极和饱和甘汞电极之间怎么换算?比如说硫酸铜电极是-850mv,换算成报和甘汞电极是-925mv还是-770mv?这两种我在文献上怎么都见过啊?
今天,有个用户想测量硫酸铜中的铅,故征求如题的问题,因为在样品前处理方面我是外行,故请有此经验的版友帮忙,在此先谢过了。

再谈不锈钢硫酸-硫酸铜腐蚀试验lylsg555 不锈钢晶间腐蚀试验是现在制造不锈钢产品过程中一个主要的检验项目,以保证产品的安全性,晶间腐蚀试验根据标准的规定有多种类型的检测方法,其中不锈钢-硫酸铜腐蚀试验方法运用广泛,适用材料的范围广,操作简单,时间短,被广泛的运用。本法的试验所需仪器,方法、过程及检验我曾经在介绍过,可能是时间久的缘故,一些版友又提出来这个话题,那么借此机会再与大家共同探讨。1、不锈钢硫酸-硫酸铜腐蚀法适用于奥氏体、奥氏体-铁素体不锈钢,方法和试验的标准为GB/T4334-2008中的方法E-不锈钢硫酸-硫酸铜腐蚀试验方法(老标准是GB/T4334.5-2000)标准式样见图,http://ng1.17img.cn/bbsfiles/images/2014/08/201408301011_512177_1622447_3.jpg 2、试样 2.1 试样的取样、加工方法、尺寸标准中都有详细的说明,试验方法E最后的样品评定是用弯曲法来完成的,试样的尺寸长度为80~100mm,来保证弯曲的顺利操作。宽度和厚度标准中也做了相应的规定,但对于堆焊、焊条和铸件则没有做厚度的要求,在取样时要看实际情况,或者双方协商规定,堆焊的试件要清理干净过渡层,以免试验收到影响。 2.2试样加工好后要进行去油污、去毛刺的处理,如果选用金相法观察,则可以将试样预先精磨好,腐蚀完成后直接抛光,这样操作省时。 2.3关于试样的数量,标准其规定为2组,若用弯曲法时,可以多带出一组,一组不进行腐蚀就弯曲,以与进行腐蚀后的试样进行对比。 3、试验方法 3.1盛装试样和腐蚀溶液的容器为1000lm的三角磨口玻璃烧瓶,这种玻璃仪器耐腐蚀,价格低、方便,磨口的瓶口密封性性好。但如果你没有磨口瓶子的条件,选用非磨口的也可以,只要保证瓶塞与瓶口间的密闭,防止腐蚀溶液加热过程中的蒸发就可以了。 3.2关于冷凝回流器,它是用于溶液蒸发的气体冷凝回流,以减少溶液的损失与浓度的变化,一般用冷水冷却。本实验方法我们采用了蛇形管式,冷却效果好,进水口为自来水管,不需要高的水压,见图。http://ng1.17img.cn/bbsfiles/images/2014/08/201408302118_512227_1622447_3.jpg 3.3腐蚀试验的溶液一般不用实际的工程介质,是采用实验室配制的晶间腐蚀能力很强的介质溶液如硫酸,硝酸盐酸等强酸。本法采用硫酸-硫酸铜溶液,为了补充在腐蚀过程中硫酸铜的损耗,保持其浓度,在溶液中加入铜屑。 3.4在烧瓶底部铺一层铜屑(铜屑是什么?一直没有用到,只用到了比较小的铜片)然后放置试样,如果试样一层摆不下,可以再在原层上继续铺铜片后放置试样,见图。http://ng1.17img.cn/bbsfiles/images/2014/08/201408302209_512233_1622447_3.jpg 3.5试验溶液应高出最表层试样高度20mm以上,加热试验溶液应保持微沸状态,可以用调节电炉来做,一般调到700~800w的度数基本上就可以保持微沸状态,见图http://ng1.17img.cn/bbsfiles/images/2014/08/201408302233_512238_1622447_3.jpg 这里再次展示下完整的分析装置图片吧http://ng1.17img.cn/bbsfiles/images/2014/08/201408302247_512244_1622447_3.jpg 4、结果评定 4.1试验结果的评定有2种方法,一是弯曲法(主要方法)二是金相法(次要法)。 4.2弯曲法是将试验后的试样弯曲90°或180°,然后用10倍放大镜或者肉眼观察弯曲试样外表面是否存在晶间腐蚀所产生的裂纹,弯曲前,试样表面无裂纹现象,弯曲的作用是使晶间腐蚀裂纹在表面张开出宏观的裂纹,便于观察。标准中还规定试样的角裂、皱纹、滑移线等均不能按晶间腐蚀裂纹算。 4.3金相法是无法进行弯曲法试验或者弯曲法的裂纹难以判定时所采取的方法,金相法(可在截面)要求表面抛光,打磨和抛光时要注意腐蚀面与金相截面的直角尽量不要打磨成圆角,截面一般可以不进行金相浸蚀,必要时可以轻浸蚀,状态为晶界刚好出现为宜,以免使金相浸蚀粗化的晶界和晶间腐蚀裂纹互相混淆。 最后在说下弯曲法判定不确定裂纹的小方法: 弯曲试验中试样的外侧表面因塑性偏低或者存在一些缺陷时,也会产生裂纹,比如焊接接头试件,这类裂纹是不能作为晶间腐蚀裂纹判定的依据,这样在区分上就产生了一定的困难,如何来准确的分清到底是哪种裂纹情况呢,可采用两种方法来判定,一种就是上面所说的金相法,晶间腐蚀的裂纹是沿晶的,而其他因力学性能而产生的裂纹则是穿晶的。第二种办法就是采用2组平行样品来做比较,一组直接做弯曲,另一种腐蚀后再进行弯曲,如果没有腐蚀的试样出现了裂纹则说明是力学性能的裂纹,如果没腐蚀的试样无裂纹,而腐蚀后的试样有,则说明试样为晶间腐蚀裂纹,那么如果2组都出现裂纹,看看未腐蚀和腐蚀后的裂纹哪个多,在结合金相法来进行判定。