在生物大分子纯化分析特别是蛋白质纯化分析中,色谱是非常重要而且常用的一种技术。 一、凝胶过滤 凝胶过滤又叫分子筛色谱,其原因是凝胶具有网状结构,小分子物质能进入其内部,而大分子物质却被排除在外部。当一混合溶液通过凝胶过滤色谱柱时,溶液中的物质就按不同分子量筛分开了。 二、离子交换色谱 离子交换色谱是在以离子交换剂为固定相,液体为流动相的系统中进行的。离子交换剂是由基质、电荷基团和反离子构成的。离子交换剂与水溶液中离子或离子化合物的反应主要以离子交换方式进行,或借助离子交换剂上电荷基团对溶液中离子或离子化合物的吸附作用进行。 三、吸附色谱 1、 吸附柱色谱 吸附柱色谱是以固体吸附剂为固定相,以有机溶剂或缓冲液为流动相构成柱的一种色谱方法。 2、 薄层色谱 薄层色谱是以涂布于玻板或涤纶片等载体上的基质为固定相,以液体为流动相的一种色谱方法。这种色谱方法是把吸附剂等物质涂布于载体上形成薄层,然后按纸色谱操作进行展层。 3、 聚酰胺薄膜色谱 聚酰胺对极性物质的吸附作用是由于它能和被分离物之间形成氢键。这种氢键的强弱就决定了被分离物与聚酰胺薄膜之间吸附能力的大小。色谱时,展层剂与被分离物在聚酰胺膜表面竞争形成氢键。因此选择适当的展层剂使分离在聚酰胺膜表面发生吸附、解吸附、再吸附、再解吸附的连续过程,就能导致分离物质达到分离目的。 四、 亲和色谱 亲和色谱是根据生物大分子和配体之间的特异性亲和力,将某种配体连接在载体上作为固定相,而对能与配体特异性结合的生物大分子进行分离的一种色谱技术。亲和色谱是分离生物大分子最为有效的色谱技术,分辨率很高。 亲和色谱的原理与众所周知的抗原一抗体、激素一受体和酶一底物等特异性反应的机理相类似,每对反应物之间都有一定的亲和力。正如在酶与底物的反应中,特异的废物(S'')才能和一定的酶(E)结合,产生复合物(E-S'')一样。在亲和色谱中是特异的配体才能和一定的生命大分子之间具有亲和力,并产生复合物。而亲和色谱与酶一底物反应不同的是,前者进行反应时,配体(类似底物)是固相存在;后者进行反应时,底物呈液相存在。实质上亲和色谱是把具有识别能力的配体L(对酶的配体可以是类似底物、抑制剂或辅基等)以共价键的方式固化到含有活化基团的基质M(如活化琼脂糖等)上,制成亲和吸附剂M-L,或者叫做固相载体。而固化后的配体仍保持束缚特异物质的能力。 因此,当把围相载体装人小色谱柱(几毫升到几十毫升床体积)后,让欲分离的样品液通过该柱。这时样品中对配体有亲和力的物质S就可借助静电引力、范德瓦尔力,以及结构互补效应等作用吸附到固相载体上,而无亲和力或非特异吸附的物质则被起始缓冲液洗涤出来,并形成了第一个色谱峰。然后,恰当地改变起始缓冲 液的PH值、或增加离子强度、或加人抑③剂等因子,即可把物质S从固相载体上解离下来,并形成了第M个色谱峰(见图6-2)。显然,通过这一操作程序就可把有效成分与杂质满意地分离开。如果样品液中存在两个以上的物质与固相载体具有亲和力(其大小有差异)时,采用选择性缓冲液进行洗脱,也可以将它们分离开。用过的固相载体经再生处理后,可以重复使用。 上面介绍的亲和色谱法也是特异性配体亲和色谱法。另外还有通用性配体亲和色谱法。这两种亲和色谱法相比,前者的配体一般为复杂的生命大分子物质(如抗体、受体和酶的类似底物等),它具有较强的吸附选择性和较大的结合力。而后者的配体则一般为简单的小分子物质(如金属、染料,以及氨基酸等),它成本低廉、具有较高的吸附容量,通过改善吸附和脱附条件可提高色谱的分辨率。 五、聚焦色谱 聚焦色谱也是一种柱色谱。因此,它和另外的色谱一样,照例具有流动相,其流动相为 多缓冲剂,固定相为多缓冲交换剂。 聚焦色谱原理可以尝试从PH梯度溶液的形成、蛋白质的行为和聚焦效应三方面来阐述。 1、PH梯度溶液的形成 在离子交换色谱中,PH梯度溶液的形成是靠梯度混合仪实现的。例如,当使用阴离子 剂进行色谱时,制备PH由高到低呈线性变化的梯度溶液的方法是,在梯度仪的混合室(这色谱柱者)中装高PH溶液,而在另一室装低PH极限溶液,然后打开色谱柱的下端出口,让洗脱液连续不断地流过柱体。这时从柱的上部到下部溶液的PH值是由高到低变化的。而在聚焦色谱中,当洗脱液流进多缓冲交换剂时,由于交换剂带具有缓冲能力的电荷基团,故PH梯度溶液可以自动形成。 2.蛋白质的行为 蛋白质所带电荷取决于它的等电点(PI)和色谱柱中的PH值。当柱中的PH低于蛋白质的PI时,蛋白质带正电荷,且不与阴离于交换剂结合。而随着洗脱剂向前移动,固定相中的PH值是随着淋洗时间延长而变化的。当蛋白质移动至环境PH高于其PI时,蛋白质由带正电行变为带负电荷,并与阴离子交换剂结合。由于洗脱剂的通过,蛋白质周围的环境PH 再次低于PI时,它又带正电荷,并从交换剂解吸下来。随着洗脱液向柱底的迁移,上述过程将反复进行,于是各种蛋白质就在各自的等电点被洗下来,从而达到了分离的目的。 不同蛋白质具有不同的等电点,它们在被离子交换剂结合以前,移动之距离是不同的,洗脱出来的先后次序是按等电点排列的。
制备色谱柱根据固定相颗粒度和柱子的尺寸,采用不同的装柱方法,往往装填越好分离效果越好。装柱效果跟填料的颗粒度关系很大,颗粒度的减少会导致装柱的难度。一般来说,颗粒直径小于20-30um的固定相采用湿法装填。所谓“敲击-装填”技术适用于颗粒直径大于25um的固定相。湿法的目的是迫使相对稀松的固定相悬浆以高速装入色谱柱子,从而减少空隙的形成。然而,当柱直径大于20mm,所加压力为30-40bar时,高压悬浆装填技术就变得十分复杂。为将小颗粒固定相装入更大得制备型色谱柱,可采用柱长压缩技术。这种方法,先将固定相悬浆(或偶尔是干填充物)装入柱中加压,利用物理方法将其压紧。压紧的方法有两种:径向压缩和轴向压缩。湿法装柱需要一定的设备,在柱子填完后,应用有柱效的测量,对柱效低的柱子应该重填。
我用氧化铝做固定相装柱对样品进行分离可以吗?应该选用什么样的色谱柱呢?如果没色谱柱可以用酸式滴定管代替吗?就是通过离子交换树脂的方法进行是不是不行啊?我感觉不太对,想求教各位高手,请帮忙呀!
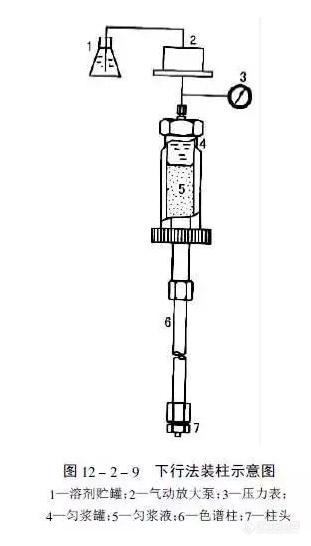
[align=center][b]色谱柱是如何填装的?[/b][/align]目前大多数实验室是购买商品预填装柱来满足分离、分析之需。液相色谱柱、特别是高效液相色谱柱的填装,需要有较高的技巧和熟练的技能。因此,有人甚至将“装柱”看作是“艺术加技术”。在有关色谱基本理论的讨论中可以得知,发生在色谱柱中总的谱带展宽效应与流动相的线速度、粒径以及溶质在流动相中的扩散系数、溶质在固定相中的扩散系数等密切相关。对于给定粒径的填料来说,能否填充成均匀而紧密的柱床,是得到高性能柱子的关键,而采用粒径细且分布均匀的优质填料,则是得到高性能柱子的最基本保证。[b]高压匀浆法装填[/b]将填料悬浮在适宜的匀浆液中制成匀浆,在其尚未沉降之前,很快以高压泵将其以很高 的流速压进柱中,便可制备出填充均匀的柱子。这是常见的分析和制备色谱柱的装填方法。常用的“标准”HPLC柱为φ4.6mm×250mm,其内腔体积约为4.2mL,约需3.5g填料。[img=,311,546]https://ng1.17img.cn/bbsfiles/images/2018/12/201812131515258469_1462_2428063_3.png!w311x546.jpg[/img][b]有关分析色谱柱的思考我认为自己装填色谱柱是有风险的,商品化色谱柱的装填是熟练技术工人千锤百炼的结果有自己独特和专用的装填设备,塞板的选择和放置都是非常精确地。如果装填技术不过关,在高压作用下,填料透过塞板,进入检测器是非常危险的,还有可能损坏检测器。所以尽可能的选择商品化的色谱柱本身是有质量保证的!本文部分节选于化工信息网微信,经作者整理加工而成[/b]
近年来离子色谱研究的一个重要趋势是研究各种分离效率高, 选择性好, 分析速度快, 可同时分析阴离子和阳离子的色谱柱. 研究的重点是将涂覆有生物表面活性剂的物质作离子色谱固定相, 并已在光学异构体和无机离子分离分析方面展示出独特的优越性和发展潜力. 1994年, Hu Wezhi等人首先采用在一分子内含有正负电荷的两性离子分子的表面活性剂作色谱固定相, 开创了静电离子色谱法. 本文利用自制的静电离子色谱柱, 选用不同种类流动相, 对含有不同阴离子的钠盐进行分离, 并初步探讨在磁场中静电离子色谱的保留行为. 1 实验部分 1.1 仪器和试剂 LC-4A高效液相色谱仪; RID-2AS示差析光检测器, C-R2A数据处理机. 静电离子色谱柱(自制), 流动相分别为水, 10 mmol/L Na2HPO4-NaH2PO4缓冲液(pH=6.8), 2.4 mmol/L NaHCO3和3 mmol/L Na2CO3; 1 mmol/L十二烷基磺酸钠. 所用试剂均为优级纯或分析纯; 溶液用二次蒸馏水按常规配制. 1.2 色谱柱制备和分离方法 把含有胆汁酸盐水溶液通过动态涂层法涂覆在ODS表面. 选用国产ODS分离柱(4.6 mm×250 mm), 将30 mmol/L的CHAPS溶液(经0.4 μm滤膜过滤)以 0.7 mL/min流速流经ODS柱80 min, 收集流出液重复上述操作2次, 然后用水冲洗40 min, 即得到在ODS柱表面涂覆一层含有正/负电荷胶束的静电离子色谱柱. 静电离子色谱法是利用在ODS载体上涂覆在同一分子内同时含有正/负两种电荷的胆汁酸诱导体胶束作固定相, 纯水或电解质溶液作流动相, 被测样品中的阴离子和阳离子通过纯粹的静电吸引、 离子配对后形成正、 负离子的缔合物(离子对), 由于被测离子的电荷和半径、 离子种类和离子浓度的不同, 因此形成的各种离子对受涂覆在固定相上的表面活性剂所带的正/负电荷静电吸引和排斥作用力不同而相互分离. 分离后的离子对进入检测器进行定量检测. 实验表明, 用本法制备的静电离子色谱柱, 连续使用3个月未发现分离效率下降. 2 结果与讨论 2.1 流动相和色谱图 分别以纯水、磷酸盐缓冲溶液为流动相得到色谱分离图 纯水为流动相时, Na2SO4和NaBr, KNO3和NaNO3, Na2S2O3和NaF+NaNO3各离子对得到分离, 但NaF与NaNO3不能分离开. 而磷酸盐为缓冲溶液时(图2), 不但Na2SO4和NaBr得到分离, 而且Na2S2O3, NaF, NaNO3也可相互分离. 由图2可见, 与纯水流动相相比, 流动相中磷酸盐的存在使各离子对保留时间和色谱峰形状发生变化, 虽然各离子对保留时间显著增加, 但出峰顺序未发生变化. 实验表明, 各离子对的保留时间与阴阳离子的半径、 电荷、 流动相种类和离子强度有关, 在流动相中加入不同种类的电解质溶液将有利于某些离子对的分离. 分别以碳酸盐、十二烷基磺酸钠为流动相得到的静电离子色谱分离图如图3所示. 由图3可见NaBr和Na2SO4可以完全分离, 与纯水为流动相相比, NaBr和Na2SO4的分离效率提高, 但保留时间增加. 特别是以十二烷基磺酸钠(表面活性剂)为流动相时, 使NaBr的保留时间延长(见图3(b)), 这说明表面活性剂的存在将对离子对的分离效率产生重要影响. 可以认为, 在流动相中加入电解质溶液, 除样品离子与固定相相互作用外, 流动相中电解质也参与了与固定相之间的静电吸引和排斥作用, 由于各离子对和电解质与固定相相互竞争的静电作用, 提高了各离子对的分离度. 2.2 流动相流速影响 当流动相流速不同时, 各离子对的保留时间发生改变. 纯水为流动相时, NaBr和Na2SO4离子对的保留时间与纯水流速的关系. 实验表明, 当采用不同种类流动相时, 随着流动相流速的增加, 保留时间都有不同程度的缩短. 但要根据被分离的离子对的分离效率和分析速度来选择流动相流速, 本实验选择流动相流速为0.6 mL/min. 2.3 外加磁场对静电离子色谱分离的影响 将静电离子色谱置于静态磁场(Nb磁铁, 160 mm×30 mm)中, 考察各离子对的分离效率和保留时间. 实验表明, 在外加磁场作用下, 纯水为流动相时, NaNO3和Na2S2O3离子对的保留时间稍向后位移(见图5), 但二者的峰形状未发生变化. 这可能是在离子对形成和洗脱过程中, 由于外加磁场的作用, 使形成的离子对与涂覆在载体上胆汁酸盐胶束所带的正负电荷静电吸引和排斥作用力发生变化, 打破了原来的平衡状态, 使离子对的保留时间发生位移.
应邀参加体育赛,色谱县令乐开怀,随同前往有三君,A君B君和C君,A君长着极性相,常与碱性有来往,B君温柔又善良,不左不右好心肠,C君外貌并不洋,私下与酸谈对象。 色谱县令坐上轿,前面三君来开道,一路正在往前赶,遇到情况不一般,绿女红男路两边,硅胶基质路上现,不酸不碱没有盐,貌似甲醇与水在中间。 A君显得很怠慢,一见绿女不想前,拉在后面嘴真甜,还想留影做留念。 B君什么都不见,一心一意保安全。 C君跑在最前边,摇摇欲试跑得欢,虽然没有强保留,但有尾巴在后头。 色谱县令连忙喊,A君为何走得慢,C君等等本县官…… 这时县令心里着急,却陡然想起色谱柱分离——这现象虽然与色谱无关,但貌似与色谱分离有缘! 中性,酸性化合物在中性条件下,具有较好的保留,碱性化合物容易受硅醇活性的影响引起拖尾。 有些碱性化合物,在具有显著硅醇活性固定相的色谱柱上大部分都会发生拖尾现象,而且在中性pH(6~8)比在酸性pH(3)条件下更易发生。 中性,和酸性化合物一般不受影响,一些碱性化合物更易受到此效应的影响。 说时迟那时快,色谱县令登上检阅台,三君进行热身赛,全力争夺金银牌。 首先进行游泳赛,先把规则晒一晒,游泳赛道有规定:第一赛道显酸性,第二赛道呈碱性,硅胶基质键合相,羟基藏在泳道旁;中间流体甲醇水,体积比例正相当;池中温度正适宜,极性相比较大滴;三人一道同时比,名次分出三二一。 第一赛道已上场,三君优势不一样,各有诀窍心中藏,面对泳道有幻想,浑身聚集正能量,只等发令往前闯! 呯……一声发令枪响,哗……三君冲入赛塘,这可是要命的比量…… 色谱县令看得清亮,C君很快沉入池塘,若隐若现像捉迷藏;B君悠然自得往前闯,环境基本没有影响;A君却是一如既往,发挥相对比较正常,色谱县官连连赞赏,鼓励A君继续发扬。本次比赛排名A——B——C。 此时,县令心中窃喜,这不正是色谱分离? 中性,和酸性化合物在酸性的条件下,具有较好的保留,有的会发生拖尾。 某些碱性化合物在酸性的条件下,发生拖尾现象,甚至没有保留,提前出柱。 酸类化合物在酸性条件下,有时会引起峰的展宽和拖尾,主要由于硅胶固定相的吸附——纠正由此类原因引起的拖尾,就应提高流动相中缓冲盐的浓度来抑制二次反应,降低流动相的pH使硅醇和溶质质子化,必要时可以向流动相中加入竞争性的酸,改善峰型,达到更好的分离效果。 第二赛道接着上场,三君表现又会怎样,不要着急请看比赛现场! 发令枪一声鸣响,三君一起冲进泳塘,这次比赛不太一样:A君立马将身隐藏,不知不觉早出池塘;B君竭尽全力往前闯,整个赛程痛断心肠;C君表现比较顽强,小小差错比较正常,总体发挥值得赞赏,赢得冠军美名远扬;本次比赛排名C——B——A。 色谱县令看傻了眼,A君让他产生失望感,总体来说还不错,不过都有拖尾巴。三人一道超限量,争抢第一太慌忙。条件不适调配方,因人而异不勉强。 三君泳赛已完毕,问题暴露很彻底。不言而喻不多言,色谱分离在里面。http://ng1.17img.cn/bbsfiles/images/2016/03/201603231943_588030_2960432_3.png 碱性化合物在碱性的条件下,具有较好的保留,但中性化合物和碱性化合物在碱性条件下,有时会出现拖尾——解决的办法提高流动相的PH值,抑制碱性化合物的电离,使其为分子状态。 固定相表面的酸性硅醇基可以形成与碱性化合物反应的离子交换位点,经反相HPLC分离某些化合物时,这种离子交换反应常常引起峰的保留(二次保留)和峰拖尾。 对于一个碱性化合物,在无盐流动相下保留时间过长,那么可以采用控制流动相为低pH条件,使其达到完全解离,增加其极性,达到缩短分离时间的目的。如果分离的化合物pKa比较低(酸性化合物),在无盐流动相下保留时间比较长,可以采用控制流动相为高一些的pH条件,道理相同。对于保留时间过短的采用相反的调整方式即可, 当进样量超过柱子的容量,样品峰会呈现一个直角三角形。当更多的样品量注入时,峰的前端变得很尖而后端就拖尾更严重。 另一个现象就是色谱柱过载后保留时间会随样品量的增加而提前。 游泳比赛已结束,稍作休整进入下一步,后面的赛事更残酷,三君便要下功夫,比赛要有好基础,切记不要出事故。 色谱县令看得明,每个赛点都很清,有话想对三君言,他们已在赛道前。无奈回到观赏台,也许赛事更精彩! 下面进行跨栏赛,三君状态有好坏。A君身高体重大,矮子一见吓趴下,虽然优势比较大,赛道并不适合他。B君小巧又玲珑,伶俐机动好名声,自信赛出高水平,努力争创第一名。C君B君像孪生,只是不如B聪明,总结经验记心中,赛出风格显威名。 三君耳闻令枪响,如龙似虎奔前方,A君好像被栏挡,一脚摔在赛道旁,B君C君受影响,三人跌在栏板上,A君倒下起不来,大赛提前被淘汰,B君机灵觉醒快,恢复状态把路带,C君随后跟其上,仅排第二把名扬。 色谱县令观其景,评价三君各不同,A君确实不适应,摔倒也在料想中,身高体大便臃肿,堵了赛道没功名,B君C君都拖尾,埋怨A君伤感情。 这个道理很显明,分离原理在其中: 对于不适应色谱柱检测的化合物,污染色谱柱的可能性很大,被污染的色谱柱,影响正常检测,使被测组分出现拖尾现象,甚至不出峰。 这场大赛进行中,色谱县令主意生,一声令下招三君,总结失败啥原因…… http://ng1.17img.cn/bbsfiles/images/2017/10/2015071305022999_01_2960432_3.png
极性色谱柱是以极性来达到分离目的的吗?那么温度对分离度的影响是怎样的?我用的仪器是气相连顶空做啤酒中的风味物质,一周前用结果还可以,关机也一切正常,但是这次一开机空运行时候出现的状况像是严重污染或是流失,但我不清楚怎样区分,只是用温度老化色谱柱,情况倒是好转了一些,但是所有条件不变的前提下我的有些峰分不开了,调试温度效果不明显,所以想知道极性柱到底是以什么达到分离效果的,改什么可以有所好转
各位有色谱方法开发经验的前辈:现有两个问题需请教1.对于高浓度主峰,峰宽很宽,有6分钟样子,在紧随其后有1杂质峰,与主峰分离度只有0.8,色谱条件除了色谱柱可以更换外,其他条件均不能改变,那么用何种色谱柱可以提高两者的分离度为1.5以上;2.哪类色谱柱更适合于分析高浓度化合物;谢谢各位赐教,不胜感激!
维权声明:本文为环烯醚萜原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。老生常谈——开放ODS柱色谱在分离纯化中的应用什么是ODS? ODS是英文octadecyl silane的缩写,意思是十八烷基硅烷,是以硅胶为基质键合的C18填料,属于反相色谱。ODS柱色谱,简单地说,就是指用ODS装成的色谱柱啦。“开放”一词,是指未对色谱柱施加任何压力,让其在重力作用下洗脱;相对于开放ODS柱色谱,有中低压柱色谱,高低柱色谱等等。 我们平时所说的反相HPLC,一定程度上来说,其实也可以说是ODS柱色谱,只不过它的分离效果更好,还配备了紫外或者示差等高级地检测手段,其实质还是属于反相柱色谱。适用范围有哪些? 首先需要说明:ODS在分离纯化的过程中,起着极为巨大的作用!! 就化合物极性而言,ODS适合分离极性中等偏大的化合物类型。对于极性较小的化合物,应该考虑用硅胶、凝胶等手段进行分离纯化,绝对不要尝试ODS,唯一的后果只能是:样品全部死吸附,根本不可能洗脱!! 某些行业,前处理一般是萃取,比如环己烷/石油醚、乙酸乙酯/氯仿、正丁醇、水。水层的、正丁醇层的样品,一般都可以用ODS进行分离纯化;乙酸乙酯层的样品,极性偏大的部分可以考虑用ODS;至于环己烷层的样品,千万不要使用ODS,那将是:上样量多少,死吸附就有多少!! 就化合物分类而言,ODS对于黄酮苷类、环烯醚萜苷类、糖苷类等成分都能有一定的分离效果,也有很多成功的分离纯化实例。但是,对于苷元类化合物,则需要慎重考虑,其实还是极性大小的问题:苷元类化合物,一般极性较小。如何装柱、上样、洗脱? 装柱:新买来的ODS,用甲醇浸泡过夜后即可装柱。具体的装柱方法,跟硅胶的装柱子法是一样的,记得用甲醇装柱就行。装完以后,置换成起始流动相系统,即可投入使用了。 上样:分为两种,一种是湿法上样,另一种是拌样。湿法上样,不必多说,就是将样品溶解至一定体积(强烈建议用起始流动相溶解,但体积不可过大,太大相当于原点变大,分离度变差),然后上样;至于拌样,很多的观点表示ODS不应该拌样,我在这里指出,依我个人经验来看,拌样是可以的,尤其对于一些溶解性较差的样品,拌样后分离的效果,比湿法上样好很多,大家可以尝试。(所谓拌样,就是指将你的样品溶解,然后从柱子里面掏出小部分ODS,然后进行拌匀,注意不要过载) 洗脱过程:如果你有ODS薄层板,你可以先点板看看样品大概的极性大小。如果你没有ODS板,你拿到的是“盲样”,一般可以采取常规的梯度洗脱,如水——30%甲醇/水——50%甲醇/水——70%甲醇/水——100%甲醇,然后依据各流分样品量的大小进一步进行细分;经过常规的梯度洗脱以后,假设,你的样品集中在50%的甲醇/水部分,进行细分的时候,你就可以选择40%甲醇/水——45%甲醇/水——50%甲醇/水——100%甲醇这样的梯度。 流动相的选择:其实就是反相流动相,无非就是甲醇/水,乙腈/水,流动相中也可以加入一些其他物质。我曾经很多次加入乙酸,用来改善拖尾的现象(点ODS薄层板分析过)。至于缓冲盐,我没有试过,具体情况不太了解。洗脱样品的如何处理? 洗脱下来的样品,可用硅胶薄层板进行点板分析,然后将相同流分进行合并,也可以采用HPLC检测合并。 我认为,对于一些量小的流分,相差不是很大的,尽量合并,避免样品的分散; 对于一些量大的流分,可合可不合,反正量大,合与不合的效果是一样的(无非就是多占点空间); 从ODS上洗脱的流分,很可能是纯品;易结晶的样品,会在溶剂挥发的过程中结晶析出来,要注意观察;柱子被污染如何处理? 污染是正常的,见过那么多,也用过那么多ODS柱子,没有哪一根能在使用一段时间后保持“洁白无瑕”的。 被污染,一般情况下就是用甲醇冲洗,一直到冲洗液蒸干没有杂质为止,就可以进行下一批样品的分离了。 也许有人问:你这么处理彻底吗?回答是否定的,但是,对于ODS柱色谱,这样的处理已经足够了。 道理很简单,用ODS进行分离的样品,一般极性不会很小,70%甲醇/水基本能全部冲洗下来。现在已经用甲醇冲洗得差不多,在你对下一批样品进行分离的时候,上一批残留的杂质也就只有100%的甲醇能洗脱下来,根本不会影响。 如果一定要处理,可以采用甲醇:异丙醇=1:1冲洗,这种做法,算是终极做法了。

维权声明:本文为yangliguo007原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。浅析硅胶分配色谱在天然产物分离中的应用背景介绍 我们通常所讲的硅胶柱色谱是指硅胶吸附色谱,其分离原理在于依据待分离化合物与硅胶表面的硅醇基的吸附力不同,从而实现化合物的分离。而硅胶柱除了依据吸附原理分离化合物外,还可以依据分配原理实现化合物的分离,即硅胶分配色谱,本人依据实践经验对硅胶分配色谱相关事宜简述如下,希望对各位朋友有所帮助。什么是硅胶分配色谱?谈到分配,就要存在两种互不相溶的溶剂系统(这有别于硅胶吸附色谱,吸附色谱所用溶剂为单一系统,可能由两相组成,但这两相肯定互溶为一个系统),极性大的溶剂系统吸附在硅胶(支持剂)上,分离过程中不移动,称为为固定相;极性小的溶剂系统作为洗脱剂,分离过程中从柱子上慢慢移动下来,称为流动相。在整个分离过程中,待分离化合物不断地在固定相和流动相之间反复分配,从而实现分离。注意:在三相系统中,我们要分清固定相与流动相,以氯仿-甲醇-水为例,流动相为水饱和的氯仿-甲醇,固定相为氯仿饱和的甲醇-水。硅胶分配色谱的应用范围?原则上讲各类化合物均可利用硅胶分配色谱实现分离,但实际工作中硅胶分配色谱用的较少,主要用于一些水溶性较大的化合物的分离,如皂苷、糖类、酚类化合物等。硅胶分配色谱常用展开系统有哪些?氯仿-甲醇-水;乙酸乙酯-乙醇-水;水饱和的正丁醇;正丁醇-乙酸乙酯-水;氯仿-甲醇-乙酸乙酯-水。硅胶分配色谱注意事项有哪些?⑴固定相与流动相必须预先相互饱和,否则,当流动相流过固定相时,会把固定相从支持剂(硅胶)上夺下来,慢慢的只剩下支持剂了,此时,已不是分配色谱了,必然导致分离的失败。⑵虽然硅胶分配色谱洗脱时使用两种或三种溶剂,但装柱时最好使用一种溶剂(为了装的均匀),所以我们应先用一种溶剂装柱,然后再将其置换成起始溶剂。⑶在洗脱过程中,要尽量使待分离化合物在两相溶剂间达到平衡,所以流动相的流速要慢一些。⑷一般来讲,生物碱或酸性物质常用缓冲溶液作为固定相。硅胶分配色谱之个人应用:硅胶分配色谱广泛用于各种皂苷的分离纯化中,如人参皂苷在用氯仿-甲醇(吸附色谱)展开时为一条直线,分不开;但采用氯仿-甲醇-水(分配色谱)展开时,效果不错,见下图:展开剂:氯仿-甲醇-水;显色剂:浓硫酸-香草醛http://ng1.17img.cn/bbsfiles/images/2010/09/201009272100_247555_1745326_3.jpghttp://ng1.17img.cn/bbsfiles/images/2010/09/201009272100_247556_1745326_3.jpg6、后记 理论上讲,部分人参皂苷可以通过硅胶分配色谱拿到纯品,但由于种种原因,后续进一步纯化工作搁置,敬请谅解。http://ng1.17img.cn/bbsfiles/images/2010/09/201009300952_248163_1745326_3.jpghttp://ng1.17img.cn/bbsfiles/images/2010/09/
各位色友们好,我想对:油酸酰胺、芥酸酰胺、乙氧基化脂肪胺。进行纯度分析不知用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法能分析吗,由于这三种样品都是粉状的用什么做溶剂,用什么色谱柱分离。有做过的朋友请留下您的宝贵意见!感谢中.......
1、色谱长度色谱长度与分离度通常成正比。色谱柱越长,组分之间分辩效果越好,但色谱柱越长压降越大,而输入的压力是有限的。色谱柱过长会增大进出口压力比,相反会降低分离度。通常采用的柱长2m~4m,内径2mm,毛细管柱长度可达20m~150m,内径为0.2mm。2、色谱柱填料颗粒大小填料的粒子越细,由于表面积增加,分辩效果越好,分离度就越高。但是颗粒极细时可能会增大柱压降,也会起反作用。一般采用惰性、多孔的固体颗粒。多由硅藻土或玻璃珠制成,分析不同极性的微生物化合物,为了获得最适的分离条件,要求有不同固定相的载体。3、柱温气体在液体中的溶解度或在固体表面的吸附程度都随温度增高而降低,在气液色谱分析中,当超过一定温度时,静态的液体通常会从色谱柱中挥发掉,所以选择柱温时应考虑到样品的沸点。一般是略低于样品沸点的平均值。4、载气种类常用的载气有 氮气、氢气等。其中氢气、氦气的分子量较小,有利于提高分析速度,但浓度较高的介质易在其间形成扩散,影响分离度,所以在实际测量中氢气、氦气一般都用在介质浓度较低的区域并提高其流速,减少扩散的影响。5、载气流速介质在固定相上的滞留时间,主要取决于介质自身的特性(挥发性,极性等)和载气的流速。所以流速快慢直接影响分离度。
氢型,钙型,钾钠,铵型阳离子色谱的分离特性,不同色谱填料的分离效果(文献资料最好)
一.载气及流速1. 载气对柱效的影响:主要表现在组分在载气中的扩散系数D m(g)上,它与载气分子量的平方根成反比,即同一组分在分子量较大的载气中有较小的D m(g) 。根据速率方程:(1)涡流扩散项与载气流速无关;(2)当载气流速 u 小时,分子扩散项对柱效的影响是主要的,因此选用分子量较大的载气,如 N2、Ar,可使组分的扩散系数 D m(g)较小,从而减小分子扩散的影响,提高柱效;(3)当载气流速 u 较大时,传质阻力项对柱效的影响起主导作用,因此选用分子量较小的气体,如 H2、He 作载气可以减小气相传质阻力,提高柱效。 2. 流速(u)对柱效的影响:从速率方程可知,分子扩散项与流速成反比,传质阻力项与流速成正比,所以要使理论塔板高度H最小,柱效最高,必有一最佳流速。对于选定的色谱柱,在不同载气流速下测定塔板高度,作 H-u 图。由图可见,曲线上的最低点,塔板高度最小,柱效最高。该点所对应均流速即为最佳载气流速。在实际分析中,为了缩短分析时间,选用的载气流速稍高于最佳流速。二. 固定液的配比 又称为液担比。 从速率方程式可知,固定液的配比主要影响Csu,降低df,可使Csu减小从而提高柱效。但固定液用量太少,易存在活性中心,致使峰形拖尾;且会引起柱容量下降,进样量减少。在填充柱色谱中,液担比一般为 5%~25%。三. 柱温的选择 重要操作参数,主要影响来自于K、k、D m(g)、Ds(l);从而直接影响分离效能和分析速度。柱温与 R和 t 密切相关。提高 t,可以改善 Cu,有利于提高 R,缩短 t。但是提高柱温又会增加B/u 导致 R 降低,r21变小。但降低 t 又会使分析时间增长。 在实际分析中应兼顾这几方面因素,选择原则是在是在难分离物质对能得到良好的分离,分析时间适宜且峰形不托尾的前提下,尽可能采用较低的柱温。同时,选用的柱温不能高于色谱柱中固定液的最高使用温度(通常低20-50℃)。 对于沸程宽的多组分混合物可采用“程序升温法”,可以使混合物中低沸点和高沸点的组分都能获得良好的分离。四. 气化温度的选择 气化温度的选择主要取决于待测试样的挥发性、沸点范围。稳定性等因素。气化温度一般选在组分的沸点或稍高于其沸点,以保证试样完全气化。对于热稳定性较差的试样,气化温度不能过高,以防试样分解。五. 色谱柱长和内径的选择 能使待测组分达到预期的分离效果,尽可能使用较短的色谱柱。一般常用的填充柱为l~3m。填充色谱柱内径为3~4mm。六.进样时间和进样量的选择 1. 进样迅速(塞子状)——防止色谱峰扩张; 2. 进样量要适当:在检测器灵敏度允许下,尽可能少的进样量:液体样0.1~10ul,气体试样为0.1~10ml
在测试中心液相色谱组呆了20多年,见过无数的客户,不同的客户对色谱的理解不一。很多人认为色谱就是打一针,出个谱图而已,容易的很,跟他们的科研档次无法比。觉得样品给你了,你必须做出来,而且很快得到其所需要的结果,全然不管你的仪器能否满足要求。做不好或者不想做,就会去告状,服务态度不好之类的。所以一旦征求意见,必然出现各种各样的服务问题。测试人员的地位在学校可见一斑。也有少数本身做液相色谱的,这些人沟通起来非常融洽,因为知道其实际做起来不容易,可惜这类的客户仅有百分之几。在色谱分析的三大分支中,我对液相、离子熟悉,对气相只是很了解,没动手做过。对于这三大类型,其实在实际中做的差别是很大的。先以我精通的离子色谱而言,我几乎涉及了所有的类型,离子色谱能否做关键在于设备,常规的很简单,特殊的全靠设备支撑,因为大部分离子色谱的分析都是优化的方法,固定的模式做起来并不难。但非常规的样品,则难度大大增加,即使同一个组分,由于基体差别,分析方案也是千差万别。也就是常规的很简单,特殊的则很难。现在厂家离子色谱方法开发就是一种特化的过程。离子色谱主要分析离子以及一些极性的化合物,表面上看应用范围比较窄,其实在很多领域有很好的应用,可以解决液相色谱无法解决的一些问题。对于气相色谱,复杂性比离子色谱要高,因为被测的有机化合物种类大大增加,但从气相的结构看,其载气的选择是非常有限的,主要靠色谱柱(极性,非极性,弱极性等),分离则依赖温度的程序升温,它真正的变化在色谱柱,在一般的分析中,大多变化在温度,柱子的变化并不多。因此对于气相色谱,基本就几根柱子。当然一些特别的检测则需要更高级特殊的装置,这跟离子色谱一样。由于受沸点的制约,气相色谱的应用受到很大的限制。而对于液相色谱,就我20年的经历,我认为其复杂性远远高于离子色谱和气相色谱。因为其变化比前二者更多,一是液相色谱分离有很多机理,每种机理都有对应的色谱柱类型,液相色谱的分离机理大约有十来个,很少有人会用过全部机理类型的色谱柱。虽然反相是最常见的分离手段,但由于反相的广泛使用,C18柱的变化类型极多差异很大,这不同C18柱之间的差异有时不亚于不同机理之间的差异。二是,液相色谱最大变化是流动相,不仅有机相类型有变,添加剂类型和浓度有变,不同pH差别很大,面对变化无穷的样品,这个流动相选择变化规律全靠长期的经验积累,很难用文字一言以蔽之。三是,液相色谱的检测器类型最多,离子色谱就三种,气相四五种,而液相色谱的检测器有十来种,相互之间差别极大,不同的检测器对色谱分离机理也有很大的选择性。因此要做好一张液相色谱图,很多情况下只能是你现有条件下的最佳分离,并不是这个化合物的最佳分析条件。对于特殊样品的分析,液相色谱更多的依赖于检测器和柱子的变化,同离子色谱不同。给你一个样品,用那类色谱(液相、气相还是离子),什么柱和条件,则完全依赖你的功底和阅历,当你拥有尽可能多的仪器装备,你才能充分发挥你的能力,依据化合物的特点,样品的特性,选择合适的仪器和配置,做出最佳的色谱图。
在做样品时发现,有的用C18的色谱柱分离效果不好的物质,如换用C8的色谱柱,分离状况会得到改善,哪位大侠能指点下,这两种色谱柱在选择分离物质时有什么不同?也可以点击:http://www.instrument.com.cn/bbs/shtml/20070911/976436/进行更多相关信息的获取
操作条件对于色谱分离有很大影响。 柱长,柱内径:一般讲,柱管增长,可改善分离能力,短则组分馏出的快些;柱内径小分离效果好,柱内径大处理量大,但柱内径过大,将导致担体不能均匀地分布在色谱柱中。分析用柱管一般内径为3-6毫米,柱长为1-4米。 柱温:是一个重要的操作变数,直接影响分离效能和分析速度。选择柱温的根据是混合物的沸点范围,固定液的配比和鉴定器的灵敏度。提高柱温可缩短分析时间;降低柱温可使色谱柱选择性增大,有利于组分的分离和色谱柱稳定性提高,柱寿命延长。一般采用等于或高于数十度于样品的平均沸点的柱温为较合适,对易挥发样用低柱温,不易挥发的样品采用高柱温。 载气流速:载气流速是决定色谱分离的重要原因之一。一般讲流速高色谱峰狭,反之则宽些,但流速过高或过低对分离都有不利的影响。流速要求要平稳,常用的流速范围每分钟在10-100亳升之间。 固定相:固定相是由固体吸附剂或涂有固定液的担体构成。(1)固体吸附剂或担体粗细:一般采用40-60目、60-80目、80-100目。当用同等长度的柱子,颗粒细的分离效率就要比粗的好些。(2)固定液含量:固定液含量对分离效率的影响很大,它与担体的重量比一般用15%-25%。比例过大有损于分离,比例过小会使色谱峰拖尾。 进样:一般讲进样快,进样量小,进样温度高其分离效果好。对进液体样,速度要快,汽化温度要高于样品中高沸点组分的沸点值,一次汽化,保证色谱峰形不致展宽、使柱效高。当进样量在一定限度时,色谱峰的半峰宽是不变的。若进样量过多就会造成色谱柱超载。一般讲柱长增加四倍,样品的许可量增加一倍。对于常规分析,液体进样量为1-20微升;气体进样量为0.1-5毫升。
液相色谱中死时间几种测定方法1:有响应的溶剂出峰时间为死时间。2:进样后的阀切换峰,对应的时间为死时间。3:工作站中输入色谱柱的空余体积或孔隙率,自动计算。(对于C18柱,也可以用硝酸钠或硫脲等在色谱柱上完全不保留组分的出峰时间来测定死时间。)影响分离度的因素有三个因素控制两个色谱峰之间的分离度——容量因子,选择性,柱效容量因子反映样品分子和固定相及流动相之间的作用力,选择性是说明色谱系统区分两个或多个色谱峰的能力,柱效与色谱峰的宽度有关,很明显要达到一定的分离度,宽色谱峰要比窄色谱峰需要更大的分离度选择性。理论塔板数越高柱效越高,柱效的高低受柱内效应和柱外效应的影响。选择性是固定相区分两个被分离样品组分的能力,用容量因子之比进行计算,它是两个被分离色谱峰顶点距离的量度,如果选择性是Ⅰ,则两个组分完全不能分离。选择性数值越高,分离越好。由于选择性取决于被分离物的物理和化学结构,流动相和固定相,流动相组成,PH,色谱柱温度,流动相添加剂,因此,尽量优化实验条件提高选择性以降低成本。容量因子为物质的特性,当分析条件一定时,容量因子为固定值。溶剂的洗脱强度与其极性有关:反相色谱:溶剂的极性越强,洗脱强度越弱。正相色谱:溶剂的极性越强,洗脱能力越强。(注意:不可以使用纯水作为正想色谱的流动相)一般样品分析要求:容量因子大于2小于5
美国赛分科技(Sepax Technologies Inc. )致力于开发生产化学与生物分离科学、生物表面科学和蛋白质组学研究(proteomics)领域的产品,包括高分辩率的高效液相仪器、色谱柱、配件和用于DNA测序和蛋白质分离的新型毛细管涂布材料与毛细管电泳仪,以及为微芯片分离和DNA、蛋白质微序列提供最好的表面技术与分离技术。 Sepax Technologies Inc.创新的尺寸排阻色谱柱(凝胶色谱柱)的填料是以刚性的高纯度球型硅胶为基质,利用独特的表面修饰技术在表面通过共价化学键合亲水性基团而成,该固定相具有亲水性并且是中性的,可以消除与生物大分子(特别是蛋白质)的非特异性相互作用,Sepax Nanofilm SEC系列尺寸排阻色谱柱具有分离的高效率与高选择性。pH适用范围为2-8.5,可使用与水完全互溶的有机溶剂,如乙腈、丙酮、甲醇或乙醇等。Sepax Nanofilm SEC系列尺寸排阻色谱柱适用于分离蛋白质和多肽类生物大分子样品以及天然与合成高分子物质。Sepax CNT SEC尺寸排阻色谱柱可以用于分离制备纳米物质,如碳钠米管、钠米棒。流动相不仅可以用缓冲溶液,也可以使用有机溶剂,如乙腈、甲醇、四氢呋喃等。 Sepax Proteomix系列离子交换色谱柱的填料是以刚性、球形、化学和机械性能都非常优异的高度交联的聚苯乙烯-二乙烯基苯(PS/DVB)聚合物为基质、树脂表面涂覆一层纳米厚度的中性的亲水性聚合物薄膜、在亲水性薄层的表面通过共价化学键合致密且均匀的离子交换功能基团而成。亲水性的薄层完全覆盖疏水的树脂表面,可以消除与生物分子之间的非特异性结合作用,从而达到高效分离,并且可以获得非常高的回收率。PS/DVB 树脂分为无孔与有孔两种。Sepax Proteomix离子交换固定相有键合磺酸根的强阳离子交换(SCX)、羧酸根的弱阳离子交换(WCX)、季胺的强阴离子交换(SAX)、叔胺的弱阴离子交换(WAX)四种。Sepax Proteomix系列离子交换色谱柱可以耐受高温(80℃)与高压(4,000psi),其pH适用范围为2-12,适用于分离蛋白质、低聚核苷酸和多肽类生物样品。流动相的选择范围广,可以是水,也可以是乙腈、甲醇等有机溶剂,还可以是缓冲盐溶液,如磷酸盐、tris、醋酸盐等。 Sepax Technologies Inc.已开发出独特的表面涂布技术,使聚合反应仅在表面上发生,可用于涂布目前市场上最细的毛细管柱(直径小于5μm)。此独特的技术能够在毛细管的内表面均一涂布厚度可控(1~50nm)的中性、阳性或阴性聚合物薄层。这些涂布的毛细管柱具有可控或可逆转的EOF,在毛细管电泳中是一高度可靠和高效率的分离工具,它已广泛应用于高通量分析中,如蛋白质组学研究。 在生物化学分离领域,Sepax Technologies Inc.也为小分子分离提供完整系列的、高质量的正相与反相HPLC柱,包括C18、C8、C4、C2、苯基柱、腈基柱、氨基柱、硅胶柱、混合型的离子交换柱HP-SCX与SAX以及宽pH范围的聚合物填料(poly-PS/DVB)柱等。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=19417]产品资料[/url]
1. 是不是所以的混合物均可用柱色谱分离?柱色谱是万能分离方法吗?2.含有金属物质的分离一般用什么样的溶剂较好?
[color=#444444]各位大佬,有机磷盐能用柱色谱进行分离吗。[/color]
氢型,钙型,钾钠,铵型阳离子色谱的分离特性,不同色谱填料的分离效果(文献资料最好)
为什么说色谱分离技术的分离效率最高
操作条件对于色谱分离有很大影响。 柱长,柱内径:一般讲,柱管增长,可改善分离能力,短则组分馏出的快些;柱内径小分离效果好,柱内径大处理量大,但柱内径过大,将导致担体不能均匀地分布在色谱柱中。分析用柱管一般内径为3-6毫米,柱长为1-4米。 柱温:是一个重要的操作变数,直接影响分离效能和分析速度。选择柱温的根据是混合物的沸点范围,固定液的配比和鉴定器的灵敏度。提高柱温可缩短分析时间;降低柱温可使色谱柱选择性增大,有利于组分的分离和色谱柱稳定性提高,柱寿命延长。一般采用等于或高于数十度于样品的平均沸点的柱温为较合适,对易挥发样用低柱温,不易挥发的样品采用高柱温。 载气流速:载气流速是决定色谱分离的重要原因之一。一般讲流速高色谱峰狭,反之则宽些,但流速过高或过低对分离都有不利的影响。流速要求要平稳,常用的流速范围每分钟在10-100亳升之间。 固定相:固定相是由固体吸附剂或涂有固定液的担体构成。(1)固体吸附剂或担体粗细:一般采用40-60目、60-80目、80-100目。当用同等长度的柱子,颗粒细的分离效率就要比粗的好些。(2)固定液含量:固定液含量对分离效率的影响很大,它与担体的重量比一般用15%-25%。比例过大有损于分离,比例过小会使色谱峰拖尾。 进样:一般讲进样快,进样量小,进样温度高其分离效果好。对进液体样,速度要快,汽化温度要高于样品中高沸点组分的沸点值,一次汽化,保证色谱峰形不致展宽、使柱效高。当进样量在一定限度时,色谱峰的半峰宽是不变的。若进样量过多就会造成色谱柱超载。一般讲柱长增加四倍,样品的许可量增加一倍。对于常规分析,液体进样量为1-20微升;气体进样量为0.1-5毫升
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=171584]蛋白质的多维色谱分离[/url]蛋白质的多维色谱分离通常生物体内提取的蛋白质样品成分复杂,应用多维色谱进行分离的方法必将流行。文章简单介绍了多维色谱分离的理论,算是一个入门材料吧。
各位大大: 混甲酚的分离选用什么样的色谱柱呢?我现在有一款备选的FLB-cd-5025-1 这款色谱柱好贵12000一根,又没有价格适中一点的色谱柱型号推荐推荐啊!谢谢各位大大!http://simg.instrument.com.cn/bbs/images/default/em09509.gif
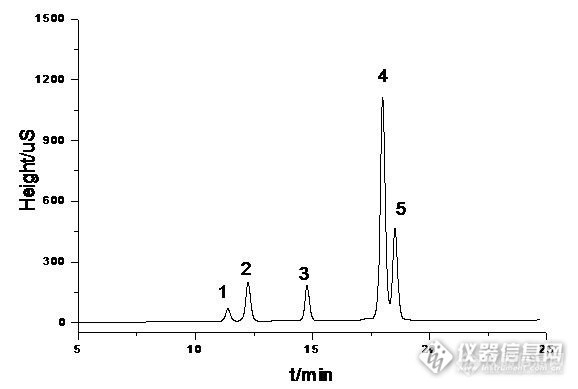
五种芳环磺酸盐的液相色谱分离方法浅谈 1-萘磺酸钠,2-萘磺酸钠,蒽醌1,5-二磺酸钠、蒽醌1,8-二磺酸钾和氨基萘酚-二磺酸钠五种物质均为强极性芳环磺酸盐化合物,在水溶液中完全电离成离子状态。在液相色谱分析中,五种物质的保留性质相似;因其为离子状态,C18反相柱对其没有保留,无法将其成功分离。本分析方法中采用离子对-反相色谱方法对其进行分离。具体分析条件和色谱分离图如下: 表1 色谱分析条件分析仪器U3000 HPLC 系统 色谱柱Diamonsil®(钻石)C18200*4.6mm,5um流动相A乙腈梯度洗脱:30minA: 20% ___ 45%B0.1%TBA+0.3%磷酸二氢钾pH6.5 温度30℃ 流速1mL/min 检测波长222nm http://ng1.17img.cn/bbsfiles/images/2016/09/201609141634_609777_3137073_3.jpg 图1 五种芳环磺酸盐的液相色谱分离图 1:蒽醌1,5-二磺酸钠,2:氨基萘酚-二磺酸钠,3:蒽醌1,8-二磺酸钾,4:1-萘磺酸钠,5:2-萘磺酸钠总结: 从色谱条件分析,本方法使用的是常规的反相C18色谱柱,在流动相中加入离子对试剂的方法增强保留性,用磷酸二氢钾调节pH至近中性。方法建立过程中发现pH和乙腈的比例对五种物质的分离影响较大,溶液的pH的大小影响芳环磺酸盐在水溶液中的分子形态,酸性溶液中,各物质形成成分子,中性和碱性条件下电离成离子状态,碱性溶液中有利于与离子对试剂的结合,但考虑到仪器和色谱柱不耐碱性能,选择中性范围较为合适。流动相中乙腈的比例对各物质在色谱柱中的保留时间影响。经过多次试验发现,梯度条件能较理想的将物种五种物质分开,而在等度条件下无法实现,特别是蒽醌1,5-二磺酸钠和氨基萘酚-二磺酸钠,1-萘磺酸那和2-萘磺酸钠两组性能保留性能相似的物质较难分开。 谱分离图来看,三种芳环二磺酸盐和萘磺酸盐完全分开,分离效果较好。蒽醌1,5-二磺酸钠和蒽醌1,8-二磺酸钾因空间结构差异,所表现出来的保留性有明显的区别,因此可以较好的分离。1-萘磺酸钠和2-萘磺酸钠结构性质非常相似,化学性质也相近,较难分离,目前还未建立将两者完全分离的方法。图中所示分离度不如其他物质理想。
离子色谱的分离机理主要是离子交换,有3种分离方式,它们是高效离子交换色谱(HPIC)、离子排斥色谱 (HPIEC)和离子对色谱 (MPIC)。那选用色谱柱是否要根据这个来呢?
求高手指点: 目标分离物:丁酮&乙酸乙酯目前使用色谱柱为:Elite-624 PE 600参数:柱子:50摄氏度 保留9min 以4摄氏度/分 升温至180 载气:N2目前还未能将其分离,保留时间一致;可有高人做过此分离,恳请分享下参数! [em09511]
废水中甲醇分析 ,甲醇含量小于100mg/L自填装:1/8英寸1.8米10%PEG20M填充柱,1克PEG20M(上海安普购Carbowax 20M,外贴的试剂标签覆盖原有标签?)溶于四氯化碳中,加入9克101酸洗硅烷化白色担体60-80目(天津博瑞健和色谱技术有限公司,白色担体中有5%左右黑色杂质?)搅拌蒸干后装柱(空气中?水浴加热温度有些高85度左右?),N2载气200度老化8小时,水峰、甲醇峰分离不开?降柱温也分离不开?是固定液浓度不够,准备试验填装30%PEG20M固定液。 原机自带没有问题:1/8英寸1.8米10%PEG20M填充柱(目数不详),FID检测器分析废水中甲醇,柱温90度;汽化室150度;检测器250度,N2载气20ml/分,干扰峰(水峰)1.7分钟(峰形差);甲醇峰:2.75分钟(峰形好)