求助各位, 我需要用0.5mM的NaOH溶液做流动相,但是工程师说钠离子不挥发不能用来做流动相,用太长时间会在质谱中聚集并可能结晶堵塞管道,可是我的研究中又必须要用,那么有什么脱盐装置是可以安在液质之间的吗?如果不用NaOH,有哪位大神用过氨水来做分离的吗?我现在用的是Thermal Fisher的Carbopac PA1 的阴离子交换柱,请问流动相如果用氨水分离效果会好吗?急求答案,谢过!
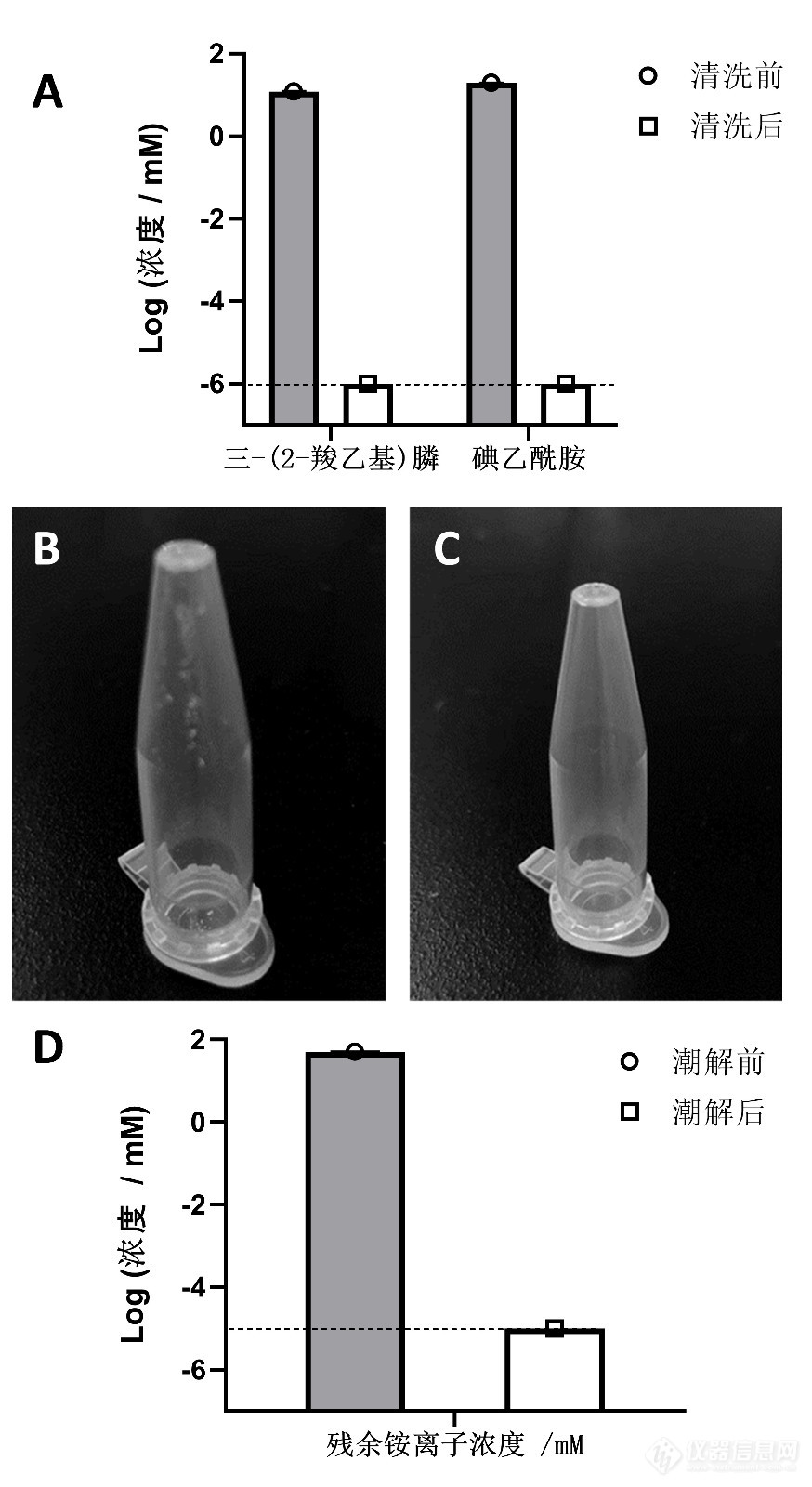
[align=center]免脱盐柱除盐的蛋白组学前处理方法[/align][align=center]季学猛,史爱莹,张 燕,王 硕[/align][align=center](南开大学 医学院, 天津 300071)[/align]摘 要:现有的蛋白组样品前处理中脱盐柱除盐的方法存在步骤繁多、易损失微量样品等缺点。这里,一种超滤管辅助酶解及加热潮解除盐的蛋白组学前处理方法被提出。具体而言,是利用超滤管辅助,通过离心在酶解前将缓冲液置换成碳酸氢铵溶液,酶解后多肽溶液中的碳酸氢铵被加热除去,最终得到脱盐的纯净多肽。该方法操作简便,无需洗脱步骤,可以方便地与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]直接衔接,而且可以减少前处理引起的氨基酸残基去酰胺和氧化修饰,有利于蛋白组学及其蛋白修饰分析。关键词:蛋白组学;样品前处理;脱盐柱 加热 碳酸氢铵中图分类号:O657.63 文献标识码:[align=center]An Improved Proteomic Pretreatment Method without Desalination Column [/align][align=center]JI Xuemeng,SHI Aiying,ZHANG Yan,WANG Shuo[/align][align=center](School of Medicine, Nankai University, Tianjin 300071, China)[/align]Abstract: The existing method for desalting protein samples in pre-processing is associated with several drawbacks, including a high number of procedural steps and the potential loss of minute sample quantities. In this context, a novel protein sample pre-processing method is proposed, which utilizes ultrafiltration tubes to assist in enzymatic digestion and employs heat-induced desalting. Specifically, the ultrafiltration tubes are employed to facilitate the replacement of the buffer solution with an ammonium bicarbonate solution via centrifugation before enzymatic digestion. Subsequently, following enzymatic digestion, the ammonium bicarbonate within the peptide solution is removed through a heating process, ultimately yielding desalted and pure peptides. This method offers simplicity in operation, eliminates the need for elution steps, enables seamless integration with [url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url], and serves to mitigate the formation of amino acid residue deamidation and oxidation modifications that may be induced during pre-processing, thereby benefiting both proteomics and protein modification analyses.Key words: Proteomic analysis Sample pre-treatment Desalting column Heating Ammonium bicarbonate通过高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]串联质谱对生物系统中全蛋白进行定性定量,已经成为一种主流的分析工具。通过高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]串联质谱对生物系统中全蛋白进行定性定量,已经成为一种主流的分析工具。大规模的蛋白组研究依赖于蛋白被切割成肽段,然后进行后续的定性定量分析。目前,蛋白组学样品前处理方法通常使用胰蛋白酶将蛋白质样品切割成多肽。胰蛋白酶的最适作用pH为7.5-8.5[sup][back=yellow][1][/back][/sup],碳酸氢铵是质谱预处理中最常用到的一种盐,50mM碳酸氢铵水溶液可以提供酶解过程需要的弱碱性环境。然而,碳酸氢铵在酶解过程中大量存在,容易影响后续质谱分析。目前常用反相C18树脂去除盐和缓冲液[sup][back=yellow][2-4][/back][/sup]。多肽在高水相流动相中与反相柱结合,盐和缓冲液被洗去,然后用高有机相流动相洗脱多肽。然而,多肽对C18吸附性有差异,包括磷酸化多肽在内的亲水肽可能不能与C18树脂很好地结合,疏水性强的多肽与C18树脂可能结合牢固,不易被洗脱[sup][back=yellow][5-7][/back][/sup],这些问题可能导致样品的损失;而且,用来洗脱多肽的有机溶剂还需进一步通过真空离心干燥去除,极性较小的有机溶剂还可能溶解塑料制品中聚合物,造成多肽样品的聚合物污染,导致质谱峰偏移[sup][back=yellow][8,9][/back][/sup]。这些问题可能导致蛋白质检出种类减少、重复性差、甚至无检出信号等问题。基于这种临床和科研上的需求, 需要对蛋白组学样品前处理方法进行改进。1? 实验原理蛋白质组学是后基因组时代的产物。基因需要依赖于转录和翻译后后的产物蛋白质行使功能。基因组是固定不变的,而蛋白质组会响应环境的变化。因此,同一生物在生物体不同部位、生命的不同时期以及不同的环境中,具有不同的蛋白质表达。人类基因组测序计划的完成并没有给人提供解开生命的密钥,科学家把兴趣转到蛋白质,希望通过蛋白质组的研究来进一步解开生命的本质。目前鸟枪法是蛋白质组学分析应用最广的分析策略[sup][back=yellow][10-12][/back][/sup]。该方法先将蛋白酶解成肽段,然后通过色谱分离肽段混合物,再用质谱的电喷雾电离(ESI)技术将肽段碎裂,根据碎裂谱图的离子峰信息进行数据库搜索来鉴定肽段,最后将鉴定的肽段进行组装、重新归并为蛋白质[sup][back=yellow][13][/back][/sup]。电喷雾电离具体包括以下几个过程:样品首先通过一个毛细管喷针被喷出来,进入质谱仪,在喷针的外面用鞘气加热样品,辅助样品的雾化。加热雾化过程中溶液中的流动相或者溶剂挥发,剩下的气态离子在毛细管喷针尖端被电离。这些离子在质谱仪入口处被真空抽到质谱仪里,电场驱动进入质谱仪进行分子量的检测[sup][back=yellow][14][/back][/sup]。一般来说,电喷雾质谱法对盐类的容忍度较低。一方面是因为小分子盐类在电喷雾系统中存在较强的竞争性电离效应,从而导致强烈的离子抑制效应,使待测物的灵敏度明显降低[sup][back=yellow][15][/back][/sup]。其次,盐类的存在会产生一系列的离子加成峰,这使得谱图的解析变得复杂[sup][back=yellow][16-18][/back][/sup]。此外,过多的盐分会腐蚀和污染质谱系统的硬件,严重时导致硬件损坏,需要及时清洗[sup][back=yellow][19][/back][/sup]。因此,蛋白组学样品前处理过程中,脱盐步骤是非常必要的。2? 存在问题为减少机器的损坏,并且提高检测灵敏度,上机前一般都会要求对蛋白组学样品脱盐处理。目前脱盐常用的方法是反相C18树脂脱盐柱法。脱盐柱法分为结合、清洗、洗脱三步。首先,利用疏水相互作用,多肽在高水相流动相中与反相柱结合。然后,使用水反复清洗盐和缓冲液。最后,用有机溶剂破坏多肽与C18的结合,洗脱多肽。然而,该方法存在一系列的弊端,比如多肽对C18吸附性有差异,包括磷酸化多肽在内的亲水性比较强的多肽可能不能与C18树脂很好地结合,会造成结合阶段的样品损失,而疏水性强的多肽与C18树脂结合牢固,洗脱阶段却难以洗脱下来,所以亲水性强的多肽和疏水性强的多肽都会在脱盐柱脱盐过程中损失,进而导致样品的选择性偏好,会损坏质谱结果的客观性。而且,最终多肽样品上机前需要在0.1%甲酸溶液中溶解,因此,有机溶剂洗脱后的多肽不能很好的与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]衔接,还需真空离心干燥去除有机溶剂。使用有机溶剂洗脱样品可能会造成样品的PEG聚合物污染,导致质谱峰偏移。这些问题导致脱盐柱脱盐后的蛋白组学样品重复性差、检出蛋白质种类低问题,因此亟需一种脱盐柱脱盐的替代方法。3? 改进措施将酶解前超滤管中的缓冲液通过反复离心置换成碳酸氢铵水溶液。酶解后利用碳酸氢铵加热潮解的特性除去多肽溶液中的碳酸氢铵成分,最终得到纯净的多肽。多肽样品溶解在0.1%甲酸溶液中后可以直接上机检测。4? 改进后效果首先取100μg蛋白样品,用6 M 盐酸胍稀释至400μL。加入10μL 500mM 三-(2-羧乙基)膦、 8 μL 1M 碘乙酰胺,混匀。室温避光振荡反应 40 min。将样品转移至10KD超滤管,室温10000g离心30分钟。加入400 μL 50mM碳酸氢铵溶液置换5次。用200 μL 50 mM 碳酸氢铵溶液垂悬,加入2μg胰蛋白酶,于37 ℃酶解过夜。10000g离心10分钟,收集滤液。真空离心干燥滤液,干燥后观察管底,如有白色盐粉末,加入少量超纯水溶解白色盐,转入75℃金属浴烘干,碳酸氢铵在烘干过程中分解挥发。上机前加入50μL 0.1% 甲酸溶液,装入超洁净样品瓶,上机检测。4.1 潮解脱盐效果评估利用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)分析表明,在五次洗涤步骤后 ,三-(2-羧乙基)膦和碘乙酰胺的浓度至少降低了100000倍,并且降至检测阈值以下,表明五次连续洗涤足以将杂质降低到不干扰的水平([color=#c45911]图1A[/color])。酶解后,离心[color=black]收集到滤液200μL。试纸法测滤液pH,呈弱碱性(pH 7.5-8.0)。[/color]多肽样品经过真空离心干燥后,观察管底,可见白色盐粉末,如[color=#c45911]图1B[/color]所示。加入2μL 超纯水溶解白色盐,转入75℃金属浴烘干,碳酸氢铵在烘干过程中分解挥发,白色粉末消失,如[color=#c45911]图1C[/color]所示。用200[color=black]μL超纯水复溶多肽,测pH为7.0。[/color]这些结果说明碳酸氢铵被去除。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411135143_5595_5680383_3.jpg[/img][color=#c45911]图1 [/color][color=#c45911]脱盐的效果与验证。A:高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)分析图;B:多肽干燥后可观察到管壁上残留白色盐分;C:加热碳酸氢铵潮解后管壁上白色盐分消失; D:潮解前后的氨离子浓度对比图。数据来自三次独立重复实验(n = 3)。[/color]为了直接确认碳酸氢铵的去除,采用分光光度尼斯勒试剂法对氨浓度进行定量。分光光度尼斯勒试剂法包括以下步骤:将样品用去离子水稀释,向样品中加入一定量的分光光度尼斯勒试剂,封闭瓶子并摇动,让混合物静置5-10分钟,使用分光光度计在紫外-可见光谱范围内的波长630nm处测量吸光度,通过相同方法处理一系列氨标准溶液,测量吸光度值并绘制标准曲线,最后,通过使用样品的吸光度值查找标准曲线上相应的氨离子浓度来计算样品浓度。实验结果显示氨离子浓度从50 mM降低到不到10 nM,证实了通过热力潮解去除碳酸氢铵的有效性([color=#c45911]图1D[/color])4.2 新方法对不同分子量的蛋白质进行的蛋白质回收性能的研究蛋白质的分子量分布范围很大,从几千到几十万道尔顿不等。为了研究在酶解之前,超滤管辅助酶解及加热潮解除盐的蛋白组学前处理方法(以下称为新方法)在蛋白质回收方面是否存在偏好,在酶解前比较了溶液法(in-solution)、过滤辅助样品制备法(Filter-Aided Sample Preparation, FASP) 和本研究提出的新方法中的蛋白质回收率。蛋白质定量采用了与还原剂相容的BCA蛋白质测定试剂盒,吸光度在分光光度计(Agilent Technologies,美国)上以562纳米的波长读取。在本研究中测试的蛋白质包括细胞色素C(约12.4 kDa)、绿色荧光蛋白(GFP)(约27 kDa)、抗凝血酶III(约58 kDa)、转铁蛋白(约80 kDa)、免疫球蛋白G(IgG)(约150 kDa)和纤维连接蛋白(具有广泛的分子量范围,通常超过200 kDa)。实验进行了三次重复,并使用小提琴图来呈现结果。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411144597_3153_5680383_3.jpg[/img][color=#c45911]图2使用溶液法、过滤辅助样品制备法和新方法对不同分子量的蛋白质进行的蛋白质回收率评估图。[/color]结果清晰地表明,在不同分子量的蛋白质中,无论是在溶液法、过滤辅助样品制备法还是新方法中,所有三种方法在蛋白质回收率方面均达到了80%以上(图2)。总的来说,在所测试的分子量范围内,过滤辅助样品制备法和新方法之间的蛋白质回收率没有显著差异。然而,值得注意的是,对于低分子量蛋白质,溶液方法展现了略高的回收率,这可能归因于使用了10 kDa分子量截止滤器。 具体来说,对于低分子量蛋白质细胞色素C,过滤辅助样品制备法和新方法的平均回收率分别为85%和83%,而溶液方法的回收率为96%。然而,随着蛋白质分子量的增加,过滤辅助样品制备法和新方法的回收率显著提高。例如,对于分子量约为27 kDa的绿色荧光蛋白(GFP),过滤辅助样品制备法和新方法的回收率约为93%,而溶液方法对GFP蛋白的回收率为97%。此外,对于分子量超过50 kDa的较大蛋白质,如抗凝血酶III,使用过滤辅助样品制备法和新方法的回收率与溶液方法没有显著差异,均达到约98%。可见,本发明方法在蛋白质酶解之前对不同分子量的蛋白质回收率能达到83%至98%范围,达到了较好的蛋白截流作用。4.3新方法中潮解脱盐对不同大小和亲水性的肽段回收性能的研究为了探究不同方法酶解后对不同分子量的肽段进行潮解除盐的潜在偏好,对潮解法脱盐和C18脱盐的多肽回收率进行比较分析。在脱盐过程之前和之后,使用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)测量了肽段的浓度。使用了一个反相柱,并监测了220 nm处的吸光度。受测试的肽段包括亮氨酸脑啡肽(分子量:555.68 Da,由五个氨基酸组成)、血管加压素(分子量:1084.23 Da,由九个氨基酸组成)、生长抑素(分子量:约1637.89 Da,由十四个氨基酸组成)和胰高血糖素(分子量:约3483.87 Da,由二十九个氨基酸残基组成),三次重复实验的结果呈现在小提琴图中(图3A)。结果显示,通过C18柱脱盐得到的回收率在75%到90%之间,与肽段的分子量之间没有明显的相关性。这可能是由于在C18柱脱盐过程中样品损失的因素,比如柱子的结合性能和洗脱效率。相比之下,潮解脱盐在所有测试的肽段中实现了超过96%的回收率,而不受它们的分子量影响。这一结果表明,潮解脱盐在回收不同分子量的肽段方面非常有效。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411149252_2052_5680383_3.jpg[/img][color=#c45911]图3肽段回收性能比较。A:使用两种脱盐方法(潮解去盐和脱盐柱脱盐)评估不同分子量的肽段回收率;B:使用潮解去盐和脱盐柱脱盐对高亲水性和疏水性肽段进行比较回收分析;实验均进行了三次独立的重复。[/color]接下来,使用C18脱盐柱脱盐和潮解脱盐对高亲水性和疏水性肽段的回收率进行了比较分析。选择了抗菌肽(Cat. No. LL37-05MG)和细胞穿膜肽(CAS号:697226-52-1)分别代表疏水性和亲水性肽段。结果显示,脱盐柱脱盐对抗菌肽和细胞穿膜肽的回收率相对较低,平均回收率分别为45%和39%。相比之下,新方法潮解除盐后对这两种肽段都实现了超过95%的回收率,而不受它们的亲水性影响(图3B)。这些发现表明,脱盐柱脱盐中的回收率受到肽段亲水性的影响。这可能归因于脱盐柱脱盐依赖于疏水相互作用将肽段结合到C18柱树脂上,然后使用亲水溶剂进行洗脱,这可能导致不同亲水性的肽段被选择性保留。另一方面,潮解脱盐提供了原位操作的优势,从而在脱盐过程中避免了肽段的损失。我们的研究结果表明,潮解脱盐不会导致肽段的损失,并实现了比C18柱脱盐更高的多肽回收率。4.4 新方法在实际蛋白质组学分析中的应用比较小鼠肠组织用PBS磷酸盐缓冲液润洗两次,以去除任何残留物质,然后与蛋白酶抑制剂混合。将组织使用组织研磨仪进行破壁,然后在冰浴中使用超声波(200W)裂解,直到悬浮液变清澈。通过孔径为0.22μm的微孔滤器纯化得到裂解物。使用BCA分析试剂盒测定蛋白质浓度。随后,采用三种方法进行了酶解:溶液法、过滤辅助样品制备法和新方法[color=black](蛋白组学原始数据保存于PXD044209)[/color]。酶解后,使用高性能[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]将蛋白质分离,并使用QE质谱仪进行分析。具体来说,酶解后的肽样品采用Q Exactive Plus质谱仪联用EASY nano[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统进行分析,该系统配备了EASY纳米电喷雾接口。色谱装置包括Pepmap纳米捕获柱(C18,5 μm,100 ?,100 μm × 2 cm)和EASY-Spray柱(Pepmap RSLC,C18,2 μm,100 ?,50 μm × 15 cm)。在色谱梯度中使用溶剂A(0.1%甲酸)和溶剂B(80% CH3CN/0.1%甲酸),梯度如下:0–8% B持续3分钟,8–28% B持续42分钟,28–38% B持续5分钟,38–100% B持续10分钟。质谱数据经Maxquant软件处理,Maxquant分析考虑至少具有两个肽段的蛋白质,并根据特定的参数和说明搜索UniProt数据库。修饰方面,半胱氨酸的烷基化修饰被设置为固定修饰,而氧化(M)被考虑为可变修饰。设置蛋白质为胰蛋白酶的特异性剪切,最多允许两个漏切位点。片段质量容差设置为0.02 Da。为确保可靠的鉴定,要求蛋白质和肽段的最大假阳性发现率(FDR)均为1.0%。蛋白质的鉴定基于至少有一个唯一的肽段鉴定,而蛋白质的定量是通过计算每个蛋白质的唯一肽段的中位数来执行的。每种方法产生了不同的蛋白质鉴定结果,如[color=#c45911]图4A[/color]所示。总体而言,新方法鉴定的蛋白质数量最多(2975±52),其次是过滤辅助样品制备法(2964±102),最后是溶液法(2803±57)。每种方法的已鉴定肽段数量如[color=#c45911]图4B[/color]所示。使用溶液法,鉴定了10931±16个独特的肽段。过滤辅助样品制备法和新方法分别鉴定了10981±48和10959±23个独特的肽段。平均而言,在溶液法中每个蛋白质匹配到3.90个独有肽段,在过滤辅助样品制备法中匹配到3.70个独有肽段,在新方法方法中匹配到3.68个独有肽段。这表明新方法表现出最高的蛋白质鉴定效率。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411151149_9928_5680383_3.png[/img][color=#c45911]图 4 不同蛋白组学前处理方法在实际蛋白质组学分析中的应用。A:使用三种方法(溶液法、过滤辅助样品制备法和新方法)比较蛋白质鉴定结果;图B为每种消化方法鉴定的独特肽段,结果代表了三次生物学实验;图C为使用组内相关系数(ICC)评估无标签定量分析的可重复性;每种方法都有三次生物学重复。[/color]随后,使用ICC评估无标签定量分析的可重复性([color=#c45911]图4C[/color])。发现新方法显示出最佳的可重复性,平均ICC值为0.622,有1375个蛋白质的ICC值大于0.4。过滤辅助样品制备法表现出稍弱的可重复性,平均ICC值为0.533,有1180个蛋白质的ICC值大于0.4。相比之下,溶液法的可重复性最差,平均ICC值仅为0.477,有1017个蛋白质的ICC值大于0.4。4.5 新方法有助于减少氨基酸残基的不利修饰[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411148874_7284_5680383_3.png[/img][color=#c45911]图 5 样品制备方法对氨基酸残基修饰的影响。A:比较三种样品制备方法(溶液法、过滤辅助样品制备法和新方法)引入的单氧化修饰;B:三种方法对氨基酸残基脱酰胺化修饰的影响,该实验作为生物学重复进行了三次。[/color]氧化修饰和去酰胺修饰通常在天然蛋白质和多肽样本中被观察到,研究这些修饰对于理解蛋白质的固有应激至关重要。然而,样品预处理引起的人为修饰可能会对修饰蛋白组学分析带来挑战。为了评估在样品处理过程中引入的这些不利修饰对样品的影响,我们比较了三种方法:溶液法、过滤辅助样品制备法和新方法,关于它们对氧化和去酰胺修饰的影响。我们鉴定和定量了不同数量的单氧化和去酰胺修饰,但未检测到双氧化和三氧化修饰。在这三种方法中,新方法和溶液法显示出相对较低水平的单氧化修饰([color=#c45911]图5A[/color])。此外,新方法还减少了非必要的去酰胺修饰([color=#c45911]图5B[/color]),鉴定了具有去酰胺修饰的蛋白质最少(473±8),其次是溶液法(485±23),最后是过滤辅助样品制备法(544±23)。考虑到有机溶剂中的羟基可以与酰胺键形成氢键,因此在溶液法和过滤辅助样品制备法中观察到较高水平的去酰胺修饰可能归因于在去盐过程中使用有机溶剂,而新方法更加高效的样品处理可能有助于减少人为的氧化修饰。总之,新方法有效减少了氨基酸残基的去酰胺和氧化修饰。5? 结语南开大学医学院实验室改进的蛋白组学样品前处理方法,利用超滤管将酶解缓冲液置换成碳酸氢铵水溶液,酶解后利用碳酸氢铵加热潮解的特性除去多肽溶液中的碳酸氢铵成分,最终得到纯净的多肽,可以方便地与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]直接衔接,进行质谱分析。与传统的方法相比,无样品损失,提高了蛋白质检测数目,同时操作简单快捷。值得注意的是,与传统的过滤辅助样品制备法相比,新方法在最小化氧化和去酰胺修饰方面表现出卓越的性能。这一创新的方法代表了蛋白质组学分析的重大进展,为质谱分析提供可靠和高效的结果。虽然新方法和过滤辅助样品制备法在使用基于滤膜的蛋白质截断方法方面有相似之处,但它们之间的关键区别变得显而易见。过滤辅助样品制备法在酶解前需要进行更彻底的洗涤,通常需要使用碳酸氢铵水溶液进行5次洗涤,而过滤辅助样品制备法通常只需要进行2次洗涤[sup][color=black][back=yellow][20][/back][/color][/sup]。此外,新方法可以通过轻度加热实现原位样品脱盐和纯化方法的完美集成。相比之下,过滤辅助样品制备法通常需要额外的脱盐柱纯化步骤。与新方法和过滤辅助样品制备法不同,悬浮陷阱法(S-Trap)采用三维多孔材料来捕获蛋白质 [sup][color=black][back=yellow][21][/back][/color][/sup]。由于其较大(亚微米级)的孔径,悬浮陷阱法滤膜的每个离心循环只需1分钟,实现了比本文中新方法和过滤辅助样品制备法更高的洗涤效率[sup][color=black][back=yellow][22][/back][/color][/sup]。然而,值得注意的是,与悬浮陷阱法相比,超滤管目前的成本较低,悬浮陷阱法在酶解后需要多次使用有机溶剂(如甲酸和乙腈)进行洗涤。悬浮陷阱法还涉及额外的脱盐柱纯化步骤,增加了实验的复杂性。总之,本文描述了一种独特的蛋白组学前处理方式,显著提高了高效样品制备的能力。6? 数据可用性声明本研究所有数据均包含在论文中。所有的蛋白质组学质谱数据已被存储在ProteomeXchange,并可通过访问编号PXD044209:[url=https://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD044209][color=#0563c1]https://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD044209[/color][/url] [sup][color=black][back=yellow][23, 24][/back][/color][/sup]来获取。参考文献(References):[1]? Solari F A, Kollipara L, Sickmann A, et al. Two birds with one stone: parallel quantification of proteome and phosphoproteome using iTRAQ[M]//Proteomics in Systems Biology. Humana Press, New York, NY, 2016: 25-41.[2]? Zhang G, Xue W, Dai J, et al. Quantitative proteomics analysis reveals proteins and pathways associated with anthocyanin accumulation in barley[J]. Food chemistry, 2019, 298: 124973.[3]? Zhu Z, Chen T, Wang Z, et al. Integrated Proteomics and Metabolomics Link Acne to the Action Mechanisms of Cryptotanshinone Intervention[J]. Frontiers in pharmacology, 2021, 12: 700696.[4]? Liu C, Si X, Yan S, et al. Development of the C12Im-Cl-assisted method for rapid sample preparation in proteomic application[J]. Analytical Methods, 2021, 13(6): 776-781.[5]? Liu Q, Shi J, Sun J, et al. Graphene and graphene oxide sheets supported on silica as versatile and high‐performance adsorbents for solid‐phase extraction[J]. Angewandte Chemie, 2011, 123(26): 6035-6039.[6]? Kecskemeti A, Bako J, Csarnovics I, et al. Development of an enzymatic reactor applying spontaneously adsorbed trypsin on the surface of a PDMS microfluidic device[J]. Analytical and bioanalytical chemistry, 2017, 409(14): 3573-3585.[7]? Li L, Wu R, Yan G, et al. A novel method to isolate protein N-terminal peptides from proteome samples using sulfydryl tagging and gold-nanoparticle-based depletion[J]. Analytical and bioanalytical chemistry, 2016, 408(2): 441-448.[8]? Shieh I F, Lee C Y, Shiea J. Eliminating the interferences from TRIS buffer and SDS in protein analysis by fused-droplet electrospray ionization mass spectrometry[J]. Journal of Proteome Research, 2005, 4(2): 606-612.[9]? LaCava J, Molloy K R, Taylor M S, et al. Affinity proteomics to study endogenous protein complexes: pointers, pitfalls, preferences and perspectives[J]. Biotechniques, 2015, 58(3): 103-119.[10]? Dupree E J, Jayathirtha M, Yorkey H, et al. A critical review of bottom-up proteomics: The good, the bad, and the future of this field[J]. Proteomes, 2020, 8(3): 14.[11]? Duong V A, Park J M, Lee H. Review of three-dimensional liquid chromatography platforms for bottom-up proteomics[J]. International Journal of Molecular Sciences, 2020, 21(4): 1524.[12]? 翟芳. 鸟枪法蛋白质组学质谱平台性能标准和参考数据集的建立[D]. 重庆大学, 2018.[13]? Shen Y, Toli? N, Zhao R, et al. High-throughput proteomics using high-efficiency multiple-capillary liquid chromatography with on-line high-performance ESI FTICR mass spectrometry[J]. Analytical Chemistry, 2001, 73(13): 3011-3021.[14]? Livesay E A, Tang K, Taylor B K, et al. Fully automated four-column capillary LC? MS system for maximizing throughput in proteomic analyses[J]. Analytical chemistry, 2008, 80(1): 294-302.[15]? Ca?as B, Pi?eiro C, Calvo E, et al. Trends in sample preparation for classical and second generation proteomics[J]. Journal of chromatography A, 2007, 1153(1-2): 235-258.[16]? Wheeler A R, Moon H, Bird C A, et al. Digital microfluidics with in-line sample purification for proteomics analyses with MALDI-MS[J]. Analytical chemistry, 2005, 77(2): 534-540.[17]? Kim K H, Compton P D, Tran J C, et al. Online matrix removal platform for coupling gel-based separations to whole protein electrospray ionization mass spectrometry[J]. Journal of proteome research, 2015, 14(5): 2199-2206.[18]? Wang C, Wu Z, Yuan J, et al. Simplified quantitative glycomics using the stable isotope label Girard’s reagent p by electrospray ionization mass spectrometry[J]. Journal of Proteome Research, 2014, 13(2): 372-384.[19]? Righetti P G, Boschetti E, Lomas L, et al. Protein Equalizer? Technology: The quest for a “democratic proteome”[J]. Proteomics, 2006, 6(14): 3980-3992.[20]? Homsi C, Rajan R E, Minati R, et al. A Rapid and Efficient Method for the Extraction of Histone Proteins[J]. Journal of Proteome Research, 2023, 22(8): 2765-2773.[21]? Fu Q, Murray C I, Karpov O A, et al. Automated proteomic sample preparation: The key component for high throughput and quantitative mass spectrometry analysis[J]. Mass Spectrometry Reviews, 2023, 42(2): 873-886.[22]? Duong V A, Lee H. Bottom-Up Proteomics: Advancements in Sample Preparation[J]. International Journal of Molecular Sciences, 2023, 24(6): 5350.[23]? Ma J, Chen T, Wu S, et al. iProX: an integrated proteome resource[J]. Nucleic acids research, 2019, 47(D1): D1211-D1217.[24]? Chen T, Ma J, Liu Y, et al. iProX in 2021: connecting proteomics data sharing with big data[J]. Nucleic Acids Research, 2022, 50(D1): D1522-D1527.[size=12px]收稿日期:[/size][size=12px]2023-10-27[/size] [size=12px]修改日期:[/size][size=12px] [/size]基金项目:国家重点研发计划(32030083)。作者简历:季学猛,硕士,实验师,研究方向为微生物学、蛋白组学。E-mail:jixuemeng@nankai.edu.cn。
脱盐柱有什么要求?
多肽药物常见的纯化方法是采用凝胶柱脱盐,这个脱盐过程是什么机理啊?
在HC-C18小柱使用过程中,在加入上清液后,用水淋洗,出现了把待测物质淋洗下来的情况,而且脱盐是在这一步吗,如果不要这一步,能不能脱盐呢。如何解决这个问题。
我用阳、阴离子离子树脂层析柱对糖浆进行脱盐,结果发现,糖浆经过阳离子树脂后含糖量基本不变,但是经过阴离子树脂以后糖液中的糖基本被脱光掉了。阳离子树脂为氢型,阴离子树脂为氢氧根型,糖液中主要为:低聚糖、蔗糖、葡萄糖。请问各位大虾,阴离子树脂怎么处理能对糖浆脱盐起作用,并且能够减少阴离子树脂对糖的吸附作用。
原油脱水脱盐的原理浅析 您清楚脱盐脱水设备的脱水原理吗?如果不知道的话就学习一下吧: 脱盐设备的脱水就是在120-150℃左右温度下,原油中注入不超过占原油量约5% 的净化水将悬浮在油中的盐分溶解,同时注入一定量的破乳剂. 通过混合器的混合进入电脱盐罐,由于破乳剂的作用打破微小液滴外牢固的乳化膜,这些液滴在高压电场的作用下产生诱导偶极或带电荷,使得液滴在电场力的作用下做定向运动,原油中小水滴聚结成大水滴,在油水比重差和电场等因素作用下,水穿过油层落于罐底,罐底的水和溶解在水中的盐通过自动控制连续地自动排出,脱盐后油从罐顶集合管流出,进入脱盐原油换热部分
原油脱水脱盐的原理浅析 您清楚脱盐脱水设备的脱水原理吗?如果不知道的话就学习一下吧: 脱盐设备的脱水就是在120-150℃左右温度下,原油中注入不超过占原油量约5% 的净化水将悬浮在油中的盐分溶解,同时注入一定量的破乳剂. 通过混合器的混合进入电脱盐罐,由于破乳剂的作用打破微小液滴外牢固的乳化膜,这些液滴在高压电场的作用下产生诱导偶极或带电荷,使得液滴在电场力的作用下做定向运动,原油中小水滴聚结成大水滴,在油水比重差和电场等因素作用下,水穿过油层落于罐底,罐底的水和溶解在水中的盐通过自动控制连续地自动排出,脱盐后油从罐顶集合管流出,进入脱盐原油换热部分。
请教大伙一个问题,关于SPE C18脱盐 我的样品是小鼠肝全蛋白,经过胰酶酶切和定量标记后想在上[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]前脱盐。用的是waters的Sep Pak C18脱盐柱,样品和填料比为1:1000。 流程如下: 活化:1、1mL 100%乙腈 2、1mL 50%乙腈/50%水 平衡:0.1% FA,10倍柱体积 上样:样品用FA调至3~4,加入萃取柱中,使其按重力自然流出 清洗:1mL 0.1% FA,洗盐 洗脱:1mL 洗脱液(50%乙腈,0.1% FA),静置2min后,洗脱样品 回收穿过液,清洗液和洗脱液测肽段浓度,用的是thermo家的肽段定量试剂盒。回收效率只有60~70%。请问该如何改进流程?
大家好: 本人在纯化蛋白时需要脱盐这一步,选择sephadex G25进行,可是层析图谱中层析峰只是显示280nm处的吸光值。 本人曾尝试用AgNO3滴定,但是不是很准确,请教高手帮助
麻烦请教一下大家,要用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]检测氯吡脲,猕猴桃基质,经过实验后,样品中引入了一些难挥发盐类,NaCl、NaH2PO4、KCl、CaCl2、NaHCO3、KH2PO4、MgCl2,应该用什么手段脱盐,或者用什么小柱脱盐,如果有相关文献就更好了,谢谢了!

1.脱盐乳清粉(demineralised whey powder)个人档案姓名脱盐乳清粉http://ng1.17img.cn/bbsfiles/images/2012/12/201212301304_417263_2227357_3.png身份辅料主要应用婴幼儿配方粉座右铭努力接近母乳水平主要产地欧盟澳洲美国2.脱盐乳清粉按脱盐程度的分类 D90:脱掉90%的灰分,灰分在1.5%以下 D70:脱掉70%的灰分,灰分在3.0%以下 D50:脱掉50%的灰分,灰分在4.0%以下 D40:脱掉40%的灰分,灰分在6.5%以下http://ng1.17img.cn/bbsfiles/images/2012/12/201212301305_417266_2227357_3.png3.工艺过程溶粉→离子交换1→ 纳滤→ 电渗析→ 离子交换2→ 标准化→ 杀菌→浓缩4.检验项目类型编号检验指标检验方法感官要求1色泽目测2滋味气味鼻嗅、口尝3组织状态[color
脱盐乳清粉在检测三聚氰胺时在加入15ml三氯乙酸时沉淀的效果不好!!这是为什么?加什么才能沉淀的彻底?????谢谢
蛋白质如何脱盐?
最近在做一种注射剂产品GC分析方法,直接进样法进样,但制剂中存在氯化钠直接进样容易带进盐去,有什么好办法脱盐啊?还望同僚们指点一二,不胜感激!
我在一份RO机图纸的技术指标上看到以下两点关于脱盐率的测试,但由于经验有限,对这个不懂,请问有这个行业的同仁可以告知指导一下吗?在下不胜感激,谢谢了!1、15%回收率:纯水加标氯化钠250ppm±10,60psig,水温25±2℃,ph值7-8,回收率在15%条件下,通水30min,脱盐率≥90%。2、在标准测试条件下(水温25±2℃,ph值7-8,纯水加标氯化钠250ppm±10),通水连续运行24h后,脱盐率≥93%。这个技术要求的标准哪里找得到,或者具体的区别是什么,怎么实现这个操作的呢?
实验七 葡聚糖凝胶层析脱盐一. 目的学习凝胶层析的工作原理和操作方法掌握利用葡聚糖凝胶层析进行蛋白质脱盐的技术二. 原理凝胶层析又称凝胶过滤或排阻层析。凝胶过滤的主要装置是填充有层析介质的层析柱。1. 层析介质的特点(1)遇水为不溶解的固相;(2)是化学惰性物质;(3)离子基团含量少;(4)颗粒大小和网眼均匀;(5)机械强度较强;(6)具有可选择的多种孔径。目前使用较多的是葡聚糖凝胶、聚丙烯酰胺凝胶、琼脂糖凝胶及其衍生物。尤其葡聚糖凝胶(商品名称Sephadex)是最常用的层析介质。它是由一定平均分子量的葡聚糖和交联剂1-氯-2,3-环氧丙烷( )交联成的具有三维结构不溶于水的高分子化合物。调节葡聚糖和交联剂配比,可以获得网眼大小不同,型号各异的凝胶。当葡聚糖分子量越小,交联剂用量越大,则交联度越大,凝胶网眼越小,吸水量越小,G值也越小。G值表示每克干胶吸水量(mL)的十倍。例如Sephadex G-25其吸水量应为2.5mL/g干胶。常用的葡聚糖凝胶有多种规格,如G-10、G-15、G-25、G-50、G-75、G-100等。实验中选用何种型号应根据被分离的混合物分子的大小及工作目的来确定(参见附录五)。2. 分离原理当混合样液加到凝胶柱上,随着洗脱剂而通过凝胶柱时,分子大小不同的物质受到不同的阻滞作用。颗粒接近或大于网眼的分子,不能进入凝胶的网眼中,在重力作用下它们随着溶剂在凝胶颗粒之间沿较短流程向下流动,受到的阻滞作用小,移动速度快,先出层析柱(此现象叫作被排阻。被排阻的最小分子量称为该规格凝胶的排阻极限);而颗粒小于网眼的分子可渗入凝胶网眼之中,它们被洗脱时不断地从一个网眼穿到另一个网眼,逐层扩散,阻滞作用大,流程长,移动速度慢,因而后出层析柱。在层析柱的出口处,我们用多个试管分步收集洗脱液,就可将混合物中各组分彼此分离。当我们从生物组织中用盐析法提取蛋白质后,常需要进行蛋白质的脱盐工作,我们可采用层析介质为葡聚糖凝胶G-25(或G-15、G-50),用适当的洗脱剂进行洗脱,经凝胶层析,就可以将大分子蛋白质与小分子盐类分离。三. 实验材料及设备1. 材料含硫酸铵盐的蛋白质溶液(参见附注3)2. 器材层 析 柱:内径×柱高=1.0cm×25cm滴定台架、螺丝夹:各1刻度试管:10mL×14移 液 管:1mL×1烧 杯:250mL×1 50mL×1滴 管:2洗 耳 球:2洗瓶、试管架、移液管架、玻棒:各1四. 试剂的配制1. 葡聚糖凝胶G-25(或G-15、G-50)溶胀凝胶方法:按每个层析柱约4g的量称取葡聚糖凝胶G-25于烧杯中,加过量蒸馏水于沸水浴中溶胀2小时或在室温下溶胀6小时以上。用倾泻法除去上层漂浮的细碎凝胶,重复3~4次。操作中避免剧烈搅拌,防止破坏其交联结构。2. BaCl2溶液(1%)3. 考马斯亮蓝G-250称取0.1g考马斯亮蓝G-250,先溶于50mL95%乙醇中,再加入85%的磷酸100mL,最后用蒸馏水定容到1000mL。暗处存放。4. 脲(6mol/L)5. 洗脱剂应依据被纯化的蛋白质的不同特性而选用不同的缓冲液。五. 操作步骤1. 层析柱的准备(1) 清洗:每组取一支层析柱,用清水冲洗干净。(若玻璃柱较脏,应卸去塑料装置,先入洗液中浸泡2小时。)(2) 安装与检查:检查出口装置中尼龙绸或烧结滤板是否完好干净。安装层析柱,让其垂直固定于滴定台架上。对准出口处,放一只250mL烧杯。向层析柱内灌洗脱剂,打开出口螺旋夹,检查有无渗漏、出口乳胶管是否通畅等情况。(3) 排气泡:保持柱内一定的水位,用手指弹击柱壁,部分气泡会从溶液中上浮排出。出口处的小气泡易停留在螺旋夹附近的乳胶管内,要想法排尽,否则会影响分离结果,排气完毕,保留柱内1~2cm高水位,关紧螺旋夹。(4) 标记高度:在距顶端8~10cm处做一标记,作为衡量灌装层析介质床体高度(15~17cm)的依据。2. 装柱每组用50mL烧杯取溶胀的凝胶悬浆25~30mL,静置片刻,观察凝胶沉淀与水的体积之比,约为1:1即可,否则应作调整。轻轻搅匀杯中凝胶,用玻璃棒引流入柱,打开出水口,并不断地向柱内补充凝胶,直到凝胶沉淀高度位于标记上方约2cm为止,凝胶柱内若有气泡和断层或柱床表面干水和歪斜,都将影响分离效果。必要时,需倒出凝胶,重新装柱。3. 平衡取15mL洗脱剂,用滴管沿柱内壁旋转着缓缓流下,不可冲动胶平面,打开出水口,经洗脱液的流动,一方面清洗内壁,另一方面使胶床收紧。洗脱平衡完毕,胶床上方保留约4cm高水位,关闭出水口。此时,胶床高度≥15cm为宜。4. 准备收集取6只干净的刻度试管(除净试管内残留的水),1~6编号,并在试管2mL处作一标记,插入试管架上,为收集洗脱样品作好准备。5. 上样与收集打开出口排水,当胶床与上方水层的弯月面相切时,关闭出口,用滴管将0.2mL混合样液沿柱内壁缓缓加入,勿冲动胶面。上样完毕,打开出水口,开始收集一号管。每管收集洗脱液2mL。当样液进入胶床,其弯月面与胶平面相切时,暂停排液,用滴管将洗脱剂沿柱内壁旋转着加入1cm高水位,然后排液,至其弯月面与胶平面相切,再缓缓注入3~5cm高的洗脱剂。6. 洗脱不断向柱内加洗脱剂,保持胶床上水位3~5cm。出口流速控制在每6秒1滴,直至收集到6号管达2mL时,关闭出口。7. 鉴定另取6只干净试管,按收集顺序将洗脱液一分为二,即每管1mL,依次在试管架上排成二排。第一排每管加2滴BaCl2,根据白色沉淀多少,判断SO42-在各管中的浓度。第二排每管加1mL考马斯亮蓝G-250试剂,根据蓝色情况,判断蛋白质在各管中的浓度。将结果记录于下表中。若鉴定的第6号管中,仍有样品,表明洗脱和收集不够,需增加7号、8号……试管继续洗脱与收集,同上法鉴定其蛋白质和盐浓度情况。管 号项 目1234567891011白色沉淀量蓝色深浅8. 再生鉴定完毕,打开出水口,继续用2~3倍床体积洗脱剂洗脱,洗脱后关闭出口,以备下次使用。六. 结果处理1. 根据实验结果,在同一坐标系中,以收集的管号为横坐标,颜色深浅程度为纵坐标,绘制二条(蛋白质及(NH4)2SO4)洗脱曲线。2. 分析混合样品分离效果。七. 思考题1. 利用凝胶层析分离混合物时,怎样才能得到较好的分离效果?2. 还有哪些方法可进行蛋白质脱盐?附注1. 凝胶的再生通常层析柱经洗脱剂再生、平衡后,就可反复使用。但使用过多次后凝胶床体积变小,流速降低,凝胶污染杂质过多,甚至变色,需经再生后才可使用。再生方法有多种:如(1)用水进行逆向冲洗,再用洗脱剂平衡,便可重新使用。又如(2)把凝胶倒出,用6mol/L脲浸泡凝胶半小时,抽滤,再用水漂洗数次,除净脲,必要时重复上述操作即可重新使用。2. 凝胶的保存(1) 湿法保存,可保存几个月至一年,有多种方法: 加入防腐剂硫柳汞,使其浓度为0.005%,下次使用前,水洗除去硫柳汞。 加入几滴氯仿,摇匀存放。下次使用前用热水浴除去氯仿。(沸点60℃)。 凝胶保存在60~70%乙醇溶液中,即凝胶以部分收缩状态保存。(2) 干法保存此法操作不及湿法简便,但处理得好,凝胶存放时间长。先抽取过量水分,再向凝胶逐步加入百分浓度递增的乙醇溶液,每次停留一段时间,使凝胶逐步脱水,最后加入95%乙醇,凝胶脱手收缩。抽干,铺与搪瓷盆中,60~80℃经常翻动烘烤。若有结块,在下次膨胀时会散开的,不可用力敲碎,否则会破坏颗粒结构。3. 用盐析法分离提取麦清蛋白取10g小麦种子,粉碎。转入250mL具塞磨口锥形瓶中。加100mL蒸馏水,在康氏震荡器上震荡1小时。静置半小时,上清液以3000转/分钟离心15分钟。将上清液在布氏漏斗上(铺3~4层滤纸)抽滤。滤液应透明。用醋酸酸化滤液至pH4.7。加等体积的饱和硫酸铵溶液,边加边搅动,即有白色絮状沉淀生成。置冰箱过夜,使麦清蛋白全部盐析沉淀出来,以3000转/分钟离心20分钟,弃去上清夜,加10mL无离子水使沉淀溶解,即得麦清蛋白和硫酸铵的混合液。
(一)原理凡盐析所获得的粗制蛋白质(盐析得到的IgG)中均含有硫酸铵等盐类,这类将影响以后的纯化,所以纯化前均应除去,此过程称为“脱盐”(desalthing)。脱盐常用透析法和凝胶过滤法,这两种方法各有利弊。前者的优点是透析后析品终体积较小,但所需时间较长,且盐不易除尽;凝胶过滤法则能将盐除尽,所需时间也短,但其凝胶过滤后样品体积较大。所以,要根据具体情况选择使用。前实验中样品体积较小,凝胶达滤后样品体积不会太增加,所以选用凝胶过滤法。(二)试剂与器材(1)Sephadex G-25。(2)0.0175mol/L,pH6.7磷酸盐缓冲液。(3)奈氏(Nessler)试剂:于500ml锥形瓶内加入碘化钾150g,碘110g,汞150g及蒸馏水100ml。用力振荡7~15min,至碘的棕色开始转变时,混合液温度升高,将此瓶浸于冷水内继续振荡,直到棕色的碘转变为带绿色的碘化钾汞液为止。将上清液倾入2000ml量筒内,加蒸馏水至2000ml,混匀备用。(4)20%(W/V)磺基水杨酸溶液。(5)1.5cm×20cm层析柱。(6)黑、白比色磁盘。
脱盐乳清粉D90检测三聚氰胺,样品加入三氯乙酸和乙腈提取,超声震荡离心后滤纸过滤,完全过滤不动,有人有方法可以让样液过滤吗?
大家在[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]收峰的杂质鉴定时,脱盐浓缩有什么好的方法吗。超滤管超滤浓缩损失太大了,经常浓缩完的信号反而更低。尝试过冻干,效果也不好。大家有什么好的方法推荐吗。

[font=none][size=16px][color=#004be0]第16届原创大赛继续与中国仪器仪表学会合作。凡符合要求的原创作品将被推荐到“ 科研仪器案例库 ”,被案例库收录后,将由中国仪器仪表学会授予“科研仪器案例库收录证书”;征集活动结束后,被评为优秀案例的,将由中国科协授予“优秀案例授予证书”,助力参赛者评定职称。(注:往届获奖作品若有投递案例库的意向,可咨询主办方)[/color][/size][/font][align=center][size=18px][b]【科研仪器案例库收录文章展示】:免脱盐柱除盐的蛋白组学前处理方法[img=,690,491]https://ng1.17img.cn/bbsfiles/images/2024/01/202401191644483441_3917_3237657_3.png!w690x491.jpg[/img][img=,690,322]https://ng1.17img.cn/bbsfiles/images/2024/01/202401191645088078_8778_3237657_3.png!w690x322.jpg[/img]原文链接:[/b][url]https://bbs.instrument.com.cn/topic/8279851[/url][/size][/align]
载气瓶更换后,标准物质的出峰时间拖延了0.5min,请问各位如何解决?谢谢。(载气的纯度99.999%)
脱盐乳清粉的生产工艺中有一步是纳滤,如果纳滤膜漏了,需要怎么样监控,除了全面更换滤膜还有其他方法么?
我是做的血清白蛋白纯化,其中涉及前处理有氯化钠,这个该怎么去掉,他对质谱影响大吗,还有谁可以回答下大家水解白蛋白变为氨基酸的方法呢
如题,看别人说可以在线脱盐,没有用过,不知道是什么样的设备,是接个柱子吗?加个在线脱盐的模块要多少钱呀?
[摘要] 质谱对于现代蛋白质化学研究是一项重要的技术。也可用于蛋白组分析,在同一时间监控上千种蛋白的表达情况。首先蛋白质混合物可以用双向凝胶电泳分开,再用质谱及随后的蛋白质数据库检索对单个蛋白进行鉴定和分析。最近几年,质谱领域取得了令人鼓舞的进展,使得全自动、高通量的蛋白检测成为可能。质谱也可以用来分析蛋白的转录后调节以及研究蛋白质复合体。本文将介绍目前蛋白组研究中质谱方法的应用并对其优缺点进行讨论。关键词: 质谱;二维电泳(2-DE);蛋白组分析MALDI-TOF1 前 言蛋白组学是研究生物特定组织或细胞内表达的所有蛋白质成分,蛋白质组的一门学科。蛋白组分析一般是用双向凝胶电泳(2-DE),质谱(MS)以及数据检索来完成。2-DE要回顾到20世纪70年代初[1],但是用质谱技术对蛋白质进行鉴定和分析是在近十年内才成为可能。其中最重要的一个原因是新的软离子技术即基质辅助激光解析电离(MALDI)[2]和电喷雾电离(ESI)[3,4]技术的发展和应用,以及样本制备技术和质谱仪的发展等。从数据库中获得成指数上升的序列信息也促进了质谱技术的发展。跟转录组学中的全自动DNA微阵列技术相比,蛋白组分析需要更多的手工操作,尤其在2-DE上会出现很多问题[5,6]。尽管存在很多困难,蛋白组学的重要性还是公认的。DNA微阵列技术是建立在对mRNA稳定水平的检测上,然而蛋白组学研究的对象是细胞中最活跃的因子——蛋白质。最近有研究证明,mRNA的表达和蛋白的水平并非具有相关性[7,8]。蛋白质有转录后修饰过程,并会以不同的形式出现。而这些修饰过程是相应的DNA测序技术所不能预测的。质谱技术在蛋白质修饰分析过程中具有重要的作用。2 质谱对蛋白质的检测质谱仪是由离子源,质量分析,离子检测器,以及数据检索等单元组成。首先,被分析的分子在离子源中被离子化,然后在质量分析器里根据不同的质荷比分开,再对分开的离子进行检测。随着MALDI和EIS的出现,质谱技术已经广泛用来分析蛋白质。质量分析器有很多种,最常用的方法是将飞行时间检测器(TOF)与MALDI或三级四级串联质谱仪联用,或者将四级杆-TOF,离子阱等连接到ESI上。蛋白组分析中,可以用两种不同的方法检测电泳分离后的单个蛋白质。最简单的方法叫做肽指纹谱测定(PMF)[9~13]。这个方法是用特殊的酶对2-DE分离后的蛋白质点进行降解,产生的肽从凝胶中分离出来后再用质谱分析和检测肽的分子量。数据库检测能够产生所有蛋白质理论上的PMF,把它们和质谱分析所获得的肽片进行比较就可以得出结果。第二种方法是在质谱仪中把凝胶分离后的肽分解成片段,产生局部的氨基酸序列(序列标签)。那么就可以用分子量或者序列信息进行数据库检索[14,15]。PMF一般用MALDI-TOF来实现,序列标签可以用串联质谱技术MS-MS进行检测[16~18]。用质谱检测蛋白的灵敏性可以精确到飞摩的水平,甚至已有报道其精确度可以达到阿摩水平[19]。3 用MALDI-TOF进行肽指纹谱分析凝胶分离后的蛋白质鉴定以及肽指纹谱分析是目前质谱实验室常规使用的方法。在进行MALDI分析之前需要最优化的凝胶上消化[20~22]和脱盐过程。胰岛素是最常用的凝胶消化酶,因为它在赖氨酸和精氨酸位点能够特异性切割蛋白质,产生分子量在600~2500Da之间的小分子肽,并能够从凝胶上有效的分离出来。MALDI-TOF是质谱技术中相对简单并很容易使用的一种方式,对样本中的盐和其他污染物有很高的耐受性,这点优于ESI。提取的肽片混合物中较小的片段可以直接沉积在靶板上做PMF分析,剩下的样本可以储存起来作为以后的ESI-MS分析。如果经凝胶分离后所有的肽全用来做MALDI分析,那么样本经脱盐以后将会取得更好的结果。脱盐的过程可以用商品化的试剂盒ZipTip(Millipore),或者在凝胶电泳仪的末端放置一个小的逆向塑料柱来实现[23,24]。PMF中非常重要的一个因素就是质谱测量分子量的准确度[25]。现代的MALDI-TOF仪都具有延迟取样反射器装置,用它们检测的肽段分子量可以精确到10~30ppm。这样的精确度使得4~5个肽段足以清楚的鉴定蛋白质的分子量。MALDI产生的大多数都是单电荷离子,所以它的图谱很容易解释。4 肽质指纹谱分析的自动化为了实现高通量蛋白检测,样本准备,质谱检测,资料分析和数据检索必须实现自动化操作。目前有些实验室用机器人对蛋白质进行自动化取点,凝胶上消化,样本脱盐以及对MALDI平板进行定点测定等。而且,现代化的MALDI-TOF仪完全能够让MALDI检测自动化。资料分析和数据检索过程同样可以自动化。在进行蛋白组分析时,如果在凝胶上不用单个分离就可以对所有蛋白质进行鉴定将是非常具有诱惑力的。为此,研究人员做了很多努力,由Hochestrasser及其同事建立了一套称作分子探测术的方法(molecular scanner)[26,27]。它是将整个2-DE胶上蛋白质样本同时酶解,并将酶解片段一起原位转移至另一张膜上,再直接用MALDI- TOF 质谱对膜上样本进行整体扫描,为实现蛋白质组学研究的自动化、规模化以及临床应用提供了一个崭新的思路和方法。这种思路的优点是显而易见的,不过按照目前的方法,要普及此种技术主要的难点是,质谱扫描一张图谱所需的时间过长,如用0.4mm的精度扫描一张4cm×4cm的膜需55个小时,这就意味着一张16cm×16cm的常用膜的扫描,至少需要36天不间断的工作和大约40G的磁盘空间存储如此庞大的原始数据。5 用ESI-MS/MS的方法创建序列标签只有当被消化的蛋白存在于已有的蛋白或基因组数据库中,并且能从MALDI分析器中得到四五个肽片的数据才能成功进行。如果在EST数据库中只有目的蛋白的部分序列,那么就需要知道肽片的序列信息。创建序列标签的优势在于,用肽的分子量和序列作为数据库检索对象比只用分子量作为检索对象具有更高的特异性。有了序列标签信息后,也可以用EST数据库进行检索[28]。通常来自于一个肽上的序列标签就足以鉴定蛋白质。同MALDI相比,纳升-ESI-MS/MS费时费力,而且在做ESI分析之前必须对样本进行脱盐处理。这些问题可以通过ESI-MS与HPLC联用得到解决。做ESI分析对样本浓度很敏感,用现代化的纳升-HPLC方法可以提供很高的局部肽片凝聚物,分离后的样本可以直接用于质谱分析,而不需要再分解。当分析混合物的时候,在质谱之前做LC分离尤其重要,因为它使得数据依赖的实验(DDE)成为可能,在DDE中,所有的离子都进入检测器进行测量,如果从HPLC到质谱之间出现一个峰的话,软件将自动从质谱转换到MS/MS模式并对产生的离子进行扫描。跟纳升-ESI相比,用这个方法可以从一份标本产生更多的MS/MS数据。Yates等已经详细叙述了如何进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS全自动蛋白检测的策略[29]。
因锅炉水一般采用处理后的冷凝液和脱盐水做补水,还有必要分析锅炉水中的微量油含量和铁吗?
最近炭同位素质谱样品峰脱尾严重,请高人指点!
目的工序编号检验指标标准值检验频率检验方法脱盐乳清粉前处理溶粉1感官(溶解情况)完全溶解每罐目测、手感2脂肪提供数据每罐FT1203蛋白质4乳糖5干物质6pH值6.0~7.0每罐(3小时1次,以后毎小时1次)pH计7杂质度≤0.75mg/L每罐GB 5413.308酸度(乳酸)≤0.12%每罐(3小时1次,以后毎小时1次)GB 5413.349温度35~40℃每罐(3小时1次,以后毎小时1次)温度计离子交换Ⅰ1电导率20~30ms/cm1次/每个溶粉批次电导率仪2pH值1~31次/每个溶粉批次pH计纳滤1电导率10~20ms/cm1次/3小时电导率仪2干物质提供数据1次/3小时折光计电渗析1电导率1~30ms/cm1次/3小时电导率仪2pH值1~31次/3小时pH计离子交换Ⅱ1电导率≤200μs/cm1次/3小时电导率仪2pH值4.5~5.81次/3小时pH计3干物质提供数据1次/3小时折光计暂存(标准化前)1脂肪提供数据每罐FT1202蛋白质3乳糖4干物质5pH值4.5~5.8每罐pH计6杂质度≤0.75mg/L每罐GB 5413.307酸度(乳酸)≤0.12%6~24h,1次/2小时GB 5413.348温度5~10℃温度计9灰分提供数据每罐GB 5009.410电导率提供数据每罐电导率仪11钾提供数据每罐GB 5413.2112钙提供数据每罐13钠提供数据每罐14镁提供数据每罐15磷提供数据每罐GB 5413.2216氯提供数据每罐GB 5413.24暂存(标准化后)1脂肪提供数据每罐FT1202蛋白质3乳糖4干物质5pH值6.0~7.0每罐pH计6杂质度≤0.75mg/L每罐GB 5413.307酸度(乳酸)≤0.12%6~24h,1次/2h,24h以上,1次/1hGB 5413.348温度35~40℃温度计9灰分提供数据每罐GB 5009.410电导率提供数据每罐电导率仪脱盐乳清粉后处理杀菌、浓缩1浓度(波美度、折光度)提供数据生产前、中、后期手工法、波美计、折光计2杂质度≤0.75mg/LGB 5413.303菌落总数≤5000CFU/mL生产前、中、后期GB 4789.24大肠菌群≤10CFU/mLGB 4789.3平板计数法5芽孢总数≤200CFU/mL生产中、后期NY/T 1331 6嗜热芽孢总数≤100CFU/mL半成品1感官合格1次/吨肉眼观察,品尝滋气味2冲调性合格按标准比例冲调3水分提供数据快速水分测定仪4杂质度≤6mg/kgGB 5413.305蛋白质产品标准乳粉快速分析仪
SNT 2318-2009 动物源食品中地克珠利、妥曲珠利、妥曲珠利亚砜和妥曲珠利砜残留量的检测 高效液相色谱-质谱 质谱法