如题:离子色谱柱的柱容量有高、中、低之分,一个分析方法中所涉及的色谱柱,其柱容量是如何选择的啊,可以随意进行选用吗
色谱分析中标液稀释后,是放在容量瓶内,还是直接移入样品瓶中?
[b][color=#444444]一根极性柱对极性化合物的容量一定大于对非极性化合物的容量;[/color][color=#444444]厚膜和大口径的色谱柱,其相对柱常量也会较高;[/color][color=#444444]而溶质的保留度增加会使柱容量降低;[/color][color=#444444]如果两种溶质极性类似,后出峰的化合物更容易发生超载现象。[/color][color=#444444]其中,第三句中的保留度指的是什么?[/color][color=#444444]还有第四句为什么后出峰的更容易发生超载现象?[/color][/b]
[list][*]在色谱仪分析检测过程中,我们会接触到这样两个概念:分配系数和容量因子。然而有绝大部分色谱使用者对这两个概念并不十分了解,今天咱们就说一说什么是色谱柱的分配系数和容量因子?二者是什么关系?[/list][size=14px]分配系数和容量因子一定程度上展现色谱柱的柱效,了解影响色谱柱分离度的因素,有助于有效地使用和保养色谱柱,提高色谱柱分离度和色谱仪检测灵敏度。[/size][size=14px][/size][size=14px]分配系数是指在一定温度下,待测样品在两相间达到分配平衡时,在固定相与流动相中的浓度之比。分配系数与组分、流动相和固定相的温度、压力有关。在[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱仪[/color][/url]中,固定相确定后,分配系数主要受流动相的性质影响。在试验中主要靠调整流动相的组成配比及pH值,以获得组分间的分配系数差异及适宜的保留时间,达到分离的目的。[/size][size=14px][/size][size=14px]在流动相、固定相、温度和压力一定条件下,样品浓度很低时,分配系数只取决于组分的性质,而与浓度无关。在大多情况下,分配系数随着浓度的增大而减小,这时色谱峰为拖尾峰;而有时随着溶质浓度增大,分配系数也增大,这时色谱峰为前延峰。因此,只有尽可能减少进样量,使组分在柱内浓度降低,分配系数恒定时,才能获得正常峰。[/size][size=14px]在同一色谱条件下,样品中分配系数值大的组分在固定相中滞留时间长,后流出色谱柱;分配系数值小的组分则滞留时间短,先流出色谱柱。混合物中各组分的分配系数相差越大,越容易分离,因此混合物中各组分的分配系数不同是色谱分离的前提。[/size][size=14px][/size][b][size=14px]分配系数K和分配比k的关系:[/size][/b][size=14px][/size][b][size=14px]K=kβ[/size][/b][size=14px]β为相比率,是反映各种色谱柱柱形特点的又一个参数,β=Vm/Vs,Vm为流动相的体积,即死时间(t0)与流动相流速的乘积,Vs为色谱柱中固定相的体积。对填充柱其β值一般为6~35,对毛细管其β值为60~600。[/size][size=14px][/size][size=14px]容量因子是待测样品在两相间达到分配平衡时,在固定相与流动相中的量之比。因此容量因子也称质量分配系数。容量因子的物理意义:表示一个组分在固定相中停留的时间是不保留组分保留时间的倍数。分配系数为0时,化合物全部存在于流动相中,在固定相中不保留,停留的时间为0;分配系数越大,说明固定相对此组分的容量越大,出柱慢,保留时间越长。[/size][size=14px][/size][b][size=14px]分配系数K,容量因子k与保留时间之间有如下关系:[/size][/b][size=14px][/size][b][size=14px]k=t'R/t0,t'R=tR-t0[/size][/b][size=14px]上式说明容量因子的物理意义:表示一个组分在固定相中停留的时间(t'R)是不保留组分保留时间(t0)的几倍。[/size][size=14px]k=0时,化合物全部存在于流动相中,在固定相中不保留,t'R=0;k越大,说明固定相对此组分的容量越大,出柱慢,保留时间越长。[/size][size=14px][/size][size=14px]容量因子与分配系数的不同点是:k取决于组分、流动相、固定相的性质及温度,而与体积Vs、Vm无关 K除了与性质及温度有关外,还与Vs、Vm有关。由于t'R、t0较Vs、Vm易于测定,所以容量因子比分配系数应用更广泛。[/size]
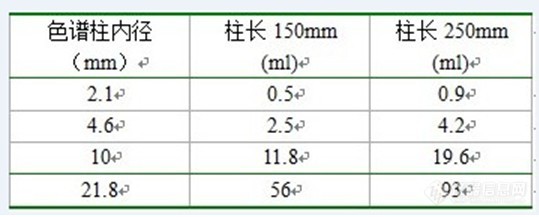
[align=center][size=4][font=宋体]浅析色谱柱的几个容量[/font][/size][/align][size=4][font=宋体][/font][/size][size=4][font=宋体]色谱柱体积:即色谱柱管的容积,V=3.14*[/font][/size][size=5][font=宋体]r[/font][/size][sup][size=4][font=宋体]2[/font][/size][/sup][size=4][font=宋体]*[/font][/size][size=4][font=仿宋]L[/font][/size][size=4][font=仿宋]。[/font][/size][size=4][font=宋体]以250*4.6mm的色谱柱为例,柱体积约为4.2ml,冲洗15倍体积约为60ml,即以1.0ml/min的流速,要冲洗60分钟。[/font][/size][size=4][font=宋体][/font][/size][size=4][font=宋体] [img]http://ng1.17img.cn/bbsfiles/images/2010/02/201002242223_202357_1638724_3.jpg[/img][/font][/size][size=4][font=宋体][/font][/size][size=4][font=宋体]容量因子:又称容量比或分配比,是在一定温度和压力下,组分在两相间分配达到平衡时的质量比。[/font][/size][size=4][font=宋体][url=http://www.ebqk.com/][color=windowtext]色谱柱[/color][/url][/font][/size][size=4][font=宋体]容量:是指色谱柱对一种溶质可容纳的最大量值,一旦超过此数值,该溶质的色谱峰就会发生畸变,也就是说常说的超载。超载的色谱峰并不均衡,而且沿固定方向变化,一般我们称之为“鲨鳍”峰。色谱柱超载常表现为色谱峰的严重拖尾,不过这种情况对[url=http://www.ebqk.com/][color=windowtext]色谱柱[/color][/url]本身没有什么影响。[/font][/size][size=4][font=宋体]在水月大姐的回复中提到:“在样品量增加到一定程度以后,柱效率迅速下降。能引起柱效率下降10%的样品量称之为柱容量。”[/font][/size][size=4][font=宋体]柱容量与固定相的极性、填料的粒径,柱内径和溶质的保留度等有关。如果色谱柱对一种溶质的容量很高,则表明该溶质与固定相的极性很相似(相似相溶),例如,一根极性柱对极性化合物的容量一定大于对非极性化合物的容量。粒径和内径大的[url=http://www.ebqk.com/][color=windowtext]色谱柱[/color][/url],其相对柱容量也会较高,如制备型色谱柱,[/font][/size][size=4][font=宋体]从分离的角度看,特别是制备纯物质的色谱分离,柱容量要大,这就需增加填充物和加大柱的内径,但柱径加大,进样量增加,柱的分离效率就会下降,势必要相应地增加柱长度,因而减慢分离速度,这是一对矛盾。故在实际工作中,常常要求在柱容量、柱效率和分析速度之间选择一个最佳的操作条件。 [/font][/size][img]http://ng1.17img.cn/bbsfiles/images/2010/02/201002242224_202358_1638724_3.jpg[/img][size=4][font=宋体]溶质的保留度增加会使柱容量降低,如果两种溶质极性类似,则后出峰的化合物更容易发生超载现象。[/font][/size][size=4][font=宋体]柱容量与固定相类型也有很大关系。表面多孔型固定相颗粒较大,多孔层厚度小,孔浅,相对死体积小,出峰迅速,柱效高,渗透性好;由于孔浅,梯度淋洗时,当流动相成分改变后.孔内外流动相成分能迅速达到平衡,机械强度高,装柱容易,其不足的是由于多孔层厚度小,因而柱容量小,最大允许样品量受到限制,适用于比较简单的样品分析及快速分析。[/font][/size][size=4][font=宋体]全多孔型固定相,由于颗粒很细,孔仍然很浅.传质速度较快,柱效高。梯度淋洗时孔内外流动相成分的平衡速度仍然较快.其最大特点是柱容量大,最大允许样品量是表面多孔型的5倍,但装填时的渗透性低,因而需要更高的操作压力.制柱比表面多孔型的难。这种固定相特别有利于痕量组分及多组分复杂混合物的分离分析。[/font][/size][size=4][font=宋体]色谱柱[/font][/size][size=4][font=宋体]超载时,要减少进样量或稀释样品或使用高容量的色谱柱。[/font][/size]
我是新手,向大家请教个问题:1. 怎么把样品浓度控制在色谱柱容量内呀?2. 如果超过色谱柱容量会出现什么结果?会损坏色谱柱吗?结果不准确吗?谢谢各位前辈了!
容量因子对色谱柱选择的影响大吗?有什么样的影响呢?
最近单位招标[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url],想了解戴安、瑞士万通、岛津分离柱及保护柱的容量,同时想了解各企业抑制器的抑制容量是多少,分阴阳离子,有知道的麻烦告知,谢谢了!!!
如题,高效液相色谱柱柱容量是多少?
请问应用液相色谱时,怎么将容量因子(K)显示在报告里?先谢谢了
请问[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]的定量进样环最大有多大容量?
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=95263]高效液相色谱柱柱容量[/url]
动态色谱法 动态色谱法是将待测粉体样品装在U型的样品管内,使含有一定比例吸附质的混合气体流过样品,根据吸附前后气体浓度变化来确定被测样品对吸附质分子(N2)的吸附量;静态法根据确定吸附吸附量方法的不同分为重量法和容量法;重量法是根据吸附前后样品重量变化来确定被测样品对吸附质分子(N2)的吸附量,由于分辨率低、准确度差、对设备要求很高等缺陷已很少使用;容量法是将待测粉体样品装在一定体积的一段封闭的试管状样品管内,向样品管内注入一定压力的吸附质气体,根据吸附前后的压力或重量变化来确定被测样品对吸附质分子(N2)的吸附量; 动态色谱法和静态法的目的都是确定吸附质气体的吸附量。吸附质气体的吸附量确定后,就可以由该吸附质分子的吸附量来计算待测粉体的比表面了。 由吸附量来计算比表面的理论很多,如朗格缪尔吸附理论、BET吸附理论、统计吸附层厚度法吸附理论等。其中BET理论在比表面计算方面在大多数情况下与实际值吻合较好,被比较广泛的应用于比表面测试,通过BET理论计算得到的比表面又叫BET比表面。统计吸附层厚度法主要用于计算外比表面; 动态色谱法仪器中有种常用的原理有固体标样参比法和BET多点法;动态色谱法之固体标样参比法 固体标样参比法也叫直接对比法,国外此种方法的仪器叫做直读比表面仪。该方法测试的原理是用已知比表面的标准样品作为参照,来确定未知待测样品相对标准样品的吸附量,从而通过比例运算求得待测样品比表面积。以使用氮吸附BET比表面标准样品为例,该方法的依据是有2个:一、BET理论的假设之一在吸附一层之后的吸附过程中的能量变化相当于吸附质分子液化热,也就是和粉体本身无关;二、在相同氮气分压(5%-30%)、相同液氮温度条件下,吸附层厚度一致;这就是以此种简单的方法所得出的比表面值与BET多点法得到的值一致性较好的原因;动态色谱法之BET多点法 BET多点法为国标比表面测试方法,其原理是求出不同分压下待测样品对氮气的绝对吸附量,通过BET理论计算出单层吸附量,从而求出比表面积;其理论认可度相对固体标样参比法高,但实际使用中,由于测试过程相对复杂,耗时长,使得测试结果重复性、稳定性、测试效率相对固体标样参比法都不具有优势,这是也是固体标样参比法的重复性标称值比BET多点法高的原因; 动态色谱法和静态容量法是目前常用的主要的比表面测试方法。两种方法比较而言动,态色谱法比较适合测试快速比表面积测试和中小吸附量的小比表面积样品(对于中大吸附量样品,静态法和动态法都可以定量的很准确),静态容量法比较适合孔径及比表面测试。虽然静态法具有比表面测试和孔径测试的功能,但静态法由于样品真空处理耗时较长,吸附平衡过程较慢、易受外界环境影响等,使得测试效率相对动态色谱法的快速直读法低,对小比表面积样品测试结果稳定性也较动态色谱低,所以静态法在比表面测试的分辨率、稳定性方面,相对动态色谱并没有优势;在BET多点法比表面分析方面,静态法无需液氮杯升降来吸附脱附,所以相对动态法省时;静态法相对于动态色谱法由于氮气分压可以很容易的控制到接近1,所以比较适合做孔径分析。而动态色谱法由于是通过浓度变化来测试吸附量,当浓度为1时的情况下吸附前后将没有浓度变化,使得孔径测试受限。静态容量法 在低温(液氮浴)条件下,向样品管内通入一定量的吸附质气体(N2),通过控制样品管中的平衡压力直接测得吸附分压,通过气体状态方程得到该分压点的吸附量; 通过逐渐投入吸附质气体增大吸附平衡压力,得到吸附等温线;通过逐渐抽出吸附质气体降低吸附平衡压力,得到脱附等温线;相对动态法,无需载气(He),无需液氮杯反复升降; 由于待测样品是在固定容积的样品管中,吸附质相对动态色谱法不流动,故叫静态容量法; 比表面积测试相关仪器简介 动态法比表面积仪测试比表面积精度影响因素 对具有风热助脱、检测器恒温、低温冷阱的动态法仪器,其相对不具有该装置的动态法比表面仪,其精度得到明显提高;动态法比表面仪,与其它分析仪器类似,其精度和灵敏度大小主要取决于信噪比;也就是要提高精度和灵敏度,就需要从提高信号强度、抑制背景噪声、消除外界干扰三方面来控制。增加信号强度的方法一般有增加称样量、增加检测器电流,但增加检测器电流一般噪声也会同时增大,所以检测器电流会有个最佳范围;所以在抑制噪声、消除外界干扰方面可做的工作就比较多了;其源于仪器自身的误差来源主要有:检测器温漂,信号锐度;以检测器恒温装置来抑制温漂,风热助脱装置可以提高信号锐度,其对于比表面1m2/g的样品0.5g对氮气的吸附量在分压0.2左右时脱附峰面积与背景可以保证在2%以内的误差; 所以对于小比表面样品,对具有风热助脱、检测器恒温、低温冷阱的动态法仪器,其灵敏度和分辨率的优势就体现出来了;但对中大比表面样品,由于信号强,普通动态法比表面积仪和静态法比表面积仪都可以保证精度;这点就像万分之一分析天平和千分之一天平的区别; 静态法比表面积仪测试小比表面积样品精度分析 以比表面积1m2/g的样品为例,该样品0.5g对氮气的吸附量在BET分压范围内在标况下约0.1ml,在测试过程中的吸附环境液氮温度下的体积约0.03ml;样品管装样部分的剩余体积(也就是背景体积)约在3-5ml左右,要在3-5ml的样品管体积中准确定量出0.03ml的总吸附量且保证精度达到3%以内,可以算出要求压力传感器的精度要达到0.03%以上;但目前进口最好的压力传感器的精度只有0.1%,而且通常比表面及孔径分析仪用的压力传感器精度为0.15%,也就是说目前最高精度的压力传感器,即使温度场理想测定,液氮面理想恒定,环境温度理想准确条件下,对吸附量确定量的不确定度也只能达到0.003ml,即不确定度达到10%;若对于比表面再小或堆积密度小也就是装样量也难以很大的样品,其准确度就可想而知了。 但对于中大比表面样品,一般吸附量不会那么微小,静态法的精度很容易保证在2%甚至1%以内便不是问题; 所以在小比表面样品的测试方面,静态法仪器测试的误差相对高精度的动态法仪器的误差大;静态法只能通过增加装样量来降低误差,常见的是静态一般都会为小比表面积样品配备大容量样品管,但由于背景体积(吸附腔体积)也随之增大,所以准确度提高也是有限的;这点是采用静态法仪器测试比表面积应考虑的因素。 比表面积计算公式 参考国标GB/T24533-2009 放到气体体系的样品,其物质表面在低温下将发生物理吸附。当吸附达到平衡时,测量平衡吸附压力和吸附的气体流量,根据BET方程式(1)求出试样单分子层吸附量,从而计算出试样的比表面积。 (P/P0 )/ V(1-P/P0) = (C-1 )/( VmC ) × P/P0 + 1/( VmC )

http://ng1.17img.cn/bbsfiles/images/2010/12/201012302229_271014_1638724_3.jpg分离度与柱效的关系由上式可以看出,对于具有一定相对保留值的物质对,分离度直接和有效塔板数有关,与neff的平方根成正比,增加neff的方法有两种,一是增长色谱柱,二是减小板高H.增加柱长的方法会使分析时间延长,造成峰扩展,所以更好的方法是制备一根性能优良的柱子,通过降低板高,提高分离度.分离度与容量比的关系http://ng1.17img.cn/bbsfiles/images/2010/12/201012302230_271016_1638724_3.jpg从上表可以看出,k10时,增大k值,k/(1+k)的变化不大,对R的影响不明显,但是会使分析时间延长,所以,一般建议的最佳范围为110,可以通过改变柱温和相比调整k的大小. 分离度与柱选择性(选择因子)的关系由基本分离方程式易知,当α=1时,R=0,物质对无法分开,α值越大,选择性越好,分离度变化显著.增加α简便而有效的方法是通过改变固定相,使各组分的分配系数有较大的差别.
如题:两根相同的色谱柱串联,是不是有如下效果?1 增加分离效果2 增加柱容量3 系统压力上升求解。。。。。
公司大概有40个[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法的项目,都要用微量注射器,也不可能每个项目都配,还有容量瓶买多少ml的合适呢?求大神帮忙
建立方法过程中如何选择色谱柱?第一次建立方法时,应考虑色谱柱的下列性能参数,以便选出用于该分离试验的最佳色谱柱。 A .色谱柱固定相 B .内径 C .膜厚度 D .色谱柱长度A.色谱柱固定相气相色谱柱中,两种分析物由于其与固定相的相互作用不同而发生分离。因此,必须选定一个与样品特性相匹配的固定相。例如,如果组分足有不同的沸点(温度差大于2℃),推荐使用非极性色谱柱。如果组分之间的主要差异是极性不同,那么使用极性色谱柱较为理想。B.内径足内径的选择通常取决于仪器或检测方式。大多数现代化得气相色谱设备都与大部分色谱柱的尺寸相兼容。内径增大,色谱柱的样品容量增加,但分离度和灵敏度降低。反之,尺寸较小的色谱柱,其分离度和灵敏度也相应提高,但缺点是样品容量减少,所需样品量也增多。最好的方法是找一个已有的色谱方法,在此基础上进行优化。C.膜厚度膜厚增加,色谱柱的样品容量也增大,但洗脱峰的速度变慢。这有助于分析挥发性化合物,如风味物质。膜的厚度增加,色谱柱的过载风险减少,分离度随之提高。不过,膜的厚度增大,对于降解的敏感性也增大。相对来说,膜的厚度越大,相同组分的洗脱温度也越高。对于具有较高沸点,如甘油三酯或较大分子量的化合物,应使用较薄的膜进行分析,以提高分离度,避免增加不必要的分析时间。另一个要考虑的因素是相比率(b)。相比率用下面含有内径和膜厚度的公式进行计算: b= 内径/(4*膜厚度) 单位:μm相比率可用于两个方面:1.对量纲进行分类: a.对于挥发性样品b4002.要将一组分析数据从某个内径的色谱柱转移到另一个色谱柱而不改变方法,应选择与该色谱柱具有相似b值的色谱柱,这样二者也具有相似的保留性能。 膜厚度(μm) 0.1 0.25 0.5 1 1.8 3 0.1 250 100 50 25 14 8内径(mm) 0.25 625 250 125 63 35 21 0.32 800 320 160 80 44 27 0.53 1325 530 265 133 74 44 一般色谱柱的相比率(b)D.色谱柱长度能色谱柱的长度越长,柱效越高,分离度也越高,但二者并不成线性关系。分离度与色谱柱长度的平方根成正比,所以色谱柱长度增大二倍,平方根为1.414,分离度只能增加41.4%。不过,色谱柱长度增加,保留时间也会增大。色谱柱长度增大二倍,分析时间也增大二倍。一般来说,推荐使用最短的色谱柱进行分离试验。
色谱柱内径对主要考虑的五个参数都有影响。它们是柱效、保留、压力、载气流速和容量。请谈谈他们都有哪些影响?
[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]配制5%乙醇5%苯5%甲苯,怎么配制?用分析天平称取质量()g甲醇()g苯()g甲苯,用( )溶液稀释100ml容量瓶中,这种配制溶液可以么?算百分含量用密度么?有公式帮忙写下,非常感谢
海藻酸钠是从海藻细胞壁和细胞间质中提取的天然生物大分子,由古洛糖醛酸(记为G单元)与其立体异构体甘露糖醛酸(记为M单元)两种结构单元通过α(1-4)糖苷键链接而成的线性嵌段共聚物【1】。海藻酸钠是一种安全的食品添加剂,可作为仿生食品或疗效食品的基材,在食品工业中被广泛用作稳定剂、增稠剂、粘结剂、分散剂和凝固剂等【2】。检测海藻酸钠中氯离子、硫酸根离子含量有助于控制海藻酸钠产品的纯度,对控制生产工艺有重要意义。 本文建立了一种离子色谱法测定海藻酸钠中阴离子氯离子、硫酸根离子的方法,灵敏快速,适用于实际样品的测定。1 实验部分主要仪器与试剂离子色谱仪:CIC-100型,青岛盛瀚色谱技术有限公司;碳酸钠、碳酸氢钠:分析纯;淋洗液:1.8 mmol/L Na2CO3-1.7 mmol/L NaHCO3混合溶液,称取0.1908 g碳酸钠、0.1428 g碳酸氢钠,用脱气水定容至1000 mL;氯离子储备液:准确称取氯化钠固体0.1648g于100 mL容量瓶中,用去离子水定容至刻度;硫酸根离子储备液:准确称取硫酸钠固体0.1479g于100 mL容量瓶中,用去离子水定容至刻度;实验用水为去离子水。
海藻酸钠是从海藻细胞壁和细胞间质中提取的天然生物大分子,由古洛糖醛酸(记为G单元)与其立体异构体甘露糖醛酸(记为M单元)两种结构单元通过α(1-4)糖苷键链接而成的线性嵌段共聚物【1】。海藻酸钠是一种安全的食品添加剂,可作为仿生食品或疗效食品的基材,在食品工业中被广泛用作稳定剂、增稠剂、粘结剂、分散剂和凝固剂等【2】。检测海藻酸钠中氯离子、硫酸根离子含量有助于控制海藻酸钠产品的纯度,对控制生产工艺有重要意义。 本文建立了一种离子色谱法测定海藻酸钠中阴离子氯离子、硫酸根离子的方法,灵敏快速,适用于实际样品的测定。1 实验部分主要仪器与试剂离子色谱仪:CIC-100型,青岛盛瀚色谱技术有限公司;碳酸钠、碳酸氢钠:分析纯;淋洗液:1.8 mmol/L Na2CO3-1.7 mmol/L NaHCO3混合溶液,称取0.1908 g碳酸钠、0.1428 g碳酸氢钠,用脱气水定容至1000 mL;氯离子储备液:准确称取氯化钠固体0.1648g于100 mL容量瓶中,用去离子水定容至刻度;硫酸根离子储备液:准确称取硫酸钠固体0.1479g于100 mL容量瓶中,用去离子水定容至刻度;实验用水为去离子水。
目前,违法添加非食用物质和滥用食品添加剂事件常有发生,为保证牛奶的食用安全,采用离子色谱仪检测牛奶中硫氰酸根。 1、检测原理:液态奶样品沉淀蛋白、去除脂肪后,用离子色谱分析,电导检测器检测,外标法定量。 2、实验部分 2.1试剂与材料 2.1.1试验用水均为超纯水 2.1.2乙腈(色谱纯) 2.1.3固相萃取小柱:OnGuardRP柱(2.5cc),或相当者(如C18),使用前依次用5ml甲醇和10ml水活化。 2.1.4硫氰酸标准品:北京化工厂 2.1.5硫氰酸标准储备液将硫氰酸标准品于80度烘箱内烘干2小时。准确称取干燥后的硫氰化钾1.6732g于1000ml容量瓶中,定容,混匀。即得1000ppm硫氰根标准储备液。 2.1.6硫氰酸标准中间液取硫氰酸标准储备溶液1mL,置于100mL容量瓶中,加水至刻度。此溶液含硫氰酸10mg/L。 2.1.7硫氰酸标准使用液移取0.1、0.2、0.5、1.0、2.0mL硫氰酸标准中间液,用水定容于10mL容量瓶中,浓度分别为0.1、0.2、0.5、1.0、2.0mg/L。 2.2仪器 2.2.1离子色谱仪:配备淋洗液发生器和电导检测器; 2.2.2离心机:冷冻离心机。 2.3样品处理取4mL液体奶样品,加入5mL乙腈沉淀蛋白,取上清液稀释10倍,过RP柱(或经冷冻离心机)去除脂肪后上机。 2.4离子色谱参考条件色谱柱:强亲水性阴离子交换柱。IonPacAS16,4.0×250mm分析柱;IonPacAG16,4.0×50mm保护柱;或其他相当者。 采用离子色谱仪检测,操作简便,检测结果准确。
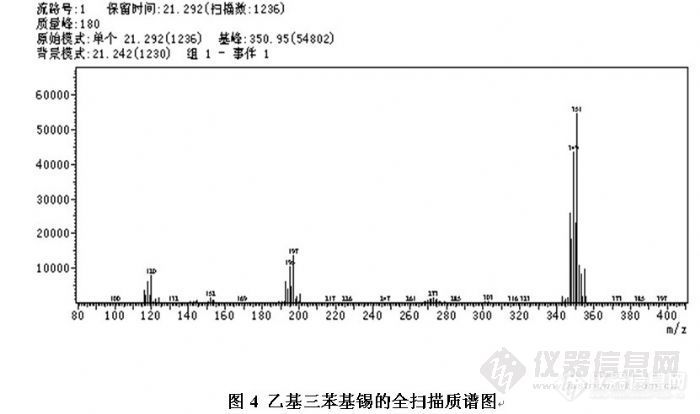
维权声明:本文为xhwy2010原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现的,均属侵权违法行为,我们将追究法律责任。摘要:研究了纺织助剂中二丁基锡、三丁基锡及三苯基锡化合物的气相色谱-质谱(GC-MS)检测方法。在pH 4.0的条件下,用正己烷萃取试样中的有机锡,然后用四乙基硼化钠溶液对萃取液中的有机锡进行衍生化。用气相色谱-质谱法(GC-MS)测定,依据保留时间和选择离子定性,外标法定量。实验结果表明,在0.1~8.0mg/L或0.1~4.0mg/L(以有机锡阳离子计)的范围内,有机锡化合物的浓度与其衍生物峰面积呈良好的线性关系,线性相关系数为0.9997~0.9999,方法的检出限为0.003~0.005mg/L;纺织助剂中三种有机锡化合物的平均加标回收率为92.6%~108.0%,相对标准偏差为2.49%~10.18%。实验摘要:1.标准溶液的前处理及衍生化取1mL混合标准工作溶液至50mL离心管中,依次加入1mL水、5mL乙酸钠-乙酸缓冲液(1.2.2)及5mL正己烷,室温超声10分钟,以3500转/分离心10分钟,用滴管转移上层有机相至10mL容量瓶中;再向离心管中加入4mL正己烷,重复以上超声、离心及有机相转移操作,用适量正己烷洗涤离心管三次,洗液转移至同一容量瓶,用正己烷定容。然后加入100μL衍生化试剂于容量瓶中,室温超声5分钟,稍冷后加入适量无水硫酸钠,振摇后静置30分钟,用0.45µm过滤膜过滤,供气相色谱-质谱测定。2.样品的前处理及衍生化本文选取了两个亲水性聚氨酯类助剂和两个疏水性聚氨酯类助剂进行实验。因样品性质不同,前处理方法可分为如下两种:㈠亲水性样品的前处理及衍生化精密称取样品0.5g[/si
液相色谱中死时间几种测定方法1:有响应的溶剂出峰时间为死时间。2:进样后的阀切换峰,对应的时间为死时间。3:工作站中输入色谱柱的空余体积或孔隙率,自动计算。(对于C18柱,也可以用硝酸钠或硫脲等在色谱柱上完全不保留组分的出峰时间来测定死时间。)影响分离度的因素有三个因素控制两个色谱峰之间的分离度——容量因子,选择性,柱效容量因子反映样品分子和固定相及流动相之间的作用力,选择性是说明色谱系统区分两个或多个色谱峰的能力,柱效与色谱峰的宽度有关,很明显要达到一定的分离度,宽色谱峰要比窄色谱峰需要更大的分离度选择性。理论塔板数越高柱效越高,柱效的高低受柱内效应和柱外效应的影响。选择性是固定相区分两个被分离样品组分的能力,用容量因子之比进行计算,它是两个被分离色谱峰顶点距离的量度,如果选择性是Ⅰ,则两个组分完全不能分离。选择性数值越高,分离越好。由于选择性取决于被分离物的物理和化学结构,流动相和固定相,流动相组成,PH,色谱柱温度,流动相添加剂,因此,尽量优化实验条件提高选择性以降低成本。容量因子为物质的特性,当分析条件一定时,容量因子为固定值。溶剂的洗脱强度与其极性有关:反相色谱:溶剂的极性越强,洗脱强度越弱。正相色谱:溶剂的极性越强,洗脱能力越强。(注意:不可以使用纯水作为正想色谱的流动相)一般样品分析要求:容量因子大于2小于5
1 原理液态奶样品沉淀蛋白、去除脂肪后,用离子色谱分析,电导检测器检测,外标法定量。2 实验部分2.1 试剂与材料2.1.1 试验用水均为超纯水2.1.2 乙腈(色谱纯)2.1.3 固相萃取小柱:OnGuard RP柱(2.5cc),或相当者(如C18),使用前依次用5 ml甲醇和10 ml水活化。2.1.4 硫氰酸标准品:北京化工厂2.1.5 硫氰酸标准储备液将硫氰酸标准品于80度烘箱内烘干2小时。准确称取干燥后的硫氰化钾1.6732g于1000ml容量瓶中,定容,混匀。即得1000ppm硫氰根标准储备液。2.1.6 硫氰酸标准中间液取硫氰酸标准储备溶液 1 mL,置于100 mL容量瓶中,加水至刻度。此溶液含硫氰酸10 mg/L。2.1.7 硫氰酸标准使用液移取0.1、0.2、0.5、1.0、2.0 mL硫氰酸标准中间液,用水定容于10 mL容量瓶中,浓度分别为0.1、0.2、0.5、1.0、2.0 mg/L。2.2 仪器2.2.1 离子色谱仪:配备淋洗液发生器和电导检测器;2.2.2 离心机:冷冻离心机。2.3 样品处理取4mL液体奶样品,加入5mL乙腈沉淀蛋白,取上清液稀释10倍,过RP柱(或经冷冻离心机)去除脂肪后上机。2.4 离子色谱参考条件色谱柱:强亲水性阴离子交换柱。IonPac AS16,4.0×250mm分析柱;IonPac AG16,4.0×50mm保护柱;或其他相当者。流动相:KOH溶液,梯度淋洗。淋洗液由淋洗液在线发生器在线产生。KOH梯度程序如下: 时间(min) KOH浓度(mmol)0 4513 45 13.1 70 18 70 18.1 4523 45流速:1.0 mL/min;抑制器:ASRS-300型抑制器,4mm;抑制器抑制模式:外接水模式,抑制电流175mA;柱温:30℃;进样体积:100 μL。3 结果计算X= c*9*10/4 …………………………(1)式中:X——液态奶中硫氰酸的含量,单位为微克每毫升(μg/mL);c——由标准曲线得到试样溶液中硫氰酸的浓度,单位为微克每毫升(μg/mL);9——液态奶的体积与乙腈体积之和,单位为毫升(mL); 4——液态奶的体积,单位为毫升(mL);10——稀释倍数;计算结果保留两位有效数字。4 精密度在重复性条件下,获得的硫氰酸的两次独立测试结果的绝对差值不大于其算术平均值的5%。
1、我单位需要采购一台大容量高速冷冻离心机,能支持50mL以上离心管高速冷冻离心,据我考查好像主要有“西格玛”和“贝克曼”,哪个品牌好用?或者有没有推荐型号?2、我单位因为要处理肉制品或油脂类等含大分子杂质的样品,需采购一台GPC凝胶净化排阻色谱仪,现咨询有莱伯泰科,瑞科,LC-tech,J2等品牌,请问用哪个品牌的仪器好用,或有没有推荐型号?感谢回复!
【摘要】 测定聚乳酸中丙交酯的含量。采用毛细管[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]法,色谱系统为:AC20色谱柱 柱温150℃ 载气为氮气 检测器为FID。在色谱条件下,测得丙交酯线性良好(γ0.99) 平均回收率为99.8% RSD0.18% 最低检测限为3.413 μg/mL,样品中丙交酯残留量符合要求。该方法灵敏、准确、可靠。【关键词】 毛细管[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]法 聚乳酸 丙交酯 单体残留 测定Abstract:To determine the contents of residual lactide in PLA.A Simple capillary gas chromatography method was established with FID detector. The capillary column was AC20 with 150℃ the residual monomer contents were calculated by the external standard method.The linearities were fairly good(γ0.99). The average recoveries were 99.8 % with RSD of 0.18%. The limit of detection was 3.413 μg/mL. The contents of residual monomer in samples were complied with the specification requirements. This method is simple, rapid and accurate.Key words:Capillary gas chromatography Polyactic acid Lactide Residual monomer Determination1 引 言聚乳酸因具有良好的生物相容性、生物可降解性,在生物医学工程领域有广阔的应用前景。我们合成的聚乳酸是用丙交酯作单体,为有效控制产品的质量,需对本品的单体残留量进行检查[1-3]。目前测定丙交酯残留的方法为氢核磁共振,但是无法定量。因此,建立一种简便、实用的分析方法测定聚乳酸残留单体,对于聚乳酸的研究开发和生产过程控制都是十分必要的。我们采用毛细管[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]法对聚乳酸中的丙交酯单体残留进行测定。2 仪器与试药日本岛津GC-8A[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱仪[/color][/url] 色谱柱:30QC3/AC20-0.5毛细管柱,30m×0.32mmI.D.(键合相为聚乙二醇) FID检测器 载气为高纯氮气 丙交酯为国产分析纯试剂。3 方法与结果3.1 色谱条件毛细管色谱柱:30m×0.32mmI.D.以键合相为聚乙二醇 柱温:150℃ 进样口温度为280℃ 检测器温度为150℃ 氮气(N2)压力为 150 kPa,氢气(H2)压力为100 kPa 助燃气(空气)压力为50 kPa,基础压为300 kPa。直接进样,进样量:1 μl。色谱图见图1、2。3.2 对照品溶液的配制精密称取丙交酯0.1022 g,置已加入少量三氯甲烷的10 ml容量瓶中,振摇,加三氯甲烷至刻度,作为对照品储备液5。3.3 线形与范围精密量取对照品储备液5 ml,置10 ml容量瓶中,加三氯甲烷于刻度,作为4号溶液 于4号样品液中分别精密量取1、5 ml,置10 ml容量瓶中,加三氯甲烷于刻度,作为2,3号溶液 于2号溶液中精密量取1 ml,置10 ml容量瓶中,加三氯甲烷于刻度,作为1号溶液。各精密量取1 μl,直接进样。以浓度C为横坐标,峰面积A为纵坐标进行线形回归,求得PLA单体的回归方程为:A=1.04951×10-6C+0.003048R=0.99999由上可知,浓度在0.01022~10.22 mg/ml范围内与各自峰面积线形关系良好,见表1。表1 丙交酯线形关系3.4 最小检测限测定用标准溶液0.01022 mg/ml,不断稀释,每一次稀释,取样进样,做GC,要求:S/N≥3,测得PLA单体的最小检测限为3.413 μg/ml。3.5 精密度试验精密量取3号溶液5 ml于10 ml容量瓶中,加三氯甲烷于刻度,照上述色谱条件进行测试。测得丙交酯的峰面积的RSD为4.8%,见表2。表2 丙交酯精密度试验3.6 回收率试验精密称取PLA(批号2008111801)约1 g,并精密量取2 ml贮备液(I),置于同一容量瓶,加三氯甲烷定容至刻度,溶解,摇匀,分别精密量取1 μl直接进样,照上述色谱条件进样测定,计算得丙交酯的平均回收率为99.8%,其RSD分别为0.18%。3.7 样品残留量测定样品:精密称取PLA1.0031 g于10 ml容量瓶中,加三氯甲烷定容至刻度,对照:精密称取对照品0.9956 g于10 ml容量瓶中,加三氯甲烷于刻度。分别精密量取1 μl,直接进样按照中国药典2005年版二部附录ⅧP第二法,照重复性项下方法分别测定样品对照品溶液的峰面积 按外标法以峰面积计算。测得样品的峰面积为51 387,单体残留为0.049%,对照品的峰面积为443 440,单体残留为0.42%。4 结论综上所述,通过[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]分析法,在本研究确定的色谱条件下,可以快速、准确地分析聚乳酸中丙交酯单体的残留量。【参考文献】[1]付春华,罗彦凤,李永刚,等.[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]分析法在聚丙交酯合成中的应用[J].高分子材料科学与工程,2007,23(4):170-173.[2]张薇.新型生物降解材料聚乳酸综述[J].贵州化工,2008,3(3):18-20.[3]郑敦胜,郭锡坤,贺璇,等.直接缩聚法合成聚乳酸的工艺改进[J].塑料工业,2004,32(12):8-10.

我看到容量因子k的意义是组分在固定相与流动相中的质量比,图中,为什么质量p为浓度比体积,而不是质量p为浓度×体积。求大神指点,[img=,690,331]http://ng1.17img.cn/bbsfiles/images/2017/11/201711261702_02_1669358_3.jpg!w690x331.jpg[/img]
请问做液相的高手,现在碰到一个问题,求助大家献计献策:请问怎么理解“缓冲容量不够会导致保留时间漂移”
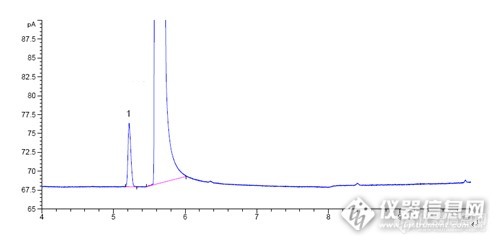
化妆品中甲醇的检测方法(气相色谱法)(征求意见稿)1 范围 本方法规定了气相测定色谱化妆品中甲醇的含量。 本方法适用于含乙醇或异丙醇化妆品中甲醇的测定。2 方法提要样品在经过气-液平衡、直接提取或蒸馏后,采用气相色谱分离,氢火焰离子化检测器检测,根据保留时间定性,峰面积定量,以标准曲线法计算含量。本方法甲醇的检出限:气-液平衡法,分流比20:1,取样量为1g时,检出浓度20 mg/kg,定量浓度80mg/kg;直接法,分流比50:1,取样量为2g时,检出浓度25 mg/kg,定量浓度100mg/kg;蒸馏法,分流比50:1,取样量为10g时,检出浓度25 mg/kg,定量浓度100mg/kg。3 试剂和材料除非另有说明,所用试剂均为分析纯。水为GB/T6682规定的一级水。3.1 高纯氮(99.999%)3.2 高纯氢(99.999%)3.3 无油压缩空气,经装5Å分子筛的净化管净化。3.4 无甲醇乙醇(色谱纯):取 1.0 μl 注入色谱仪,应无杂峰出现,无甲醇检出。3.5 乙醇:取无甲醇乙醇(3.4)75 ml,用水稀释至 100 ml。3.6 甲醇(标准品,99.8%)3.7 氯化钠。4 仪器和设备4.1 气相色谱仪,配有氢火焰离子化检测器(FID)。4.2 微量进样器或自动进样装置4.3 顶空进样器。4.4 顶空瓶:20 ml。4.5 分析天平。4.6 全磨口水浴蒸馏装置。5 分析步骤5.1标准系列配制5.1.1 甲醇标准溶液取甲醇标准品(3.6)约1 g(精确至0.0001 g) 置于100 ml容量瓶中,用无甲醇乙醇(3.4)定容,得10 g/L甲醇标准溶液。5.1.2 气-液平衡法标准溶液系列取(5.1.1)甲醇标准溶液0.1、0.2、0.5、1.0、2.0、4.0 ml 于10 ml容量瓶中,用无甲醇乙醇(3.4)定容,配制成0.1、0.2、0.5、1.0、2.0、4.0 g/L的标准系列溶液,取标准系列溶液各1.0 ml分别置于顶空瓶中,加 75%乙醇(3.5)10.0 ml,顶空盖密封,摇匀,备用。5.1.3 直接法标准溶液系列取(5.1.1)甲醇标准溶液0.1、0.25、0.50、1.0、2.0 ml 于50 ml容量瓶中,用无甲醇乙醇(3.4)定容,配制成0.02、0.05、0.1、0.2、0.4 g/L的标准系列溶液,摇匀,备用。5.1.4 蒸馏法标准溶液系列取(5.1.1)甲醇标准溶液0.5、1.0、2.0、5.0、10.0 ml 于250 ml蒸馏烧瓶中,加水50 ml,氯化钠(3.7) 2.0 g,无甲醇乙醇(3.4)35 ml,水浴加热蒸馏,收集蒸馏液于50.0 ml容量瓶中,至接近刻线,加无甲醇乙醇(3.4)定容,配制成 0.1、0.2、0.4、1.0、2.0 g/L的标准系列溶液,摇匀,备用。5.2 样品处理 5.2.1 气-液平衡法取样品约1 g(精确至0.01 g)于顶空瓶(4.4)中,加75%乙醇(3.5)10 .0ml,密封后振摇,置于顶空进样器中,70 ℃平衡20 min,取气液平衡后的液上气体作为待测样品。 5.2.2 直接法取样品约2 g(精确至0.01 g)于10 ml刻度管中,加无甲醇乙醇(3.4)定容,振摇,涡旋混匀,超声提取15 min,5000 rpm离心10 min,取上清液0.45μm滤膜过滤作为样品溶液。 5.2.3 蒸馏法取样品约10 g(精确至0.01 g)于蒸馏瓶中(4.6),加水50 ml,氯化钠(3.7)2.0 g,无甲醇乙醇(3.4)35 ml,水浴加热蒸馏,收集蒸馏液于50.0 ml容量瓶中,至接近刻线,加无甲醇乙醇(3.4)定容,作为样品溶液。 5.3 参考气相条件5.3.1 顶空进样器参考条件 a) 汽化室温度:70 ℃; b) 汽液平衡时间:20 min; c) 进样时间:0.03 min(1.2 ml,根据气相色谱状况优化选择)。5.3.2 气相色谱参考条件a) 色谱柱:毛细管色谱柱,DB-WAXETR,30 m × 0.32 mm (i.d.) × 1.00 µm,或相当极性;b) 载气流速:1.0 ml/min;c) 进样量:1 µL(直接法、蒸馏法);d) 升温程序:50 ℃ 10 ℃/min 120 ℃(1 min) 40 ℃/min 230 ℃(8 min);e) 进样方式:分流进样,分流比:20:1(气-液平衡法);50:1(直接法、蒸馏法);f) 进样口温度:230 ℃;g) 检测器温度:250 ℃;h) 高纯氢气流量40 ml/min;i) 高纯空气流量400 ml/min。5.4 测定 5.4.1 标准曲线测定根据样品性质,选择5.1项下相应标准系列溶液,注入气相色谱仪,按5.3气相条件测定,记录峰面积,以峰面积-浓度(g/L)作图,得到标准溶液曲线方程。5.4.2 样品测定按5.2项下相应方法处理取得待测样品溶液,注入气相色谱仪,按5.3气相条件测定,根据峰保留时间定性,峰面积定量,代入5.4.1标准溶液曲线方程,得到甲醇质量浓度,按“6.1”计算样品中甲醇含量。6 分析结果的表述6.1 计算 ω(CH3OH)=ρXVX1000/m式中:ω(CH3OH)—— 样品中甲醇的质量分数,单位mg/kg;ρ —— 测试溶液中甲醇的质量浓度,单位g/L;V —— 样品定容体积,单位为ml;m —— 样品取样量,单位g。在重复性条件下获得的两次独立测试结果的绝对值不得超过算术平均值的15%。6.2 回收率和精密度气-液平衡法在0.1 g/L ~ 4.0 g/L浓度范围内,高低两点回收率为85%~115%,RSD≤5%。直接法在0.02 g/L ~ 0.4 g/L浓度范围内,高低两点回收率为85%~115%,RSD≤5%。蒸馏法在0.1 g/L ~ 2.0 g/L浓度范围内,高低两点回收率为85%~115%,RSD≤5%。7 色谱图 http://ng1.17img.cn/bbsfiles/images/2014/12/201412060819_526044_1680138_3.jpg图1 甲醇标准溶液色谱图1 甲醇