请教各位,全血中EDTA含量检测有[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]的检测方法吗,如果配制标准曲线,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]连用法检测全血中EDTA含量,可以直接进质谱吗。谢谢
气相色谱-质谱法检测鱼肉中脂肪酸含量摘要:本实验通过气相色谱-质谱联用技术检测鱼肉中脂肪酸的组分并通过面积归一化法对各组分进行百分含量测定。 关键词:梭鲈鱼;气相色谱-质谱联用;脂肪酸 实验部分1、仪器:气相色谱—串联质谱仪(Agilent 安捷伦,7890B-7000B);2、试剂与标准品:正己烷、甲醇(Fisher Scientific 飞世尔);三氯甲烷、氢氧化钾(天津光复试剂厂)。3、样品前处理:称取10g左右的鱼肉置于索式提取器中,加入40mL氯仿回流4h,取出后旋转蒸发浓缩近干,加入5mL乙醚-正己烷(1:2)溶液,溶解脂肪后倒入25mL试管中,继续加入5mL氢氧化钾-甲醇溶液(甲酯化),振摇后加入5mL正己烷静置10min后,吸取上层正己烷过滤膜后放入自动进样瓶中待测。4、色谱与质谱条件:色谱柱:HP-5MS(30 m×0.25 mm×0.5 μm);载气:氦气(99.999%);恒流模式流速:1.0 mL/min;进样:1.0 μL,不分流;进样口温度:250 ℃;程序升温:80 ℃保持1min,以10 ℃/min升温至180 ℃,以5℃/min升温至
用液相色谱-质谱对燕窝中唾液酸含量的检测,不知道对流动相的选择有什么要求?与液相色谱法检测选择的流动相有何不同?江湖救急,求各位大神各显神通帮帮忙。
求助质谱检测化合物时为什么有机溶剂含量越大物质的响应越高?
高效液相色谱仪可以直接测物质的成分及含量吗?不经过质谱啥的,只用HPLC。物质是未知物,可以直接测吗?
[color=#444444]请问用液相色谱串联质谱法测试水样中农药含量时,为什么要在过滤后的水样中加入等体积的有机溶剂?最终如何计算测得的浓度?是否为2倍关系?[/color]
最近得到一份岛津的文献方法《气相色谱质谱法测定葡萄酒中104种农残含量》,给大家分享。如附件。没想到葡萄酒也要检测那么多种农残。说明葡萄上打农药也打得很厉害。岂不是很危险,尤其像我这样吃葡萄不吐葡萄皮的。元芳,你怎么看?
SNT 2534-2010 进出口水果和蔬菜制品中展青霉素含量检测方法 液相色谱-质谱 质谱法与高效液相色谱法
蜂蜜中碳4植物糖含量测定~稳定碳同位素比值质谱法,有人参加上述实验室比对吗?
:高效液相色谱_串联质谱法测定酸奶中纳他霉素的含量期刊:中国卫生检验杂志作者:李媛媛; 王伟; 关树文; 李刚; 董巧红;链接:http://202.119.208.220:8002/kns50/detail.aspx?dbname=CJFD2010&filename=ZWJZ201004027
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=152821]饲料中孔雀石绿和隐形孔雀石绿含量的液相色谱-串联质谱测定方法[/url]摘要建立了超高效液相色谱一串联四级杆质谱法测定饲料中孔雀石绿和隐性孔雀石绿的含量。用乙腈提取,提取液经蒸干浓缩后用中性氧化铝和阳离子交换固相萃取柱净化,使用u.PLC—MS/M进行检测。色谱条件:ACQUITY uPLC M BEH C】8柱(2.1 innl×100 rain i.d.,1.7 ),流动相乙腈0.1%甲酸溶液,梯度洗脱流速O.3 mL/min。采用电喷雾串联四极杆质谱检测。结果表明,孔雀石绿和隐性孔雀石绿的浓度为1~500 ng/mL时线形良好,在1~100 g/kg的添加水平条件下平均回收率为68.5% ~91.6% ,该方法的检测限为1.0/zg,/kg。
谁那里有《等离子体质谱法测定硅片硼磷硅玻璃层中硼磷含量》这篇文章?如果能提供,非常感谢!愿以积分交换
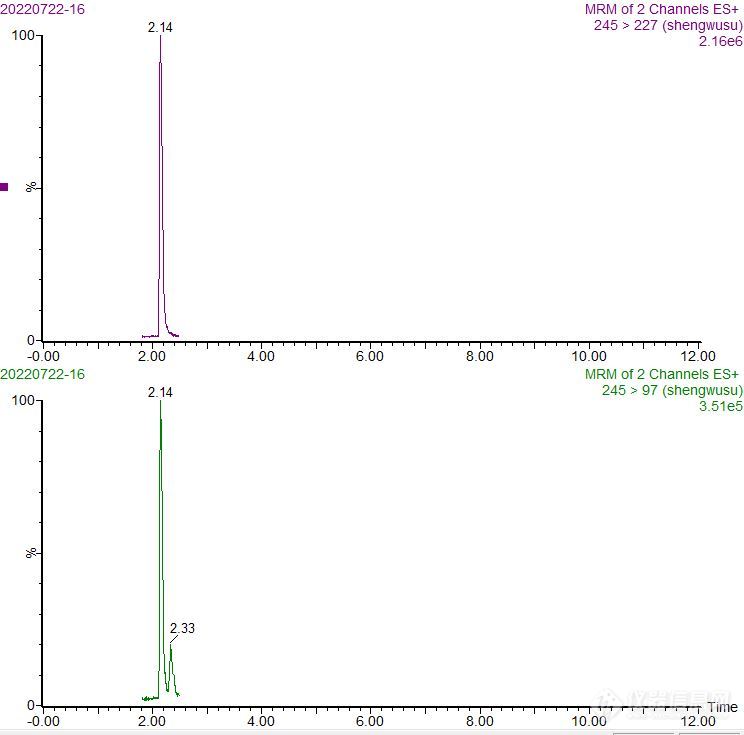
[size=16px]超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法测定奶粉中生物素的含量[/size][align=center][size=16px]户江涛[/size][/align][align=center][size=16px](黑龙江省农垦科学院测试化验中心,黑龙江 佳木斯 154007 )[/size][/align][size=16px]摘要:采用超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法建立了检测奶粉中生物素含量的分析方法,对试样提取、净化条件,流动相、色谱柱和质谱条件进行了优化,结果表明该方法与国标微生物法对同一样品检测得到的生物素含量基本一致,但检测所需时间大大减少,且抗干扰能力、精密度均比微生物法高,特别适和大批量奶粉中生物素含量检测。关键词:超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱;奶粉;生物素生物素又称维生素B7,是生物体内羧基转化酶作用的一种辅酶,在人体生长、代谢、发育过程中发挥着重要的作用。人类自身不能合成生物素,需从膳食中获得,而奶粉是人类(特别是婴幼儿)获取生物素的重要途径,准确测定奶粉中生物素含量有重要意义。目前国家标准规定的生物素测定方法《GB 5009.259-2016 食品安全国家标准 食品中生物素的测定》为微生物法。该方法需要购买特定菌种,成本较高,且菌种难保存、易受污染,实验操作复杂、费时费力、技术难度大、对检验人员和实验室要求较高,且容易受到基质干扰、检测结果重复性较差。同时奶粉成分复杂,所含生物素含量极低,一般为十几个微克/100克。因此,制定一种准确、高效、便捷、灵敏度高的生物素测定方法迫在眉睫。基于高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]的分离能力和质谱的高灵敏度、高选择性,采用[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱测定法具有前处理简单、分析速度快,适用的基质范围广、实用性强,可以为奶粉中生物素含量的测定提供一种有效的检测手段。本文建立的超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法测定奶粉中生物素含量[color=black]的方法前处理过程简便、分析时间短、灵敏度高、抗干扰能力强,特别适用于大批量奶粉样品中生物素[/color]含量的检测。1 实验部分1.1 材料与试剂[color=black]生物素(纯度[/color][font=宋体][color=black]≥[/color][/font][color=black]99%,Sigma公司);婴儿配方乳粉定量分析质控样品(BQC1051147452,北京普天同创生物科技有限公司);乙腈、甲酸(色谱纯,Fisher公司);Prime HLB固相萃取柱(200 mg,3 mL,[/color][font=宋体]Waters[/font][color=black]公司);0.2 um有机系滤膜;实验用水为Millipore纯水仪制备。[/color]1.2 仪器与设备UPLC XEVO TQ-S超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱仪(Waters公司);涡旋振荡器。1.3 [color=black]生物素[/color]标准储备液的配置称取一定量生物素[color=black]标准品[/color],用50%乙醇-水溶液配置成质量浓度为100 ug/mL标准储备液,于2~4℃冰箱保存(有效期1个月),待用;临用前将溶液回温至室温,并吸取一定体积储备液用水逐级稀释成所需浓度的标准工作液。1.4 样品前处理准确称取1.00 g(精确到0.01 g)奶粉试样于50 mL离心管中,加入10.00 mL纯水涡旋混匀2 min,然后加入10.00 mL乙腈,涡旋混匀1 min,然后在离心机中以15000 r/min离心5 min,取出后吸取2 mL上清液置于[color=black]Prime HLB固相萃取柱中,使其自然流出弃去最初几滴,然后用玻璃试管接取流出液约1 mL涡旋混匀,[/color]过0.22[font=宋体]u[/font]m有机系微孔滤膜后供UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS分析测定。1.5 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]及质谱条件[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]:色谱柱:Waters HSS [font=times new roman]T3(1.8 μm,100mm×2.1mm);柱温:30℃[/font];流速:[font=times new roman]0.3 [/font]mL/min;进样量:[font=times new roman]2[/font] [font=times new roman]μL;流动相A:乙腈;流动相B:0.1%的甲酸水溶液。梯度洗脱程序:0~0.5min,10% A;0.5~3. 0 min,10%~100% A;3. 0 ~4. 0 min,100%A,4 ~4.1min,100% A~10% A,4.1 ~5.0min 10% A。[/font]质谱:离子源:电喷雾离子源( ESI [sup]+[/sup] ) ;扫描方式:正离子扫描;检测方式:多反应监测( MRM);毛细管电压:3.2 kv;离子源温度:150℃;去溶剂气温度:500℃;去溶剂气流量:1000 L /h;定性、定量离子对及碰撞能量见表1。[/size][align=center][size=16px]表1生物素的质谱参数[/size][/align][table][tr][td][align=center][size=16px]分析物[/size][/align][/td][td][align=center][size=16px]锥孔电压/V[/size][/align][/td][td][align=center][size=16px]母离子/(m/z)[/size][/align][/td][td][align=center][size=16px]子离子/(m/z) [/size][/align][/td][td][align=center][size=16px]碰撞能量/V[/size][/align][/td][/tr][tr][td][size=16px]生物素[/size][/td][td][align=center][size=16px]30[/size][/align][size=16px][/size][/td][td][align=center][size=16px]245[/size][/align][size=16px][/size][/td][td][align=center][size=16px]227﹡[/size][/align][align=center][size=16px]97[/size][/align][size=16px][/size][/td][td][align=center][size=16px]13[/size][/align][align=center][size=16px]25[/size][/align][size=16px][/size][/td][/tr][/table][size=16px]﹡为定量离子2 结果与讨论2.1 色谱质谱条件及前处理过程的优化流动相的选择:对比了酸性体系(0.1%甲酸水溶液)与甲醇、乙腈的流动相体系组合,结果发现生物素在乙腈体系中响应值比甲醇更好一些,故本研究采用0.1%甲酸水溶液+甲醇流动相体系。色谱柱的选择:比较了[font=宋体]Waters [/font]BEH C[sub]18[/sub](1.7 μm,50mm×2.1mm)和[font=宋体]Waters [/font]HSS T[sub]3[/sub](1.8 μm,100mm×2.1mm)两种不同填料的分析柱,实验时发现目标物在这两款色谱柱上响应值差不多,但目标物在BEH C[sub]18[/sub]上保留时间比HSS T[sub]3[/sub]要短,考虑到生物素本身属于水溶性维生素,极性较强,若出峰太早可能造成奶粉中一些极性强的基质随目标物一起共流出进而干扰目标物测定,因此本方法采用了HSS T[sub]3[/sub]色谱柱。质谱参数优化:将1.0 mg/L 生物素标准溶液直接注射到质谱中,在正离子模式下进行母离子全扫描,发现目标物各自对应的准分子离子峰[M+H][sup]+[/sup]具有很好的响应,然后在分别进行子离子全扫描,各得到两对丰度高、干扰小的子离子对进行MRM监测,最终确定的质谱条件见表1,相应的色谱质谱图见图1、图2。前处理过程优化:生物素属于水溶性维生素,用纯水作为提取试剂可以得到很好的提取效果。但实验过程中发现,用纯水将奶粉溶解后整个溶液呈乳白色,只通过离心方式很难去除其中大量的蛋白、脂肪等杂质,需要对提取液进行除蛋白操作。通过考察乙酸铅、三氯乙酸、乙腈等几种常用的沉淀蛋白方法,综合考虑在去除蛋白的同时要尽可能减少其它杂质的引入,因此本方法采用乙腈除蛋白的方式,比较了几种不同水/乙腈比例,最终选定水/乙腈(1:1体积比)达到最优的实验效果。对于脂肪的去除则选用了目前较流行的[color=black]Prime HLB固相萃取柱通过式方法,即提取液通过Prime HLB时脂肪等大分子保留在SPE小柱上,目标物不保留以达到去除脂肪等杂质的目的,[/color]综合以上因素本实验最终采用了1.4的前处理方法。[/size][align=center][size=16px][img]https://ng1.17img.cn/bbsfiles/images/2022/10/202210071506558084_124_1729077_3.jpg[/img][/size][/align][align=center][size=16px]图1 [color=black]生物素[/color]标准溶液(10 ng/mL)MRM色谱图[/size][/align][size=16px][/size][align=center][size=16px][img]https://ng1.17img.cn/bbsfiles/images/2022/10/202210071506561980_1283_1729077_3.jpg[/img][/size][/align][align=center][size=16px]图2 奶粉样品中[color=black]生物素[/color]MRM色谱图[/size][/align][size=16px][color=black]2.2 线性范围和定量限[/color][color=black]吸取不同体积的生物素标准储备液(1.3),用[/color]纯水[color=black]分别配置不同浓度的[/color]上机标准溶液,以各自定量离子的峰面积(或与内标峰面积比值)为Y对应质量浓度X([color=black]m[/color]g/L)做标准曲线,得到的线性方程和相关系数见表2;以10倍信噪比(S/N)计算得到生物素的定量下限,结果见表2。表2 生物素标准溶液的线性方程、相关系数和定量下限(LOQ)[/size][table][tr][td][align=center][size=16px]分析物[/size][/align][/td][td][align=center][size=16px]线性范围/(ng/mL)[/size][/align][/td][td][align=center][size=16px]线性方程[/size][/align][/td][td][align=center][size=16px]R[/size][/align][/td][td][align=center][size=16px]LOQ/(ug/100g)[/size][/align][/td][/tr][tr][td][align=center][size=16px]生物素[sub] [/sub][/size][/align][/td][td][align=center][size=16px]0.2~50[/size][/align][size=16px][/size][/td][td][align=center][size=16px]Y=3078.1X-106.32[/size][/align][size=16px][/size][/td][td][align=center][size=16px]0.9993[/size][/align][size=16px][/size][/td][td][align=center][size=16px]0.5[/size][/align][/td][/tr][/table][size=16px][color=black]2.3回收率和精密度[/color][color=black]生物素在奶粉中天然存在[/color],选取已知生物素含量的奶粉作为基质进行加标。具体添加水平为:[color=black]0.5,5,50[/color] ug/100g。[color=black]每个[/color]水平重复6次,[color=black]同时做该奶粉的本底实验。[/color]按照1.4前处理方法处理后上机检测,回收率计算结果(扣除空白后)见表3。结果表明,该方法生物素的平均回收率为87.2%~110%,相对标准偏差(RSD,n=6)为2.3%~5.2%,均满足实验要求。[/size][align=center][size=16px]表3 奶粉生物素的加标回收率和相对标准偏差(n=6)[/size][/align][table][tr][td][align=center][size=16px]分析物[/size][/align][/td][td][align=center][size=16px]添加水平(ug/100g)[/size][/align][/td][td][align=center][size=16px]回收率/%[/size][/align][/td][td][align=center][size=16px]相对标准偏差/%[/size][/align][/td][/tr][tr][td][align=center][size=16px]生物素[/size][/align][size=16px][sub] [/sub][/size][/td][td][align=center][size=16px]0.5[/size][/align][align=center][size=16px]5[/size][/align][align=center][size=16px]50[/size][/align][/td][td][align=center][size=16px]86.8[/size][/align][align=center][size=16px]93.2[/size][/align][align=center][size=16px]91.6[/size][/align][size=16px][/size][/td][td][align=center][size=16px]4.6[/size][/align][align=center][size=16px]3.3[/size][/align][align=center][size=16px]2.1[/size][/align][size=16px][/size][/td][/tr][/table][size=16px][color=black]2.4实际样品分析[/color][color=black]为进一步验证该方法的准确性,采用本方法和《[/color]GB 5009.259-2016[color=black]》微生物法同时对北京普天同创生物科技有限公司的奶粉质控样品BQC1051147452生物素含量进行检测,结果见表4[/color]。由表4可知,UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法测定结果与国标方法的结果基本一致,无显著性差异,但前者所需时间更短,精密度更好。[/size][align=center][size=16px]表4 奶粉质控样品[color=black]BQC1051147452[/color]生物素的测定结果[/size][/align][table][tr][td][align=center][size=16px]检测方法[/size][/align][/td][td][align=center][size=16px]特性值区间(ug/100g)[/size][/align][/td][td][align=center][size=16px]测定平均值(n=6)[/size][/align][/td][td][align=center][size=16px]相对标准偏差/%(n=6)[/size][/align][/td][/tr][tr][td][size=16px]UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法微生物法[sub] [/sub][/size][/td][td][align=center][size=16px]15.6~22.4[/size][/align][align=center][size=16px]15.6~22.4[/size][/align][size=16px][/size][/td][td][size=16px]18.718.1[/size][/td][td][align=center][size=16px]2.5[/size][/align][size=16px] 4.6[/size][/td][/tr][/table][size=16px]3 结语本文建立了超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)测定奶粉中[color=black]生物素[/color]含量的分析方法。该方法具有较高的灵敏度、准确度和精密度,前处理步骤简单,分析速度快,特别适合大批量样品的检测。参考文献:[1] GB 5009.259-2016 食品安全国家标准 食品中生物素的测定.[2] 薛霞, 赵慧男, 魏莉莉, 等. 超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法测定蜂蜜中五种水溶性维生素的含量[J]. 食品与发酵工业. 2021,47(12) : 250-256.[3] 李佳兴, 周利, 金艳, 等. 超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法测定枸杞子中8种水溶性维生素[J]. 食品科技. 2018,43(11) : 336-341.[/size]
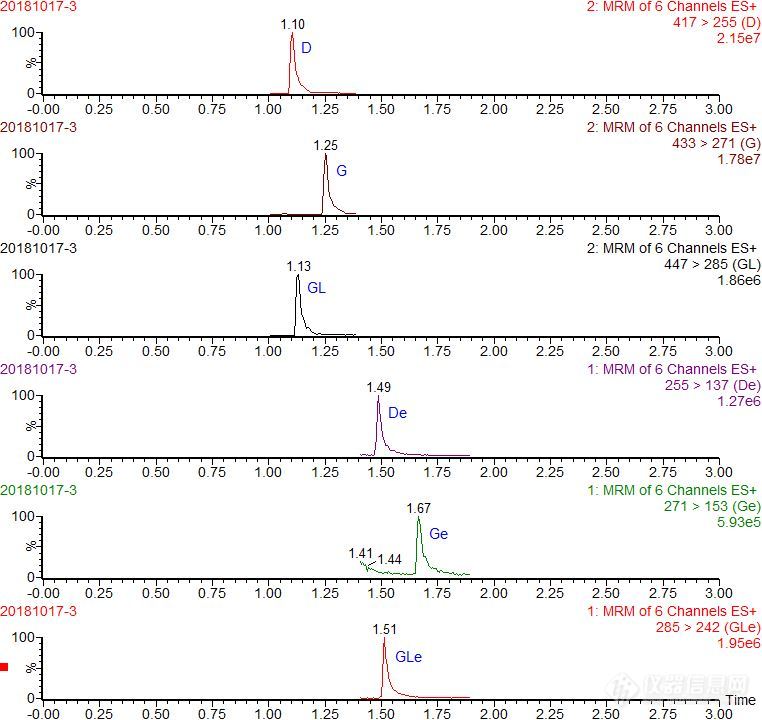
[align=center][b]超高效液相色谱-串联质谱法测定大豆中大豆异黄酮的含量[/b][/align][align=center]户江涛[/align][align=center](农业农村部豆类产品质量安全风险评估实验室(佳木斯),黑龙江省农垦科学院测试化验中心,黑龙江佳木斯 154007 )[/align]摘要:采用超高效液相色谱-串联质谱法建立了检测大豆中大豆异黄酮含量的分析方法。试样经90%甲醇水提取后,6种大豆异黄酮在C[sub]18[/sub]色谱柱上以0.1%甲酸水溶液和乙腈为流动相,进行液相色谱分离;质谱检测采用电喷雾正离子化模式和多反应监测模式(MRM)。结果表明,6种大豆异黄酮分别在0.01~0.5 mg/L(D、GL、G)和0.002~0.1 mg/L(De、GLe、Ge)范围内线性关系良好,相关系数(R)为0.9993~0.9998,定量限(LOQ)为0.0001 g/kg。在大豆空白样品添加浓度分别为0.01、0.05、0.2 g/kg(De、GLe、Ge)和0.2、1、2 g/kg(D、GL、G),6种大豆异黄酮的平均回收率为86.6%~96.2%,相对标准偏差(RSD)为1.07%~5.93%(n=6)。本方法简便、灵敏、抗干扰,适用于大豆中大豆异黄酮含量检测。关键词:超高效液相色谱-串联质谱;大豆;大豆异黄酮[align=center]Determination of soybeanisoflavone in soybean by ultra performance liquid chromatography-tandem massspectrometry[/align][align=center]HU Jiangtao[/align][align=center]([i]Laboratory of Qualityand Safety Risk Assessment for Soybean products, Ministry of Agriculture andRural Affairs, Testing and Analysis Center of Heilongjiang Academy of LandReclamation Sciences, Jiamusi 154007,China[/i])[/align][b]Abstract:[/b]A methodwasdeveloped for the determination of soybeanisoflavone in soybean by ultra performance liquid chromatography-tandem massspectrometry(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS). The samples were extracted by 90% methanol-water, then 6 soybean isoflavones were separated on aWaters BEH C[sub]18[/sub] column with gradient elution with the mobile phase of0.1% formic acid and acetonitrile, and finally detected by positive eletrosprayionization-mass spectrometry(ESI[sup]+[/sup]-MS/MS) in multiple reactionmonitoring(MRM) mode. The results showed the linearities of 6 soybean isoflavones were good in the concentrationrange of 0.01~0.5 mg/L(D、GL、G)and 0.002~0.1 mg/L(De、GLe、Ge), the correlation coefficients were 0.9993~0.9998. The limitof quantification(LOQ) of soybean isoflavone was 0.0001 g/kg. At the spiked levels of 0.01、0.05、0.2 g/kg(De、GLe、Ge)and 0.2、1、2 g/kg(D、GL、G) in the blank soybean samples, the mean recovery of soybeanisoflavone was 86.6%~96.2%, andthe relative standard deviation(RSD) was 1.07%~5.93%(n=6).This method is simple,sensitive, anti-jamming and suitable for simultaneous determination of soybean isoflavone in soybean.[b]Key words: [/b]ultra performance liquid chromatography-tandem massspectrometry (UPLC-MS/MS) soybean soybean isoflavone大豆异黄酮(soybean isoflavone)是一族化合物的统称,是大豆植物体内的一种次生代谢产物,是大豆主要活性成分之一,其母核为3-苯并吡喃酮,主要包括大豆苷、大豆黄苷、染料木苷及其相应苷元[sup][/sup]。研究表明,大豆异黄酮除具有天然抗氧化作用外[sup][/sup],还具有降低胆固醇含量、预防多种癌症及改善妇女更年期综合征等多方面生物功效[sup][/sup]。大豆异黄酮主要存在于大豆籽实中,其总含量约为0.4~5 g/kg,其中大豆苷、大豆黄苷和染料木苷这三种含量约占总量的97%~98%,而其对应的苷元含量仅占2%~3%左右[sup][/sup]。目前,大豆异黄酮的检测方法主要有高效液相色谱法(HPLC)[sup][/sup]、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法[sup][/sup]、紫外分光光度法[sup] [/sup]、质谱法(HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS[sup][/sup])等。紫外分光光度法[sup] [/sup]只能测定大豆异黄酮总量,且灵敏度不高;[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法[sup][/sup]需要对异黄酮进行衍生,前处理复杂;目前,大豆异黄酮检测现有的国家标准GB/T 26625-2011[sup] [/sup]采用的是高效液相色谱法(HPLC),在实际检测过程中发现,由于紫外检测器灵敏度不高,存在个别样品中异黄酮相应苷元检测不到的情况;同时大豆提取液中含有蛋白、脂肪等杂质影响色谱柱柱效,以至于不能满足分离度要求,严重干扰低含量组分峰面积积分定量。而[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法质谱检测器灵敏度高,通过选定大豆异黄酮的特征离子,能有效去除上述杂质干扰,定量更加准确可靠。目前,国内外采用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法检测大豆中大豆异黄酮含量的文献很少[sup][/sup]。本文对大豆中大豆异黄酮检测的前处理方法借鉴GB/T 26625-2011[sup][/sup],提取液改用UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS测定。该方法前处理过程简便、灵敏度高、分析时间短、抗干扰能力强,适用于大批量大豆样品中大豆异黄酮含量的检测。[b]1 实验部分[/b]1.1 材料与试剂大豆苷(daidzin,记为D,以下同)、大豆黄苷(glycitin,GL)、染料木苷(genistin, G)、大豆素(daidzein,De)、大豆黄素(glycitein, GLe)、染料木素(genistein,Ge)(纯度≥99%,Dr.Ehrenstorfer公司);甲醇、乙腈、甲酸(色谱纯,Fisher公司);实验用水为Millipore纯水仪制备。1.2 仪器与设备Acquity UPLC型超高效液相色谱仪(Waters公司);XEVO TQ-S三重四级杆质谱仪(Waters公司);KQ-500DE型超声波仪(昆山市超声仪器有限公司);涡旋混合器(IKA公司);CR21GⅢ型高速离心机(HITACHI公司)。1.3 大豆异黄酮标准储备液的配置分别称取适量的D、GL、G、De、GLe、Ge标准品,用甲醇配置成质量浓度为1mg/mL标准储备液,于-18℃冰箱保存(有效期6个月),待用;使用时用10%甲醇水逐级稀释成所需浓度的混合标准工作液,现用现配。1.4 样品前处理提取:称取粉碎均与后的试样1.0g(精确到0.01g)于50mL聚乙烯离心管中,加入10.0 mL90%甲醇水,涡旋混合30 s后置于60℃超声波清洗器中提取30 min,在离心机中以15000 r/min离心5 min,将上清液转移至100 mL容量瓶中,残渣再加入10.0 mL90%甲醇水溶液按上述步骤提取后,合并两次上清液于100 mL容量瓶中,用10%甲醇水溶液定容至刻度,摇匀。a)De、GLe、Ge的测定:取1 mL过0.22um有机系微孔滤膜,供UPLC/MS/MS分析测定;b)D、GL、G的测定:由于D、GL、G含量较高,需要将a)中过完滤膜的待测液用10%甲醇水稀释50倍后,供UPLC/MS/MS分析测定。1.5 液相色谱及质谱条件液相色谱:色谱柱:Waters BEH C[sub]18[/sub](1.7 μm,50mm×2.1mm);柱温:30℃;流速:0.5 mL/min;进样量:1μL;流动相A:乙腈;流动相B:0.1%的甲酸水溶液。梯度洗脱程序:0~0.5min,10% A;0.5~3. 0 min,10%~100% A;3. 0 ~4. 0 min,100%A,4 ~4.1.1min,100% A~10% A,4.1 ~5.0min 10% A。质谱:离子源:电喷雾离子源( ESI [sup]+[/sup] ) ;扫描方式:正离子扫描;检测方式:多反应监测( MRM);毛细管电压:3.2 kv;离子源温度:150℃;去溶剂气温度:500℃;去溶剂气流量:1000 L /h;定性、定量离子对及碰撞能量见表1。[align=center]表1大豆异黄酮的质谱参数[/align][align=center]Table 1 MRM parameters of soybean isoflavone[/align] [table][tr][td] [align=center]Analyte[/align] [/td][td] [align=center]Cone/V[/align] [/td][td] [align=center]Parent ion/(m/z)[/align] [/td][td] [align=center]Daughter ion/(m/z)[/align] [/td][td] [align=center]Collision energy/V[/align] [/td][/tr][tr][td] [align=center]D[/align] [align=center] [/align] [/td][td] [align=center]30[/align] [align=center] [/align] [/td][td] [align=center]417[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]255﹡[/align] 137[/td][td] [align=center]27[/align] [align=center]18[/align] [/td][/tr][tr][td] [align=center]G[/align] [align=center] [/align] [/td][td] [align=center]30[/align] [align=center] [/align] [/td][td] [align=center]433[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]271﹡[/align] 153[/td][td] [align=center]21[/align] [align=center]50[/align] [/td][/tr][tr][td] [align=center]GL[/align] [align=center] [/align] [/td][td] [align=center]30[/align] [align=center] [/align] [/td][td] [align=center]447[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]285﹡[/align] 270[/td][td] [align=center]25[/align] [align=center]46[/align] [/td][/tr][tr][td] [align=center]De[/align] [align=center] [/align] [/td][td] [align=center]25[/align] [align=center] [/align] [/td][td] [align=center]255[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]137﹡[/align] 181[/td][td] [align=center]30[/align] [align=center]26[/align] [/td][/tr][tr][td] [align=center]Ge[/align] [align=center] [/align] [/td][td] [align=center]25[/align] [align=center] [/align] [/td][td] [align=center]271[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]153﹡[/align] 215[/td][td] [align=center]30[/align] [align=center]25[/align] [/td][/tr][tr][td] [align=center]GLe[/align] [align=center] [/align] [/td][td] [align=center]25[/align] [align=center] [/align] [/td][td] [align=center]285[/align] [align=center][sup] [/sup][/align] [/td][td] [align=center]242﹡[/align] 168[/td][td] [align=center]27[/align] [align=center]35[/align] [/td][/tr][/table]﹡quantitativeion[b]2 结果与讨论[/b]2.1 色谱及质谱条件的优化流动相的选择:对比了酸性体系(0.1%甲酸水溶液)与非酸性体系(纯水、乙酸铵溶液)分别与甲醇、乙腈的流动相体系组合,结果发现目标物在酸性体系中比非酸性体系响应更高、峰形更好;同时大豆提取液中含有蛋白、脂肪等杂质可能会残留在色谱柱上,影响色谱柱的使用寿命,而乙腈比甲醇体系洗脱能力更强,可以有效去这些杂质。综合考虑目标物信号强度、色谱分离效果以及除杂等因素,本研究采用0.1%甲酸水溶液+乙腈流动相体系。质谱的选择:根据6种大豆异黄酮的分子量,用10%甲醇水配置1.0 mg/L 大豆异黄酮标准溶液直接注射到质谱中,在正离子模式下分别对各种组分进行母离子及对应子离子全扫描,最终确定的质谱条件见表1。2.2 质谱法(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)与色谱法(HPLC)的比较国家标准《GB/T 26625-2011粮油检验大豆异黄酮含量测定高效液相色谱法》[sup][/sup]中规定的大豆异黄酮检测方法为HPLC法。对同一大豆样品分别采用本文UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法(MRM色谱图见图1、2)和GB/T 26625 HPLC法检测,结果表明这两种方法测定的大豆异黄酮总含量值基本一致。由于De、GLe、Ge这三种苷元在大豆中含量很低,用HPLC法检测时,紫外检测器灵敏度不高,存在个别样品中上述三种组分检测缺失的情况;同时在实际大批量样品检测中发现,随着进样次数的增加,色谱柱柱效下降,大豆提取液中存在的蛋白、脂肪等杂质对含量低的目标物峰干扰越来越大,定量困难。研究发现,同浓度的大豆异黄酮在质谱检测器上的响应值要远远超过紫外检测器,同时质谱法可以通过选定大豆异黄酮的特征离子,有效地去除杂质的干扰,其目标物分离度不受色谱柱进样次数增加的影响,定量更加准确可靠。[align=center][img=,690,651]https://ng1.17img.cn/bbsfiles/images/2019/08/201908050912587968_4111_3299836_3.jpg!w690x651.jpg[/img][/align][align=center]图1 大豆异黄酮标准溶液(0.01mg/L)MRM色谱图[/align][align=center]Fig.1 MRM chromatograms of soybean isoflavone standard solution at 0.01 mg/L[/align][align=center][/align][align=center][img=,690,653]https://ng1.17img.cn/bbsfiles/images/2019/08/201908050913342201_5843_3299836_3.jpg!w690x653.jpg[/img][/align][align=center]图2 大豆样品中大豆异黄酮MRM色谱图[/align][align=center]Fig.2 MRM chromatograms of soybean isoflavone in soybean[/align]2.3线性范围和定量限吸取不同体积的大豆异黄酮标准储备液(1.3),用10%甲醇水分别配置0.002、0.005、0.01、0.05、0.1(De、GLe、Ge)和0.01、0.05、0.1、0.2、0.5(D、GL、G)的大豆异黄酮上机混合标准溶液,以各自定量离子的峰面积为Y对应质量浓度X(mg/L)做标准曲线,得到的线性方程和相关系数见表2。结果表明,大豆异黄酮标准溶液在各自浓度范围内线性良好,相关系数R为0.9993~0.9999。以10倍信噪比(S/N)计算,大豆异黄酮上机液最低定量浓度为0.001 mg/L,通过公式(1)计算得到大豆中大豆异黄酮含量,最终确定本方法大豆异黄酮的定量限(LOQ)为0.0001 g/kg。糠氨酸质量分数计算公式:[align=center][img=,207,87]https://ng1.17img.cn/bbsfiles/images/2019/08/201908050915166414_5621_3299836_3.jpg!w207x87.jpg[/img] ………………(1)[/align] 式中:X为试样中大豆异黄酮含量,以g/kg计;C为大豆异黄酮上机浓度(mg/L);V为定容体积(V=100)。表2 大豆异黄酮标准溶液的线性方程和相关系数[align=center]Table 2 Linear equation and correlation of soybean isoflavone in 10% methanol-water standard solutions[/align] [table][tr][td] [align=center]Analyte[/align] [/td][td] [align=center]Linear range/(mg/L)[/align] [/td][td] [align=center]Linear equation[/align] [/td][td] [align=center]R[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]D[/align] [align=center]GL[/align] [align=center]G[/align] [align=center]De[/align] [align=center]GLe[/align] [align=center]Ge[/align] [/td][td] [align=center][sup]0.01~0.5[/sup][/align] [align=center][sup]0.01~0.5[/sup][/align] [align=center][sup]0.01~0.5[/sup][/align] [align=center][sup]0.002~0.1[/sup][/align] [align=center][sup]0.002~0.1[/sup][/align] [align=center][sup]0.002~0.1[/sup][/align] [/td][td] [align=center]Y=2393.6x+479.38[/align] Y=1885x+139.66 [align=center]Y=1470.9x+187.97[/align] [align=center]Y=4287.9x+442.79[/align] [align=center]Y=3521.7x-103.62[/align] [align=center]Y=1993x+122.79[/align] [/td][td] [align=center]0.9995[/align] [align=center]0.9999[/align] [align=center]0.9993[/align] [align=center]0.9998[/align] [align=center]0.9997[/align] [align=center]0.9998[/align] [/td][td] [/td][/tr][/table]2.4回收率和精密度大豆中De、GLe、Ge含量较低,而D、GL、G含量较高,故本方法准确度实验分为高低浓度梯度组进行加标。称取大豆试样1.00 g,分别添加0.01、0.05、0.2 g/kg(De、GLe、Ge)和0.2、1、2 g/kg(D、GL、G),每个水平重复6次,同时做该大豆的空白本底实验。按照1.4前处理方法处理后上机检测,计算回收率(扣除空白),结果表明:不同添加浓度下,De、GLe、Ge的平均回收率为91.7%~96.2%,相对标准偏差(RSD,n=6)为2.78%~5.93%;D、GL、G的平均回收率为86.6%~93.8%,相对标准偏差(RSD,n=6)为1.07%~3.77%。[b]3 结语[/b]本文建立了超高效液相色谱-串联质谱法(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)测定大豆中大豆异黄酮含量的分析方法。该方法灵敏度高,线性范围宽,能同时覆盖大豆中多梯度浓度大豆异黄酮组分含量的测定。同时该方法具有较高的准确度和精密度,前处理步骤简单,分析速度快,可有效避免由于色谱柱柱效下降对最终检测结果的影响,特别适合大批量样品的检测。田娟娟, 宋宏哲, 张飞, 等. 水剂法纯化大豆异黄酮的研究. 大豆通报, 2005, 6:19-22. Hagen M K, Ludke A, Araujo A S, et al.Antioxidant characterization of soy derived products in vitro and the effect ofa soy diet on peripheral markers of oxidative stress in a heart disease model .Canadian Journal of Physiology and Pharmacology, 2012,90(8):1095-1103. 徐春华, 张治广, 谢明杰, 等. 大豆异黄酮的抗氧化和抗肿瘤活性研究研究 . 大豆科学, 2010, 29(5): 870-873. 李俏俏, 王清路, 薛金艳, 等. 大豆异黄酮对绝经女性血清中脂类物质的影响的研究 . 大豆科学, 2009, 28(1):172-174. 胡润芳, 张玉梅, 陈宇华, 等. 大豆异黄酮含量的初步研究. 东南园艺, 2017, 6:9-11. 刘琴, 朱媛媛, 白兴梁. 不同种类大豆中大豆异黄酮含量及抗氧化性比较. 北京工商大学学报(自然科学版), 2012, 30(6): 45-51. 袁凤杰, 姜莹, 董德坤, 等. 中国大豆核心种质异黄酮含量分析.中国粮油学报, 2011, 26(2):5-8. Tepavcevic V, Atanackovic M,Miladinovic J,et al. Isoflavone composition,total polyphenolic content,and antioxidant activity in soybeans of different origin. MedFood,2010,13(3):657-664 GB/T 26625-2011《粮油检验大豆异黄酮含量测定高效液相色谱法》. Liggins J,Bluck J C. Deidzein and genistein content of fruits and nuts. Journal ofNutritional Biochemistry,2000,11(6):326-331. 鞠兴荣, 袁建, 汪海峰. 三波长紫外分光光度法测定大豆异黄酮含量的研究. 食品科学, 2001, 22(5):46-48.
液相色谱-质谱联用技术在测定血液中左炔诺孕酮含量的应用,各位如果有时间请帮忙翻译看看,小妹先谢了。[~79658~]
想测鱼类养殖暴露水中(培养皿养)DEHP含量,请问各位老师有详细的检测方法吗?HPLC,GC-MS的都行。我目前搜到的是HJ/T 72-2001,不知道还有没有其他方法?(不会质谱的我要自己测含量了,害)
求助:GB/T 5009.204-2005 食品中丙稀酰胺含量的测定方法 [url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]-质谱(GC-MS)法各位老大!帮帮忙,本人急需此标准。
[b]行業開始更新測試PFOS & PFOA 的方法 .... ISO 23702-1:2018...好像在本壇也沒有上傳... 有大大可以發一個嗎?[color=#333333]皮革--有机氟--第1部分:用液相色谱/串联质谱检测器([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)萃取法测定非挥发性化合物含量[/color][/b]
我想咨询一下,一种物质在某一样品的含量,用质谱测和用液相测,含量能差多少,5%??10%?; 一个测化妆品中物质的含量的方法用到别的样品测得的含量差多少?
饲料研究. 2019,42(01)北大核心[color=#343434][back=none]印刷版[/back][/color]▼[color=#506697][back=transparent][/back][/color][list][*] [*] [*] [*] [*] [*][url=https://x.cnki.net/search/common/testlunbo?dbcode=CJFD&tablename=CJFDLAST2019&filename=slyj201901022&filesourcetype=1]记笔记[/url][/list][align=center][b][url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]法测定进口鱼粉中镉含量的不确定度评定周衡刚[size=12px]1,2[/size]朱克卫[size=12px]1,2[/size]刘正华[size=12px]3[/size]徐正华[size=12px]1,2[/size]邓锦华[size=12px]1,2[/size]郑思珩[size=12px]1,2[/size]许文娟[size=12px]1,2[/size]1. 黄埔海关2. 国家酒类检测重点实验室(广东) 3. 中山市小榄镇农业服务中心 [/b][/align]摘要:[color=#666666]采用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]法测定进口鱼粉中的镉含量,对整个测量过程的不确定来源进行了分析,并对不确定度各个分类进行了评定和合成。结果表明,[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]法测定进口鱼粉中的镉含量的不确定度来源主要为工作曲线的拟合和样品的重复性测定。采用本方法测定了一个进口鱼粉中镉含量的测定结果为(0.959±0.048)mg/kg(k=2,p=95%)。 [/color]关键词:不确定度 镉 [url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]法 鱼粉 基金资助:广东出入境检验检疫局科技项目(项目编号:2018GDK52);[list][*]DOI:10.13557/j.cnki.issn1002-2813.2019.01.022[*]专辑:农业科技[*]专题:畜牧与动物医学[/list]
电感耦合等离子体串联质谱法测定钽酸锂中金、钠、钾和钙的含量作者:墨淑敏、祝利红等
T/BPCT 001-2023牛乳及制品中A2 β-酪蛋白含量的测定 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]质谱法
1 试剂和对照品除特殊说明,所用试剂均为色谱纯。1.1 试剂:甲酸,甲醇,氯化钠(分析纯),乙腈1.2 对照品:邻苯二甲酸酯类混合对照(供含量测定用)、DNP(供含量测定用)2 仪器2.1 液相质谱联用仪(API3200)2.2 分析天平2.3 超声震荡器2.4 涡旋仪2.5 离心机2.6 氮吹仪3 分析方法3.1 色谱参考条件1-适用于DNP3.1.1 色谱柱:以十八烷基硅烷健合硅胶为填充剂(柱长5cm,内径4.6mm,粒径2.7μm )或同等性能的色谱柱3.1.2 柱温:40℃3.2 色谱参考条件2-适用于剩余的22种塑化剂3.2.1 色谱柱:以十八烷基硅烷健合硅胶为填充剂(柱长5cm,内径4.6mm,粒径2.7μm )或同等性能的色谱柱与以十八烷基硅烷健合硅胶为填充剂(柱长15cm,内径4.6mm,粒径5μm )或同等性能的色谱柱两根串联3.2.2 柱温:40℃3.2.3 流动相:时间(分钟)流速(ml/min)0.1%甲酸水溶液(%)甲醇(%)0.000.820802.000.820805.000.820808.000.829813.000.829813.101.229814.001.229814.011.329818.001.329818.100.8208023.000.820803.2.4 质谱条件:ESI+ 模式化合物 Q1Q3Time(msec)IDDPEPCECXP邻苯二甲酸酯二壬酯419.335149.100300DNP 166.06.0021.004.00 419.335275.200300DNP 260.45.6215.356.25邻苯二甲酸酯二甲酯195.116320DMP 11510163 195.113520DMP 21510353邻苯二甲酸二乙酯223.1149.120DEP 12010273 223.1121.120DEP 22010443邻苯二甲酸二丙酯251.214920DPrP12310173 251.2191.120DPrP22310173邻苯二甲酸二异丙酯251.214920DIPrP12310173 251.2121.120DIPrP22310173邻苯二甲酸二烯丙酯247.1189.120DAP 12010123 247.1149.120DAP 22010263邻苯二甲酸二异丁酯279.214920DIBP 12310223 279.2205.120DIBP 22310123邻苯二甲酸二丁酯279.214920DBP 12310223 279.2205.120DBP 22310123邻苯二甲酸二(2-甲氧基)乙酯283.2207.120DMEP 12810113 283.259.120DMEP 22810303邻苯二甲酸二异戊酯307.27120DIPP13010253 307.2149.120DIPP23010213邻苯二甲酸二(4-甲基-2-戊基)酯335.314920BMPP 13010273 335.3167.120BMPP 23010183邻苯二甲酸二(2-乙氧基)乙酯311.2221.120DEEP 13010123 311.273.120DEEP 23010213邻苯二甲酸二戊酸307.2149.120DPP13010213 307.2219.120DPP23010123邻苯二甲酸丁基苄基酯313.291.120BBP 13010403 313.2149.120BBP 23010213邻苯二甲酸二己酯335.314920DHXP 13010273 335.3233.120DHXP 23010123邻苯二甲酸二(2-丁氧基)酯367.3101.120DBEP 13510183 367.3249.120DBEP 23510123邻苯二甲酸二环己酯331.2149.120DCHP 13010363 331.2167.120DCHP 23010213邻苯二甲酸二庚酯363.214920DHP 13510223 363.2247.120DHP 23510133邻苯二甲酸二(2-乙基)己酯391.314920DEHP 13510253 391.3167.120DEHP 23510203邻苯二甲酸二苯酯319.122520D_P 13010163 319.17720D_P 23010543邻苯二甲酸二正辛酯391.314920DNOP 13510253 391.3261.220DNOP 23510133邻苯二甲酸二异壬酯419.314920DINP 13810543 419.3127.220DINP 23810183邻苯二甲酸二异癸酯447.214120DIDP 14510153 447.2289.220DIDP 24510153CURCADISTEMGS1GS2256550065065653.3 溶液制备3.3.1对照品溶液制备:3.3.1.1邻苯二甲酸酯二壬酯(DNP)对照液:精密称取邻苯二甲酸酯二壬酯(DNP)对照品5mg,置于500ml容量瓶中,加入适量甲醇超声溶解,定容。精密量取1ml置于100ml容量瓶中,加入甲醇定容至刻度,摇匀,过0.45μm的滤膜,即得。3.3.1.2邻苯二甲酸酯类混合对照液:精密量取邻苯二甲酸酯类混合对照品1ml,置于100ml容量瓶中,加入甲醇定容至刻度,摇匀,过0.45μm的滤膜,即得。3.3.2供试品溶液制备:3.3.2.1不含油脂固体或半固体试样 取固体试样20粒(片)或10g(若试样为胶囊,应取内容物),研细,混合均匀。精密称取试样1.0g,置于50ml具塞比色管中,精密量取5ml乙腈,超声(功率500W,频率50kHz)处理至提取完全(约5min),取上清液,经0.45μm的滤膜过滤,即得。3.3.2.2 含油脂试样 精密称取混合均匀试样1.0g,置于25ml具塞磨口玻璃试管中,加入5ml乙腈,涡旋混合2min, 超声(功率500W,频率50kHz)处理至提取完全(约10min),离心,收集上清液。重复提取一次,合并上清液。将提取液于40℃氮吹至干,精密量取1ml乙腈,超声(功率500W,频率50kHz)处理至提取完全(约1min),放入-18℃的冰箱冷藏2h,离心,取上清液,经0.45μm的滤膜过滤,即得。3.4 测定精密吸取对照品溶液进样量:2μL,4μL,6μL,8μL,10μL与供试品溶液进样量:10μl,注入液相质谱联用仪,建立标准曲线方程。供试品色谱中应呈现与对照品色谱峰保留时间相同的色谱峰定量。3.5 结果计算X=V×C×100/M式中: X—试样中邻苯二甲酸酯类的含量,mg/100g;C—试样溶液中邻苯二甲酸酯类的浓度,mg/mL; M—试样的质量,g; V—试样稀释的体积,mL。
[color=#333333]质谱定量实验测定乙腈的杂质含量,结果实验结果显示产生CO2??是什么原因,请指教![/color]

超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法测定婴幼儿配方奶粉中叶酸的含量[align=center]户江涛[/align][align=center](黑龙江省农垦科学院测试化验中心,黑龙江 佳木斯 154007 )[/align]摘要:本实验建立了超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法建立了检测婴幼儿配方奶粉中叶酸含量的分析方法。试样经50℃热水溶解,超声提取,等电法去除蛋白后,在T[sub]3[/sub]色谱柱上以0.1%甲酸水和乙腈为流动相进行[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]分离,质谱检测采用电喷雾正离子化模式和多反应监测模式(MRM)。结果表明该方法在浓度范围内线性关系良好,相关系数(r)为0.9998,定量下限(LOQ)为10 [color=black]u[/color]g/100 g,加标回收率为83.7%~101%,相对标准偏差(RSD)为2.5%~5.1%(n=6)。本方法快速、灵敏、准确,特别适和大批量婴幼儿配方奶粉中叶酸含量检测。关键词:超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱;婴幼儿配方奶粉;叶酸[align=center]Determination of Folic acid in infant formula by ultra performance liquid chromatography-tandem mass spectrometry[/align][align=center]HU Jiangtao[/align][align=center](Testing and Analysis Center of Heilongjiang Academy of Land Reclamation Sciences, Jiamusi 154007,China)[/align]Abstract:A method was developed for the determination of Folic acid in infant formula by ultra performance liquid chromatography-tandem mass spectrometry(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS). The samples were disolved by 50℃ water,extracted by ultrasound,after protein was removed by Isoelectric method, Folic acid was separated on a Waters HSS T[sub]3[/sub] column with gradient elution with the mobile phase of 0.1% formic acid and acetonitrile, and finally detected by positive eletrospray ionization-mass spectrometry(ESI[sup]+[/sup]-MS/MS) in multiple reaction monitoring(MRM) mode. The results showed the linearity of Folic acid was good in the concentration range of 0.02~1 mg/L, and the correlation coefficient was 0.9998. The limit of quantification(LOQ) was 10 ug/100 g,the mean recovery was 83.7%~101%, and the relative standard deviation(RSD) was 2.5%~5.1%(n=6).This method is rapid, sensitive, accurate and suitable for simultaneous determination of Folic acid in infant formula.Key words: UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS infant formula Folic acid叶酸([font=helvetica][color=#333333]C[/color][/font][font=helvetica][sub][size=12px][color=#333333]19[/color][/size][/sub][/font][font=helvetica][color=#333333]H[/color][/font][font=helvetica][sub][size=12px][color=#333333]19[/color][/size][/sub][/font][font=helvetica][color=#333333]N[/color][/font][font=helvetica][sub][size=12px][color=#333333]7[/color][/size][/sub][/font][font=helvetica][color=#333333]O[/color][/font][font=helvetica][sub][size=12px][color=#333333]6 [/color][/size][/sub][/font]),[font=helvetica][color=#333333]又名维生素B[/color][/font][font=helvetica][sub][color=#333333]9[/color][/sub][/font][font=helvetica][color=#333333],[/color][/font]是一种水溶性维生素,在人类蛋白质合成、细胞分裂与生长过程中具有重要作用。叶酸缺乏可能会引起婴幼儿[font=helvetica][color=#333333]发生神经闭合不完全[/color][/font],从而导致神经性厌食症,叶酸虽然广泛存在于[font=helvetica][color=#333333]如菠菜等绿叶蔬菜及肝脏等动物源食品中,但在婴幼儿阶段(特别小于6个月婴儿)很长一段时间不能直接食用这些辅食,[/color][/font]这时婴幼儿配方奶粉便成为婴幼儿获取叶酸的重要途径,因此准确测定婴幼儿配方奶粉中叶酸含量有重要意义。目前食品中叶酸测定的国标方法《GB 5009.211-2022 食品安全国家标准 食品中叶酸的测定》为微生物法,该方法是将鼠李糖乳杆菌接种至含有叶酸的培养基中,培养一段时间后测定吸光度,利用在一定范围内叶酸含量与吸光度值符合某种规律而得到叶酸含量数值。该方法对菌种活力、培养条件、检验人员操作水平要求较高,检测周期较长,且容易受到基质干扰、检测结果重复性往往较差。因此,制定一种准确、高效、快速测定婴幼儿配方奶粉中叶酸的检测方法十分必要。[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱测定法具有前处理简单、分析速度快、抗基质干扰能力强等优点,能有效避免叶酸在长时间、繁琐的前处理及检测过程中损失,可以为奶粉中叶酸含量的测定提供一种有效的检测手段。本文建立的超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法测定奶粉中叶酸含量[color=black]的方法前处理过程简便、分析时间短、灵敏度高、抗干扰能力强,且用到的都是实验室常用试剂,实验成本较低,特别适用于大批量[/color]婴幼儿配方[color=black]奶粉中叶酸[/color]含量的检测。1 实验部分1.1 材料与试剂[color=black]叶酸(纯度[/color][font=宋体][color=black]≥[/color][/font][color=black]99%,Dr公司);乙腈、甲酸(色谱纯,Fisher公司);盐酸、氢氧化钠(优级纯,科密欧公司);0.2 um水系滤膜;实验用水为Millipore纯水仪制备。[/color]1.2 仪器与设备UPLC XEVO TQ-MS超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]串联质谱仪(Waters公司);涡旋振荡器。1.3 [color=black]叶酸[/color]标准储备液的配置称取一定量叶酸[color=black]标准品[/color],用甲醇配置成质量浓度为100 ug/mL标准储备液,于-18℃冰箱保存,待用;临用前将溶液回温至室温,并吸取一定体积储备液用水逐级稀释成所需浓度的标准工作液。1.4 样品前处理准确称取2.00 g(精确到0.01 g) 婴幼儿配方奶粉试样于50 mL刻度离心管中,加入10 mL 50℃纯水使奶粉充分溶解,超声提取10 min,然后用2 mol/L盐酸调节试样pH值至1.7,静置5 min后用2 mol/L氢氧化钠调节试样溶液pH至4.5,用纯水定容至25 mL,在离心机中以10000 r/min离心10 min[color=black],取上清液[/color]过0.2 um水系微孔滤膜后供UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS分析测定。1.5 [url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]及质谱条件[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]:色谱柱:Waters HSS [font=times new roman]T3(1.8 μm,50mm×2.1mm);柱温:35℃[/font];流速:[font=times new roman]0.3 [/font]mL/min;进样量:[font=times new roman]2[/font] [font=times new roman]μL;流动相A:乙腈;流动相B:0.1%的甲酸水溶液。梯度洗脱程序:0~0.5min,5% A;0.5~3. 0 min,5%~100% A;3. 0 ~4. 0 min,100%A,4 ~4.1min,100% A~5% A,4.1 ~5.0min 5% A。[/font]质谱:离子源:电喷雾离子源( ESI [sup]+[/sup] ) ;扫描方式:正离子扫描;检测方式:多反应监测( MRM);毛细管电压:3.0 kv;离子源温度:150℃;去溶剂气温度:500℃;去溶剂气流量:1000 L /h;定性、定量离子对及碰撞能量见表1。[align=center]表1叶酸的质谱参数[/align][table][tr][td][align=center]分析物[/align][/td][td][align=center]锥孔电压/V[/align][/td][td][align=center]母离子/(m/z)[/align][/td][td][align=center]子离子/(m/z) [/align][/td][td][align=center]碰撞能量/V[/align][/td][/tr][tr][td]叶酸[/td][td][align=center]18[/align][/td][td][align=center]442.3[/align][/td][td][align=center]295﹡[/align]176[/td][td][align=center]18[/align][align=center]30[/align][/td][/tr][/table]﹡为定量离子2 结果与讨论2.1 色谱质谱条件及前处理过程的优化流动相的选择:B族维生素在酸性条件下比较稳定,对比了酸性体系(0.1%甲酸水溶液)与甲醇、乙腈的流动相体系组合,发现叶酸在乙腈体系中响应值更高,故本研究采用0.1%甲酸水溶液+乙腈流动相体系。色谱柱的选择:比较了[font=宋体]Waters [/font]BEH C[sub]18[/sub](1.7 μm,50mm×2.1mm)和[font=宋体]Waters [/font]HSS T[sub]3[/sub](1.8 μm,50mm×2.1mm)两种不同填料的分析柱,实验时发现目标物在C[sub]18[/sub]上保留比T[sub]3[/sub]弱,考虑到若出峰太早可能造成奶粉中一些极性强的基质随目标物共流出,可能会干扰目标物测定,因此本方法采用了HSS T[sub]3[/sub]色谱柱。质谱参数优化:将1.0 mg/L 叶酸标准溶液直接注射到质谱中,在正离子模式下分别进行母离子和子离子全扫描,同时优化质谱条件,找到两对响应好高、干扰小的子离子对,最终确定的质谱条件见表1,相应的色谱质谱图见图1、图2。前处理过程优化:叶酸属于水溶性维生素,易于氧化,这个实验过程需在避光条件下进行。通过查阅相关文献的前处理方法,发现通过先酸化样品再用NaOH调节pH的等电法去除蛋白方式,可以得到很好的提取和净化效果,能大大减少奶粉中蛋白等大分子基质对目标物干扰;调节pH后的溶液产生了蛋白沉淀,需要用过滤或离心方式予以去除,通过实验比较了过滤和离心去除蛋白沉淀的效果,发现高速离心后得到的上清液明显更容易通过0.2 um水系滤膜,综合以上因素本实验最终采用了1.4的前处理方法。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310041348335007_5097_1729077_3.png[/img][/align][align=center]图1 [color=black]叶酸[/color]标准溶液(1 ug/mL)MRM色谱图[/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310041348338570_9110_1729077_3.png[/img][/align][align=center]图2 奶粉样品中[color=black]叶酸[/color]MRM色谱图[/align][color=black]2.2 线性范围和定量限[/color][color=black]吸取不同体积的叶酸标准储备液(1.3),用[/color]纯水[color=black]分别配置不同浓度的[/color]上机标准溶液,以各自定量离子的峰面积为Y对应质量浓度X([color=black]m[/color]g/L)做标准曲线,得到的线性方程和相关系数见表2;以10倍信噪比(S/N)计算得到叶酸的定量下限,结果见表2。表2 叶酸标准溶液的线性方程、相关系数和定量下限(LOQ)[table][tr][td][align=center]分析物[/align][/td][td][align=center]线性范围/(mg/L)[/align][/td][td][align=center]线性方程[/align][/td][td][align=center]R[/align][/td][td][align=center]LOQ/(ug/100 g)[/align][/td][/tr][tr][td][align=center]叶酸[sub] [/sub][/align][/td][td][align=center]0.02~1[/align][/td][td][align=center]Y=12793X-56.759[/align][/td][td][align=center]0.9998[/align][/td][td][align=center]10[/align][/td][/tr][/table][color=black]2.3回收率和精密度[/color][color=black]选用[/color]不添加叶酸的奶粉样品作为基质进行加标。添加水平为:[color=black]20,100,200[/color][size=12px] ug/100g。[/size][color=black]每个[/color]水平重复6次,[color=black]同时做该奶粉的本底实验。[/color]按照1.4前处理方法处理后上机检测,回收率计算结果见表3。结果表明,该方法叶酸的平均回收率为83.7%~101%,相对标准偏差(RSD,n=6)为2.5%~5.1%,均满足实验要求。[align=center]表3 奶粉叶酸的加标回收率和相对标准偏差(n=6)[/align][table][tr][td][align=center]分析物[/align][/td][td][align=center]添加水平(ug/100g)[/align][/td][td][align=center]回收率/%[/align][/td][td][align=center]相对标准偏差/%[/align][/td][/tr][tr][td][align=center]叶酸[/align][sub] [/sub][/td][td][align=center]20[/align][align=center]100[/align][align=center]200[/align][/td][td][align=center]89.0±5.3[/align][align=center]95.3±2.7[/align][align=center]98.5±2.5[/align][/td][td][align=center]5.1[/align][align=center]3.2[/align][align=center]2.5[/align][/td][/tr][/table][color=black]2.4实际样品分析[/color][color=black]采用本方法随机抽取市售8批次婴幼儿配方奶粉,对其叶酸含量进行测定[/color],实测值、标示值及实测值与标示值比值见表4。结果表明,这些样品中叶酸实测含量均符合《GB 28050-2011 食品安全国家标准 预包装食品营养标签通则》中对维生素等营养成分的规定——婴幼儿配方奶粉中叶酸实际含量不应低于标示值的80%。[align=center]表4 实际样品中叶酸实测值与标示值比对结果[/align][table][tr][td][align=center]样品编号[/align][/td][td][align=center]实测值(ug/100g)[/align][/td][td][align=center]标示值(ug/100g)[/align][/td][td][align=center]比值[/align][/td][/tr][tr][td]1[sub] [/sub]2345678[/td][td][align=center]65[/align][align=center]156[/align][align=center]103.2[/align][align=center]57[/align][align=center]117[/align][align=center]86.5[/align][align=center]79[/align][align=center]101[/align][/td][td]81.3203230134106146198185[/td][td][align=center]1.25[/align]1.302.232.350.911.692.511.83 [/td][/tr][/table]3 结语本文建立了超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-串联质谱法(UP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)测定婴幼儿配方奶粉中[color=black]叶酸[/color]含量的分析方法。该方法具有较高的灵敏度、准确度和精密度,前处理快速、简单,特别适合大批量样品的检测。参考文献:[1] GB 5009.211-2016 食品安全国家标准 食品中叶酸的测定[s].[2] GB 28050-2011 食品安全国家标准 预包装食品营养标签通则[s].[3]张丽芳,张鑫,周鑫,等. 高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法同时测定婴幼儿奶粉中7种水溶性维生素[J].[size=13px] [/size]食品工业,2022,43(01):[size=13px] [/size]277-280.[4]刘娜,陈大舟,汤桦,等. 婴幼儿奶粉中8种水溶性维生素的高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]同时测定[J].[size=13px] [/size]分析测试学报,2008,27(4):[size=13px] [/size]408-411.[5]严华,崔凤云,别玮,等. 超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]-同位素稀释质谱法同时测定婴幼儿奶粉中10种水溶性维生素 [J].[size=13px] [/size]食品安全质量检测学报,2020,17(11):[size=13px] [/size]5871-5878.[6]郭建博,宋莉,牟霄,等.超高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法快速测定复合维生素产品中的10种水溶性维生素 [J].[size=13px] [/size]食品安全质量检测学报,2017,8(5):[size=13px] [/size]1794-1799.[7]夏静,俞婧,孙磊,等.功能性饮料中9种水溶性维生素的HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]-MS同步检测技术 [J]. 食品科学,2014,35(12): 196-199.[/s][/s]
求助文献:仿生提取电感耦合等离子体-质谱法同时测定小儿牛黄清心散中可溶性汞和砷含量作者:闫哲、龚华、曾祥程
求助文献:仿生提取电感耦合等离子体-质谱法同时测定小儿牛黄清心散中可溶性汞和砷含量作者:裴海燕、高慧珠等
GBT 223.81-2007 钢铁及合金 总铝和总硼含量的测定 微波消解-电感耦合等离子体质谱法 链接:http://www.docin.com/p-204279445.html
GB/T 223.81-2007 钢铁及合金 总铝和总硼含量的测定 微波消解-[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]法[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=191590]GBT 223.81-2007 钢铁及合金 总铝和总硼含量的测定 微波消解-[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]法.pdf[/url]
GB/T 223.81-2007 钢铁及合金 总铝和总硼含量的测定 微波消解-[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]法[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=191590]GBT 223.81-2007 钢铁及合金 总铝和总硼含量的测定 微波消解-[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]电感耦合等离子体质谱[/color][/url]法.pdf[/url]