Nature!庄小威团队利用MERFISH技术绘制小鼠全大脑分子可定义和高空间分辨的细胞图谱
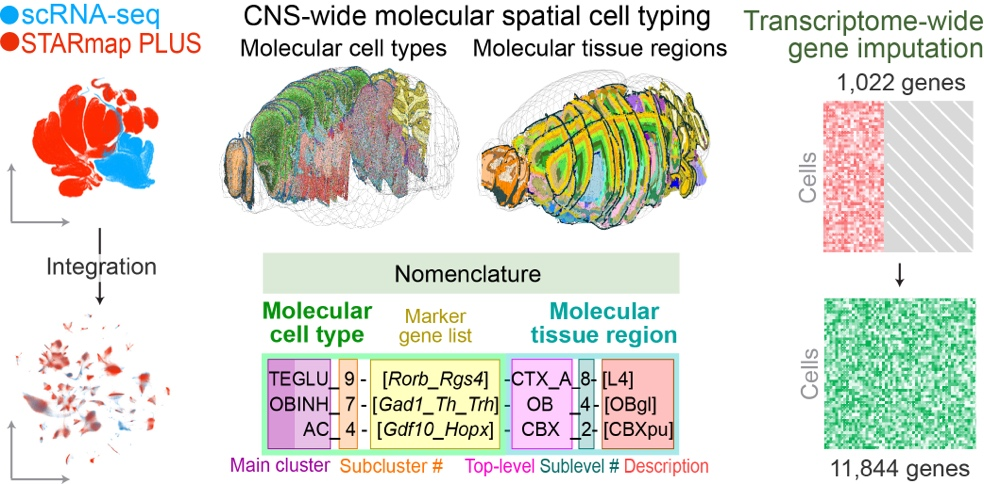
在哺乳动物的大脑中,许多不同类型细胞形成复杂的相互作用网络,从而实现广泛的功能。由于细胞的多样性和复杂的组织,人们对大脑功能的分子和细胞基础的理解受到了阻碍。单细胞RNA测序(scRNA-seq)和单细胞表观基因组分析的发展使发现大脑中许多分子上不同的细胞类型成为可能[1,2]。然而,这些研究中有限的样本量可能导致对大脑细胞多样性的低估。此外,了解大脑功能背后的分子和细胞机制不仅需要对细胞及其分子特征进行全面的分类,还需要详细描述分子定义的细胞类型的空间组织和相互作用。在更精细的尺度上,细胞之间的空间关系是通过相邻分泌和旁分泌信号传递的细胞间相互作用和通信的主要决定因素。虽然突触通信可以发生在细胞体相距较远的神经元之间,但神经元和非神经元细胞之间的相互作用以及非神经元细胞之间的相互作用通常借助直接的体细胞接触或旁分泌信号,因此需要细胞之间的空间接近。而且涉及局部中间神经元的相互作用也倾向于发生在空间近端神经元之间。因此,一个高空间分辨率的全脑细胞图谱对于理解大脑的功能极其重要。来自美国哈佛大学的庄小威教授课题组使用多重误差鲁棒荧光原位杂交(MERFISH)技术对整个成年小鼠大脑中大约1000万个细胞中的1100多个基因进行了成像,并通过整合MERFISH和scRNA-seq数据,在全转录组尺度上进行了空间分辨的单细胞表达谱分析。研究人员在整个小鼠大脑中生成了5000多个转录不同的细胞簇(属于300多种主要细胞类型)的综合细胞图谱,将该图谱与小鼠大脑共同坐标框架进行定位,可以系统量化单个大脑区域的细胞类型组成和组织,并进一步确定了具有不同细胞类型组成特征的空间模块和以细胞渐变为特征的空间梯度。这种高分辨率的细胞空间图—每个细胞都具有转录组表达谱,有助于推断数百种细胞类型对之间的细胞类型特异性相互作用和预测这些细胞-细胞相互作用的分子(配体-受体)基础和功能。总之,此研究不仅为大脑的分子和细胞结构提供了丰富的见解,而且为其在健康和疾病中的神经回路和功能障碍奠定了基础。该结果于近日发表在Nature上,题为“Molecularly defined and spatially resolved cell atlas of the whole mouse brain”。研究小组通过MERFISH技术对横跨4只成年小鼠(1雌3雄)大脑整个半球的245个冠状面和矢状面切片上进行成像,根据DAPI和总RNA信号,单个RNA分子被识别并被分配到细胞,进而得到单个细胞的表达谱。总之,该研究对成年小鼠大脑中大约1000万个细胞进行成像和分割,包括11个主要的大脑区域:嗅觉区、等皮层(CTX)、海马形成、皮质底板(CS)、纹状体(ST)、苍白球、丘脑、下丘脑(HT)、中脑、后脑和小脑。基于典型相关性分析整合MERFISH数据和scRNA-seq数据,采用K最近邻(k-NearestNeighbor,KNN)分类算法对MERFISH细胞进行分类。为了对不同大脑区域的细胞类型组成和组织进行系统定量,他们将MERFISH生成的细胞图谱注册到艾伦脑科学研究所发布的小鼠脑三维图谱第三版(Allen Mouse Brain Common Coordinate Framework,CCFv3)[3],可将每个单独的MERFISH成像细胞及其细胞类型身份标签放入3D CCF空间(图1)。图1 对整个小鼠大脑的分子定义和空间分辨的细胞图谱(图源:Zhang, M., et al.. Nature, 2023)据统计,整个小鼠大脑由46%的神经元和54%的非神经元细胞组成,神经元细胞与非神经元细胞的比例在后脑中最低、在小脑中最高。神经元细胞包括315个亚类和超过5000个集群,其类型也表现出很强的区域特异性,大多数神经元亚类仅在11个主要区域中的一个区域富集。这11个主要区域包含了不同数量的细胞类型,尤其是后脑、中脑和下丘脑所包含的神经元细胞类型的数量以及局部复杂性远远高于其它大脑区域。基于神经递质转运体和参与神经递质生物合成相关基因的表达,他们将成熟的神经元分为8个部分重叠的组别。其中,谷氨酸能神经元和γ-氨基丁酸(GABA)能神经元分别约占神经元总数的63%和36%,谷氨酸能与GABA能神经元的比例在不同的大脑区域中差异很大,而5-羟色胺(5-HT)能、多巴胺能、类胆碱能、甘氨酸能、去甲肾上腺素能和组胺能神经元仅占神经元总数的2%(图2c)。谷氨酸能神经元和GABA能神经元广泛分布于全脑,可分为具有不同空间分布的不同细胞类型;在谷氨酸能神经元中,Slc17a7(Vglut1)、Slc17a6(Vglut2)和Slc17a8(Vglut3)在不同的脑区分布存在差异,Slc17a7主要位于嗅觉区、CTX、海马形成、CS和小脑皮层,而Slc17a6主要位于HT、中脑和后脑(图2d,e)。他们还观察到两个未成熟神经元(IMNs)亚类:一种是抑制性的,一种是兴奋性。抑制性IMNs由30个簇组成,沿脑室下区(SVZ)分布,通过前连合处延伸至嗅球;兴奋性IMNs由七个簇组成:簇516主要位于嗅觉区域,而其它簇沿海马体形成的齿状回分布(图2f),这与之前关于海马形成中成人神经发生的发现一致[4]。图2 神经元细胞的类型和空间分布(图源:Zhang, M., et al.. Nature, 2023)非神经元细胞包括23个亚类和117个簇。通过量化,研究小组发现在整个大脑中,非神经元细胞由30%少突胶质细胞、6%少突胶质细胞前体细胞(OPCs)、28%血管细胞、23%星形胶质细胞、8%免疫细胞和5%其它类型细胞组成。一些非神经元细胞类型,特别是星形胶质细胞和心室系统中的细胞也表现出很强的区域特异性。星形胶质细胞包括36个细胞簇,最大的两个集群Astro 5225和Astro 5214,分别占星形胶质细胞总数的48%和33%。基本上每个Astro星团都显示出独特的空间分布,Astro 5225只位于端脑区,Astro 5214只位于非端脑区,Astro 5215位于丘脑,Astro 5216位于后脑,Astro5231-5236位于嗅球,Astro 5207位于小脑,Astro 5222位于齿状回,Astro 5208富集于靠近软脑膜表面的髓质,Astro 5228、5229和5230位于SVZ沿线,延伸至嗅球,并与抑制性IMNs广泛共定位(图3d)。少突胶质细胞在纤维束中富集,在整个脑干中十分丰富,而OPCs则均匀分布地整个大脑;在集群水平上,一些少突胶质细胞和OPCs也表现出区域特异性,如Oligo 5277在皮层中富集,而Oligo 5286在后脑中富集(图3e)。与心室系统相关的细胞也呈现区域特异性分布,在第三脑室,下丘脑室管膜—胶质细胞位于腹侧区域,而ependymal细胞占据背侧区域,Hypendymal细胞位于第三脑室背侧的下联合器,心室内的主要细胞是脉络膜丛细胞和血管软脑膜细胞(VLMCs)。除了VLMC 5301和VLMC 5302,大多数VLMC集群被限制在软脑膜(图3f)。图3 非神经元细胞的类型和空间分布(图源:Zhang, M., et al.. Nature, 2023)接下来,研究团队为每个细胞定义了一个局部细胞类型的组分矢量,并使用这些矢量聚类细胞,从而得到了包含相似邻域细胞类型组成的细胞的“空间模块”(图4a)。他们确定了16个一级空间模块和130个二级空间模块,一级空间模块将大脑分割成与CCF中定义的主要大脑区域基本相吻合的区域,一个显著的差异是中脑和后脑之间的边界(图4b,c)。许多2级空间的模块与CCF中定义的子区域一致,但观察到更多的差异(图4d)。此研究中的空间模块描述是基于单个细胞的转录组范围内的表达谱所定义的细胞类型,因此比CCF中脑区描述的信息具有更高的分子分辨率,空间梯度代表了对该区域的分子轮廓的更精确的描述。图4 空间模块:分子定义的大脑区域(图源:Zhang, M., et al.. Nature, 2023)考虑到在某些情况下,细胞的基因表达谱可能会表现出渐进或连续的变化,他们因此检查了所有的细胞亚类,结果发现细胞的空间梯度广泛分布在大脑的许多区域。例如,颅内(IT)神经元在整个CTX上形成了一个连续的梯度,在这个区域,基因表达沿皮层深度方向逐渐变化,但第2/3层IT神经元的分离更为明显(图5a)。在纹状体中,D1和D2中棘神经元均沿背外侧-腹内侧轴形成空间梯度(图5b,c)。在外侧间隔复合体(LSX)中,几个GABA能亚类沿着背腹轴形成了一个梯度(图5d)。在海马体的CA1、CA3和齿状回区域和中脑的下丘中也观察到空间梯度。他们也观察到了一些非神经元细胞之间的空间梯度,如下丘脑室管膜—胶质细胞,沿着第三脑室的背腹轴形成了一个连续的梯度(图5e)。通过基于UMAP(一致的多方面逼近和投影以进行降维)的基因表达可视化分析,他们发现一个大规模的跨越HT、中脑和后脑区域的空间梯度(图5f)。图5 分子定义的细胞类型的空间梯度(图源:Zhang, M., et al.. Nature, 2023)最后,他们分析了亚类水平上的细胞类型,并推断单个大脑区域中细胞类型特异性的细胞-细胞相互作用(包括非神经元细胞间,非神经元细胞和神经元之间以及神经元间)。几百对细胞亚类被确定,统计学结果显示有显著的相互作用。预测的大多数具有相互作用的细胞类型对包含多个配体-受体对,与同一细胞类型对中的非近端细胞对相比,近端细胞对的表达显著上调,为这些细胞间相互作用的分子基础提供了见解。在非神经元细胞之间,发现内皮细胞和周细胞均与大脑中的边缘相关巨噬细胞(BAMs)、巨噬细胞有显著的相互作用。在这两种情况下,与非近端细胞对相比,来自层粘连蛋白信号通路的配体-受体对在近端细胞对中均明显上调,一些细胞因子(内皮细胞中的Cytl1和周细胞中的Ccl19)在BAMs近端血管细胞中表达上调,这说明大脑中的血管细胞可能利用这些细胞因子来招募巨噬细胞(图6d,e)。小胶质细胞也被发现与内皮细胞、周细胞之间的显著相互作用;与内皮细胞相比,周细胞与小胶质细胞相互作用的可能性更高,而与BAMs相互作用的趋势则相反(图6f,g)。他们还观察到神经元和非神经元细胞之间的显著相互作用,例如星形胶质细胞和抑制性IMNs在嗅球中、星形胶质细胞和兴奋性IMNs在海马形成中表现出显著的相互作用。此分析也预测了一些神经元亚类之间的相互作用,例如,海马形成过程中Pvalb枝形吊灯状GABA神经元和CA3谷氨酸能神经元之间、IPN Otp Crisp1 GABA神经元和中脑的DTN-LDT-IPN Otp Pax3 GABA神经元之间的相互作用。图6 细胞间的相互作用和通信(图源:Zhang, M., et al.. Nature, 2023)文章结论与讨论,启发与展望通过MERFISH技术成像约1000万个细胞,并将MERFISH数据与全脑scRNA-seq数据集整合,该研究生成了一个具有高分子和空间分辨率的、横跨整个小鼠大脑的分子定义的细胞图谱。进一步将该图谱注册到了艾伦脑科学研究所发布的CCF中,提供了一个可被科学界广泛使用的参考细胞图谱,使科研人员能够确定每个大脑区域不同转录细胞类型的组成、空间组织和潜在的相互作用。一方面,非神经元细胞与神经元细胞或非神经元细胞之间的相互作用,以及配体-受体对、基因的相关上调,为测试不同非神经元细胞类型的功能作用提供了切入点。另一方面,将转录组成像与不同行为范式下的神经元活动成像相结合可以揭示神经元的功能角色[5]。未来的研究将结合空间分辨的转录组学分析和各种其它特性的测量(如表观基因组谱、形态学、细胞的连通性和功能、系统的基因扰动方法),将有助于大家阐述大脑的分子和细胞结构的功能和功能障碍在健康和疾病中的作用。MERFISH(Multiplexed Error-Robust Fluorescence In Situ Hybridization),一种空间分辨的单细胞转录组学方法,经过近年的发展已成为生命科学领域中最具有前景的单细胞测序技术之一。该技术独特的原理和方法,可实现对单细胞进行多重靶向探测,从而深入研究细胞的生物学特性,对于疾病诊治及药物研发等方面也有着广泛的应用价值。