[B]分子印迹技术在样品前处理中的应用[/B][I]作者:胡小刚 李攻科[/I]摘 要 分子印迹聚合物具有选择性高、稳定性好及制备简单的特点,可用于生物、医药、环境样品等复杂基体中痕量分析物的高选择性分离与富集,因此在样品前处理中的应用特别引人关注。本文介绍了分子印迹技术的基本原理,综述了分子印迹技术在样品前处理中应用的研究进展。关键词 分子印迹,样品前处理,固相萃取,固相微萃取,膜分离,评述1 引 言 复杂基体如生物、医药和环境样品中痕量、超痕量物质分析要依赖高效和高选择性的样品前处理技术。但相对于仪器分析技术的发展,样品前处理技术的进展一直较缓慢。 固相萃取(SPE)是70年代中期出现的技术。其萃取机制取决于分析物与固相(填充剂)表面的活性基团之间的分子间作用力。SPE填充剂主要为键合材料,如C8、C18离子交换树脂等,选择性不强,在富集分析物的同时,大量基体和干扰物质也被富集,导致洗脱液中仍含有基体和杂质,干扰最后的色谱分析。近来出现一种利用抗体自身选择性的免疫吸附剂[1],作为固相萃取材料具有选择性高的优点,但制备复杂、耗时且可供选择的抗体种类少,机械强度和稳定性均较差。 1989年Belardi等提出了固相微萃取(SPME)技术,SPME是基于分析物在流动相以及固定在熔融SiO2纤维表面的高分子固定相之间两相分配的原理,实现对样品中的有机分子进行萃取和富集。然后可直接在联用仪器中解吸、进样及分析,使样品预处理过程大为简化,提高了分析速度及灵敏度。与传统的样品前处理技术如液液萃取、索氏提取、SPE相比,克服了需使用大量溶剂和样品、处理时间长、操作繁琐、易产生二次污染及不易在线联用等缺点,在环境、食品、生物以及药物等领域得到了广泛应用。在SPME技术中,纤维涂层的材料是最关键的。但目前商品化的纤维涂层仅有少数几种,并且以非特异性吸附作用为主,选择性不够高,在样品前处理时仍有大量化学、物理性质相近的基体物质同时被富集,处理极性或碱性药物时会遇到较大的困难[2,3]。虽然一些文献报道了新的SPME涂层的研制工作[4~5],但主要是用于测定挥发或半挥发性的有机环境污染物,急需研制出选择性更高的纤维涂层。 分子印迹(MI)技术的发展,可望解决以上问题。分子印迹技术是将要分离的目标分子与功能单体通过共价或非共价作用进行预组装,与交联剂共聚制备得到聚合物。除去目标分子后,聚合物中形成与目标分子空间互补并具有预定的多重作用位点的“空穴”,对目标分子的空间结构具有“记忆”效应,能够高选择性识别复杂样品中的印迹分子。分子印迹聚合物(molecularly imprinted polymer, MIP)制备简单,能够反复使用,机械强度较高,稳定性好。因此它非常适合用作SPE的填充剂或SPME的涂层材料来分离富集复杂样品中的分析物,以达到分离净化和富集的目的。MIP作为膜分离的材料可将膜的筛分作用与MIP的高选择性结合在一起,用于样品的富集、回收或去除杂质等。 2 分子印迹技术的基本原理 MIP是以某种化合物分子为模板合成的聚合物,对模板分子具有较高的特异性识别能力,类似于酶底物的“钥匙锁”相互作用原理。目前,根据印迹分子与功能单体在聚合过程中相互作用的机理,将分子印迹技术分为共价法与非共价法两种类型。目前各类文献上报道的MIP制备方法基本上是非共价法。在此方法中,印迹分子与功能单体之间通过分子间的非共价作用预先自组装排列,以非共价键形成多重作用位点,这种分子间的相互作用通过交联聚合后保留下来。常用的非共价作用有:氢键、静电引力、金属螯合作用、电荷转移、疏水作用以及范德华力等,其中以氢键应用最为广泛[6]。 目前,文献报道中制备出的MIP一般均具有较好的物理和化学稳定性:机械强度较高;耐高温、高压;能抵抗酸、碱、高浓度离子及有机溶剂的作用;在很复杂的化学环境中能保持稳定[7]。研究表明,MIP反复使用300次之后印迹能力也未发生衰减[8];保存八个月之后其性能不发生改变[9]。 关于MIP的制备和性能研究,国内外已有较多综述文章详细介绍[10~12],本文不再详述。[color=#DC143C][B]注:其他的三篇相关文献在4-6楼。[/B][/color]
我是研究分子印迹的,要应用于固相萃取柱中,有做分子印迹的同道吗?一起交流交流!!
分子印迹QQ群 32430532欢迎做分子印迹的加入 新建,也希望加入的同志宣传宣传,壮大队伍
请问那位朋友也是做分子印迹的。并且是以微球的方式制作。分子印迹的微球是透明的吗?
分子印迹技术的概念就是将各种生物大分子从凝胶转移到一种固定基质上的过程,当体系中存在着模板分子时,功能单体可以通过聚合使这些模板分子以互补的形式固定下来.聚合后,模板分子可以被除去,从而使获得的分子组装体能专一性地键合模板分子及其类似物。 利用分子印迹化学发光技术进行定量测定,增加了一种准确测定的方法,分子印迹技术可以对混合的样品进行选择性的分离,然后从印迹模板上将待测的物质洗脱下来,进行化学发光测定,从而提高了CL体系的选择和减小了其他物质对体系的干扰。
[font=宋体]链接:[/font]https://bbs.instrument.com.cn/topic/6028886问题描述:[font=宋体]分子印迹膜分离技术[/font]解答:[font=宋体]分子印迹技术是指合成对模板分子或目标分子具有特异性识别能力的分子印迹聚合物([/font]molecularlyimprinted polymers[font=宋体],[/font]MIPs[font=宋体])的新型分离技术。[/font][font=宋体]有特异性识别能力的分子印迹聚合物([/font]molecularly[font=宋体]当模板分子(印迹分子)与聚合物单体接触时会形成多重作用点,通过聚合过程这种作用就会被记忆下来,当模板分子除去后,聚合物中就形成了与模板分子空间构型相匹配的具有多重作用点的空穴,这样的空穴将对模板分子及其类似物具有选择识别特性。[/font]MIPS[font=宋体]最广泛的应用之一是利用其特异的识别功能去分离混合物,近年来,引人瞩目的立体、特殊识别位选择性分离已经完成。其适用的印迹分子范围广,无论是小分子(如氨基酸、药品和碳氢化合物等)还是大分子(如蛋白质等)已被应用于各种印迹技术中。[/font]以上内容来自仪器信息网《样品前处理实战宝典》
BCEIA中有一偏关于分子印迹技术在色谱中应用的文章,其中出现libarary这个单词不知是不是图库的意思。有看过此篇文章的请回帖 谢谢
前两天有人发了关于分子印迹的问题,因此想把有关分子印迹的知识和应用发一下,有兴趣的朋友可以学习交流一下。同时把word版本作为附件上传。------------------绪论1.引言分子印迹也叫分子模板技术,是一种模拟抗体—抗原相互作用的人工生物模板技术。最初出现源于20世纪40年代的免疫学,当时的诺贝尔奖获得者Pauling[7]在研究抗原和抗体的相互作用时,首次提出了抗体形成学说,要点是抗体在形成时其三维结构会尽可能地同抗原体形成多重作用点,抗原作为一种模板就会“铸造”在抗体地结合部位。虽然这一设想并不可行,却是对分子印迹最初的描述,为分子印迹理论的产生奠定了基础。到20世纪70年代,Wulff[8]等人利用新的方法合出了几种高分子,对糖类和氨基酸衍生物具有较高的选择性,被用作高效液相色谱(HPLC)的固相填充物[10],这种新的方法,被称为分子印迹。但由于他的研究主要集中在共价型模板聚合物上,动力学过程较慢,其应用仅限于催化领域,而在分子识别领域的应用没有展开。80年代后非共价型模板聚合物的出现,尤其是1993年Mosbach[2]等人有关茶碱分子印迹聚合物的研究报道,使这一技术在生物传感器、人工抗体模拟及色谱固相分离等方面有了新的发展,并由此使其成为化学和生物学交叉的新兴领域之一,得到世界注目并迅速发展。欧洲委员会并于1998年启动了一项科研发展计划,资助分子印迹聚合物(MIPs)的制备、结构表征以及将MIPs用于临床分析、环境分析和生物分析等方面的研究。目前,全世界至少有包括瑞典、日本、德国、美国、中国、澳大利亚、法国在内的10多个国家、100个以上的学术机构和企事业团体在从事MIPs的研究和开发[1]。短短的二十多年,分子印迹由于其卓越的分子识别性能已经得到了广泛的发展,成为化学工作者的热门研究课题。分子印迹(MIPs)之所以发展如此迅速,主要是因为它有三大优点:即预定性(predetermination)、识别性(recognition)和实用性(practicability)[1]。由于MIPs具有抗恶劣环境的能力,表现出高度的选择性、稳定性和长的使用寿命等优点,因此,在许多领域,如色谱中对映体和异构体的分离、固相萃取、化学仿生传感器、模拟酶催化、临床药物分析、膜分离技术等领域展现了良好的应用前景。2.分子印迹聚合物的原理和作用方式MIPs是以某种化合物的分子结构为模板合成的聚合物。在印迹分子存在的条件下,将带有特殊官能团的单体与大量的基质单体在适当的介质中进行模板聚合反应,两者之间发生相互作用,如共价和分子间作用力。由于印迹分子的存在,因此在聚合过程中,单体分子本身所带的官能团会根据与印迹分子相互作用的需要, 在分子印迹分子周围按一定的取向和排列形成分子聚合物,形成特定的空间构象,得到高度交联的聚合物。聚合结束后通过洗脱等方法除去聚合物上结合的印迹分子,聚合物主体上就形成了与印迹分子空间结构匹配的具有多重作用位点的“空穴”结构。这种具有“记忆”效应的印迹聚合物对印迹分子及其它与印迹分子结构相似的客体分子具有较高的特异性结合能力,类似于酶-底物的“钥匙-锁”相互作用,依赖于印迹聚合物和客体分子大小及形状的匹配。如图1所示:根据模板分子和功能单体形成复合物时作用力的性质,分子印迹可分为共价型和非共价型两种。两种印迹类型的印迹过程如图2所示。共价键法 在共价型印迹过程中,印迹分子与官能团单体以共价键形式结合而形成印迹分子的衍生物,该衍生物在交联剂的存在下连接到聚合物的基质上。在印迹聚合物形成后,再将与印迹分子连接的这些共价键打断,并将印迹分子洗脱出来,从而形成具有吸附活性的印迹聚合物。在共价键法中,所采用的单体通常为低分子化合物,在选择时应考虑该单体与印迹分子形成的共价键键能要适当,达到在聚合时能牢固结合,在聚合后又能完全脱除的目的;另外还要考虑该单体与客体印迹分子有良好的相互作用。目前,共价键结合作用包括硼酸酯、西佛碱、缩醛(酮)、酯、螯合键作用等。非共价键法 把适当比例的印迹分子与官能团单体和交联剂混合,通过非共价键结合在一起制成非共价键印迹分子聚合物。这些非共价键包括离子键、氢键、偶极作用、疏水作用、静电作用以及范德华力等。由于这种方法与溶剂的极性密切有关,所以印迹高聚物的形成是在有机溶剂中完成的。在溶液中官能团单体与印迹分子的比例至少为4:1,以便尽可能多的非共价作用形成。这些与印迹分子相配位的官能团单体在溶液中与交联剂达到快速平衡,形成印迹聚合物将印迹分子包围,产生与印迹分子在形状、功能上互补的识别位点。在聚合物形成后再将印迹分子洗脱掉,所得的印迹聚合物就具有吸附活性。 共价型分子印迹中,单体与模板分子之间是通过化学键连在一起的,印迹过程复杂,形成的复合物也很稳定,必须采用化学方法除去模板分子。有限的可逆化学反应,限制了此法的应用性。与共价型印迹相比,非共价型印迹简单易行,模板分子易于除去,是目前广为流行的方法,其分子识别过程也更接近于那些天然的分子识别系统,如“抗体-抗原”和“酶-底物”等。在印迹过程中还可以同时采用多种单体,以提供给模板分子更多的相互作用,产生更好的印迹效果。[/color][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=65867]分子印迹MIP论文[/url]
分子印迹整体柱合成后,要用极性较大的溶剂将印迹分子冲去,我用手动的方法用注射器冲洗,但是就是打不穿,没有液滴从另一端出来。(我是合成了3个小时,就硬结成这样了)。请问是我合成的太致密了?还是我打的时候压力不够?需要换成用液相泵,买个接头冲洗?这样在电泳仪上是不是意味着压不进液体了?(我们这边电泳仪是公用的,从来没有用过外加小氮气瓶压力进样)恳请高手赐教!
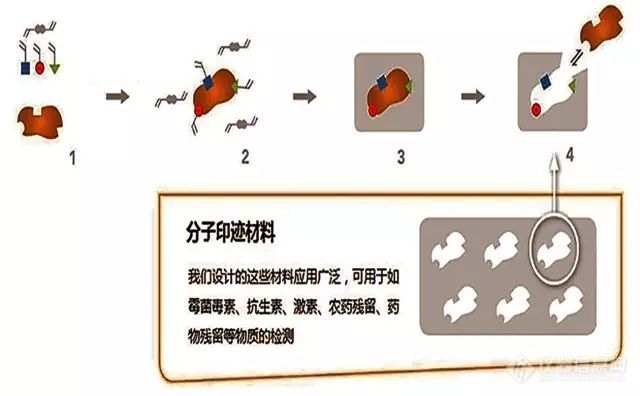
[color=#333333]在科研方法和仪器不断更新发展的今天,你是否发现那些曾经给我们带来巨大便利的检测方法、仪器、耗材,已经又不能满足我们对“高效率”永无止境的追求?[/color][color=#333333][b]使用新型的检测方法、新型仪器和耗材,就是为自己赢得时间![/b][/color][color=#333333]那么何为分子印迹固相萃取技术?[/color][color=#333333]它能为我们的前处理过程带来哪些好处呢?[/color][color=#333333][/color][b][color=#333333]基本原理[/color][/b][align=center][img=,600,371]https://ng1.17img.cn/bbsfiles/images/2019/10/201910141549069798_4494_932_3.jpg!w640x396.jpg[/img][/align][color=#333333][/color][color=#333333]分子印迹(MIP)固相萃取技术是近些年来逐渐流行的前处理技术,它在食品安全、环境和医药分析等领域[/color][color=#f41616]复杂基质样品中的痕量分析[/color][color=#333333]具有明显优势。在国外已经受到越来越多用户的青睐。[/color][color=#333333][b]应用案例[/b][/color][b]采用分子印迹小柱净化同时测定谷物中伏马毒素B1、B2和呕吐毒素[/b][color=#0d76dc][b]实验步骤[/b][/color][color=#0d76dc][b][/b][/color][b]样品制备:[/b][color=#333333]25g样品+100ml提取液(水/乙腈/甲醇=50/25/25,v/v/v),均质提取3分钟;[/color][color=#333333]提取液用滤纸(4-7um)过滤;[/color][color=#333333]取10ml滤液+10ml去离子水,再经滤纸过滤即得上样溶液(待净化液)[/color][b]样品净化:[/b][color=#333333]净化小柱:月旭AFFINIMIP分子印迹小柱 FumoZON 100mg/3mL[/color][color=#333333]活化:2ml乙腈、2ml水[/color][color=#333333]上样:6mL上样溶液[/color][color=#333333]淋洗:6mL淋洗液(乙腈/水=40/60)[/color][color=#333333]洗脱:2ml洗脱液 (含2%醋酸的甲醇溶液)[/color][color=#333333]浓缩与复溶:洗脱液浓缩后用水复溶供HPLC分析[/color][b][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]色谱条件:[/b][color=#333333]色谱柱: Ultimate XB-C18 column 50mm x2.1mm[/color][color=#333333]流动相:ZON和FB1: 0.1%甲酸水溶液/乙腈= (73/27,v/v) FB2: 0.1%甲酸水溶液/乙腈= (65/35,v/v)[/color][color=#333333]流速: 0.2mL/min[/color][color=#333333]MS 条件:[/color][color=#333333]m/z 722 for FM B1 (ESI+)[/color][color=#333333]m/z 706 for FM B2 (ESI+)[/color][color=#333333]m/z 317 for ZON(ESI-)[/color][color=#333333]进样体积: 20μL.[/color][b][/b][color=#333333][b][/b][/color][b]分析结果:[/b][align=center][b][img=,500,459]https://ng1.17img.cn/bbsfiles/images/2019/10/201910141549162308_4838_932_3.png!w272x250.jpg[/img][/b][/align]经小柱净化后得到的谱图:其中ZON加标为38μg/kg,FB1加标为2408μk/kg,FB2加标为630μg/kg回收率:[b][/b][align=center][b][img=,600,147]https://ng1.17img.cn/bbsfiles/images/2019/10/201910141549197578_6652_932_3.png!w559x137.jpg[/img][/b][/align][align=center][color=#333333](注:本规格的分子印迹小柱也可用于伏马毒素B3的测定。)[/color][/align][color=#333333][/color][color=#333333][b]评价:[/b][/color][color=#333333]该方法采用分子印迹固相萃取小柱净化,同时检测两种类型的毒素,与原国标方法中采用免疫亲和小柱相比,[/color][color=#f41616]大大缩短了前处理时间[/color][color=#333333];同时分子印迹小柱[/color][color=#f41616]价格更低廉[/color][color=#333333],[/color][color=#f41616]也大大降低了检测成本[/color][color=#333333],是很理想的前处理方法。[/color][color=#333333]分子印迹和免疫亲和方法对比[/color][color=#333333] [/color][table=379][tr][td=1,1,151][b]特点[/b][/td][td=1,1,107][b]免疫亲和[/b][/td][td=1,1,121][b]分子印迹[/b][/td][/tr][tr][td]选择性[/td][td]高[/td][td]高[/td][/tr][tr][td]载样能力[/td][td]6μmol/g[/td][td]10-100μmol/g[/td][/tr][tr][td]分析物溶于水[/td][td]可靠[/td][td]不稳定[/td][/tr][tr][td]分析物溶于有机溶剂[/td][td]差[/td][td]好[/td][/tr][tr][td]稳定性[/td][td]一般[/td][td]很高[/td][/tr][tr][td]重复性[/td][td]较好[/td][td]好[/td][/tr][tr][td]成本[/td][td]昂贵[/td][td]相对经济[/td][/tr][/table][b]分子印迹的优势:[/b]1、高亲和力2、高选择性3、重现性好4、应用范围广5、定量限更低分子印迹小柱还可以检测哪些项目[align=center][img=,500,790]https://ng1.17img.cn/bbsfiles/images/2019/10/201910141549229588_7400_932_3.png!w490x775.jpg[/img][/align]
请教一下各位了。因为最近要忙保研的事情,不知道如何选择自己的专业方向,老板那里分子印迹缺人手,我有机会去,但是不知道它将来发展如何,就业怎么样?谢谢各位达人了!~
[font=宋体]链接:[/font]https://bbs.instrument.com.cn/topic/774432问题描述:分子印迹膜分离技术的基本流程有哪些?解答:a) [font=宋体]模板分子与功能单体中的功能基团结合,形成功能单体[/font]-[font=宋体]模板分子的主客体配合物。[/font]b) [font=宋体]选择合适的交联剂,在惰性溶剂(致孔剂)中,对功能单体[/font]-[font=宋体]模板分子配合物进行交联,形成共聚物。在交联过程中,将功能单体上与模板分子结合的功能基团的空间取向与排列位置固定下来。[/font][font='Times New Roman','serif']c) [/font][font=宋体]通过一定的方式(物理或化学方法),断开模板分子与功能单体的结合键,再去除模板分子。[/font]以上内容来自仪器信息网《样品前处理实战宝典》
各位大侠:请问分子印迹膜在国内外市场情况如何,国内哪所大学对这个研究最好的?国家有这方面的标准、规范和认证机构?
1.您在做分子印迹物合成的时候,所用的甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EDMA)是否均重蒸过?2.外国公司生产的甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EDMA)是否可以直接用于MIP合成?3.我在重蒸MAA时,烧瓶出现白色泡沫继而膨胀,最后形成白色多孔胶状物,重蒸失败。你遇到过这种情况吗?是什么原因?有什么办法避免和处理?
乙酰甲胺磷分子印迹聚合物识别特性的光谱研究
一般做分子印迹荧光量子点材料(MIP-QDs)的时候,用什么溶剂做荧光测试啊?做测试的时候,是将MIP-QDs分散到溶剂中么?
[b][url=http://www.f-lab.cn/microarray-manufacturing/cfm.html]生物分子打印机CFM[/url][/b]已用于打印各种各样的生物分子,包括DNA、蛋白质、脂类、糖类和细胞抗体。生物分子打印机CFM与PIN或非接触式印刷技术相比,能够使得配体浓度稀释比其他技术高出1000倍,并且配体直接从粗混合物到选择性捕获表面上直接打印印刷.[b]生物大分子打印机CFM[/b]采用微通道网络打印,一个4×12模块一次打印48个样品。自动化流体处理和定位系统可以在一次运行中打印多达768个独特的样品。该系统是用于印刷到SenseyeSPR传感器mx96。[b]生物分子打印机CFM[/b]使标准耦合传递和捕捉较低吞吐量的多通道系统,这种条件是基于高通量阵列系统的。 [img=生物分子打印机,299,340]http://www.f-lab.cn/Upload/cfm-printers.jpg[/img][b]生物分子打印机[/b]:[b][url]http://www.f-lab.cn/microarray-manufacturing/cfm.html[/url][/b]
[em24] 我是做农药残留的,采用分子印记技术来进行净化,但是在交联剂纯化方面给难住了,我采用的交联剂是TMPTMA请大家知道怎样纯化的把具体方法给说一下,不胜感激哦
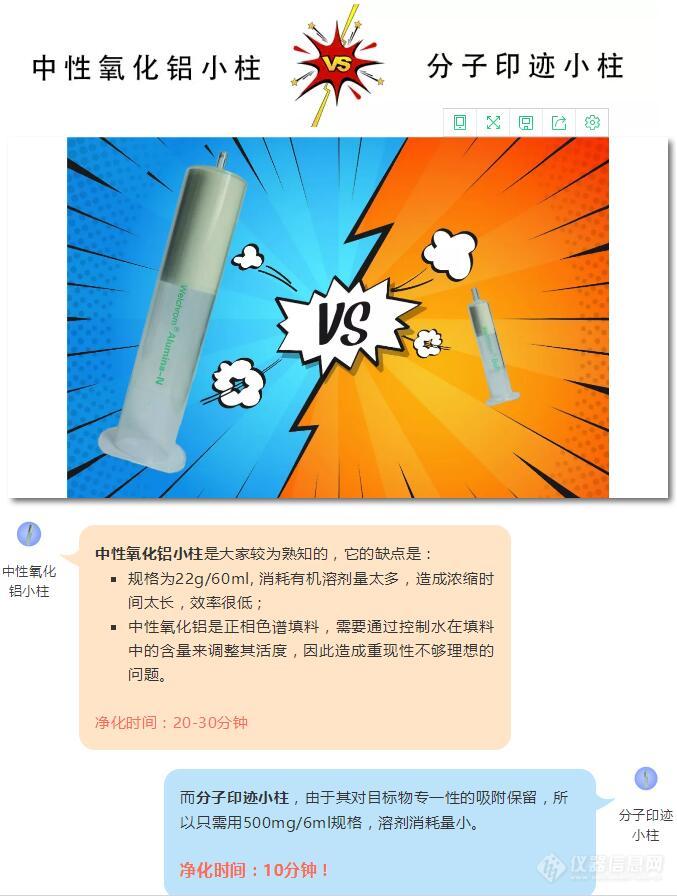
[align=left][b]强势围观:月旭分子印迹小柱10分钟完成苯并(a)芘净化步骤[/b][/align]食品中苯并(a)芘的测定(国标GB 5009.27-2016)实验中,样品前处理要求采用:[color=#ff4c00][b]中性氧化铝或分子印迹小柱净化。[/b][/color][align=left][img=,600,794]http://ng1.17img.cn/bbsfiles/images/2018/08/201808091128326505_1029_932_3.jpg!w677x896.jpg[/img][/align][b]中性氧化铝小柱[/b]是大家较为熟知的,它的缺点是:[list][*]规格为22g/60ml, 消耗有机溶剂量太多,造成浓缩时间太长,效率很低;[*]中性氧化铝是正相色谱填料,需要通过控制水在填料中的含量来调整其活度,因此造成重现性不够理想的问题。[/list][color=#f96e57][b]净化时间:20-30分钟[/b][/color]而[b]分子印迹小柱[/b],由于其对目标物专一性的吸附保留,所以只需用500mg/6ml规格,溶剂消耗量小。[color=#f96e57][b][/b][/color][color=#f96e57][b]净化时间:10分钟![/b][/color][b]下面看一下实验过程:1 适用范围[/b]适用于食品中苯并(a)芘的检测。[b]2 标准品说明[/b]实验过程中所用苯并(a)芘标准溶液为溶液态,浓度:100 mg/L于乙腈。[b]3 提取步骤[/b]以菜籽油为例,将0.5 g样品置于15 mL 离心管,加入3 mL色谱纯正己烷,涡旋充分混匀,待净化。[b]4 SPE净化步骤[/b]SPE柱:月旭Welchrom BaP-2固相萃取柱(规格:500 mg/6mL),月旭Welchrom Silica固相萃取柱(规格:500 mg/6mL),将Silica硅胶柱串联在BAP-2柱上。(1) 活化:5 mL 二氯甲烷,5 mL 正己烷;(2)上样:将待净化液加入到串联柱上,并用2 mL 正己烷润洗盛放样品的15 mL离心管,确保完全上样;(3) 淋洗1:5 mL 正己烷淋洗整个串联柱;然后弃去Silica硅胶柱;(4) 淋洗2:5 mL 正己烷淋洗BaP-2柱;(5) 洗脱:5 mL 二氯甲烷,收集洗脱液;(6) 浓缩:将洗脱液在40 oC下氮气吹至近干,用1mL 乙腈定容,超声1 min,涡旋10 s,过0.22 μm PTFE 滤膜,待HPLC测定。[align=left][img=,346,600]http://ng1.17img.cn/bbsfiles/images/2018/08/201808161555151455_8549_932_3.jpg!w346x600.jpg[/img][/align][align=left]图1:固相萃取实验过程[/align][b]5 色谱条件[/b]色谱柱:月旭UltimateXB-C18, 4.6 x 250 mm, 5 μm流动相:乙腈/水 =88/12流速:1.0 mL/min进样量:20 μL柱温:30 oCFLD:Ex=384 nm, Em=406 nm[b]6 色谱图或加标回收率结果[/b][align=left][img=,654,312]http://ng1.17img.cn/bbsfiles/images/2018/08/201808161641220117_8499_932_3.png!w654x312.jpg[/img][/align][align=left]图2:苯并(a)芘标准溶液色谱图(进样浓度:10 ng/mL)[/align][align=left][/align][align=left][img=,654,309]http://ng1.17img.cn/bbsfiles/images/2018/08/201808161641344215_7488_932_3.jpg!w654x309.jpg[/img][/align][align=left]图3:苯并(a)芘标准溶液色谱图(进样浓度:5 ng/mL)[/align][align=left][/align][align=left][img=,654,309]http://ng1.17img.cn/bbsfiles/images/2018/08/201808161641489805_1064_932_3.png!w654x309.jpg[/img][/align][align=left]图4:实际植物油样品色谱图[/align][align=left][img=,663,309]http://ng1.17img.cn/bbsfiles/images/2018/08/201808161641579215_8754_932_3.jpg!w663x309.jpg[/img][/align][align=left][/align][align=left]图5:实际植物油加标色谱图(加标浓度:20 μg/kg)[/align][align=left][/align][align=left][img=,662,313]http://ng1.17img.cn/bbsfiles/images/2018/08/201808161642095695_9383_932_3.jpg!w662x313.jpg[/img][/align][align=left]图6:实际植物油加标色谱图(加标浓度:10 μg/kg)[/align][align=left][/align][align=left][/align][align=left]表1:加标回收率测定结果[/align][align=left][img=,648,208]http://ng1.17img.cn/bbsfiles/images/2018/08/201808161642201965_2919_932_3.jpg!w648x208.jpg[/img][/align][align=left][/align][align=left][b]7.相关产品信息[/b][/align][align=left][img=,579,478]http://ng1.17img.cn/bbsfiles/images/2018/08/201808161642288637_9135_932_3.jpg!w579x478.jpg[/img][/align]
电化学分子印迹实验,用邻苯二胺做单体,采用电聚合的方法-0.2到0.9V 循环伏安扫描20圈,在电极表面形成分子印迹膜。然后用酸和醇的混合液浸泡去除模板分子,为什么空白组被浸泡后的电流很高啊,比实验组的电流更高。重复了好多次,对照组分子印迹膜浸泡后电流都很高。方法就是最基本的电聚合方法,好多文献都是这样做的,为什么做了好多次就是不行,对照组就是会有很高的电流。
请教各位大虾: 分子印记一般他投哪个杂志?!谢谢了!
请教各位大虾: 分子印记一般他投哪个杂志?!谢谢了!

[color=#333333]食品中苯并(a)芘的测定(国标GB 5009.27-2016)实验中,样品前处理要求采用:[/color][color=#ff4c00][b]中性氧化铝或分子印迹小柱净化。[/b][/color][align=center][color=#ff4c00][b][img=,600,115]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101535518056_3845_932_3.jpg!w640x123.jpg[/img][img=,600,400]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101535577312_7000_932_3.jpg!w690x460.jpg[/img][/b][/color][/align][b][/b]中性氧化铝小柱是大家较为熟知的,它的缺点是:[color=#ff4c00][b][color=#3e3e3e][/color][/b][/color][list][*]规格为22g/60ml, 消耗有机溶剂量太多,造成浓缩时间太长,效率很低;[*]中性氧化铝是正相色谱填料,需要通过控制水在填料中的含量来调整其活度,因此造成重现性不够理想的问题。[b][color=#3e3e3e][/color][/b][/list][color=#f96e57]净化时间:20-30分钟[/color][color=#f96e57][/color]而[b]分子印迹小柱[/b],由于其对目标物专一性的吸附保留,所以只需用500mg/6ml规格,溶剂消耗量小。[color=#ff6666]净化时间:10分钟![/color][b][b]下面看一下实验过程:[/b][/b]1、适用范围适用于食品中苯并(a)芘的检测。2、标准品说明实验过程中所用苯并(a)芘标准溶液为溶液态,浓度:100 mg/L于乙腈。3、提取步骤以菜籽油为例,将0.5 g样品置于15 mL 离心管,加入3 mL色谱纯正己烷,涡旋充分混匀,待净化。4、SPE净化步骤SPE柱:月旭Welchrom BaP-2固相萃取柱(规格:500 mg/6mL),月旭Welchrom Silica固相萃取柱(规格:500 mg/6mL),将Silica硅胶柱串联在BAP-2柱上。(1) 活化:5 mL 二氯甲烷,5 mL 正己烷;(2)上样:将待净化液加入到串联柱上,并用2 mL 正己烷润洗盛放样品的15 mL离心管,确保完全上样;(3) 淋洗1:5 mL 正己烷淋洗整个串联柱;然后弃去Silica硅胶柱;(4) 淋洗2:5 mL 正己烷淋洗BaP-2柱;(5) 洗脱:5 mL 二氯甲烷,收集洗脱液;(6) 浓缩:将洗脱液在40 oC下氮气吹至近干,用1mL 乙腈定容,超声1 min,涡旋10 s,过0.22 μm PTFE 滤膜,待HPLC测定。[align=center][img=,346,600]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101536416928_888_932_3.jpg!w346x600.jpg[/img][/align][align=center]图1:固相萃取实验过程[/align]5、色谱条件色谱柱:月旭UltimateXB-C18, 4.6 x 250 mm, 5 μm流动相:乙腈/水 =88/12流速:1.0 mL/min进样量:20 μL柱温:30 oCFLD:Ex=384 nm, Em=406 nm6、色谱图或加标回收率结果[align=center][img=,600,285]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101536487315_2673_932_3.png!w640x305.jpg[/img][/align][color=#333333][/color][align=center]图2:苯并(a)芘标准溶液色谱图(进样浓度:10 ng/mL)[/align][align=center][/align][align=center][color=#333333][color=#333333][img=,600,283]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101537000084_6099_932_3.png!w640x302.jpg[/img][/color][/color][/align][align=center][color=#333333][color=#333333]图3:苯并(a)芘标准溶液色谱图(进样浓度:5 ng/mL)[/color][/color][/align][align=center][color=#333333][color=#333333][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333][img=,600,280]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101537053349_3285_932_3.jpg!w632x295.jpg[/img][/color][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333]图4:实际植物油样品色谱图[/color][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333][/color][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333][img=,600,279]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101537119248_1155_932_3.png!w640x298.jpg[/img][/color][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333]图5:实际植物油加标色谱图(加标浓度:20 μg/kg)[/color][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333][/color][/color][/color][/align][align=center][color=#333333][color=#333333][color=#333333][img=,600,284]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101537166051_9217_932_3.png!w640x303.jpg[/img][/color][/color][/color][/align][color=#333333][color=#333333][color=#333333][/color][/color][/color][align=center]图6:实际植物油加标色谱图(加标浓度:10 μg/kg)[/align][align=center][img=,600,191]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101537213628_852_932_3.png!w640x204.jpg[/img][/align][align=center]表1:加标回收率测定结果[/align][color=#333333]相关产品信息[/color][align=center][color=#333333][color=#333333][color=#333333][img=,600,595]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101537264223_9282_932_3.jpg!w574x570.jpg[/img][/color][/color][/color][/align][color=#333333][color=#333333][color=#333333][b]实验细节及操作注意事项,欢迎致电400-8106969.[/b][/color][/color][/color]
[font=宋体]免疫荧光法和免疫印迹法是生物学领域中两种常用的实验技术,它们在原理、操作过程和应用方面有着显著的区别。本文将详细探讨这两种技术的区别,以便更好地理解它们的特点和应用价值。[/font][font=宋体] [/font][font=宋体]首先,我们来了解免疫荧光法。免疫荧光法是一种利用荧光物质标记的特异性抗体来检测细胞内或细胞表面抗原的技术。其基本原理是抗原抗体反应,通过荧光显微镜观察荧光标记的抗原,从而实现对抗原的定位和定量分析。免疫荧光法具有高灵敏度、高特异性和定位准确的特点,广泛应用于细胞生物学、微生物学、免疫学等领域。[/font][font=宋体] [/font][font=宋体]相比之下,免疫印迹法则是通过检测细胞或组织提取物中特定抗原的存在和分布,以了解其在生物学过程中的作用。这种方法通常涉及到蛋白质的提取、分离、转移和检测等步骤。免疫印迹法能够检测蛋白质的分子量、表达水平以及与其他分子的相互作用,为生物学研究提供了重要的信息。[/font][font=宋体] [/font][font=宋体]在操作过程上,免疫荧光法主要涉及细胞的固定、通透、抗体孵育和荧光显微镜观察等步骤。而免疫印迹法则需要进行蛋白质的提取、电泳分离、膜转移、抗体孵育和显色等复杂操作。因此,从操作难度和复杂性来看,免疫印迹法相对更为繁琐。[/font][font=宋体] [/font][font=宋体]在结果解读和应用方面,免疫荧光法能够提供直观、定位准确的抗原分布信息,有助于研究细胞的结构和功能。而免疫印迹法则能够揭示蛋白质的表达水平、分子量和相互作用,为疾病诊断、药物研发和生物学机制研究提供有力支持。[/font][font=宋体] [/font][font=宋体]此外,免疫荧光法和免疫印迹法在应用领域上也有所不同。免疫荧光法广泛应用于细胞生物学、微生物学、免疫学等领域,特别是在病毒检测、细胞信号转导和细胞凋亡等研究中发挥着重要作用。而免疫印迹法则更多地应用于分子生物学、生物化学和病理学等领域,对于研究蛋白质的结构、功能和调控机制具有重要意义。[/font][font=宋体] [/font][b][font=宋体]免疫荧光法和免疫印迹法优缺点介绍:[/font][/b][font=宋体] [/font][table][tr][td][font=宋体]技术[/font][/td][td][font=宋体]优点[/font][/td][td][font=宋体]缺点[/font][/td][/tr][tr][td=1,4][align=center][font=宋体]免疫荧光法[/font][/align][/td][td][font=宋体]特异性强[/font][/td][td][font=宋体]非特异性染色问题尚未完全解决[/font][/td][/tr][tr][td][font=宋体]敏感性高[/font][/td][td][font=宋体]操作程序较复杂[/font][/td][/tr][tr][td][font=宋体]速度快[/font][/td][td][font=宋体]需要特殊的昂贵仪器(荧光显微镜)[/font][/td][/tr][tr][td][font=宋体]早期诊断价值[/font][/td][td][font=宋体]染色标本不能长期保存[/font][/td][/tr][tr][td=1,3][align=center][font=宋体]免疫印迹法[/font][/align][/td][td][font=宋体]操作简便[/font][/td][td][font=宋体]对于低丰度的抗原可能不够敏感[/font][/td][/tr][tr][td][font=宋体]所需实验材料相对简单[/font][/td][td][font=宋体]无法提供抗原在细胞或组织中的定位信息[/font][/td][/tr][tr][td][font=宋体]对某些特定抗原的检测具有较高的灵敏度[/font][/td][td][font=宋体]需要一定的实验技能和经验[/font][/td][/tr][/table][font=宋体] [/font][font=宋体]综上所述,免疫荧光法和免疫印迹法是两种具有不同特点和应用领域的实验技术。免疫荧光法注重抗原的定位和定量分析,操作简便直观;而免疫印迹法则关注蛋白质的表达和相互作用,操作相对复杂但能提供深入的信息。在实际应用中,我们需要根据研究目的和需求选择合适的技术手段,以获取准确、可靠的实验结果。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/immunofluorescence-service][b]免疫荧光([/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/immunofluorescence-service][b]IF[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/immunofluorescence-service][b])检测服务[/b][/url],更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/immunofluorescence-service[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
大家好,我做的是有机磷分子印迹固相萃取在上过柱子后,检查上样液没见有分析物随着溶剂留下来,在洗脱后回收率又不高,一开始我怀疑是洗脱剂强度不够没有洗完全,然后在原有的柱上又用强度更强的(加了三氟乙酸)的洗脱剂,可是没有发现分析物洗下来。请问是怎么回事呀?知道的朋友指点一下吧。
空心阴极灯是原子吸收光谱仪必不可少的组成部分,空心阴极灯有单元素灯、多元素灯、高性能灯和多阴极灯。各种灯都有其优缺点,筒子们,你们用的空心阴极灯是啥样子,感觉如何?拿出来和我们分享一下呗!发帖格式:空心阴极灯种类:可见这里http://bbs.instrument.com.cn/shtml/20130507/4718528/照片:生产厂家:价格(自愿):优点:缺点:按要求发帖者,版主均给予5积分奖励!!大家支持!!!
最近新合成了一根分子印迹整体柱,上了电泳试了下,发现样品混合物出来的图是一个尖峰边上连着一个馒头峰,进单独定峰位时也是一个尖峰连着一个馒头峰,是是不是意味着没有印迹效果?还是印迹效果太强了,保留在柱子里洗脱不出来了?另外,在分子印迹整体柱样品与样品分析之间是用什么冲洗的?我用的是乙腈,不知道对不对还有,发现了一个现象,刚合成好的柱子,进的第一针是丙酮,充当电渗流标记物,刚开始还好好的,后来进了几针样品之后发现丙酮不出峰了,我在想是不是因为样品吸附到MAA上了,导致电渗流变小,那用什么流动相去冲洗呢?
做阴极保护时通常将最小保护电位订在自腐蚀电位再往正100~200mv的区间,测量自腐蚀电位的方法很多,有极化曲线法、开路电位法、换向电压法,我想问一下哪种方法测出的电位被认为是阴极保护的自腐蚀电位最优?有没有相关资料啊,请指教。
近几日,看到版面里大家对阴极灯讨论得很火热,于是我在网上查到了一篇国内某灯厂关于阴极灯规格的阐述,感到很有代表性,于是便截取一部分内容供大家参考。
今天在网上看一个关于的文章,感觉不错,贴上来分享一下简述空心阴极灯的工作原理。 在空心阴极灯两个电极间加上一定电压时,阴极灯开始辉光放电,电子从空心阴极射向阳极,并与周围惰性气体碰撞使之电离。带正电荷的惰性气体离子在电场作用下连续轰击阴极表面,阴极表面的金属原子发生溅射,溅射出来的金属原子在阴极区受到高速电子及离子流的撞击而激发,从而辐射出具有特征谱线的锐线光谱。 为什么原子吸收光谱法需要使用待测元素材料相同的锐线光源? 锐线光源是指能发射出谱线半宽度很窄(O.0005~0.002nm)辐射线的光源。 原子吸收分析需要锐线光源是基于下述原因: 当试样喷人火焰经原子化后,原子呈分散状态(多普勒变宽),当不同频率的光通过被测元素的原子蒸气时,所产生的吸收线并不是一条理想的几何直线,而是具有一定宽度的吸收线。 在原子吸收分析中,将原子蒸气所吸收的全部辐射能量称为积分吸收,从理论上讲,如果能测得由连续波长光源获得的积分吸收,即可计算出待测元素的含量。但目前仪器还不能准确地测出积分吸收。 在分析中发现:在通常原子吸收分析条件下,吸收线中心频率的峰值吸收系数K取决于多普勒变宽,而当测定温度恒定时,多普勒变宽为常数,对一定的待测元素其振子强度也是常数,所以极大吸收系数K就仅与单位体积中原子蒸气中吸收特征(中心)辐射的基态原子数Ⅳ0成正比。 要测得极大吸收系数K一是必须使光源发射线的中心频率与吸收线的中心频率相重合;二是必须使光源发射线的宽度小于中心吸收线的宽度。而要实现这两点,使用一个与待测元素相同材料的空心阴影灯即可很好的实现。因为待测元素材料的灯发出的中心频率,必定与待测元素吸收线的中心频率相重合。而空心阴影灯可以发出谱线半峰宽度很窄的辐射线。所以在原子吸收光谱分析中必须使用待测元素相同材料判做的空心阴极灯。