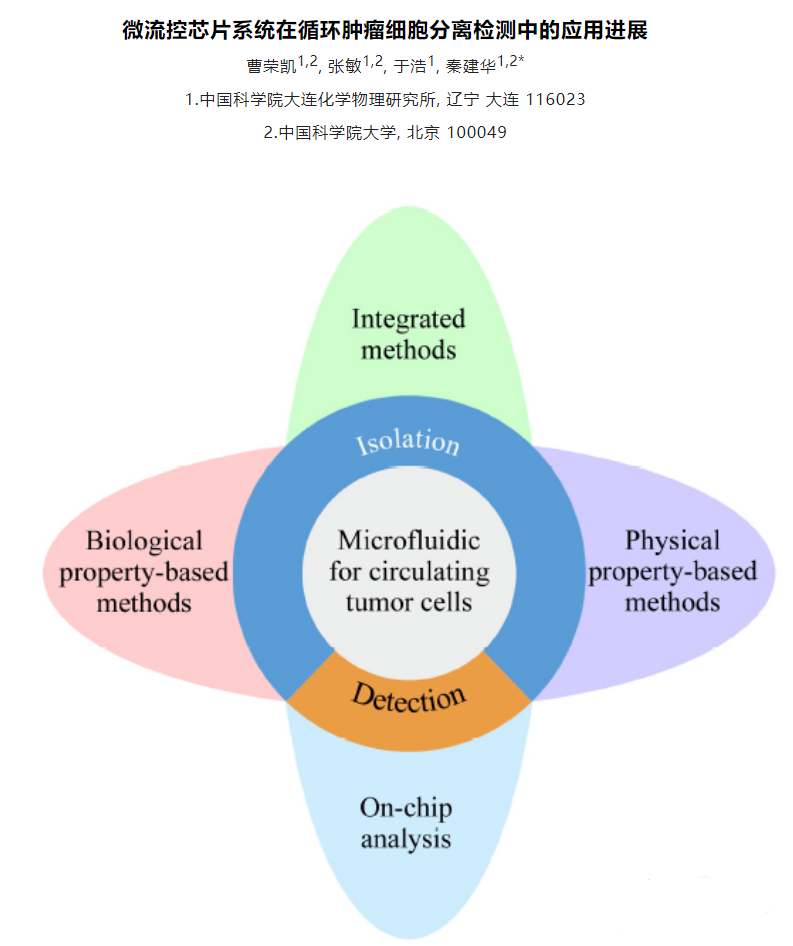
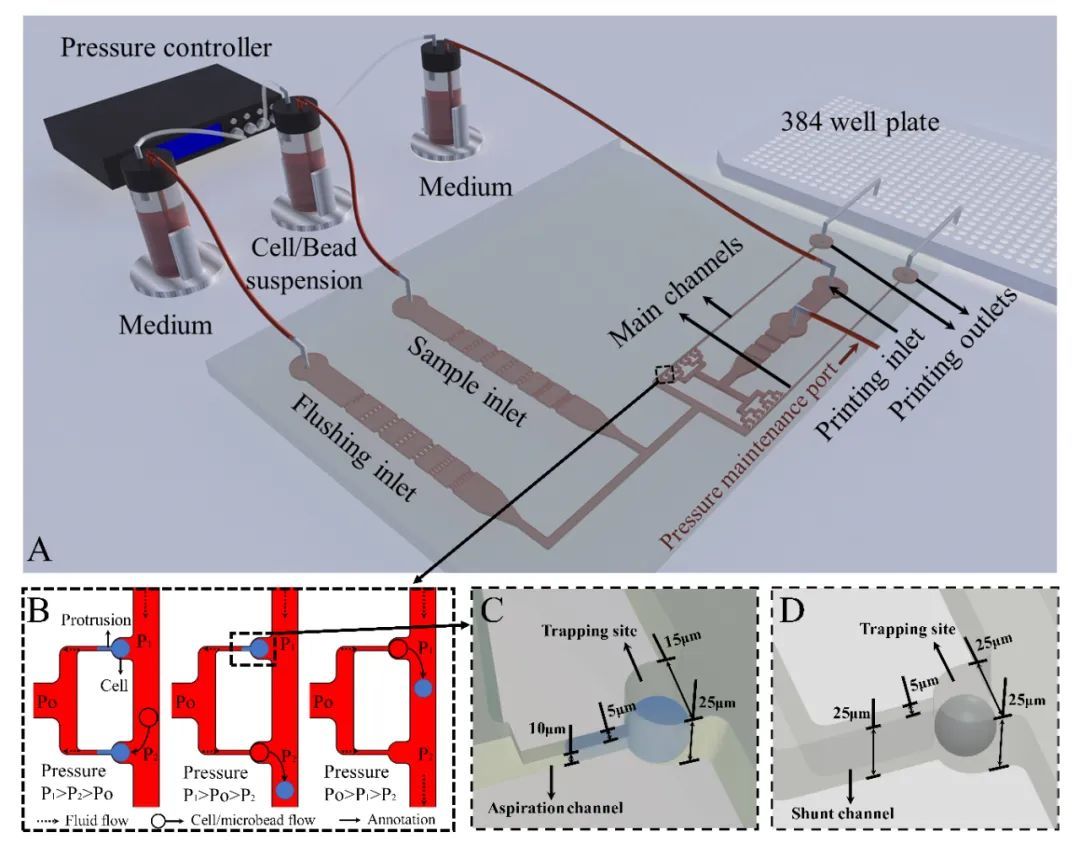
肿瘤细胞分离检测中微流控芯片系统的应用有哪些?
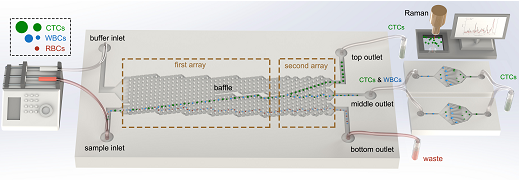
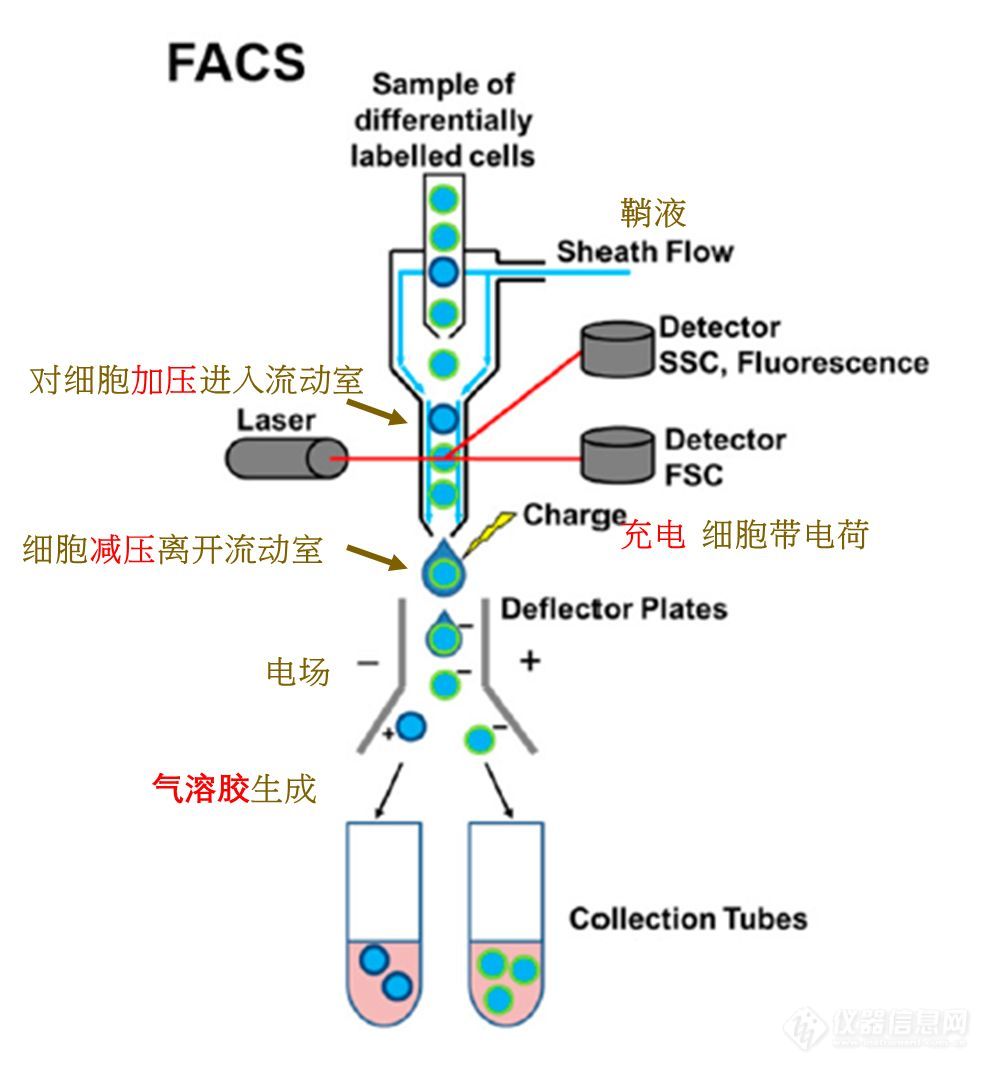
作为液体活检的重要标志物之一,循环肿瘤细胞(CTCs)在外周血中的含量可以用来辅助判断患者的癌症病发状况。除此以外,CTCs对于肿瘤细胞转移行为等基础研究也具有非常重要的意义。然而人体血液中的CTCs含量极其稀少,通常仅有0~10个/mL,与之相对,红细胞、白细胞和血小板的含量则分别达到5×109 个/mL、4×106 个/mL和3×108 个/mL,而且肿瘤细胞在转移过程中可以通过上皮-间质转化(EMT)和间质-上皮转化(MET)来不断地改变自身的特征。正是由于其稀缺性和异质性,以及血液中复杂基质的干扰,CTCs的精准检测成为巨大的难题。 由于常规的光学分析手段在检出限和灵敏度上均难以达到直接检测的要求,因此通常在进行外周血中CTCs的检测之前,要通过一些样品前处理方法来实现其分离和富集。常采用的样品前处理方法可以分为物理法和化学法,物理法主要根据细胞在物理特征上的差异来进行分离,例如膜过滤分离和密度梯度离心,就是分别依据细胞的大小和密度来完成筛选。化学法则主要依靠生物大分子的特异性识别作用,例如抗原抗体相互作用,核酸适配体与靶标的选择性结合。 上述样品前处理方法虽然能够在不同程度上实现CTCs的分离富集,但也存在着一定的缺陷。由于这些方法都是非连续性的,在吸附、洗脱和转移的过程中难免会造成细胞的丢失,加之CTCs本身的稀缺性,很容易导致假阴性结果的产生。利用微流控芯片功能集成的特点则可以很好地解决这一问题,CTCs的捕获、释放、计数及检测等操作均可在芯片上完成,连续的自动化处理可以有效减少人为误差的干扰。此外,微流控芯片所需要的进样量非常小,可以大大减少珍贵样品和试剂的消耗,降低检测成本。并且在微尺度下表面力的作用会明显放大,可以有效提高物质混合和反应的效率,实现快速高效的分离分析。因此,近年来多项研究尝试利用微流控芯片平台开展CTCs分离检测工作,取得了良好的效果。本文对微流控芯片技术用于CTCs分离检测的相关研究进展进行了综述,将采用的分离方法主要分为物理筛选和生物亲和两大类,同时囊括正向富集和反向富集两种策略。此外,对于近期发展的芯片原位检测CTCs新方法也进行了介绍。 1、CTCs分离芯片研究进展 作为商品化较为成功的CTCs分离检测系统,强生公司的CellSearch产品采用的是基于上皮细胞黏附分子(EpCAM)抗体特异性识别肿瘤细胞的方法,类似的方法在CTCs分离芯片中也被广泛使用,可以视作利用生物亲和作用进行CTCs分离富集的代表。 另一方面,依据细胞在物理性质方面的差异,无须生物标志物的条件下即可实现CTCs的筛选,其中有无外力介入的被动分离方法,例如利用微尺度下流体力学中的惯性效应和黏弹性效应来进行筛分。 也有外加物理场的主动分离方法,诸如介电泳、表面声波和光镊技术等。除了直接对CTCs进行特异性识别实现正向富集外,也可以通过选择性结合诸如白细胞等干扰,再将其排除,从而达到反向富集的效果。 2、、芯片原位CTCs检测 对于CTCs的检测,通常采取先进行细胞染色,再用荧光显微镜观察的方法,但该方法在灵敏度上有待提高,且重现性较差,需要手动操作和人工计数。 此外,以荧光光谱为代表,一些常见的光谱检测手段也被广泛应用在芯片上CTCs的检测中。 除了光学分析方法外,研究人员通过使用传感元件实现了CTCs芯片检测结果的数字化直读或可视化分析。 3、总结与展望 本文对CTCs分离微流控芯片的技术原理、分离策略和研究进展进行了综述。其技术原理主要分为物理筛选和生物亲和两大类,分离策略分为正向富集和反向富集两个方向。同时,介绍了CTCs芯片原位检测的主要技术方法和优化策略。随着微流控芯片技术的快速发展,其微尺度流体操控、微结构加工和集成传感检测能力得到极大提升,进一步推动了CTCs分离微流控芯片技术的发展。多项研究显示,以微流控芯片为平台来分离检测外周血中的CTCs,可以充分发挥芯片本身微量、高效、易于自动化和集成化的优势,最终实现对临床血液中CTCs的快速精准分析,在肿瘤早期诊断、复发与转移监测以及抗肿瘤药物评价等多个领域具有重要的应用空间。 现阶段,CTCs芯片在筛选精度和筛选效率方面仍存在较大的提升空间。针对这一挑战,由于精准与高效二者难以兼得,未来的芯片设计应该更专注于单个目标的实现。一方面,针对基础研究,应当注重于提高CTCs筛选的细胞纯度及细胞活性。可以先利用惯性效应对血液进行粗分离,筛分出尺寸较大的白细胞和CTCs。再采用液滴分选的方法,通过免疫磁性分离实现CTCs的精确筛选。液滴分选技术能够达到单细胞分析的精度,利用液滴分选进行肿瘤细胞筛选也已有文献报道。另一方面,针对临床检测领域,研究重点则在于实现临床样本的高通量分析。可以采用电分析方法,依据不同种类细胞的比膜电容和细胞质电导率差异来设置恰当的阈值,对流经检测窗口的CTCs实现快速分析。此外,微流控芯片技术属于多学科交叉领域,CTCs芯片的发展同时也受益于微机电系统(MEMS)、材料学、流体力学和生物医学等研究领域的技术突破。随着相关领域研究技术的发展,CTCs芯片未来有望成为肿瘤基础研究和癌症早期临床诊断的重要平台。