聚合酶链式反应的主要用途在那些领域?
定义 聚合酶链式反应简称PCR(英文全称:Polymerase Chain Reaction), 具体内容点击: 聚合酶链式反应,简称PCR。聚合酶链式反应,其英文Polymease Chain Reaction(PCR)是体外酶促合成特异DNA片段的一种方法,由高温变性、低温退火及适温延伸等几步反应组成一个周期,循环进行,使目的DNA得以迅速扩增,具有特异性强、灵敏度高、操作简便、省时等特点。它不仅可用于基因分离、克隆和核酸序列分析等基础研究,还可用于疾病病的诊断或任何有DNA,RNA的地方.聚合酶链式反应(Polymerase Chain Reaction,简称PCR)又称无细胞分子克隆或特异性DNA序列体外引物定向酶促扩增技术。 由美国科学家PE(Perkin Elmer珀金-埃尔默)公司遗传部的Dr. Mullis发明,由于PCRPCR技术在理论和应用上的跨时代意义,因此Mullis获得了1993年诺贝尔化学奖。 技术原理 DNA的半保留复制是生物进化和传代的重要途径。双链DNA在多种酶的作用下可以变性解链成单链,在DNA聚合酶与启动子的参与下,根据碱基互补配对原则复制成同样的两分子挎贝。在 实验中发现,DNA在高温时也可以发生变性解链,当温度降低后又可以复性成为双链。因此,通过温度变化控制DNA的变性和复性,并设计引物做启动子,加入DNA聚合酶、dNTP就可以完成特定基因的体外复制。 但是,DNA聚合酶在高温时会失活,因此,每次循环都得加入新的DNA聚合酶,不仅操作烦琐,而且价格昂贵,制约了PCR技术的应用和发展。发现耐热DNA聚合同酶--Taq酶对于PCR的应用有里程碑的意义,该酶可以耐受90℃以上的高温而不失活,不需要每个循环加酶,使PCR技术变得非常简捷、同时也大大降低了成本,PCR技术得以大量应用,并逐步应用于临床。 工作原理 类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR由变性--退火--延伸三个基本反应步骤构成:①模板DNA的变性:模板DNA经加热至93℃左右一定时 间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备;②模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合;③引物的延伸:DNA模板--引物结合物在TaqDNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA链互补的半保留复制链重复循环变性--退火--延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一个循环需2~4分钟,2~3小时就能将待扩目的基因扩增放大几百万倍。
聚合酶链式反应是一种用于放大扩增特定的DNA片段的分子生物学技术,它可看作是生物体外的特殊DNA复制,PCR的最大特点,是能将微量的DNA大幅增加。因此,无论是化石中的古生物、历史人物的残骸,还是几十年前凶杀案中凶手所遗留的毛发、皮肤或血液,只要能分离出一丁点的DNA,就能用PCR加以放大,进行比对。这也是“微量证据”的威力之所在。由1983年美国Mullis首先提出设想,1985年由其发明了聚合酶链反应,即简易DNA扩增法,意味着PCR技术的真正诞生。到如今2013年,PCR已发展到第三代技术。1973 年,台湾科学家钱嘉韵,发现了稳定的Taq DNA聚合酶,为PCR技术发展也做出了基础性贡献。PCR(聚合酶链式反应)是利用DNA在体外摄氏95°高温时变性会变成单链,低温(经常是60°C左右)时引物与单链按碱基互补配对的原则结合,再调温度至DNA聚合酶最适反应温度(72°C左右),DNA聚合酶沿着磷酸到五碳糖(5'-3')的方向合成互补链。基于聚合酶制造的PCR仪实际就是一个温控设备,能在变性温度,复性温度,延伸温度之间很好地进行控制。Khorana (1971)等最早提出核酸体外扩增的设想:“经DNA变性,与合适的引物杂交,用DNA聚合酶延伸引物,并不断重复该过程便可合成tRNA基因。”但由于当时基因序列分析方法尚未成熟,热稳定DNA聚合酶尚未报道以及引物合成的困难,这种想法似乎没有实际意义。加上70年代初分子克隆技术的出现提供了一种克隆和扩增基因的途径,所以,Khorana的设想被人们遗忘了。1985年,Kary Mullis在Cetus公司工作期间,发明了PCR。Mullis要合成DNA引物来进行测序工作,却常为没有足够多的模板DNA而烦恼。1983年4月的一个星期五晚上,他开车去乡下别墅的路上,猛然闪现出“多聚酶链式反应”的想法。1983年12月,Mullis用同位素标记法看到了10个循环后的49 bp长度的第一个PCR片段;1985年10月25日申请了PCR的专利,1987年7月28日批准(专利号4,683,202 ),Mullis是第一发明人;1985年12月20日在Science杂志上发表了第一篇PCR的学术论文,Mullis是共同作者;1986年5月,Mullis在冷泉港实验室做专题报告,全世界从此开始学习PCR的方法。DNA的半保留复制是生物进化和传代的重要途径。双链DNA在多种酶的作用下可以变性解旋成单链,在DNA聚合酶的参与下,根据碱基互补配对原则复制成同样的两分子拷贝。在实验中发现,DNA在高温时也可以发生变性解链,当温度降低后又可以复性成为双链。因此,通过温度变化控制DNA的变性和复性,加入设计引物,DNA聚合酶、dNTP就可以完成特定基因的体外复制。但是,DNA聚合酶在高温时会失活,因此,每次循环都得加入新的DNA聚合酶,不仅操作烦琐,而且价格昂贵,制约了PCR技术的应用和发展。耐热DNA聚合酶--Taq酶的发现对于PCR的应用有里程碑的意义,该酶可以耐受90℃以上的高温而不失活,不需要每个循环加酶,使PCR技术变得非常简捷、同时也大大降低了成本,PCR技术得以大taq酶taq酶量应用,并逐步应用于临床。PCR技术的基本原理类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR由变性--退火--延伸三个基本反应步骤构成:①模板DNA的变性:模板DNA经加热至93℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备;②模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合;③引物的延伸:DNA模板--引物结合物在72℃、DNA聚合酶(如TaqDNA聚合酶)的作用下,以dNTP为反应原料,靶序列为模板,按碱基互补配对与半保留复制原理,合成一条新的与模板DNA链互补的半保留复制链,重复循环变性--退火--延伸三过程就可得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一个循环需2~4分钟,2~3小时就能将待扩目的基因扩增放大几百万倍。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=54998]食物和动物饲料的微生物学.食物病原体检测用聚合酶链式反应[/url]
聚合酶链式反应(Polymerase Chain Reaction,PCR)是体外酶促合成特异DNA片段的一种方法,为最常用的分子生物学技术之一。典型的PCR由(1)高温变性模板;(2)引物与模板退火;(3)引物沿模板延伸三步反应组成一个循环,通过多次循环反应,使目的DNA得以迅速扩增。其主要步骤是:将待扩增的模板DNA置高温下(通常为93℃-94℃)使其变性解成单链;人工合成的两个寡核苷酸引物在其合适的复性温度下分别与目的基因两侧的两条单链互补结合,两个引物在模板上结合的位置决定了扩增片段的长短;耐热的DNA聚合酶(Taq酶)在72℃将单核苷酸从引物的3’端开始掺入,以目的基因为模板从5’→3’方向延伸,合成DNA的新互补链。 PCR能快速特异扩增任何已知目的基因或DNA片段,并能轻易在皮克(pg)水平起始DNA混合物中的目的基因扩增达到纳克、微克、毫克级的特异性DNA片段。因此,PCR技术一经问世就被迅速而广泛地用于分子生物学的各个领域。它不仅可以用于基因的分离、克隆和核苷酸序列分析,还可以用于突变体和重组体的构建,基因表达调控的研究,基因多态性的分析,遗传病和传染病的诊断,肿瘤机制的探索,法医鉴定等诸多方面。通常,PCR在分子克隆和DNA分析中有着以下多种用途:(1) 生成双链DNA中的特异序列作为探针;(2) 由少量mRNA生成 cDNA文库;(3) 从cDNA中克隆某些基因;(4) 生成大量DNA以进行序列测定;(5) 突变的分析;(6) 染色体步移;(7) RAPD、AFLP、RFLP等DNA多态性分析等。一、试剂准备1. DNA模版2.对应目的基因的特异引物3.10×PCR Buffer 4.2mM dNTPmix:含dATP、dCTP、dGTP、dTTP各2mM5.Taq酶二、操作步骤 1.在冰浴中,按以下次序将各成分加入一无菌0.5ml离心管中。 10×PCR buffer 5 μl dNTP mix (2mM) 4 μl 引物1(10pM) 2 μl 引物2(10pM) 2 μl Taq酶 (2U/μl) 1 μl DNA模板(50ng-1μg/μl) 1 μl 加ddH2O至 50 μl 视PCR仪有无热盖,不加或添加石蜡油。2. 调整好反应程序。将上述混合液稍加离心,立即置PCR仪上,执行扩增。一般:在93℃预变性3-5min,进入循环扩增阶段:93℃ 40s → 58℃ 30s → 72℃ 60s,循环30-35次,最后在72℃ 保温7min。3. 结束反应,PCR产物放置于4℃待电泳检测或-20℃长期保存。4.PCR的电泳检测:如在反应管中加有石蜡油,需用100μl氯仿进行抽提反应混合液,以除去石蜡油;否则,直接取5-10μl电泳检测。三、PCR反应体系的组成与反应条件的优化 PCR反应体系由反应缓冲液(10×PCR Buffer)、脱氧核苷三磷酸底物(dNTPmix)、耐热DNA聚合酶(Taq酶)、寡聚核苷酸引物(Primer1,Primer2)、靶序列(DNA模板)五部分组成。各个组份都能影响PCR结果的好坏。1. 反应缓冲液:一般随Taq DNA聚合酶供应。标准缓冲液含:50mM KCl,10mM Tris-HCl(pH8.3室温),1.5mM MgCl2。Mg2+的浓度对反应的特异性及产量有着显著影响。浓度过高,使反应特异性降低;浓度过低,使产物减少。在各种单核苷酸浓度为200μM时,Mg2+为1.5mM较合适。若样品中含EDTA或其它螯合物,可适当增加Mg2+的浓度。在高浓度DNA及dNTP条件下进行反应时,也必须相应调节Mg2+的浓度。据经验,一般以1.5-2mM(终浓度)较好。2. dNTP :高浓度dNTP易产生错误掺入,过高则可能不扩增;但浓度过低,将降低反应产物的产量。PCR中常用终浓度为50-400μM的dNTP。四种脱氧三磷酸核苷酸的浓度应相同,如果其中任何一种的浓度明显不同于其它几种时(偏高或偏低),就会诱发聚合酶的错误掺入作用,降低合成速度,过早终止延伸反应。此外,dNTP能与Mg2+结合,使游离的Mg2+浓度降低。因此,dNTP的浓度直接影响到反应中起重要作用的Mg2+浓度。3. Taq DNA聚合酶酶:在100μl反应体系中,一般加入2-4U的酶量,足以达到每min延伸1000-4000个核苷酸的掺入速度。酶量过多将导致产生非特异性产物。但是,不同的公司或不同批次的产品常有很大的差异,由于酶的浓度对PCR反应影响极大,因此应当作预试验或使用厂家推荐的浓度。当降低反应体积时(如20μl或50μl),一般酶的用量仍不小于2U,否则反应效率将降低。4. 引物:引物是决定PCR结果的关键,引物设计在PCR反应中极为重要。要保证PCR反应能准确、特异、有效地对模板DNA进行扩增,通常引物设计要遵循以下几条原则:⑴ 引物的长度以15-30bp为宜,一般(G+C)的含量在45-55%,Tm值高于55℃。应尽量避免数个嘌呤或嘧啶的连续排列,碱基的分布应表现出是随机的。⑵ 引物的3’端不应与引物内部有互补,避免引物内部形成二级结构,两个引物在3’端不应出现同源性,以免形成引物二聚体。3’端末位碱基在很大程度上影响着Taq酶的延伸效率。两条引物间配对碱基数少于5个,引物自身配对若形成茎环结构,茎的碱基对数不能超过3个由于影响引物设计的因素比较多,现常常利用计算机辅助设计。⑶ 人工合成的寡聚核苷酸引物需经PAGE或离子交换HPLC进行纯化。⑷ 引物浓度不宜偏高,浓度过高有两个弊端:一是容易形成引物二聚体(primer-dimer),二是当扩增微量靶序列并且起始材料又比较粗时,容易产生非特异性产物。一般说来,用低浓度引物不仅经济,而且反应特异性也较好。一般用0.25-0.5pM/μl较好。⑸ 引物一般用TE配制成较高浓度的母液(约100μM),保存于-20℃。使用前取出其中一部分用ddH2O配制成10μM或20μM的工作液。5. 模板:PCR对模板的要求不高,单、双链DNA均可作为PCR的样品。虽然PCR可以用极微量的样品(甚至是来自单一细胞的DNA)作为摸板,但为了保证反应的特异性,一般还宜用μg水平的基因组DNA或104拷贝的待扩增片段作为起始材料。原材料可以是粗制品,某些材料甚至仅需用溶剂一步提取之后即可用于扩增,但混有任何蛋白酶、核酸酶、Taq DNA聚合酶抑制剂以及能结合DNA的蛋白,将可能干扰PCR反应。6. PCR循环加快,即相对减少变性、复性、延伸的时间,可增加产物的特异性。四、注意事项1.PCR反应应该在一个没有DNA污染的干净环境中进行。最好设立一个专用的PCR实验室。2.纯化模板所选用的方法对污染的风险有极大影响。一般而言,只要能够得到可靠的结果,纯化的方法越简单越好。3.所有试剂都应该没有核酸和核酸酶的污染。操作过程中均应戴手套。4.PCR试剂配制应使用最高质量的新鲜双蒸水,采用0.22μm滤膜过滤除菌或高压灭菌。5.试剂都应该以大体积配制,试验一下是否满意,然后分装成仅够一次使用的量储存,从而确保实验与实验之间的连续性。6.试剂或样品准备过程中都要使用一次性灭菌的塑料瓶和管子,玻璃器皿应洗涤干净并高压灭菌。7.PCR的样品应在冰浴上化开,并且要充分混匀。
[size=24px][font=仿宋][b]摘要[/b]:[/font][font=仿宋]聚合酶链反应分析仪(PCR仪)广泛用于疾控、出入境检测、药监、生物制药企业、医疗机构、专业基因检测和分子生物实验室等。应用于司法鉴定、临床诊断、基因研究、疾病控制等领域。其控温性能直接影响到检测结果的可靠性。而常用的铂电阻温度计、热电偶温度传感器因尺寸问题不适用于聚合酶链反应分析仪(PCR仪)控温性能的校准,所以在检测、校准过程中必须使用专用的检测设备,而此类设备大多依赖进口,价格昂贵,未能普遍应用,使得聚合酶链反应分析仪(PCR仪)实验的数据、结果的可靠性不能得到有效保证。本文依据聚合酶链反应分析仪(PCR仪)的检测、校准项目,结合国家相关计量校准规范,提出一种用于聚合酶链反应分析仪(PCR仪)温度性能校准的专用检测设备。[/font][font=仿宋][b]关键词:[/b][/font][font=仿宋]聚合酶链反应分析仪、温度、校准、检测设备[/font][/size][font=宋体][size=22.0000pt][b] 一、绪论[/b][/size][/font][font=仿宋][size=24px]1、聚合酶链反应分析仪(PCR仪)[/size][/font][font=仿宋][size=24px]1.1聚合酶链反应分析仪(PCR仪)的基本原理[/size][/font][img=,561,467]https://ng1.17img.cn/bbsfiles/images/2020/06/202006271433435955_7689_1638093_3.jpg!w561x467.jpg[/img][img=,550,269]https://ng1.17img.cn/bbsfiles/images/2020/06/202006271434048558_6420_1638093_3.jpg!w550x269.jpg[/img][font=宋体][size=18px] [b]图1 基因扩增原理图[/b][/size][/font][size=24px][font=宋体][font=仿宋] 聚合酶链反应分析仪(以下简称PCR仪)就是聚合酶链反应过程中的控温设备,能在变性温度、复性温度、延伸温度之间准确进行温度调整、控制。[/font][/font][font=宋体][font=仿宋]1.2 PCR仪的分类1.2.1按功能分类 a)普通定性PCR仪 仅具备温度控制功能,自动调节温度至不同温度点,完成聚合酶链反应的变性、退火及延伸过程,可自动进行聚合酶链反应,完成基因扩增。 b)荧光定量PCR仪 荧光定量PCR仪是在普通PCR仪的基础上增加一个荧光信号采集系统和计算机分析处理系统的PCR仪,称作荧光定量PCR仪。其PCR扩增原理和普通PCR仪扩增原理相同,只是PCR扩增时加入的引物是利用同位素、荧光素等进行标记,使用引物和荧光探针同时与模板特异性结合扩增。扩增的结果通过荧光信号采集系统实时采集信号连接输送到计算机分析处理系统得出量化的实时结果输出。荧光定量PCR仪有单通道、双通道和多通道。当只用一种荧光探针标记的时候,选用单通道,有多荧光标记的时候用多通道。单通道也可以检测多荧光的标记的目的基因表达产物,因为一次只能检测一种目的基因的扩增量,需多次扩增才能检测完不同目的基因片段的量。[/font][/font][/size][font=仿宋][size=24px]1.2.2按孔数分类[/size][/font][font=仿宋][font=仿宋][size=24px] 目前常见的[/size][/font][/font][font=仿宋][size=24px]PCR仪按试验孔数分主要包括:48孔、96孔、384孔。[/size][/font][font=仿宋][font=仿宋][size=24px]1.3、PCR仪的检测校准[/size][size=24px]1.3.1 PCR仪的检测校准依据和主要校准项目[/size][size=24px] 目前,PCR仪的校准可执行JJF1527-2015《聚合酶链反应分析仪校准规范》。主要检测项目包括:[/size][size=24px] a)温度示值误差;[/size][size=24px] b)温度均匀度(孔间温差);[/size][size=24px] c)平均升温速率;[/size][size=24px] d)平均降温速率;[/size][size=24px] e)样本示值误差;[/size][size=24px] f)样本线性。[/size][/font][/font][font=仿宋][font=仿宋][size=24px] 其中温度示值误差、温度均匀度、平均升温速率、平均降温速率需使用专用温度测量设备进行校准。因考虑到聚合酶链反应过程中,反映酶在温度较高的条件下会发生活性下降甚至失活,对试验结果造成影响的问题,在校准过程中还应加入温度过冲项目的校准。所以用于校准聚合酶链反应分析仪温度性能的检测设备需具备校准:温度示值误差、温度均匀度(孔间温差)、平均升温速率、平均降温速率和温度过冲的功能。[/size][/font][/font][font=仿宋][font=仿宋][size=24px]1.3.2 PCR仪检测仪的功能和技术要求 依据JJF1527-2015《聚合酶链反应分析仪校准规范》的要求,用于校准PCR仪的校准设备,其温度测量性能需满足: a)测温范围:(0~120)℃; b)温度测量结果的不确定度:[i]U[/i]≤0.1℃([i]k[/i]=2); c)可同时测量多个孔的温度。[/size][/font][/font][font=仿宋][font=仿宋][size=24px] 同时为方便平均升温速率、平均降温速率和温度过冲项目的校准,还应具备自动计时、最高温度点自动记录、检测数据定时记录等功能。[/size][/font][/font][font=仿宋][font=仿宋][size=24px]1.4、PCR仪检测仪的发展现状 PCR仪由于实验室应用的特点,其样品槽较小,温度测量中常用的铂电阻温度计、热电偶传感器因尺寸问题,一般不适用于PCR仪温度性能的检测、校准,要实现PCR仪温度性能的检测、校准必须使用专用的检测设备。目前用于PCR仪温度计量性能检测的设备主要分为有线式检测和无线式检测,其中:[/size][/font][/font][font=仿宋][font=仿宋][size=24px] a)有线检测。有线检测的准确度较高,基本满足量传溯源的要求,但因连接线影响PCR仪温度环境的密闭性,使用过程中经常出现因控温环境不密闭,造成检测、校准结果不能真实反应仪器实际控温性能的问题,并且不适用于必须在密闭条件下使用的PCR仪的校准,不具备自动检测和记录功能。 b)无线检测。无线检测设备随能实现自动检测、自动记录检测结果,一次实验可完成多个参数的检测、校准,但目前多依赖于进口,而且准确度较低,不能满足量传溯源的要求。同时此类无线检测设备多为PCR仪生产企业针对本公司仪器开发的专用检测设备,主要用于对本公司产品的质量控制,对其他品牌的PCR仪不具备广泛适用性。 我国第一台PCR仪温场检测仪由成都市计量检定测试院于2013年引进。目前,已有50余家计量检测机构配置了此类设备,开展PCR仪的温度校准工作。但大多计量检测机构配的设备均为PCR仪生产厂家开发的仅适用于本公司产品的检测设备,不能适用于多种品牌、不同型号的PCR仪的校准,而且准确度相对较低,不能满足JJF1527-2015《聚合酶链反应分析仪校准规范》对标准器的要求。由于进口设备,价格昂贵(售价数十万元),不仅一般PCR仪使用机构难以配置,而且专业计量检测机构也极少配置,检测、校准能力严重不足。即便具备PCR仪检测、校准能力的计量检测机构也因检测设备购置成本较高,在开展此项检测、校准工作中也会收取较高的检测费用,致使目前PCR仪的定期溯源率相对较低。[/size][/font][/font][font=仿宋][font=仿宋][size=24px]1.5、发展趋势 随着JJF 1527-2015 《聚合酶链反应分析仪校准规范》的发布,各实验室对PCR仪温度计量性能校准的需求日渐增强,同时对校准系统的适用性、准确性和规范性要求越来越高,市场亟需一套适用广泛,满足现行国家计量校准规范,满足计量溯源体系的,售价在大多数检测机构承受范围内的专用校准系统。[/size][/font][/font][font=仿宋][font=仿宋][size=24px][b]二、技术路线和技术方案[/b] 依据国家校准规范JJF1527-2015《聚合酶链反应分析仪校准规范》规定,PCR仪温场检测设备至少需要15个精密温度传感器,同时完成PCR仪温度计量性能的校准,测温范围:(0~120)℃,温度测量不确定度[i]U[/i]≤0.1℃([i]k[/i]=2)。因此温度采集器选用微小尺寸的高精度耐腐蚀同时具备线性的铂电阻PT1000作为传感器,探头按照PP标准反应管尺寸设计,PT1000涂导热胶后封于探头内。将温度传感器、信号放大采集、数据处理,数据存储集成到一个电路板产品上,非常有效的缩短传感器信号的距离,系统的抗干扰性和准确的提高,同时实现集成化小型化。 参照PCR仪温度控制标准程序,温度采集器将用恒温槽分段标定30℃、50℃、60℃、70℃、90℃、95℃六个温度点,其它温度通过线性换色,可以满足测温范围(0~120)℃,显示分辨率0.01℃,温度测量误差≤0.2℃,通过定期校准,进行修正后,可实现30℃、50℃、60℃、70℃、90℃、95℃六个温度点的测量结果的不确定度[i]U[/i]≤0.1℃([i]k[/i]=2)。 为了实现小型化集成化和无线连接等智能化,PCR仪温场检测设备设计包括温度采集器,无线信号接收器,电脑软件,手机软件;温度采集器功能包括温度传感器,信号放大采集,单片机数据采集和处理,蓝牙无线收发,锂电池充放电管理,USB数据通信等功能,系统复杂功能强大,物理尺寸很小方便工作人员使用;无线信号接收器通过USB插入电脑,用于无线连接温度采集器,实现动态实时数据交互,完成校准工作;电脑软件用于控制和数据接收工作,公司完成数据分析和报告;手机软件用于移动监控和数据下载。[/size][/font][/font][font=仿宋][font=仿宋][size=24px][b]三、技术创新点[/b] 3.1、设计开发的PCR仪温场检测设备,在满足我国JJF1527-2015《聚合酶链反应分析仪校准规范》的基础上,实现集成化、小型化,并采用无线连接,适用性较强;[/size][/font][/font][font=仿宋][font=仿宋][font=仿宋][img=,520,308]https://ng1.17img.cn/bbsfiles/images/2020/06/202006271440249432_2417_1638093_3.jpg!w520x308.jpg[/img][/font][/font][/font][font=仿宋][font=仿宋][size=18px] [b] 图2 采用无线传输方式的PCR仪温度校准系统[/b][/size][/font][/font][font=仿宋][font=仿宋][size=24px] 3.2、设计选用微小尺寸的高精度铂电阻RTD传感器,并将温度传感器、信号放大采集、数据存储集成到一个电路板产品上,系统的抗干扰性和准确度提高,同时实现小型化。温度传感器分布符合JJF1527-2015《聚合酶链反应分析仪校准规范》对温度传感器的分布要求,各温度传感器间距、尺寸与市场主流PCR仪相匹配,可直接替代PCR仪专用孔板嵌入PCR仪进行测量。[/size][/font][/font][font=仿宋][font=仿宋][font=仿宋][img=,548,365]https://ng1.17img.cn/bbsfiles/images/2020/06/202006271441522860_8625_1638093_3.jpg!w548x365.jpg[/img][/font][/font][/font][font=仿宋][size=18px] [b] 图3 PCR仪温度校准系统温度传感器的分布[/b][/size][/font][font=仿宋][size=24px][img=,325,228]https://ng1.17img.cn/bbsfiles/images/2020/06/202006271442214388_1285_1638093_3.jpg!w325x228.jpg[/img][/size][/font][size=18px][b][font=仿宋]图4 [/font][font=仿宋]JJF1527-2015[/font][font=仿宋]规定的温度传感器布点要求[/font][/b][/size][font=仿宋][size=24px] 3.3、PCR仪温度校准系统包括温度采集器,无线信号接收器,电脑软件,手机软件;温度采集器集成了温度传感器,信号放大采集,单片机数据计算,蓝牙无线收发,锂电池充放电管理,USB通信等功能; 3.4、本系统可采用恒温槽和标准温度计对实际校准点,30℃、50℃、60℃、70℃、90℃、95℃六个温度点进行温度分段标定,提高测量准确度;[/size][/font][font=仿宋][size=24px][font=仿宋] 3.5[/font][font=仿宋]、[/font][font=仿宋]本[/font][font=仿宋]系统的温度采集[/font][font=仿宋]器[/font][font=仿宋]采用[/font][font=仿宋]锂电池[/font][font=仿宋]供电[/font][font=仿宋],[/font][font=仿宋]方便[/font][font=仿宋]产品的[/font][font=仿宋]无线[/font][font=仿宋]连接[/font][font=仿宋]和[/font][font=仿宋]移动工作[/font][font=仿宋];[/font][font=仿宋]通过[/font][font=仿宋]电池[/font][font=仿宋]采用直流电压[/font][font=仿宋]供电提高了温度信号采集的稳定性,[/font][font=仿宋]隔离[/font][font=仿宋]了工频电源的[/font][font=仿宋]干扰;[/font][font=仿宋]通过USB[/font][font=仿宋]接口[/font][font=仿宋]给温度采集[/font][font=仿宋]器的[/font][font=仿宋]锂电池进行充电[/font][font=仿宋];[/font][font=仿宋] 3.6[/font][font=仿宋]、本[/font][font=仿宋]系统的温度采集[/font][font=仿宋]器设计数据[/font][font=仿宋]存储芯片,[/font][font=仿宋]用[/font][font=仿宋]电池供电工作自动[/font][font=仿宋]进行[/font][font=仿宋]温度采集[/font][font=仿宋]存储,校准工作[/font][font=仿宋]完成后,[/font][font=仿宋]再[/font][font=仿宋]连接电脑读出数据[/font][font=仿宋]做[/font][font=仿宋]分析[/font][font=仿宋]和[/font][font=仿宋]报告[/font][font=仿宋],可[/font][font=仿宋]实现[/font][font=仿宋]多台[/font][font=仿宋]机器同时校准工作;[/font][font=仿宋] 3.7[/font][font=仿宋]、[/font][font=仿宋]本[/font][font=仿宋]系统的温度采集[/font][font=仿宋]器设计USB[/font][font=仿宋]数据接口[/font][font=仿宋]和[/font][font=仿宋]无线[/font][font=仿宋]蓝牙;[/font][font=仿宋]可通过USB[/font][font=仿宋]或者[/font][font=仿宋]无线蓝牙[/font][font=仿宋]对[/font][font=仿宋]温度采集器进行监控[/font][font=仿宋]和[/font][font=仿宋]数据读取[/font][font=仿宋]。[/font][/size][/font][font=仿宋][font=仿宋][size=24px][b]四、产品功能[/b] 4.1、具有无线连接功能,可以使用USB无线接收器进行工作,也可以用手机APP进行操作工作; 4.2、采用高精度铂电阻RTD传感器,测温范围(0~120)℃,分辨率0.01℃,温度测量误差≤0.2℃,通过校准,进行修正后,可实现测量结果的不确定度[i]U[/i]≤0.1℃([i]k[/i]=2); 4.3、温度采集器设计了锂电池,通过USB充电; 4.4、温度采集器设计了数据存储芯片,用电池供电工作自动进行温度采集存储,校准工作完成后,再连接电脑读取数据,自动完成数据处理,生成校准报告。并根据采集得到的数据自动生成热成像图,通过热成像图直观体现PCR仪各加温孔内温度的偏移情况,为试验人员提供参考,避免使用温度明显偏移温度设定点的加温孔进行试验。同时可实现多台仪器同时校准,集中读取校准数据;[/size][/font][/font][font=仿宋][font=仿宋][font=仿宋][img=,563,395]https://ng1.17img.cn/bbsfiles/images/2020/06/202006271444186719_9018_1638093_3.jpg!w563x395.jpg[/img][/font][/font][/font][font=仿宋][font=仿宋][size=18px] [b]图5 PCR温场检测系统依据检测数据自动生成热成像图[/b][/size][/font][/font][font=仿宋][font=仿宋][size=24px] 4.5、温度采集器设计了无线蓝牙;电脑可通过USB或者无线蓝牙对温度采集器进行监控和数据读取。[/size][/font][/font][font=仿宋][font=仿宋][size=24px][b]五、技术指标[/b][/size][/font][/font][font=仿宋][font=仿宋][size=24px] 5.1、集成化小型化。温度传感器,检测探头,信号放大采集,数据计算,数据存储,无线蓝牙连接,USB通信接口,锂电池供电及充放电控制;实现以上功能产品,并且设计可以放入PCR仪([url=https://insevent.instrument.com.cn/t/jp][color=#3333ff][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]基因扩增仪[/color][/url][/color][/url])的物理尺寸。[/size][/font][/font][font=仿宋][font=仿宋][font=仿宋][img=,379,269]https://ng1.17img.cn/bbsfiles/images/2020/06/202006271445178540_2384_1638093_3.jpg!w379x269.jpg[/img][/font][/font][/font][font=仿宋][font=仿宋][size=18px] [b]图6 直接以PCR温场检测仪代替孔板放入PCR仪[/b][/size][/font][/font][font=仿宋][font=仿宋][size=24px] 5.2、实现无线接收器,可以无线连接温度采集器,发送控制命令,或者将温度数据通过USB转发给电脑。 5.3、实现电脑软件,用于人机控制,对PCR仪校准过程中的数据动态监控,数据分析和数据报告的输出。 5.4、实现手机软件,用于移动状态监控和数据监控。 5.5、适用于48孔、96孔PCR仪的检测、校准,温度采集共15个通道,分辨率0.01℃,测量误差≤0.2℃。 5.6、温度采集15个通道,每个通道温度数据10sps,即每秒实现采集10个温度数据。预估整个校准工作25分钟需要产生:10sps * (25 * 60)seconds * 15channel = 225000个温度数据。数据存储选择4Mbit闪存芯片。 5.7、PCR仪温度校准系统的温度采集器工作电流估算30mA,峰值电流估算50mA,电池工作有效时间设计2小时,选择输出3.7V的锂电池容量大于100mAh。 5.8、USB数据读取闪存芯片中的温度数据,不超过30秒。无线蓝牙传输温度数据,不低于每秒150(10sps*15channel)个温度数据。[/size][/font][/font][font=仿宋][font=仿宋][size=24px][b]六、市场分析[/b] 目前,我国在用PCR仪约300万台,并逐年递增。主要分布于疾控、出入境检测、药监、生物制药企业、医疗机构、专业基因检测和分子生物实验室等。应用于司法鉴定、临床诊断、基因研究、疾病控制等领域,特别是在病毒性传染病筛查过程中发挥着至关重要的作用。由于目前专用的PCR仪温场检测设备价格昂贵,全国仅50余家计量检测机构具备检测能力,无法满足每年PCR仪的检测需求。而此套检测设备的开发成功,在技术性能满足JJF1527-2015《聚合酶链反应分析仪校准规范》,达到国外同类产品技术水平的条件下,产品价格预计可降低50%,为中小型计量检测机构购置PCR仪温场检测设备开展校准工作提供了可能,同时也可用于PCR仪使用机构定期核查PCR仪温度性能,合理选用反应试剂,提高检测可靠性。[/size][/font][/font][size=24px]结束语[/size][font=仿宋][font=仿宋][size=24px] PCR仪专用检测仪是以实现PCR仪的计量校准为目的开发的专用检测设备,解决了长期以来此类设备依赖进口的问题,有助于PCR仪量值溯源体系的建立和完善,通过定期校准的方式保证PCR仪检测结果的可靠性。能够为我国基因研究、食品安全检测、医学诊断等领域提供必要的技术保障。[/size][/font][/font][size=32px][color=#cc0000][i]注:此套检测设备已于2020年实现技术成果转化,并开始小规模生产。[/i][/color][/size]
[B][center]聚合酶链反应(PCR)技术的发展和应用(一) [/center][/B] 第一节 概述 聚合酶链反应或多聚酶链反应(Polymerase Chain Reaction, PCR),又称无细胞克隆技术(“free bacteria”cloning technique),是一种对特定的DNA片段在体外进行快速扩增的新方法。该方法一改传统分子克隆技术的模式,不通过活细胞,操作简便,在数小时内可使几个拷贝的模板序列甚至一个DNA分子扩增107~108倍,大大提高了DNA的得率。因此,现已广泛应用到分子生物学研究的各个领域。 PCR技术最早由美国Cetus公司人类遗传研究室Kary Mullis及同事于1985年发现并研制成功的;最早的应用报道是Saiki等1985年将PCR技术应用于β-珠蛋白基因扩增和镰刀状红细胞贫血的产前诊断。随后使用了1976年Chien等分离的热稳定性Taq DNA聚合酶,使PCR操作大为简化,并使PCR自动化成为可能;1987年Kary Mullis等完成了自动化操作装置,使PCR技术进行实用阶段。 国内复旦大学1988年起开始研制耐热性多聚酶,军事医学科学院马立人教授等在1989年研制成功了PCR自动装置,并且不断推陈出新,最近研制的PTC-51A/B型DNA热循环仪体积小,造型美观,价格适宜,操作简单,尤为适宜国内应用。 PCR发明不到10年,却已获得广泛应用。目前,每年都有上千篇文章 发表。1991年,期刊“PCR方法与应用”(PCr Methods and Application)在美国创刊,使有关学者有了自己的论坛和参考的专业期刊。PCR技术作为一种方法学革命,必将大大推动分子生物学各有关学科的研究,使其达到一个新的高度。 1993年度诺贝尔化学将已于10月13日揭晓,Kary Mullis因发明了“聚合酶链式反应”而获得此殊荣。现在世界各地都在使用PCR检测病人血液中的微量遗传物质,这一成就为精确诊断艾滋病及其它病症铺平了道路。瑞典皇家科学院说:“PCR方法已经广泛应用于生物医学中。该方法同DNA测序法结合起来很可能将成为研究动植物分类学的一种革新工具。”一名加拿大籍英国科学家Michael Smith因开创了“寡核苷酸基因定点诱变”的方法而与Mullis同享此荣。
聚合酶链反应(PC)技术的发展和应用作者:antony第一节 概述 聚合酶链反应或多聚酶链反应(Polymerase Chain Reaction, PCR),又称无细胞克隆技术(“free bacteria”cloning technique),是一种对特定的DNA片段在体外进行快速扩增的新方法。该方法一改传统分子克隆技术的模式,不通过活细胞,操作简便,在数小时内可使几个拷贝的模板序列甚至一个DNA分子扩增107~108倍,大大提高了DNA的得率。因此,现已广泛应用到分子生物学研究的各个领域。 PCR技术最早由美国Cetus公司人类遗传研究室Kary Mullis及同事于1985年发现并研制成功的;最早的应用报道是Saiki等1985年将PCR技术应用于β-珠蛋白基因扩增和镰刀状红细胞贫血的产前诊断。随后使用了1976年Chien等分离的热稳定性Taq DNA聚合酶,使PCR操作大为简化,并使PCR自动化成为可能;1987年Kary Mullis等完成了自动化操作装置,使PCR技术进行实用阶段。 国内复旦大学1988年起开始研制耐热性多聚酶,军事医学科学院马立人教授等在1989年研制成功了PCR自动装置,并且不断推陈出新,最近研制的PTC-51A/B型DNA热
聚合酶链反应 现已报道用多种不同条件通过PCR扩增DNA片段,现归纳如下。当对哺乳动物DNA 进行实验时,我们用的反应总体积为50μl,内含50-500ng基因组DNA.反应缓冲液: 67mM Tris.HCl,pH8.8,6.7mM MgCl2,16mM(NH4)2SO4,10mMβ羟基乙醇和10%二甲 基亚砚。反应液同时分别含有75pmol四种脱氧核苷三磷酸、每一种寡核苷酸引物为 50pmol.混匀样品后,加入一个单位的Taq DNA聚合酶,100μl矿物油覆盖于反应溶 液的上层以防蒸发。反应样品于93℃保温1分钟使DNA变性,然后如下所述在60℃到 70℃之间放置1-2分钟。扩增后,将水相转入另一支试管,酚抽提及乙醇沉淀。用 50μl非变性胶载样缓冲液悬浮在PCR扩增过程中出现的一些问题以及建议如下 一、错误的PCR扩增片段:使用简便的EB染色检测在变必梯度胶中的扩增DNA,经PCR 扩增应该合成单一的DNA.不幸的是反应产物偶尔比预料的要复杂得多;例如形成除靶 DNA之外的许多不同大小的DNA,有时这些非靶DNA片段占产物的绝大部分。在此情况 下,额外产笺DNA干扰了在DGGE上对靶片段的分析。我们采取以下几个步骤为防止上 述问题的出现: 1、在PCR过程中避免产生非靶DNA片段的方法之一是使反应在尽可能高的温度下进 行。反应在低温下(45-55℃)退火有可能使引扩增基因组DNA上的其它区域而不是靶片 段。很可能引物不能完全与非靶DNA序列互补,但经PCR最初合成反应之后,这些新的 产物在随后的扩增循环中成为退火良好的模板。因此,我们一般在尽可能高的温度下 退火,通常是55-65℃,然后在可能的最高温度下延伸,一般为60-72℃。对于每一对 寡核苷酸温度的选择是根据经验来决定的。2、选择比较长的寡核苷酸引物(25-30个核苷酸而不是20个,不包括GC发夹序列) 有时能改善反应的特异性,减少非目的产物。较长的引物同时可增高退火/延伸的温 度,而这也增加了反应的特异性。实际上,30个核苷酸长的引物在PCR过程中可直接 在两个温度之间(通常是70-72℃和93℃)进行循环反应,而不需要通过退火步骤,从 而有助于防止非物异的带产生。
‘有奖问答’对错题:生产聚丙烯腈纤维(腈纶)中的湿纺工艺反应为链式聚合 ( )
什么是PCR技术? PCR(Polymerase Chain Reaction)技术,中文译为聚合酶链式反应,是一种在体外(试管、切片…)扩增核酸的技术。PCR的基本反应包括以DNA为模板的反应和以mRNA为模板的反应。 PCR技术是模拟体内天然DNA(脱氧核糖核酸)的复制过程。以扩增DNA为例,其基本原理是在模板、引物、4种dNTP和耐热DNA聚合酶存在的条件下,特异扩增位于两段已知序列之间的DNA区段的酶促合成反应。
一、通过聚合酶链式反应(PCR)将靶基因亚克隆到质粒载体上(一)PCR引物设计的基本原则与PCR反应组分和条件1. PCR引物设计的基本原则(1)引物与靶基因间配对的碱基一般为15-20。(2)引物碱基尽可能随机分布,避免出现嘌呤、嘧啶堆积现象,引物G + C含量宜在45-55%左右。(3)引物内部不应形成二级结构,两个引物之间尤其在3’末端不应有互补链存在。(4)引物的碱基顺序不应与非扩增区域有同源性。可用计算机进行辅助检索分析。(5)引物3’末端一般以单个C或G结尾。 2. PCR反应组分和条件PCR反应体系一般选用50 μl体积,其中含有:10×Reaction buffer,5 μl2个引物,各12.5-25 pmol (终浓度各0.25-0.50 μmol/L)4种底物(dATP + dCTP + dGTP + dTTP),各200μmol/L模板DNA,100 ng左右Taq DNA聚合酶,2.5-3 U PCR反应条件一般为:(1)94℃,5分钟([font=Times New Ro
[b][url=http://www.f-lab.cn/pcr/micropcr.html]微型PCR仪PCR-200[/url][/b]是专业为[b]聚合酶链式反应[/b]Ploymerase Chain Reaction, PCR而设计的[b]微量PCR仪[/b],非常适合作为微量热循环仪器使用。[b]微型PCR仪[/b]PCR-200用于分子学、医学、食品工业、司法科学、生物技术、环境科学、微生物学、临床诊断、流行病学、遗传学、基因芯片、基因检测、基因克隆、基因表达等领域以聚合酶链式反应(Ploymerase Chain Reaction, PCR)为特征的、以检测DNA/RNA为目的的各种病原体检测及基因分析。[b][b]微型PCR仪[/b]PCR-200特点[/b]结构紧凑,尺寸较小[img=微型PCR仪]http://www.f-lab.cn/Upload/PCR-200.jpg[/img]具有指导性的界面方便用户使用盖子是耐高温材料制造,适合各种类型的试管内存功能两种工作模式:PCR控制或计算机软件控制[b][b]微型PCR仪[/b]PCR-200参数[/b]容积:25x0.2mL(A), 9x0.5mL(B),16x0.2ml+9x0.5ml(C)温度范围:0-99℃最大加热速率:=2℃/s均匀性:=2℃/s热盖温度:105℃可存储命令数:3最大循环数:99显示:12864LCD尺寸:160x140x120mm重量:2.2kg更多PCR仪官网:[url]http://www.f-lab.cn/pcr.html[/url]
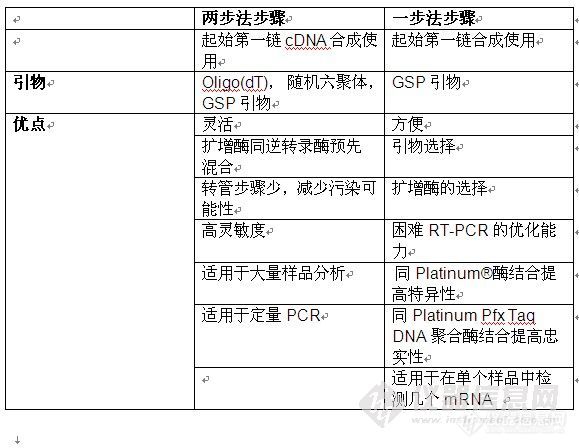
第一章 PCR和RT-PCR基础PCR基础 聚合酶链式反应(PCR)过程利用模板变性,引物退火和引物延长的多个循环来扩增DNA序列。这是一个指数增长的过程,因为上一轮的扩增产物又作为下一轮扩增的模板,使其成为检测核酸的一种非常灵敏的技术。一般,经过20-30个循环得到的扩增产物就足够在溴化乙锭染色的凝胶上观察到。反应包括几个成分(表1)。模板可以为纯化的基因组或质粒DNA;由RNA转化得到的cDNA;或未经纯化的粗制生物样品,如细菌克隆或噬菌斑。引物确定了扩增产物的序列和长度。最常用的热稳定聚合酶是Taq DNA聚合酶。这种酶适用于常规扩增,但是使用其他热稳定聚合酶会改善结果。扩增反应还包括缓冲液,三磷酸脱氧核苷及镁离子。镁离子浓度影响酶的活性、引物退火、模板和PCR产物的熔点(Tm),忠实性以及引物二聚体的形成等。在随后的章节中将讨论这些成分、循环参数以及其他参与作用的因子相互间各种作用对于成功PCR的影响。http://ng1.17img.cn/bbsfiles/images/2010/12/201012301341_270843_1856701_3.jpgRT-PCR基础 RT-PCR将以RNA为模板的cDNA合成同PCR结合在一起,提供了一种分析基因表达的快速灵敏的方法。RT-PCR用于对表达信息进行检测或定量。另外,这项技术还可以用来检测基因表达差异或不必构建cDNA文库克隆cDNA。RT-PCR比其他包括Northern印迹、RNase保护分析、原位杂交及S1核酸酶分析在内的RNA分析技术,更灵敏,更易于操作。 RT-PCR的模板可以为总RNA或poly(A)+选择性RNA。逆转录反应可以使用逆转录酶,以随机引物、oligo(dT)或基因特异性的引物(GSP)起始。RT-PCR可以一步法或两步法的形式进行。在两步法RT-PCR中,每一步都在最佳条件下进行。cDNA的合成首先在逆转录缓冲液中进行,然后取出1/10[/s
我对原核生物和真核生物的DNA聚合酶及RNA聚合酶的结构,分类和功能还比较模糊。希望那位高手能赐教。谢谢[em0802]
某日,我正在做聚合酶链式反应(简称PCR反应), 一师兄不满的问我: "你拉完(PCR)了吗?" 答曰:"快拉完了。" 他催促说: "你怎么拉的这么慢,都两个多小时了。" 我满不在乎的说: "这有什么,上次XXX还拉了四个小时呢。" 师兄嘱之曰: "这几天拉的人比较多,你快些就是了, 互相照顾一下,大家都很急!"
新华网东京12月14日电 日本鹿儿岛大学的一个研究小组以甲型H1N1流感病毒感染人体的机制为切入点,开发出一种能快速检测甲型流感病毒的新方法。 该研究小组日前发布的公报说,甲型H1N1流感病毒会与人体细胞表面的糖链结合,进而感染细胞。鹿儿岛大学教授隅田泰生等人以此为突破口进行研究,人工合成了人体细胞表面的这种糖链,使其附着在极微小的金粒表面。 在实验中,研究人员将含有甲型H1N1流感病毒的患者唾液与上述金微粒混合后放入离心装置。被病毒附着的金微粒由于质量较大,能被分离出来,而且得到的病毒浓度较高。 目前判断某人是否感染甲型H1N1流感病毒,首先要用简易检查工具对其进行检测,尔后再让病毒的基因增殖,进行聚合酶链式反应检测。但由于在感染初期,甲型流感病毒在感染者体内还未增殖到足够数量,因此现行简易检查的结果可能呈阴性。而新方法由于分离出的病毒浓度较高,不会出现这样的失误。 报告说,新方法只需30分钟左右就能判断被检测者是否感染甲型H1N1流感病毒,而包括聚合酶链式反应在内的现行检测法用时更长。此外,与从被检测者鼻腔深处采集样本相比,新方法采用唾液,被检测者没有不适感。 目前,该研究小组正与兵库县的一家企业合作开发采用这种新方法的检测仪器。又要有新仪器问世啦!
拟增修订项目1、一部共16项,其中新增6项: 电泳测定法 渗透压摩尔浓度测定法 等离子体发射光谱法大孔树脂有机残留物测定法 聚合酶链式反应法 中药特征图谱指导原则 2、二部共45项,新增12项: 核磁共振波谱法 离子色谱法 电导率测定法 锥入度检查法 2-乙基己酸测定法 光学显微镜法 拉曼光谱法指导原则 溶出度测定指导原则 药物多晶型研究指导原则 蛋白质含量测定法合成多肽中醋酸测定法 氨基酸测定指导原则
细菌的实验室检测方法进展——金黄色葡萄球菌的鉴定方法摘要:金黄色葡萄球菌广泛分布于自然界,多存在于人和动物的鼻腔、咽喉、皮肤及与外界相通的腔道。能引起人和动物机体局部、脏器的化脓性感染,重者可引起败血症、脓毒血症等全身感染。金黄色葡萄球菌也是国内外最常见的细菌性食物中毒病原菌之一,在我国由金黄色葡萄球肠毒素引起的食物中毒占细菌性食物中毒事件的前几位。典型的金黄色葡萄球菌为球型,显微镜下排列成葡萄串状。金黄色葡萄球菌肠毒素被分为7 个血清型,A、B、C(C1、C2、C3)、D、E。目前实验室对金黄色葡萄球菌的检验有传统培养法,金黄色葡萄球菌肠毒素的检测方法,脉冲场凝胶电泳检测分型方法和聚合酶链式反应(PCR)技术对金黄色葡萄球菌的检测方法。
中国科技网讯 据物理学家组织网8月29日(北京时间)报道,美国能源部劳伦斯·利弗莫尔国家实验室(LLNL)研究人员最近开发出一种核酸(DNA和RNA)快速扩增技术,使聚合酶链式反应(PCR)的速度大大加快,可在3分钟内将基因组片段扩增10亿倍,迅速识别出病原菌。疾病快速诊断有望很快成为现实。相关论文发表在最近出版的《分析师》杂志上。 PCR技术能让研究人员把一段DNA或RNA复制上百万副本,然后用于基因组测序、基因分析、遗传病诊断、亲子鉴定、法庭鉴定、确定疾病感染等。该过程一般需要1小时到几天时间。然而,快速诊断、应急反应或传染病监控往往要求PCR技术缩短到几分钟。 领导这项研究的工程师雷金纳德·比尔和同事克服酶动力学和热动力学方面的限制,用多孔材料和绝热薄膜制造出一种设备,实现了极速热循环,能每秒钟加热或制冷45℃,一次热循环不超过2.5秒。比尔特别指出:“这种设备的独特之处还在于,它制冷的速度和加热一样快。” 开发出这种设备后,比尔和同事从10种商用酶中选出了2种,这2种酶的链式反应速度非常快,将一些参数略作调整,就能使反应更快。 他们用一种肠杆菌属的细菌测试了新的PCR设备迅速扩增DNA片段的能力,然后用一段严重急性呼吸道综合征(SARS)DNA片段演示了设备处理威胁公共健康病毒方面的效果。该设备完成对目标DNA30个周期(10亿倍)的PCR扩增,用时仅为2分18秒。 目前,研究小组正在开发一种实时探测设备。按照他们的设想,将来一台PCR仪器就能完成整个测试,从样本到结果只需10分钟。市场对这种设备的需求将是巨大的,除传统的公共卫生和医疗研究领域,一台简单实用的实时PCR设备在养殖、农业以及食品加工行业都非常有用,可用来保障食品安全。(记者 常丽君) 总编辑圈点 随着人类基因组逐渐被破译,一张生命之图将被绘就,我们对人类自身的了解也会迈上新的台阶,很多疾病的病因将被揭开,药物就会设计得更好,治疗方案也能“对因下药”,生活起居、饮食习惯有可能根据基因情况进行调整,人类的整体健康状况将会提高。然而,病来如山倒,为了尽快找到病因,疾病的快速诊断就显得异常重要。而文中提到的技术,可在三分钟内识别病原菌,无疑为很多急症患者的生存争取了宝贵的时间。 《科技日报》(2012-8-30 一版)

配置PCR体系需要DNA模板,引物,4种dNTP混合物,Taq DNA聚合酶,Mg2+,缓冲液和水等多种物质。一般在实验中,DNA模板和引物是根据自己的实际情况来选择,其他的东西在不同的PCR体系中可以通用,因此,很多公司把其他的剩余物质都组合在一起制成MIX试剂卖给我们。这种MIX不但给我们实验带来了方便,也给公司带来了收入,一举两得。 可是,凡事都有两面性,随之而来的也有问题了。这种MIX受到这么大的欢迎,因此,不同厂家开始自己生产,甚至不同厂家有不同的MIX体系。从颜色分,MIX有紫色,绿色,蓝色,无色等多种色系;从价位来分,从几十到上千不等;从效果来分,有普通的,高保真,快速的等多种类别,这么多种足以让我们眼花缭乱。面对这么多种,类似我这样的有选择综合症的人几乎要崩溃,还好,有实验室的前辈们帮忙,问题也就迎刃而解了。http://ng1.17img.cn/bbsfiles/images/2015/09/201509281534_568302_3041149_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/09/201509281534_568303_3041149_3.jpg 首先,对PCR扩增要求不高的,可以选用普通的MIX。一般的实验室有经常用的一类值得信赖的产品。当然,如果有公司过来推销,可以先用试用装,如果效果好,价格也好的话,可以继续使用,甚至推广。而对于一些扩增片段长的,扩增片段碱基含量特异的或者退火温度有要求的,可以选用特异的MIX,因为有些MIX的设计是专门针对PCR扩增时的特殊要求的,例如对于一些要求扩增片段无差异的,最好选用高保真酶。当然,有针对特殊功能的MIX一般价格也比较高,不过如果能达到目的的话还算物有所值,经常花了钱也的不到结果。所以面对一些难以扩增的片段,最好采用多种酶同时扩增,这样成功的几率大很多。即使是有这么多的MIX产品,仍旧有一批人坚持自己配PCR体系。所以说选用哪种产品,哪种方法是关键还是取决于实验需要。http://simg.instrument.com.cn/bbs/images/default/em09511.gif
‘有奖问答’对错题:逐步聚合的聚合方法:熔融缩聚、溶液缩聚、界面缩聚、固相缩聚 链式聚合的聚合方法:本体聚合、溶液聚合、悬浮聚合、乳液聚合( )

[size=16px] 大肠杆菌检测仪如何检测大肠菌群 检测大肠杆菌(Escherichia coli,E. coli)群的方法通常需要使用特定的实验室仪器和技术,而不是简单的手持式检测仪。以下是一般的步骤,说明如何使用传统的实验室方法检测大肠杆菌群: 样品采集: 收集你要检测的样品,这可以是水样、食品样品、环境样品等。 确保采样过程是卫生的,以防止样品污染。 样品预处理: 根据样品类型,可能需要进行样品的预处理步骤。例如,对于食品样品,可能需要将其加入到适当的培养基中以培养细菌。 培养: 将样品或样品预处理液接种到含有营养成分的培养基中,通常使用MacConkey培养基,它有助于选择性生长大肠杆菌。 培养基可能会在37°C的恒温培养箱中培养一段时间,通常为24小时。 大肠杆菌群的鉴定: 观察培养后的培养基,大肠杆菌通常会呈现典型的粉红色或红色粘液样的生长。 使用细菌学技术,例如格拉姆染色、生化测试或分子生物学技术,来进一步确认大肠杆菌的身份。 统计计数: 可以使用传统的计数方法,如涂布法,在含有大肠杆菌的培养基上制作细菌计数板,然后通过计算细菌的数量来确定菌群浓度。 数据分析: 分析实验结果,记录大肠杆菌群的数量,并将其与相关法规或标准进行比较,以确定样品是否符合健康和卫生标准。 需要注意的是,上述步骤是传统的实验室方法,通常需要专业实验室设备和培训的操作人员才能执行。此外,大肠杆菌检测通常需要一定的时间,因为培养和鉴定的过程可能需要一至数天。对于快速的检测需求,也可以使用分子生物学方法,如聚合酶链式反应([url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]),来快速检测大肠杆菌的存在。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/09/202309181131200540_8358_6098850_3.png!w690x690.jpg[/img][/size]

http://ng1.17img.cn/bbsfiles/images/2017/10/2015101316285033_01_1664_3.jpg 根据市场需求,Polymer Char研发一种可靠的全自动的聚合物材料特性粘度分析仪IVA®,溶解温度可以达到200℃。IVA®研发建立在已成熟的质控平台上,集成了强大的双毛细管粘度检测器和非常可靠的高温自动进样器,同时客户也可以选配红外检测器IR4。 双毛细管粘度计原理简单:聚合物溶液通过不锈钢毛细管管线产生的压降与纯溶剂所产生的压降之比,压降是同时测得的。聚合物溶液的相对粘度是由压力之比得到的,而特性粘度的计算要考虑注入聚合物的质量。 和乌氏粘度计的毛细管不同,IVA®的不锈钢管毛细管和管线无需额外的清洗或者冲洗,可以提供精确的粘度数值,经久耐用。加热部件和传输管线的精妙设计确保聚合物能够完全溶解,即使是高分子量的聚合物也能够完全溶解完成分析。 分析时,分析人员将已加聚合物的样品瓶放置在自动进样器的外部托盘中,直到需要分析前外部托盘处于室温状态。然后自动进样器的机械手会把需要分析的样品瓶从外部托盘转移到加热炉中,仪器自动加入溶剂,开始震动。分析人员可以自动选择溶解温度,震动的速率和时间,实现聚合物的完全溶解,同时也可以最大限度地减少聚合物热降解。选配IR4检测器,分析聚烯烃或者具有明显的C-H键的聚合物可以更加精确地获得聚合物的注入质量,从而提高特性粘度测试的精度和准确度。主要特点:Ø 配有高温溶解自动进样器Ø 全自动分析,包括溶解,无需处理溶剂Ø 自动清洗Ø 选配IR4检测器时无需精确称量Ø 操作简单,仪器可靠Ø 结果精确Ø 一次可以自动分析多达42个样品Ø 可用于分析高分子量和超高分子量聚合物Ø 溶剂消耗量小http://ng1.17img.cn/bbsfiles/images/2015/10/201510131629_569903_1664_3.jpg
问题描述:核酸扩增体系如何判断是否受到抑制?解答:[align=left][font=宋体][color=black]聚合酶链式反应[/color][/font][font='Times New Roman','serif'][color=black]([url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url])[/color][/font][font=宋体][color=black]已经成为生物学研究中一项常用的技术,但核酸扩增核过程中会存在许多抑制因素。通过在反应体系中增加内参,可实时监控每一个反应孔内是否受到[/color][/font][font='Times New Roman','serif'][color=black][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/color][/font][font=宋体][color=black]抑制或干扰,防止[/color][/font][font='Times New Roman','serif'][color=black][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/color][/font][font=宋体][color=black]反应抑制剂引起的假阴性结果。[/color][/font][/align]以上内容来自仪器信息网《PCR实战宝典》
由Mullis等在1983年建立的PCR技术已成为分子生物学、遗传学等学科研究领域的经典实验方法。近年来,该技术本身获得了长足发展,可靠性不断提高,在聚合酶链式反应基本原理的基础上,发展了一系列新的概念和实验方法,在生命科学研究中具有重要价值。实时定量RT - PCR的原理、方法和应用1、实时定量RT - PCR的原理实时定量PCR的发明归功于两个重要的发现:一是发现DNA Taq酶有5′ 3′外切酶活性,二是利用荧光能量传递技术构建了双标记寡核苷酸探针,即TaqMan探针。在PCR过程中,这些荧光信号可以被探测器所“即时”捕获,电脑软件可以通过等式ΔRn = R+n - R-n 计算ΔRn ,其中, R+n 是表示每点测量的荧光强度, R-n 表示荧光基线强度,ΔRn 的值表示PCR过程中,探针降解的量,就是PCR产物的量 。Comp lex探针技术:该技术的特点是先合成荧光探针和淬灭探针,荧光探针为25个碱基左右, 5′端有荧光报告基团,淬灭探针长度为15个碱基左右, 3′端有荧光淬灭基团,并能与荧光探针5′端杂交。当荧光报告基团与淬灭基团靠近时,荧光信号被吸收。当反应体系中没有特异性模板时,不能检测到报告基团的荧光信号。当有特异性模板存在时,在PCR复性阶段荧光探针优先与模板结合,以致两探针分离,报告基团的荧光信号可被释放出来,其强度与被扩增的模板数量成正比,因而可进行PCR定量。2、方法首先提取细胞因子mRNA,合成cDNA,可以采用TR Izol试剂盒,也可以采用Higher Pure RNA isolationkit从组织中提取RNA,所得到的RNA必须有较高的纯度,且不含DNA;然后,确定管家基因,设计引物和探针;再进行PCR扩增和基因定量。3、实时定量RT - PCR的应用实时定量PCR可用于基因表达研究,转基因研究,单核苷酸多态性及突变分析,病原体检测,药物疗效考核,肿瘤基因检测等。
这款[url=http://www.f-lab.cn/pcr/pcrsg-500.html][b]梯度PCR热循环仪[/b]PCRSG-500[/url]是真正意义上的[b]梯度PCR仪,[/b]适合[b]聚合酶链式反应[/b]为特征的、以检测DNA/RNA为目的的各种病原体检测及基因分析。[b]梯度PCR热循环仪PCRSG-500特点[/b]方便而灵活的模块更换设计密封样品设计,用于低温保存,清洁和干燥双阶热盖压力调节器,确保完美密封镀金或镀银模块,增加热传导效率,实验更为有效超大尺寸高对比度LCD显示屏[img=梯度PCR热循环仪]http://www.f-lab.cn/Upload/PCRSG-500.jpg[/img]具有指导性的界面方便用户使用操作可调旋钮配置,适合各种试管断电内存保存功能超低噪音,节能,寿命长热盖可在任何角度停止金属材料盖子,更加安全可靠可以连接硬盘和鼠标可与计算机连接进行多功能控制Windows系统方便免费程序升级[b]梯度PCR热循环仪PCRSG-500参数[/b]容积:96x0.2mL, 54x0.5mL,96x0.2ml,77x0.5ml,384well温度范围:0-99℃最大加热速率:=4.5℃/s均匀性:=4℃/s温度精度:=+/-0.2℃温度梯度范围:30-99℃梯度扩散:1-30℃梯度均匀性:=0.2℃加热盖温度:20-110℃可存储命令数:1000最大循环数:999显示:5.7''LCD尺寸:380x270x250mm重量:7.8kg[color=#1C1C1C]更多PCR仪请浏览官网:[url]http://www.f-lab.cn/pcr.html[/url][/color]
[em09505]怎么才能知道自己是不是感染了甲型流感呢?现在有甄别的办法了,那就是利用PCR技术对从疑似患者身上得到的标本,在BSL-2级的实验室生物安全柜中对病毒核酸进行检测。在10月15号的时候,甘肃省卫生厅下发了一个重要通知:为了尽早发现重症甲型H1N1流感病例,进一步加强甲型H1N1流感重症病例的救治工作,要求所有通过PCR实验室验收的省级医院要在11月1日前开展甲型H1N1流感病毒核酸检测工作。检测对象被确定为在医院住院病例中,具有流感样病例表现需排查重症甲型H1N1流感的患者;在急诊、发热门诊、内科、儿科门诊流感样病例中自愿、自费检测的患者。而检测试剂则必须是经过国家权威机构评价认可的试剂。按照程序,省级医院对检测出的病毒核酸阳性标本,必须及时送流感监测网络实验室进行病毒分离培养工作。阳性病例的信息必须通过网络直报系统进行报告或订正报告。在检测中发现甲型H1N1流感重症病例时,医院必须将患者及时送到具备医疗救治条件的病房或医院救治,及时报告。对于什么是PCR?相关检测仪器又是什么?普通大众可能接触的不多,现在让我们先了解一下什么是PCR吧:聚合酶链式反应 (Polymerase Chain Reaction),简称PCR,是一种分子生物学技术,用于放大特定的DNA片段。可看作生物体外的特殊DNA复制。 1995年,美国科学家Mulis众望所归地获得了诺贝尔化学奖,他所取得的成就是发明了PCR技术。其中,PCR扩增仪是普通的PCR反应,反应后产物一般通过电泳查看结果。实时荧光PCR即real-time PCR,是在反应体系中加入目的基因的探针,PCR过程中,根据目标基因的表达量多少,探针可发荧光,RT-PCR仪通过检测荧光表达量来记录基因表达量,从而达到了同不定量检测基因表达量,不需要电泳辅助。实验室生物安全柜主要是在进行生物实验时,用以防止发生病原体或毒素无意中暴露及意外释放的设备。目前世界通用生物安全水平标准是由美国疾病控制中心(CDC)和美国国家卫生研究院(NIH)建立的。根据操作不同危险度等级微生物所需的实验室设计特点、建筑构造、防护设施、仪器、操作以及操作程序,实验室的生物安全水平可以分为基础实验室-一级生物安全水平、基础实验室-二级生物安全水平、防护实验室-三级生物安全水平和最高防护实验室-四级生物安全水平。二级生物安全柜是目前应用最为广泛的柜型。按照NSF49的中的规定,二级生物安全柜依照入口气流风速、排气方式和循环方式可分为4个级别:A1型,A2型(原B3型),B1型和B2型。所有的二级生物安全柜都可提供工作人员、环境和产品的保护。甲流肆虐的秋季到来,各大医院和检测实验室对这类型的仪器和设备应该会有较大的需求空间,有能力的仪器商家不妨多留意一下相关的招标公告,这也是一个不小的商机。 [color=#DC143C]**********广告内容,被版主屏蔽,请珍爱帐号,远离广告!*********[/color]
民以食为天,但随着社会发展,食品生产中以假乱真、以次充好的水平和手段却越来越高明,仿真度极高的伪劣产品给分析工作带来了巨大困难,使许多传统的鉴别方法失效,如何运用新型的技术手段来进行鉴定食品的真实性,已成为当下食品科技的研究前沿——食品组学。食品组学(Foodomics)将蛋白组学和代谢组学等组学的分析思路和方法,运用到食品分析和营养学分析范畴的一种研究方式,常用于鉴别食品的物种、产地和品质。通过本篇文章,我们一起了解一下广泛认可的质谱技术在食品组学分析中的应用。挂羊头,卖狗肉“挂羊头,卖狗肉”是日常用的一个熟语。自从2013年欧盟“马肉风波”之后,中国肉类掺假的现象也屡见报道,进一步加深了人们对肉类真实性的担忧。目前最常用检测的方法有:基于核酸的聚合酶链式反应技术([url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]),和基于抗体抗原结合的酶联免疫法(ELISA)。前者受DNA降解,复杂基质干扰和样品提取方法的影响,干扰了定性和定量的准确性。后者受制于抗体的制备,复杂的基质和同源干扰导致的假阳性的影响。随着生物质谱技术的成熟,大规模的定性和定量研究蛋白表达谱的技术已经成熟。我们通过超高分辨的 Thermo Scientific? Q Exactive? 质谱平台,研究了五种常见肉类。整个实验流程如下图:鉴定到各个物种相对于其他四种物种专属性的多肽条数为:鸡 339 条,鸭 125 条,猪 426 条,牛 337 条,羊 152 条。通过寻找不同种属肉类中的特征性多肽,并在不同样本中对该特征肽段进行监测,实现对肉类的掺假的分析。真假威士忌威士忌酒是一种常见的烈性酒。由于威士忌酒零售价格普遍较高,市面上充斥着大量伪劣商品。最普遍的一种方式是将威士忌酒的主要已知化学成分加入某种低价烈酒中,以“人造产品”冒充威士忌;另一种造假就是以次充好,夸大威士忌陈酿的年数。[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]-质谱联用技术([url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GC-MS[/color][/url])在威士忌酒表征分析中的广泛应用,非常有效地帮助实现酒中挥发性和半挥发性化学成分的鉴定。同时,利用 Thermo Scientific? Q Exactive? GC质谱仪出色的分析表现来对不同产地、年份、和类型的威士忌酒进行轮廓描绘分析。下图总结了达成这些目标所需的工作流程。“名贵”植物油大豆油、菜籽油、花生油、亚麻籽油等十余种不同种类常见食物植物油是目前我们常食用的油类。鉴于油酸与多不饱和脂肪酸(PUFA)亚油酸、亚麻酸广泛而具有差异的生物功能。利用 Thermo Scientific? Q Exactive? 高分辨质谱与相关信息处理软件产品,开展了基于脂质轮廓谱的食用植物油分类研究,可为名贵食用植物油的掺假打假、油脂的功能营养学研究提供新的思路。
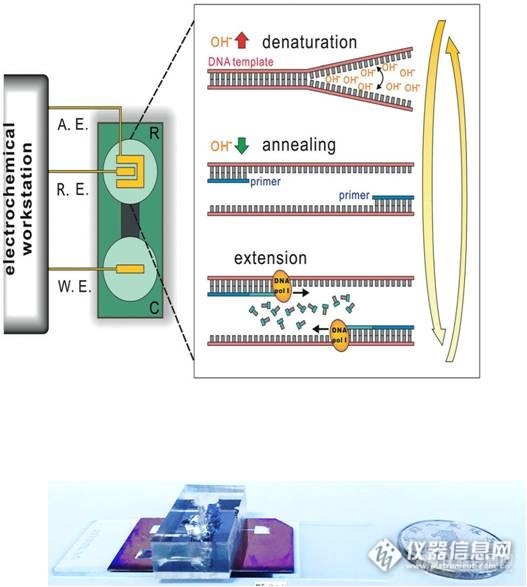
http://ng1.17img.cn/bbsfiles/images/2016/11/201611141442_616419_0_3.jpg 近日,中国科学院上海应用物理研究所与清华大学合作,发展了一种新型的离子介导聚合酶链式反应(Ion-Mediated Polymerase Chain Reaction, IM-PCR),通过精确调控溶液pH值(即质子和氢氧根离子),可以在室温下完成PCR扩增,相关结果发表于《德国应用化学》(Angew. Chem. Int. Ed.)杂志,并申请了美国和国际专利。 PCR是体外通过酶反应合成、高灵敏扩增目标基因片段的一种方法,是最常用的分子生物学技术之一。常规PCR是通过控制溶液温度来实现DNA分子的可逆变复性,从而达到复制扩增的目的。而这种升降温过程通常需要复杂的控温装置并消耗大量能源。从理论上来说,DNA变复性还可以通过酸碱变性来实现,然而如何在不改变溶液体积的情况下精确控制溶液pH值则是一个难题。上海应物所物理生物学研究室樊春海课题组与清华大学化学系刘冬生课题组合作,建立了一种基于微流控的电化学芯片,可以通过电压驱动快速、精确调控溶液pH值,并实现了对DNA分子机器的电驱动控制(Nano Lett. 2010,10,1393)。基于这一研究基础,上海应物所博士张一和副研究员李茜发现微流控电化学可以有效控制PCR反应体系的pH值,实现了室温下的酸碱驱动的IM-PCR扩增。与传统PCR技术相比,这一新型的集成化IM-PCR技术无需变温过程,所有反应步骤均在室温下进行。这一小型化、低成本、易于集成的PCR新技术有望在生物检测、临床诊断及环境监测中发挥作用。