目前国内哪个生产厂商生产的的细菌内毒素测定仪性能比较好,要求是凝胶法和光度法都能检测,大概什么价位啊?
细菌内毒素检测新手指南 鲎试剂 鲎试剂是从栖生于海洋的节肢动物“鲎”的蓝色血液中提取变形细胞溶解物,经低温冷冻干燥而成的生物试剂,专用于细菌内毒素与β-葡聚糖检测。 鲎试剂按原料来源分:全世界目前有4个种属的鲎,其中仅有东方鲎(Tachypleus tridentatus Leach) 和美洲鲎(Limulus polyphemus Linnaeus)可制造鲎试剂,对应生产出来的鲎试剂分别为东方鲎鲎试剂(Tachypleus Amebocyte Lysate, TAL)和美洲鲎鲎试剂(Limulus Amebocyte Lysate,LAL),TAL与LAL具有相同的功效。 鲎试剂按方法分: 凝胶法鲎试剂动态浊度法鲎试剂终点浊度法鲎试剂动态显色法鲎试剂终点显色法鲎试剂 凝胶法系通过鲎试剂与内毒素产生凝集反应的原理来定性检测或半定量内毒素的方法。凝胶法鲎试剂常见规格为0.1ml/支或0.5ml/支或者更大装量,使用时应加除热原水(细菌内毒素检查用水)复溶后使用。凝胶法是通过观察有无凝胶形成作为反应的终点。此法操作比较简单,经济,不需要专用测定设备,可以进行定性或半定量测定。 特异性鲎试剂,即弃G因子鲎试剂,是国内首创的产品, 它专一对内毒素起反应,避免了G因子旁路的干扰,使检测结果更加可靠,在药检和临床检验方面是不可或缺的理想检测试剂。 动态浊度法鲎试剂、终点浊度法鲎试剂、动态显色法鲎试剂、终点显色法鲎试剂,这四种方法都是定量检测内毒素的。 根据检测原理,终点浊度法和动态浊度法都属于浊度法。浊度法系利用检测鲎试剂与内毒素反应过程中的浊度变化而测定内毒素含量的方法。终点浊度法未见商品化产品。动态浊度法(又称动态比浊法)是检测反应混合物的浊度上升某一预先设定的吸光度所需要的反应时间,或是检测浊度增加速度的方法。 终点显色法和动态显色法都是属于显色基质法。显色基质法系利用鲎试剂与内毒素反应过程中产生的凝固酶使特定底物显色释放出的呈色团的多少而测定内毒素含量的方法,根据产物颜色判断内毒素浓度,又称为比色法。厦门鲎试剂厂于2005年推出以鲎四肽为显色底物的鲎试剂盒,抗干扰能力强, 灵敏度高达0.005EU/ml, 质量达到国际领先水平。目前已有500多家单位使用该试剂盒,并有部分单位发表相应文献。国内有少量国外产品,但价格远高于国产试剂,到货周期长。 如果您仅需要检测样品的内毒素限量,可以选择凝胶法鲎试剂,通过确定内毒素限值及最大有效稀释倍数,做样品的干扰试验从而确定使用的鲎试剂的灵敏度。如果您需要定量测定样品中内毒素含量则应选择显色基质鲎试剂盒或动态浊度法鲎试剂。 动态浊度法与动态显色法需要带温育系统的动态光度测定仪器及配套软件,例如,微板鲎试仪ELx808及软件TALgent 或Gen5。动态浊度法与动态显色法简单方便、一步即成,线性范围宽。 终点显色法需要配套酶标仪或可见分光光度计进行检测。配套带有温育系统的酶标仪,如微板鲎试仪ELx808,可减少试剂用量。 相关链接:厦门市鲎试剂实验厂有限公司于1983年成立,于2000年加资改组,是国内最大最早生产鲎试剂的厂家,本厂于1987年研制成功鼓浪屿牌鲎试剂(荣获1978-1979年度福建省重大科技成果二等奖,1983年卫生部甲级成果奖,1988年获卫生部科学技术进步三等奖),1988年获卫生部新试剂生产批件((88)卫药SJ-02号),1995年全国首家推出特异性鲎试剂,2005年又推出显色基质鲎试剂,2007年推出高效、自动、微量的鲎试仪ELX808(内毒素测定仪)及配套软件,2009年重磅推出透析专用鲎试剂盒。目前已有透析专用鲎试剂盒、显色基质鲎试剂、凝胶法鲎试剂、动态浊度法鲎试剂、特异性鲎试剂、内毒素、辅剂及鲎试仪ELX808、除热源耗材等一系列产品。
本法系利用鲎试剂来检测或量化由革兰氏阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。 细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。供试品检测时,可使用其中任何一种方法进行试验。当测定结果有争议时,除另有规定外,以凝胶法结果为准。 本试验操作过程应防止微生物和内毒素的污染。 细菌内毒素的量用内毒素单位(EU )表示,1EU 与1 个内毒素国际单位(IU )相当。 细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度和标定细菌内毒素工作标准品的效价。 细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于试验中的赏试剂灵敏度复核、干扰试验及各种阳性对照。 细菌内毒素检查用水系指内毒素含量小于0.O15EU/ml(用于凝胶法)或0.005EU / ml (用于光度侧定法)且对内毒素试验无干扰作用的灭菌注射用水。 试验所用的器皿需经处理,以去除可能存在的外源性内毒素。耐热器皿常用干热灭菌法(250℃ 、30 分钟以上 ) 去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。若使用塑料器械,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器械。
想和大家交流一下,测定细菌内毒素的时候是否需要在洁净环境下呢?实际操作是怎样的呢?我们目前在普通环境下测定的。[em44]
1968年美国科学家Dr. Levin和Bang建立了鲎试验法。此后世界各国对鲎试剂的生产和应用得以迅速发展。1980年美国药典20版首先收载了细菌内毒素检 查法。随后,英国药典、日本药局方、中国药典等也相继收载了该方法。本文主要对中国药典1995年版与英国药典1995年增补本、美国药典23版和日本药局方13版等的细菌内毒素检查法进行了比较。1 检验品种的比较中国药典1995年版二部共收载细菌内毒素检查品种12个,2000年版二部增至47个,而美国药典23版收载了471个品种进行细菌内毒素检查。因此,我们需加紧对更多的品种进行细菌内毒素检查方法的研究,加快该法对药品检验的普及和推广工作,提高我国药品标准和检验水平。2 检验方法的比较细菌内毒素试验的方法有凝胶法、浊度法、显色基质法、免疫学法等。其中凝胶法多为限量 检查法,浊度法和显色基质法为定量检查法,且后两种方法都属于分光光度法。浊度法还可 分为终点浊度法和动态浊度法;显色基质法也可分为终点显色基质法和动态显色基质法。凝胶法是较为经典的方法,各国药典都有收载,而收载了细菌内毒素定量测定法的有美国药典、英国药典、欧洲药典和日本药局方等。中国药典1995年版只收载了凝胶法,2000年版才涉及到定量测定法。因此,我们还需要对细菌内毒素定量测定进行研究,需要有供定量测定 用的标准品、仪器和试剂,以后逐步建立起我国的细菌内毒素定量测定方法。3 细菌内毒素标准品各国药典均设置了细菌内毒素的标准品,其中中国药典、英国药典和美国药典还可采用根据标准品为基准进行标定的工作标准品或对照标准品。除英国药典采用U为内毒素的单位外,其余各国药典都用EU为内毒素的单位。美国药典和中国药典对内毒素标准品每一步稀释时的混匀时间作出了明确规定。除中国药典外,其余各国药典规定了内毒素标准贮备液在冰箱里保存不得超过14d,且用前应在旋涡混 合器上充分混合至少3min。
[center]鲎法测定细菌内毒素影响因素的研究进展[/center] 鲎试剂法是利用鲎血细胞溶解物与微量(pg/ml级)细菌(主要是革兰氏阴性细菌,G-)的内毒素反应,从而检出被检物中内毒素的一种生物体外检测新技术。因为其具有快速、简便、经济、灵敏度高、重现性好、一次可同时测几个样品等优点,自从一九六四年美国学者Levin 和 Bang发现此法以来[1],鲎法正被日益广泛地应用于医药卫生、食品卫生、环境卫生、分子生物学、以及微生物学中。 鲎法大致可分为凝胶法、比浊法色原基质法、以及免疫法等。本文依据文献报道,总结了近年来国内外学者在用这些方法测定细菌内毒素时发现的一些影响因素及其消除方法的研究进展,以供试验者参考。 [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=153149]鲎法测定细菌内毒素影响因素的研究进展[/url]
细菌内毒素的概念 细菌内毒素,英文称作Endotoxin,是G-菌细胞壁个层上的特有结构,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。内毒素的主要化学成分为脂多糖中的类脂A 细菌内毒素这个概念在1890年的时候就已被提了出来,它是在研究发热物质过程所引成的,1933年Boivin最先由小鼠伤寒杆菌提取出来,进行化学免疫学方面的研究,到1940年时候,Morgan使用志贺氏痢疾菌阐明了细菌内毒素是由多糖脂质及蛋白质三部分所组成的复合体,到了1950年以后,随着生物学,物理化学,免疫学以及遗传学等的进步发展,细菌内毒素的研究工作,尤其是其化学结构组成及各种生物活性间的关系也更加明确起来。 细菌英文叫Bacteria:为原核生物中的一类单细胞微生物由二分裂法繁殖。若按革兰氏染色法可将细菌分为G+菌和G-菌两大类。这两类细菌细胞壁的结构和化学组成存在很大差异。唯有肽聚糖为其共同成分,但其含量的多少和肽链的性质有所不同,见下表:细胞壁结构革蓝氏阳性菌革蓝氏阴性菌厚度厚,15—50薄,10—15肽聚糖含量多,占胞壁干重50—80%少,占胞壁干重10%左右脂类含量少,约1—4%多,约11—22%磷壁酸有无外膜无有脂蛋白无有脂多糖无有 细胞壁较薄,厚约10-15nm,结构也较复杂。肽聚糖含量低,仅占细胞干生10%左右,层薄又较疏松,因肽聚糖之间仅四肽侧链直接联结,缺乏五肽桥;肽聚糖居于细胞最内层,外面由内向外还有脂蛋白,外膜和脂多糖的三层聚合物。 (1)脂蛋白(lipoprotein) 由类脂和蛋白质构成,联结在外膜与肽聚糖层之间,类脂一端经非共价键联结到外膜的磷脂上,另一端由共价键联结到肽聚糖肽链中的二氧基庚二酸 残基上,使外膜和肽聚糖层构成一个整体。 (2)外膜(outer membrane) 是革兰氏阴性菌细胞壁的重要结构,位于肽聚糖的外侧,其结构类似细胞膜,为液态的磷脂双层,其中镶嵌一些特异蛋白质,穿透外膜的内外双层,呈液态镶嵌体。外膜中间有微小孔道,容许水溶性的小分子通过,以进行细胞内外的物质运输和交换。除此之外,外膜还能防止胰蛋白酶和溶菌酶等进入,起到保护性屏障作用。(3)脂多糖(lipopolysaccharide,LPS) 由多糖O抗原、核心多糖和类脂A(lipid A)组成(图1-8),位于最外层。多糖O抗原向外,由若干个低聚糖的重复单位组成的多糖链,即革兰氏阴性菌的菌体抗原(O抗原),有特异性。核心多糖由庚糖、半乳糖、2-酮基-3-脱氧辛酸(2-keto-3-deoxyoctonic acid, KDO)等组成,所有革兰氏阴性细菌都有此结构。类脂A是以脂化的葡萄胺二糖为单位,通过焦磷酸酯键组成的一种独特的糖脂化合物,具有致热作用,是革兰氏阴性细菌内毒素的毒性成分。 细菌内毒素即:许多病原性细菌所产生的毒素。 一般细菌毒素可分为两类,一类为外毒素(Exotoxin);它是一种毒性蛋白质,是细菌在生长过程中分泌到菌体外的毒性物质。产生外毒素的细菌主要是革兰氏阳性菌。如白喉杆菌、破伤风杆菌、肉毒杆菌、金黄色葡萄球菌以及少数革兰氏阴性菌。另一类为内毒素(Endotoxin)。是革兰氏阴性菌的细胞壁外壁层上的特有结构。细菌在生活状态时不释放出来,只有当细菌死亡自溶或粘附在其它细胞时,才表现其毒性,内毒素的主要化学成分是脂多糖中的类脂A成分。
细菌内毒素1 设备:电冰箱、恒温水浴箱、超净工作台、旋涡混合器、计时器2 用具:剪刀、镊子、无热原空安瓿5mg/支、浮板、封口膜、精密[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url][/color][/url](50ml-250ml、250ml-1000ml)、吸头(50ml-250ml、250ml-1000ml)、PH试纸3 试剂3.1 细菌内毒素工作标准品:用于仲裁鲎试剂的灵敏度和各种阳性对照。3.2 鲎试剂:为冻干品制剂,灵敏度为0.25EU/ ml,规格为:0.1ml/支3.3 细菌内毒素检查用水:内毒素含量不超过0.03EU/ml注射用水。(BET水)3.4 0.1mol/L HCl溶液、0.1mol/L NaOH溶液(临用时用细菌内毒素检查用水配制)。3.5 清洁液:75%酒精4 操作步骤4.1 鲎试剂灵敏度复核试验:鲎试剂灵敏度定义为在本检查法规定的条件下能检测出内毒素标准溶液或供试品溶液中的最低内毒素浓度,用EU/ml表示。4.2 根据鲎试剂灵敏度的标示值(λ),将细菌内毒素工作标准品用细菌内毒素检查用水溶解,在旋涡混合器上混匀15分钟,然后制成2.0λ、1.0λ、0.5λ或0.25λ四个浓度为内毒素标准溶液,每稀释一步均应在旋涡混合器上混匀30秒钟,按检查法项下试验,每一浓度平行做4支,同时用细菌内毒素检查用水做2支阴性对照,如最大浓度2.0λ管均为阳性,最低浓度0.25λ管均为阴性,阴性对照管均为阳性,按下式计算,反应终点浓度的几何平均值,即为鲎试剂灵敏度的测定值(λc)。λc=lg-1(∑x/4)当λc在0.5λ-2.0λ(包括0.5λ-2.0λ)时,方可用于细菌内毒素检查,并以λ为该批鲎试剂的灵敏度。5 干扰试验5.1 用细菌内毒素检查用水和未检出内毒素的供试品溶液或其不超过最大有效稀释倍数的稀释液分别将同一支细菌内毒素工作标准品制成含细菌内毒素工作标准品2.0λ、1.0λ、0.5λ、0.25λ四种浓度的内毒素溶液。用细菌内毒素检查用水和供试品溶液制成每一浓度平行做4支,另取细菌内毒素养检查用水和供试品溶液各做2支阴性对照管。如果最大浓度2.0λ管均为阳性,最低浓度0.25λ管均为阴性,阴性对照管均为阴性时,按下式计算,用细菌内毒素检查用水制成的内毒素标准溶液的反应终点浓度的几何平均值(Es)和用供试品溶液或其稀释液制成的内毒素溶液的反应终点浓度的几何平均值(Et)。Es=lg-1(∑xs/4)Et=lg-1(∑xt/4)当Es在0.5 λ-2.0λ,且当Et在0.5Es和2.0Es时,则认为供试品在该浓度下I 干扰试验。6 检查法6.1 精密称取土霉素检品适量,加0.1mol/L HCl溶液适量溶解,加0.1mol/L NaOH溶液适量,调节PH在6.5-7.5之间,加BET水稀释至一定浓度,备用。6.2 取装量为0.1mol/L的鲎试剂5支,备用。6.3 NC管的制备:取0.2ml BET水加入一支鲎试剂中,摇匀。6.4 PC管的制备:取0.1ml BET水溶解一支鲎试剂,加0.1ml用BET水稀释的含2λ的内毒素工作标准品的溶液,摇匀。6.5 PPC管的制备:取0.1ml BET水溶解鲎试剂,加0.1ml的用供试品的稀释液稀释的含2λ内毒素工作标准品,摇匀。6.6 供试品管的制备:取0.1ml BET水溶解鲎试剂,加0.1ml的供试品稀释液,摇匀。6.7 以上各管按顺序排列,置浮板上,放置37±1℃的恒温水浴箱中,保温1小时±2分钟。7 结果判断:将试管从恒温器中轻轻取出,缓缓倒转180°时,管内凝胶不变形,不从管壁滑脱者为阳性(+)。凝胶从管壁滑脱者并不能保持完整者为阴性(-),供试品管2支均为阴性(-)。应认为符合规定;如2支为阳性(+),应认为不符合规定。如2支中1支为正(+),1支为负(-),按上述方法另取4支供试品管复试。4支中1支为(+),即认为不符合规定。阳性对照品为(-)或供试品阳性对照品管为(-),或供试品阴性对照品为(+),试验无效。[em62]
介绍一下背景信息:鲎试剂相对价格比较高,我们测定细菌内毒素时,标准曲线不是每次都做的,(当然,规定是应该做的),只是更换鲎试剂批号和产品变更时做曲线。因为产品测定的细菌内毒素离限值相差很多个数量级,所以也就一直没做,但是还是觉得不太稳妥。大家平时都做曲线吗?每次做?每天做?还是定期做?
作为冻干类的注射剂产品原辅料得增加细菌内毒素项目检测,国家要求的接着问题来了,一些不能溶于水的原辅料,用什么溶液溶解?可以用氢氧化钠溶液或者其他溶液溶解,但是怎么保证溶液中无细菌内毒素,或者用计量先确定有多少细菌内毒素,然后再标定?希望大神们给个解决方法,可行的。
USP里面的一句话,是细菌内毒素的:Bacterial endotoxins 85 — It contains not more than 25 USP Endotoxin Units per mL of Injection细菌内毒素85-每ml注射液含细菌内毒素不得过25 USP Endotoxin Units.上面的英文是不是25EU/ml?细菌内毒素不太懂,美国药典和中国药典是否有差距,谢谢![em61]
产品的细菌内毒素不大于20EU/件,灵敏度:0.25EU/ml,细菌内毒素供试品浓度怎么计算?
本文是USP24细菌内毒素检查法(BACTERLAL ENDOTOXINS TEST)的译文,但目前执行的标准是USP24版第二增补本(USP—NF19 Second Supplement)的细菌内毒素检查法,读者可对照学习,从中可看出USP24细菌内毒素检查的不足之处。本文将介绍用鲎试剂检测样品内或样品上存在的细菌内毒素浓度的方法。鲎试剂(Limulus Amebocyte,LAL)来自鲎的循环细胞,经水提取而行,制备和检验后,用于凝固法。反应的终点是将供检样品稀释后,与平行稀释的参考内毒素标准进行直接比较得到的。测得的内毒素含量用规定的内毒素单位表示。鲎试剂也是用浊度法或显色法来读取数据的,这些试齐只要能满足这些选择方法的要求,就可以使用。在做试验时,需要先做出一条标准曲线,并用该曲线计算供检样品的内毒素含量,包括样品和对照液加鲎试剂后的培育时间和在分光光度计上读取光密度时使用的波长等操作,都应该事先规定好。如果是终点浊度法,则到达培育期后,应立刻读取读数。而动力学检测(凶手浊度法和显色法),光密度的测定是贯穿于整个反应期间,而用于计算结果的百分数就是从这些读数中计算出来的。在用终点法的显色法检测时,在到达事先规定的反应时间后,添加停止酶反应的试剂使反应停止后,再读取数据。1、参考内毒素标准与对照内毒素标准参考内毒素标准(Reference standard endotoxin,RSE)是美国药典(USP)的内毒素参考标准,其效价为每瓶10 000个USP内毒素单位(EU)。每瓶参考内毒素标准加5ml鲎试剂用水(LAL Reagent Watet),用旋转搅拌器间歇搅拌30min使其溶解,制成原液,用这一原液制作合适的系列稀释。原液应保存于冰箱中,用于以后的稀释,但保存时间不得超过14d。用前,用旋转搅拌器强力搅拌至少3min,每一步稀释,至少搅拌30s,然后才能用它稀释下一步。经稀释的参考内毒素不得贮存待以后使用,因为吸附作用会使其失去活性。对照内毒素标准(Contuol standard endotoxin,CSE)是以参考内毒素标准为标准另行制备的。一批新的对照内毒素标准在使用前应进行检定。检定时使用的鲎试剂应为试验中使用的同批鲎试剂。参考内毒素标准对照内毒素标准进行检定时,可使用鲎试剂的凝固法,按“试验操作”进行。每批对照内毒素标准,至少取1瓶与1瓶参考内毒素标准进行对比。参考内毒素标准的每个稀释度作4管。每瓶或每个样品的对照内毒素标准的每个稀释度也都要4管。参考内毒素标准终点的对数Log10的平均值和对照内毒素标准终点的对数Log10平均值之间的差值的反对数等于对照内毒素标准效价的标定值。可根据情况,将其变换成每ng干燥制剂的单位数或每瓶所含的单位数。适宜的对照内毒素标准的效价应不小于2EU/ng也不大于50EU/ng。2、试验的准备鲎试剂的灵敏度应经过确证。试验中使用的所有容器和用具,都必须在≥250℃的烤箱中,用足够的时间进行加热处理、破坏这些用具表面上可能存在的外源性内毒素。内毒素试验的结果是否可靠,还必须从试验使用的各种用具、溶液、洗涤用品中取样或提取样品,并用适当的方法证明它们对反应没有抑制或拉强或其它干扰作用。可按下述方法进行抑制试验或增强试验。试验中应设置阴性对照。如果鲎试剂的原材料、生产方法或处方发生改变时都要重新进行试验。3、鲎试剂灵敏度的确认试验为了确认鲎试剂标签上的灵敏度,每批至少取1瓶样品进行检定。参考内毒素标准(或对照内毒素标准)作2倍系列稀释,稀释成2.0λ,1.0λ,0.5λ和0.25λ。其中λ是鲎试剂标签上的灵敏度EU/ml。上述4个稀释度和阴性对照都要重复做4管。所得结果的几何平均值的对数应大于或等于0.5λ,小于或等于2.0λ。每一批新的鲎试剂,使用前都必须作标签灵敏度的确认试验。4、抑制试验和增强试验用不超过地大有效稀释而检测不出内毒素的样品,不加或内毒素,使最后浓度等于2.0λ,1.0λ,0.5λ和0.25λ。按照试验操作(Test Procedure)项的规定用标准内毒素进行检定。不加和加内毒素的样品管至少做4管。同时,用水稀释上述相同浓度的内毒素和阴性对照各两管,做平行两管试验。按照计算和判定项的方法,计算样品终点内毒素浓度的几何平均值。如果所得结果大于或等于0.5λ,小于或等于2.0λ,则该样品适合作细菌内毒素检查。用中和、灭活或除去干扰物质方法或用不超过最大有效稀释度稀释检品后,可重做抑制试验和增强试验。如果用不超过最大有效稀释法,对已知加量的内毒素可以克服抑制和增强作用。则样品可以经过稀释后,再作内毒素检查。如果在试验条件下,对未处理的样品检查出有内源性内毒素。则该样品不适合用于作抑制或拉强试验。不过,这种样品可用超过滤法将存在的内毒素去掉或做适当稀释、使之适合于作抑制或增强试验。稀释未处理样品(像开瓶溶解或在使用前注射前稀释那样),稀释到检验不到内毒素但不超过最大有效稀释倍数。再用这些已稀释的样品重作抑制试验或增强试验。5、最大有效稀释度(MVD) 最大有效稀释度是指在使用时将药物溶解或稀释成恰好用于注射或其它非经口途径使用的浓度。有时为了避免给药量的体积(EU/ml)计算。用试剂标签上的灵敏度(EU/ml)λ除限定浓度,就可以得到MVD因子。如果某一试剂的限量浓度是按重量或按药品的活性单位
摘要:本文对细菌内毒素检查方法的建立、限值的确定、方法学验证及常见问题进行了介绍。关键词:细菌内毒素检查、方法、验证细菌内毒素检查法作为控制药品质量的一种有效方法,已经广泛的被世界各国药典收载。经过30多年的不断改进,无论是凝胶法还是光度法均比较成熟和完善。但是,在为新化合物或新药建立细菌内毒素检查方法时,常常会遇到各种各样的困难,尤其是尚处于新药研发早期阶段的药物,由于药物制剂、赋形剂等还不稳定,经常会发生变化,这样就给方法的建立带来不同程度的影响。在建立细菌内毒素检查法之前,应尽可能多的收集有关该药品的基本信息,例如:有关样品的溶解性信息,推荐的稀释液,在水中的溶解度,以及最适溶剂;样品的pH范围;分子量大小;产品规格、体积或重量;拟用于临床的用法和用量等等。以便选择合适的样品处理方法和内毒素检查方法,对于早期研发阶段的药物,应选择合适的赋形剂,以有利于细菌内毒素检查中对样品的稀释处理。此外,在确定内毒素限值时还应尽可能采用最大人拟用剂量,为临床安全性和有效性研究中增加剂量留出空间。
热原和细菌内毒素 一、热原(progon) 医院临床在使用药品注射剂时,常有发生冷感、寒战、发热、头痛、恶心、呕吐、肤色灰白、休克、严重时导致死亡,这种症状称为热原反应。 为提高药品质量和用药安全,人们对热原进行了广泛的研究,直到1923年Seibert提出了用家兔检测热原的方法。在1942年美国药典首先将家兔热原检查项收入药典成为法定方法,中国药典1953年版开始收载该方法,随后的世界各国药典都以动物热原检查法作为药品质量监测的方法之一。 家兔热原检查法的优点,可在规定时间里观察到家兔的体温变化,相应反应了热原质引起哺乳类动物复杂的体温反应过程。所以,在半个多世纪以来热原检查法,为保障药品质量和用药安全发挥了重要作用。 但随着制药工业的发展和临床用药的要求,该方法的局限性越来越明显。这种热原检查法,只局限于某种药物进入体内(血循环)是否能引起体温变化或热原反应作为判断药品是否污染热原的方法,已不能满足医药工业发展的需要。其缺点: ①标准化程度低,无法判断检查样品中存在的热原质到底是什么或是哪一种物质。 ②由于试验动物家兔是处在被细菌污染的环境中,通过吸入或皮肤感染细菌内毒素而被免疫,导致动物的个体差异较大。 ③试验动物受到药品的药理活性干扰,而影响体温变化(如放射性药品、抗生素、生物制品等),实验结果难以判断。 ④设备及实验费用昂贵(如建设动物房、水电、动物饲料等耗费),做一种药品需要几百元/次,而鲎试剂仅几十元/次。 综上情况分析,鲎试验法可避免以上动物热原检查法的不足,该技术的成功和应用真可谓是药品质量监控一场大革命。 什么是热原?目前国内外仍未有统一的认识,但从国内外文献报道中,一个共同的意见,都普遍认为:它是指细菌内毒素的脂多糖。 欧洲药典委员会副主席J.Van Noordwijk提出:“严格地讲,不是每一种热原都具有脂多糖的结构,但所有已知的细菌内毒素脂多糖都有热原活性”。在药品生产质量管理规范(GMP)条件下,药品生产的质量控制一般可以接受的观点是:不存在细菌内毒素意味着不存在热原。 二、细菌内毒素(Endotoxin) 细菌内毒素是革兰氏阴性菌细胞壁上的一种脂多糖(Lipoply Saccharide)和微量蛋白(Protein)的复合物,它的特殊性不是细菌或细菌的代谢产物,而是细菌死亡或解体后才释放出来的一种具有内毒素生物活性的物质。其化学成分广泛分布于革兰氏阴性菌(如大肠杆菌、布氏杆菌、伤寒杆菌、变形杆菌、沙门氏菌等)及其它微生物(如衣原体、立克次氏体、螺旋体等)的细胞壁层的脂多糖,其化学成份主要是由O-特异性链、核心多糖、类脂A三部分组成。(附图1) 、O—特异性链:位于脂多糖分子最外层的多糖链,是由3—5个单糖(一般不多于25个)连成为一个多糖链。其单糖包括戊糖、氨基戊糖、已糖、氨基已糖、脱氧已糖等,单糖的种类、位置和排列顺序和空间构型,因菌种不同而异。因此,它决定菌体热原的特异性。 核心多糖:核心多糖的变异性较小,位于类脂A和0—特异性链(内层)之间,在结构上分为内核心和外核心。外核心含有数种己糖,包括葡萄糖、半乳糖、乙酰氨基葡萄糖等组成。内核心含有庚糖及特殊的酮糖(3-脱氧-D-甘露糖-辛酮糖KDO)。这部分结构对不同菌株的LPS基本相似,而且KDO是以不耐酸的酮糖链与类脂A的氨基葡萄糖连接,是构成内毒素脂多糖的核心部分。 类脂A:位于LPS分子结构的外层,是由氨基葡萄糖、磷酸和脂肪酸(10—18C)组成,故称之为糖磷脂,也是细菌外膜的一种,形成单体聚合物。具有疏水性(强)和亲水性(弱)的双相性。但是,类脂A可从O-特异链及核心多糖分离出来,游离的类脂A可自身凝聚成大分子的复合体而难溶于水,并具有生物活性。所以,类脂A(Lipida)是内毒素多种生物活性或毒性反应的主要基团。该基团没有种属特异性,所以各属细菌的类脂A结构相似,其毒性反应相似。如发热、血液流动力学改变、弥漫性血管内凝血,并导致休克等。 由于类脂A有4条主链和2条支链的脂肪酸与内酰胺连接组成,所以提纯的内毒素LPS是极为不稳定的。这就要求内毒素应在低温条件下保存,在工作中内毒素稀释应尽可能地缩短时间,并要现配现用。 三、内毒素的生物活性与疾病的相关性 据文献报道,在很早期(约19世纪末)的意大利学者Centanne通过菌属自溶的方法,从革兰氏阴性杆菌中提取出一种类似毒素的物质,因为这种物质对动物体产生致热活性的同时,亦产生出一种病理学病性反应,而被命名为致热毒素(Pyrotoxina)。同时由德国的Buchner也从多种细菌中提取到相似的致热毒素,并证实了这种毒素在导致白细胞数目的改变同时,具有增强机体对细菌感染时的免疫能力。因此建立了“发热疗法”。 在美国纽约的临床医师,William B• Coley用加热法杀死录杆菌和化脓性链球菌,将上清滤液用于各种恶性肿瘤(特别是肉瘤)的治疗,取得较好的疗效。他将这种细菌上清液命名为Coley氏毒素。此后murrayJ.Shear 证实Coley氏毒素中具有抗肿瘤作用的物质为内毒素。 直到1933年Boivin等学者在研究鼠伤寒杆菌的致病机理时,从鼠伤寒杆菌中提取出内毒素。在50年代以后,对内毒素的化学成分和化学结构的研究得到迅速发展。经过大量实验表明,内毒素具有极强的生物学活性,特别是革兰氏阴性菌感染和静脉注射提取的内毒素溶液时,可导致动物体发生内毒素休克和死亡。 内毒素的致病机理,主要是由于革兰氏阴性杆菌(如大肠杆菌、沙门氏杆菌、伤寒杆菌,布氏杆菌、变形杆菌金黄色葡萄球菌等)和其它微生物(病毒、立克次氏体、衣原体螺旋体等)感染时,这类菌属随病灶渗液进入血液循环,并扩散到各种组织器官和体液细胞内繁殖,这类菌属在体内死亡和解体后,才稀放出大量的细菌内毒素脂多糖(LPS),据初步实验表明,当机体内毒素浓度國值 0.005ng/ml时,可诱生内源性热原质如肿瘤坏死因子、白细胞介素和β2—干扰素等。这些因子刺激体温调节中枢导致机体发热,细菌内毒素直接或间接作用于肝脏和胰腺时,可使肝细胞损伤,使糖原异生酶(如葡萄糖—6—6磷酸酶、糖原合成酶)的活性降低,抑制糖原的异生和分解。同时内毒素作用于胰腺导致胰腺功能障碍,并形成胰岛素抵抗,造成血糖升高致使并发心肌炎和心肌肿大的系列高血糖症状。所以,革兰氏阴性菌属感染或在病灶中的细菌进入体液细胞繁殖,当其死亡或解体后产生的内毒素,可多次进入血液,引起反复发作,其病理变化极为广泛,几乎所有的器官和组织都可被侵犯,而引起各器官的功能障碍。其中以网状内皮系统最常见,淋巴、脾、肝、肾、骨髓中均有上皮细胞增生,形成肉芽肿,以肝脏有肉芽肿外,还可发生冲血、水肿和肝细胞坏死,最终导致肝硬化的发生。其它器官亦有相似的毒性反应。
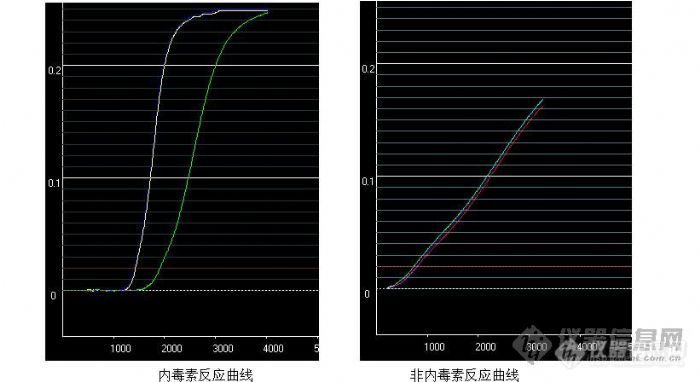
[center]非细菌内毒素反应曲线的发现[/center]鲎试剂的特异性系指在药品、生物制品和血液制品中鲎试剂能准确测出被测物质内毒素的能力,既不能造成样品内毒素的漏检,也不能将其它物质错判为内毒素。目前我公司研究证明,已知能与鲎试剂发生反应的物质有细菌内毒素和β-葡聚糖。中国药品生物制品检定所夏振民报道除(1-3)-β-葡聚糖外,(1-4)、(1-6)-β-葡聚糖同样使鲎试验产生阳性结果,这些物质的总称为真菌多糖,普遍存在于真菌细胞壁。如果这类物质具有像内毒素一样的致热活性,细菌内毒素检查和热原检查结果的符合率会接近一致,但是真菌多糖不是一种致热物质。这将导致在使用普通鲎试剂检测这些样品时,出现细菌内毒素检查不合格,热原检查合格的现象,造成对这些物质热原检查的错判(假阳性),将其它物质错判为内毒素,造成企业直接经济损失。判断假阳性的方法: 1、特异性鲎试剂法。特异性鲎试剂经特殊的工艺改造,只与细菌内毒素发生凝胶反应,阻断了β-葡聚糖生成凝胶的反应,避免假阳性的形成。本公司的鲎试剂特异性好,对药品中超量的细菌内毒素分辨率为100%,只与细菌内毒素发生凝胶反应,不与β-葡聚糖生成凝胶反应,避免假阳性的形成,避免将合格药品判为不合格而造成企业的经济损失;同时可避免因样品内毒素的漏检,造成临床用药的不良反应,保证患者用药安全。 2、定量反应曲线分析法。细菌内毒素、β-葡聚糖样物质与定量鲎试剂反应的区别:定量鲎试剂与细菌内毒素反应曲线为规则S型特征曲线,β-葡聚糖样物质与定量鲎试剂反应曲线为经过0点的斜线或不规则曲线;定量鲎试剂与细菌内毒素为变速反应,反应速度先慢然后变快最后又变慢,β-葡聚糖样物质与定量鲎试剂反应基本是恒速。通过观察定量反应的反应曲线及反应速度可以区分细菌内毒素和β-葡聚糖样物质。[img]http://ng1.17img.cn/bbsfiles/images/2009/06/200906011408_153048_1626679_3.jpg[/img]该反应曲线能直观的判断内毒素反应类型
细菌内毒素及溶液有毒性或污染吗,用灭菌处理吗?以及细菌内毒素检查用试管、针头、移液管等,如何处理?
热原检查法和细菌内毒素检查药典附录并没有统一的给药剂量和标准限度,均在各品种项下具体规定,故是否能有效地保证临床用药的安全性,其标准限值是我们在制订质量标准时首先要关注的。 对于内毒素限值的确定,药典附录有相应计算公式,即当今世界各国普遍采用的细菌内毒素计算公式,即:L=K/M,式中K为按规定给药途径,人每公斤体重每小时可以接受的不产生任何不良反应的细菌内毒素剂量(亦称致热阈),它基本上是一固定值,药典上对每一给药途径的K值都有具体的规定。M为按规定的给药途径,人每公斤体重每小时给药的最大剂量。这一个值的确定实际上才是计算限值的关键。 原则上一般根据药品使用说明书来确定最大剂量。通常以一次剂量为准,如注明输2小时,则除以2,否则均以1小时为准;不足1小时的,也以1小时计;如未给出一次剂量,而是一日剂量,如一日2~4g,分2~4次用,这种情况以计算后的最大剂量,即2 g/次计算。用法用量中有成人剂量、儿童剂量、重症剂量时,要体现出最大剂量。通常儿童剂量以Kg计算时大于成人剂量,所以,此时应用儿童剂量,因为儿童与重症病人更易出现问题,故应更严格。用于感染、肿瘤、心血管、中枢疾患易感的药物建议加上安全系数。复方、输液、工艺易污染者从严,大输液一般计为0.5EU/ml。 有时候,细菌内毒素限值也以国外药典为参考,甚至就直接采用国外药典的限值。这一点在实际应用的时候,必须从中国的临床用药的实际出发,不能不加区分地把同品种中国外药典规定的限值移至中国药典,总的原则是,对这一类国外药典已建立细菌内毒素检查法的品种,原则上要求将国外药典规定的限值与按公式计算出的数值进行比较,一般应以严格者为该品种的限值。另外以热原剂量作参考的问题,现在原则上已不再考虑热原的剂量。但大容量输液细菌内毒素限值为0.5EU/ml,主要是由热原试验中以10ml/kg iv家兔剂量得出的。 细菌内毒素的限值确定后,需要关注的第二个方面就是细菌内毒素方法学研究问题。在申报资料中,无论是仿制药还是创新药,申请人一般均会提供有关物质、溶出度、含量测定等主要检测项目的方法学研究资料,而对于细菌内毒素检查,给予的关注似乎要少得多,而申报资料中提供了这方面资料的也少之又少。实际上,处方工艺的改变对检测方法所带来的影响,对有关物质、溶出度、含量测定等项目的影响绝对不会比对细菌内毒素检查法带来的影响大,因为,细菌内毒素检查法实际是一种较为特殊的检查方法,中国药典2005年版对什么时候该进行细菌内毒素的干扰试验进行了相关规定【1】: 当进行新药的细菌内毒素检查试验前,或无细菌内毒素检查项的品种建立内毒素检查法时,须进行干扰试验。 当鲎试剂、供试品的配方、生产工艺改变或试验环境中发生了任何有可能影响试验结果的变化时,须重新进行干扰试验。 所谓干扰试验,换句话说就是方法的可行性试验。从药典对它的要求可以看出,不论是新药,还是已有国家标准的仿制药,只要须控制细菌内毒素的,有这样一项检查项的,均应在质量研究中对其方法的可行性进行验证。在以往工作中遇到的一个实例可以对其进行说明,我们曾经对硫酸头孢匹罗这个品种进行标准复核,结果发现不同厂家的硫酸头孢匹罗,几乎相同的含量、相同的工艺,对其细菌内毒素检查所产生的干扰情况却存在较大的差别,通过进一步的试验研究,结果发现造成这种结果最大的可能是由于生产过程中引入的微量杂质的不同所引起的。这个例子进一步说明了在申报资料中提供细菌内毒素方法学研究资料的必要性。 进行内毒素干扰试验时,首先要确定限值,然后采用至少两个厂家的鲎试剂进行干扰预试验,得到一最大不干扰浓度或最小稀释倍数后,即可用这一最大不干扰浓度进行正式的干扰试验。预试验一般不要以市售鲎试剂灵敏度计算所得的MVD作为起始浓度来做。注射液建议以原液来做,粉针剂建议至少往上几个浓度级来做,探索其干扰程度,如没有干扰,方法则更可靠。
细菌内毒素检查法应用与论坛[R].2005,4(1):9,做细菌内毒素检测,想参考一下,谁有这篇文章啊?
细菌内毒素标准品溶液的制备,在美国药典中是“根据包装说明书上的标准和内毒素储备标准溶液的标签上关于制备和贮存的说明”进行储备液的制备,再由“充分混合内毒素储备标准溶液后,用细菌内毒素试验检查用水(BET检查用水)稀释,制成适当的系列稀释液,即得BET检查用内毒素标准溶液。”这具体是一个怎样的制备过程?而在中国药典中,标准品溶液的制备,按照说明书上步骤加内毒素检查用水后在漩涡混合器上进行15min的混合。但是,我公司所购买内毒素工作标准品说明书上提到的是进行5min的混合。这两个时间如何取舍。如果按中国药典上进行15min的混合,时间会不会过长,如此会不会对标准品有所影响?
[b][color=#333333][font=宋体]摘要:本文对细菌内毒素检查方法的建立、限值的确定、方法学验证及常见问题进行了介绍。[/font][/color][color=#333333][font=Arial] W!6&T [j [/font][/color][color=#333333][font=Arial] [/font][/color][color=#333333][font=宋体]关键词:细菌内毒素检查、方法、验证[/font][/color][color=#333333][font=Arial] !'#Y-"=ypk [/font][/color][color=#333333][font=Arial] [/font][/color][color=#333333][font=宋体]细菌内毒素检查法作为控制药品质量的一种有效方法,已经广泛的被世界各国药典收载。经过[/font][/color][color=#333333][font=Arial]30[/font][/color][color=#333333][font=宋体]多年的不断改进,无论是凝胶法还是光度法均比较成熟和完善。但是,在为新化合物或新药建立细菌内毒素检查方法时,常常会遇到各种各样的困难,尤其是尚处于新药研发早期阶段的药物,由于药物制剂、赋形剂等还不稳定,经常会发生变化,这样就给方法的建立带来不同程度的影响。在建立细菌内毒素检查法之前,应尽可能多的收集有关该药品的基本信息,例如:有关样品的溶解性信息,推荐的稀释液,在水中的溶解度,以及最适溶剂;样品的[/font][/color][color=#333333][font=Arial]pH[/font][/color][color=#333333][font=宋体]范围;分子量大小;产品规格、体积或重量;拟用于临床的用法和用量等等。以便选择合适的样品处理方法和内毒素检查方法,对于早期研发阶段的药物,应选择合适的赋形剂,以有利于细菌内毒素检查中对样品的稀释处理。此外,在确定内毒素限值时还应尽可能采用最大人拟用剂量,为临床安全性和有效性研究中增加剂量留出空间。[/font][/color][/b]
细菌内毒素标准品溶液的制备,在美国药典中是“根据包装说明书上的标准和内毒素储备标准溶液的标签上关于制备和贮存的说明”进行储备液的制备,再由“充分混合内毒素储备标准溶液后,用细菌内毒素试验检查用水(BET检查用水)稀释,制成适当的系列稀释液,即得BET检查用内毒素标准溶液。”这具体是一个怎样的制备过程?而在中国药典中,标准品溶液的制备,按照说明书上步骤加内毒素检查用水后在漩涡混合器上进行15min的混合。但是,我公司所购买内毒素工作标准品说明书上提到的是进行5min的混合。这两个时间如何取舍。如果按中国药典上进行15min的混合,时间会不会过长,如此会不会对标准品有所影响?
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=165941]细菌内毒素检查方法建立中应注意的几个问题[/url]细菌内毒素检查方法建立中应注意的几个问题审评四部 王彦厚摘要:本文对细菌内毒素检查方法的建立、限值的确定、方法学验证及常见问题进行了介绍。关键词:细菌内毒素检查、方法、验证细菌内毒素检查法作为控制药品质量的一种有效方法,已经广泛的被世界各国药典收载。经过30多年的不断改进,无论是凝胶法还是光度法均比较成熟和完善。但是,在为新化合物或新药建立细菌内毒素检查方法时,常常会遇到各种各样的困难,尤其是尚处于新药研发早期阶段的药物,由于药物制剂、赋形剂等还不稳定,经常会发生变化,这样就给方法的建立带来不同程度的影响。在建立细菌内毒素检查法之前,应尽可能多的收集有关该药品的基本信息,例如:有关样品的溶解性信息,推荐的稀释液,在水中的溶解度,以及最适溶剂;样品的pH范围;分子量大小;产品规格、体积或重量;拟用于临床的用法和用量等等。以便选择合适的样品处理方法和内毒素检查方法,对于早期研发阶段的药物,应选择合适的赋形剂,以有利于细菌内毒素检查中对样品的稀释处理。此外,在确定内毒素限值时还应尽可能采用最大人拟用剂量,为临床安全性和有效性研究中增加剂量留出空间。 一、细菌内毒素检查方法建立的主要步骤对某一新化合物建立细菌内毒素检查方法时,首先应根据人体最大日给药剂量和给药途径,计算和确定样品的内毒素限值,选择合适的鲎试剂,根据临床规格,计算最大有效稀释倍数,稀释产品,并在低于最大稀释倍数的浓度下进行检查。可以采用凝胶法,也可以采用终点法或动态法。当测定结果有争议时,除另有规定外,以凝胶法为准。1、细菌内毒素限值的确定一个药品在投放市场前,它是否满足内毒素限值的要求?样品的内毒素含量具体是多少?这些问题不但关注用药安全,还应该最大限度的提供有关内毒素含量的准确信息,为药品生产过程中质量控制提供警戒信息。尽管细菌内毒素检查方法的建立是一个科学方法的研究过程,但其最终目的还是要为控制药品质量服务。因此,在方法建立时,不但要阐明限值的合理性,考虑技术可能达到的限值,同时还要满足相关药品管理法规的要求。研究人员在建立方法的早期,一般会按照临床建议的最大人用剂量确定一个非正式的限值,这个限值可以根据实验室可以达到的最低检测水平,把限值订的相对比较严格,但往往由于早期的临床剂量会比最终上市的临床剂量高几倍,所以严格的限值,可能会使得正式生产时很多产品不能通过检查,从而造成不必要的浪费;因此参按照法规允许的最高水平,酌情确定样品的限值。样品内毒素限值的确定一般与临床人体最大给药剂量有关,剂量越大,单位重量或体积的内毒素限值越低。一般按以下公式计算:内毒素限值L=K/M。式中内毒素限值L是以EU/ml、EU/mg或EU/u表示;K为按规定的给药途径,人体每公斤体重每小时最大可耐受的内毒素剂量,以EU/(kg.h)表示,注射剂K=5EU/(kg.h),其中放射性药品注射剂K=2.5EU/(kg.h),鞘内用注射剂K=0.2EU/(kg.h)。一般我国人群平均体重按60kg计算,人体对细菌内毒素的最大耐受量为300EU/h;另我国人体的平均体表面积按1.55m2计算,人体每平方米的最大耐受剂量为(300EU/h)/ 1.55m2 =(193EU/h)/ m2 。 M为人体每公斤体重每小时接受的最大给药剂量,以ml/(kg.h)、mg/(kg.h)或u/(kg.h)表示。内毒素限值计算举例(一):A注射剂的人体最大用量为每小时1.5g,每公斤每小时体重的剂量为1.5g/60kg=0.025g/kg=25mg/kg,内毒素限值L=K/M=(5EU/kg)/( 25mg/kg ) = 0.2EU/mg。在细菌内毒素检查法中,细菌内毒素标准品和鲎试剂常常以EU/ml表示,所以在具体实验中样品的内毒素的限量可以转换为EU/ml的表示方法,可使实验操作计算更为方便。假定产品A的浓度为100mg/ml(或原料药经溶解后的浓度为100mg/ml), 那么,将产品A的限值从EU/mg转变为EU/ml时,内毒素限值L= 0.2 EU/mg 100 mg/ml = 20 EU/ml。内毒素限值计算举例(二):B注射剂的临床最大用药剂量为1g/m2,规格为50mg/ml,内毒素限值L=(193 EU/ m2)/(1g/m2)=193 EU/g=0.193 EU/mg,转换为EU/ml 表示时,L = 0.193 EU/mg50 mg/ml=9.65EU/ml。大输液品种的限值一般定为0.5EU/ml,灭菌注射用水则定为0.25EU/ml。内毒素限值没有考虑到几个药物联合用药问题,但一般情况下,药品中内毒素的含量远低于限值,并且药品生产厂家的内控标准严于注册标准,所以药典内毒素限值也被称为最大允许内毒素浓度(Maximum allowable endotoxin concentration)。2、样品最大有效稀释倍数或最小有效浓度的计算最大有效稀释倍数(MVD)是指在所选择的鲎试剂灵敏度条件下,对产品进行最大倍数的稀释,仍能够进行内毒素限值的检测,此时所允许稀释的最大倍数。 MVD的计算公式为:当被规定的内毒素的限值以体积表示时, MVD=内毒素限值L(EU/ml )/鲎试剂灵敏度(λ);当内毒素的限值以重量或药品的生物活性(EU/mg或EU/u)表示时, MVD=内毒素限值L(EU/mg 或 EU/u)×供试品溶液的浓度C/ 鲎试剂灵敏度(λ)。在凝胶法中, λ=鲎试剂的标示灵敏度(EU/ml),在浊度法或显色法中, λ=所使用标准曲线上最低点的内毒素浓度(EU/ml)。最小有效浓度(MVC)是指在所选择的鲎试剂灵敏度条件下,将产品稀释到一定浓度,仍能够进行内毒素限值的检测,此时所允许的最小浓度。计算MVC的一般公式为:MVC=鲎试剂灵敏度(λ)/内毒素限值(L)。对所选定的鲎试剂灵敏度来讲,MVC是一个绝对值;而MVD对特定的产品浓度是特异的,浓度变化时,MVD也会随之发生变化。 3、方法学验证试验的预试验确定了样品的内毒素限值,考察了样品的溶解性,并且选定了一定灵敏度的鲎试剂,此时便可以考虑进行预试验。尽管法规中并不要求进行预试验,但在细菌内毒素检查法的建立过程中,一般需要进行预试验。预试验的主要目的是确定不出现干扰的第一个样品稀释度,也就是不干扰浓度(non-interfering concentration, NIC),为后续的验证试验选择适当的样品稀释度(或浓度)。不管采用凝胶法还是光度法,预试验都是对一系列样品的稀释液进行试验,在每一个稀释浓度,都有一组添加内毒素的样品和一组不添加内毒素的样品,添加内毒素的浓度保持不变,而样品浓度会逐级稀释,但最终样品的稀释倍数不得超过MVD。可以采用直接把内毒素添加到样品溶液中,添加内毒素的体积宜小,以免导致样品溶液被稀释,一般添加体积等于或小于样品体积的10%为宜;也可以采用下述方法添加内毒素,就是将两倍于终浓度的内毒素溶液与两倍于终浓度的样品溶液等体积混合,内毒素和样品溶液间相互稀释,得到两者所需终浓度的混合液。添加内毒素的浓度,凝胶法为2λ;终点显色法为4λ(这里的λ表示标准曲线上的最低点,也就是方法的检测限)。动态显色法则有3种选择添加内毒素浓度的方法,可以选择标准曲线的中点浓度,也可以与终点比色法一样,选择4λ。此外,当样品稀释液中,内毒素的限值小于或等于1.0EU/ml时,添加内毒素的浓度可定为0.1-0.5EU/ml之间,当样品稀释液中,内毒素的限值大于或等于1.0EU/ml时,添加内毒素的浓度可定为1.0-5.0EU/ml之间。对于凝胶法的结果判断,不添加内毒素的样品不应该凝集,如果发生凝集说明含有内毒素或内毒素样物质;添加有内毒素的样品应该出现凝集,若没有发生凝集表明样品凝集反应被抑制。光度法的结果判断标准为,测得的添加内毒素的量应该在已知添加量的±50%范围内,超出范围(多或少)表明存在增强或抑制作用。通过预试验结果可以确定验证试验中样品的稀释度或浓度,其选择的基本原则包括:经稀释后的样品含内毒素的量应尽可能少,比其内毒素限值至少少4倍,最好检测不到内毒素。要求验证试验选择的稀释度至少要比NIC大1-2倍,但不可超过MVD。若样品需要多支合并进行验证试验,此时试验不可采用原来的MVD,因为假定合并样品中有一瓶存在污染,其它瓶没有污染,污染瓶
[font=&][size=16px][color=#333333]点击链接查看更多:[url]https://www.woyaoce.cn/service/info-39860.html[/url]检测内容[/color][/size][/font][font=&][color=#333333][/color][/font][font=微软雅黑] [/font][font=宋体]最近“猫粮细菌内毒素”的话题热度很高,中广测带您了解细菌内毒素,并针对宠物食品中疑似隐患项目推出检测方案。[/font][font=宋体][size=16px]一、什么是细菌内毒素[/size][/font][font=宋体][size=16px]?[/size][/font][font=宋体][size=16px]细菌内毒素(Endotoxin)是革兰氏阴性菌细胞壁的主要成分,其化学成分为脂多糖(LPS)。细菌在正常状态时不释放出来,只有当细菌死亡裂解或自溶时,才表现其毒性。[/size][/font][font=宋体][size=16px]二、细菌内毒素有什么危害[/size][/font][font=宋体][size=16px]?[/size][/font][font=宋体][size=16px]相关研究表明,细菌内毒素广泛存在环境中,环境中低浓度细菌内毒素经口进入人体消化道并不产生明显危害,肝脏可以将细菌内毒素分解去除,并使细菌内毒素保持在相对较低的含量。当突然遇到或摄入大剂量细菌内毒素时,超出机体的免疫承受力时可引起发热,严重的会导致内毒素血症、休克甚至死亡。[/size][/font][font=宋体][size=16px]目前,我国已对注射剂和疫苗类产品中细菌内毒素有限量要求,但对人类食品和宠物食品中细菌内毒素含量未做规定。[/size][/font][font=宋体][size=16px] 中广测是华南地区唯一的国家级分析测试中心,是广东省饲料和饲料添加剂行政审批检测机构,2021年宠物饲料加工产品企业标准“领跑者”评估机构。拥有专业的宠物食品检测技术团队,针对当前宠物食品热点问题,参考《中国药典》“细菌内毒素检查法”,研究建立了适用于宠物食品中细菌内毒素含量的检测方法,可为从事宠物食品生产经营的广大企事业单位、爱宠人士提供全面专业的科研和检测技术服务。[/size][/font][font=&][size=16px][color=#333333]检测标准[/color][/size][/font][font=&][color=#333333][/color][/font][table][tr][td]产品名称[/td][td]检测项目[/td][td]检测标准[/td][/tr][tr][td]细菌内毒素[/td][td]细菌内毒素检查法[/td][td]中国药典[/td][/tr][/table]
中国药典规定:细菌内毒素检查法器皿处理:250℃干烤,30分钟以上。干热灭菌法250℃×45min的干热灭菌也可除去无菌产品包装容器及有关生产灌装用具中的热原物质。 中国药典2005年版的规定是:细菌内毒素检查法器皿处理:250℃干烤至少60分钟。.到底多少时间合适?
中国药典2005年版二部附录细菌内毒素检查法中的干扰试验,说:"使用的供试品溶液应为未检查出内毒素且不超过最大有效稀释倍数(MVD)的溶液."请问如果做注射用水的细菌内毒素,那么供试品溶液是什么样的注射用水?怎样处理不含内毒素?后面的"凝胶半定量试验"A "从通过干扰试验的稀释倍数开始"这个稀释倍数是定值吗?怎样求?"系列溶液A中每一系列平行管的终点稀释倍数乘以λ,"什么是终点稀释倍数?
弱弱得问一下,热源和细菌内毒素之间是什么关系呢?
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=26329]细菌内毒素试验记录[/url]欢迎交流
中国药典2005年版无菌、微生物限度及细菌内毒素检查方法学验证内容简介[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=117279]无菌、微生物限度及细菌内毒素检查方法学验证[/url]
注射用水中有一项细菌内毒素的检测,从来没有做过,不知道要购买哪些仪器和试剂,望有经验的老师指点。