[align=center][size=16px][/size][/align][size=16px] 光合作用是地球上最重要的化学反应,植物、藻类及光合细菌等吸收光能、将[/size][size=16px]CO[/size][font='calibri'][sub][size=16px]2[/size][/sub][/font][size=16px]和水转化为有机物并释放[/size][size=16px]O[/size][font='calibri'][sub][size=16px]2[/size][/sub][/font][size=16px]。获得光能的叶绿素分子从基态跃迁到激发态,激发态的叶绿素分子可通过三种途径释放能量回到基态:推动光化学反应、以热的形式耗散、释放光子产生荧光。这三种途径的总和是一定的,因此叶绿素荧光的变化反映了光化学效率和热耗散能力的变化。叶绿素荧光成像是[/size][size=16px]广泛应用[/size][size=16px]的[/size][size=16px]光合生理研究的重要探针[/size][size=16px],[/size][size=16px]叶绿素荧光显微成像又将研究尺度进一步拓展到细胞、亚细胞水平。叶绿素荧光技术发展出了很多不同的测量程序,以慢诱导荧光动力学曲线为例,通过测量光([/size][size=16px]ML[/size][size=16px])、作用光([/size][size=16px]AL[/size][size=16px])、饱和脉冲光([/size][size=16px]SP[/size][size=16px])激发样品,记录动力学曲线并计算叶绿素荧光参数[/size][size=16px],[/size][size=16px]可以用于反映植物光合作用机理和光合生理状况([/size][size=16px]朱新广[/size][size=16px],[/size][size=16px]2021[/size][size=16px])。[/size][size=16px][/size][size=16px] 叶绿素荧光成像技术能记录整个叶片、植株等样品不同区域的荧光动力学分布变化,实现从宏观到微观的光合机理研究。叶绿素荧光成像由于其无损、高通量的技术特征,在光合作用相关突变体筛选领域成为了广泛应用的重要技术,为光合作用机理及抗[/size][size=16px]逆研究[/size][size=16px]提供了强大的技术支持。叶绿素荧光显微成像技术最早出现于[/size][size=16px]2000[/size][size=16px]年,[/size][size=16px]K[/size][size=16px]ü[/size][size=16px]pper[/size][size=16px]等人将叶绿素荧光脉冲调制式激发光源与显微镜结合,首次获得了显微尺度的叶绿素荧光图像([/size][size=16px]K[/size][size=16px]ü[/size][size=16px]pper[/size][size=16px] [/size][size=16px]et al.[/size][size=16px], 2000[/size][size=16px])。叶绿素荧光显微成像技术在国外已经展开多方面研究应用,[/size][size=16px]目前国内的叶绿素荧光成像显微研究尚处于起步阶段,多个课题组都[/size][size=16px]正[/size][size=16px]在[/size][size=16px]探索[/size][size=16px]这项技术[/size][size=16px]在[/size][size=16px]不同研究领域中[/size][size=16px]的[/size][size=16px]应用。[/size][size=16px][/size][size=16px] 叶绿素荧光技术[/size][size=16px]适用研究样品微观结构上光[/size][size=16px]合功能[/size][size=16px]的空间差异,例如叶片横截面栅栏组织与海绵组织的差异,[/size][size=16px]C[/size][size=16px]4[/size][size=16px]植物花环结构[/size][size=16px]中维管束鞘细胞与叶肉细胞的差异[/size][size=16px],藻类中有差异的单个细胞、异形胞[/size][size=16px]等。我们多年来与[/size][size=16px]吉林师范大学、四川省农业科学研究院[/size][size=16px]等[/size][size=16px]单位[/size][size=16px]合作[/size][size=16px],[/size][size=16px]目前已合作发表的[/size][size=16px]3[/size][size=16px]篇相关论文是国内该领域[/size][size=16px]开创性[/size][size=16px]的应用成果,[/size][size=16px]以叶绿素荧光显微成像的特色优势技术[/size][size=16px]为光合作用的微观[/size][size=16px]探究提供有力支撑[/size][size=16px]。[/size][size=16px][/size][size=16px] Yu[/size][size=16px]等[/size][size=16px]发现[/size][size=16px]狗枣猕猴桃[/size][size=16px]([/size][size=16px]A[/size][size=16px]ctinidia [/size][size=16px]kolomikta[/size][size=16px])[/size][size=16px]的白化[/size][size=16px]叶片[/size][size=16px]通过调整叶片结构及基因表达调控,仍然保持了相对较高的光合能力[/size][size=16px]。[/size][size=16px]应用[/size][size=16px]叶绿素荧光显微成像技术[/size][size=16px]比较了[/size][size=16px]白化和绿色叶片栅栏组织、海绵组织的叶绿素荧光参数,[/size][size=16px]揭示了白化叶片海绵组织光[/size][size=16px]合能力[/size][size=16px]增强的机理[/size][size=16px]。[/size][size=16px]绿叶中栅栏组织[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px](最大光化学效率)[/size][size=16px]更高,而白叶中海绵组织[/size][size=16px]显著增厚,[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]更高[/size][size=16px],[/size][size=16px]光[/size][size=16px]合能力[/size][size=16px]增强,补偿[/size][size=16px]了[/size][size=16px]白化的影响,成为叶片光合作用主力组织[/size][size=16px]([/size][size=16px]Yu [/size][size=16px]et al.[/size][size=16px], 2022[/size][size=16px])[/size][size=16px]。[/size][size=16px]接下来[/size][size=16px]Chen[/size][size=16px]等又比较了两种猕猴桃白化叶片的光保护策略差异[/size][size=16px],狗枣猕猴桃的白叶[/size][size=16px]主要通过反射实现光保护,强光下花青素[/size][size=16px]积累,叶片[/size][size=16px]转变为粉色[/size][size=16px],更有效地保护叶片[/size][size=16px];[/size][size=16px]而[/size][size=16px]葛[/size][size=16px]枣猕猴桃([/size][size=16px]A[/size][size=16px]ctinidia[/size][size=16px] [/size][size=16px]polygama[/size][size=16px])[/size][size=16px]强光下[/size][size=16px]仍为白色[/size][size=16px],[/size][size=16px]具[/size][size=16px]有更[/size][size=16px]强[/size][size=16px]的叶绿[/size][size=16px]素荧光参数,说明[/size][size=16px]它[/size][size=16px]具有更高的强光适应能力[/size][size=16px]([/size][size=16px]Chen[/size][size=16px] [/size][size=16px]et al.[/size][size=16px], 202[/size][size=16px]3[/size][size=16px])。[/size][size=16px]Liu[/size][size=16px]等比较了干旱处理下的玉米叶肉细胞和维管束鞘细胞,发现这两种细胞具有不同的不同光保护策略[/size][size=16px]。对玉米[/size][size=16px]完整叶片的分析显示,[/size][size=16px]随着干旱处理程度增强,[/size][size=16px] [/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]、[/size][size=16px]Φ[/size][font='calibri'][size=14px][sub][size=16px]PSII[/size][/sub][/size][/font][size=16px](实际光化学效率)[/size][size=16px]降低,[/size][size=16px]NPQ[/size][size=16px](非光化学猝灭[/size][size=16px]系数[/size][size=16px])[/size][size=16px]显著升高[/size][size=16px]。进一步应用[/size][size=16px]叶绿素荧光显微成像[/size][size=16px]的分析结果[/size][size=16px]与完整叶片[/size][size=16px]相符合,并且发现[/size][size=16px]与叶肉细胞相比,维管束鞘细胞[/size][size=16px] [/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]、[/size][size=16px]Φ[/size][font='calibri'][size=14px][sub][size=16px]PSII[/size][/sub][/size][/font][size=16px]更低,干旱胁迫后[/size][size=16px]NPQ[/size][size=16px]升高更显著[/size][size=16px],[/size][size=16px]不同细胞的变化趋势[/size][size=16px]差异[/size][size=16px]表明它们[/size][size=16px]具有不同的光保护策略[/size][size=16px],[/size][size=16px]维管束鞘细胞中可能具有更强的热耗散能力[/size][size=16px]([/size][size=16px]Liu [/size][size=16px]et al.[/size][size=16px], 2022[/size][size=16px])。[/size][size=16px][/size][size=16px] 叶绿[/size][size=16px]素[/size][size=16px]荧光显微成像技术在光合作用的微观研究领域具有独特的技术优势,在[/size][size=16px]光合作用机理研究、环境及毒理胁迫与抗性筛选、优良品系选育等领域[/size][size=16px]具[/size][size=16px]有广阔的应用前景。目前多家单位的科研人员[/size][size=16px]都[/size][size=16px]在[/size][size=16px]探索该技术[/size][size=14px][size=16px]的新应用,我们也正在[/size][size=16px]将该技术拓展到[/size][size=16px]多个新的领域,例如对[/size][size=16px]原生质体[/size][size=16px]以及[/size][size=16px]种子、茎秆等非叶片器官的[/size][size=16px]研究[/size][size=16px]。[/size][/size][font='黑体']参考文献:[/font][font='calibri'][size=13px][1] [/size][/font][font='calibri'][size=13px]朱新广[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]许大全主编[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]光合作用研究技术[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]上海科学技术出版社[/size][/font][font='calibri'][size=13px], 2021[/size][/font][font='calibri'][size=13px][2] [/size][/font][font='calibri'][size=13px]H[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Küpper[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]I[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]?etlík[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Trtílek[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Photosynthetica[/size][/font][font='calibri'][size=13px], 2000, 38, s553-570 [/size][/font][font='calibri'][size=13px][3] [/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Yu, [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Chen, [/size][/font][font='calibri'][size=13px]D[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] H[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Liu[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Front. Plant Sci.[/size][/font][font='calibri'][size=13px], 2022, 13: 856732 [/size][/font][font='calibri'][size=13px][4] [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Chen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] D[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Q[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Wen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] G[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Shi[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]et al.[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Physiol. Plant.[/size][/font][font='calibri'][size=13px], 2023, [/size][/font][font='calibri'][size=13px]175:[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]e13880[/size][/font][font='calibri'][size=13px][5] [/size][/font][font='calibri'][size=13px]W[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] J[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Liu, [/size][/font][font='calibri'][size=13px]H[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Liu, [/size][/font][font='calibri'][size=13px]Y[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] E[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Chen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Front. Plant Sci.[/size][/font][font='calibri'][size=13px], 2022, 13: 885781[/size][/font]
分析叶绿素a的高速离心机有什么具体参数要求?叶绿素荧光仪能否直接测叶绿素a ?国家环保局认可吗?
我是分子荧光的新手,现在单位买了一台日立F-4500,不知道?还需要?资料和辅助才能做叶绿素叶绿素a(Sigma公司)的标准那里有卖啊?
叶绿素a存在于一切独立营养植物中,是一种能将光合作用的光能传递给化学反应系统的惟一色素。因此,叶绿素a就成为水中有机物的源泉。通过测定叶绿素a,可以了解海洋、湖泊和河流中植物性浮游生物的现存量和基础生产量,可掌握水体中藻类现存量。因此,叶绿素a指标是评价水体富营养化程度最直接有效的方法,也是目前科学地预测其发展趋势的有效方法。根据实测资料分析,当叶绿素a含量从常量上升至10 mg/m3以上,并有迅速增加的趋势,就可预测水体即将发生富营养化。(一)叶绿素a的分光光度法测定在一定量的水样中添加1%碳酸镁悬浮液1 mL,充分搅匀,用玻璃纤维滤纸或微孔滤膜过滤。若不能立即提取,将带样品的滤膜放人冰箱保存(1~2 d)。将载有藻类的滤膜放人研钵中,加入90%丙酮6~7 mL,研磨至呈糊状,再用90%丙酮溶液洗入具塞刻度离心管中,密封,放置暗处静置萃取6~20 h。以3500~4000r/min转速离心lO~15 min,取上清液转入1 cm比色皿中,以90%丙酮溶液为参此,于波长665 nm和750 nm处测吸光度,然后加入几滴l mol/L盐酸酸化,于波长665 nm和750 nm处再测吸光值。叶绿素a浓度计算公式为:Chla=27.3×665一E750)一(A665一A750)]×V丙酮/V水样式中:Chla——叶绿素a含量(μg/L);E665,E750——丙酮萃取液分别于波长665 nm和750 nm的吸光度;A665,A750——丙酮萃取液酸化后分别于波K 665 nm和750 nm的吸光度;V丙酮——丙酮萃取液的体积,mL;V水样——水样过滤的体积,L。(二)叶绿素a的荧光法测定适合于藻类较少的贫营养湖泊或外海洋中的叶绿素a的测定。基本原理是,当丙酮提取液经紫外线照射时,叶绿素a显现其固有的红色荧光特征,其浓度与荧光强度存在一定的规律性,因此可定量测定叶绿素a的含量。由于所用的光源强度高,故荧光法的灵敏度比分光光度法约高两个数量级。[/td][/tr][/table]
如题,每组概念没有放到一起感觉好像明白,一放到一起傻眼啦。以下均引自粱钰教材《X射线荧光光谱分析基础》 脉冲高度分布或脉冲高度分布曲线是进入探测器X射线的脉冲高度值的X射线强度分布----没理解其深层意思。 脉冲高度值和X射线强度:前者是X射线信号幅度(能量)的大小,后者是信号值得多少。脉冲高度分布曲线和定性元素峰:前者是在某2θ角度被衍射的X射线能量分布;后者是在一定的分光条件下,测得样品中元素在各自衍射角多对应的特征荧光X射线的强度分布。
脉冲信号发生器QA2系列函数信号发生器拥有比传统函数发生器更杰出的性能。稳定的输出频率,低失真度和微小的频率解析度都是这个系列产品的优秀特性。QA2系列系列包含有QA212D和QA206D产品两种,其中QA212D标准输出120MHz正弦波,25MHz脉冲波和方波,其他波形均为1MHz;QA206D标准输出60MHz正弦波,12MHz脉冲波和方波,其他波形均为0.5MHz。1. 采用DDS和可编程逻辑器件技术,双通道,实时500MSa/s采样率,16bits垂直分辨率,独特功能可以提高测试效率和测量置信度。2. 晶体振荡基准,频率精度高,分辨率高,任意模拟标量调制信号,矢量调制信号,逻辑信号产生。3. 多种内置函数信号产生(包括正弦,三角,锯齿, 方波,脉冲, 噪声, 直流等)。4. 优越的小失真,方便的存贮调用功能,可以设置精确的方波占空比及斜波对称度。5. 1ppm信号频率高度稳定,-120dBc/Hz相位噪声低达,波形失真小。6. 波形存储深度达56K样本/通道。7. USB连接PC端GUI界面,操控简洁自如。8.具备扫描和猝发脉冲模式,可调整扫描时间和扫描宽度。9.丰富的模拟和数字调制能力,以及图形显示功能。(AM,MASK,FM,MFSK,PM,MPSK调制和外部计频功能。) 10. 体积小(20*12.8*4.4CM),重量轻(0.9KG),方便携带。支持的波形有如下所示:非调制波形:周期波:正弦波,方波,三角波,脉冲波,斜波,直流,伪随机二进制序列,高斯白噪声,任意波:高斯脉冲,心电图,指数下降,指数上升,半正失曲线,D洛伦兹曲线,洛伦兹曲线,Sinc函数,负斜波,用户自定义波形调制波形:AM调幅,MASK幅移键控,FM调频,MFSK 频移键控,PM 调相,MPSK相移键控[/s
如题[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=24112]叶绿素荧光原理[/url]
在使用同步荧光法测叶绿素a时,该如何设置日立F-7000型荧光分光光度计相关参数?
最近要用到叶绿素,哪里有叶绿素样品卖??
荧光分光光度法测海水叶绿素a,脱镁叶绿素a为负值怎么回事
标准里说的说的标准叶绿素 已买,但是就是不明白,为什么做出来酸化前的荧光值不稳定,变化还是挺大的,酸化后也是变化很多,里面的酸化因子是不是固定的,校准的那个标准浓度值是不是可以随意配制 ,小白求教了。还有就是做过这个方法的大神,可否告知一下,你标准叶绿素的浓度,以及做出来R,或者Ra Rb F 的值大概是多少?万分感激
[size=16px] 叶绿素测定仪是一种用于测量植物叶片中叶绿素含量的设备。叶绿素是植物中进行光合作用的关键色素,它们吸收光能并将其转化为化学能以支持植物的生长和发展。以下是一般情况下使用叶绿素测定仪测量植物叶绿素相对含量的步骤: 样本准备: 从要测量的植物中选取代表性的叶片样本。这些叶片应该是健康的、没有损伤的,并且尽可能避免太老或太嫩的叶片。 叶片处理: 如果需要,将叶片处理成较小的块状或碎片,以确保测量时样本的均匀性。同时,避免过度损伤叶片,因为这可能会影响叶绿素的测量结果。 提取叶绿素: 使用适当的提取液(比如乙醇、乙醚等)将叶片中的叶绿素提取出来。提取的过程通常需要在低温下进行,以防止叶绿素的降解。 测量光吸收: 将提取液中的叶绿素溶液置于叶绿素测定仪中。这种仪器通过照射样本并测量样本对不同波长光的吸收来确定叶绿素的含量。最常见的方法是使用分光光度计,它可以测量不同波长下样本吸收的光强度。 建立标准曲线: 使用已知浓度的叶绿素标准溶液,进行一系列测量以建立标准曲线。标准曲线可以用来将样本吸收的光强度值转换为叶绿素浓度值。 测量样本: 使用同样的方法测量你的样本,获取其吸收的光强度值。 计算叶绿素含量: 根据标准曲线,将样本的光吸收值转化为叶绿素浓度。如果你感兴趣的是叶绿素的相对含量,可以将不同样本的叶绿素浓度与标准样本进行比较。 请注意,使用叶绿素测定仪需要一定的实验操作技能和基本的化学常识。在操作之前,云唐建议仔细阅读仪器的操作手册,并根据实际情况调整实验步骤。另外,确保在实验过程中遵循安全操作规范,使用适当的防护措施。[/size]
任何用荧光分光光度计测绿叶中叶绿素的含量?
原先用普通的可见分光光度法测了一系列的叶绿素含量。可老板不满意,叫用F-4500荧光仪测量。新手的我查了半天也没找到相关的标准方法,他又急着要,哭啊!不知道哪位大侠有这方面的资料,可否指点一下小弟。弟弟先在这儿谢谢您了!
各位大牛,我组刚买了一台新的原子荧光,用了不到两个月,走基线就出现不定频率的尖脉冲峰,不知道啥原因,工程师过来说灯坏了,换灯又有这种情况出现,不知道谁还碰到过这种情况,我看光换灯也不行啊,是不是仪器的问题呢,还是其他什么原因,谢谢了!
[size=16px] 叶绿素测定仪是一种用于测量植物叶片中叶绿素含量的设备。它在植物生理学、生态学和农业研究中非常有用。然而,是否认为叶绿素测定仪好用取决于具体的使用情境和需求。 以下是一些使用叶绿素测定仪的优点和考虑因素: 优点: 快速准确: 叶绿素测定仪能够快速测量叶片中的叶绿素含量,提供准确的结果,节省时间和人力成本。 非破坏性: 使用叶绿素测定仪通常不需要摘取植物叶片,因此不会对植物造成破坏,可以进行长期监测。 数据量大: 叶绿素测定仪能够高通量地收集数据,适用于大规模实验和研究。 定量分析: 通过叶绿素测定仪,您可以获取叶绿素含量的定量数据,有助于更深入地理解植物生长和环境因素之间的关系。 考虑因素: 成本: 叶绿素测定仪可能需要较高的投资成本,包括设备购买和维护费用。 操作复杂性: 操作叶绿素测定仪可能需要一定的技术培训,特别是对于没有相关经验的人员。 适用范围: 叶绿素测定仪主要用于叶绿素含量的测量,如果您需要其他植物参数的数据,可能需要其他类型的设备或方法。 样本处理: 样本的准备和处理可能会影响测量结果的准确性,需要注意标准化的操作步骤。 综合考虑以上因素,如果您在植物研究、农业实验或环境监测等领域需要准确测量叶绿素含量,叶绿素测定仪可能会非常有用。然而,在购买之前,云唐建议您仔细评估您的研究需求、预算以及操作和维护的可行性。[/size]
如何在水中提取叶绿素?利用某个波长检测叶绿素产生荧光,如何在水样中萃取叶绿素。
你好,我在做用叶绿素表征水中藻类的含量,同时测定投加不同药剂时的去除率。用的是《水和废水中的生物监测方法〉中得叶绿素a的测定方法,但是同种的水样测出来得叶绿素值差别很大,或是投加杀藻剂后叶绿素含量反而上升。我想可能是一个水样研磨得充分,而另一个研磨的不够充分,那末在测定多个样的时候,如何才能让它的研磨程度达到一致,才能使各个样具备可比性。急切盼指教,谢谢
脉冲电镀技术与脉冲电源兰为国 2006-05-24 09:45:41 在能源紧张、耗材昂贵、资源短缺、竞争激烈的新形势下,我们怎样才能立于不败之地?省钱等于赚钱才是硬道理。那么怎样才能省钱呢?降低成本就能省钱。表面处理行业,首先是个电老虎,而因为电的问题没解决好,电镀行业电的成本占经营成本的20%,耗材占经营成本的30%;氧化行业电的成本占经营成本的33%,耗材占经营成本的20%;有没有既能省电,又能节省材料,又能提高生产效率的设备,来帮助我们提高生产力呢? 高频脉冲电源是大家向往以久的设备。上世纪,我们国家表面处理行业的前辈们,就已提出这一脉冲工艺技术,而在国外更早已普遍应用了。 一、什么是脉冲电镀 脉冲电镀所依据的电化学原理,主要是利用脉冲电压或脉冲电流的张弛(间隙工作),增强阴极的活性极化和降低阴极的浓差极化,从而有效地改善镀层的物理化学特性。 在脉冲电镀过程中,电流导通时,接近阴极的金属离子充分地被沉积,而电流关断时,阴极周围的放电离子又恢复到初始浓度。脉冲电镀时的导通电流密度,远远大于直流电源电镀时的电流密度,这将使金属离子处在直流电镀实现不了的极高过电位下电沉积,其结果不仅能改善镀层的物理化学特性,而且还能降低析出电位较负金属电沉积时析氢副反应所占比例。 二、脉冲电镀的特点 能得到致密、均匀和导电率高的镀层。这是采用电子电镀最最可贵的,无论是硅整流还是可控硅整流都难以实现的。 降低浓度极化,提高阴极的电流密度。从而提高镀速(频率越高,镀速越快),缩短了电镀时间,为企业创造更好的效益。 减少镀层的孔隙率,增强镀层的抗蚀性。由于均匀脉冲有张有弛,使得镀层的致密性得到非常有效的改善,孔隙率降低,几乎是完美无缺,抗蚀能力得到加强。 消除氢脆,改善镀层的物理特性,由于采用脉冲电源镀层和被镀物的导电率极高,致密性极好,几乎不会出现氢脆现象,经电镀后的表面光洁平整。 降低镀层的内应力,提高镀层的韧性。由于脉冲电流电镀的一瞬间,电流及电流密度是非常之强大,此时金属离子处在直流电源电镀实现不了的极高过电位下电沉积(吸附能力极强),大大提高镀层的韧性。 减少镀层中杂质,提高镀层的纯度。因为在电镀的瞬间,脉冲电流只对金属离子作用,好比是过滤,这样,将有用的金属离子送到被镀物上沉积,而滤其杂质,提高镀层的纯度。 降低添加剂的成份,降低成本。由于脉冲电镀的均匀,致密性好,光洁度高,存放时间长,一般镀件免加添加剂,有要求的镀件,也可少加添加剂。 脉冲电镀中金属的电结晶。在金属电结晶过程中,晶核形成的几率与阴极的极化有关,阴极极化越大,阴极过电位越高,则阴极表面吸附原子的浓度越高,晶核形成的几率越大,晶核尺寸越小,使得沉积层的晶粒细微化,这就是脉冲电镀能获得细致光滑镀层的本质原因。 三、脉冲电源的特点 节电:效率≥90%,比硅整流省电达40%左右或比可控硅电源省电达20%左右。 节料:由于它的工作原理与普通电源不一样,因此在达到相同表面要求的前提下,可节料达15%左右。 节时:由于采用高频脉冲工作方式,电镀完全是在过电位下的电沉积,因此可节约时间达10%左右,提高工效。 高频脉冲电源采用N+1方式多个并联,(硅整流或可控硅电源不可以),大功率、大电流可任意并用,效率更高。 高频电源的稳定性:由于采用了最新现代半导体双极型器件(IGBT智能模块),其可靠性、安全性、稳固性和长时间工作寿命都大大加强和延长,这也是硅整流或可控硅电源无法比拟的。 高频脉冲电源:其工作时,脉冲顶部非常之平,完全是一条直线,纹波可小到0.5%,关断时可对被镀件进行瞬间退镀整平,因此克服了硅整流或可控硅电源的脉动波纹及被镀件表面的高低区,不会形成高的地方镀层厚,低的地方镀层薄的现象。 四、脉冲电源参数及选择 1.脉冲参数表示 Q:周期 Ton:脉冲导通时间 Toff:脉冲关断时间 f:频率 Jp: 脉冲电流密度 Jm:平均电流密度 r%:占空比(导通时间与周期之比的百分数) 2.常用计算公式 ①占空比:r%=(Ton/Q)×100% =[Ton/(Ton+Toff)]×100% ②平均电流密度:Jm=Jp×r% =Jp×[Ton/(Ton+Toff)]×100% ③频率:f=1/Q=1/×(Ton+Toff) ④平均电流密度:Jm=Jp×r% 3.脉冲参数的选择 ⑴脉冲导通时间Ton选择: 脉冲导通时间Ton是由阴极脉动扩散层建立的速率或由金属离子在阴极表面消耗的速率Jp来确定。如果Jp大,金属离子在阴极表面消耗得快,那么,脉动扩散层也建立得快,则Ton可短些,反之则取长。但无论Ton取长或短,只要大于tc(电容效应产生的放电常数)即可。 ⑵脉冲关断时间Toff选择: 脉冲关断时间Toff是受特定离子迁移率控制的阴极脉动扩散层的消失速率来确定。如果将扩散层向脉动扩散层补充金属离子使之消失得快,则Toff可取短些,反之则长,但Toff只要大于tcd(电容效应产生的时间常数)即可。 ⑶脉冲电流密度Jp的选择: 脉冲电流密度Jp是脉冲电镀时金属离子在阴极表面的最大沉积速度,它的大小受Ton、Toff、Jm的制约,在选定Ton和Toff,并保持Jm/Jgg≤0.5这个比值,则希望Jp越大越好。 ⑷脉冲占空比r%选择: 脉冲占空比是由Ton和Toff及Q决定的,一般脉冲电镀贵重金属时,占空比选取10~50%为最佳,脉冲电镀普通金属时,占空比选取25~70%。占空比的真正选择要在实际试验后得到最佳结果。 五、脉冲电镀电源使用须知 1.脉冲电镀电源与镀槽之间的距离 为了确保脉冲电流波形引入镀槽时不畸变,且衰减小,希望在安装时,脉冲电镀电源与镀槽的间距2~3m为佳,否则对脉冲电流波形的后沿(下降沿)影响较大,电镀将不能达到预期效果。 2.阴、阳极的导线连接方式 直流电源的导线连接方式,不适合脉冲电源的连接,脉冲电镀电源的输出连接,希望两根导线的极间电容能够抵消导线的传输电感效应,因此阴、阳极导线最好的方法就是双绞交叉后,引送到镀槽边,从而保持脉冲波形不变。 总之,采用高频脉冲整流机,总体效益提高20%左右,符合现代企业清洁生产与可持续发展之要求,这是淘汰硅整流和可控硅整流机的必然优势。
各位老师,我想寻找一种检测叶绿素a、叶绿素b和叶绿素铜钠的含量,目前使用紫外-可见光分光光度计,采用的是标准曲线法,但是非常麻烦;希望能够找到更简便快捷的测量方法或者仪器,精确度要求99.99%。请各位老师指点!!
GBZ/T 189.8-2007工作场所物理因素测量 噪声3.4.6 脉冲噪声测量时,应测量脉冲噪声的峰值和工作日内脉冲次数。脉冲噪声的峰值可以直接用声级计测出LCpk,可是脉冲次数怎么测量?要自己数吗?怎么判断是不是脉冲噪声?谢谢指导!
公司生产的一种野菜用到叶绿素铜钠盐作为着色剂,但是客户检测说是只检测到叶绿素铜。请问由钠盐向叶绿素铜怎么转化?(产品为酸性,pH值4.0-4.6)是不是酸碱反应呢?请给出比较有说服力的依据,谢谢!
化学反应过程一旦超越某一临界点,可能会迅速释放出大量气体以致超过消解各罐的压力上限(110bar)而难以驾御。因此需随时谨慎监视反应过程,并及时改变微波功率输出加以调控。一般根据控制能力可分低、中、高三档,控制能力不同,程序输入也不一样。1)开关式脉冲控制:传统的办法是采用固定功率输出,但间歇关闭微波以改变输出功率总量的方式,其特征是开关式脉冲微波。如:在10秒钟内关闭微波5次间隔1秒,功率为50%。开关式控制是第一代控制技术。研究人员发现这种控制方式不仅不易控制,还可能会直接影响到反应结果,且意外都是发生在开关方式下。根据功率发射方式把微波定义为脉冲和非脉冲,即间断发射为脉冲微波,而不间断发射为非脉冲微波。 研究表明,脉冲微波在开关瞬间会产生高阈值电磁脉冲,对消解含有机脂类和醇类的样品,其与硝酸的反应产物可能会刺激发生临界爆炸,其反应机理与炸药引爆相似。在萃取反应中也宜采用非脉冲技术,因为高阈值脉冲微波也极易破坏所萃取的有机分子形态,不能保证分子有机形态的完整,从而影响结果的一致性和可靠性。2)自动功率变频控制和非脉冲技术:这是第二代控制技术,特征是功率自动变化,输出均为非脉冲微波。特点是无须关闭微波发射,在连续微波发射条件下,根据温压反馈信号,自动线性改变微波功率输出,调整反应状态。不仅提高了反应速率,而且非常安全。由于闭环响应是基于精确可靠的在线罐内温压传感装置,从而提高了整机技术,当然成本也相应提高。非脉冲微波是在连续微波发射的条件下,自动线性调整微波的功率输出,其特征是无论功率如何变化,微波仍能持续输出,无脉冲刺激。实验结果表明,这种方式更易于控制微波辅助反应,提高消解反应的稳定性和安全性。且有机萃取反应回收率和稳定性也得到改善。大功率微波仪器最好采用非脉冲,因为其阈值太高,有潜在的危险。因此,非脉冲微波化学仪器的发展对反应动力学的研究十分有利,它实际上代表了微波技术发展的一个新方向。
从事天然药分离纯化工作的各位虫虫,在对叶类等植物进行成分分离时可能都会遇到挠头的问题,就是药材的乙醇提取液中油油绿的叶绿素怎样才能快速除去,虽然文献书籍中有很多传统方法,但都效果一般。本人在实验中偶然发现这样一个快速的方法,实在太好了,拿出来供大家分享。 将药材的乙醇提取液(大于50%乙醇提取液均可)直接通过一个装有D152树脂柱(此树脂也以同浓度的乙醇湿法装柱,并以同浓度乙醇洗至流液无浑浊现象,树脂量与药材比例一般为1:3左右),收取流液即可。此方法快速,此树脂对叶绿素有超强的吸附能力容量极大,而在大于50%乙醇的溶剂环境中,对其它成分吸附较少。
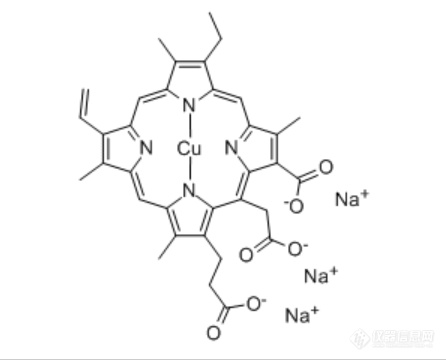
[align=center][font='黑体'][size=29px]叶绿素铜钠盐[/size][/font][/align][align=center]杨宗琦[/align]叶绿素是植物进行光合作用所必需的催化剂,是由四个吡咯环与镁离子相互配合而形成的镁卟啉类化合物。它是天然生物活性物质之一,具有排毒养颜,抗病强身,抑菌除臭等功效,一方面被广泛应用于日用品、食品、色素、脱臭剂等方面,另一方面在医药上也可用来治疗多种疾病,并应用于各种牙膏的开发中。但游离的叶绿素卟啉环中的镁离子在酸性条件下容易被氢离子取代,生成脱镁叶绿素使色泽褪去,且对光、酸和热比较敏感,使叶绿素的应用受到严重限制。近年来,有不少研究者试图对叶绿素的结构进行修饰,使其变成相对稳定的金属卟啉结构,而叶绿素铜钠盐就是极其重要的一种。叶绿素铜钠盐具有很高的稳定性,在医学上,叶绿素铜钠盐是一类重要的药物,甚至可用叶绿素铜钠盐用于治疗白血病。本文将从基本性质、制备工艺、含量测定等方面介绍叶绿素铜钠盐。[font='黑体'][size=18px]一、基本性质[/size][/font] [align=left]叶绿素,英文名Chlorophyllin,中文别名叶绿素镁钠盐 、叶绿酸粉末、 叶绿素铜三钠,呈墨绿色粉末,着色力强,色泽亮丽,其水溶液呈蓝绿色澄清透明液,[font='宋体'][size=13px][color=#000000]易溶于水,几乎不溶于低醇,不溶于氯仿。水溶液透明、无沉淀。在酸性情况下([/color][/size][/font][font='times new roman'][size=13px][color=#000000]pH 6.5 [/color][/size][/font][font='宋体'][size=13px][color=#000000]以下[/color][/size][/font][font='宋体'][size=9px][color=#000000])[/color][/size][/font][font='宋体'][size=13px][color=#000000]或钙离子存在时,则有沉淀析出。[/color][/size][/font]当其水溶液pH 值小于6 时,染液底部出现粉末状沉淀,这是由于平面空间结构的叶绿素铜钠分子在酸性条件下易于聚集 。叶绿素铜钠盐可以菠菜或蚕粪为原料,用丙酮或乙醇提取叶绿素,添加适量硫酸铜、叶绿素卟啉环中的镁原子被铜置换即生成。[/align]1.1物理化学性质沸点:801.6℃at 760 mmHg分子式:C[font='calibri'][size=13px]34[/size][/font]H[font='calibri'][size=13px]31[/size][/font]CuN[font='calibri'][size=13px]4[/size][/font]Na[font='calibri'][size=13px]3[/size][/font]O[font='calibri'][size=13px]6[/size][/font]分子量:724.148闪点:438.6℃储存条件:密封于2-8℃阴凉干燥处溶解性:易溶于水,略溶于醇和氯仿。[img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108061804161897_7669_1608728_3.png[/img] [img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108061804162109_5211_1608728_3.png[/img]1.2中毒症状和影响,急性和迟发效应系统性铜中毒症状包括:毛细血管损伤、头痛、冷汗、脉搏微弱、肝肾损伤、中枢神经系统兴奋继而抑制、黄疸、抽搐、麻痹和昏迷。休克和肾衰会导致死亡。慢性铜中毒包括肝硬化、脑损伤和脱髓鞘、肾损害;铜沉积在角膜引起人威尔逊病。还有报道铜毒性导致血红蛋白贫血和加剧动脉硬化。目前,其化学、物理和毒性性质尚未经完整的研究。1.3安全操作的注意事项在有粉尘生成的地方,提供合适的排风设备。1.4安全储存的条件,包括任何不兼容性贮存在阴凉处。 容器保持紧闭,储存在干燥通风处。建议的贮存温度:2 - 8℃,对光线敏感[font='黑体'][size=18px]二、制备工艺[/size][/font]工艺流程:原料→预处理→浸提→过滤→皂化→回收乙醇→石油醚洗涤→ 酸化铜代→抽滤水洗→ 溶解成盐→过滤→干燥→ 成品2.1方法一将富含叶绿素的原料( 国内生产以蚕沙为主) 于40~ 50℃烘干后,研细成粉末状。加粉末量3倍的乙醇丙酮混合液( 1/ 1)于40~45℃提取2.5h,抽滤,滤渣用同等体积乙醇丙酮的混合液再提取 一次。合并两次提取液并加NaOH 调pH 值为11,加热皂化( 50°C左右) 30min。皂化是否完全可用石油醚萃取来判断,上层液呈黄色即为皂化完全 。皂化完全后蒸馏浓缩回收混合液( 60°C左右) 直至体积为原来的1/4~ 1/ 3 即可。再用石油醚萃取4次。下层用盐酸调至pH 值为7,加硫酸铜后调pH值为2, 并在50℃下铜代2h。反应结束即有颗粒状沉淀形成,静置冷却。室温下收集沉淀, 先用50~ 60℃水洗涤,再用30% ~ 40% 的乙醇洗涤至乙醇层为浅绿色。再用石油醚洗涤至石油醚层为浅绿色。滤饼用丙酮溶解,用5%的NaOH 乙醇溶液沉淀,pH 值为12,收集沉淀,用无水乙醇洗涤即得产品。在制备过程中反应温度不易过高,调节pH 值时要小心,温度过高以及pH 值过大或过小都能使叶绿素分解 。此为百度文库提供的制备方法。通过查阅知网,我们了解到以下几种从不同原材料出发的制备叶绿素铜钠盐的方法。2.2方法二:螺旋藻制取叶绿素铜钠盐基本思路:利用硫酸铜对螺旋藻进行浸泡铜化,再用丙酮乙醇混合液浸提得到叶绿素的有机溶液,再经过皂化、萃取、浓缩、干燥等步骤将叶绿素改造为叶绿素铜钠盐。具体步骤:材料:螺旋藻主要试剂:AR乙醇(沸点 78.1℃),AR 丙酮(沸点 56.1℃),AR氢氧化钠,AR 石油醚,AR 盐酸,硫酸铜晶体(CuSO[font='calibri'][size=13px]4[/size][/font].5H[font='calibri'][size=13px]2[/size][/font]O),食盐,白砂糖,可溶性淀粉,用时配成各种所需浓度。工艺流程:螺旋藻→粉碎→铜化(5%CuSO[font='calibri'][size=13px]4[/size][/font]溶液)→洗涤、脱水→浸提(丙酮乙醇混合液)→过滤→浓缩→皂化(5%NaOH溶液)→萃取(石油醚)→干燥→叶绿素铜钠盐产品具体步骤:称量 5.0g 粉碎好的螺旋藻于试管中铜化 13h 后,洗涤脱水于锥形瓶中,加入 70:30 的丙酮乙醇混合液 300mL,加盖在室温下浸提 2h,过滤,浓缩,皂化(5%NaOH 溶液),萃取(石油醚),干燥,可制得墨绿色带金属光泽的叶绿素铜钠盐产品。该文献还对叶绿素铜钠盐的稳定性进行实验分析,实验结果表明,螺旋藻叶绿素铜钠盐的耐光性较较差,需在避光条件下保存;热稳定性较好,但不能高于85 ℃;不耐强酸;食盐、白砂糖、淀粉等食品添加剂无不良影响。2.3方法三:剑麻膏中叶绿素铜钠盐的制备基本思路:以从剑麻膏中萃取得到的叶绿素为原料,研究了酸化、铜代、皂化条件对叶绿素铜钠盐产率的影响。该文献指出,叶绿素铜钠盐的制备过程可分为两种,一种是先皂化,后铜代,目前大多数文献都采用这种方法,但由于叶绿素的耐酸性较差,所得产品纯度不够,产率不高 另一种是先铜代后皂化,即将提取出的叶绿素首先脱镁铜代,使叶绿素变成比较稳定的叶绿素铜,再经皂化成盐得到产品。这种方法对反应温度和时间的要求不太苛刻,有利于提高叶绿素的稳定性。故他们采用先铜代后皂化的方法,遵循节能降耗,提高效率的原则,对反应条件进行优化,并对所得叶绿素铜钠盐的性能和质量进行检测。实验试剂与仪器:剑麻膏,由广西武鸣东风农场提供 乙醇、丙酮、盐酸、氢氧化钠、石油醚、硫酸铜均为分析纯。BSA224S电子天平 FZ102 微型植物试样粉碎机 HH-2数显恒温水浴锅 723N可见分光光度计 R201L 旋转蒸发仪。具体步骤:[font='宋体']①[/font]叶绿素的提取称取30 g 剑麻膏于250 mL的三口烧瓶中,用 85% 的乙醇在 60 ℃水浴锅中提取3 h。提取液减压浓缩,得到含有叶绿素的提取膏状物。加入丙酮,萃取叶绿素,回收丙酮,得到叶绿素膏状物。[font='宋体']②[/font]叶绿素铜的制备 叶绿素加入少量乙醇溶解,用 10%的盐酸调 pH 为酸性,这时溶液由绿色变成黄褐色,酸化脱镁 45 min 后,边搅拌边加入10%CuSO[font='calibri'][size=13px]4[/size][/font]溶液进行铜代,有絮状沉淀生成,抽滤,用热水反复洗涤,得叶绿素铜。[font='宋体']③[/font]叶绿素铜钠盐的制备 叶绿素铜用少量乙醇溶解,加入 10% NaOH 溶液,75 ℃皂化 1 h,加入等量的石油醚,充分摇动,静置分层。除去上层黄色的叶黄素等脂溶性杂质,将下层深绿色的叶绿素铜钠盐收集于小烧杯中,水浴蒸干水分,在 60 ℃下烘干,即得目标产物。 该文献还讨论了酸化脱镁的条件优化,他们发现,叶绿素铜的产率随着溶液 pH 的增大而逐渐减小,pH>3时,产率下降。说明当 pH较大时,酸度不够,一部分叶绿素卟啉环中的镁离子没有脱落下来,导致叶绿素铜得率下降。所以,以pH =3 为宜。对于[font='fzktk--gbk1-00'][size=13px][color=#000000]酸化时间对叶绿素铜得率的影响[/color][/size][/font][font='fzktk--gbk1-00'][size=13px][color=#000000],研究发现[/color][/size][/font][font='ssj4'][size=13px][color=#000000],[/color][/size][/font]酸化时间超过 60 min 时,叶绿素铜的产率增大不太明显,说明酸化反应基本完成。为了节约实验时间,酸化时间以 60 min 为宜。对于酸化温度对叶绿素铜得率的影响,发现叶绿素铜得率在45-65℃随着酸化温度的升高呈上升趋势在65-85 ℃产率变化不大,超过85 ℃时,产率突然下降。可能是高温使叶绿素铜中的环状结构氧化,四吡咯环破坏而被降解,使叶绿素铜的产率降低。所以,酸化温度以65℃为宜。对于加铜量对叶绿素铜得率的影响,研究发现随着硫酸铜量的增加,叶绿素铜的得率增加,加入量大于 15 mL 时,增大幅度不明显,基本保持稳定。实验过程中还发现,加铜量太多时,溶液中游离铜的量也会增多,会延长叶绿素铜的洗涤时间。考虑到实验效率和能耗问题,加铜量以15 mL为宜。对于铜代时间对叶绿素铜得率的影响,研究发现叶绿素铜的得率随着铜代时间的延长呈增大趋势,铜代时间超过2h时,叶绿素铜得率的增大幅度不大。所以,铜代时间以2h为宜。对于皂化温度对叶绿素铜钠盐得率的影响,叶绿素铜钠盐的产率随着皂化温度的升高不断提高,当温度高于85℃时,产率稍有下降,这可能是因为生成的叶绿素铜钠盐在较高的温度下会部分分解,导致产率下降,为了保证叶绿素铜钠盐的质量,皂化温度选择75 ℃为宜。对于皂化时间对叶绿素铜钠盐得率的影响,研究发现叶绿素铜钠盐的得率随着皂化时 间的延长而增大,≥60 min 后得率趋于稳定。皂化时间较短时,用石油醚萃取的过程中,分层不明显,醚相呈绿色,说明没有皂化完全。所以,皂化时间以60 min 为宜。对于pH 对叶绿素铜钠盐得率的影响,研究发现,当pH>11 时,叶绿素铜钠盐的得率趋于稳定,在实验过程中发现,当 pH为9或10时,用石油醚萃取酯溶性物质时,界面会有固体颗粒,分层界面不清晰,醚相为绿色,这都是因加碱量不够,导致皂化不完全。所以,皂化时以pH = 12为宜。该文献还对叶绿素铜钠盐的性质进行了探究。对于耐光性,研究表明叶绿素铜钠盐在强光下不稳定,但与叶绿素相比,已经大大提高了耐光性。对于耐热性,实验结果为在90 ℃以内,叶绿素铜钠盐的吸光度基本保持不变,颜色均为绿色 温度高于90 ℃时,吸光度开始有下降趋势,但幅度不大,即使是在110 ℃时,叶绿素的保存率也为96.9%,说明叶绿素铜钠盐的耐热性还是比较理想的,可添加到处理温 度在100 ℃以内的食物中。对于耐酸碱性,从实验数据可以看出溶液的吸光度随着pH的增大而升高,pH在3~6 范围内,吸光度变化幅度不大,溶液颜色呈土绿色 pH = 7时,吸光度值有个比较大的跳跃 在 7~12 范围内,吸光度的变化幅度也不太大,溶液颜色呈碧绿色。在实验过程中发现,当 pH<3时,溶液中会出现大量沉淀,这可能是因为叶绿素铜钠盐在强酸条件下生成了不溶于水的叶绿素铜酸 当pH>11时,因碱性太强,加速脱酯反应,使叶绿素分解,溶液的吸光度迅速下降,但在碱性条件下,因不发生脱镁或碳环裂解反应,却能保持相对稳定的色泽,在使用中只要控制溶液 pH 值在近中性或偏碱水平,就能基本维持叶绿素铜钠盐的稳定性。综上可以得出,采用先铜代后皂化的方法制备叶绿素铜钠盐,即叶绿素提取出来后先脱镁铜代,增加中间产物的稳定性,在后续操作中,不必考虑因温度太高或时间太长而使叶绿素分解的问题,从而提高了产品的产率和纯度。从剑麻膏中萃取制备叶绿素铜钠盐的优化条件是: 酸化时 pH = 3,酸化时间 60 min,温 度 65 ℃ 铜代时硫酸铜加量1.5 g,时间2h 皂化时温度 75 ℃,时间 60 min,pH = 12。在此条件下,产率为 4.46% ,产品为墨绿色粉末,略带氨臭,易溶于水,水溶液呈绿色透明澄清液,微溶于或不溶于乙醇、乙醚、丙酮、氯仿等有机溶剂,有Ca[font='calibri'][size=13px]2+[/size][/font],Mg[font='calibri'][size=13px]2+[/size][/font]存在时,产品中会有少许白色沉淀,在空气中容易吸潮,应隔绝空气保存。[font='黑体'][size=18px]三、含量测定[/size][/font]3.1试剂与材料氢氧化钠乙酸铵甲醇冰乙酸聚酰胺粉:粒径0.150mm~0.180mm。3.2试剂配制氢氧化钠溶液(4mol/L):称取16.0g氢氧化钠,用水溶解并定容至100mL。氢氧化钠溶液(0.1mol/L):称取0.40g氢氧化钠,用水溶解并定容至100mL。乙酸铵缓冲溶液(0.2mol/L):称取7.708g乙酸铵,用水溶解并定容至500mL。解吸液:0.1mol/L氢氧化钠溶液+甲醇=1+10(体积比)。3.3标准溶液配制精确称取经105℃±1℃干燥至恒重并按其纯度折算为100%质量的叶绿素铜钠标准品0.0500g,用水溶解并定容至100mL棕色容量瓶中,此溶液浓度为500μg/mL,当天配制,避光保存。3.4标准工作溶液准确移取500μg/mL标准溶液10mL至100mL烧杯中,加入0.2mol/L的乙酸铵溶液30mL,用4mol/L氢氧化钠溶液和冰乙酸调pH5~6。加入3.0g聚酰胺粉,充分搅拌2min,避光静置5min用约20mL蒸馏水转移至 G3砂芯漏斗中抽滤,弃去滤液。用75mL 解吸液分3次解吸色素:每次倒入约25mL解吸液,浸泡2min,再振摇2min,抽滤并用20mL解吸液洗净抽滤瓶中残液。收集滤液,用解吸液定容至100mL,配制成浓度为50μg/mL的标准溶液,此溶液临用时配制。[font='e-bz'][size=12px][color=#000000] [/color][/size][/font]3.5被测样品溶液后期处理向含有被测样品粉末或样品浆液的100mL烧杯中加入0.2mol/L的乙酸铵溶液30mL,溶解并混匀样液,用4mol/L氢氧化钠溶液和冰乙酸调pH5~6。加入3.0g聚酰胺粉,充分搅拌2min。将样品溶液用约20mL60 ℃±2 ℃蒸馏水转移至 G3砂芯漏斗中抽滤,弃去滤液。再用75mL 解吸液分3次解吸色素,抽滤并用20mL解吸液洗净抽滤瓶中残液,收集滤液,用解吸液定容至100mL。3.6仪器条件测定波长:405nm。比色皿:1cm。3.7标准曲线的制作分别取标准工作液0mL、5.0mL、10mL、20mL、30mL、40mL、50mL至100mL容量中,用解吸液稀释至刻度,配制成浓度为 0μg/mL、5μg/mL、10μg/mL、20μg/mL、30μg/mL、40μg/mL、50μg/mL的标准系列。以0μg/mL溶液为空白,测定其吸光值。以浓度为横坐标,以吸光值为纵坐标绘制标准曲线。试样溶液的测定取经过前处理的样品的制备液,以标准曲线的0μg/mL为空白,测定其吸光值,根据标准曲线获得样品溶液中叶绿素铜钠的浓度。本标准检出限为0.001g/kg,定量限为0.005g/kg。3.8总铜含量试样处理[align=left][font='宋体'][size=13px][color=#000000]准确称取 [/color][/size][/font][font='times new roman'][size=13px][color=#000000]0.1g [/color][/size][/font][font='宋体'][size=13px][color=#000000]试样,精确至 [/color][/size][/font][font='times new roman'][size=13px][color=#000000]0.000 2g[/color][/size][/font][font='宋体'][size=13px][color=#000000],置于硅皿中,在不超过 [/color][/size][/font][font='times new roman'][size=13px][color=#000000]500[/color][/size][/font][font='宋体'][size=13px][color=#000000]℃下灼烧至无碳,用[/color][/size][/font][font='times new roman'][size=13px][color=#000000]1[/color][/size][/font][font='宋体'][size=13px][color=#000000]滴[/color][/size][/font][font='times new roman'][size=13px][color=#000000]~2 [/color][/size][/font][/align][font='宋体'][size=13px][color=#000000]滴硫酸湿润,再次灰化。用质量分数为[/color][/size][/font][font='times new roman'][size=13px][color=#000000]10%[/color][/size][/font][font='宋体'][size=13px][color=#000000]的盐酸溶液分[/color][/size][/font][font='times new roman'][size=13px][color=#000000]3[/color][/size][/font][font='宋体'][size=13px][color=#000000]次(每次[/color][/size][/font][font='times new roman'][size=13px][color=#000000]5mL[/color][/size][/font][font='宋体'][size=13px][color=#000000])煮沸溶解灰分,并过滤[/color][/size][/font]于100mL容量瓶中,冷却后用水定容至刻度,此为试样液。测定[align=left][font='宋体'][size=13px][color=#000000]除试样处理外,其他步骤按[/color][/size][/font][font='times new roman'][size=13px][color=#000000]GB/T 5009.13[/color][/size][/font][font='宋体'][size=13px][color=#000000]规定的方法测定。[/color][/size][/font][/align]游离铜含量3.9试样处理[align=left][font='宋体'][size=13px][color=#000000]准确称取[/color][/size][/font][font='times new roman'][size=13px][color=#000000]0.1g[/color][/size][/font][font='宋体'][size=13px][color=#000000]试样,加水约[/color][/size][/font][font='times new roman'][size=13px][color=#000000]50mL[/color][/size][/font][font='宋体'][size=13px][color=#000000]溶解后,用[/color][/size][/font][font='times new roman'][size=13px][color=#000000]1mol/L [/color][/size][/font][font='宋体'][size=13px][color=#000000]盐酸调节[/color][/size][/font][font='times new roman'][size=13px][color=#000000]pH[/color][/size][/font][font='宋体'][size=13px][color=#000000]至[/color][/size][/font][font='times new roman'][size=13px][color=#000000]4.0[/color][/size][/font][font='宋体'][size=13px][color=#000000],定容至[/color][/size][/font][font='times new roman'][size=13px][color=#000000]100mL[/color][/size][/font][font='宋体'][size=13px][color=#000000],过 [/color][/size][/font][/align][align=left][font='宋体'][size=13px][color=#000000]滤,此为试样液。[/color][/size][/font][/align]测定[align=left][font='宋体'][size=13px][color=#000000]除试样处理外,其他步骤按[/color][/size][/font][font='times new roman'][size=13px][color=#000000]GB/T 5009.13[/color][/size][/font][font='宋体'][size=13px][color=#000000]规定的方法测定。[/color][/size][/font][/align]参考文献[align=left][font='宋体'][size=13px][color=#000000]【1】韩敏.直接皂化法制备叶绿素铜钠盐[J].应用化工,:,2014.43(4):704-707.[/color][/size][/font][/align][align=left][font='宋体'][size=13px][color=#000000]【2】赖海涛.螺旋藻制取叶绿素铜钠盐的稳定性研究[J].化学工程与装备,:,2020.3(3):14-15.[/color][/size][/font][/align][align=left][font='宋体'][size=13px][color=#000000]【3】李祥.剑麻膏中叶绿素铜钠盐的制备及性能测定[J].应 用 化 工,:,2018.47(2):262-267.[/color][/size][/font][/align][align=left][/align][align=left][/align][align=left][/align]
叶绿素测定仪是一种用于测量植物或其他生物样品中叶绿素含量的仪器。叶绿素是植物中的关键色素之一,它在光合作用中扮演着重要的角色,将光能转化为化学能。测定叶绿素含量可以用来评估植物的生长状况、健康状态以及光合作用效率。 叶绿素测定仪在许多领域都有广泛的应用,主要涉及到植物生长、生态系统研究、环境监测和农业等。以下是叶绿素测定仪的一些主要应用范围: 植物生长与健康评估: 叶绿素测定仪可以用于评估植物的健康状况和生长状态。通过测量叶绿素含量,可以推断出植物的光合作用活性、养分吸收能力以及受到的环境影响。 农业领域: 叶绿素测定仪在农业中被用来监测作物的生长情况和健康状态。这有助于决定适宜的施肥、灌溉和其他农业管理措施,以提高农作物产量和质量。 生态学研究: 叶绿素测定仪在生态系统研究中非常有用。通过对植物叶片和水体中叶绿素的测量,可以了解生态系统的光合作用活动、能量流动和生态链的结构。 水质监测: 叶绿素测定仪可用于评估水体中的藻类和蓝藻数量,从而判断水体的富营养化程度和水质。这对于保护水体生态平衡和提供饮用水质量至关重要。 环境污染监测: 叶绿素测定仪可以用于检测污染物对植物生长和光合作用的影响。它们可以帮助监测工业排放、空气污染和土壤污染等对环境的影响。 生物学研究: 叶绿素测定仪在生物学领域中用于研究不同生物体中叶绿素的含量和分布,如藻类、植物、海洋生物等。 教育与科普: 叶绿素测定仪也可用于教育和科普活动,帮助人们理解光合作用的基本原理以及叶绿素在生态系统中的作用。 总之,叶绿素测定仪在植物学、生态学、环境科学、农业和生物学等多个领域中都发挥着重要作用,帮助人们更好地了解和评估生态系统、植物健康和环境状况。
我们准备扩叶绿素a,标准要求离心用15ml玻璃离心管,但公司买的离心机15ml规格的只有pp管(按参数定制了玻璃管也放不进去),想问下各位有没有类似的情况,能不能用pp管做,谢谢
对于入射X射线 (待测元素特征射线):1.其能量大小通过脉冲高度或幅度来表征,脉冲高度正比于入射光子能量~~这个我基本能理解啦。2.进入探测器的光子变化率和探测到的脉冲变化率相关~~光子变化率是指入射X射线强度,即待测元素特征射线强度吧?3.脉冲高度分布,如何体现特征射线的能量和强度呢?
各位老师,关于水质叶绿素a检测有些问题想请教大家。根据HJ 897-2017S水质叶绿素a的测定 -分光光度法,在实际操作中发现,加标回收率超级高,高达300%多,我的加标操作过程为:1、将标品(sigma,C6144)用90%丙酮溶解,定容100mL棕色容量瓶,即为10mg/mL;2、取200mL水样过滤,滤膜吸干水分于-20℃保存;3、隔天取200ul标品溶液,滴加到样品滤膜上,分两次加入3ml地90%丙酮,研磨5min,将研磨液置于试管中,并用90%丙酮冲洗研磨器,定容至10ml;4、试管置于4℃避光静置4h,期间震荡3次;5、离心,取上清液过膜,以90%丙酮为参比,测定样品吸光度。 后期又用空白膜实验一次,发现回收率也超过300%,自己实在想不出哪里出了问题,请各位老师指教,谢谢大家
各位老师,关于水质叶绿素a检测有些问题想请教大家。根据HJ 897-2017S水质叶绿素a的测定 -分光光度法,在实际操作中发现,加标回收率超级高,高达300%多,我的加标操作过程为:1、将标品(sigma,C6144)用90%丙酮溶解,定容100mL棕色容量瓶,即为10mg/mL;2、取200mL水样过滤,滤膜吸干水分于-20℃保存;3、隔天取200ul标品溶液,滴加到样品滤膜上,分两次加入3ml地90%丙酮,研磨5min,将研磨液置于试管中,并用90%丙酮冲洗研磨器,定容至10ml;4、试管置于4℃避光静置4h,期间震荡3次;5、离心,取上清液过膜,以90%丙酮为参比,测定样品吸光度。 后期又用空白膜实验一次,发现回收率也超过300%,自己实在想不出哪里出了问题,请各位老师指教,谢谢大家