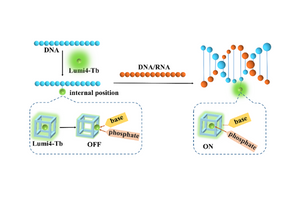
广州大学王家海教授在体外诊断领域(核酸传感器)取得系统性进展
王家海教授在过去十多年,对核酸探针进行了系统的探索,开发了一系列基于核酸纳米结构或者G-quadruplex为主题的核酸传感器,开发了生物芯片新的修饰方法,设计了一种的Insertion Approach,极大地提高了传感器电信号重现性,2021年王家海团队构建了以三维核酸纳米结构为信号传导载体的纳米孔传感器。团队另外一个方向纳米孔单分子计数器和整流器平台的发展,也充分得益于我们在功能核酸探针上所开展的系统性工作。体外诊断,尤其是分子诊断离不开对探针的设计。在功能化核酸探针的优化和设计上,我们做出了一系列有特色的工作。运用核酸四链体(G-quadruplex)构建了探测各种离子,小分子的高灵敏,高选择性的生物化学传感器,并被国际刊物邀请撰写综述。为纳米孔的可控功能化,选择性识别打下了坚实的基础。最终优化设计的核酸探针需要参考如下标准:更好的检测限,选择性,更高的稳定性,更稳更强的信号放大系统和更好的实验信号重现性。我们设计的能结合荧光分子的G-quadruplex能对铜离子,钾离子和毒素小分子灵敏探测(G-quadruplex facilitated turn off fluorescent chemosensor for selective detection of copper ion. Chem. Commun., 2010, 46, 7385-7387. Qin Haixia,Ren Jiangtao,Wang Jiahai*,Wang Erkang*;G-quadruplex-modulated fluorescence detection of potassium ion in the presence of 3500-fold excess of sodium ion , Anal. Chem., 2010, 82 (19), pp 8356–8360. Qin Haixia,Ren Jiangtao,Wang Jiahai*,Wang Erkang*.;图 1.四链体核酸高灵敏检测K离子图 2.四链体核酸高灵敏检测Cu离子PVP-coated Graphene oxide for Selective Determination of Ochratoxin A via Quenching Fluorescence of Free Aptamer,Biosensor and Bioelectronics, 2011, 26, 3494-3499. Sheng LinFeng, Ren Jiangtao, Miao Yuqing, JiaHai Wang* Erkang Wang*.)。其中对真菌毒素小分子OTA的检测,他引已经超过100多次,对钾离子的探测选择性达到3500倍,他引超过50多次。后续的工作中,可以探索用纳米孔结合这些探针进行检测。图 3. 对真菌毒素小分子OTA的检测可以预期的是修饰适配体的纳米孔可以结合离子整流区分手型多肽(Enantioselective and label-free detection of oligopeptide via fluorescent indicator displacement” Biosensor and Bioelectronics, 2012, 35, 401-406. Ren Jiangtao, Jiahai Wang*, Jin Wang*, Nathan W. Luedtke, Erkang Wang*.)图 4. 手性多肽的检测设计了劈开的G-quadruplex探针对病毒核酸小片段进行了探测,并对其机理做了详细的阐述(Label-Free Detection of Nucleic Acids by Turn-ON and Turn-OFF G-Quadruplex Mediated Fluorescence. Analytical and Bioanalytical Chemistry, 2011, 399:2763-2770. Ren Jiangtao, Qin Haixia, Wang Jiahai*, Luedtke, Nathan W, Wang ErKang*, Wang Jin*;Contribution of potassium ion and split modes of G-qaudruplex to the sensitivity and selectivity of label-free sensor toward DNA detection using fluorescence Biosensor and Bioelectronics, 2012, 31, 316-322. Ren Jiangtao, Jiahai Wang*, Jin Wang*, Nathan W. Luedtke, Erkang Wang*.)。有理由相信,对这类探针了解的越多,将其应用在纳米孔上的机会越多:譬如G-quadruplex的重新组装引起局部体积和局部电荷的变化,这都是纳米孔传感器很重要的特征。图 5.分裂式探针有三种,在乙肝病毒基因存在下,四链体核酸可以被激活根据多年的经验和大胆展望,体外诊断(分析化学)的进一步发展还离不开探针体系本身的优化和信号放大。2011年我们建立了两种核酸马达,运用A方案组建了一个免标记的核酸传感器,该方法可以扩展到探测其他一些小分子,譬如毒素。运用B方案建立的另一个马达可以把四极子(G-quadruplex)加入到核酸纳米结构中,应用前景广泛;可以进一步把核酸纳米结构组装成三维结构用于药物释放(Kinetically grafting G-qaudruplex onto DNA nanostructure as structure and function encoding via DNA machine,Chem. Commun., 2011, 47, 10563–10565. Jiangtao Ren, Jiahai Wang* , Lei Han, Erkang Wang*, Jin Wang* .)。图6. 这个体系中A途径可以用于生物分子的探测的信号放大,这个体系中B途径有很强的扩展性,可以用于制备其他一些智能化材料或者信号放大免标记,免修饰方法并不能覆盖全部探测对象,其他绝大多数探测系统都需要表面探针修饰。2014年我们发展了一种新的表面修饰方法,极大地提高了分子表面组装和信号放大的重现性(Insertion Approach:Bolstering the Reproducibility of Electrochemical Signal Amplified via DNA Superstructure Analytical Chemistry 2014, 86, 4657-4662. Yang, Li, Zhang, Caihua, Hong, Jiang, Li, Guijuan*, Jiahai Wang*, Wang, Erkang*.)。通常在金电极上修饰核酸探针,都是先修饰巯基核酸,然后修饰小分子覆盖的空白区域。但这种方法重现性并不高。我们设计了一种新方法,先修饰小分子,后修饰核酸探针是通过插入小分子空白区域。发现核酸超级结构在电极表面的组装就有非常好的重现性。期待这种方法能在将来运用到纳米孔表面的内部修饰。图 7.核酸修饰新方法(Insertion Approach)2021年,构建了以三维核酸纳米结构为信号传导载体的纳米孔传感器。(Insertion Approach:Bolstering the Reproducibility of Electrochemical Signal Amplified via DNA Superstructure Analytical Chemistry 2014, 86, 4657-4662.)。小尺寸分析物的检测仍然是限制固态纳米孔应用的主要挑战之一。要实现具有良好抗干扰能力、高信噪比和可重复使用的固态纳米孔传感器,一种潜在的策略是使用大孔径纳米孔(直径大于10 nm)。孔径远大于靶标和干扰物的尺寸,可以满足干扰物通过纳米孔无电阻脉冲的要求,解决了孔堵塞问题。DNA纳米结构具有精确形状和可调节大小等优点,有潜力成为最通用的一种。可以根据特定的孔径组装出尺寸均匀的DNA纳米结构。另外,CRISPR-Cas12a已被证明是一种优秀的信号放大策略,Cas12a通过将序列特异性靶标转化为其他可检测信号,如荧光、生物发光或比色信号,被广泛应用于生物传感器的设计中。图8 基于CRISPR-cas12a转换机制,使用DNA四面体作为信号传导载体的固态纳米孔传感器示意图。对于目标分子,Cas12a的反分裂活性导致连接器ssDNA的降解,导致DNA四面体信号传导载体通过纳米孔的易位率增加;如果没有目标分子,Cas12a就不会被激活,因此DNA四面体信号传导载体被磁铁拉下,不能观察到任何易位事件