如何配制EDTA钠盐缓冲溶液,pH值8左右因工作需要,需配制EDTA缓冲溶液,拟用于解决土壤中硼中毒的问题。要求EDTA钠盐缓冲溶液pH值为8左右,浓度为0.05mol/L不知道这能否起到缓解土壤硼中毒的作用啊。
哪位大师帮帮忙,土壤缓冲容量有没有检测分析方法,如何计算
石灰性土壤又称碱性土壤,是土壤剖面中含有碳酸钙或碳酸氢钙等石灰性物质的土壤的总称。在我国多分布于北部和西北部半湿润、半干旱和干旱地区。其成土母质多为黄土状沉积物和石灰岩风化物。碳酸钙在剖面中的分布,根据不同的成土条件,有的与土壤均匀混合,有的沿土壤孔隙以菌丝或皮膜状的白色析出物存在,有的形成硬结核,还有的在一定深度形成碳酸盐积聚层,称为钙积层(calcic horizon)或石灰结盘层(calcareous hardpan)。石灰性土壤中盐基高度饱和,呈中性至碱性反应,土壤中含碳酸钙含量多少,可以影响许多重金属元素在土壤环境中的行为。如镉在碱性土壤中易形成难溶性氢氧化物,毒性降低。铬、镉等重金属在碱性土壤中的环境容量比在酸性土壤中高。
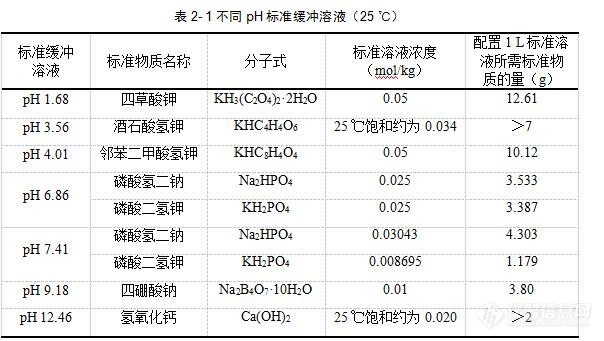
[font=宋体]发帖人:天涯就是天地[/font][font=宋体]链接:[/font][u][font=宋体][color=#0000ff][font=Times New Roman]https://bbs.instrument.com.cn/topic/2775092[/font][/color][/font][/u][font=黑体][b]问题描述:[/b][/font][font=宋体] [/font][font='Times New Roman'] [/font][font=宋体][font=宋体]土壤[/font][font=Times New Roman]pH[/font][font=宋体]测定时每次都要校正[/font][font=Times New Roman]pH[/font][font=宋体]计?校正[/font][font=Times New Roman]pH[/font][font=宋体]计的缓冲液是自己配制的?还是市场购买?[/font][font=Times New Roman]pH[/font][font=宋体]电极不用时应该怎么保存?[/font][/font][font=黑体][b]解答:[/b][/font][font=宋体] [/font][font='Times New Roman'] [/font][font=宋体][font=宋体]每次测量前均需对[/font][font=Times New Roman]pH[/font][font=宋体]计进行校准。每测[/font][font=Times New Roman]5~6[/font][font=宋体]个样品后,需用标准缓冲溶液检查或校准定位。标准缓冲溶液可以自己配制,也可以购买市售标准物质。根据实际需要,可以选择其他[/font][font=Times New Roman]pH[/font][font=宋体]标准缓冲溶液,选择的标准缓冲溶液应与样品的[/font][font=Times New Roman]pH[/font][font=宋体]值相近,详细信息可参考《土壤[/font][/font][font='Times New Roman'] [/font][font=宋体][font=Times New Roman]pH[/font][font=宋体]值的测定[/font][/font][font='Times New Roman'] [/font][font=宋体]电位法》([/font][font=Times New Roman]HJ 962-2018[/font][font=宋体])附录[/font][font=Times New Roman]A[/font][font=宋体]:[img=,604,341]https://ng1.17img.cn/bbsfiles/images/2023/03/202303202152113623_4731_3389662_3.jpg!w604x341.jpg[/img][font=宋体]目前实验室常用的电极都是复合电极,其优点是使用方便,不受氧化性或还原性物质的影响,且平衡速度较快。使用前,检查电极前端的球泡。正常情况下,电极应该透明而无裂纹;球泡内要充满溶液,不能有气泡存在。使用时,将电极加液口上所套的橡胶套和下端的橡皮套全部取下,以保持电极内氯化钾溶液的液压差(非可充式的复合电极可省略此步)。[/font][font=宋体][font=宋体]复合电极不用时,可充分浸泡于氯化钾溶液中(切忌用洗涤液或其他吸水性试剂浸洗,严禁在脱水性介质如无水乙醇或重铬酸钾等中使用。)可充式电极的电极保护套内的[/font][font=Times New Roman]KCl[/font][font=宋体]溶液要及时补充,不能干涸,且每隔一段时间就应对[/font][font=Times New Roman]pH[/font][font=宋体]电极进行保养。[/font][/font][font=宋体] [/font][font='Times New Roman'] [/font][font=宋体][font=宋体]长时间存放不用的玻璃电极需要在水中浸泡[/font][font=Times New Roman]24[/font][/font][font='Times New Roman'] [/font][font=宋体][font=Times New Roman]h[/font][font=宋体],使之活化后才能使用。玻璃电极表面受到污染时,需进行处理。甘汞电极腔内要充满饱和氯化钾溶液,在室温下应该有少许氯化钾结晶存在,但氯化钾结晶不宜过多,以防堵塞电极与被测溶液的通路。玻璃电极的内电极与球泡之间、甘汞电极内电极和多孔陶瓷末端芯之间不得有气泡。[/font][/font][/font]
土壤中存在着各种化学和生物化学反应,表现出不同的酸性或碱性。划分为9等级。 9.5极强碱性。 l 我国土壤pH大多在4.5~8.5范围内,由南向北pH值递增,长江(北纬33°)以南的土壤多为酸性和强酸性,如华南、西南地区广泛分布的红壤、黄壤,pH值大多在4.5~5.5之间;华中华东地区的红壤,pH值在5.5~6.5之间;长江以北的土壤多为中性或碱性,如华北、西北的土壤大多含CaCO3,PH值一般在7.5~8.5之间,少数强碱性土壤的pH值高达10.5。 [size=4][b]1.土壤酸度:[/b][/size] 根据土壤中H离子的存在方式,土壤酸度可分为两大类。 [b](1)活性酸度[/b]:土壤溶液中氢离子浓度的直接反映,又称为有效酸度,通常用pH表示。 [b]活性酸度[/b]的来源,主要是CO2溶于水形成的碳酸和有机物质分解产生的有机酸,以及土壤中矿物质氧化产生的无机酸,还有施用的无机肥料中残留的无机酸,如硝酸、硫酸和磷酸等。此外,由于大气污染形成的大气酸沉降,也会使土壤酸化,所以它也是土壤活性酸度的一个重要来源。 [b](2)潜性酸度[/b]:土壤潜性酸度是土壤胶体吸附的可代换性H和Al的反映。当这些离子处于吸附状态时,是不显酸性的,但当它们通过离子交换作用进入土壤溶液之后,即可增加土壤溶液的H浓度,使土壤pH值降低。只有盐基不饱和土壤才有潜性酸度,其大小与土壤代换量和盐基饱和度有关。 潜性酸度分为代换性酸度和水解酸度。 Ø [b]代换性酸度[/b]:用过量中性盐(如NaCl或KCl)溶液淋洗土壤,溶液中金属离子与土壤中H和Al发生离子交换作用,而表现出的酸度,称为代换性酸度。代换性Al是矿物质土壤中潜性酸度的主要来源。例如,红壤的潜性酸度95%以上是由代换性Al产生的。由于土壤酸度过高,造成铝硅酸盐晶格内铝氢氧八面体的破裂,使晶格中的Al释放出来,变成代换性Al。 Ø [b]水解性酸度[/b]:用弱酸强碱盐(如醋酸钠)淋洗土壤,溶液中金属离子可以将土壤胶体吸附的H、Al代换出来,同时生成某弱酸(醋酸)。此时,所测定出的该弱酸的酸度称为水解性酸度。由于生成的醋酸分子离解度很小,而氢氧化钠可以完全离解。氢氧化钠离解后,所生成的钠离子浓度很高,可以代换出绝大部分吸附的H和Al。 [b](3)活性酸度与潜性酸度的关系[/b]:活性酸度与潜性酸度是同一个平衡体系的两种酸度。二者可以互相转化,在一定条件下处于暂时平衡状态。土壤活性酸度是土壤酸度的根本起点和现实表现。土壤胶体是H和Al的贮存库,潜性酸度则是活性酸度的贮备,土壤的潜性酸度往往比活性酸度大得多,二者的比例,在砂土中约为1000;在[url=http://baike.baidu.com/view/1053488.htm]有机质[/url]丰富的粘土中则可高达5×10—1×10。 [size=4][b]2.土壤碱度[/b][/size] l 土壤溶液中OH离子的主要来源,是CO3和HCO3的碱金属(Na、K)及碱土金属(Ca、Mg)的盐类。[b]碳酸盐碱度和重碳酸盐度的总和称为总碱度[/b]。可用中和滴定法测定。 l 不同溶解度的碳酸盐和重碳酸盐对土壤碱性的贡献不同,CaCO3和MgCO3的溶解度很小,在正常的CO2分压下,它们在土壤溶液中的浓度很低,故富含CaCO3和MgCO3的石灰性土壤呈弱碱性(pH7.5~8.5);Na2CO3、NaHCO3及Ca(HCO3)2等都是水溶性盐类,可以大量出现在土壤溶液中,使土壤溶液中的总碱度很高,从土壤pH来看,含Na2CO3的土壤,其pH值一般较高,可达10以上,而含NaHCO3及Ca(HCO3)2的土壤,其pH值常在7.5~8.5,碱性软弱。 l 当土壤胶体上吸附的Na、K、Mg(主要是Na)等离子的饱和度增加到一定程度时,会引起交换性阳离子的水解作用: 土壤胶体(x Na)+yH2O=土壤胶体((x –y)Na、yH)+yNaOH 在土壤溶液中产生NaOH,使土壤呈碱性。此时Na离子饱和度称为土壤碱化度。 [size=4][b]3.土壤的缓冲性能[/b][/size] 土壤缓冲性能是指土壤具有缓和其酸碱度发生激烈变化的能力,它可以保持土壤反应的相对稳定,为植物生长和土壤生物的活动创造比较稳定的生活环境,所以土壤的缓冲性能是土壤的重要性质之一。 [b](1)土壤溶液的缓冲作用[/b]:土壤溶液中含有碳酸、硅酸、磷酸、腐殖酸和其他有机酸等弱酸及其盐类,构成一个良好的缓冲体系,对酸碱具有缓冲作用。 Ø 碳酸及其钠盐。 当加入盐酸时,碳酸钠与它作用,生成中性盐和碳酸,大大抑制了土壤酸度的提高。 Na2CO3+2HCL=2NaCL+ H2CO3 当加大Ca(OH)2时,碳酸与它作用,生成溶解度较小的碳酸钙,限制了土壤碱度。 H2CO3+Ca(OH)2= CaCO3+ 2H2O Ø 土壤中的某些有机酸(如氨基酸、胡敏酸等)是两性物质,具有缓冲作用,如氨基酸含氨基和羧基可分别中和酸和碱,从而对酸和碱都具有缓冲能力。 R-CH(NH2)(COOH)+HCL= R-CH(NH3CL)(COOH) R-CH(NH2)(COOH)+NaOH= R-CH(NH2)(COONa)+ H2O [b](2)土壤胶体的缓冲作用[/b]:土壤胶体吸附有各种阳离子,其中盐基离子和氢离子能分别对酸和碱起缓冲作用。 Ø 对酸的缓冲作用 (以M代表盐基离子) 土壤胶体-M+ HCL=土壤胶体-H+ MCL Ø 对碱的缓冲作用 土壤胶体-H+ MOH=土壤胶体-M+ H2O 土壤胶体的数量和盐基代换量越大,土壤的缓冲性能就越强。因此,砂土掺粘土及施用各种有机肥料,都是提高土壤缓冲性能的有效措施。在代换量相等的条件下,盐基饱和度愈高,土壤对酸的缓冲能力愈大;反之,盐基饱和度愈低,土壤对碱的缓冲能力愈大。 Ø 铝离子对碱的缓冲作用:在PH5.5,铝离子开始形成Al(OH)3沉淀,失去缓冲能力。 土壤酸碱性对植物的影响 1、大多数植物在pH9.0或2.5的情况下都难以生长。植物可在很宽的范围内正常生长,但各种植物有自己适宜的pH。 喜酸植物:杜鹃属、越桔属、茶花属、杉木、松树、橡胶树、帚石兰; 喜钙植物:紫花苜蓿、草木犀、南天竺、柏属、椴树、榆树等; 喜盐碱植物:柽柳、沙枣、枸杞等。 2、植物病虫害与土壤酸碱性直接相关: 1)地下害虫往往要求一定范围的pH环境条件如竹蝗喜酸而金龟子喜碱; 2)有些病害只在一定的pH值范围内发作,如悴倒病往往在碱性和中性土壤上发生。 3、土壤活性铝:土壤胶体上吸附的交换性铝和土壤溶液中的铝离子,它是一个重要的生态因子,对自然植被的分布、生长和演替有重大影响; 在强酸性土壤中含铝多,生活在这类土壤上的植物往往耐铝甚至喜铝(帚石兰、茶树);但对于一些植物来说,如三叶草、紫花苜蓿,铝是有毒性的,土壤中富铝时生长受抑制;研究表明铝中毒是人工林地力衰退的一个重要原因。 二、土壤酸碱性对养分有效性的影响 1、在正常范围内,植物对土壤酸碱性敏感的原因,是由于土壤pH值影响土壤溶液中各种离子的浓度,影响各种元素对植物的有效性; 2、土壤酸碱性对营养元素有效性的影响: (1)氮在6~8时有效性较高,是由于在小于6时,固氮菌活动降低,而大于8时,硝化作用受到抑制; (2)磷在6.5~7.5时有效性较高,由于在小于6.5时,易形成磷酸铁、磷酸铝,有效性降低,在高于7.5时,则易形成磷酸二氢钙; 无机磷的固定 (3)酸性土壤的淋溶作用强烈,钾、钙、镁容易流失,导致这些元素缺乏。在pH高于8.5时,土壤钠离子增加,钙、镁离子被取代形成碳酸盐沉淀,因此钙、镁的有效性在pH6-8时最好; (4)铁、锰、铜、锌、钴五种微量元素在酸性土壤中因可溶而有效性高;钼酸盐不溶于酸而溶于碱,在酸性土壤中易缺乏;硼酸盐在pH5-7.5时有效性较好。 三、土壤酸碱性的改良 1、土壤酸性土改良 经常使用石灰。达到中和活性酸、潜性酸、改良土壤结构的目的。 沿海地区使用含钙的贝壳灰。也可用紫色页岩粉、粉煤灰、草木灰等。 石灰施用量 生石灰需要量(g/m2 )=阳离子代换量*(1—盐基饱和度)*土壤重量*28*1/1000 2、中性和石灰性土壤的人工酸化 露地花卉可用硫磺粉(50g/平方米)或硫酸亚铁(150克/平方米),可降低0.5——1个pH单位。也可用矾肥水浇制。 3、碱性土壤 施用石膏,还可用磷石膏、硫酸亚铁、硫磺粉、酸性风化煤。
如何EDTA钠盐缓冲溶液,pH值8左右因工作需要,需配制EDTA缓冲溶液,拟用于解决土壤中硼中毒的问题。要求EDTA钠盐缓冲溶液pH值为8左右,浓度为0.05mol/L不知道这能否起到缓解土壤硼中毒的作用啊。
缓冲溶液是怎么一回事每次做能力验证,都怕通过不了发愁,有的人为了方便通过,就选择一个简单的项目,比如pH等等。pH值是很难稳定的,经典的滴定分析中误差千分之一,所造成的突跃范围为4.30到9.70,达到了5.4个浓度单位。所以在这种体系中,想要测酸度也是很难的。所谓缓冲溶液,是指对溶液的酸度有稳定性作用的溶液。当向其中加入少量的酸碱的时候,或者稀释一定量的时候,其溶液的酸度基本上是保持不变的。我们常用的缓冲溶液是在酸度计的校正过程中使用的混合磷酸盐和邻苯二甲酸氢钾缓冲,他们的pH分别是6.86和4.00。配制该缓冲溶液的时候,你一不小心洒了一点,其实对这个体系没有什么影响。缓冲溶液的特性决定了体系的稳定性。作为缓冲溶液,本身有一个缓冲范围,只有pH在这个范围内,缓冲溶液才有缓冲效果,即其pKa值正负1的范围内。有一次,一位同事要配制4.0的错酸铵缓冲溶液,其酸度调节剂是醋酸,她加了几滴没反应,再加还是没反应,我就用分析化学的原理和她说,缓冲溶液非常稳定,是比值的对数关系,你只管加就行了。最后加了很多酸,才达到需要的酸度。按照缓冲溶液的基本公式,只是和缓冲溶液离子对的浓度比值有关系,和浓度没有关系,这个就错了。还有个缓冲容量的问题,不可能一滴缓冲溶液滴到大海里,整个大海的pH都随其发生改变。什么情况下缓冲溶液的缓冲效果最好呢?就是要在缓冲容量的范围内,通常情况下缓冲组分的浓度值在0.01-1mol/L之间。缓冲溶液浓度过大会增加离子的强度,对体系还是有副作用的。生命体本身是一个稳定的体系,也是一个缓冲体系。所以我们体内的各项生理指标相对稳定,目前缓冲溶液在生物化学的研究中具有重要的研究意义。我们单位检测的番茄酱产品,其pH也大多数情况下稳定在4.2左右。说到这块,我又想到当年的一个笑话,就是用pH试纸测定5%盐酸的酸度,其结果肯定是酸性结果。试纸只能测定正常生命体系的pH,化学条件下的酸度,还是要依赖于酸度计进行检测。试纸可以测测自来水的酸度,也可以测测苹果的酸度
[font=黑体][b]问题描述:[/b][/font][font=宋体][font=宋体]《土壤质量[/font] [font=宋体]氟化物的测定[/font] [font=宋体]离子选择电极法》([/font][/font][font='Times New Roman']GB[/font][font=宋体][font=Times New Roman]/T [/font][/font][font='Times New Roman']22104-2008[/font][font=宋体][font=宋体])中总离子强度缓冲液([/font][font=Times New Roman]TISAB[/font][font=宋体])使用了两种不同配置方法,但是并未明确指出应该使用哪一种,是否表明任何一种配制方法都可以?[/font][/font][font='Times New Roman'][font=黑体][b]解答:[/b][/font][/font][font=宋体][font=宋体]总离子强度缓冲液([/font][font=Times New Roman]TISAB[/font][font=宋体])在土壤氟离子测定过程中的主要作用是消除待测液中[/font][/font][font=宋体][font=Times New Roman]Fe[/font][/font][sup][font=宋体][font=Times New Roman]3+[/font][/font][/sup][font=宋体][font=宋体]和[/font][font=Times New Roman]Al[/font][/font][sup][font=宋体][font=Times New Roman]3+[/font][/font][/sup][font=宋体][font=宋体]的干扰,土壤中[/font][font=Times New Roman]Fe[/font][font=宋体]、[/font][font=Times New Roman]Al[/font][font=宋体]干扰离子的强度一般时,两种不同[/font][/font][font=宋体]总离子强度缓冲液[/font][font=宋体][font=宋体]柠檬酸钠([/font][font=Times New Roman]TISABI[/font][font=宋体])和钛铁试剂([/font][font=Times New Roman]TISAB[/font][font=宋体]Ⅱ)均能满足要求,使用其中任何一种配置方法都可以。实验表明,当土壤中[/font][font=Times New Roman]Fe[/font][font=宋体]、[/font][font=Times New Roman]Al[/font][font=宋体]干扰离子的强度较高时,两种不同[/font][/font][font=宋体]总离子强度缓冲液[/font][font=宋体][font=宋体]柠檬酸钠([/font][font=Times New Roman]TISABI[/font][font=宋体])和钛铁试剂([/font][font=Times New Roman]TISAB[/font][font=宋体]Ⅱ)在消除[/font][font=Times New Roman]Fe[/font][/font][sup][font=宋体][font=Times New Roman]3+[/font][/font][/sup][font=宋体][font=宋体]的干扰均能达到很好的效果,而在消除[/font][font=Times New Roman]Al[/font][/font][sup][font=宋体][font=Times New Roman]3+[/font][/font][/sup][font=宋体]干扰方面[/font][font=宋体]总离子强度缓冲液[/font][font=宋体][font=宋体]柠檬酸钠([/font][font=Times New Roman]TISABI[/font][font=宋体])比钛铁试剂([/font][font=Times New Roman]TISAB[/font][font=宋体]Ⅱ)效果好。[/font][/font]
急求教:石灰性土壤属酸性土壤还是碱性土壤?谢谢回复!
第一次做土壤水溶性氟化物,疑问有四,恳请各位大神解答:1,标准曲线不调节pH,土壤样品要调节pH,步骤不完全相同,为什么?2,缓冲溶液调节pH范围是5-6,可是加入到标准溶液中定容后,试液的pH>7,该怎么办?3,土壤浸提离心后,取10ml到50ml容量瓶中,加入2滴溴甲酚紫指示剂,是紫色的,加入盐酸至刚变为黄色,怎么加了缓冲溶液后又变成紫色了呢?如果这个时候再加酸,调节至黄色,测得的KB值要比不调pH的标曲KB值大不少,而加缓冲溶液后变为紫色不再加酸调节,而是继续加水定容,kb测定值和标准kb很接近。请问哪一种方法合适?4,称5g土加入50ml水,25℃超声30min,取10ml浸提液用盐酸调节ph后加缓冲溶液后变为紫色不再加酸调节,而是继续加水定容。这时测的值偏低很多,请问有哪些方面的原因?谢谢!!!!!
缓冲溶液浓度变大,迁移时间一定变长?
在土壤分析书上经常看到石灰性土壤这个词,想请教具体含义是什么?怎么快速判断一份土壤样品是否是石灰性,还有盐碱土?
对溶液的酸度起稳定作用的溶液叫缓冲溶液。缓冲溶液能调节和控制备稳定溶液的PH值,其PH值不因加入酸、碱,或稀释而产生显著变化。如测硬度时,使用NH3.H2O-NH4Ci缓冲溶液,当溶液中产生少量H-时,H++OH- H2O,使溶液中﹝OH-﹞减少,NH3.H2O NH4+-OH-的反应向右进行,溶液中的OH-含量不会显著的减少。当溶液中产生少量OH-时,OH-+ NH4+ NH3.H2O的反应向右进行,溶液中的OH-含量不会显著增加,当溶液稀释时,H+、OH-浓度虽减少,但电离度增加,PH值亦不会发生显著变化。所以缓冲溶液能够起到稳定溶液PH值的作用
缓冲溶液与缓冲作用原理 (一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4molL-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4 molL-1),若将1滴氢氧化钠溶液(12.4molL-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7 molL-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用 具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。 3.弱碱及其对应的盐 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。 (三)缓冲溶液的作用原理 现以HOAc-NaOAc缓冲溶液为例,说明缓冲溶液之所以能抵抗少量强酸或强碱使PH稳定的原理。醋酸是弱酸,在溶液中的离解度很小,溶液中主要以HOAc分子形式存在,OAc-的浓度很低。醋酸钠是强电解质,在溶液中全部离解成Na+和OAc-,由于同离子效应,加入NaOAc后使HOAc离解平衡向左移动,使 HOAc的离解度减小,[HOAc]增大。所以,在HOAc-NaOAc混合溶液中,存在着大量的HOAc和OAc-。其中HOAc主要来自共轭酸HOAc,OAc-主要来自NaOAc。这个溶液有一定的[H+],即有一定的PH值。在HOAc-NaOAc缓冲溶液中,存在着如下的化学平衡: 在缓冲溶液中加入少量强酸(如HCL),则增加了溶液的[H+]。假设不发生其他反应,溶液的PH值应该减小。但是由于[H+]增加,抗酸成分即共轭碱OAc-与增加的H+结合成HOAc,破坏了HOAc原有的离解平衡,使平衡左移即向生成共轭碱HOAc分子的方向移动,直至建立新的平衡。因为加入H+较少,溶液中OAc-浓度较大,所以加入的H+绝大部分转变成弱酸HOAc,因此溶液的PH值不发生明显的降低。 在缓冲溶液中加入少量强碱(如NaOH),则增加了溶液中OH-的浓度。假设不发生其他反应,溶液的PH值应该增大。但由于溶液中的H+立即加入的OH-结合成更难离解的H2O,这就破坏了HOAc原有的离解平衡,促使HOAc的离解平衡向右移动,即不断向生成H+和OAc-的方向移动 ,直至加入的OH-绝大部分转变成H2O,建立新的平衡为止。因为加入的OH-少,溶液中抗碱成分即共轭酸HOAc的浓度较大,因此溶液的PH值不发生明显升高。 在溶液稍加稀释时,其中[H+]虽然降低了,但[OAc-]同时降低了,同离子效应减弱,促使HOAc的离解度增加,所产生的H+可维持溶液的PH值不发生明显的变化。所以,溶液具有抗酸、抗碱和抗稀释作用。 多元酸的酸式盐及其对应的次级盐的作用原理与前面讨论的相似。例如,在NaH2PO4-Na2HPO4溶液中存在着离解平衡: HPO2-4是抗酸成分,通过平衡移能对抗外加酸的影响。H2PO2-4是抗碱成分,通过平衡右移能对抗外加碱的影响。 弱碱及其对应盐的缓冲作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能对抗外加酸的影响是抗酸成分,NH+4能对抗外加碱的影响是抗碱成分。前者通过下述平衡向右移动而抗酸,后者通过平衡向左移动而抗碱,从而使溶液的PH值稳定。
缓冲液可以提供离子平衡的反离子,并使流动相保持一定的离子强度和ph值,减少拖尾。 但是使用缓冲液要注意几点 1:避免使用盐酸盐,盐酸盐对钢质有腐蚀作用。 2:缓冲液最好要现配现用,往往缓冲液是良好的菌类培养液,隔天或放置长时间实验时会有很多怪现象发生。 3:实验后不可用有机溶剂直接过度,有机溶剂会处使盐类析出,造成液路或色谱柱堵塞,可用95:5的水甲醇冲洗。 4:使用缓冲液要及时掌握ph范围,做到胸中有数。 5:清洗液路和柱子时,有温控可加热到30摄氏度易于冲洗。 6:长时间用缓冲溶液要注意观察接头处有无析出,若有白色盐类析出,可考虑一定周期用10%硝酸冲洗一下液路(拆下柱子,走 30ml,再用5倍水冲洗)可以避免液路的堵塞。 7:选择缓冲液要用可靠的试剂,避免不纯的盐类造成不必要的麻烦。http://simg.instrument.com.cn/bbs/images/brow/em09511.gif
缓冲液可以提供离子平衡的反离子,并使流动相保持一定的离子强度和ph值,减少拖尾。但是使用缓冲液要注意几点:1、避免使用盐酸盐,盐酸盐对钢质有腐蚀作用。2、缓冲液最好要现配现用,往往缓冲液是良好的菌类培养液,隔天或放置长时间实验时会有很多怪现象发生。3、实验后不可用有机溶剂直接过度,有机溶剂会处使盐类析出,造成液路或色谱柱堵塞,可用95:5的水甲醇冲洗。4、使用缓冲液要及时掌握ph范围,做到胸中有数。5、清洗液路和柱子时,有温控可加热到30摄氏度易于冲洗。6、长时间用缓冲溶液要注意观察接头处有无析出,若有白色盐类析出,可考虑一定周期用10%硝酸冲洗一下液路(拆下柱子,走30ml,再用5倍水冲洗)可以避免液路的堵塞。7、选择缓冲液要用可靠的试剂,避免不纯的盐类造成不必要的麻烦
转自色谱网缓冲液可以提供离子平衡的反离子,并使流动相保持一定的离子强度和ph值,减少拖尾。但是使用缓冲液要注意几点1:避免使用盐酸盐,盐酸盐对钢质有腐蚀作用。2:缓冲液最好要现配现用,往往缓冲液是良好的菌类培养液,隔天或放置长时间实验时会有很多怪现象发生。3:实验后不可用有机溶剂直接过度,有机溶剂会处使盐类析出,造成液路或色谱柱堵塞,可用95:5的水甲醇冲洗。4:使用缓冲液要及时掌握ph范围,做到胸中有数。5:清洗液路和柱子时,有温控可加热到30摄氏度易于冲洗。6:长时间用缓冲溶液要注意观察接头处有无析出,若有白色盐类析出,可考虑一定周期用10%硝酸冲洗一下液路(拆下柱子,走30ml,再用5倍水冲洗)可以避免液路的堵塞。7:选择缓冲液要用可靠的试剂,避免不纯的盐类造成不必要的麻烦。
急需用磷酸氢二钾与磷酸二氢钾配制磷酸盐缓冲液(pH7.8), 取磷酸氢二钾5.59g与磷酸二氢钾0.41g,加水使溶解成1000ml,即得。这种方法配出来的是多少mol/L的缓冲液?pH是7.8吗,有没有别的方法?详细点的。另外,用下面方法磷酸盐缓冲液(pH7.8) 甲液:取磷酸氢二钠35.9g,加水溶解,并稀释至500ml。乙液:取磷酸二氢钠2.76g,加水溶解,并稀释至100ml。取上述甲液91.5ml与乙液8.5ml混合,摇匀,即得。钠盐和钾盐有什么区别呢,用来做土壤样品提取液进[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]?方法步骤如下:称取10 g试样,加入10.0 mL乙腈:0.2mol/L磷酸缓冲溶液(pH 7.8)(2:8,v/v)(以下简称提取液),旋涡1 min,提取5 min,离心5 min。提取步骤重复3次,每次提取液均为10 mL。合并3次提取并离心后的上清液与50 mL烧杯中,加约1 mL 83%磷酸调节pH值至2.5±0.1净化:SPE柱先用5mL甲醇浸泡活化30min,淋洗,再用5mL提取液(用85%磷酸调节pH值至2.5)淋洗。上样,控制在1mL/min,样品过完后,抽真空10~15min。洗脱,最后用3mL乙腈:pH7.8磷酸缓冲液(9:1,v/v)洗脱,N2吹干,用乙腈定容至1mL,待测。这个步骤有什么问题吗,最后上[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]质有和不利影响吗?谢谢了先
解答:1、避免使用盐酸盐,盐酸盐对钢质有腐蚀作用。2、缓冲液最好要现配现用,往往缓冲液是良好的菌类培养液,隔天或放置长时间实验时会有很多怪现象发生。3、实验后不可用有机溶剂直接过度,有机溶剂会处使盐类析出,造成液路或色谱柱堵塞,可用95:5的水甲醇冲洗。4、使用缓冲液要及时掌握pH范围,做到胸中有数。5、清洗液路和柱子时,有温控可加热到30℃易于冲洗。6、长时间用缓冲溶液要注意观察接头处有无析出,若有白色盐类析出,可考虑一定周期用10%硝酸冲洗一下液路(拆下柱子,走30ml,再用5倍水冲洗)可以避免液路的堵塞。7、选择缓冲液要用可靠的试剂,避免不纯的盐类造成不必要的麻烦。如果流动相中有机溶剂的比例很高是不能用来冲洗缓冲盐的,是洗不出来的。通常C18柱先用5%~10%的甲醇冲洗,是可以把缓冲盐冲洗出来的,然后用纯的有机溶剂来保护柱子。最好的方法是使用与流动相相同浓度不含盐的流动相进行清洗。但就是速度慢一些。用水是为了快速替换,一般在15分钟以内最好,且用0.8的流速较好。如果用纯水冲,容易造成键合的碳链的流失,最好用5%~10%甲醇水溶液冲。可以用纯水代替流动相中的缓冲液,有机相不变。这样冲洗柱子比较稳妥。
1、避免使用盐酸盐,盐酸盐对钢质有腐蚀作用。2、缓冲液最好要现配现用,往往缓冲液是良好的菌类培养液,隔天或放置长时间实验时会有很多怪现象发生。3、实验后不可用有机溶剂直接过度,有机溶剂会处使盐类析出,造成液路或色谱柱堵塞,可用95:5的水甲醇冲洗。4、使用缓冲液要及时掌握ph范围,做到胸中有数。5、清洗液路和柱子时,有温控可加热到30摄氏度易于冲洗。6、长时间用缓冲溶液要注意观察接头处有无析出,若有白色盐类析出,可考虑一定周期用10%硝酸冲洗一下液路(拆下柱子,走30ml,再用5倍水冲洗)可以避免液路的堵塞。7、选择缓冲液要用可靠的试剂,避免不纯的盐类造成不必要的麻烦。如果流动相中有机溶剂的比例很高是不能用来冲洗缓冲盐的,是洗不出来的。通常C18柱先用5%~10%的甲醇冲洗,是可以把缓冲盐冲洗出来的,然后用纯的有机溶剂来保护柱子。最好的方法是使用与流动相相同浓度不含盐的流动相进行清洗。但就是速度慢一些。用水是为了快速替换,一般在15分钟以内最好,且用0.8的流速较好. 如果用纯水冲,容易造成键合的碳链的流失,最好用5%~10%甲醇水溶液冲。可以用纯水代替流动相中的缓冲液,有机相不变。这样冲洗柱子比较稳妥。
土壤化学-正文 主要指土壤中的物质组成、组分之间和固液相之间的化学反应和化学过程,以及离子(或分子)在固液相界面上所发生的化学现象。包括土壤矿形成。 土壤化学性质可以借助各种方法加以调节和改善。常用的农物和有机质的化学组成、土壤胶体、土壤溶液、土壤电荷特性、土壤吸附性能、土壤酸度、土壤缓冲性、土壤氧化还原性等。它们之间相互联系、相互制约,而以土壤矿物和有机质等居主导地位。 土壤化学性质和化学过程是影响土壤肥力水平的重要因素之一。除土壤酸度和氧化还原性对植物生长产生直接影响外,土壤化学性质主要是通过对土壤结构状况和养分状况的干预间接影响植物生长。土壤矿物的组成、有机质的数量和组成、土壤交换性阳离子的数量和组成等都对土壤质地、土壤结构直至土壤水分状况和生物活性产生影响。进入土壤中的污染物的转化及其归宿也受土壤化学性质的制约。土壤物理性质,如土壤质地、土壤结构和土壤水分状况对土壤胶体数量和性质、电荷特性、氧化还原程度和土壤溶液的组成有明显影响;土壤生物,尤其是土壤微生物则影响到土壤有机质的积累、分解和更新以及腐殖质的业措施包括施用有机肥料、客(粘)土、耕作、灌水或排水等;化学措施包括对酸性土壤施用石灰,对碱土施用石膏等。
缓冲剂及缓冲溶液 能抵抗外加的少量酸、碱或稀释而保持本身的 PH 值基本不变的溶液叫做缓冲溶液,用来配制缓冲溶液的试剂又称缓冲剂。 缓冲溶液一般是具有同离子效应的弱酸和弱酸盐或弱碱和弱碱盐组成的。例如:乙酸 - 乙酸钠、氨 - 氯化铵、碳酸氢钠 - 硫酸钠、硼砂 - 硼酸、磷酸二氢钾 - 磷酸氢二钠等都可以配成缓冲溶液,缓冲溶液根据用途不同分成几种。
样品的处理方法为用一定pH的磷酸缓冲盐浸提,可以用石墨炉进样吗?担心盐的析出会堵塞管路,还有一个问题,样品溶液和校准溶液的基体不一致有做过金属迁移的前辈吗,请指点一下
PH缓冲溶液一般我们室温保存,,会提前失效的吗?
一、缓冲容量 (一)缓冲容量的概念 为了定量地表示缓冲溶液缓冲能力的大小,采用缓冲容量(也称缓冲指数或缓冲值)β来衡量。 定义:使1L或1ml缓冲溶液的pH值改 变一个单位所需加入一元强酸或一元 强碱的物质的量(mol或mmol), 称为该缓冲溶液的缓冲容量。
氮、磷、钾、钙等大量元素,是植物生长发育不可缺少的,虽然作物对这些元素需要的量相差很大,但是它们对作物生长发育起的作用同等重要,而且不可相互代替。过多地使用某种营养元素,不仅会对作物产生毒害,还会妨碍作物对其它营养元素的吸收,引起缺素症。例如磷过多会降低钙、锌、硼的有效性。土壤有效磷的测定,不仅可了解近期磷素供应水平状况,而且是植物合理施肥的依据之一。因此,推广测土配方施肥,大力宣传植物所需营养元素的重要性及测定土壤营养元素的含量迫在眉睫。现就土壤有效磷的测定方法介绍如下: 1 方法原理及适用范围用碳酸氢钠提取,采取钼锑抗比色法。 石灰性土壤中的有效磷,多以磷酸一钙和磷酸二钙状态存在,可用pH值8.50,浓度0.05mol/L的碳酸氢钠提取到溶液中。磷酸一钙可直接溶于碳酸氢钠水溶液中,而磷酸二钙与碳酸氢钠反应成为磷酸钠而溶解,钙则成为碳酸钙的沉淀而析出。其反应式为:Ca(H2P04)2 +2NaHC03→CaHC03上+NaH2P04 CaHP04+NaHC03→CaC03↓ +NaH2P04土壤被浸提出的磷量与土液比、液温、振荡时间及方式有关。测定时土液比为1:20,浸提液温度为25℃,振荡提取时间为30min。浸出液中的磷采取钼锑抗比色法测定,用紫外可见分光度计测定。该方法适用于测定含碳酸盐土壤的有效磷含量,也可用于测定中性土壤的有效磷含量。
1、避免使用盐酸盐,盐酸盐对钢质有腐蚀作用。2、缓冲液最好要现配现用,往往缓冲液是良好的菌类培养液,隔天或放置长时间实验时会有很多怪现象发生。3、实验后不可用有机溶剂直接过度,有机溶剂会处使盐类析出,造成液路或色谱柱堵塞,可用95:5的水甲醇冲洗。4、使用缓冲液要及时掌握ph范围,做到胸中有数。5、清洗液路和柱子时,有温控可加热到30摄氏度易于冲洗。6、长时间用缓冲溶液要注意观察接头处有无析出,若有白色盐类析出,可考虑一定周期用10%硝酸冲洗一下液路(拆下柱子,走30ml,再用5倍水冲洗)可以避免液路的堵塞。7、选择缓冲液要用可靠的试剂,避免不纯的盐类造成不必要的麻烦。如果流动相中有机溶剂的比例很高是不能用来冲洗缓冲盐的,是洗不出来的。通常C18柱先用5%~10%的甲醇冲洗,是可以把缓冲盐冲洗出来的,然后用纯的有机溶剂来保护柱子。最好的方法是使用与流动相相同浓度不含盐的流动相进行清洗。但就是速度慢一些。用水是为了快速替换,一般在15分钟以内最好,且用0.8的流速较好. 如果用纯水冲,容易造成键合的碳链的流失,最好用5%~10%甲醇水溶液冲。可以用纯水代替流动相中的缓冲液,有机相不变。这样冲洗柱子比较稳妥。
缓冲溶液配制久了会不会失去缓冲能力呢?

土壤有效锌的测定中空白试验锌高的原因土壤肥料技术推广系统已在全国建设了千余个土肥实验室,在实验室中经常要对土壤中有效态铜、锌、铁、锰含量进行测定,在《土壤分析技术规范》中土壤有效态锌的测定时,出现空白试验锌吸光度值高达0.2488,而标准曲线的最高含量0.8ug/mL的吸光度值才有0.3768,需要查找空白试验锌高的原因。1 材料与方法1.1 实验原理用pH7.3的DTPA-TEA-CaCl2缓冲溶液作为浸提剂,螯合浸提出土壤中有效态锌、锰、铜、铁,用原子吸收分光光度法测定。其中DTPA为螯合剂,氯化钙能防止石灰性土壤中游离碳酸钙的溶解,避免因碳酸钙所包蔽的锌、铁等元素释放而产生的影响。三乙醇胺作为缓冲剂,能使溶液pH保持7.3左右,对碳酸钙溶解也有抑止作用。1.2 仪器及主要试剂原子吸收分光光度计(美国热电AAS)、酸度计、恒温往复式或旋转式振荡机;DTPA浸提剂,锌标准贮备液(p=100ug/mL)。1.3 分析步骤称取通过2mm孔径尼龙筛的风干试样10.00g于200mL塑料瓶中,加入DTPA浸提剂20mL,盖好瓶盖,摇匀,在25℃±2℃的条件下,以180r·min±20r·min的频率振荡2h,立即过滤。保留滤液,在48h内完成测定。同时做空白试验。2 结果与论讨2.1 标准曲线浓度 (µg /ml)0.000.200.400.600.80吸光度值0.00070.12110.20490.29310.3768回归方程Y=0.4621x+0.0145相关系数(r)R=0.9972 2.2查找过程 查找过程吸光度值说明1三角瓶(用硝酸浸泡过)用大肚管加纯水20mL,振荡2h0.0050证明纯水中不含锌2三角瓶(用硝酸浸泡过)用大肚管加DTPA浸提剂20mL,振荡2h0.0102证明浸提剂不含锌3三角瓶(用硝酸浸泡过),上面放一滤纸,用大肚管加DTPA浸提剂20mL,振荡2h0.0106证明滤纸不含锌4[
1.碱性缓冲溶液有哪些?2.哪些缓冲溶液能更好的稳定PH?3.有哪些缓冲溶液同时能做掩蔽剂的?