大肠杆菌中带有绿色荧光蛋白的基因,想要拍照的话,是用油镜还是多大倍数的物镜?显微镜是奥林巴斯的,软件是MIE。高手指教一下,谢啦
绿色荧光蛋白等电点是多少?
生物、化学是一家。[em0814]Kary Mullis因为发明PCR技术而获得了1993年的诺贝尔化学奖,但谁都知道PCR的意义在于分子生物领域;15年后Roger Y. Tsien因为绿色荧光蛋白GFP的发现而获得了化学奖,不过GFP还是因为其分子标记能力而在生命科学领域有着广泛的研究和应用。本帖应景请大家谈谈GFP,形式自由,可以发收集的研究进展等资料,也可以谈谈自己对GFP的研究或了解,或者说说感想也行。还是老原则:质优者额外加分。
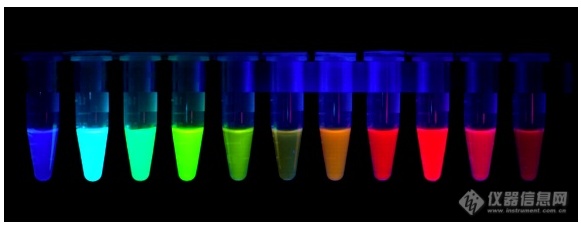
[font='Times New Roman'][font=宋体]引言[/font][/font][i][font='Times New Roman'][font=宋体]无数科学家的努力下,蛰居在水母的绿色荧光蛋白已经被导入到病毒、放线菌、酵母、植物、果蝇、线虫、小鼠、大鼠、人类细胞等几乎所有的模式生物,荧光蛋白的发现与应用被认为是点亮了生命科学,让黑暗中的生命活动被可视化的展示在科学家眼前。[/font][/font][/i][font='Times New Roman'][font=宋体]上期文章中,我们对比了活体光学成像的两种技术,生物发光和荧光成像的不同点。随着荧光标记技术的进一步发展,荧光成像的应用范围已经大大超过了生物发光,荧光成像已经可以满足绝大多数情况下的实验需求。[/font][/font][font='Times New Roman'][color=#ff0000][font=宋体]荧光成像需要对检测的细胞或分子进行荧光标记[/font][/color][/font][font='Times New Roman'][font=宋体]。目前,主要有两种标记方法,第一种利用[/font][/font][font='Times New Roman'][color=#191919][font=Arial]内源荧光信号[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体],在细胞中表达荧光蛋白进行标记。第二种利用荧光分子对细胞、药物或纳米颗粒等分子进行标记。[/font][/color][/font][font='Times New Roman'][font=宋体]本期将为大家介绍荧光蛋白[/font][/font][font=宋体][font=宋体]的[/font][/font][font='Times New Roman'][font=宋体]选择方法![/font][/font][align=center][img=,581,228]https://ng1.17img.cn/bbsfiles/images/2020/09/202009271417587236_9957_1887_3.png!w581x228.jpg[/img][font='Times New Roman'][color=#191919] [/color][/font][/align][align=center][font='Times New Roman'][color=#191919]Rainbow of fluorescent proteins [Tsien lab][/color][/font][/align][align=center][font='Times New Roman'][color=#191919][font=Arial]选择荧光蛋白建议考虑的参数[/font][/color][/font][/align][font='Times New Roman'][color=#191919]1. [/color][/font][font='Times New Roman'][color=#191919][font=Arial]激发波长[/font]/[font=Arial]发射波长[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]:每一种荧光蛋白都有其独特的激发波长和发射波长,因此,选择的荧光蛋白必须是使用的[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]成像[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]系统能够激发和检测到的。比如,使用的[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]成像系统只有两个激发光源:[/font][/color][/font][font='Times New Roman'][color=#191919]488 nm[font=Arial]和[/font][font=Times New Roman]561 nm[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]。[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]那就不能够选择远红外荧光蛋白。[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]同时[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]使用超过一个荧光蛋白时,必须确保发射波长没有重叠。[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=宋体]荧光蛋白应用于活体成像实验时,尽量选择红色或近红外的荧光蛋白,这类荧光蛋白的发射波长较长,具有更好的[/font][/color][/font][font=宋体][color=#ff0000][font=宋体]组织[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=宋体]穿透[/font][/color][/font][font=宋体][color=#ff0000][font=宋体]能力。[/font][/color][/font][font='Times New Roman'][color=#191919]2. [font=Arial]寡聚反应[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]:[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]早期开发的[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]荧光蛋白易于寡聚化,[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]与[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]目的基因融合表达时可能会影响目的基因蛋白的生物学功能。[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=宋体]因此[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=Arial]建议使用单体的荧光蛋白,比如[/font]mCherry[font=Arial]。[/font][/color][/font][font='Times New Roman'][color=#191919]3[/color][/font][font='Times New Roman'][color=#191919]. [font=Arial]亮度[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]:荧光蛋白的亮度值由消光系数与量子产率的乘积计算得出。在许多情况下,将荧光蛋白的亮度与[/font]EGFP([font=Arial]设定为[/font][font=Times New Roman]1)[/font][font=Arial]进行比较,有一些荧光蛋白非常暗淡(例如[/font][font=Times New Roman]TagRFP657[/font][font=Arial],其具有亮度只有[/font][font=Times New Roman]0.1[/font][font=Arial])[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]。[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=Arial]因此[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=宋体]活体成像实验时,[/font][/color][/font][font='Times New Roman'][color=#ff0000][font=Arial]亮度也需要考虑。[/font][/color][/font][font='Times New Roman'][color=#191919]4[/color][/font][font='Times New Roman'][color=#191919]. pH[font=Arial]稳定性[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]:如果计划在酸性环境中表达荧光蛋白,则此参数非常重要,一些荧光蛋白具有不同的[/font][/color][/font][font='Times New Roman'][color=#191919][font=宋体]激发[/font]/[font=宋体]发射[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]光谱(例如[/font]mKeima[font=Arial])或在[/font][font=Times New Roman]pH[/font][font=Arial]变化时荧光强度会发生改变(例如[/font][font=Times New Roman]pHluorin[/font][font=Arial],[/font][font=Times New Roman]pHTomato[/font][font=Arial])。[/font][/color][/font][font=宋体][color=#191919]5.[font=宋体]避免自发荧光:[/font][/color][/font][font=宋体][color=#191919][font=宋体]生物体自身的很多物质具有较强的自发荧光,如指甲、毛发具有强烈的绿色背景信号,因此活体成像时需要对动物进行完全的脱毛处理或尽量避免绿色荧光蛋白,可选[/font][/color][/font][font='Times New Roman'][color=#191919]RFP[font=宋体]、[/font][font=Times New Roman]dsRed, mCherry, mTomato[/font][/color][/font][font=宋体][color=#191919][font=宋体]等荧光蛋白。[/font][/color][/font][b][font='Times New Roman'][color=#ff0000] [/color][/font][font='Times New Roman'][font=Arial]在选择好了荧光蛋白后,后续就是做实验、拿数据、发文章了![/font][/font][/b][font='Times New Roman'][font=Arial]可[/font][/font][font='Times New Roman'][color=#191919][font=Arial]是选用什么成像[/font][/color][/font][font=Arial][color=#191919][font=Arial]设备[/font][/color][/font][font='Times New Roman'][color=#191919][font=Arial]好呢?[url=http://dwz.date/cwes]点击了解更多详情![/url][/font][/color][/font]
生物标记三部曲:绿色荧光蛋白(GFP)、辣根过氧化物酶(HRP)和小型单线态氧制造者(MiniSOG)【towersimper注:本文为译文,每篇都有部分改动,仅用作研究之用,不得用作商业开发,转载请标明翻译者towersimper,第一篇来自Sowmya Swaminathan, Nature Cell Biology, "GFP: the green revolution", doi:10.1038/ncb1953, October 1, 2009;第二篇来自Andy, brainslab.wordpress.com,"Horseradish peroxidase as marker for anatomical em", April 3, 2011; 第三篇来自Andy, brainslab.wordpress.com, "MiniSOG, a light and electron microscopy fusable marker", April 16, 2011】 第一篇:绿色荧光蛋白: 绿色革命http://bbs.bioon.net/bbs/data/attachment/album/201107/23/1829154rjsutzjgu2tw4hf.jpg来自秀丽隐杆线虫(Caenorhabditis elegans)的两个触觉感受器神经元的细胞体(cell body)用编码β-微管蛋白的基因表达的绿色荧光蛋白标记,图片来自doi:10.1126/science.8303295.1994年,Chalfie等人在Science杂志发表一篇报道,表明来自维多利亚水母(Aequorea Victoria)的绿色荧光蛋白(green fluorescent protein, GFP),在没有任何A. Victoria的辅助因子存在下,能在活着的细菌和线虫细胞中用作蛋白定位和表达的标记。这种显示GFP作为体内研究蛋白的工具基本上改变了细胞生物学家能够解决的问题的性质和范围。1962年,Shimomura和他的同事们在A. victoria生物发光蛋白水母素(aequorin)的纯化过程中偶然间第一次发现了GFP。1974年,Morise和他的同事们在随后的纯化、晶体形成和从水母素到GFP能量转移的体外重建过程中,为GFP的荧光性质提供启迪,而且证实GFP接受来自水母素的能量转移后发射绿光。在此之后许多年,在外源系统中GFP是否需要水母素和可能来自水母的其他因子发出荧光,这仍然是一个公开的问题。1992年,也就是在GFP发现后的30年,Prasher等人克隆了编码GFP的基因,就为实验上评估它用作蛋白质的体内标记铺平道路。而在两年后,Chalfie等人证实当GFP在细菌和线虫细胞中表达时,它能够发出荧光。在线虫中,GFP是在一个表达β-微管蛋白的基因启动子的控制下表达的。它在线虫特异性神经元中的时空表达模拟了内源性β-微管蛋白基因的表达,因而证明GFP能够作为一种可靠的标记以便监控基因表达模式。此后不久,Roger Tsien的实验室对天然GFP进行改造使之变得更加明亮和耐光,以及在一个与常规显微镜过滤器装置相匹配的波长下激发,因而增加了它的实际适应性。GFP技术的下一个突破便是开发GFP变异体产生蓝色、青色和黄色荧光蛋白,因而能够使得影像实验在细胞和有机体中采用多种标记的蛋白。绿色荧光蛋白(GFP)是由238个氨基酸残基组成,在蓝色波长范围的光线激发下,会发出绿色荧光。而EGFP是增强型的GFP (enhanced GFP),发生了双氨基酸取代,亮氨酸(Leu)取代GFP上第64位苯丙氨酸(Phe),苏氨酸(Thr)取代了GFP上的第65位丝氨酸(Ser),与GFP相比,具有更强更稳定的绿色荧光。黄色荧光蛋白(yellow fluorescent protein, YFP)其序列与GFP基本相同,不同之处就是把第203位Thr以Tyr取代,这样的GFP不发出绿色荧光,而发出较长波长的黄色荧光。青色荧光蛋白(cyan fluorescent protein, CFP)与此类似,也是GFP第66位Tyr(酪氨酸)被Thr(色氨酸)所取代的结果,发青色荧光。由此可见,GFP标签与其它突变体GFP、YFP、EYFP、CFP的序列非常的类似,只有1-2个氨基酸残基的变化。
第一篇来自Sowmya Swaminathan, Nature Cell Biology, "GFP: the green revolution", doi:10.1038/ncb1953, October 1, 2009;第二篇来自Andy, brainslab.wordpress.com,"Horseradish peroxidase as marker for anatomical em", April 3, 2011;第三篇来自Andy, brainslab.wordpress.com, "MiniSOG, a light and electron microscopy fusable marker", April 16, 2011第一篇:绿色荧光蛋白: 绿色革命http://www.biomart.cn//upload/userfiles/image/131175417948693.jpg来自秀丽隐杆线虫(Caenorhabditis elegans)的两个触觉感受器神经元的细胞体(cell body)用编码β-微管蛋白的基因表达的绿色荧光蛋白标记,图片来自doi:10.1126/science.8303295.1994年,Chalfie等人在Science杂志发表一篇报道,表明来自维多利亚水母(Aequorea Victoria)的绿色荧光蛋白(green fluorescent protein, GFP),在没有任何A. Victoria的辅助因子存在下,能在活着的细菌和线虫细胞中用作蛋白定位和表达的标记。这种显示GFP作为体内研究蛋白的工具基本上改变了细胞生物学家能够解决的问题的性质和范围。1962年,Shimomura和他的同事们在A. victoria生物发光蛋白水母素(aequorin)的纯化过程中偶然间第一次发现了GFP。1974年,Morise和他的同事们在随后的纯化、晶体形成和从水母素到GFP能量转移的体外重建过程中,为GFP的荧光性质提供启迪,而且证实GFP接受来自水母素的能量转移后发射绿光。在此之后许多年,在外源系统中GFP是否需要水母素和可能来自水母的其他因子发出荧光,这仍然是一个公开的问题。1992年,也就是在GFP发现后的30年,Prasher等人克隆了编码GFP的基因,就为实验上评估它用作蛋白质的体内标记铺平道路。而在两年后,Chalfie等人证实当GFP在细菌和线虫细胞中表达时,它能够发出荧光。在线虫中,GFP是在一个表达β-微管蛋白的基因启动子的控制下表达的。它在线虫特异性神经元中的时空表达模拟了内源性β-微管蛋白基因的表达,因而证明GFP能够作为一种可靠的标记以便监控基因表达模式。此后不久,Roger Tsien的实验室对天然GFP进行改造使之变得更加明亮和耐光,以及在一个与常规显微镜过滤器装置相匹配的波长下激发,因而增加了它的实际适应性。GFP技术的下一个突破便是开发GFP变异体产生蓝色、青色和黄色荧光蛋白,因而能够使得影像实验在细胞和有机体中采用多种标记的蛋白。绿色荧光蛋白(GFP)是由238个氨基酸残基组成,在蓝色波长范围的光线激发下,会发出绿色荧光。而EGFP是增强型的GFP (enhanced GFP),发生了双氨基酸取代,亮氨酸(Leu)取代GFP上第64位苯丙氨酸(Phe),苏氨酸(Thr)取代了GFP上的第65位丝氨酸(Ser),与GFP相比,具有更强更稳定的绿色荧光。黄色荧光蛋白(yellow fluorescent protein, YFP)其序列与GFP基本相同,不同之处就是把第203位Thr以Tyr取代,这样的GFP不发出绿色荧光,而发出较长波长的黄色荧光。青色荧光蛋白(cyan fluorescent protein, CFP)与此类似,也是GFP第66位Tyr(酪氨酸)被Thr(色氨酸)所取代的结果,发青色荧光。由此可见,GFP标签与其它突变体GFP、YFP、EYFP、CFP的序列非常的类似,只有1-2个氨基酸残基的变化。在GFP发现后的将近半个世纪以来,因为发现和开发绿色荧光蛋白,2008年诺贝尔化学奖被授予给Osamu Shimomura, Martin Chalfie和Roger Tsien,来表彰这次发现给后世带来的巨大影响。参考文献:Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W. & Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science 263, 802–805 (1994).Shimomura, O., Johnson, F. H. & Saiga, Y., Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan Aequorea. J. Cell. Comp. Physiol. 59, 223–239 (1962).Morise, H., Shimomura, O., Johnson, F. H. & Winant, J. Intermolecular energy transfer in the bioluminescent system of Aequorea. Biochemistry 13, 2656–2662 (1974).Prasher, D. C., Eckenrode, V. K., Ward, W. W., Prendergast, F. G. & Cormier, M. J. Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111, 229–233 (1992).Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509–544 (1998).第二篇:辣根过氧化物酶作为解剖学电子显微镜(anatomical electron microscopy)的标记要绘制诸如视网膜的大容量组织中的突触联系(synaptic connection) James R. Anderson等人于2009年就已经主张应当将分子表达谱(molecular profiling)与电子显微镜图片相关联。如今,这里给出一个例子来说明分子表达谱仪(molecular profiler)如何得到很好的利用。Jianli Li等人采用电穿孔技术产生将携带有靶向到细胞膜的辣根过氧化物酶(membrane-targeted horseradish peroxidase, mHRP)基因的表达构建物导入神经元。辣根过氧化物酶发射可放大的波长为428nm的荧光。这些研究人员就使用它作为解剖学上的标记,与蝌蚪神经元的连续切片电子显微镜图片(serial section electron microscopy, SCEM)在空间上相互关联。辣根过氧化物酶的优势之一在于它在包括线粒体/小泡(vesicle)在内的细胞膜上均匀分布。它也有助于鉴定长轴突(axon)/小直径的树突(dendrite)。但是另一方面,不同于其他的标记,它不得不在动物仍然活着的时候通过电穿孔技术导入细胞才有效果。下面是一系列电子显微镜图片,其中远侧树突分支(distal dendritic branch),蓝色显示;带有轴突末端(axon terminal, 用粉红色显示)的突触,用白色箭头符号指示:http://www.biomart.cn//upload/userfiles/image/131175420478195.jpg比例尺=1微米当从向右观看这一系列图片时,你能够看到树突如何缩减,而研究人员能够在他们的微回路(microcircuit)模型中重构这些图片。
AKATA制备型液相色谱蛋白分析仪纯化蛋白步骤很简单的,比较适合初学者。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=113913]AKATA制备型液相色谱蛋白分析仪纯化蛋白步骤[/url]
牛奶蛋白质分析仪可以用于检测乳蛋白制品。以下是详细解释和相关信息: 功能与应用:牛奶蛋白质分析仪是一种专门用于分析牛奶及其制品中蛋白质含量的仪器。它基于先进的生化分析技术,如比色法、光谱法或电化学法等,能够准确、快速地检测样品中的蛋白质含量。 乳蛋白制品的检测:乳蛋白制品,如奶粉、酸奶、奶酪等,其蛋白质含量是产品质量和营养价值的重要指标。牛奶蛋白质分析仪可以有效地检测这些乳蛋白制品中的蛋白质含量,为生产厂家提供准确的质量控制手段。 优点与特点: 准确性高:牛奶蛋白质分析仪具有高灵敏度和高准确性,能够确保测量结果的可靠性。 快速便捷:该仪器操作简单,使用方便,可以快速得出测量结果,提高检测效率。 适用范围广:除了牛奶及其制品外,还可以用于其他含蛋白质样品的检测,如豆类制品、肉制品等。 在乳品工业中的重要性:随着乳品市场的不断扩大和消费者对乳制品质量要求的提高,牛奶蛋白质分析仪在乳品工业中的重要性日益凸显。它可以帮助乳品企业提高产品质量、降低生产成本,同时为消费者提供更加安全、健康的乳制品。 综上所述,牛奶蛋白质分析仪是一种功能强大、应用广泛的检测仪器,完全可以用于检测乳蛋白制品中的蛋白质含量。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405271615421543_8284_6238082_3.jpg!w690x690.jpg[/img]
[b][font=宋体][font=宋体]一、[/font][font=Calibri]EGFP[/font][font=宋体]蛋白全称[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri]EGFP[/font][font=宋体],全称为增强型绿色荧光蛋白([/font][font=Calibri]Enhanced Green Fluorescent Protein[/font][font=宋体]),是一种在生物科学研究中广泛应用的荧光报告蛋白。它是由普通绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])进行突变和优化得到的,相较于原始的[/font][font=Calibri]GFP[/font][font=宋体],[/font][font=Calibri]EGFP[/font][font=宋体]具有更高的荧光亮度和更稳定的性质。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]二、[/font][font=Calibri]EGFP[/font][font=宋体]蛋白大小[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri]EGFP[/font][font=宋体]蛋白的大小为[/font][font=Calibri]238[/font][font=宋体]个氨基酸,分子量约为[/font][font=Calibri]27kDa[/font][font=宋体]。这个分子量相对较小,使其在融合蛋白、抗体标记等生物分子标记领域中具有广泛的应用价值。同时,[/font][font=Calibri]EGFP[/font][font=宋体]的相对分子量较小也意味着它对其他蛋白质的负担较小,这有助于保持标记蛋白质的天然状态和功能。[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]三、[/font][font=Calibri]EGFP[/font][font=宋体]蛋白序列[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]以下是[/font][font=Calibri]EGFP[/font][font=宋体]蛋白的氨基酸序列:[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]MVHHIQGGGPGMPMPGEEMMMAAN[/font][font=宋体]稚[/font][font=Calibri]TSGSHMVHHIQGGGPGMPMPGEEMMMAAN[/font][font=宋体]稚[/font][font=Calibri]TSGSHMVHHIQGGGPGMPMPGEEMMMAAN[/font][font=宋体]稚[/font][font=Calibri]TSGSHMVHHIQGGGPGMPMPGEEMMMAAN[/font][font=宋体]稚[/font][font=Calibri]TSGSHMEEEEDVMKDVEEETPIPELMLLDMAAQDPIPELMLLDMAAQDPIPELMLLDMAAQDPIPELMLLDMAAQDPIPELMLLDMAAQDP[/font][/font][font=宋体] [/font][font=宋体][font=宋体]通过分析[/font][font=Calibri]EGFP[/font][font=宋体]的氨基酸序列,我们可以发现其中包含一些重要的结构域和功能位点。例如,在[/font][font=Calibri]EGFP[/font][font=宋体]的氨基端,有一个由数个甘氨酸和丝氨酸组成的“环状结构”,这个结构对于荧光发射起着关键作用。在羧基端,我们还可以看到一个“多肽区”,这个区域对于荧光亮度和稳定性也有重要影响。此外,在[/font][font=Calibri]EGFP[/font][font=宋体]的氨基酸序列中还包含多个突变位点,这些位点使得[/font][font=Calibri]EGFP[/font][font=宋体]相较于原始的[/font][font=Calibri]GFP[/font][font=宋体]具有更高的荧光亮度和更稳定的性质。[/font][/font][b][font=宋体] [/font][font=宋体]四、总结[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]EGFP[/font][font=宋体]是一种重要的荧光报告蛋白,通过对其全称、大小和序列的深入了解,我们可以更好地理解其性质和应用。在实际的生物科学研究中,[/font][font=Calibri]EGFP[/font][font=宋体]已被广泛应用于细胞生物学、分子生物学、生物医学等多个领域,为科研工作者提供了强有力的工具,有助于推动生命科学研究的进步。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]详情可以查看义翘神州网:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-tag[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=Calibri] [/font]
不知有谁使用过这个机器,是否能提供DU530核酸/蛋白分析仪使用说明书,谢谢!
蛋白分析系统在我们选择蛋白分析工具的时候,通常是根据不同的蛋白来选择不同的分析手段,如凝胶电泳、化学荧光染色、质谱等等。但是目前已经研制出的蛋白分析工具的种类繁多,从这一方面也在一定程度上反映了蛋白分析的复杂性。以下是一些近期推出的蛋白分析系统,希望能帮助您轻松完成研究工作。
请教一下各位:用氨基酸分析仪能检测皮革水解蛋白吗?
纳米材料与结合蛋白的纳米材料,1.在荧光光度分析上会有什么不同[em01] ?2.蛋白的包覆会影响纳米材料的荧光峰吗?3.纳米材料的结合对蛋白的荧光峰会有影响吗?谢谢
[font=宋体][font=宋体]蛋白标签([/font][font=Calibri]Protein Tag[/font][font=宋体])又称为标签蛋白,是利用[/font][font=Calibri]DNA[/font][font=宋体]体外重组技术,将目的蛋白与其融合表达形成的一种多肽或蛋白。这种标签有助于目的蛋白的表达、检测、示踪和纯化等操作。随着技术的不断进步,研究人员已经成功开发出了具有各种不同功能的蛋白标签。然而,由于不同的蛋白标签具有各自的特性,因此在质粒构建过程中常常会遇到多种问题。今天,我们将深入探讨蛋白标签的各个方面。[/font][/font][font=宋体] [/font][font=宋体][b]蛋白标签类型[/b][/font][font=宋体]蛋白标签主要分为三类,适用于不同的应用场景:表位标签、亲和标签和荧光标签。[/font][font=宋体] [/font][font=宋体][font=宋体]①表位标签往往是短肽序列,可用于免疫学应用,如 [/font][font=Calibri]Western Blot [/font][font=宋体]和免疫共沉淀。最常用的表位标签有[/font][font=Calibri]His[/font][font=宋体]、[/font][font=Calibri]FLAG[/font][font=宋体]、[/font][font=Calibri]HA[/font][font=宋体]等。[/font][/font][font=宋体][font=宋体]②亲和标签一般较长,可增加蛋白溶解度,广泛应用于重组蛋白的纯化,如[/font][font=Calibri]SUMO[/font][font=宋体]、[/font][font=Calibri]Trx[/font][font=宋体]、[/font][font=Calibri]MBP[/font][font=宋体]等。[/font][/font][font=宋体][font=宋体]③荧光标签可用于活细胞和死细胞检测,最常用的荧光蛋白包括绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])、橙色荧光蛋白([/font][font=Calibri]OFP[/font][font=宋体])、红色荧光蛋白([/font][font=Calibri]RFP[/font][font=宋体])和黄色荧光蛋白([/font][font=Calibri]YFP[/font][font=宋体])。它们被广泛用于影像学研究,如细胞定位和共表达实验。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b][font=宋体]蛋白标签在重组蛋白生产中有什么作用[/font][font=Calibri]?[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、识别:给蛋白加标签使其易于识别,进而快速鉴定感兴趣的蛋白质。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、纯化:利用标签蛋白对目的蛋白进行纯化。例如,[/font][font=Calibri]His6[/font][font=宋体]是一种由六个组氨酸残基组成的融合标签,可以插入目的蛋白的[/font][font=Calibri]C[/font][font=宋体]末端或[/font][font=Calibri]N[/font][font=宋体]末端。组氨酸残基侧链与固态的镍有强烈的吸引力,这使得[/font][font=Calibri]His6[/font][font=宋体]标签可用于固定化金属螯合层析[/font][font=Calibri](IMAC)[/font][font=宋体],从而对重组蛋白进行分离纯化。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、定量:通过量化标签来确定目的蛋白的存在量。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、定位:通过定位标签蛋白定位到目标蛋白在细胞中的特定位置,进而研究其生理功能、信号通路等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、跟踪:在细胞、组织和生物体中,通过追踪标签蛋白质追踪目的蛋白,以研究它们的表达、分布、代谢等生物学过程。[/font][/font][font=宋体] [/font][font=宋体]总之,蛋白标签在重组蛋白生产中扮演着重要的角色,它们不仅提高了生产效率,还为蛋白的检测、纯化和示踪提供了便利。[/font][font=宋体] [/font][font=宋体][font=宋体]常用的[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]有:[/font][font=Calibri]His-Tag[/font][font=宋体]、[/font][font=Calibri]FLAG-Tag[/font][font=宋体]、[/font][font=Calibri]HA-Tag[/font][font=宋体]、[/font][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/myc-tag-protein-production][b]Myc-Tag[/b][/url][/font][font=宋体]、[/font][font=Calibri]SUMO-Tag[/font][font=宋体]、[/font][font=Calibri]Trx-Tag[/font][font=宋体]、[/font][font=Calibri]GST-Tag[/font][font=宋体]……义翘神州不仅可提供重组蛋白表达定制服务,也可提供对应标签抗体产品及融合蛋白标签切除常用工具酶,如[/font][font=Calibri]EK[/font][font=宋体]蛋白酶、[/font][font=Calibri]3C[/font][font=宋体]蛋白酶等。下图是具体蛋白标签的序列和大小介绍,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-tag[/font][/font]
[font=宋体][b][font=宋体]什么是[/font][font=Calibri]fc[/font][font=宋体]融合蛋白?[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b]Fc[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b]融合蛋白[/b][/url]是一种由免疫球蛋白(如[/font][font=Calibri]IgG[/font][font=宋体]、[/font][font=Calibri]IgA[/font][font=宋体]等)的[/font][font=Calibri]Fc[/font][font=宋体]片段与目标蛋白序列融合而成的新型重组蛋白。通过将[/font][font=Calibri]Fc[/font][font=宋体]区域与其他蛋白质或肽段融合,可以赋予这些蛋白质或肽段新的特性和功能,同时利用[/font][font=Calibri]Fc[/font][font=宋体]区域的稳定性和免疫系统的[/font][font=Calibri]Fc[/font][font=宋体]受体相互作用,增强融合蛋白的稳定性和半衰期。例如,普通重组[/font][font=Calibri]IL-2[/font][font=宋体]的体内半衰期较短,只有[/font][font=Calibri]6.9[/font][font=宋体]分钟,这限制了其在体内的持续作用时间。然而,通过与免疫球蛋白的[/font][font=Calibri]Fc[/font][font=宋体]片段融合,重组[/font][font=Calibri]IL-2/Fc[/font][font=宋体]融合蛋白在体内半衰期延长了近[/font][font=Calibri]700[/font][font=宋体]倍,从而使其能够在体内更长时间地发挥作用。此外,延长半衰期还可以降低药物的剂量和频率,减少潜在的副作用和毒性。[/font][/font][font=宋体][font=Calibri]https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins[/font][/font][font=宋体] [/font][font=宋体][b]融合蛋白有哪些?[/b][/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/fusion-protein][b]融合蛋白[/b][/url]是一种由至少两个结构域组成的蛋白,这些结构域由被连接起来的独立基因编码,因此能够作为一个单元被转录和翻译,产生单克隆多肽。现在几乎所有的重组蛋白都是利用融合结构域制备,也被称为[/font][font=宋体]“标签”(参阅重组蛋白标签的完整列表)。因此,融合蛋白又称融合标签蛋白或嵌合蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]大体上有两种类型的融合蛋白:第一种是由两个蛋白或蛋白亚单位端对端融合,通常由一个[/font][font=Calibri]linker[/font][font=宋体]连接,第二种是来自两个供体的氨基酸穿插在融合蛋白产物中。[/font][/font][font=宋体] [/font][font=宋体][b]融合蛋白应用:[/b][/font][font=宋体] [/font][font=宋体]融合蛋白最重要的三个用途是:[/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]作为克隆基因纯化的辅助手段[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]作为报告的表达水平[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]作为组织化学标签,使蛋白质在细胞、组织或生物体中的位置可视化[/font][/font][font=宋体] [/font][font=宋体][font=宋体]融合蛋白在纯化中可以通过亲和层析简单方便地纯化,如葡萄球菌蛋白[/font][font=Calibri]A[/font][font=宋体]、谷胱甘肽[/font][font=Calibri]-S-[/font][font=宋体]转移酶[/font][font=Calibri](gst)[/font][font=宋体]、麦芽糖结合蛋白[/font][font=Calibri](mbp)[/font][font=宋体]和纤维素结合蛋白。 重组融合蛋白最常用作报告构建体的融合伙伴,包括 β[/font][font=Calibri]-[/font][font=宋体]半乳糖苷酶、荧光素酶和绿色荧光蛋白 [/font][font=Calibri](GFP)[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体]荧光融合蛋白[/font][font=宋体] [/font][font=宋体][font=宋体]在融合蛋白中,最多的一类称为荧光蛋白,如绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])、橙色荧光蛋白([/font][font=Calibri]OFP[/font][font=宋体])和黄色荧光蛋白([/font][font=Calibri]YFP[/font][font=宋体])。 绿色荧光蛋白 [/font][font=Calibri](GFP) [/font][font=宋体]等荧光蛋白能够直接观察动态细胞内过程。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])是一种荧光蛋白,最初是从水母维多利亚发光管中分离出来的。 与荧光素酶不同,[/font][font=Calibri]GFP [/font][font=宋体]具有不需要任何底物、荧光素以及 [/font][font=Calibri]ATP[/font][font=宋体]、[/font][font=Calibri]O2 [/font][font=宋体]或 [/font][font=Calibri]Mg2+ [/font][font=宋体]的优势。 [/font][font=Calibri]GFP [/font][font=宋体]在被蓝光或紫外线激发时会发出绿光,在许多情况下可用于活的、完整的细胞和生物体,从而确保 [/font][font=Calibri]GFP [/font][font=宋体]作为自发荧光蛋白的功能。[/font][/font][font=宋体] [/font][font=宋体]融合蛋白标签[/font][font=宋体] [/font][font=宋体][font=宋体]在融合标签中,既有短序列(如[/font] [font=Calibri]PolyHis[/font][font=宋体]、[/font][font=Calibri]PolyArg[/font][font=宋体]、[/font][font=Calibri]FLAG[/font][font=宋体]、[/font][font=Calibri]c-Myc[/font][font=宋体]、[/font][font=Calibri]Streptag [/font][font=宋体]等),也有大蛋白([/font][font=Calibri]GST[/font][font=宋体]、[/font][font=Calibri]MBP [/font][font=宋体]等)。 在许多情况下,短序列不会影响分子的三级结构及其生物学特性,而大融合分子更常用于增强所需蛋白质的溶解度。 与短序列标签不同,需要从重组构建体中去除大的融合标签。[/font][/font][font=宋体] [/font][font=宋体]有许多融合标签,既包含经过充分验证的标签,也包含最近开发的具有各种特性和不同优缺点的标签。[/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/fusion-protein[/font][/font]
牛奶蛋白质分析仪的原理主要基于光学测量技术,特别是光谱分析法。具体地说,它采用红外光谱法来测量牛奶中乳清蛋白和酪蛋白的含量。首先,将牛奶样品制成透明薄片,然后使用近红外光电传感器和光源对其进行扫描。牛奶中的蛋白质对特定波长的红外光有特定的吸收特性,通过测量这些吸收特性,可以分析出牛奶中蛋白质的种类和含量。此外,仪器会将牛奶光谱与事先建立的标准光谱进行比较,通过复杂的算法处理,从而得出各种蛋白质形态的含量。这种比较和计算过程确保了测量结果的准确性和可靠性。总的来说,牛奶蛋白质分析仪通过光学测量和光谱分析技术,能够快速、准确地测定牛奶中蛋白质的含量和种类,为乳制品生产、质量控制和科学研究提供了有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404291701212298_2595_6238082_3.jpg!w690x690.jpg[/img]
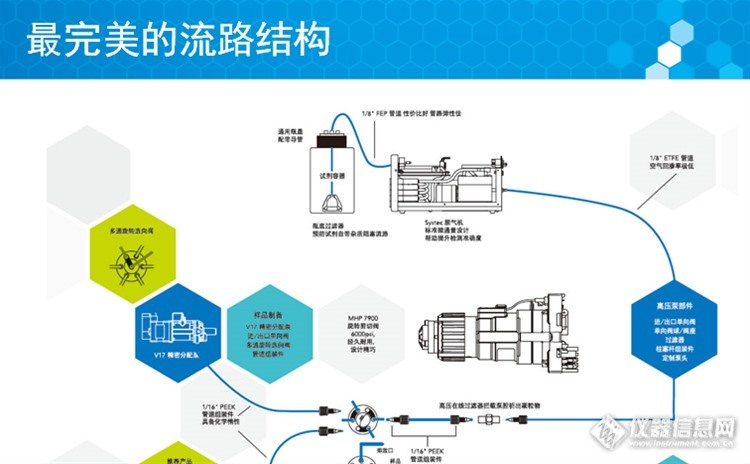
糖尿病是一种慢性病,随着经济生活水平的提高和社会老龄化的加剧,近年来患者人数在全球包括中国逐年递增,目前已严重威胁到国民的健康。对糖尿病的监测也越来越受到国家和人们的重视。作为全球公认的糖尿病检测"金标准",糖化血红蛋白(HbA1c)能够稳定可靠地反映出受检人在检测前90天到120天内的平均血糖水平,不受抽检时间、空腹与否或胰岛素等因素的干扰,经过国际临床化学和实验室医学联盟(IFCC)的技术验证和推广使用,使得糖化血红蛋白检测已成为诊断糖尿病的一种趋势。我们国家也参考国际公认的HPLC-LC-MS/MS方法,已经基本建立了自己的糖化血红蛋白检测一级参考体系。http://ng1.17img.cn/bbsfiles/images/2015/10/201510221629_570638_1587_3.jpg糖尿病检测方法以及主流仪器分析使用最先进的流体技术和产品,为您打造最优秀的HbA1c分析仪项目难度以及如何解决各类流路问题糖化血红蛋白(HbA1c)分析仪市场情况以及前景分析立即报名参与讲座:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1689
[font=宋体][font=宋体]蛋白质的检测在生物科学研究中占据着至关重要的地位。其中,免疫分析方法被广泛应用,包括[/font][font=Calibri]Western Blot[/font][font=宋体]、酶联免疫吸附试验([/font][font=Calibri]ELISA[/font][font=宋体])和免疫沉淀法([/font][font=Calibri]IP[/font][font=宋体])等。这些方法依赖于抗原[/font][font=Calibri]-[/font][font=宋体]抗体间的特异性反应,通过注射目标蛋白作为抗原至动物体内,产生免疫反应后分离抗体,进而进行检测。尽管应用广泛,但这种方法的缺点在于每次更换目标蛋白时都需要制备对应的抗体,操作繁琐且成本高昂。[/font][/font][font=宋体] [/font][font=宋体]融合标签技术的出现为蛋白质免疫分析带来了通用化和便利化。通过将特定的标签与目标蛋白融合,两者实现共同表达。通过对融合标签的检测,我们可以了解目标蛋白的表达情况。这种蛋白标签技术利用基因克隆手段,将具有特定功能的多肽、蛋白质结构域甚至完整蛋白质与目标蛋白结合,广泛应用于目标蛋白的表达、纯化、检测和跟踪等方面。经过长期研究,已经发展出一些成熟的检测标签技术。这些标签不仅简化了实验操作,降低了成本,而且为蛋白质研究提供了强有力的工具。下面就挑几个来介绍一下:[/font][font=宋体] [/font][b][font=宋体]①[/font][font=宋体][font=Calibri]His[/font][/font][font=宋体][font=Calibri]-tag[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/poly-his-tag-protein-expression][b]His[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/poly-his-tag-protein-expression][b]标签[/b][/url]是当前最为热门的标签蛋白之一。[/font][font=Calibri]His6[/font][font=宋体]是指六个组氨酸残基组成的融合标签([/font][font=Calibri]HHHHHH[/font][font=宋体]),可插入在目的蛋白的[/font][font=Calibri]C[/font][font=宋体]末端或[/font][font=Calibri]N[/font][font=宋体]末端。当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析([/font][font=Calibri]IMAC[/font][font=宋体]),对重组蛋白进行分离纯化。[/font][/font][font=宋体] [/font][b][font=宋体]②[/font][font=宋体][font=Calibri]Flag-tag[/font][/font][/b][font=宋体][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/flag-tag-protein-expression][b]Flag[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/flag-tag-protein-expression][b]标签蛋白[/b][/url]为编码[/font][font=Calibri]8[/font][font=宋体]个氨基酸的亲水性多肽([/font][font=Calibri]DYKDDDDK[/font][font=宋体]),同时载体中构建的[/font][font=Calibri]Kozak[/font][font=宋体]序列使得带有[/font][font=Calibri]FLAG[/font][font=宋体]的融合蛋白在真核表达系统中表达效率更高。 [/font][/font][font=宋体] [/font][b][font=宋体]③[/font][font=宋体][font=Calibri]AviTag[/font][/font][/b][font=宋体][font=宋体]是一个[/font][font=Calibri]15[/font][font=宋体]个氨基酸的短肽,具有一个单生物素化赖氨酸位点,与已知天然可生物素化序列完全不同,可以加在目标蛋白的[/font][font=Calibri]N[/font][font=宋体]端和[/font][font=Calibri]C[/font][font=宋体]端。融合表达后,可被生物素连接酶生物素化,为了纯化重组蛋白选用低亲和性的单体抗生物素蛋白或抗生物素蛋白衍生物,除了用于蛋白质分离纯化,还用于蛋白质相互作用研究。[/font][/font][font=宋体] [/font][b][font=宋体]④[/font][font=宋体][font=Calibri]SNAP-Tag[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri]SNAP-Tag[/font][font=宋体]是从人的[/font][font=Calibri]O6[/font][font=宋体]-甲基鸟嘌呤[/font][font=Calibri]-DNA[/font][font=宋体]甲基转移([/font][font=Calibri]O6-alkylguanine-DNA-alkyltransferase[/font][font=宋体])获得。[/font][font=Calibri]SNAP[/font][font=宋体]所带的活性巯基位点接受了苯甲基鸟嘌呤所携带的侧链苯甲基基团,释放出了鸟嘌呤。这种新的硫醚键共价结合使[/font][font=Calibri]SNAP[/font][font=宋体]所带的目的蛋白携带上了苯甲基基团所带的标记物。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]检测:生物素或各种颜色荧光的底物(如荧光素、若丹明)可渗透进入细胞,方便快捷地进行活细胞内[/font][font=Calibri]SNAP-Tag[/font][font=宋体]融合蛋白的标记与检测。它们也可特异性地标记大肠杆菌,酵母和哺乳动物等细胞抽提液或已经纯化的蛋白液中的[/font][font=Calibri]SNAP-tag[/font][font=宋体]融合蛋白。 [/font][/font][font=宋体] [/font][b][font=宋体]⑤[/font][font=宋体][font=Calibri]GST[/font][font=宋体](谷胱甘肽巯基转移酶)[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression][b]GST[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression][b]标签蛋白[/b][/url]本身是一个在解毒过程中起到重要作用的转移酶,它的天然大小为[/font][font=Calibri]26KD[/font][font=宋体]。[/font][font=Calibri]GST[/font][font=宋体]融合表达系统广泛应用于各种融合蛋白的表达,可以在大肠杆菌和酵母菌等宿主细胞中表达。结合的融合蛋白在非变性条件下用[/font][font=Calibri]10mM[/font][font=宋体]还原型谷胱甘肽洗脱。[/font][font=Calibri]GST[/font][font=宋体]标签可用酶学分析或免疫分析很方便的检测。标签有助于保护重组蛋白免受胞外蛋白酶的降解并提高其稳定性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]纯化:该表达系统表达的[/font][font=Calibri]GST[/font][font=宋体]标签蛋白可直接从细菌裂解液中利用含有还原型谷胱甘肽琼脂糖凝胶亲和树脂进行纯化。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]如果要去除[/font][font=Calibri]GST[/font][font=宋体]融合部分,可用位点特异性蛋白酶切除。[/font][/font][font=宋体] [/font][b][font=宋体]⑥[/font][font=宋体][font=Calibri]GFP[/font][/font][/b][font=宋体] [/font][font=宋体][font=Calibri]GFP[/font][font=宋体](绿色萤光蛋白)是由下村修等人在水母中发现的。它在蓝色波长范围的光线激发下,会发出绿色萤光。[/font][font=Calibri]GFP[/font][font=宋体]标签可位于蛋白质的[/font][font=Calibri]C[/font][font=宋体]端或[/font][font=Calibri]N[/font][font=宋体]端,该系统已广泛应用于各种细胞类型,包括细菌、酵母和哺乳动物细胞等,相应的[/font][font=Calibri]GFP[/font][font=宋体]标签抗体也被广泛应用。[/font][font=Calibri]GFP[/font][font=宋体]在检测蛋白表达、蛋白和细胞荧光示踪、研究蛋白质之间相互作用和构象变化中,起到了重要的作用。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]该如何选择表达克隆的标签[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、首先,需要确定融合标签的目的[/font][/font][font=宋体] [/font][font=宋体][font=宋体]蛋白纯化[/font] [font=宋体]:标签的普遍用途是蛋白纯化。小分子[/font][font=Calibri]6XHis Tag[/font][font=宋体]常被用于细胞内源蛋白的纯化。[/font][font=Calibri]6XHis Tag[/font][font=宋体]也广泛应用于大肠杆菌的蛋白纯化。可是哺乳动物细胞中因非分泌蛋白自身存在高组氨酸背景,因此极少使用[/font][font=Calibri]6XHis Tag[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Western Blot[/font][font=宋体]检测:若需要做[/font][font=Calibri]Western Blot[/font][font=宋体]实验来检测细胞裂解物中蛋白的表达,你可以选择有匹配的抗体的小分子标签。[/font][font=Calibri]FLAG Tag[/font][font=宋体]以其分子量小以及拥有许多与之匹配的商业化的抗体等优势,成为[/font][font=Calibri]Western Blot[/font][font=宋体]实验中常用的[/font][font=Calibri]Tag[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫沉淀反应:[/font][font=Calibri]FLAG Tag[/font][font=宋体]其分子量小以及拥有大量相匹配的商业用抗体等优势成为免疫沉淀反应中最常用的[/font][font=Calibri]Tag. [/font][font=宋体]其他常用的标签有:[/font][font=Calibri]HA[/font][font=宋体]和[/font][font=Calibri]cMyc.[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫共沉淀。首先,裂解您的样本,以释放蛋白。向试管中添加裂解液的同时,加入靶向融合标签的抗体,抗体会识别融合标签。然后抗体与蛋白[/font] [font=Calibri]A [/font][font=宋体]或 [/font][font=Calibri]G [/font][font=宋体]偶联微珠结合,后者拉出您的目标蛋白,以及与之复合的其他蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]活细胞成像:荧光蛋白([/font][font=Calibri]Fluorescent Proteins, FPs[/font][font=宋体])是活细胞成像常用的标记蛋白。其中最常用的是绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])和它的衍生物([/font][font=Calibri]CFP, YFP, etc.[/font][font=宋体]),以及一些红色变体,如[/font][font=Calibri]dTomato[/font][font=宋体]和[/font][font=Calibri]mCherry.[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、考虑融合标签的影响[/font][/font][font=宋体] [/font][font=宋体]任何一类标签处于氨基酸序列的任一位置,都具有影响目的蛋白表达或功能的可能性。最主要原因是标签可能会干扰蛋白的正确折叠,致使目的蛋白失活或形成包涵体。其次,标签可能会中断亚细胞定位信号,这种情况下,蛋白能够正确翻译和折叠,但在细胞内所处的位置是错误的。因此,您需要知道添加的标签对目的蛋白的表达是否有影响。[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、考虑是在[/font][font=Calibri]N-[/font][font=宋体]端还是[/font][font=Calibri]C-[/font][font=宋体]端标记[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]N-[/font][font=宋体]端或[/font][font=Calibri]C-[/font][font=宋体]端标记的选择还需要根据蛋白结构、定位等特性。然而,倘若你没有确切的蛋白结构,或蛋白功能域图谱,建议分别构建[/font][font=Calibri]N-[/font][font=宋体]端标记和[/font][font=Calibri]C-[/font][font=宋体]端标记的表达克隆,以检测哪个更有效。[/font][/font][font=宋体] [/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-expression][b]重组蛋白表达[/b][/url]技术现已在生物学各个具体领域应用广泛,尤其是蛋白质的大规模生产和体内功能研究都需要应用重组蛋白表达载体。[/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=Calibri] [/font]
http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378379551.jpg 氨基酸是蛋白质的基础组成单位,通过研究蛋白质中氨基酸的性质和组成来预测蛋白质的结构和功能,蛋白质氨基酸残基组成分析主要是通过氨基酸分析仪来完成的,本文推荐了2个基于氨基酸组成进行蛋白质预测软件。基于氨基酸组成的蛋白质预测软件根据组成蛋白质的20种氨基酸的物理和化学性质可以辨析电泳等实验中的未知蛋白质,也可以分析已知蛋白质的物化性质。ExPASy工具包包涵的程序:AACompIdent:与把氨基酸序列在SWISS-PROT库中搜索不同,AACompIdent工具利用未知蛋白的氨基酸组成去确认具有相同组成的已知蛋白。该程序分析时需提交的相关信息包括:蛋白质的氨基酸组成、等电点pI和分子量(如果知道)、正确的物种分类及特别的关键词。此外,用户还需在六种氨基酸“组合”中作出选择,这影响到分析如何进行。例如,某种“组合”会把残基Asp/Asn(D/N)和Gln/Glu(Q/E)组合成 Asx(B)和Glx(Z);或者某种残基会在分析中被完全除去。对数据库中的每一个蛋白序列,算法会对其氨基酸组成与所查询的氨基酸组成的差异打分。由电子邮件返回的结果被组织成三级列表:第一张列表中的蛋白都基于特定的物种分类而不考虑pI和分子量;第二张列表包含了不考虑物种分类、pI和分子量的全体蛋白;第三张列表中的蛋白不但基于特定物种分类,并且将 pI和分子量也考虑在内。虽然计算所得结果各不相同,但零分表明了该序列与提出的组成完全相符。AACompSim:AACompIdent的一个变种,AACompSim提供类似的分析,但与前者以实验所得的氨基酸组成为依据进行搜索不同,后者使用SWISS-PROT中的序列为依据。有报道称,氨基酸组成在物种之间是十分保守的(Cordwell等,1995),并且通过分析氨基酸的组成,研究者能从低于25%序列相似性的蛋白之间发现弱相似性(Hobohm和Sander,1995)。因此,在“传统的”数据库搜索基础上辅以组成分析,能为蛋白质之间关系提供更多见解。PROSEARCH:PROPSEARCH也提供基于氨基酸组成的蛋白质辨识功能。用144种不同的物化性质来分析蛋白质,包括分子量、巨大残基的含量、平均疏水性、平均电荷等,把查询序列的这些属性构成的“查询向量”与SWISS-PROT和PIR中预先计算好的各个已知蛋白质的属性向量进行比较。这个工具能有效的发现同一蛋白质家族的成员。可以通过Web使用这个工具,用户只需输入查询序列本身。分子量搜索(MOWSE)分子量搜索(MolecularWeightSearch,MOWSE)算法利用了通过质谱(MS)技术获得的信息。利用完整蛋白质的分子量及其被特定蛋白酶消化后产物的分子量,一种未知蛋白质能被准确无误地确认,给出由若干实验才能决定的结果。由于未知蛋白无需再全部或部分测序,这一方法显著地减少了实验时间。MOWSE的输入是一个纯文本文件,包含一张实验测定的肽段列表,分子量范围在0.7到4.0Kda之间。计算过程基于在OWL非冗余蛋白质序列库中包含的信息。打分基于在一定分子量范围内蛋白中一个片段分子量出现的次数。输出的结果是得分最佳的30个蛋白的列表,包括它们在OWL中的条目名称、相符肽段序列、和其它统计信息。模拟研究得出在使用5个或更少输入肽段分子量时,准确率为99%。该搜索服务可通过向mowse@daresburg.ac.uk发送电子邮件实现。为获得更多关于查询格式的细节信息,可以相该地址发送电子邮件,并在消息正文中写上“help”这个词。蛋白质氨基酸组成分析用盐酸在110 ℃将蛋白或多肽水解成游离的氨基酸,用氨基酸分析仪测定各氨基酸的含量。采用经典的阳离子交换色谱分离、茚三酮柱后衍生法,对蛋白质水解液及各种游离氨基酸的组分含量进行分析。仪器基本结构同普通HPLC相似,但针对氨基酸分析进行了细节优化(例如氮气保护、惰性管路、在线脱气、洗脱梯度及柱温梯度控制等等)通常细分为两种系统:蛋白水解分析系统(钠盐系统)和游离氨基酸分析系统(锂盐系统),利用不同浓度和pH值的柠檬酸钠或柠檬酸锂进行梯度洗脱。其中钠盐系统一次最多分析约25种氨基酸,速度较快,基线平直度好;锂盐系统一次最多分析约50种氨基酸,速度较慢,基线一般不如钠盐系统好。分析效果:从目前已知的氨基酸分析方法比较来看,除灵敏度(即最低检测限)比HPLC柱前衍生方法稍低以外(HPLC:0.5 pmol;氨基酸分析仪:10 pmol),其他如分离度、重现性、操作简便性、运行成本等方面,都优于其他分析方法。蛋白质氨基酸残基组成分析的主要步骤包括:首先是蛋白被水解为氨基酸,其次是采用离子色谱等方法进行游离的氨基酸含量和组成的分析。总之利用蛋白可以分析氨基酸,利用氨基酸也可以研究蛋白质。
蛋白质分析仪的校准
[align=center][b][/b][/align][align=center][b]Multifocal two-photon laser scanning microscopy combined with photo-activatable GFP for [i]in vivo [/i]monitoring of intracellular protein dynamics in real time[/b][/align][b]摘要[/b]使用[color=#ff0000]Lavision Biotec[/color]公司[b]多焦点双光子激光扫描显微镜[color=#ff0000]Trim Scope[/color][/b]来进行局部和选择性的蛋白激活以及细胞内蛋白动态的的量化调查。局部激活使用光激活绿色荧光蛋白(pa-GFP)和光学双光子激发来实现,以调查实时原位的细胞内动态。这个过程对于深入理解和建模活细胞内的调控和代谢过程极其重要。作为范例,既包含了一个核输入信号又包含了一个核输出信号的拟南芥MYB转录因子LHY/CCA1-like 1 (LCL1)被定量化调查。我们使用了由质粒编码的光激活绿色荧光蛋白(pa-GFP)融合蛋白和一个红色荧光转染标记联合转染的烟草BY-2原生质体,并pa-GFPLCL1在核内光激活后的快速向核外输出。作为对照,一个LCL1核输出阴性突变体仍然被束缚在核内。我们确定了由激活pa-GFP-LCL1的双向核运输和pa-GFP的扩散分别导致的核内荧光下降的51s和125s的平均时间常数。[b]材料与方法[/b][i]并行的64焦点双光子激光扫描显微镜[/i]Pa-GFP的激活和荧光的原位检测,通过基于根据蛋白动态监测需求改进的商业化系统([color=#ff0000]TriM Scope, LaVision Biotec[/color] Martini et al., 2005 Nielsen et al., 2001)多焦点2光子LSM检测(Fig. 1). 64焦点2光子LSM (Martini et al., 2006)包括一个倒置光学显微镜和一个可以产生从760nm到960nm的100fs激光脉冲的由固态激光器泵浦的锁模飞秒Ti:Sa激光器。用于激活和成像循环的波长选则通过一个允许5s内转换波长的ahome-built screw motorization来实现。激光扫描单元([color=#ff0000]TriM Scope, LaVision BioTec[/color]) 包括一个内置的预啁啾部分以补偿激光脉冲的色散,一个光束分光器部分和振镜扫描器。通过选择一组10个100%反光镜和50%分光镜,激发的NIR激光束在样品中被分为1, 2, 4,……, 64个激发焦点。这些数目可调的焦点在显微镜物镜(UPLAO60XW3/IR, NAD1.2 Olympus)的焦平面上被激光扫描单元中的2个扫描镜扫描。整个激活和测量过程在一个温度可控环境中在293±1K下进行。因为在保持每个焦点的能量沉积低于样品的退化极限的同时,多个焦点产生了相对高的双光子诱导荧光产额,成像可以30ms的时间分辨率进行。图像用一个背照明的EMCCD相机(IXON DV887ECS-UVB, Andor Technology)以non-descanned方式获取。激发的NIR激光束被引导通过一个分光镜 (2光子-Beamsplitter, Chroma)到物镜的后光圈上。为了成像深度和光谱荧光切片,倒置显微镜采用了机械聚焦驱动(MFD, Marzhauser)和一个程序控制滤波轮([color=#ff0000]LaVision-BioTec)[/color]。数据获取和实验控制由 TriM Scope的软件包Imspector(LaVision-BioTec)执行。操作和处理5维的数据列,包括光谱和时间数据轴,使用软件包Imspector ([color=#ff0000]LaVision-BioTec)[/color],ImageJ (Rasband, 1997) 或 Imaris (Bitplane)。[img=,657,421]http://qd-china.com/uploads/bio-product/81.jpg[/img]Fig. 1.多焦点双光子激光扫描显微镜的原理图(1) Tsunami Ti:Sa 激光器(波长可调)由固态Millenia X 激光器泵浦 (均来自 Spectra Physics), (2) 多焦点激光扫描单元 (TriM-scope, LaVision BioTec), (3) 分光镜 (2光子-Beamsplitter, Chroma), (4) 短波通过滤波轮 (2光子-Emitter, Chroma), (5) 物镜 (UPLAO60XW3/IR, NA D 1.2 Olympus), (6) 样品中可选择数目的荧光焦点, (7) 倒置光学显微镜(IX 71, Olympus), (8) 滤波轮 (滤波轮, LaVision BioTec)装备带通滤波片 D 605/55 (Chroma)用于检测 Ds-Red 和 HQ525/50 结合 HQ510/20 (均来自 Chroma)以检测 pa-GFP, (9) 背照式 EMCCD-camera (IXON DV887ECS-UVB, Andor Technology) 在NDD光路中, (10) 荧光灯 (HBO 50, Zeiss), (11) 带通激发滤波轮 D 540/25 (Chroma) 用于 Ds-Red 或带通激发滤波轮HQ 480/20 (Chroma) 用于 pa-GFP.[b]结果[img=,380,768]http://qd-china.com/uploads/bio-product/82.jpg[/img][/b]Fig. 2.含有核输入输出信号的拟南芥转录因子LCL1 (分别为NLS, NES). 由质粒编码GFP融合蛋白转染的烟草BY-2原生质体。通过单光子共聚焦激光扫描显微镜分析的GFP融合蛋白稳定态定位。(a) GFP-LCL1 揭示的核与细胞质间的分区。(b) 使用核输出抑制剂leptomycin B (LMB)孵育后,由于功能性NLS的存在,GFP-LCL1的稳定态分区剧烈转化为几乎完全分布于核中。 (c,d) 对照,LMB对单独的GFP没有影响。 (e) GFPLCL1(NESm)中,它的NES的点突变造成的LCL1的核输出活性削弱同样导致了GFP融合蛋白在核内的聚集。(f) 与(e)中同一个原生质体的透射光与GFP荧光成像的叠加标尺为10um (g) 作为对照的 GFP-NLS 在核内的增加。 (h) 同一原生质体的GFP-NLS绿色荧光蛋白和作为转染标记的Pra1-DsRed (At2g38360)红色荧光蛋白的叠加。[img=,700,109]http://qd-china.com/uploads/bio-product/83.jpg[/img]Fig. 3. pa-GFP 在一个活原生质体内的自由动态扩散。选出的5幅表达pa-GFP的烟草BY-2原生质体的单光子透射荧光图像。(a)实验开始,未激活 (b) pa-GFP的双光子激活期间 (c-e) 双光子激活后,所示时间点。(a)核内(红虚线)的pa-GFP在双光子激发前平均荧光很难被检测到。使用4个平行焦点(10mW at 800 nm 每焦点)的持续3s的飞秒激光对一个7X8um的区域进行pa-GFP 2光子激发开始 (b) 激发后很短时间内检测到一个强的荧光信号(c-e) pa-GFP从核内向细胞质的扩散被监测,直到两组分间达到平衡。荧光强度标尺显示在每幅图的左边。[img=,707,514]http://qd-china.com/uploads/bio-product/84.jpg[/img]Fig. 4.在核内被光激活后,pa-GFP从核内向细胞质扩散的量化分析。在激活前,核内(ROI)平均的1光子荧光强度非常低(平均强度~300).在26s和29s间的时间点,由飞秒激光激活诱导的荧光增强在图上进行了监测。 与光激活前相比,平均荧光强度是之前的大约5倍,伴随着ROI内的荧光降低。在第一个地方,监测到的细胞核内荧光下降是由于激活的pa-GFP向细胞质内的扩散。后来,光漂白变得显著。双指数拟合非常近似地拟合了整个荧光下降过程(红线)。以此方式计算出这个实验中175s的扩算时间常数。[img=,705,375]http://qd-china.com/uploads/bio-product/85.jpg[/img]Fig. 5. 烟草BY-2原生质体中At2g38360-DsRed的定位和平行双光子荧光显微镜对pa-GFP的3D监测(64 foci, 920 nm, 240 mW)。 (a) 双光子荧光下降的量化分析,给出了一个123s的扩散时间常数。Figs. 3 and 4中的数据源于两个不同的实验,解释了荧光值的绝对差异(不同的表达水平)和统计分析。 (b) At2g38360-DsRed作为转染标记在核中pa-GFP激活前的荧光 (c) At2g38360-DsRed和pa-GFP数据采集后400 s的3D荧光图像,清楚显示了荧光团从细胞核向细胞质的扩散。[img=,697,603]http://qd-china.com/uploads/bio-product/86.jpg[/img]Fig. 6.在核内光激活前后,烟草BY-2原生质体内活跃转运的pa-GFP-LCL1的3D动态监测和量化分析。(a) 在pa-GFP-LCL1双光子激发后核内的单光子荧光表明双光子激活荧光增强 (b) pa-GFP被双光子激活后双指数曲线拟合(红线)的荧光下降量化分析。计算得出的由于主动运输导致的核内pa-GFP-LCL1荧光下降的一个20s的时间常数(c,d) At2g38360-DsRed(转染标记)和pa-GFP-LCL1的双色双光子荧光3D成像 (c)核内光激活前 (d)数据获取后。[img=,691,345]http://qd-china.com/uploads/bio-product/87.jpg[/img]Fig. 7. 烟草BY-2原生质体的核输出阴性突变pa-GFP-LCL1(NESm)光激活前后的3D动态监测和量化分析。(a) pa-GFP-LCL1(NESm)被双光子激活后的单光子荧光显示了双光子激活荧光增强和激活后核内荧光极其缓慢的下降,反映了pa-GFPLCL1(NESm)的核限制 (b,c) At2g38360-DsRed (转染标记) 和 pa-GFP-LCL1(NESm) 的双光子荧光3D图像 (b) 光激活前的核内 pa-GFP (c) 数据获取后300s的时间点。
如题,立F-4500荧光分光光度计是否能对细胞内EGFP进行定量分析?我向Hela细胞中转入了绿色荧光蛋白,想对绿色荧光蛋白的表达量进行定量分析。不知道用荧光分光光度计是否可行?谢谢![color=red][I]疯子哥提示:由于你发的内容与GC无关,已经将其转到对应的版面,谢谢参与![/I][/color]
把蛋白完全水解成氨基酸,可以在pmol到nmol水平上分离和定量。虽然氨基酸的序列信息已经无法得到,但是组成蛋白的氨基酸种类及含量信息可以得到,利用氨基酸的指纹信息可以鉴定蛋白。
请教用荧光胺定量蛋白时有什么应该注意的地方?线性范围大概多少?
[font=宋体][b][font=宋体]抗绿色荧光蛋白[/font][font=Calibri](GFP)[/font][font=宋体]抗体,小鼠单克隆[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]GFP[/font][font=宋体]([/font][font=Calibri]Green fluorescent protein[/font][font=宋体],绿色荧光蛋白)标签含有 [/font][font=Calibri]238 [/font][font=宋体]个氨基酸,分子量约为 [/font][font=Calibri]26.9 KDa[/font][font=宋体],最先是 [/font][font=Calibri]1962 [/font][font=宋体]年下村修等在维多利亚多管发光水母([/font][font=Calibri]Aequorea victoria[/font][font=宋体])中发现的。[/font][font=Calibri]GFP [/font][font=宋体]标签在紫外线的照射下会发出绿色的荧光,而且与靶蛋白融合后不会显著地影响天然蛋白质的组装和功能。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]凭借[/font] [font=Calibri]10 [/font][font=宋体]多年在蛋白表达和抗体制备领域的技术积淀,义翘神州自主研发了多款抗 [/font][font=Calibri]GFP [/font][font=宋体]标签抗体。高品质的抗 [/font][font=Calibri]GFP [/font][font=宋体]标签抗体可用于检测 [/font][font=Calibri]GFP[/font][font=宋体](绿色荧光蛋白),满足多种应用的需求,包括蛋白印迹([/font][font=Calibri]WB[/font][font=宋体])、[/font][font=Calibri]ELISA [/font][font=宋体]或免疫沉淀([/font][font=Calibri]IP[/font][font=宋体])。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]特异性:单克隆抗绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])识别[/font][font=Calibri]N[/font][font=宋体]末端和[/font][font=Calibri]C[/font][font=宋体]末端[/font][font=Calibri]GFP[/font][font=宋体]([/font][font=Calibri]27 kDa[/font][font=宋体])标记的融合蛋白。抗体与原核表达载体表达的融合蛋白反应。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫原:[/font][font=Calibri]GFP[/font][font=宋体]标记的融合蛋白[/font][/font][font=宋体] [/font][font=宋体][font=宋体]生化[/font][font=Calibri]/[/font][font=宋体]生理作用:[/font][font=Calibri]GFP ([/font][font=宋体]绿色荧光蛋白[/font][font=Calibri])[/font][font=宋体]是一种用于检查基因表达和蛋白定位的报告分子。[/font][font=Calibri]GFP [/font][font=宋体]用紫外线[/font][font=Calibri]/[/font][font=宋体]蓝光激发时会发出绿光。[/font][font=Calibri]GFP [/font][font=宋体]荧光保持稳定,可在活细胞中进行无创检测。[/font][font=Calibri]GFP [/font][font=宋体]被认为是监测几种活细胞或生物体动态过程的工具。当在真核细胞或原核细胞中表达并被蓝光或紫外光照射时,[/font][font=Calibri]GFP [/font][font=宋体]产生明亮的绿色荧光。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]外形:[/font][font=Calibri]0.01 M [/font][font=宋体]磷酸盐缓冲液 [/font][font=Calibri](pH 7.4)[/font][font=宋体],含 [/font][font=Calibri]15 mM [/font][font=宋体]叠氮化钠[/font][/font][font=宋体] [/font][font=宋体][font=宋体]储存及稳定性:如需连续使用,请在[/font][font=Calibri]2-8[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]下储存,最长一个月。若需延长储存时间,可将溶液分装并冷冻。不建议反复冻融。如果长期储存时出现轻微浑浊,请在使用前通过离心澄清溶液。若工作稀释样品在[/font][font=Calibri]12[/font][font=宋体]小时内未使用完,则应丢弃。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]该如何选择表达克隆的标签[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、首先,需要确定融合标签的目的[/font][/font][font=宋体] [/font][font=宋体][font=宋体]蛋白纯化[/font] [font=宋体]:标签的普遍用途是蛋白纯化。小分子[/font][font=Calibri]6XHis Tag[/font][font=宋体]常被用于细胞内源蛋白的纯化。[/font][font=Calibri]6XHis Tag[/font][font=宋体]也广泛应用于大肠杆菌的蛋白纯化。可是哺乳动物细胞中因非分泌蛋白自身存在高组氨酸背景,因此极少使用[/font][font=Calibri]6XHis Tag[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Western Blot[/font][font=宋体]检测:若需要做[/font][font=Calibri]Western Blot[/font][font=宋体]实验来检测细胞裂解物中蛋白的表达,你可以选择有匹配的抗体的小分子标签。[/font][font=Calibri]FLAG Tag[/font][font=宋体]以其分子量小以及拥有许多与之匹配的商业化的抗体等优势,成为[/font][font=Calibri]Western Blot[/font][font=宋体]实验中常用的[/font][font=Calibri]Tag[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫沉淀反应:[/font][font=Calibri]FLAG Tag[/font][font=宋体]其分子量小以及拥有大量相匹配的商业用抗体等优势成为免疫沉淀反应中最常用的[/font][font=Calibri]Tag. [/font][font=宋体]其他常用的标签有:[/font][font=Calibri]HA[/font][font=宋体]和[/font][font=Calibri]cMyc.[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫共沉淀。首先,裂解您的样本,以释放蛋白。向试管中添加裂解液的同时,加入靶向融合标签的抗体,抗体会识别融合标签。然后抗体与蛋白[/font] [font=Calibri]A [/font][font=宋体]或 [/font][font=Calibri]G [/font][font=宋体]偶联微珠结合,后者拉出您的目标蛋白,以及与之复合的其他蛋白。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]活细胞成像:荧光蛋白([/font][font=Calibri]Fluorescent Proteins, FPs[/font][font=宋体])是活细胞成像常用的标记蛋白。其中最常用的是绿色荧光蛋白([/font][font=Calibri]GFP[/font][font=宋体])和它的衍生物([/font][font=Calibri]CFP, YFP, etc.[/font][font=宋体]),以及一些红色变体,如[/font][font=Calibri]dTomato[/font][font=宋体]和[/font][font=Calibri]mCherry.[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、考虑融合标签的影响[/font][/font][font=宋体] [/font][font=宋体]任何一类标签处于氨基酸序列的任一位置,都具有影响目的蛋白表达或功能的可能性。最主要原因是标签可能会干扰蛋白的正确折叠,致使目的蛋白失活或形成包涵体。其次,标签可能会中断亚细胞定位信号,这种情况下,蛋白能够正确翻译和折叠,但在细胞内所处的位置是错误的。因此,您需要知道添加的标签对目的蛋白的表达是否有影响。[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、考虑是在[/font][font=Calibri]N-[/font][font=宋体]端还是[/font][font=Calibri]C-[/font][font=宋体]端标记[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]N-[/font][font=宋体]端或[/font][font=Calibri]C-[/font][font=宋体]端标记的选择还需要根据蛋白结构、定位等特性。然而,倘若你没有确切的蛋白结构,或蛋白功能域图谱,建议分别构建[/font][font=Calibri]N-[/font][font=宋体]端标记和[/font][font=Calibri]C-[/font][font=宋体]端标记的表达克隆,以检测哪个更有效。[/font][/font][font=宋体] [/font][font=宋体][url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]重组蛋白表达技术[/b][/url]现已在生物学各个具体领域应用广泛,尤其是蛋白质的大规模生产和体内功能研究都需要应用重组蛋白表达载体。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]详情可以关注义翘神州:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-tag[/font][/font]
最近在做几个酸性蛋白的CIEF。贝克曼的方法比较适用于中性和偏碱性的蛋白分析,对于酸性蛋白分析效果不太理想。氨水迁移法比较适合酸性蛋白,但是据说很伤柱子,做不了几个样品。讨论一下,有没有人遇到同样的问题,是怎么优化方法的呢?我尝试调整占位剂的配比,暂时也没有得到理想的结果。
维纶基牛奶蛋白纤维和维纶基大豆蛋白纤维定性分析的研究维纶基大豆蛋白纤维是迄今为止我国获得的唯一完全知识产权的纤维发明,在纺织行业得到了快递的发展,广泛的应用,但与维纶基大豆蛋白纤维一样由我国企业自主研发的维纶基牛奶蛋白纤维也申请到专利好几年了,但迟迟没有相关标准的出台,使这一我国自主研发的新型纤维得不到有效利用新型纤维的不断推出,为我们提供了更多的纤维原料,但同时由于国家标准的相对滞后,给检测工作者带来了很大的难题,下面就目前市场上两种新型蛋白复合纤维给予试验,进行定性分析。主要原理是在观察了维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维显微结构和燃烧性状后,研究两者在常用化学试剂中的溶解性。试验结果表明,维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维在88%甲酸和浓硝酸中都能够部分溶解;在沸腾水浴中,维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维能够完全溶解于75%硫酸和98%硫酸牛奶蛋白纤维是再生蛋白质纤维,是以牛奶为原料经脱水、脱脂、分离、纯化、浓缩制成牛奶酪蛋白,与高分子化合物共混、共聚制成纺丝液,再经湿法纺丝而成;牛奶酪蛋白与聚乙烯醇制得的纤维称为维纶基牛奶蛋白纤维;牛奶酪蛋白与纤维素共聚制得粘胶基牛奶蛋白纤维。牛奶蛋白纤维含有多种氨基酸,具有良好的亲肤性和吸湿导湿性,抗菌防蛀,服用性强,受到消费者的青睐。维纶基牛奶蛋白纤维呈浅黄色,是由牛奶酪蛋白和聚乙烯醇大分子共混、共聚、醛化、揉和、脱泡,湿法纺成的纤维,克服了合成纤维吸湿性差和天然纤维强度低的不足,其比电阻介于天然纤维和合成纤维之间,吸湿性也优于聚乙烯醇纤维,在直接染料、弱酸性染料、活性染料和中性染料中都有良好的上染能力。本文在观察维纶基牛奶蛋白纤维和维纶基大豆蛋白纤维显微结构和燃烧性状后,研究两者在常用化学试剂中的溶解性,为纤维检测提供参数。大豆蛋白纤维属于再生植物蛋白纤维类,是以榨过油的大豆豆粕为原料,利用生物工程技术,提取出豆粕中的球蛋白,通过添加功能性助剂,与腈基、羟基等高聚物接枝、共聚、共混,制成一定浓度的蛋白质纺丝液,改变蛋白质空间结构,经湿法纺丝而成. 其有着羊绒般的柔软手感,蚕丝般的柔和光泽,棉的保暖性和良好的亲肤性等优良性能,还有明显的抑菌功能,被誉为“新世纪的健康舒适纤维”。大豆纤维是以脱去油脂的大豆豆粕作原料,提取植物球蛋白经合成后制成的新型再生植物蛋白纤维,是由我国纺织科技工作者自主开发,并在国际上率先实现了工业化生产的高新技术,也是迄今为止我国获得的唯一完全知识产权的纤维发明。1 试验1. 1试验材料、仪器和试剂纤维细度成分显微分析仪,万分之一电子天平;SHA-C水浴振荡器;鼓风恒温烘箱; 索氏萃取器;酒精灯;具塞三角瓶若干。甲酸(88%);硫酸(75%);浓硫酸(98%);浓硝酸;1MOL/L次氯酸钠溶液;石油醚(馏程为40℃~60℃)。1.2试验方法显微结构试验:用纤维细度成分显微分析仪观察纤维的显微结构。 以下试验维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维同一方法分别做一次燃烧性状试验:点燃酒精灯,用镊子夹取10mg左右纤维束,徐徐靠近火焰,观察试样对热的反应情况。将纤维移入火焰,观察纤维的燃烧情况;然后离开火焰,观察纤维的燃烧情况,并用鼻子闻试样燃烧刚熄灭的气味。最后,待试样熄灭冷却,观察残留物灰分的状态。预处理:取纤维5g左右,用定量滤纸包好,置于索氏萃取器中,用石油醚萃取1h,每小时至少循环6次,待试样中的石油醚挥发后,把试样浸入冷水中浸泡1h,再在(65±5)℃的水中浸泡1h,浸泡过程中时时搅拌。水(mL)与试样(g)之比为100:1。然后抽吸脱水,晾干。溶解性试验:准确称取试样1g置于具塞三角瓶中,加入100mL化学试剂,在搅拌条件下观察不同温度下纤维和试剂随时间的变化情况。待一定时间后,洗涤,抽吸排液,烘干。2 试验结果2.1显微结构在显微镜下观察维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维的横截面呈腰圆形或哑铃形,纵向有沟槽,两种纤维在显微镜下几乎无差别,无法区分这两种纤维。2.2燃烧性状维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维靠近火焰时现象都是熔融并卷曲;进入火焰,熔融、卷曲并燃烧;离开火焰,燃烧,有时会自然熄灭。燃烧过程中散发出蛋白质燃烧时所特有的臭味。纤维燃烧的一端形成黑褐色硬块。两种纤维在燃烧情况下,火焰颜色,气味几乎无差别,无法区分这两种纤维。2.3溶解性取维纶基牛奶蛋白纤维与和维纶基大豆蛋白纤维分别置于88%甲酸、75%硫酸、浓硫酸、浓硝酸和1MOL/L次氯酸钠溶液中进行溶解性试验, 品名/溶液88%甲酸[/ali
大家好,氨基酸分析仪与蛋白质测序仪有主要区别在什么地方呢?目前实验室需要进行氨基酸的测序分析,究竟买一台蛋白质测序仪好呢,还是氨基酸分析仪好呢?价格大概有多少呢?这些仪器有没有国产的呢 QQ:2392795357
牛奶是由水、蛋白质、脂肪、乳糖、盐类、维生素 E、A、B1 、B6、钙、铁、锌和少量卵磷脂等物质组成的混合物,其中牛乳蛋白质主要包括酪蛋白、乳清蛋白及少量的脂肪球膜蛋白质,酪蛋白具有很强的水结合能力,乳清蛋白可与水以及一些阳离子相结合;脂肪主要是棕榈酸、硬脂酸的甘油酯, 也含少量低级脂肪酸如丁酸、己酸、辛酸等;乳糖、水溶性盐类、水溶性维生素等呈分子或离子态分散于乳中。蛋白质的荧光主要来自于色氨酸,其激发与发射峰分别在 280nm 和 348nm,所以,我们认为峰Ⅲ反映的是牛奶中的蛋白质的贡献;根据牛奶分析仪的检测结果可知,饱和脂肪酸和维生素 VE 的激发与发射峰位均分别在 293nm 和 327nm 附近,所以峰Ⅱ(331nm)可能是牛奶中的脂肪和 VE所为;而 VA、VB1 和 VB6 的荧光峰分别在 490nm、415nm 和 395nm 处,它们在液态奶中属于微量物质,所以峰Ⅴ正是这些等多种物质荧光共同产生的。蛋白质的最佳激发波长为 280nm,且单一物质的荧光光谱近似高斯曲线,可推断峰Ⅲ在275nm 光激发下的荧光强度比在 265nm 光激发下的荧光强度强。但从牛奶分析仪的测量结果中看出峰Ⅲ的荧光强度基本上不变,牛奶分析仪的结果显示峰Ⅳ在 275nm 光激发下的荧光强度比在 265nm 光激发下的荧光强度大很多,且较宽的峰Ⅳ与峰Ⅲ有较多的重叠,很可能也有蛋白质的贡献。但同时可能还有一些未知的荧光团的贡献,考虑到牛奶中的乳糖成分相对较多,有关文献报道,乳糖可引起蛋白质的蓝移,这是由于乳糖与蛋白质分子折叠成更紧密的结构,则可认为峰Ⅰ是受乳糖影响下蛋白质产生的荧光峰。
为探究生物进程的分子机制,需要确定介导这个过程的蛋白质-蛋白质间的相互作用。研究蛋白质间相互作用的主要技术总结如下:一、酵母双杂交系统酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。将这种技术微量化、阵列化后则可用于大规模蛋白质之间相互作用的研究。在实际工作中,人们根据需要发展了单杂交系统、三杂交系统和反向杂交系统等。Angermayr等设计了一个SOS蛋白介导的双杂交系统。可以研究膜蛋白的功能,丰富了酵母双杂交系统的功能。此外,酵母双杂交系统的作用也已扩展至对蛋白质的鉴定。二、噬茵体展示技术在编码噬菌体外壳蛋白基因上连接一单克隆抗体的DNA序列,当噬菌体生长时,表面就表达出相应的单抗,再将噬菌体过柱,柱上若含目的蛋白,就会与相应抗体特异性结合,这被称为噬菌体展示技术。此技术也主要用于研究蛋白质之间的相互作用,不仅有高通量及简便的特点,还具有直接得到基因、高选择性的筛选复杂混合物、在筛选过程中通过适当改变条件可以直接评价相互结合的特异性等优点。目前,用优化的噬菌体展示技术,已经展示了人和鼠的两种特殊细胞系的cDNA文库,并分离出了人上皮生长因子信号传导途径中的信号分子。三、等离子共振技术表面等离子共振技术(SurfacePlasmonResonance,SPR)已成为蛋白质相互作用研究中的新手段。它的原理是利用一种纳米级的薄膜吸附上“诱饵蛋白”,当待测蛋白与诱饵蛋白结合后,薄膜的共振性质会发生改变,通过检测便可知这两种蛋白的结合情况。SPR技术的优点是不需标记物或染料,反应过程可实时监控。测定快速且安全,还可用于检测蛋白一核酸及其它生物大分子之间的相互作用。四、荧光能量转移技术荧光共振能量转移(FRET)广泛用于研究分子间的距离及其相互作用;与荧光显微镜结合,可定量获取有关生物活体内蛋白质、脂类、DNA和RNA的时空信息。随着绿色荧光蛋白(GFP)的发展,FRET荧光显微镜有可能实时测量活体细胞内分子的动态性质。提出了一种定量测量FRET效率以及供体与受体间距离的简单方法,仅需使用一组滤光片和测量一个比值,利用供体和受体的发射谱消除光谱间的串扰。该方法简单快速,可实时定量测量FRET的效率和供体与受体间的距离,尤其适用于基于GFP的供体受体对。五、抗体与蛋白质阵列技术蛋白芯片技术的出现给蛋白质组学研究带来新的思路。蛋白质组学研究中一个主要的内容就是研究在不同生理状态下蛋白水平的量变,微型化,集成化,高通量化的抗体芯片就是一个非常好的研究工具,他也是芯片中发展最快的芯片,而且在技术上已经日益成熟。这些抗体芯片有的已经在向临床应用上发展,比如肿瘤标志物抗体芯片等,还有很多已经应用再眼就的各个领域里。六、免疫共沉淀技术免疫共沉淀主要是用来研究蛋白质与蛋白质相互作用的一种技术,其基本原理是,在细胞裂解液中加入抗兴趣蛋白的抗体,孵育后再加入与抗体特异结合的结合于Pansobin珠上的金黄色葡萄球菌蛋白A(SPA),若细胞中有正与兴趣蛋白结合的目的蛋白,就可以形成这样一种复合物:“目的蛋白—兴趣蛋白—抗兴趣蛋白抗体—SPA\|Pansobin”,因为SPA\|Pansobin比较大,这样复合物在离心时就被分离出来。经变性聚丙烯酰胺凝胶电泳,复合物四组分又被分开。然后经Westernblotting法,用抗体检测目的蛋白是什么,是否为预测蛋白。这种方法得到的目的蛋白是在细胞内天然与兴趣蛋白结合的,符合体内实际情况,得到的蛋白可信度高。但这种方法有两个缺陷:一是两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用;二是必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。七、pull-down技术蛋白质相互作用的类型有牢固型相互作用和暂时型相互作用两种。牢固型相互作用以多亚基蛋白复合体常见,最好通过免疫共沉淀(Co-IP)、Pull-down技术或Far-western法研究。Pull-down技术用固相化的、已标记的饵蛋白或标签蛋白(生物素-、PolyHis-或GST-),从细胞裂解液中钓出与之相互作用的蛋白。通过Pull-down技术可以确定已知的蛋白与钓出蛋白或已纯化的相关蛋白间的相互作用关系,从体外传路或翻译体系中检测出蛋白相互作用关系。