各位老师有了解高效液相反相色谱的吗?求告知高效液相反相色谱原理?
跪求 ,莠去津的 液相反相分析方法 谢谢
请问大家非极性物质可以用液相反相柱进行分离吗?比如石油醚提物,氯仿提物。会不会对反相柱造成什么损伤呀?谢谢大家!
谁有噻呋酰胺的液相反相分析方法 关键是波长多少 。。。谢谢!!
迪马液相反相色谱柱的再生程序是怎么样的?
液相反相色谱分析中各组分为苯甲酸甲酯,苯甲酸乙酯,苯甲酸丙酯,苯甲酸丁酯,丙醇,异丁醇.请问各组分的流出顺序并说明原因.谢谢了!回答得好的话另有重谢!
请教下岛津的液相反相色谱柱,vp ods的最大柱压是多少呀?
新买的液相反向柱,用了一段时间后柱压骤增?各位大侠帮助分析一下,是何原因。流动相是乙腈水,后来用的是100%的甲醇,前几天出差,5天,回来后就压力过高了,大概在18--22MPa 之间吧。
最近在做一个项目:叔丁基亚磺酰胺,这种物质见水易发生水解。我们公司的分析室里的液相用的都是反相色谱柱agilent SB-C18和紫外检测器,流动相是乙腈/水和甲醇/水体系。由于易水解这种特性,很明显就不能用上述的两种体系来测,要么就是用纯乙腈或者纯甲醇来测样,但是这样的话,峰几乎是无法分开的。是不是说明这个项目得用正相来测?
请问各位师傅,正相反相柱子的主要区别在哪儿?
大家都知道,我们在用反向柱子的时候,当流动相中有盐,一般在做完样后都先用10%的乙腈冲柱子,然后再用90%的乙腈饱和柱子最近,听我同事说10%的乙腈也不能长时间冲柱子,因为水的亲和力很强,会破坏柱子里的填料,导致柱校降低。大家说说呢?是怎么一回事啊?
[color=#444444]反向高效液相色谱是流动相的极性大于固定相,极性大的物质先出峰,但有个问题我想不明白,当流动相为乙腈:水=50:50时,物质1在5.1min出峰,物质2在8.9分钟出峰,当改变流动相的比例为乙腈:水=30:70时,物质1和2的出峰时间均退后,而且物质1和2出峰时间相差更大,这应该怎么解释?水的极性大于乙腈,改变流动相的比例后,流动相的极性更大了,出峰时间不应该更短吗?为什么刚好相反?[/color]
做一个样品,第一次用反相体系,主峰在3分左右出峰,后面紧跟这就是一个杂质峰,改变条件就是分不开;第二次用正相体系,主峰在15峰左右出,走完一遍再没有别的杂质峰,不知道杂质跑哪了?另外,反相改正相,出峰顺序是不是相反的?
反向色谱增加有机相比例,保留时间问题?第一种说法:流动相极性减弱,洗脱能力下降,样品保留时间滞后,第二种说法,流动相极性减弱,样品分配系数减小,洗脱能力越强,保留时间提早,所以怎么看待这个问题?
所配溶液颜色太深对测定结果有无影响液相反应平衡
三 清洗硅胶基质的色谱柱 恢复一根已受污染的高效液相色谱柱的关键在于了解污染物的性质,然后寻找一种合适的溶剂将其去除。如果污染物是由于一些强保留物质的多次进样积聚而产生,一个除去这些污染物的简单的冲洗过程往往会使色谱柱恢复性能。有时,在经过了等度操作之后,用20个柱体积的90%~100%的溶剂B(二元反相体系中较强的溶剂)将会除去这些污染物。(表二列出了各种型号的高效液相色谱柱的柱体积,所以读者可以很轻易地确定色谱柱的冲洗体积。)例如,脂质类的化合物可以使用一些非水性的溶剂来去除,如甲醇、乙睛、四氢呋喃。如果你正在使用含水的缓冲流动相,则千万不能将流动相直接跳到强溶剂中。将流动相猛然间改到高比例有机相的举动会导致高效液相色谱流动体系的缓冲沉淀,这将会造成更加严重的问题,如使筛板堵塞,接口管路堵塞,泵的密封垫失效,刮伤泵的柱塞杆,使进样阀转子失灵。相反,应使用非缓冲的流动相来冲洗色谱柱(就是用水来代替缓冲液)。在经过了5~10个柱体积的非缓冲溶剂冲洗之后才能允许较强的溶剂流经色谱柱。 有时,流动相中的强溶剂组分是不能充分去除色谱柱中的污染物的。必须另外使用一种更强的溶剂或一系列的溶剂才能清洗色谱柱。假如污染物是非生物性的,则使用者可以通过一种或更多的其他有机溶剂来去除不需要的化合物。可以使用许多种的溶剂和溶剂组合方式。访问一些色谱柱生产厂商的网站可以浏览到一些推荐使用的溶剂系统。 一般来说,所有的清洗都会遵循一个相似的模式。清洗过程中的溶剂浓度是增加的,通常最后都是使用一些非极性的溶剂(例如:乙酸乙酯,乃至碳氢化合物),它将会有助于溶解一些脂质类和油类化合物。重要的是要确保这一系列的每个溶剂都能与所使用的下一个溶剂互溶。一个清洗循环的结论是,在回到初始的流动相系统之前,可通过中间的可互溶的溶剂反向走。例如,异丙醇就是这个中间步骤的一个极好的溶剂,因为它能够同有机溶剂互溶,如正己烷和二氯甲烷,而且同样也能够和水相溶剂互溶。因为异丙醇有很大的粘度,所以必须确保清洗时流速不能太高,否则会引起泵的压力过载。同样,如果使用了紫外检测器,则需避免使用在紫外光谱区有吸收的溶剂,因为这样会需要大量的清洗溶剂才能去除所有吸收的溶剂以得到一个稳定的基线。对于典型的键合硅色谱柱和无缓冲液的流动相的一个推荐使用的清洗系统就是:l100%甲醇;l100%乙睛;l75%乙睛——25%异丙醇;l100%异丙醇;l100%二氯甲烷;l100%正己烷; 当使用了二氯甲烷或正己烷作为冲洗溶剂后,由于溶剂的不互溶性,需要先用异丙醇冲洗色谱柱,而后才能使用含水的流动相。冲洗色谱柱的清洗溶剂的体积最小为柱体积的十倍。对于一根250mm×4.6mm的色谱柱,分析者可以使用经典的1~2mL/min的高效液相色谱流量。为了要回到原来的流动相,色谱工作者可以跳过颠倒使用该系列的清洗溶剂。推荐使用异丙醇为中间的清洗溶剂,然后用不含缓冲液的流动相冲洗,最后再用最初使用的流动相进行冲洗。四氢呋喃是另一个使用广泛的溶剂,它可以被用来清洗受污染的色谱柱。如果使用者怀疑色谱柱受到了比较严重的污染,则可以用二甲亚砜或二甲基甲酰胺与水以50:50的比例,以小于0.5mL/min的流速进行清洗。成功的反向液相色谱柱的再生需要花费相当多的时间,使用溶剂进行冲洗可以设置梯度程序来进行通宵操作。* 在清洗过程中产生了是否应该将色谱柱颠倒过来冲洗的问题。因为大部分的强保留的污染物都会留在色谱柱的前端,将色谱柱颠倒过来清洗会减少已被溶解的污染物流出色谱柱的迁移距离。就填料层的稳定性而言,大部分的现代高效液相色谱柱都是用比普通操作压要高得多的压力装填的;因此,色谱柱的填料层应该不会受到反向的流速的干扰。然而,如果色谱柱顶端的筛板的空隙要比底部的来得大,这种反向的方式则是有害的。比如说,如果底部筛板的空隙为2µ m,则足够容纳装填有平均填料粒径为5µ m的色谱柱。(含有粒径5±2µ m的尺寸分布)。然而生产商往往在色谱柱的顶端安装空隙度比较大的筛板,以防止其被样品或流动相颗粒所堵塞。如果这种筛板的空隙度要比粒径大小分布的最小微粒大,部分填料会经筛板而流出色谱柱,这样就会产生中空。如果色谱柱上有一个箭头来提醒色谱柱的流向,我觉得应该在反向使用色谱柱之前参考说明使用书,浏览生产商的网站,或与技术支持组进行商讨,以确定这是否是一个安全的举动。无论你是否将色谱柱反向使用,最好要将色谱柱同高效液相色谱检测器断开,使污染物或者颗粒留在筛板上而不流经检测池,因为这些物质会污染检测池。 清洗污染的反相色谱柱的频率依懒于有多少不明物质被注射到柱子中,因为反相色谱柱有时在分辨率损失和外来物质的洗脱前可以忍受大量的污染物, 使用者往往等到他们观察到一些异常现象才对柱子进行清洗。然而,长时间累积的污染物会使色谱柱的清洗工作变得更难。正因为如此,如果你知道自己的色谱柱很容易受到脏的样品基体的污染时,我建议定期清洗你的色谱柱。清洗的次数越多,清洗条件也就越简单。反相硅胶基质色谱柱中残留蛋白质的清洗 如果一些如血浆、血清的生物物质留在了反相液相色谱柱上,色谱工作者必须使用一些不同的清洗程序。在大部分情况下,一些比较纯的有机试剂如乙睛或甲醇是不能溶解肽和蛋白质的,所以它们不能有效清洗反相液相色谱柱。然而加入了缓冲液、酸或者一些离子对试剂的混合有机溶剂能够有效清洗这些物质。起初,可以尝试含比较高浓度的溶剂B的流动相来冲洗色谱柱。Freiser和他的同事(4)发现来回反复地梯度洗脱,使用三氟乙酸的水溶液和三氟乙酸—正丁醇可以使污染的反相液相色谱柱再生。Bhadway和Day(5)建议进样100µ L的三氟乙醇到250mm×4.6mm色谱柱可以达到清洗的目的。如果这些方案都失败了的话,推荐使用Cunico和他的同事们(6)的强洗脱液和溶解性的试剂(见表三)。然而,在用这些试剂冲洗色谱柱之前,应该参考色谱柱的手册,或和生产商进行商议,以确保其不会破坏色谱柱的填料。硅键合色谱柱的填料往往能够与这些试剂共存,而聚合物色谱柱可能会因为与特定溶剂结合而使填料产生膨胀或收缩,从而影响到色谱柱的性能。表三 用于HPLC反相色谱柱蛋白质物质除去的清洗溶剂溶剂组成乙酸1%的水溶液三氟乙酸1%的水溶液0.1%三氟乙酸-异丙醇40:60(V:V)(粘稠的,通常降低流速)TEA-异丙醇40:60(V:V)(在三乙胺混合前用0.25N的磷酸调节pH到2.5)尿素或胍的水溶液5-8M(调节pH到6-8)NaCl,Na3PO4,Na2SO4水溶液0.5-1.0M (Na3PO4 pH 7.0)DMSO-水 或 DMF-水50:50(V:V)来自参考文献6。如果使用了早期的一系列溶剂,则必须确保表三中的溶剂与这个系列中的溶剂都是互溶的。异丙醇是一个良好的中间冲洗溶剂。在体系中的清洗体积最少为20个柱体积。由于一些溶剂清洗系统具有一定的粘滞性,所以必须调整冲洗流速以避免产生超压。在清洗完一根含有胍和尿素的色谱柱后,需要用至少40~50柱体积的色谱级的水进行冲洗。对于反相高效液相色谱柱来说使用一些如十二烷基磺酸钠(SDS)和Triton的清洗剂来清洗是不妥的,因为这些化合物会强烈地吸附在硅胶基质的表面而难以去除。这些试剂会影响填料表层,改变填料的性质。然而,分离小组的研究发现,肽合成过程中保护基团和净化剂产物对柱子的污染,可以通过在流动相中注射500µ L的1%SDS溶液以1mL/min的流速进行冲洗(7)。如果接下来使用含0.1%(V/V)三氟乙酸的5%~95%乙睛的梯度,在开始的条件下进行平衡,多肽的分离效果则可恢复。
液相色谱出峰顺序和反相液相色谱出峰顺序有何不同同一组物质,采用正相液相色谱和反相高效液相色谱柱分别进行分离,出峰的顺序是不是会相反啊,比如使用正相色谱柱时是1、2、3、4、5种物质的出峰顺序为12345,而用反相柱时出峰顺序会变成54321啊,谢谢!
[color=#444444]我们分析的一个样品用的是正相液相色谱,但是里面有些组分不能确定,所以想做[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url],但是听说不能做正相的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url],所以考虑了做反相的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url],但是反相跟正相的图完全不一样,怎么办啊?哪位高手给点指点[/color]
[color=#444444]反相液相色谱法分离苯,甲苯,乙苯,联苯,先流出色谱柱的组分是什么[/color][color=#444444]没学过这方面的,百度一下也没看明白,求指教[/color]
[color=#444444]我的问题是:在反相高校液相色谱中,流动相有机溶剂的比例增加,所有样品的化合物的保留都会减弱,提前出峰。这是为什么?[/color][color=#444444]恳请各位给予解答,[/color]
[size=3][b]高效液相的操作中遇到的问题[/b][/size]请问薄层上展的很高的点即极性很小的点在反相柱中却最先流出是不是哪出现了问题希望有经验的给我讲解一下万分感激
由非极性固定相和极性流动相所组成的液相色谱体系。它正好与由极性固定相和弱极性流动相所组成的液相色谱体系(正相色谱)相反。RP-HPLC的典型的固定相是十八烷基键合硅胶,典型的流动相是甲醇和乙腈。RP-HPLC是当今液相色谱的最主要的分离模式,几乎可用于所有能溶于极性或弱极性溶剂中的有机物的分离。
请问 高效液相色谱的正相与反相怎么区分
替加环素的反相液相分析方法
纯品物质,在反相液相中出峰比较乱,是不是因为水合的原因?
反相高效液相色谱缓冲体系PH的选定反相高效液相色谱中缓冲体系PH值的选择在反相高效液相色谱分析中,选择正确的缓冲液PH值,对可离解的化合物分析的重现性十分重要,不恰当的PH值可能导致不对称峰,宽峰,分裂峰或肩峰,而尖锐的,对称的峰是定量分析中获得低的检测限以,两次分析之间较低的相对标准偏差(RSD)和保留时间的高重现性的前提。我们将讨论在使用缓冲液时如何选择缓冲液的PH值,以及如何选择正确的缓冲体系。什么时候需要缓冲溶液?在反相液相色谱分析中,流动相的PH值一般在2.5-7之间,当被分析物在反相条件下可离解,或样品的PH值在2.5-7之外时,就需要缓冲液。在反相条件下可离解的化合物一般都有氨基和羧基,他们的Pka在1-11之间,选择正确的缓冲液PH值可保证可离解的官能团以一种形式存在,离子形式或中性化合物的形式。如果样品的PH值对柱子有伤害,则缓冲溶液可使其变温和从而减小其危害。如何选择缓冲液PH值在选择缓冲液PH值之前,应先了解被分析物的Pka,高于或低于Pka两个PH值单位的,有助于获得好的、尖锐的峰,从HH公式:PH=Pka+log([A-]/[A])得知,溶液PH值高于或低于Pka两个单位,化合物中99%以一种形式存在,而一种形式存在的化合物才能获得好的尖锐的峰。如果选择不到合适的,样品的pKa与流动相的pH非常接近,那么流动相pH微小的变化,都会引起样品保留时间较大的变动。当化合物只有氨基时,缓冲体系的选择十分简单,大多数氨基化合物在PH值小于9时都被质子化,所以所有PH值在7或更低的溶液均适合应用,你也许会问水的PH值大约是7,为什么还用缓冲盐,因为缓冲盐有助于增加方法的可靠性,以及色谱峰的尖锐性,PH值的降低有助于氨基化合物保留的减弱,减小化合物与硅胶表面硅羟基的作用,而使峰更尖锐,从表1 可值,任何缓冲液均可应用于氨基化合物的分析,但我们认为PH值等于3的磷酸钾盐最适合用于氨基化合物的分析。在上面两个例子中,PH=3的磷酸钾盐都能获得良好的应用,在一般情况下,它是含羧基和氨基化合物分析中最好的缓冲液,并且我们认为在氨基化合物分析中钾盐比钠盐更好。为离子对试剂选择缓冲液为应用离子对试剂的方法选择缓冲液的过程是相似的,离子对试剂例如四丁基铵的盐,十四烷基磺酸钠等,在流动相中可与化合物中可离解的官能团配对,在缓冲液中以离子形式存在的化合物就需要应用离子对试剂。应用缓冲液PH值来调节方法选择性如前面提到的,氨基化合物的保留随PH的减小而降低,这个特性可以用来调节方法的选择性,如果两个化合物共流出,一个含有氨基,适当改变PH值就可以用来分离这一物质对。由于可离解化合物的选择性依靠PH值,所以变化PH值也可以用来鉴别未知化合物的官能团,如果PH值变小,出峰便快,则化合物中可能存在氨基,当PH变大,化合物出峰很快,或流出在死时间处,化合物可能是一种羧酸,因为羧基离子化后流出大大快于比质子化的中性化合物。总结正确选择缓冲溶液在反相液相色谱方法中对于优化尖峰,捡出限,以及获得稳定的保留时间十分重要,如果你知道化合物官能团信息和化合物的Pka值这一过程将十分简单。[em01] [em01]
请问“等度反相高效液相色谱法”中的“等度”是什么意思?是指等度洗脱吗?谢谢!
1.利用C18柱反相高效液相测定维生素D3的含量时流动相能否加入缓冲液?一般加入的缓冲液有哪些?以及缓冲液的ph值和所占流动相的比例是多少?2.利用C18柱反相高效液相测定维生素D3的含量时,它的含量如何计算?计算公式是什么?如何推导?与中国药典2010版有什么不一样?影响因子在反相高效液相中如何测定以及计算?3.测定维生素D3含量时,对照品的单位是mg,而样品中含有的维生素D3的单位是国际单位(IU),在配制溶液时,单位是否要换成一致,对后面的含量计算有什么影响?一般维生素D3在上反相液相是进样所配制的浓度范围是多少?
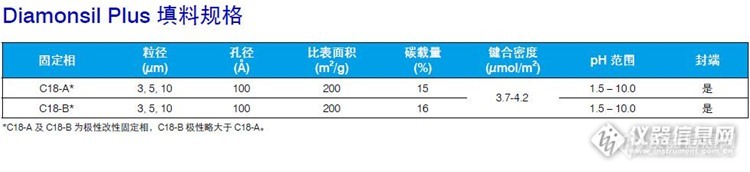
常规C18 色谱柱在高水相条件下长时间操作,经常会出现“柱塌陷” 现象,造成分析物的保留时间和分离度骤降。极性改性反相色谱柱由于采用独特的极性改性技术,通过引入极性基团使其表面更容易被水润湿,从而有效地避免了该现象的发生。此外,极性改性反相液相色谱柱在高有机相下表现同样出色,能在LC-MS 测试中加快去溶剂化的过程,从而有效提高LC-MS 的检测灵敏度。极性改性反相液相色谱柱的流动相适用范围可以从100% 水相到100% 有机相,使方法开发更加简单易行。极性改性反相色谱柱是以高纯硅胶为基质,采用独特的极性改性技术生产的色谱柱。这个系列的色谱柱不但保留了传统硅胶基质反相色谱柱的性能,而且又增加了一些新的特性:• 填料表面具有极性基团,适合于高水相条件下的分离• 增强了对亲水性、极性化合物的保留能力• 独特的选择性和优异的分离度• 降低了碱性化合物与残余硅羟基的相互作用,提高了色谱峰的对称性• pH 范围更宽,适合于分析酸、碱化合物迪马科技极性改性反相液相色谱柱有两个系列:一个是Spursil(思博尔)系列,包括Spursil C18 和Spursil C18-EP,二者的结构差异如下http://ng1.17img.cn/bbsfiles/images/2015/06/201506021619_548446_1610895_3.jpg一个是Diamonsil Plus 系列,包括Diamonsil Plus C18-A 及 Diamonsil Plus C18-B,Diamonsil Plus C18-B的极性略大约Diamonsil Plus C18-Ahttp://ng1.17img.cn/bbsfiles/images/2015/06/201506021624_548450_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/06/201506021624_548451_1610895_3.jpg
液相新人,有个疑问请教各位老师,分析极性化合物,为什么不直接采用正相系统或者Hilic色谱柱,而要在反相系统中使用离子对试剂来增强保留?