衣服穿久了要洗,色谱柱用久了要冲,不过冲洗色谱柱可不像洗衣服那么简单,到底该怎么洗,还是有些门道的:第一个问题:用什么冲1.1:什么叫冲洗色谱柱通常,色谱柱冲洗就是把色谱柱上的脏东西和对色谱柱有损坏的东西冲出来,并且保存在合适的溶剂中;还有另一种情况,也可以算作冲洗的范畴,就是梯度方法间重新平衡色谱柱的过程。1.2:常用的溶剂针对于反相色谱柱,通常是用到纯的水和有机溶剂,水主要是作为冲洗掉色谱柱中的盐和其他添加剂,而有机溶剂则是用来冲洗掉一些在色谱柱上有较强保留的污染物,除了在分析中常用到的甲醇和乙腈之外,还有一些对污染物去除能力更强的有机溶剂也可以使用,比如异丙醇。第二个问题:冲多久色谱柱到底要冲多久,这个是经常困扰大家的问题,20分钟,30分钟,还是一个小时?2.1.1:色谱柱冲洗的计算原理其实,冲洗色谱柱并不是一个时间概念,而是一个体积的问题:通常要完全置换色谱柱中的流动相,需要至少十倍柱体积,也就是说,要有至少十倍于色谱柱体积的溶剂流过色谱柱才能把里面原有的溶剂彻底置换。2.1.2:色谱柱体积的计算色谱柱的柱体积就是色谱柱的圆柱型体积乘以色谱柱柱填料的孔隙率(一般约为0.6),所以算下来,一根常用的4.6×150mm的色谱柱柱体积大约是1.5mL,如果是10倍柱体积的量,就是15mL,按照常用的1mL/min的流速,就是15min的时间。2.2.1:梯度重新平衡的冲洗时间不过,这仅仅是置换所有溶剂的时间,其实仅仅是适合于短期冲洗色谱柱,比如梯度方法间的平衡时间,但是这还要受到仪器延迟体积的影响,已经流动相是否容易重新达到化学平衡的考虑,通常仪器的延迟体积越大,这个时间要越长,如果所使用的流动相不容易达到化学平衡,还要加长时间,比如使用使用某些缓冲盐的情况。当然也后很多情况下,梯度方法间的平衡时间是不需要这么长的。2.2.2:清洁色谱柱的冲洗时间如果需要彻底冲洗色谱柱,还需要更长的时间,通常建议是20倍的柱体积,也就是说,对于4.6×150mm的色谱柱,要冲30分钟才能保证冲洗完全。其他规格的色谱柱可以根据色谱柱的规格和流速进行简单的计算。第三个问题:怎么冲色谱柱的冲洗,无非两个情况:正常情况下的冲洗和非正常情况下的冲洗3.1:正常情况下色谱柱的冲洗步骤3.1.1:使用不含添加剂流动相后的冲洗正常情况下,仅仅是对色谱柱进行流动相替换和净化,对于一般的方法,只需在方法结束后使用高比例的有机相比如甲醇或者乙腈冲洗色谱柱大约20倍柱体积即可。3.1.2:使用含盐或添加剂后的冲洗如果是使用的到的方法的流动相中含有缓冲盐或者其他添加剂的时候,先要使用和方法流动相起始比例相同的纯水相替代缓冲盐一相,冲洗20倍柱体积之后,再换上高比例有机相冲洗20倍柱体积。3.1.3:色谱柱冲洗后的保存对于色谱柱的保存,一般是存放在纯的有机相中,短期存放,甲醇乙腈均可,长期存放,建议储存在甲醇中。3.2:非正常状况下的冲洗如果是非正常的状况,就要考虑一些不走寻常路的冲洗办法了:什么叫做非正常状况?常见的有两种,柱效下降和堵塞:3.2.1:柱效下降色谱柱的冲洗对于柱效下降,我们首先要确定是色谱柱的问题而不是由于仪器或分析方法造成的,排除这两者,如果不是色谱柱损坏比如塌陷(物理冲击造成),键合相水解(高温低pH下长时间使用),硅胶基质水解(高pH下使用)等不可逆损伤造成的柱效下降,因为排除上述问题外,多数情况都是因为色谱柱不太正常的“脏”了,可以首先使用纯的甲醇或乙腈长时间冲洗色谱柱,如果还不能奏效,可以考虑使用纯的异丙醇冲洗色谱柱,异丙醇的洗脱能力比甲醇乙腈更强,能把很多这两种溶剂无法冲洗的污染物从色谱柱上洗脱下来。如果效果仍旧不明显,可以参考色谱柱说明书中的“色谱柱再生”一项里面的说法,使用更加强大的溶剂冲洗,不过这些溶剂通常不是常用的反相液相色谱溶剂。3.2.2:堵塞色谱柱的冲洗如果是遇到堵塞的情况,首先要确定堵塞是由于什么原因引起的,如果是由于色谱柱中残留的缓冲盐引起的,这是最万幸的堵塞了,可以尝试用高比例的水相(推荐95%)在较高的温度下冲洗色谱柱。如果是由于样品原因导致色谱柱堵塞,又要考虑另外的办法,如果是样品中含有太多吸附性很强的物质(有时是复杂样品中的某些杂质,无法通过过滤离心等办法去除)沉积吸附在柱头导致堵塞,可以尝试使用不同的溶剂(对此类物质有较好溶解性的)慢慢冲洗。如果是由于样品过滤不当或者样品在色谱柱上析出导致某些颗粒杂质堵塞了色谱柱,除了尝试寻找合适溶剂冲洗之外,只能考虑反冲了,通常,不建议反冲色谱柱,因为可能对色谱柱造成较大损害,所以反冲是迫不得已的死马当活马医的办法,一定要慎用。做好样品的前处理并使用预柱或在线过滤器才是保护色谱柱的好办法!3.3:快速冲洗色谱柱看上去很好很强大的说法,其实很简单,在冲洗色谱柱的时候,可以通过增加流速来缩短冲洗时间,我们已经知道色谱柱冲洗的完全程度是通过体积衡量的,所以提高流速是可以节省下时间的。但是要特别注意的是,对于堵塞的色谱柱,提高流速可能并不是个很可行的办法...
今日看到一篇文章,在讲到固定相稳定性时,作者说“经常清洗色谱柱会加速色谱柱固定相的水解”。清洗色谱柱是保养色谱柱的重要手段,但同时又“加速”了其固定相的水解,我们该如何抉择呢?你是否也赞同“经常清洗色谱柱会加速色谱柱固定相的水解”这个观点?
最近跑了一个HPLC肽谱,跑完之后跑了个空白,就把柱子收起来了,今天拿出来再做样品是发现在高有机相处有一杂峰,在70%B相,反复清洗了几次后强度未减弱,用纯乙腈清洗,40分钟,无色谱峰被洗脱,跑空白后杂峰仍存在,请教高手该如何清洗色谱柱?
仪器岛津LC20AT,色谱柱岛津C18大家使用色谱柱以前一般是怎样活化的呢?在每天日常检测完毕后又是如何冲洗的呢?看到有 资料说使用前需要用纯甲醇/乙腈冲洗色谱柱,待压力稳定后上流动相平衡色谱柱。在日常检测完毕后用90%左右的乙腈冲洗色谱柱一小时,之后保存在纯乙腈中。但是呢!又有资料说岛津不可以用纯乙腈冲洗……瞬间懵逼我平时是用20%的甲醇过度到90%的乙腈冲洗80min后,最后纯乙腈冲洗60min,保存在纯乙腈中……请问这样合理吗………………
气相色谱色谱柱的清洗
关于色谱柱冲洗问题,想请教一下各位大神有什么好的建议? 首先采用流动相为有机相和水相,其中有机相中有四氢呋喃只占5%,色谱柱为C8柱,我们在长期使用过程中发现,此色谱柱使用寿命有限,通常一个月左右(基本每天使用10小时左右),平时我们都是采用高低比例的甲醇或乙腈冲洗;想请教各位有没有什么办法延长该色谱柱的使用寿命(尤其是通过色谱柱冲洗来实现)
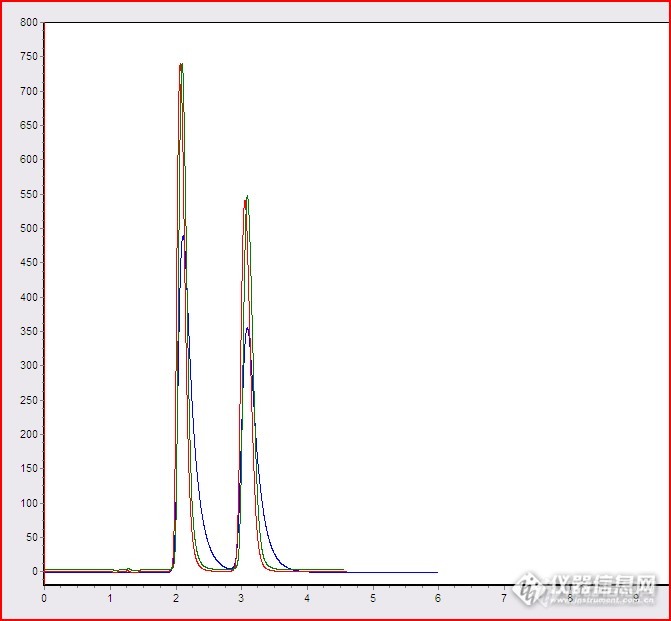
关于色谱柱的再生和修补论坛里已有很多类似的好帖,他们很详细的说明了色谱柱污染原因,再生方法以及如何修补,在这里我只是通过学习了他们的帖子,对于解决色谱柱的污染 再生 以及修补做一个实例分享,以便于有更多出现类似情况的盆友能够去解决实际问题。=======================================================================~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~先看一下污染后的色谱图(黑色) 再生后的色谱图(绿色) 修补后的色谱图(红色):http://ng1.17img.cn/bbsfiles/images/2015/05/201505181246_546500_2960432_3.png色谱柱的污染(黑色色谱图)现象:峰高降低,缝宽增加,分离度降低,严重拖尾,影响检测。采取措施:1:用色谱甲醇做流动相,以1.00ml/min的流速,反向(只适用于色谱柱两端封口一致的色谱柱)冲洗一小时,不接检测器。2:用异丙醇,以0.3ml/min的流速,反向冲洗三小时 3:再用甲醇,以1.00ml/min的流速,反向冲洗30分钟。 4:连接检测器,正向连接色谱柱,用流动性过渡, 5:基线平稳后,进样。进样色谱图(上图中绿色色谱图)这时,色谱图还是有点拖尾,卸开色谱柱进口螺帽,看污染情况,如下图:(柱头填料污染)http://ng1.17img.cn/bbsfiles/images/2015/05/201505181242_546497_2960432_3.jpg 筛板变黑,污染,如下图:http://ng1.17img.cn/bbsfiles/images/2015/05/201505181242_546498_2960432_3.jpg采取措施:1:挖去柱头污染的填料,大约1.5mm,挖去的污染填料如下图:http://ng1.17img.cn/bbsfiles/images/2015/05/201505181244_546499_2960432_3.jpg2:用同种填料,湿法填平挖去的柱头填料,筛板用异丙醇超声15分钟,再用水超声5分钟,用滤纸擦干,上好柱头螺丝。3:流动相冲洗30分钟,不连接检测器。4:连接检测器,过渡平衡,进样(如图:红色色谱图)结论:根据色谱柱出现柱效降低,分离效果不好,严重拖尾,影响正常检测的情况,进行了反向冲洗,以及修补,效果还是可以的,不免盆友见笑,说实在的这一根色谱柱在三个月以前已经进行了一次修补,现在是第二次修补,通过两次修补的色谱柱还能使用多久呢?让我们拭目以待吧!再者:对于使用效果不好的色谱柱,要根据情况作相应的处理,如果通过清洗能解决问题的一般不要修补,清洗不能达到使用效果的再进行修补。哈哈......这句名言已经有人说过了,我只是再背一遍哦http://simg.instrument.com.cn/bbs/images/default/em09502.gif=======================================================================~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~版友,盆友们:有关色谱柱的清洗 再生 修补 之类的帖子原创也好,分享也好,你认为有参考价值的其他版友的帖子也好,你可以把主题及链接方式,并作一些总结进行回复!你可以得到不同的积分奖励哦!如果你的回复是其他版友的帖子,你只是做了一些说明,和链接方式,那么,你可以把作者以“@作者”的方式出现哦!
[color=#3e3e3e][b]衣服穿久了要洗,色谱柱用久了要冲,不过冲洗色谱柱可不像洗衣服那么简单,到底该怎么洗,还是有些门道的:[/b][/color][color=#3e3e3e][b]第一个问题:用什么冲[/b]1.1:什么叫冲洗色谱柱通常,色谱柱冲洗就是把色谱柱上的脏东西和对色谱柱有损坏的东西冲出来,并且保存在合适的溶剂中;还有另一种情况,也可以算作冲洗的范畴,就是梯度方法间重新平衡色谱柱的过程。1.2:常用的溶剂针对于反相色谱柱,通常是用到纯的水和有机溶剂,水主要是作为冲洗掉色谱柱中的盐和其他添加剂,而有机溶剂则是用来冲洗掉一些在色谱柱上有较强保留的污染物,除了在分析中常用到的甲醇和乙腈之外,还有一些对污染物去除能力更强的有机溶剂也可以使用,比如异丙醇。[/color][color=#3e3e3e][b]第二个问题:冲多久[/b]色谱柱到底要冲多久,这个是经常困扰大家的问题,20分钟,30分钟,还是1小时?2.1.1:色谱柱冲洗的计算原理其实,冲洗色谱柱并不是一个时间概念,而是一个体积的问题:通常要完全置换色谱柱中的流动相,需要至少十倍柱体积,也就是说,要有至少十倍于色谱柱体积的溶剂流过色谱柱才能把里面原有的溶剂彻底置换。2.1.2:色谱柱体积的计算色谱柱的柱体积就是色谱柱的圆柱型体积乘以色谱柱柱填料的孔隙率(一般约为0.6),所以算下来,一根常用的4.6×150mm的色谱柱柱体积大约是1.5mL,如果是10倍柱体积的量,就是15mL,按照常用的1mL/min的流速,就是15min的时间。2.2.1:梯度重新平衡的冲洗时间不过,这仅仅是置换所有溶剂的时间,其实仅仅是适合于短期冲洗色谱柱,比如梯度方法间的平衡时间,但是这还要受到仪器延迟体积的影响,已经流动相是否容易重新达到化学平衡的考虑,通常仪器的延迟体积越大,这个时间要越长,如果所使用的流动相不容易达到化学平衡,还要加长时间,比如使用使用某些缓冲盐的情况。当然也有很多情况下,梯度方法间的平衡时间是不需要这么长的。2.2.2:清洁色谱柱的冲洗时间如果需要彻底冲洗色谱柱,还需要更长的时间,通常建议是20倍的柱体积,也就是说,对于4.6×150mm的色谱柱,要冲30分钟才能保证冲洗完全。其他规格的色谱柱可以根据色谱柱的规格和流速进行简单的计算。[/color][color=#3e3e3e][b]第三个问题:怎么冲[/b]色谱柱的冲洗,无非两个情况:正常情况下的冲洗和非正常情况下的冲洗[b]3.1:正常情况下色谱柱的冲洗步骤[/b]3.1.1:使用不含添加剂流动相后的冲洗正常情况下,仅仅是对色谱柱进行流动相替换和净化,对于一般的方法,只需在方法结束后使用高比例的有机相比如甲醇或者乙腈冲洗色谱柱大约20倍柱体积即可。3.1.2:使用含盐或添加剂后的冲洗如果是使用的到的方法的流动相中含有缓冲盐或者其他添加剂的时候,先要使用和方法流动相起始比例相同的纯水相替代缓冲盐一相,冲洗20倍柱体积之后,再换上高比例有机相冲洗20倍柱体积。3.1.3:色谱柱冲洗后的保存对于色谱柱的保存,一般是存放在纯的有机相中,短期存放,甲醇乙腈均可,长期存放,建议储存在甲醇中。[b]3.2:非正常状况下的冲洗[/b]如果是非正常的状况,就要考虑一些不走寻常路的冲洗办法了:什么叫做非正常状况?常见的有两种,柱效下降和堵塞:3.2.1:柱效下降色谱柱的冲洗对于柱效下降,我们首先要确定是色谱柱的问题而不是由于仪器或分析方法造成的,排除这两者,如果不是色谱柱损坏比如塌陷(物理冲击造成),键合相水解(高温低pH下长时间使用),硅胶基质水解(高pH下使用)等不可逆损伤造成的柱效下降,因为排除上述问题外,多数情况都是因为色谱柱不太正常的“脏”了,可以首先使用纯的甲醇或乙腈长时间冲洗色谱柱,如果还不能奏效,可以考虑使用纯的异丙醇冲洗色谱柱,异丙醇的洗脱能力比甲醇乙腈更强,能把很多这两种溶剂无法冲洗的污染物从色谱柱上洗脱下来。如果效果仍旧不明显,可以参考色谱柱说明书中的“色谱柱再生”一项里面的说法,使用更加强大的溶剂冲洗,不过这些溶剂通常不是常用的反相液相色谱溶剂。3.2.2:堵塞色谱柱的冲洗如果是遇到堵塞的情况,首先要确定堵塞是由于什么原因引起的,如果是由于色谱柱中残留的缓冲盐引起的,这是最万幸的堵塞了,可以尝试用高比例的水相(推荐95%)在较高的温度下冲洗色谱柱。如果是由于样品原因导致色谱柱堵塞,又要考虑另外的办法,如果是样品中含有太多吸附性很强的物质(有时是复杂样品中的某些杂质,无法通过过滤离心等办法去除)沉积吸附在柱头导致堵塞,可以尝试使用不同的溶剂(对此类物质有较好溶解性的)慢慢冲洗。如果是由于样品过滤不当或者样品在色谱柱上析出导致某些颗粒杂质堵塞了色谱柱,除了尝试寻找合适溶剂冲洗之外,只能考虑反冲了,通常,不建议反冲色谱柱,因为可能对色谱柱造成较大损害,所以反冲是迫不得已的死马当活马医的办法,一定要慎用。做好样品的前处理并使用预柱或在线过滤器才是保护色谱柱的好办法![b]3.3:快速冲洗色谱柱[/b]看上去很好很强大的说法,其实很简单,在冲洗色谱柱的时候,可以通过增加流速来缩短冲洗时间,我们已经知道色谱柱冲洗的完全程度是通过体积衡量的,所以提高流速是可以节省下时间的。但是要特别注意的是,对于堵塞的色谱柱,提高流速可能并不是个很可行的办法...[/color][color=#3e3e3e]转载于:液相达人馆[/color]
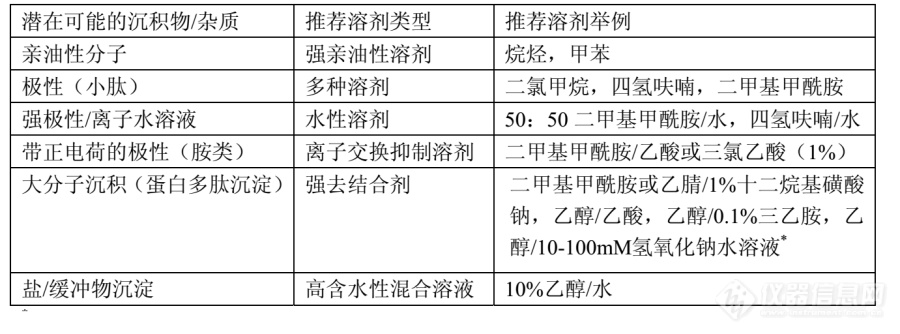
[b]色谱柱的清洗和再生[/b]反压升高、保留时间改变、柱效下降,这些表征现象都在提示柱床内或者移动相表层有沉积物存在。大多数时候,可以按照正确的清洗步骤来处理解决以上问题。值得注意的是,在大多数情况下越早动手清洗(再生)效果越好。强吸附性物质总是会停留在色谱柱的溶剂导入端,许多情况下反向冲洗会有助于色谱柱的清洗。值得指出的是,装填效果好的色谱柱是不会因为逆流操作而降低性能的。在反相色谱中沉积物通常会以填料床表面吸附物或沉淀的形式存在。对于不同类型的杂质可采用的冲洗溶剂详见下表:[img=,690,255]https://ng1.17img.cn/bbsfiles/images/2018/08/201808301104043318_1334_2428063_3.png!w690x255.jpg[/img]*作为最后的选择,使用量不超过 10 倍柱体积,操作最后用乙醇/1%水性乙酸(50: 50)酸化固定相填料。再生操作步骤:1. 针对杂质选择合适的溶剂/溶剂混合比。在杂质成分未知时,权当强极性/离子物质情况处理以防止沉淀的进一步产生。2. 降低移动相流速(正常流速的 10%),尽可能用反相工作模式并略微提高一点工作温度(40℃),冲洗量上限为 10 倍柱体积。3. 反压出现异常时,选择在常用流速下频繁查看反压的变化情况。4. 如果问题没有好转,使用针对带正电荷极性和/或大分子沉积物的冲洗条件。如果使用十二烷基磺酸钠作为冲洗液,事后需用纯四氢呋喃,二甲基甲酰胺或者乙腈对色谱柱做彻底冲洗。5. 如果问题顽固存在。请联系我方技术支持寻求进一步帮助。本文来源于上海鲲霆生物网站
[color=#3e3e3e]用溶剂清洗色谱柱包括将色谱柱从GC上卸下来,并将几毫升溶剂至于色谱柱中。任何可溶于清洗剂的残留物就会从色谱柱中去除。如果未卸下色谱柱就注入大量溶剂,将不能清洗色谱柱,也不能从色谱柱中去除任何污染物。毛细管GC色谱柱必须具有键合和交联的固定相才可以使用溶剂进行清洗。使用溶剂清洗非键合的固定相会严重损坏色谱柱。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 可使用色谱柱清洗装置来将溶剂注入色谱柱中,溶剂冲洗装置会连接到有压力的气源(N2或He),并把色谱柱插入到清洗装置中。把溶剂加入样品瓶中,然后使用气源对溶剂瓶回压。压力会强制溶剂流过色谱柱。残留物将溶解到溶剂中,并随溶剂反冲出色谱柱。然后将溶剂吹扫出色谱柱,并对色谱柱进行适当的老化。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 清洗色谱柱前,从色谱柱的前端将其切去半米(即靠近进样器的一端)。将色谱柱连接检测器的一端插入清洗装置中。通常使用多种溶剂来清洗色谱柱。后面继续使用的溶剂必须与前面的溶剂互溶。一定不要使用高沸点溶剂,特别是不要用作最后使用的溶剂。溶解样品的溶剂通常是不错的选择。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 建议使用甲醇、二氯甲烷和已烷,它们在大多数情况下都不错。可使用丙酮替代二氯甲烷、以避免使用含氯溶剂,但是二氯甲烷是最好的清洗溶剂之一。如果注射的是水性样品(例如生理体液或组织),则请在使用甲以前先使用水来冲洗。某些来自于水性样品残留物只能溶于水中而不溶于有机溶剂。应使用水和醇类(例如甲醇、乙醇和异丙醇)来清洗键合的聚乙二醇基固定相,但一般不建议采用该方法。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 下表列出了针对各种直径的色谱柱,建议使用的溶剂的体积。使用大量溶剂虽无害,但效果不会好很多,并且还十分浪费。加入第一种溶剂后,对清洗装置加压,但要低于20psig。使溶剂流速低于1ml/min。除大多数0.53mm内径的色谱柱外,在流速达到1ml/min之前清洗装置的压力将先达到20psi。如果使用的是比重较大或粘度较大的溶剂,或色谱柱长度长或内径小,则需要较长的清洗时间。第一种溶剂全部进入或大部分进入色谱柱中后,加入下一种溶剂。当开始加入第二种溶剂后,上一种溶剂不要完全赶出色谱柱。[/color][color=#3e3e3e] [/color][color=#3e3e3e] 最后一种溶剂流出色谱柱后,让加压的气体流入色谱柱5-10分钟,将色谱柱装入进样口,然后通入载气。将载气通入色谱柱5-10分钟。把色谱柱连接到检测器上(或也可以不接检测器)。使用程序升温,从40℃-50℃开始将色谱柱以2-3℃/min的速度达到温度上限。将此温度保持1―4个小时,直至色谱柱完全老化为止。[/color][color=#3e3e3e][/color][color=#3e3e3e]冲洗色谱柱的溶剂体积[/color][table][tr][td][color=#3e3e3e]色谱柱内径(mm)[/color][/td][td][color=#3e3e3e]溶剂体积(ml)[/color][/td][/tr][tr][td][color=#3e3e3e]0.18-0.2[/color][/td][td][color=#3e3e3e]3-4[/color][/td][/tr][tr][td][color=#3e3e3e]0.25[/color][/td][td][color=#3e3e3e]4-5[/color][/td][/tr][tr][td][color=#3e3e3e]0.32[/color][/td][td][color=#3e3e3e]6-7[/color][/td][/tr][tr][td][color=#3e3e3e]0.45[/color][/td][td][color=#3e3e3e]7-8[/color][/td][/tr][tr][td][color=#3e3e3e]0.53[/color][/td][td][color=#3e3e3e]10-12[/color][/td][/tr][/table]
气相色谱柱是气相色谱仪的核心部件之一。在气相色谱分析时,色谱柱的选择至关重要,需要考虑待测组分的性质、实验条件(如柱温、柱压的高低)等等。在我们查阅资料的时候,经常看到将气相色谱分为气固色谱和气液色谱,将气相色谱柱分为毛细管色谱柱和填充色谱柱,它们是根据什么条件划分的呢?它们之间有何区别?经常提到的毛细管色谱柱和填充色谱柱,在分析工作中应该如何选择呢?
色谱柱使用完毕以后要进行清洗?如何清洗是最优方案?用甲醇洗?用乙腈洗?还是用95%的水甲醇溶液清洗?怎么做才能最大程度的保护好色谱柱?延长色谱柱的使用寿命?
最近看了篇文章:The cleaning and regeneration of reversed-phase HPLC columns觉得写得挺不错的,想到让实验室的同事自己来看原文不太现实,就想着把它翻译过来的。经过一周的努力,终于弄完了,现分享给大家,方便有需要的朋友参考。另外,原文可以在这里下载:http://www.instrument.com.cn/download/DownLoadFile.asp?id=20468&huodong=2这次我也会把原文和译文一起都发一下,欢迎下载,鉴于原文有相应的表和图以及参考资料,在译文中我就都省掉了,如要了解更清楚,请参考原文信息。此外,有些地方翻译不出来或不太明白,我也用红色标注出来了,希望能够得到大家的指导,谢谢!拙文,请勿见笑。反相高效液相色谱柱的清洗与再生RonaldE. Mayors, Agilent Technologies, Wilmington DelaWare, USA.本月的”ColumnWatch”介绍一些实用的使被污染的色谱柱性能恢复或接近恢复至初始水平的方法。Ron Majors也会讨论一些键合硅胶和其他类型的反相色谱柱的清洗方法。迄今为止,反相色谱是高效液相色谱中使用最广泛的技术,它能普及的原因是其能适用于绝大多数非极性化合物,很多可解离和离子化合物的分析。反相色谱中使用的固定相大多是天然存在的疏水化合物,因此,被分析物因它们与固定相之间相互作用的不同而被分离开来,同时,极性表中疏水性接近的化合物也表现出相似的色谱行为。表1列出了与硅胶键合的最常用的固定相,固定相的亚种,比如混合固定相(如苯基-已基混合),终端封尾以及其变种和极性包合固定相也被统计在了这些硅胶键合相之中,多种其他包合材料也被用在了反相色谱中,包括高分子聚合物,聚合物包裹硅胶,氧化铝,无机-有机混合物和石墨化碳。第一种固定相都有它的优势和不足。反相色谱柱被用于多种使用各种流动相和添加物的应用中,有一些应用中使用的添加物会改变填料的表面性质,有时这些添加物本身硅胶会污染填充物表面或键合相。由于疏水键合相的存在,键合硅胶颗粒的表面会有一些特性。残留的硅醇会存在于所有键合硅胶颗粒的表面。图1显示了硅醇可能存在的多种形式。在弱酸性环境中,这些硅醇能和特定的化合物和基质成分特别是碱性化合物发生相互作用。因为硅醇的PKa大约为4.5,在中等PH条件下会发生解离,因此有可能与阳离子组分发生静电相互作用。传统的A型硅胶的金属离子含量会很高(有时高达100ppm甚至更高),这些金属离子会将酸性更强的物质引入到硅胶表面中,也会与金属螯合物或清洁剂发生相互作用。残留硅胶对非终端封尾和像C2或C4这样的短链键合相的影响会更大。用户必须清楚他们所使用的固定相的表面性质以及被分析物与固定相表面的相互作用,这样在他们开发和使用反相方法时,就可以把这些因素考虑进去,例如,像玉米油,高级芳香化合物和蜡这样的样品基质会粘附在反相填料表面并改变其性质,含有蛋白质成分的生物样品也会吸附在填料颗粒表面,即使分析师采用最好的方法来避免外来物质的污染以保护色谱柱,最终待分析物-基质仍然会影响固定相。色谱柱在被污染后,它的色谱表现会不同于未被污染的色谱柱。本期的”Column Watch”会介绍一些使色谱柱恢复或接近恢复其初始状态的实用方法。由于硅胶键合色谱柱使用最广泛,我会特别重点介绍这一方面,在本文结束的时候,我也会讨论其他类型的反相色谱柱的清洗规程。反相色谱柱是如何被污染的?通常,样品基质中会含有一些与目标分析物无关的物质。在使用过程中,盐,酯类,脂肪化合物,有机酸,疏水蛋白和其他生物组分是一部分可能与色谱柱发生相互作用的物质。与目标分析物相比,这些物质的保留能力可能更强,保留能力较弱的化合物,如盐,通常在死体积内被冲出色谱柱,这些预料之外的干扰可被检测器检测到,表现为色谱峰分叉,基线波动甚至是负峰。如果样品基质成分在色谱柱上的保留能力很强,而流动相的洗脱能力从来都没有强到足以将这些化合物冲出来,那么在多次进样后,这些吸附在色谱柱上的基质组分就会聚集,当足够多时,它们就会像新的固定相一样表现出性质,被分析物与这些污染物的相互作用会影响分离机制,可能导致保留时间波动和峰拖尾。如果污染物更多,则柱压可能升至很高的水平,甚至超过柱压上限,也可能造成色谱柱坍塌并形成死体积,这取决于堵塞形成的位置。冲洗硅胶键合色谱柱复原一根被污染的色谱柱的关键是知晓污染物的性质并找到能够将其清除的适当的溶剂。当污染来自于重复生进样后强保留物质的积累时,一些简单的能将这些物质清除的处理方法通常能恢复色谱柱的性能。有时用相同的操作,即用20个柱体积的90%~100%B相(双通道色谱中洗脱能力更强的溶剂)冲洗色谱柱。表2列出了多种规格的色谱柱柱体积,这样读者在用非水溶剂如甲醇,乙腈或四氢呋喃冲洗色谱柱时就能很容易确定适当的冲洗体积。如果你的流动相为缓冲盐溶液,不要直接过渡到强溶剂,直接过渡到高浓度的有机溶剂会使缓冲盐在HPLC流路系统中析出结晶。这会导致更严重的后果,比如筛板堵塞,接头连接处堵塞,柱塞杆初始化失败,柱塞杆磨损或进样阀转动失败。相反,用5~10个柱体积的不含缓冲盐的流动相(即用水来替代缓冲盐)冲洗色谱柱后就可以用洗脱能力更强的溶剂来冲洗色谱柱了。很多时候,流动相中洗脱能力更强的溶剂仍不足以清除色谱柱上的污染物,这时为了清除色谱柱上的污染物就需要使用一种或多种洗脱能力更强的溶剂了。如果这些污染物是非生物性的,那么使用者可以用一种或多种有机溶剂来冲洗色谱柱以清除掉这些污染物。可以使用的溶剂或混合溶剂有很多种,可访问一家或数家色谱柱生产厂商的网站以获取各种关于溶剂系统的建议和提醒。总体而言,所有的清洗过程都遵循相似的原则,即所使用的溶剂的洗脱能力越来越强,常常以一种极性非常低的溶剂(比如乙酸乙酯甚至是碳氢化合物)结束,这种溶剂对清除像蜡类,油酯这样的非极性化合物很有帮助。确保冲洗过程中任何相邻的两种溶剂的混溶性是非常重要的。在冲洗完后,应当用适当的溶剂过渡后再使用初始流动相来冲洗色谱柱。举个例子,异丙醇就是一种优良的过渡溶剂,因为它既可以与像正已烷或二氯乙烷这样的有机物混溶,也可以与水溶性试剂相混溶。由于异丙醇的粘度很大,注意控制其流速以免系统压力超过压力上限。同时,如果使用了紫外检测器,则应避免使用在紫外区有吸收的溶剂,否则就需要用大量的溶剂来清除掉这些溶剂以得到稳定的基线。对于普通的硅胶键合色谱柱并且使用的流动相中不含盐时,可用下面的程序进行清洗:·100%甲醇·100%乙腈·75%:25%乙腈甲醇混合液·100%异丙醇·100%二氯甲醇和·100%正已烷如果使用二氯甲烷或正已烷冲洗了色谱柱,由于溶剂的不相溶性,在恢复至水溶性流动相之前,必须用异丙醇过渡。每一种用来清洗色谱柱的溶剂至少需要10个柱体积,对于规格为250mm×4.6mm的分析柱来说,分析员可以用典型的1~2ml/min的流速来进行冲洗。为了恢复至最初使用的流动相,分析员没有必要将清洗时的整个程序反着来一遍,建议使用异丙醇过渡,然后用不含缓冲盐的溶液,最后使用最开始的流动相来冲洗色谱柱。四氢呋喃也是一种常用于清洗污染色谱柱的溶剂,如果用户怀疑存在严重污染,也可以用二甲亚砜(DMSO)或二甲基甲酰胺与水以50:50比例混合,然后以小于0.5ml/min的流速冲洗色谱柱,成功的反相色谱柱再生是一个特别耗时的过程,可以在夜间来运行这种梯度冲洗程序。有一个值
除非特殊说明,在所有情况下,所用溶剂的体积应该是色谱柱体积的40-60倍。应在清洗过程开始和结束时各测一次柱效和容量因子等,比较色谱柱性能的改善,以确定清洗的效果。确保色谱柱中没有样品和缓冲溶液,清洗前所用的溶剂应与最初清洗时所用的溶剂相溶。应确保实验测试时所用的流动相与色谱柱中最后的溶剂相溶。1.正相填料用四氢呋喃冲洗。用甲醇冲洗。用四氢呋喃冲洗。二氯甲烷冲洗。用无苯正己烷冲洗。2.反相填料用HPLC级水冲洗,冲洗时进4等份的200μl的二甲亚砜(DMSO)。用甲醇冲洗。用氯仿冲洗。用甲醇冲洗。3.阴离子交换填料用HPLC级水冲洗。用甲醇冲洗。用氯仿冲洗。
一般情况下正相色谱柱的清洗和再生的操作:清洗:每次清洗先用低流速,当检测到柱压稳定在一定水平后再增加流速。先用10柱体积不含其它添加剂的流动相中的弱溶剂,如正己烷、氯仿等反冲色谱柱。再用20柱体积的诸如二氯甲烷或异丙醇等流动相中的强溶剂反冲色谱柱。再生:用四氢呋喃,甲醇,四氢呋喃,二氯甲烷,正己烷分别冲洗20个柱体积。
实话说,这个问题的求解欲望是被开开勾引起来的。http://simg.instrument.com.cn/bbs/images/brow/em09510.gif谁让他前几天一直发“无线套打”的制备色谱图来。然后就想搞明白,制备色谱柱和分析色谱柱,到底有什么关系?难道,制备色谱柱只是分析色谱柱的放大——柱长放大,柱径放大?还是,还有别的神秘之处?
我使用的新色谱柱一开始理论塔板能达8000多,经过八个月的连续使用,理论塔板降至3000~4000,且峰的分离效果不好,是不是与我的清洗方式有关,把柱子弄得不好了,我想问一下色谱柱怎样清洗对柱子起到更好的效果作用(我自己的清洗方式:10%甲醇以1.0流速清洗1~2h,用甲醇同流速保存1~2h)。能否有更好的处理方式让这根柱子的柱效提高一些。
我在去年3月份气相版面的讲座中增加提到过,色谱柱的维护有两种方法,一种是高温老化,一种是色谱柱冲洗。高温老化虽然能除去部分高沸点物质的残留,但是会对色谱柱造成不可逆损坏,降低柱效和使用时间,而色谱柱冲洗无论从清洗的彻底程度还是对色谱柱的损害较高温老化都有明显优势,但问题在于这个操作相对麻烦,要求也高,很少有人会去做。不过还是想问下有没有高手试过,真如传说中那么麻烦吗?维护效果如何呢?
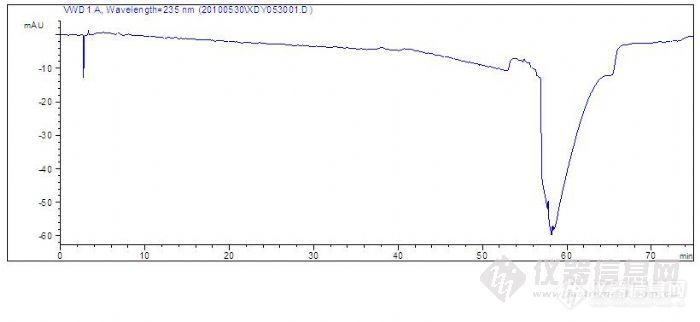
在这篇帖子中,是一个色谱柱的筛板污染后走出的色谱图谱,见【分享】一个色谱柱污染后的图谱:http://bbs.instrument.com.cn/shtml/20100611/2605541/我卸开柱头,把筛板清洗后图谱明显变好,如下:http://ng1.17img.cn/bbsfiles/images/2010/06/201006130954_224219_1622024_3.jpg
冲洗对色谱柱的影响 用纯水短时间内冲洗色谱柱,通常不会对色谱柱造成较大的损伤,但如果长时间用水冲洗色谱柱则可能引起固定相流失和相塌陷现象,所以若非必要请尽量避免用纯水冲洗色谱柱,建议在水中加入一定量的甲醇或乙腈进行冲洗,通常水的含量90%不会对色谱柱造成任何影响。 原因分析: 首先,由于目前所用的色谱柱大多以硅胶为基质,硅胶的溶解特点是在纯水中的溶解度比在含有一定浓度有机溶剂的流动相中要大得多,所以长时间的用纯水冲洗会导致固定相的流失,引起柱效下降。 其次,对于常规的C18柱而言,由于C18长链与水是不互溶的,C18长链之间的相互作用力大于C18 与水分子的作用力,长时间的用水冲洗,使得C18 长链之间相互靠近,水流的冲刷,导致相互联结的C18 长链倒伏在硅胶基质的表面,对疏水性物质的保留能力下降,即相塌陷。针对用纯水冲洗容易出现相塌陷的现象,有些厂家推出了纯水柱(如我公司的 UltimateTM AQ-C18 柱),这种纯水柱可以用纯水作流动相而不会产生相塌陷,这对只溶于纯水的样品的分析提供了一个很好的选择。
色谱柱的清洗我用的柱子是Z715柱子,在做过生物柴油(用麻风油与甲醇酯化反应得到的)的检测后,发现谱图没有峰。请问这是什么原因?是柱子被堵了吗?应该怎样清洗。谢谢!!!!
想用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]分析CO2催化加氢反应的原料及产品,请问用什么色谱柱分析?最好是国产的色谱柱,谢谢
清洗键合硅胶反相色谱柱的特殊方法有时,使用有机溶剂是不能去除色谱柱上的污染物的。如果金属离子被硅胶吸附或与键合,这种情况就特别明显了。这时,可以使用螯合试剂如0.05M的乙二胺四乙酸(EDTA)来冲洗色谱柱。EDTA会同许多金属形成络合物,并把他们进行溶解。在使用过了EDTA后,分析者可以用水彻底冲洗色谱柱。如果样品基体含有一些离子性的化合物,可以改变pH值使其变成非离子状态,然后用水—有机溶剂混合溶剂进行冲洗。例如,一个强碱性的基体化合物可以将其pH值调到小于3而将其去除,这会使质子化的胺在水中溶解性更大。对于去除酸性的基体化合物则是将pH值调到比较高—略高于其pKa——pH值大约为8或9,在这个pH值条件下,酸正处于它们的离子状态。然而,要小心键合硅胶基质的色谱柱,因为长时间暴露在高pH值下会损坏的(8)。为了控制缓冲体系和色谱柱中残留缓冲液中的细菌生长,色谱工作者可以使用一些家用的漂白剂稀释到1:10或1:20,用50个柱体积过柱,接着再用50个柱体积的高效液相色谱级的水进行冲洗。不能让漂白剂流经检测器,因为它会破坏流通池。为了防止溶剂瓶中的细菌生长,应该当天配制足够使用的缓冲液,并将不用的缓冲液存放在冰箱中,并加入0.1%的叠氮化钠,不允许在没有流速的情况下使缓冲液长时间驻留在色谱柱中。色谱工作者往往会讨论使用离子对试剂之后对色谱固定相柱产生的影响。一些离子对试剂如辛磺酸(用于阳离子)和四丁基溴化铵(用于阴离子)在含有某些有机改性剂的条件下会强烈地吸附在键合硅相的表面。色谱柱受到了污染不可能再生到他们的初始状态,这只能说用于离子对色谱的色谱柱需要为这门技术而献身,而且永远无法再用于常规的反相高效液相色谱。Bidlingmeyer(9)则并不赞同这种一般性的观点,认为较为极端的pH值,如在酸性条件下(pH 1-3)键合相和末端封尾硅羟基的水解或在高pH值(pH 7-8)条件下的硅胶溶解,这些离子对试剂能改变一些色谱柱的属性。为了去除磺酸类的离子对试剂,他推荐首先使用至少20倍柱体积的不含离子对试剂的相同流动相冲洗色谱柱,然后用不含缓冲液的流动相进行冲洗(在这个清洗步骤中,甲醇是一个比乙睛要好的有机溶剂;对于长链的离子对试剂,需要使用四氢呋喃)很明显,磺酸类的离子对试剂和胺类的离子对试剂存在不同的色谱行为,其对于色谱柱的影响是不同的。Bidlingmeyer和他的同事们(10)证明了当使用了C18柱,流动相浓度大于70%甲醇,SDS,这个长链的阴离子离子对试剂是不会吸附在固定相上的。这种发现也恰好验证了分离组的研究(7)。硅胶键合整体柱,例如Chromolith 色谱柱(Merk KGaA Darmstadt,Germany)应该被当成其他类型的硅胶色谱柱来进行处理。聚合柱的再生用来分离生物分子的聚合柱也会被污染而需要清洗。这种聚合材料的化学稳定性往往决定于它们的强度。实际上,许多的生产商推荐用1.0M的硝酸或1.0M的氢氧化钠来清洗聚合柱。某些反相聚合物柱子如聚乙烯填料(苯乙烯——二乙烯基苯)(PS-DVB)和聚合整体柱如CIM RP-SDVB的叠片柱(BIA Seperations, Ljublijana, Slovenia)以及Swift色谱柱(Isco, Lincoln, Nebraska)可以承受较宽的pH值范围(通常为1~13,有时为0~14),但是,使用者在用一些要求苛刻的有机试剂清洗色谱柱时应该谨慎。根据它们键交联度,当色谱柱暴露在有些有机溶剂中时,会使色谱柱填料产生收缩或膨胀。8—10%以上的高交联度的聚合填料通常具有非常良好的机械稳定性,在水相溶剂中有最小程度的收缩,而在有机溶剂中有最小程度的膨胀。在用一系列溶剂清洗聚合柱之前,最好能够参阅色谱柱手册,或同色谱柱生产商的技术支持部门进行商讨。按照BIA分离要求(11),使用者再生PS-DVB的聚合物整体柱可以通过:l 用10个柱体积的含0.1%的三氟乙酸的异丙醇,以一半的工作流速进行冲洗柱子;l 用至少5个柱体积的100%流动相B以一半的工作流速进行冲洗柱子;l 用至少10个柱体积的100%的流动相A以工作流速重新平衡色谱柱。如果要清洗一根有丁基和乙基的甲基丙烯酸填料的整体柱,可以用10倍柱体积的每份含1.0M的氢氧化钠、水、20%的乙醇溶液和缓冲液,反方向冲洗色谱柱(12),并将蛋白质除去。对于大部分的亲水性蛋白质,使用者应在用水清洗之后加入一个用异丙醇(30%V/V)或乙醇(70%V/V)的清洗步骤。http://simg.instrument.com.cn/bbs/images/brow/em09503.gif对于微生物污染的清除和钝化,一根PS-DVB整体柱可以用0.5~1.0M的氢氧化钠完全清洗。装填的整体柱应该在室温下用氢氧化钠浸泡至少一个小时以上。用来分离复杂蛋白质如不溶性的细胞膜蛋白、结构蛋白和病毒外壳蛋白的传统聚合填料的色谱柱只需粗糙的清洗条件。例如,清洗这些复杂蛋白质(13)也许要在60 °C条件下用到含3M盐酸胍的50%的异丙醇。肽的合成中来自于固定相树脂的碎片,产生了活性碳正离子,这些碳正离子可以用苯甲醚和硫代苯甲醚来提取。这些碳正离子反应会产生大量的芳香分子,这些芳香分子会在肽的纯化中破坏反相色谱柱。这些污染物在C18柱内有很强的保留,不能用100%的乙睛或甲醇除去。为了清洗这些色谱柱,应该颠倒色谱柱的使用方向,然后用3~5个柱体积的100%异丙醇,3~5个柱体积的二氯甲烷,3~5个柱体积的异丙醇,再回到原来的初始溶剂系统进行冲洗(14)。芳香性杂质的洗脱可以用紫外检测器在260nm波长下进行核实。
各位大虾,本人现在用正相色谱做曲酸双酯含量,流动相为:甲醇:正己烷=3:1,色谱柱为C18,请问用什么溶剂冲洗色谱柱较好呢?
[table=100%][tr][td]分析流动相使用的是磷酸盐,检测某多肽,发现检测主峰后面多出一个峰紧挨着主峰,进空白后没有杂峰,另一台HPLC上是没有这个峰,新启用的色谱柱,被其他同事走空两次,流动相使用乙腈水冲洗后依然不见效果!!希望各位大佬能解决这个问题,如何有效的冲洗,冲洗常用方式!色谱柱使用的是安捷伦C18柱子[/td][/tr][/table]
戴安离子色谱柱AS16做完牛奶里面的硫氰酸盐怎么清洗?
做片剂HPLC含量测定时,进样约30针,色谱柱的冲洗时间应多长最合理?
在冲洗色谱柱过程中为什么要逐渐改变溶剂组成?
用溶剂清洗毛细管色谱柱的方法,包括将要清洗的色谱柱从GC上卸下来,并将几毫升溶剂注入色谱柱中。 任何可溶于清洗溶剂的残留物就会从色谱柱中去除。如果仪器分析未卸下色谱柱,就注入大量溶剂,将不能清洗色谱柱,也不能从色谱柱中去除任何污染物。毛细管GC色谱柱必须具有键合和交联的固定相才可以使用溶剂进行清洗。若使用溶剂清洗非键合的固定相会严重损坏色谱柱。 可使用色谱柱清洗装置来将溶剂注入色谱柱中。溶剂清洗装置会连接到有压力的气源(N2或He),同时把色谱柱插入阿斗清洗装置中。把溶剂加入到样品瓶中,分析化学任何使用气源对溶剂瓶加压。压力会强制溶剂流过色谱柱。残留物将溶解在溶剂中,并随溶剂反冲出色谱柱。然后将溶剂吹扫出色谱柱,并对色谱柱进行适当的老化。 清洗色谱柱前,从色谱柱的前端敬爱能够其切去0.5米(即靠近进样器的一端)。将色谱柱连接检测器的一端插入清洗装置中。通常使用多种溶剂来清洗色谱柱。后面继续使用的溶剂要必须要与前一种溶剂互溶。分析化学一定不要使用高沸点溶剂,特别是不要作为最后使用的溶剂。溶解样品的溶剂通常是不错的选择。 建议使用甲醇、二氯甲烷和己烷,它们在大多数情况下效果不错。可使用丙酮代替二氯甲烷,以避免使用含氯溶剂,但是,二氯甲烷是最好的清洗溶剂之一。 两篇不错的气相色谱经验文章:《气相色谱仪器故障排除方法(不出峰与灵敏度降低)》 《经验:气相色谱维修维护经验谈》 如果测定的样品是水性的样品,如:生理体液和组织,则请在使用甲醇以前先使用水来冲洗。某些来自于水性样品的残留物只能溶于水中而不溶于有机溶剂。应使用水和醇类(如:甲醇、乙醇和异丙醇)来清洗键合的聚乙二醇基固定相(如:DB-WAX、DB-WAXetr、B-FFAP、HP-Innowax),但一般不建议采用该方法。 表中列出了针对各种直径的色谱柱,建议使用的溶剂的体积。使用大量溶剂虽然无害,但效果不会好很多,并且还十分浪费。加入第一种溶剂后,对清洗装置加压,但要低于20psi。使用可保持溶剂流速低于1mL/min的最高压力。除大多数0.53mmm内径的色谱柱外,在流速达到1mL/min之前清洗装置的压力将先到达20psi。如果使用的是比重较大或粘度较大的溶剂,或色谱柱直径小或长度大,则需要较长的清洗时间。待第一种溶剂全部进入或大部分已进入色谱柱中后,加入下一种溶剂。仪器分析待清洗的溶剂流出色谱柱后,让加压的气体通入色谱柱5-10分钟。将色谱柱装入进样口然后通入载气。将载气通入色谱柱5-10分钟。把色谱柱连接到检测器上(或也可以根据个人意愿不接到检测器上)。使用程序升温,从40-50℃开始将色谱柱以2-3℃/min的升温速率,直至达到温度上限。将此温度保持1-4个小时,直至色谱柱完全老化为止。
hilic模式色谱柱清洗建议:用50/50的乙腈/水清洗以去除极性污染物。如果清洗无效,可用5:95的乙腈/水清洗色谱柱。hilic色谱柱的保存。如果较长时间内不使用色谱柱,请将柱子保存在95%乙腈中;不要将色谱柱保存在缓冲盐流动相中,如果流动相中含有缓冲盐,先用10倍柱体积的HPLC级水清洗色谱柱然后换上95%乙腈保存。如果中间不用水“过渡”清洗有可能在使用95%乙腈时造成盐析出。