配位化学中的有机金属配合物的合成需要有机配体和金属离子。有机配体多种多样,双齿多齿的,如:4,4'-bipy,等,金属离子一般用过渡金属的和稀土离子,这样形成单核、双核、或多核0D\1D\2D\3D等的配位聚合物。还可以形成纳米体系的金属聚合物体系。配位聚合物一般由水热和溶剂热法得到单晶,然后经过xrd得到它的结构,进而测出它的性质。值得一提的是,形成的配位聚合物往往会是非常美观的的结构,拓扑结构等等。关键是要选择配体和金属离子,推出它们结合的方式,会得到怎样的结构,又怎样的新颖性。因而,在原有的简单配体上,合成新的配体非常重要和有必要。这就跟有机合成有点关系,看怎样能合成新型的配体应用于配位当中,进而产生更多结构和性质新颖的配位聚合物!
1 化学式 “原则”在IUPAC1970规定一致,即:(1)“在配位个体中如既有无机配体又有有机配体,则无机配体排列在前,有机配体排列在后。” 例:cis-[PtCl2(Ph3P)2]。因此,如[Cr(en)2Cl2]Cl,[Co(en)2(NO2)(Cl)]SCN,[Pt(en)CO3]等都不符合(1)。 (2) “无机配体和有机配体中,先列出阴离子,后列出阳离子和中性分子。” 例:K[PtCl3NH3],[Co(N3)(NH3)5]SO4。因此如[Co(NH3)5Cl]Cl2,[Pt(NH3)2Cl2],[Co (NH3)5(CO3)]+, [Co(NH3)3(OH2)Cl2]+,[Co(en)2(NO2)(Cl)]+,[Pt(en)(NH3)(CO3)]等都不符合(2)或(1)和(2)以及“原则”10.3(见下文)。(3) “同类配体的名称,按配位原子元素符号的英文字母顺序排列。” 例:[Co(NH3)5H2O]3+。据此不能写成[CoH2O(NH3)5]3+。(4) “同类配体中若配位原子相同,则将含较少原子数的配体排在前面,较多原子数的配体列后。” 例:[PtNO2NH3NH2OH(Py)]Cl。因此,[Co(NH3)3(NO2)3]不符合(4)。2 命名 配体命名的顺序,按“原则”示例可知,与配位个体中中心离(原)子后的配体书写顺序(化学式)完全一致;IUPAC的规则却不同,是按配体的英文名称词头字母(例中有底线者)的英文字母顺序命名,故与化学式的顺序不一致;日本则按阴离子配体、阳离子配体、中性分子配体的顺序命名[2],与我国的“原则”大体一致。例:(1)K3[Fe(CN)6] 六氰合铁(Ⅲ)酸钾(stock方法), 六氰合铁酸(3-)钾(Ewen—Basett方法); potassium hexa cyanoferrate(Ⅲ)或potassium hexa cyanoferrate(3-)(英)以下仅用stock方法。 (2) [Co(N2)(NH3)5]SO4 硫酸叠氮五氨合钴(Ⅲ) penta ammine azidocobalt(Ⅲ)sulfate (3) NH4[Cr(NCS)4(NH3)2] 四(异硫氰酸根)二氨合铬(Ⅲ)酸铵 ammonium di ammineterakis (isothiocyanato) chromate (Ⅲ)(英) (4) Na2[Fe(CN)5NO] 五氰亚硝酰合铁(Ⅲ)酸钠 sodium penta cyano nitrosylferrate(Ⅲ)(英)有的教材中,将K4[Fe(CN)6]称为六氰合亚铁(Ⅱ)酸钾,其中的“亚”字实无必要;而有的则称之为六氰合铁酸(Ⅱ)钾,并将K[Co(NH3)2(NO2)4]称为四硝基二氨合钴酸(Ⅲ)钾,这些显然不是笔误。至于如将[Co(NH3)3(H2O)Cl2]称为一氯化二氯一水三氨合钴(Ⅲ),则从化学式到命名均无符合“原则”之处。二 配体命名(“原则”10.3)“原则”规定,“带倍数词头的无机含氧酸阴离子配体命名时,要用括号括起来,如:(三磷酸根)。有的无机含氧酸阴离子,即使不含倍数词头,但含有一个以上直接相连的代酸原子,也要用括号,如:(硫代硫酸根)、……。”对于有机配体,也“一律用括号括起来。”据此[Ag(S2O3)2]3-应称为二(硫代硫酸根)合银(Ⅰ)离子;[Fe(NCS) 6] 3-应称为六(异硫氰酸根)合铁(Ⅲ)离子,不应称为六异硫氰合铁(Ⅲ)离子。事实上,“硫氰”、“异硫氰”、“硫代硫酸”等的叫法,在各教材中出现的频率不低,而且括号也常被忽略。其他与命名有关的例如配位个体的化学式,应该用“[]”号括起来,但不少书中误用了“〔〕”号;又如Fe3+离子与SCN-离子所形成的一系列配合物,根据“HSAB”原理,已用[Fe(NCS)n]3-n,(n=1-6)表示,但至今仍不乏用[Fe(SCN)n]3-n来表示者。最后尚须说明,当讨论配合物的结构和反应时,其化学式可以根据需要而不必拘泥于“原则”所规定的顺序书写
各位大家,有机配体对金属离子友好的配位作用,尤其是过渡金属元素。可以形成1D等多维结构,大家知道有哪些较好的有机配体呢?最好是多齿配体,谢谢!要找它们的结构有那些好的去处?
各位大家,有机配体对金属离子友好的配位作用,尤其是过渡金属元素。可以形成1D等多维结构,大家知道有哪些较好的有机配体呢?最好是多齿配体,谢谢!要找它们的结构有那些好的去处?
[color=#444444]想通过做质谱,来得到配体与金属离子的配位情况。也就是说,希望得到的质谱为:配体+金属离子的分子量...不知道大家,是如何做这个质谱的。。本来我通过10-5M浓度的配体,加入1当量,5当量,10当量的金属离子。。。打质谱均没得到想要的质谱峰。。。想请教高人,如何可以有效得得到配体与金属离子的配位峰???[/color]
[color=#333333] 核酸适配体是一种经由体外指数级富集系统进化技术筛选得到的随机寡核苷酸片段,该寡核苷酸片段能特异性结合靶物质。核酸适配体与固相萃取技术相结合,可以高选择性地应用于复杂样品中痕量组分的萃取、分离、富集和纯化,由此引起了广泛关注。该文综述了基于核酸适配体的固相萃取研究进展,着重评述了核酸适配体固相萃取柱的制备、固相萃取过程、面临的问题和应用前景。 [/color]
[align=center][size=24px]流式细胞仪监测适配体与靶细胞的结合[/size][/align][align=center]肖书棋 18122884967[/align][align=center][/align]本次说明是基于核酸适配体能与靶标进行特异性结合的原理,利用流式细胞仪监测适配体与靶细胞的结合状况,还能比较不同适配体与靶细胞之间的结合强度的比较;本次所使用的流式分析仪是BD FACSAria III。[font='times new roman'][size=16px]1.原理介绍:[/size][/font][font='times new roman'][size=16px]1.1核酸适配体:[/size][/font]核酸适配体(Aptamer,Apt):是一段寡核苷酸序列(ssDNA或RNA),是利用指数富集的系统进化技术(the Systematic Evolution of Ligands by Exponential Enrichment,SELEX)在多样寡核苷酸序列的文库中,进行体外筛选得到。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026239049_1528_5413603_3.jpeg[/img][/align][align=center][size=13px]Aptamer结合靶标原理[/size][size=13px]图[/size][/align]如图所示,在合适的缓冲液环境下,单链寡核苷酸序列具有弯曲以及折叠成特定的三级空间结构的能力,该结构可以与靶分子特异性结合,SELEX技术就是应用该原理来进行选择的。将信息量巨大且随机的的寡核苷酸文库与靶标孵育,经过多轮的优胜劣汰和PCR扩增,最后得到能与靶标高亲和力性结合的寡核苷酸序列,即核酸适配体(Aptamer)。由于核酸适配体具有靶向特异性的特点,因此应用广泛;那么如何监测适配体靶向细胞亲和力的方法,就需要用到流式细胞术进行表征。[font='times new roman'][size=16px]1.2流式细胞仪原理:[/size][/font]流式细胞术能够快速检测细胞或者生物颗粒的特征,其检测灵敏,能够定性或者定量分析颗粒的参数,还具有细胞分选的功能,功能强大,分析参数多,实用性较强。流式细胞仪(flow cytometer,FCM)的设计应用了光学、细胞化学、电子学等技术,拥有较强大的细胞及微粒分析功能,在临床医学、免疫学、微生物学等等研究领域发挥着巨大的作用。流式分析可以检测细胞表面颗粒复杂程度、核酸以及蛋白质的含量、细胞表面积或者细胞表面的抗体、细胞受体等等,在多种研究领域起到重要作用。在本研究中应用流式分析细胞荧光强度的基本步骤原理是:(1)制备成单细胞悬液:将待测细胞预处理进行荧光标记后制成单细胞悬液,通过气压将流式管中的细胞悬液通过管道压进流动室,同时喷出的鞘液将细胞包裹,形成圆形的鞘流,细胞在鞘液的包被下单行排列,依次通过流动室检测区域。(2)形成光散射:激发光源侧向垂直射向单个细胞,含有荧光的细胞形成两种光:①前向散射光(forward scatter, FSC):激光束照射细胞时,光束偏移量较小(10°以内),散射至前方,可用于检测细胞等粒子的表面信息,颗粒体积越大,信号越强。②侧向散射光(side scatter,SSC)激光束照射颗粒,产生偏移角度为直角的散射光,可反应细胞内含物的信息。(3)光信号转化成电信号:光信号导入到计算机中,依次形成电信号,再转化为数字信息。应用FlowJo软件处理数据,可以获得相应的散点图、直方图等形式,便于直观分析。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026241158_6946_5413603_3.jpeg[/img][/align][align=center][font='times new roman'][size=13px]流式分析基本原理图[/size][/font][/align][font='times new roman'][size=16px]2.分析步骤:[/size][/font][font='times new roman'][size=16px]2.1细胞预处理:[/size][/font]通过流式分析预处理,可以使细胞在特定的环境,与带有FAM荧光的适配体进行特异性结合,通过平行实验使细胞与不同的适配体文库进行标记,最终表征其荧光强度,进行亲和力的分析与比较。如表所示,流式分析条件为:[align=center][size=13px]流式细胞分析条件探寻[/size][/align][table][tr][td][align=center][size=13px][color=#000000]孵育时条件[/color][/size][/align][/td][td][size=13px][color=#000000]孵育时体积[/color][/size][/td][td=2,1][align=center][size=13px][color=#000000]孵育时浓度[/color][/size][/align][align=center][size=13px][color=#000000]细胞浓[/color][/size][size=13px][color=#000000]度 [/color][/size][size=13px][color=#000000]单链DNA浓度[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]第二次洗涤用液[/color][/size][/align][/td][/tr][tr][td][align=center][size=13px][color=#000000]4 ℃,30 min,BB,摇晃[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]500 μL[/color][/size][/align][/td][td][size=13px][color=#000000]2.5×10^6个/mL[/color][/size][/td][td][align=center][size=13px][color=#000000]125 nM[/color][/size][/align][/td][td][align=center][size=13px][color=#000000]PBS x 2[/color][/size][/align][/td][/tr][/table]流式分析的大致步骤为:消化细胞、细胞与文库孵育、润洗重悬、上样分析。最终确定,初始的细胞悬液浓度为5×10[font='times new roman'][size=16px]6[/size][/font] 个/mL,初始文库的浓度为250 nM;孵育时体系的总体积为250 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL,适配体浓度为125 nM,环境为4 ℃、30 min,震荡。最后上样的细胞悬液体积为500 L,细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。[align=left][font='times new roman'][size=16px]2.1.1材料准备:[/size][/font][/align][align=center][size=13px] 流式分析主要仪器与试剂[/size][/align][table][tr][td][align=center]名称[/align][/td][td][align=center]规格/型号[/align][/td][td][align=center]作用[/align][/td][/tr][tr][td][align=center]流式细胞仪[/align][/td][td][align=center]FACSAria III[/align][/td][td][align=center]对细胞进行流式分析[/align][/td][/tr][tr][td][align=center]可调式混匀仪[/align][/td][td][align=center]MX-S[/align][/td][td][align=center]混悬适配体悬液[/align][/td][/tr][tr][td][align=center]震荡仪[/align][/td][td][align=center]MX-M[/align][/td][td][align=center]震荡孵育体系,防止细胞贴壁[/align][/td][/tr][tr][td][align=center]制冷恒温金属浴[/align][/td][td][align=center]HX-20L[/align][/td][td][align=center]热击适配体,使核酸变性恢复到自由的无规则卷曲状态[/align][/td][/tr][tr][td][align=center]显微镜[/align][/td][td][align=center]DMI1[/align][/td][td][align=center]观察细胞[/align][/td][/tr][tr][td][align=center]水浴氮吹仪[/align][/td][td][align=center]FY-DCY12S[/align][/td][td][align=center]加热试剂[/align][/td][/tr][tr][td][align=center]电子天平[/align][/td][td][align=center]JA2003[/align][/td][td][align=center]称量药品[/align][/td][/tr][tr][td][align=center]离心管[/align][/td][td][align=center]15 mL×10、50mL×10[/align][/td][td][align=center]分装试剂,装载需离心的细胞[/align][/td][/tr][tr][td][align=center]低吸附离心管[/align][/td][td][align=center]2 mL×20[/align][/td][td][align=center]装适配体悬液,减少适配体与细胞在管壁上的吸附[/align][/td][/tr][tr][td][align=center]一次性使用吸管[/align][/td][td][align=center]3 mL×20[/align][/td][td][align=center]方便地吸取PBS[/align][/td][/tr][tr][td][align=center]细胞刮刀[/align][/td][td][align=center]3010×1[/align][/td][td][align=center]刮下贴壁生长的细胞[/align][/td][/tr][tr][td][align=center]PBS[/align][/td][td][align=center]50 mL×2[/align][/td][td][align=center]ScienCell[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]Cell Dissociation Solution[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]消化细胞[/align][/td][/tr][tr][td][align=center]0.25%Trypsin-EDTA[/align][/td][td][align=center]100 mL[/align][/td][td][align=center]Gibco[/align][/td][/tr][tr][td][align=center]1×PBS缓冲液[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]润洗细胞,重悬细胞[/align][/td][/tr][tr][td][align=center]无酶无菌水[/align][/td][td][align=center]500 mL[/align][/td][td][align=center]溶解适配体文库[/align][/td][/tr][tr][td][align=center]DMEM高糖培养基[/align][/td][td][align=center]50 mL[/align][/td][td][align=center]停止消化[/align][/td][/tr][tr][td][align=center]细胞[/align][/td][td][align=center]>5×10[font='times new roman'][size=16px]6[/size][/font]个[/align][/td][td][align=center]作为目的细胞进行流式表征[/align][/td][/tr][/table]①配置Binding buffer(结合缓冲液BB):配置10 g/L BSA:称量0.1g BSA,溶于10 mL Washing Buffer,过膜;取上述溶液5 mL,加入到445 mL Washing Buffer中;再加入500 L鲑精DNA,混匀。②将U盘格式化,提前打开制冰机和金属浴(95℃);③37℃水浴:将无酶消化液、ECM、PBS(1)放入37℃水浴。④4℃冰敷:向泡沫盒中加碎冰,离心管架、温度计,准备4℃孵育环境,放入PBS和BB预冷。⑤打开显微镜(酒精擦拭载物台)。⑥打开离心机:120 g,1 min,25℃。[align=left][font='times new roman'][size=16px]2.1.2[/size][/font][font='times new roman'][size=16px]计数和文库预处理[/size][/font][/align](1)细胞计数(20倍或者40倍显微镜):①采用直接计数法,在显微镜中随机选择五个点进行计数取平均值,根据视野的面积以及T75培养瓶面积计算细胞总数,推出公式:Y为总细胞数;X为视野中细胞平均数;Y=27886.12X(20倍镜下)/Y=111111.11X(40倍镜下)。为了保证流式有足够的细胞,需要保证细胞总数>5×10[font='times new roman'][size=16px]6[/size][/font]个/mL。②计算BB体积:V=Y/(2×10[font='times new roman'][size=16px]7[/size][/font])mL,用V体积的BB重悬细胞沉淀,可获得细胞浓度为5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的初始细胞悬液。(2)文库预处理:①将粉末状适配体文库进行离心:4000 r,5 min,4℃;使适配体粉末聚集在离心管底部,防止打开离心管时干粉状适配体飞出。②按照说明用一定体积的无酶无菌水溶解适配体,使适配体母液浓度在5 M。③取100 L母液,并加入900 LBB,使适配体浓度在500 nM。④再去上述液体500 L,并用BB稀释至浓度为250 nM,最终得到250 nM的适配体文库悬液。⑤95℃热击3 min,热击后放在泡沫盒中冰敷。[align=left][font='times new roman'][size=16px]2.1.3[/size][/font][font='times new roman'][size=16px]细胞处理[/size][/font][/align](1)消化:①PBS(37℃)润洗3次。②无酶消化液3 mL,消化9 min(等待期间准备好孵育用离心管;确认离心机参数为:120 rcf,1 min,25 ℃),吹打细胞使其从培养瓶表面脱落。直接转移至15mL离心管中,吹打混匀约20次(吹散细胞团,分离成单个细胞)。③显微镜观察确认细胞均从培养瓶上脱落,加入2-3 mL ECM至培养瓶中润洗,然后转移至上述离心管中,吹打终止消化。④离心:120 rcf,1 min,25℃。(等待期间各加入250 L待测文库至低吸附离心管中,注意要快速,吸取之前需要先混悬文库)。⑤离心之后小心倒出,用枪吸出剩下的ECM,加入2V L BB,重悬吸打混匀,获得5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[align=left][font='times new roman'][size=16px]2.1.4[/size][/font][font='times new roman'][size=16px]细胞与文库结合[/size][/font][/align]①孵育:分别加入250 μL上述细胞悬液至250 μL ssDNA文库中,进行孵育:4℃,30 min,打开摇床第二格。②等待期间离心机调至4℃;用密封袋装好洁净的1000 L枪头准备流式上样用;2.2.2.5 润洗重悬细胞①取出孵育好的体系,进行离心:4℃,120 g,1 min(等待期间准备好4℃ PBS)。②倒掉上清液,用枪头小心吸出管口残留的上清液,每管加500 L PBS(4℃)用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸打重悬约20次。③再次离心4℃,120 g,1 min。④第二次重悬:重复①-③步骤。⑤每管加入500 L PBS重悬,忽略实验损失,最后得到理论细胞浓度为2.5×10[font='times new roman'][size=16px]6[/size][/font]个/mL的细胞悬液。[font='times new roman'][size=16px]2.2[/size][/font][font='times new roman'][size=16px]送样分析[/size][/font]FAM荧光染色较弱,在预处理之后应尽快进行流式分析,流式分析上样程序复杂,需要正确进行开机,测样,关机的步骤,才能够得到准确的数据。[align=left](1)准备工作:[/align][align=left]准备1000 mL[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url],1000 mL 洁净枪头,流式管,质控微球。[/align][align=left]①开启液流系统:由上至下打开流式细胞仪开关;再开启计算机,打开FACSDiva软件,在“Cytometer仪器框”中确认流式细胞仪已与电脑连接,启动液流之前,确认液流系统水平,进行补充鞘液、去离子水、乙醇以及漂水,并清空废液。[/align][align=left]在“Cytometer”菜单中,点击“Fluidics Startup(启动液流系统)”,按照提示进行操作:确定气路和液路是从乙醇桶连接到了鞘液桶上:将蓝色液路管接到过滤器下方,透明气路管接到鞘液桶上;确定闭合的喷嘴是在流动检测池上。[/align][align=left]②将70 m的喷嘴放入装有超纯水的烧杯中,超声30 s,用无尘纸蘸干;抽出闭合的喷嘴;插入70 m的喷嘴(红圈朝上)。[/align][align=left]③点击“×steam”,开启液流,出现水滴状,调整使上端横线位于第二个或者第三个水滴的尾部,下端横线位于第三个或者第四个液滴的中部,调整好后关闭液流。[/align][align=left](2)做质控:[/align][align=left]①用CS&T微球,用之前一定将微球甩匀(保证取出的微球呈均匀体系)用涡旋震荡;取一支洁净的流式管加入333 L的鞘液,再加一滴微球(用之前用混悬仪混匀,正常的微球为浑浊状)。[/align][align=left]②打开液流系统,在“Cytometer”菜单下点击“CST”;展开Setup Control窗口:在Characterize菜单中中选择“Check Performence”;在Configuration流式设置中:喷嘴的大小:选择70m,点击左下角“set configuration”,再点击“OK”。[/align][align=left]③选择微球的Lot ID:与微球瓶身上编号对应:10549。[/align][align=left]④敲弹准备好的微球悬液使其混匀,进行上样,打开液流;确认激发光源没问题即可关掉页面并关掉液流。[/align][align=left](3)上样:[/align][align=left]①新建样品,并勾选FITC、SSC、FSC的H、A、W、log数据项。[/align][align=left]②作图:建立散点图,横坐标为FSC-H,纵坐标为SSC-H;再建立一个图:横坐标:FITC-H,纵坐标为:Count。[/align][align=left]③打开液流至3,选择对应样品;吹打混匀并放置样品,点击“LOAD”上样。调整FSC和SSC的电压,使散点图的中的点都集中在所圈的门中。(若散点偏右,则FSC电压过大,调整FSC电压使其变小,若散点偏上,则调整SSC使其变小。)当调整合适时点击“RECORD”记录数据。[/align][align=left]④计数完毕,调低流速,点击“unload”,选择第二个样品并重复第③步。[/align][align=left]⑤上样完毕之后,保存数据。[/align][align=left](4)关机步骤:[/align][align=left]①上一管clean液,高速冲2 min;再上一管去离子水,高速冲5 min;关闭液流,检查液路系统。[/align][align=left]②在“Cytometer”菜单中,选择“shutdown”,根据指示操作:取下70 m的喷嘴,超声清洗,安装闭合喷嘴(红色点朝上)。[/align][align=left]③把液路和气路连接到乙醇桶上,用乙醇冲洗(先拔气路再拔液路)。[/align][align=left]④装一管clean液,清洗上样针和流动池。[/align][align=left]完成上述步骤之后即可关闭界面。[/align][align=left][/align][font='times new roman'][size=16px]2.3数据处理:[/size][/font]将原始数据用Flowjo软件进行处理,得到散点图以及荧光强度直方图,接下来通过举例来说明数据如何分析:(1) 散点图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026242555_5228_5413603_3.jpeg[/img][size=13px]数据处理分析散点图[/size][/align]该图为散点图,可以看出大体分为两个集团,散点图有两个集团说明体系中有两种细胞粒子,并且在该图片的左下角粒子较少,说明细胞碎片较少,在预处理时较好地保护了细胞的完整性。散点图中可以区分出整个上样的体系中主要含有两种大小的细胞颗粒,在预处理的过程中,无酶消化液的消化能力较弱,并且细胞团密度较大,细胞间黏连较多,在最后孵育结束用PBS进行重悬的时候仍然能够肉眼可见有白色细微絮状物。FSC值越大,代表颗粒的体积越大;SSC值越大,代表颗粒内部的复杂程度越高。故可初步判断,G1门中的颗粒为未消化完全的细胞团,而G2门中的颗粒为分散的单个细胞。(2) 直方图分析:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301026243736_5071_5413603_3.jpeg[/img][size=13px]数据处理分析直方图[/size][/align]图中为G2门选中的样品的荧光强度,该图中有两个峰,横坐标10[font='times new roman'][size=16px]2[/size][/font]附近所产生的荧光峰可以判定是残留的细胞碎片,可视为背景值,横坐标10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]附近的峰代表四个适配体分别与细胞结合所产生的荧光强度,SYL3C-Aptamer结合偏移量最大,荧光较强,且高荧光事件次数较多,说明SYL3C-Aptamer与单个细胞的结合能力最强,并且G2门中的颗粒大多数为消化完全的单个细胞,呈现出较好的特异性。总之,该组结果对比体现出,单个细胞靶点较多,适配体与单个细胞结合能力较高,通过荧光强度波峰的偏移所反映的适配体与细胞特异性结合能力的大小依次为SYL3C-Aptamer>EP166-Aptamer>CA2-Aptamer>ARC1172-Aptamer。同时,由图中可以看出:10th-ssDNA pool与SYL3C-Aptamer在10[font='times new roman'][size=16px]4[/size][/font]~10[font='times new roman'][size=16px]5[/size][/font]荧光强度波峰较高,说明二者与单个细胞的结合能力较好,结合位点较多,呈现良好的特异性和亲和性。SYL3-Aptamer荧光波峰明显右移,与单个细胞的结合位点较多。[font='times new roman'][size=16px]三、总结[/size][/font]本次说明旨在利用带荧光的适配体靶向特异性结合目的细胞的原理,利用流式细胞仪监测适配体结合靶细胞能力的强弱,同时还可以应用于不同适配体靶向同一种细胞的结合能力强弱的比较。进一步利用流式细胞仪,还可以测定适配体的Kd值;还可以根据预处理的条件不同,与对照组比较,来测定适配体靶向细胞的受体是位于细胞膜表面还是细胞内,从而进一步测定适配体的生物学稳定性。同时,流式细胞仪还有很多方面的应用,例如鉴定细菌、检测细胞凋亡等,一些抗体-细胞复合物的结合情况也能够由流式细胞仪来进行监测。 在进行流式上样的过程中,预处理、上样以及数据处理阶段都有需要注意的细节,例如:本次所使用的细胞为贴壁生长的内皮细胞,故在细胞预处理时需要先消化细胞;在进行上样前,需要将样品进行吸打混匀,以免细胞沉积在流式管底部,导致未吸取到样品;在应用流式细胞仪的过程中,使用前的维护、质控流程十分重要,该流程会直接影响所得数据的稳定性;不同的流式细胞仪的维护程序稍有不同,本次说明中的使用方法只适用于BD FACSAria III,流式细胞仪具有强大的分析功能,其在细胞研究中具有重要的作用。[align=left][/align][align=left][/align][align=left][/align][align=left][/align]

[align=center][font='黑体'][size=29px]双配体锌配合物的结构表征[/size][/font][/align][font='宋体'][size=12px]摘要:[/size][/font][font='宋体'][size=12px]本文合成了一种锌的混配配合物:[[/size][/font][font='times new roman'][size=12px]Zn(4-ABS)(phen)[/size][/font][font='times new roman'][size=12px]([/size][/font][font='times new roman'][size=12px]H[/size][/font][font='times new roman'][sub][size=12px]2[/size][/sub][/font][font='times new roman'][size=12px]O[/size][/font][font='times new roman'][size=12px])[/size][/font][font='times new roman'][size=12px]][/size][/font][font='times new roman'][size=12px]ClH[/size][/font][font='times new roman'][sub][size=12px]2[/size][/sub][/font][font='times new roman'][size=12px]O[/size][/font][font='times new roman'][size=12px]。[/size][/font][font='宋体'][size=12px]利用[/size][/font][font='宋体'][size=12px]红外光谱([/size][/font][font='times new roman'][size=12px]IR[/size][/font][font='宋体'][size=12px])、荧光光谱([/size][/font][font='times new roman'][size=12px]FL[/size][/font][font='宋体'][size=12px])[/size][/font][font='宋体'][size=12px]、紫外光谱([/size][/font][font='times new roman'][size=12px]UV[/size][/font][font='宋体'][size=12px])[/size][/font][font='宋体'][size=12px]和热重分析([/size][/font][font='times new roman'][size=12px]TG/DTG[/size][/font][font='宋体'][size=12px])[/size][/font][font='宋体'][size=12px]等测试手段对[/size][/font][font='宋体'][size=12px]该[/size][/font][font='宋体'][size=12px]配合物进行表征,结果表明过渡金属锌离子分别与[/size][/font][font='宋体'][size=12px]对氨基苯磺酸[/size][/font][font='宋体']上[/font][font='宋体'][size=12px]的[/size][/font][font='times new roman'][size=12px]1[/size][/font][font='宋体'][size=12px]个[/size][/font][font='times new roman'][size=12px]O[/size][/font][font='宋体'][size=12px]、[/size][/font][font='宋体'][size=12px]邻[/size][/font][font='宋体'][size=12px]菲罗啉上的[/size][/font][font='times new roman'][size=12px]2[/size][/font][font='宋体'][size=12px]个[/size][/font][font='times new roman'][size=12px]N[/size][/font][font='宋体'][size=12px]和[/size][/font][font='times new roman'][size=12px]1[/size][/font][font='宋体'][size=12px]个[/size][/font][font='times new roman'][size=12px]H[/size][/font][font='times new roman'][sub][size=12px]2[/size][/sub][/font][font='times new roman'][size=12px]O[/size][/font][font='宋体'][size=12px]配位。[/size][/font][font='宋体'][size=12px]关键词:[/size][/font][font='宋体'][size=12px]混配[/size][/font][font='宋体'][size=12px];表征手段;谱图解析[/size][/font][font='黑体']1.[/font][font='黑体']实验原理[/font][font='宋体']红外光谱是研究分子振动和转动信息的十分有力的分析手段,能够反映出分子化学键的特征吸收频率;热重分析是一种热分析技术,在程序控制升温下,通过测量样品的失重变化,探究样品的热稳定性及其组分;紫外可见光谱研究[/font][font='宋体']特定波长或一定波长范围内物质对光的吸收度,可用于定性或定量分析[/font][font='宋体'];荧光发射光谱是在一定波长的激发下,物质发出的[/font][font='宋体']荧光强度在不同波长的分布情况[/font][font='宋体']。[/font][font='黑体']2.[/font][font='黑体']实验仪器[/font][font='times new roman']布鲁克[/font][font='times new roman']Tensor 27[/font][font='times new roman']傅里叶红外光谱仪[/font][font='times new roman'](KBr[/font][font='times new roman']压片法,[/font][font='times new roman']4000[/font][font='times new roman']~[/font][font='times new roman']400 cm[/font][font='times new roman'][sup][size=13px]-1[/size][/sup][/font][font='times new roman'] )[/font][font='times new roman'];北京恒久[/font][font='times new roman']HTG-1[/font][font='times new roman']热重分析仪[/font][font='times new roman'],测定条件为空气气氛,升温速率为[/font][font='times new roman']10℃min[/font][font='times new roman'][sup][size=13px]-1[/size][/sup][/font][font='times new roman'],终点温度为[/font][font='times new roman']800[/font][font='times new roman']℃;紫外光谱采用岛津[/font][font='times new roman']UV-2600[/font][font='times new roman']紫外可见分光光谱仪;荧光光谱采用日立[/font][font='times new roman']F[/font][font='times new roman']70[/font][font='times new roman']00[/font][font='times new roman']型荧光分光光谱仪,在室温下测定(激发狭缝和发射狭缝均为[/font][font='times new roman']2 nm[/font][font='times new roman'],扫描速率[/font][font='times new roman']600 nm/min)[/font][font='times new roman']。[/font][font='黑体']3.[/font] [font='黑体']谱图解析[/font][font='黑体'][color=#000000]3.1 [/color][/font][font='黑体']红外光谱[/font][align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211161501457322_9243_5853070_3.jpeg[/img][/align][align=center][font='times new roman'][size=12px]图[/size][/font][font='times new roman'][size=12px]1.[/size][/font][font='times new roman'][size=12px]配合物的红外吸收光谱[/size][/font][/align][align=center][font='times new roman'][size=12px]Fig.1 IR spectrum ofcoordinationcompound[/size][/font][/align][font='times new roman']配合物的红外光谱以KBr为基质,4000~400 cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']范围内测定(如图1)。根据文献中图谱对照解析,配位化合物的IR谱图的主要吸收峰为:3463[/font][font='times new roman'],[/font][font='times new roman']1624,1599,1516,1427,1122,1049[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']。分别作如下指派:1624,1599,1427[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']为苯环的特征吸收峰;3463[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']为对氨基苯磺酸配体上-NH[/font][font='times new roman'][sub][size=13px]2[/size][/sub][/font][font='times new roman']的伸缩振动,1122、1049[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']为对氨基苯磺酸配体上-SO[/font][font='times new roman'][sub][size=13px]3[/size][/sub][/font][font='times new roman']基团的不对称伸缩振和对称伸缩振动,1516[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']为邻菲罗啉配体[/font][font='times new roman']C[/font][font='times new roman']-N的伸缩振动峰,724-843[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']为邻菲罗啉配体上苯环面外的碳氢键的弯曲振动吸收峰。[/font] [font='times new roman']经与文献中[/font][font='times new roman']配体[/font][font='times new roman']ABS、phen的标准[/font][font='times new roman']红外谱图对[/font][font='times new roman']照分析[/font][font='times new roman']可[/font][font='times new roman']知[/font][font='times new roman'],对氨基苯磺酸配体上-NH[/font][font='times new roman'][sub][size=13px]2[/size][/sub][/font][font='times new roman']伸缩振动峰没有发生位移,表明金属离子未与氨基氮配位。而对氨基苯磺酸配体上-SO[/font][font='times new roman'][sub][size=13px]3[/size][/sub][/font][font='times new roman']基团的特征吸收峰发生了位移(1122~1118[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman'],[/font][font='times new roman']1049~1034[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']),邻菲罗啉上的[/font][font='times new roman']C-N[/font][font='times new roman']特征吸收峰发生了位移(1516~1587[/font][font='times new roman'] [/font][font='times new roman']cm[/font][font='times new roman'][sup][size=13px]-[/size][/sup][/font][font='times new roman'][sup][size=13px]1[/size][/sup][/font][font='times new roman']),归属于两[/font][font='times new roman']个[/font][font='times new roman']配体[/font][font='times new roman']参与锌离子[/font][font='times new roman']配位的结果[/font]。[font='黑体'][color=#000000]3.2 [/color][/font][font='黑体'][color=#000000]热重分析[/color][/font][align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211161501459512_358_5853070_3.jpeg[/img][/align][align=center][font='times new roman'][size=12px]图[/size][/font][font='times new roman'][size=12px]2.[/size][/font][font='times new roman'][size=12px]配合物的热重曲线[/size][/font][/align][align=center][font='times new roman'][size=12px]Fig. 2 TGA of[/size][/font][font='times new roman'][size=12px] [/size][/font][font='times new roman'][size=12px]coordination[/size][/font][font='times new roman'][size=12px] [/size][/font][font='times new roman'][size=12px]compound[/size][/font][/align][font='times new roman']配合物的热重曲线如图[/font][font='times new roman']2[/font][font='times new roman']所示,由失重百分比推测,配合物在75[/font][font='宋体']℃开始[/font][font='times new roman']失去[/font][font='times new roman']2[/font][font='times new roman']个水[/font][font='times new roman']分子[/font][font='times new roman'],对应的[/font][font='times new roman']失重率为7.2[/font][font='times new roman']%[/font][font='times new roman']([/font][font='times new roman']理论值[/font][font='times new roman']为7.3[/font][font='times new roman']%[/font][font='times new roman']),实验值与理论值基本一致。[/font][font='times new roman']随后TG曲线在285℃[/font][font='times new roman']后[/font][font='times new roman']急剧下降,表明配合物[/font][font='times new roman']结构坍塌[/font][font='times new roman'];在560℃[/font][font='times new roman']后继续[/font][font='times new roman']下降,表明配合物继续分解[/font][font='times new roman'],[/font][font='times new roman']760℃之后曲线趋于平稳,此时残余[/font][font='times new roman']物重约[/font][font='times new roman']20.7%[/font][font='times new roman'],推测为ZnO(理论值16.6[/font][font='times new roman']%[/font][font='times new roman']),残余量高于理论值,原因可能与配合物含碳量较高而产生的积碳效应有关[/font][font='宋体'][sup][size=13px][[/size][/sup][/font][font='宋体'][sup][size=13px]5[/size][/sup][/font][font='宋体'][sup][size=13px]][/size][/sup][/font][font='times new roman']。[/font][align=left][font='黑体']3.3 [/font][font='黑体']紫外光谱[/font][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211161501462780_686_5853070_3.png[/img][/align][align=center][font='times new roman'][size=12px]图[/size][/font][font='times new roman'][size=12px]3. [/size][/font][font='times new roman'][size=12px]配合物的紫外光谱[/size][/font][/align][align=center][font='times new roman'][size=12px]Fig.3 UV-vis ofcoordinationcompound[/size][/font][/align][font='times new roman'] 由图3可知,配合物的最大吸收峰为[/font][font='times new roman']292[/font][font='times new roman'] nm;与两个配体ABS(最大吸收峰为248 nm)、phen(两个吸收峰位置分别为229 nm,263 nm)不同,形成配合物后配体的吸收峰发生位移,由此推测两个配体与锌离子发生配位作用。[/font][align=left][font='黑体']3.4 荧光光谱[/font][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211161501464470_9673_5853070_3.png[/img][/align][align=center][font='times new roman'][size=12px]图4. [/size][/font][font='times new roman'][size=12px]配体及[/size][/font][font='times new roman'][size=12px]配合物的荧光光谱[/size][/font][/align][align=center][font='times new roman'][size=12px]Fig. 4 Fluorescentspectrum of [/size][/font][font='times new roman'][size=12px]ligands and [/size][/font][font='times new roman'][size=12px]coordination compound[/size][/font][font='times new roman'][size=12px]s[/size][/font][/align] [font='times new roman']如图[/font][font='times new roman']4[/font][font='times new roman']所示,与配体[/font][font='times new roman']ABS(342 nm)[/font][font='times new roman']、[/font][font='times new roman']phen(361 nm,378 nm)[/font][font='times new roman']的荧光发射峰位置不同,目标产物双配体锌配合物[/font][font='times new roman']在300 nm波长激发下,显示[/font][font='times new roman']发射峰为[/font][font='times new roman']366 nm和382 nm[/font][font='times new roman'],且荧光强度大大增强。作为对照,[/font][font='times new roman']我们发现[/font][font='times new roman']单配体的配合物[/font][font='times new roman']Zn(ABS)[/font][font='times new roman']荧光光谱发射峰位置为348 nm,表明第二配体phen的引入,使得目标产物双配体配合物的荧光发射峰红移了18 nm,且显示出[/font][font='宋体']更强的荧光性能[/font][font='宋体']。[/font][font='times new roman']由于[/font][font='times new roman']Zn离子的d[/font][font='times new roman'][sup][size=13px]10[/size][/sup][/font][font='times new roman']电子构型难以[/font][font='times new roman']被氧化[/font][font='times new roman']或还原,[/font][font='times new roman']配合物的发光机制[/font][font='times new roman']可能归属于以配体为中心的电子跃迁[/font][font='times new roman'],由于phen的引入,使得双配体配合物的分子平面性更好,发光性能得以显著提高[/font][font='times new roman'][sup][size=13px][[/size][/sup][/font][font='times new roman'][sup][size=13px]6[/size][/sup][/font][font='times new roman'][sup][size=13px]][/size][/sup][/font][font='times new roman']。[/font][font='times new roman'][color=#000000]此外,进一步探究了配体ABS、phen、单配体锌配合物和双配体锌配合物在紫外灯254 nm照射下的发光性质(如图5)。结果发现,phen呈现蓝色,ABS和单配体锌配合物几乎不发光,而目标产物双配体锌的配合物显示出亮黄色,可以[/color][/font][font='宋体'][color=#000000]明显看出[/color][/font][font='宋体'][color=#000000],[/color][/font][font='宋体'][color=#000000]引入[/color][/font][font='宋体'][color=#000000]第二配体[/color][/font][font='times new roman'][color=#000000]phen[/color][/font][font='宋体'][color=#000000]后[/color][/font][font='宋体'][color=#000000],生成的[/color][/font][font='宋体'][color=#000000]配合物[/color][/font][font='宋体'][color=#000000]显示出[/color][/font][font='宋体'][color=#000000]很好的[/color][/font][font='宋体'][color=#000000]发[/color][/font][font='宋体'][color=#000000]光性能[/color][/font][font='宋体'][color=#000000]。[/color][/font][align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211161501464053_1160_5853070_3.png[/img][/align][align=center][font='times new roman'][size=12px]图5.[/size][/font][font='times new roman'][size=12px] 紫外灯下配体和配合物的发光图[/size][/font][/align][align=center][font='times new roman'][size=12px]Fig. 5 Luminescence of ligands and coordination[/size][/font][font='times new roman'][size=12px] [/size][/font][font='times new roman'][size=12px]compound[/size][/font][font='times new roman'][size=12px]s[/size][/font][font='times new roman'][size=12px] under [/size][/font][font='times new roman'][size=12px]UV[/size][/font][font='times new roman'][size=12px] lamps[/size][/font][/align][font='仿宋'][size=18px]3.结论[/size][/font][font='宋体']本[/font][font='宋体']文对所制备的双配体[/font][font='宋体']锌的[/font][font='宋体']混配[/font][font='宋体']配合物[/font][font='times new roman'][Zn(4-ABS)(phen)(H[/font][font='times new roman'][sub][size=13px]2[/size][/sub][/font][font='times new roman']O)]ClH[/font][font='times new roman'][sub][size=13px]2[/size][/sub][/font][font='times new roman']O[/font][color=#000000]进行了热重、红外、紫外、荧光等[/color][font='times new roman']表征,证实锌离子为四配位的结构,配位原子分别来[/font][font='times new roman']自对氨基苯磺酸上的1个O[/font][font='times new roman']、[/font][font='times new roman']邻菲罗啉上的2个N和1[/font][font='times new roman']个[/font][font='times new roman']H[/font][font='times new roman'][sub][size=13px]2[/size][/sub][/font][font='times new roman']O[/font][font='times new roman']。研究表明,由于第二配体phen的引入,[/font][font='times new roman']锌和对氨基苯磺酸的[/font][font='times new roman']配位键合方式发生了显著改变:当只有[/font][font='times new roman']对氨基苯磺酸[/font][font='times new roman']作为配体与锌离子结合时,[/font][font='times new roman']对氨基苯磺酸[/font][font='times new roman']是以双齿配体的形式参与到锌离子的配位中,[/font][font='times new roman']而[/font][font='times new roman']第二配体phen[/font][font='times new roman']的引入[/font][font='times new roman'],调控了[/font][font='times new roman']对氨基苯磺酸[/font][font='times new roman']的配位方式,[/font][font='times new roman']仅有[/font][font='times new roman']磺酸根的[/font][font='times new roman']O[/font][font='times new roman']参与[/font][font='times new roman']锌[/font][font='times new roman']的[/font][font='times new roman']配位[/font][font='times new roman'],[/font][font='times new roman']同时大大增强了配合物的荧光性能[/font][font='times new roman'],[/font][font='times new roman']这与[/font][font='times new roman']phen[/font][font='times new roman']自身结构中共轭体系大[/font][font='times new roman']、[/font][font='times new roman']电子流动性好密切相关[/font][font='times new roman']。[/font]
EPR的g值和配体效应有什么关系
请问有没有大侠做过利用毛细管电泳筛选小分子(比如金属离子)的核酸适配体?求经验交流啊!!!!!!
现在买到适配体是从文献里找的找生工合成的,结果怎么都结合不了靶标物质,传感体系加靶标和不加靶标基本没有变化,有没有做过老师有遇到这样的情况吗,大家是怎么解决的,是孵育条件的影响吗
FTIR可表征金属离子和羧酸盐配体的配位模式吗?如果是,那么AL3+与聚丙烯酸钠的配位模式如何表征?
在毛细管分离中用到了核酸适配体(aptamer),前段时间做还挺正常的,为什么这几天特别容易吸附,管子也容易堵住?求大神解答。。
[font=SimSun, STSong, &]卡拉胶-魔芋胶复配体系,加入什么盐类,可以使得凝胶速度加快?[/font]
除了峰位置发生变化以外。。最近做了一个效果比较差的配合物红外图,对比配体的图,发现只有我认为发生配合的官能团的峰比较明显。想问一下这是不是有理论依据,还是只是巧合?
在研究蛋白质和小分子配体复合物相互作用时,如何看它们的15N-1H HSQC图谱?
摘 要:综述了高效液相色谱配体交换色谱手性固定相的发展、制备及其在手性拆分中的应用,讨论了洗速、进样量、中心金属离子及其浓度、流动相pH 值、柱温、有机改性剂等对对映体分离的影响,阐述了对手性识别机理的认识.[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=23983]高效液相色谱手性拆分中的配体交换色谱手性固定相[/url]
有偿求助,[url=https://bbs.instrument.com.cn/topic/152724]处理[color=red]蛋白质[/color]和小分子配体复合物15N-1H [color=red]HSQC[/color]图谱的教程和软件[/url]。
附件是原料巯基丙酮用酒精稀释后进的gcms,请问巯基丙酮二聚体的峰到底是14.866还是22.072,或者说两者都是?还有,根据香料通则,这个东西的含量要达到95%,根据图上看有个很大的巯基丙酮,含量应该不到95%,巯基丙酮是本来就有的呢还是二聚体分解出来的?大家做原料控制的时候怎么做的呢?
开发适用于纸质传感器的发光材料,一直是一项重大挑战。可视化纸基生物传感器具有众多优点,然而也存在着缺点。那就是普通的发光材料难以固定在纸质衬底上,同时其光学活性也很容易丧失。因此,想要找到适用于纸质传感器的发光材料难度很大。 近日,中科院合肥物质科学研究院智能所研究人员成功研制出了一种发光氧化石墨烯,能够具有高荧光量子产率,并且可以通过普通打印机在衬底上打印出荧光“开”的生物传感器。该研究对我国多种生物分子研究具有重要意义。 该研究基于氧化石墨烯上功能基团的有机胺化反应制备而成,发光氧化石墨烯可以充满“墨水”用于普通打印机。因为其稳定的发光和二维的平面结构,因此通过普通喷墨打印机也可以将图案打印在微孔滤膜上。打印的图案在紫外灯下可呈现稳定的荧光,最后通过滴加各种配体修饰的银纳米颗粒、与配体对应的目标生物分子,就可以形成可视化荧光“开”的纸质传感器。该研究能够实现对生物硫醇、蛋白质、DNA等可视化检测,在生物学领域将会发挥重要作用。
[em61] 请教用丁二酮肟测镍的具体操作是怎样的?为什么我向含镍溶液中加入丁二酮肟会有白色浑浊?而不是酒红色沉淀呢?
求助:在做土壤半挥发性有机物中二氯甲烷和丙酮1:1的萃取体系有没有替代溶剂?
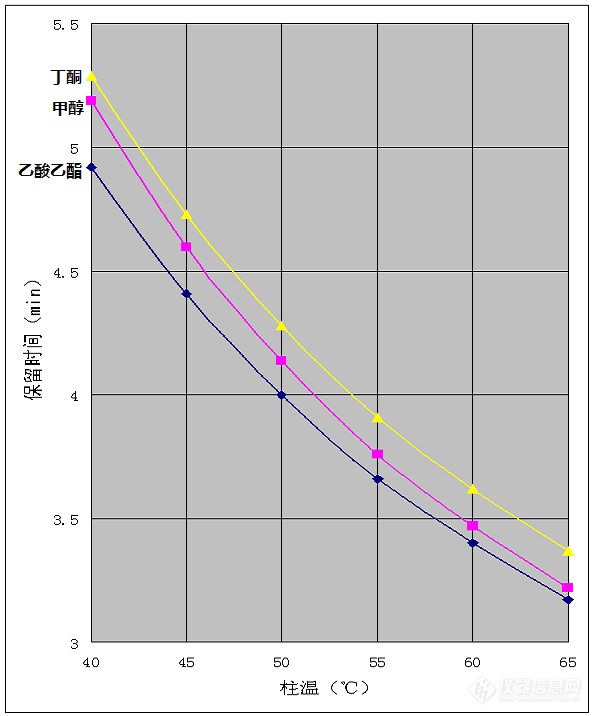
溶剂残留分析是[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]的重要应用之一,在药品、食品、包装等领域都是必测的项目。常见溶剂中涉及到的检测目标物经常有乙酸乙酯、甲醇、丁酮,以及二甲苯异构体这几项。最近看到 @m3091333、@p3109800、@Insm_c1196d2b 等多人发帖子讨论相关问题,我从原理上进行了一些解释,但终究纸上谈兵,于是找别的实验室要了这几种试剂,用实践检验了一下。首先,如果二甲苯异构体不要求分离,用624柱可以很容易的解决问题,这里就不讨论了。如果要求乙苯、对二甲苯、间二甲苯、邻二甲苯四种异构体分离,用624柱是无法完成的。因为二甲苯异构体色散力差异非常小,只能靠诱导力的差异分离,不同异构体在强极性柱上的极化率不同,乙苯极化率最低,其次是对二甲苯、间二甲苯,邻二甲苯极化率最大,出峰时间也随极化率的增加而延长。而624柱的极性比较弱,不能产生足够的极化作用,特别是对二甲苯与间二甲苯的极化差异非常小,无法实现分离。这个问题是由分子结构决定的,无论怎么调节色谱条件都不能解决。要想解决只能换强极性柱,常见的就是聚乙二醇柱,包括各种wax柱和FFAP柱等。三氟丙基柱也是强极性的,可以分离二甲苯异构体,但是这种柱很少使用。在聚乙二醇类的色谱柱上,乙酸乙酯、甲醇、丁酮三种目标物分离困难,各种类型的聚乙二醇柱选择性略有差异,但这三种物质都是较为接近的,想要分离是不太容易的。但是这三种物质与聚乙二醇固定相之间的作用力存在本质上的差异,因此通过调整柱温条件是可以分离的。下面三幅图是用60米*0.53mm*1um的INNOWAX柱分离乙酸乙酯、甲醇、丁酮的效果,柱温分别是40℃、50℃、60℃。[img=,690,796]http://ng1.17img.cn/bbsfiles/images/2018/08/201808022157168864_5041_2204387_3.png!w690x796.jpg[/img][img=,690,796]http://ng1.17img.cn/bbsfiles/images/2018/08/201808022157170984_7926_2204387_3.png!w690x796.jpg[/img][img=,690,796]http://ng1.17img.cn/bbsfiles/images/2018/08/201808022157172914_736_2204387_3.png!w690x796.jpg[/img]图中很明显,柱温低时甲醇与丁酮出峰时间接近分不开,高温时甲醇与乙酸乙酯出峰时间接近分不开,温度适中时三者可以实现分离。虽然未达到基线分离,但分离度都超过1,用来定量是完全可以的。这是找别人借的一根旧柱子,柱效只有4万塔板,如果是新柱子柱效应该能达到七八万塔板,分离度肯定更高,如果是0.32mm口径的柱子分离就更没问题了。要强调的是,能够实现分离的条件并不是完全靠盲目尝试获得的。我们看一看三种目标物的保留时间随柱温的变化就能发现其中的规律,见下图:[img=,594,716]http://ng1.17img.cn/bbsfiles/images/2018/08/201808022156374904_6999_2204387_3.png!w594x716.jpg[/img]图中可以看出,三种目标物的保留时间都是随温度升高而减小的,但是减小的幅度却并不相同。甲醇的保留时间随温度升高而减小的幅度明显大一些。这是因为甲醇具有羟基,与聚乙二醇固定相的相互作用力以氢键为主,氢键的强度随温度升高而迅速减弱。而乙酸乙酯、丁酮与聚乙二醇固定相的作用力都是以诱导力和取向力为主,这种力是由分子偶极矩决定的,受温度的影响要小一些。甲醇峰位置在乙酸乙酯与丁酮之间,温度升高时保留时间都减小,但甲醇减小更多,于是甲醇与乙酸乙酯靠的更近,与丁酮的分离度提高。温度降低时保留时间都增大,但甲醇增大更多,于是甲醇与丁酮靠的更近,与乙酸乙酯的分离度提高。用其他的柱子,如DB-wax或者FFAP时,各组分之间的相对位置会有差别,甚至有时出峰顺序都会变,但是保留时间随温度变化的这种规律仍然是适用的。所以遇到分不开的情况,一定不要盲目的乱试一通,也不用盲目的换柱子,一定要把问题想明白,有针对性的优化条件。最后要强调的是,这里虽然是以溶剂检测为例讨论了如何只用一根柱子就实现分离,但实际样品很复杂,并不是每次都能通过这种优化实现全部分离目的。所以色谱实验室配备多种不同极性的色谱柱是非常重要的。特别是做复杂样品时,即使谱图上看起来分离不错,最好也能用另外一种柱子进行一次验证,以免实际样品中有干扰物共流出,造成假阳性。
dfppy(2-(2,4-二氟苯基)吡啶),在与Ir配位形成Ir(dfppy)3后,dfppy中氢的化学位移将如何变化?
[font=&]【题名】:二氧化氮气体的体积变化同颜色变化的关系[/font][font=&]【全文链接】: https://www.cnki.com.cn/Article/CJFDTOTAL-FXJJ198004009.htm[/font]
做空气中苯,甲苯和二甲苯测定时,是否可以用丙酮代替二硫化碳做溶剂进行解析。
在做二羟基丙酮的硅烷化分析的时候,出现一个问题:当标准样品的量比较少的时候比如10mg左右的时候,气相上出来的是二羟基丙酮的硅烷化的峰,但是当标品的来那个超过20mg的时候会出来二羟基丙酮硅烷化峰以及二羟基丙酮二聚体硅烷化峰,不知哪位专家做过此物质的分析,可否指点一下。
二恶英类化学物质的毒性机理 二恶英类化学物质毒性的分子机制还没完全研究清楚,但经过二十多年的研究人们对其机理也有了一定的认识。总的说来二恶英类化学物质产生作用并不是通过直接的损伤,二恶英类化学物质并不与蛋白质和核酸形成加合物,也不直接损害细胞DNA。它们的作用主要是通过芳香烃受体诱导基因表达,改变激酶活性,改变蛋白质功能等而起作用。一、芳香烃受体介导的基因表达 通过芳香烃受体介导基因表达(如P4501A1)是二恶英类化学物质毒性作用最主要也是最基本的作用机制。芳香烃受体是一高分子量的蛋白质(110-150KD),与二恶英类化学物质有可逆转的高亲和力,主要存在于细胞浆中(也有小部分在胞核中),其作用模式类似于甾体类受体,但也有不同。该蛋白属于basichelix-loop-helix PAS(Per-Arnt-Stim)超家族,该家族均为转录因子),均含有两个功能部位即:basichelix-loop-helix部位和PAS功能部位,该族蛋白对激活基因的转录具有重要意义。且各芳香烃受体具有明显的种间,种内和组织差异。芳香烃受体在细胞浆中是以380 KD的复合物无活性的形式存在,除自身外还有3-4种蛋白质与之结合,其中只鉴别出了90 KD的热休克蛋白(heatshock protein, HSP90),该蛋白对受体的活性具有重要影响。 芳香烃受体介导的基因表达基本的作用过程可区分以下几个基本过程:①二恶英类化学物进入细胞;②化合物与芳香烃受体结合;③配体-受体复合物与DNA识别位点结合;④特异基因的转录及翻译;⑤表达蛋白发挥作用。在这些过程中,前三步研究的较清楚,而后续过程还不是很清楚. 1. 二恶英类化学物质进入细胞。通常认为二恶英类化学物质通过被动扩散方式进入细胞浆(由于二恶英类化学物质为脂溶性物质),但也有几个研究显示被动扩散并不能完全解释二恶英类化学物质的毒性反应。如:该类物质可刺激肝细胞的生长和脂肪的浸润,上皮细胞的肥大增生,这些观察表明细胞膜在二恶英类化学物质的毒性作用中起着一定作用。 2. 二恶英类化学物质与芳香烃受体的结合。二恶英类化学物质进入胞浆后即与胞浆中的芳香烃受体结合,该结合过程将导致芳香烃受体激活。但该结合导致的物理化学变化目前并不清楚。有实验显示配体-芳香烃复合物的形成并不能与DNA结合位点结合,不足以导致生物反应,说明受体的激活是一个多步骤的过程。体外研究中温度对芳香烃受体的激活有重要作用,于4℃形成的复合物并不能正确与基因位点结合,而在高于在20℃形成的复合物则有生物活性,说明该过程需要温度依赖性的激活步骤。HSP90对受体的激活起着重要作用,HSP90对于配体的结合是必须的,并且可以抑制未与配体结合的受体与DNA结合(设想为抑制受体与核中的转录因子结合)。当配体与受体结合,原结合于受体的HSP90即脱落下来,暴露出受体的DNA结合位点,导致受体的激活。 3. 配体-受体复合物与DNA的结合。二恶英类化学物质与芳香烃受体的结合使芳香受体激活,随后配体-受体复合物即转移入胞,在细胞核中聚集。该复合物在与DNA结合以前必须与细胞核中的一种蛋白结合即芳香烃受体核转位子蛋白(Ah receptor nuclear translocator protein, ARNT)结合,才能获得与DNA结合的能力。该蛋白质分子量为87kDa,也属于basic helix-loop-helixPAS(Per-Arnt-Stim)超家族,含有两个功能部位即:basic helix-loop-helix(bHLH)部位和PAS功能部位。它与同属一个家族的芳香烃受体结合形成异二聚体,对于与DNA的结合意义重大。仅保留芳香烃受体核转位子蛋白的bHLH和PAS部位,可保存ARNT形成二聚体及与DNA结合的能力,其中bHLH部位的两个α-helilx结构主要参与二聚体的形成,而basic结构则仅与DNA的结合有关;PAS部位包括两个亚结构即PASA和PAS B,去除两者之一,仅轻微影响异二聚体形成能力,但两者均去除则严重影响异二聚体形成能力。AhR/ ARNT复合物然后与特异基因上游部位的增强子即二恶英反应元件(dioxin responsive element, XRE)结合即可激活基因的转录。二恶英/外来物反应元件的核心序列为5′-T/GNGCGTGA/CG/CA-3′。 4. 特定基因的转录和翻译。二恶英类化学物质激活的基因表达包括细胞色素P4501A1和1A2,谷胱甘肽S转移酶,甲基醌氧化还原酶,醛脱羟酶等。其中最主要的是细胞色素P4501A1和1A2,同时也研究的最为广泛。AhR/ARNT复合物与增强子核心序列结合后,通过何种方式激活基因的转录研究较少。一般而言AhR/ ARNT复合物与增强子核心序列的结合后可导致DNA链的弯曲,核染色质的断裂,从而增加了激活启动子的机率,增加了CYP1A1起始转录的机率,导致细胞色素P4501A1的mRNA在核中的聚集。Roberton等研究发现,在细胞色素P4501A1转录起始点上游,281-950个碱基间有九个顺式反应元件,其中三个为二恶英反应元件,另六个元件的作用不详。但当AhR/ ARNT复合物与二恶英反应元件结合后其余几个反应元件更易与各自的蛋白作用因子结合。表明基因的转录可能主要是通过Oozing方式.转录后的信使RNA即进入细胞浆,结合于核糖体开始蛋白质的翻译。 5. 表达蛋白作用的发挥。对这一过程的研究很少,主要还是对细胞色素P4501A1和1A2表达产物的研究,如:芳烃羟化酶,可将前致癌物转化为致癌物,从而促进机体癌症的发生。 二、芳香烃受体介导的蛋白激酶途径 二恶英毒性作用的另一条途径是通过激活蛋白激酶,然后通过激酶途径产生各种生物学活性。首先发现的蛋白激酶为酪氨酸蛋白激酶。Enan等在1996发现2,3,7,8-TCDD在非细胞条件下可使豚鼠脂肪细胞胞浆中的酪氨酸蛋白激酶的活性增高,且该作用为芳香烃受体依赖性的。不久他们进一步发现酪氨酸蛋白激酶不仅可被2,3,7,8-TCDD激活,并且酪氨酸蛋白激酶在胞浆中特异地与芳香烃受体复合物结合。Enan等认为酪氨酸蛋白激酶在胞浆中与芳香烃受体复合物结合,当配体与芳香烃受体结合,则使酪氨酸蛋白激酶被释放且被激活。从而使细胞内蛋白质的酪氨酸残基的磷酸程度增加。这种磷酸化作用对于细胞的增殖和分化具有重要意义。Blankenship等通过实验也得出了类似的结论。不久又发现了cAMP依赖的蛋白激酶,Enan等发现2,3,7,8-TCDD可通过芳香烃受体使细胞内的cAMP依赖的蛋白激酶激活,从而使细胞内Ca+2水平增高,细胞分泌功能加强,以及对糖原分解和合成途径及葡萄糖的摄取产生影响,这对二恶英导致的机体脂肪消耗和进行性衰竭具有重要意义.三、二恶英类化学物质对机体营养代谢影响的分子机制 二恶英类化学物质对机体营养代谢的影响主要体现在:高脂血症(高甘油三酯和高胆固醇),进行性衰竭,细胞葡萄糖摄取减少。在生化方面的表现主要为:影响脂蛋白脂肪酶,低密度脂蛋白受体和葡萄糖转位蛋白(glucose transport proteins, GLUT)。 二恶英类化学物质对细胞葡萄糖摄取的抑制与其影响GLUT浓度的作用相关。Hugh等研究表明2,3,7,8-TCDD对细胞摄取葡萄糖的抑制主要是通过GLUT-4浓度的下调而发生作用,芳香烃受体拮抗剂可拮抗二恶英类化学物质对细胞葡萄糖摄取的抑制,且各二恶英类化学物质与芳香烃受体的结合能力与它们抑制细胞葡萄糖摄取的能力一致。Hugh等的研究结果说明二恶英类化学物质主要是通过芳香烃受调控GLUT-4的浓度,从而抑制葡萄糖的摄取,但中间的具体过程目前还不清楚。细胞摄取葡萄糖的减少将导致脂肪组织中脂蛋白脂肪酶的活性降低和肝脏细胞膜上低密度脂蛋白受体的下调,也是二恶英类化学物质导致衰竭综合症的基本原因。脂蛋白脂肪酶主要作用为水解血清甘油三酯,使之转位于脂肪组织,该酶活性的降低则导致高甘油三酯血症和脂肪组织的耗竭。肝脏细胞膜上低密度脂蛋白受体途径为低密度脂蛋白代谢的主要途径,该受体的下调则导致血清低密度脂蛋白浓度上升,则血清胆固醇浓度也上升. 二恶英类化学物质毒性的分子机理经过十余年的研究,至今以有一个大致的轮廓,但很多细节问题还没有完全研究清楚,尤其是基因表达后,表达产物如何发挥作用;蛋白激酶激活后如何导致毒性效应;以及芳香烃受体存在于机体的意义也就是其生理作用和内源性配体。这些问题是当前二恶英类化学物质毒理机制研究的重点及热点,对这些问题的研究将对二恶英毒性的评价、预防和治疗都具有十分重要的意义。
根据IFRA内部通讯,美国职业安全和卫生研究所(NIOSH)发布《丁二酮和2,3-戊二酮职业暴露的推荐性标准(草稿)》,制定这两种香料的建议(职业暴露)限量。 丁二酮(CAS 431-03-8)和2,3-戊二酮(CAS 600-14-6)主要用于食用香料行业,也有少量用于日用香料的生产。根据2008年的调查,二者在日用香料行业的使用量分别为12438公斤和2813公斤,因此IFRA认为日用香料行业有必要就这个标准(草稿)进行交流。 在标准(草稿)中,NOISH建议,每周工作时间40小时,丁二酮的浓度应在5ppb以下;同时建议丁二酮15分钟的短时间暴露限值(STEL)为25ppb。对于2,3-戊二酮,NOISH建议每周工作时间40小时,其浓度应在9.3ppb以下,15分钟的短时间暴露限值(STEL)为31ppb。 NOISH还提到丁二酮的替代品,由于结构类似,具有相似毒性,因此也需要考虑这些物质的暴露情况,以及通过合理控制能够达到的最低浓度。 尽管NOISH的建议限量不属于法规要求,但是美国职业安全和卫生管理局在制定这两个物质的允许暴露限量(PELs)时,很大程度上会借鉴NOISH的建议限量,而PELs则属于OSHA的强制性法规要求。
做蔬菜样品时,先加的水和丙酮,加NaCl分层后,上层应该是丙酮吧?但为什么开始加的丙酮比水多很多,分层后丙酮却比水相少很多呢?而且色素全在丙酮里。 分出来的水相再加二氯甲烷提,分层后下层是二氯甲烷吗?怎么也有人说加了NaCl使二氯甲烷在水的上层呢?