有人做过GPO的蛋白电泳吗?今天做GPO(甘油磷酸氧化酶,MW:75KD)的还原型SDS-PAGE电泳,5%浓缩胶,12%的分离胶,理论上应该可以进行的,但什么都没有染出(其他蛋白都是正常的)。
各位,我遇到一个问题,我现在有一个AmBn的复合蛋白,其中A蛋白有m个,B蛋白有n个,老师想让我求出m、n的确切数值。请问用毛细管电泳怎么做?有人做过吗?谢谢了
4. 电泳时虽然小电泳分离效果要好一些,但2小时以上的等待的时间实在是痛苦,因此可以提高电泳至150V,但需要将整个电泳槽放在放满冰水的脸盆里散热,这样跑出来的胶分离效果丝毫不比低电压来的差,关键是时间大大节省,不需1h即可看结果了。5. 做SDS-PAGE的时候,除了蛋白量上样一致,最好体积也一致,这样跑出来的胶各个泳道之间的band能做到一样宽,方便后面的比较,特别是WB。做法就是拿1X的上样缓冲补全要加的样做到体积一致,否则跑出来会有的宽有的窄,特别是上样体积相差较大的。
亲们,跑蛋白电泳时,0.05%的溴酚蓝水溶液怎么配比较好呢,因为它不溶于水。还有SDS溶液应该怎么配,它也不溶于水啊,一搅拌全是泡沫
蛋白PAGE电泳后如何回收?把胶切割后装在透析袋中电洗脱的具体步骤是什么?如果不要电洗脱能采用什么方式?
1.原理等电聚焦凝胶电泳是依据蛋白质分子的静电荷或等电点进行分离的技术,等电聚焦中,蛋白质分子在含有载体两性电解质形成的一个连续而稳定的线性pH梯度中电泳。载体两性电解质是脂肪族多氨基多羧酸,在电场中形成正极为酸性,负极为碱性的连续的pH梯度。蛋白质分子在偏离其等电点的pH条件下带有电荷,因此可以在电场中移动;当蛋白质迁移至其等电点位置时,其静电荷数为零,在电场中不再移动,据此将蛋白质分离。 等电聚焦中,只有在凝胶两端给以高电压时,才能获得较好的蛋白质条带分辨率,这就需要非常有效的凝胶冷却系统(否则会导致烧胶),即凝胶同期周围液体之间的热传递效率要高。由于平板胶热传递能力高,并可方便的同时比较多种蛋白质样品,所以平板胶用在等电聚焦上的居多。由于等电聚焦对蛋白质的电荷差异非常敏感,若要好的重复性,制备蛋白样品时一定要小心,要避免任何对蛋白质化学组成和结构的修饰。另外,蛋白质-脂类、蛋白质-蛋白质相互作用可引起电荷改变,进而导致等电点迁移或纹理现象。除非特殊需要研究蛋白质-蛋白质相互作用或者必须保持蛋白质的生物学功能,等电聚焦通常在含有尿素的变性凝胶系统中进行。使用非离子去垢剂也可以提高分辨率。 2.主要仪器、试剂仪器:微型电泳系统、电源、注射器、固定和染色用容器 试剂:丙稀酰胺、双-丙稀酰胺、载体两性电解质、尿素、过硫酸胺、TEMED、TritonX-100、2-巯基乙醇、溴酚蓝、磷酸、氢氧化钠、氯化钾、三氯乙酸、考马斯亮蓝、甲醇、乙酸。 储存液:1)30%(w/v)丙稀酰胺,1%(w/v)双-丙稀酰胺;2)20%Triton X100;3)10%三氯乙酸;4)1%三氯乙酸;5)1%溴酚蓝;6)考马斯亮蓝染色液;7)考马斯亮蓝脱色液;
以前一致用伯乐的蛋白电泳仪,现第一次用六一的工具做了SDS-PAGE胶,上电泳,结果电压加到250v了电流还只有9mA,电泳了很久也没有太大的变化,开始以为是电泳液有问题,重装重配还是这样,终于电泳完了,很丑的结果。为什么会这样呢,在拆胶的时候发现配胶用的胶条还在上面,原来是胶条阻止了电流通过!望大家注意哟!!哈
采用P/ACETM MDQ高效毛细管电泳仪,电泳缓冲液为50mmol/L 柠檬酸-20mmol/L 柠檬酸三钠,pH2.6,电泳温度25℃,电压22kV,紫外检测波长196nm。结果表明:肌肉中肌红蛋白和血红蛋白含量测定结果相对标准偏差为0.69% 和0.90%,后加标准品和前加标准品回收率分别为93.26%~97.84%、90.32%~97.46% 和79.89%~84.14%、79.52%~83.65%。该方法简单、快速、对同时测定畜禽肌肉色素物质肌红蛋白和血红蛋白含量准确度良好,是评价肉品质参数的一种值得推广应用的新方法。
用毛细管电泳分离蛋白组分时,样品峰比较宽,怎么样使样品峰变窄?
奶粉蛋白质中乳清蛋白含量的测定 十二烷基硫酸钠-毛细管凝胶电泳法该标准还未正式发布

【题目】毛细管电泳法对乳及乳制品中真蛋白的测定【期刊】食品科学【年、卷、页】2010年,Vol.31 No.22【作者】丁晓静,杨媛媛,李芸,赵珊,王志http://ng1.17img.cn/bbsfiles/images/2014/03/201403242226_494084_2279481_3.jpg
5. 做SDS-PAGE的时候,除了蛋白量上样一致,最好体积也一致,这样跑出来的胶各个泳道之间的band能做到一样宽,方便后面的比较,特别是WB。做法就是拿1X的上样缓冲补全要加的样做到体积一致,否则跑出来会有的宽有的窄,特别是上样体积相差较大的。6. 在把蛋白胶做成干胶时,很多时候会因为有气泡使胶裂掉,我的经验是在做胶时加上层膜前在胶上多加些水就不容易进气泡了,还有就是高温烘胶(管家哥提醒慎用),我喜欢放到60度烘箱里烘,这样水分蒸发速度快,即使有一些小的气泡也不会有影响。
1. 跑page胶的时候,小电压跑会避免高电压产生的热量尔导致的胶层变形。低电压泳道会比大电压泳道跑的直一些,且分离效果更高,有利于分子量相差不大的蛋白分离。2. 做WESTERNBLOT 的时候,大家往往会摸索一抗、二抗的浓度,封闭时间,曝光时间等等,而每次变换其中的一个条件就需要从新跑胶、转膜,甚至重新提蛋白,这样会浪费大量的时间。其实完全没有必要这样。一次转膜后,将PVDF膜晾干,裁减成小块,保存起来,用的时候取出一块,没有任何影响。这对于摸索条件的战友来说,节约了大量的时间。3. 可将SDS-PAGE的积层胶,分离胶预先配好大体积如100ml储存在4度冰箱(注:10%AP,TEMED不加,切记!!!),每次配置时只需吸取相应体积的预制胶加入AP,TEMED即可,没必要每次制胶时候翻分子克隆,特别方便,而且,这样的预制胶可储存半年以上,不失为偷懒的绝佳方法;更关键的是可大大减少与丙稀酰胺的接触,因此大大减少中毒的机会。
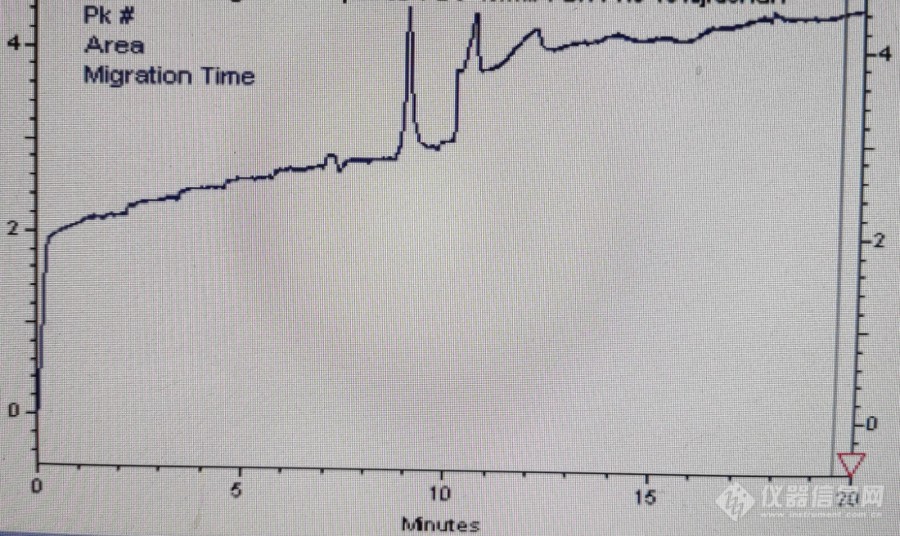
[img=,690,410]https://ng1.17img.cn/bbsfiles/images/2023/04/202304071246366038_1302_5414383_3.jpg!w690x410.jpg[/img]毛细管电泳跑蛋白标准品出了峰之后基线突然升高,求助各位大神是怎么回事。电泳仪是BECKMAN的P/ACE MDQ,用的DAD检测,BGE是10%甲醇+40mM PBS PH8。
11. 配胶最好现用现配,先配下层胶(分离胶),后配上层胶(浓缩胶或积层胶),而且在临灌胶前加APS并迅速混匀,即用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]抽吸与注入1-2次即可。(管家哥提醒,有条件最好现配现用,如果是配好板子的,也最好尽快在2天内使用,同时保鲜膜注意密封好。)12. 跑蛋白page的时候,一开始用加样针,太麻烦,发现用20ul枪+普通小白枪头点样,非常省事。另外,点样时有可能看不清孔在哪,看远离你的那面胶,孔有反光的。点样也点你对面的那块胶,省的总低头,干咱这行的容易得颈椎呀,爱惜自己。
蛋白分析系统在我们选择蛋白分析工具的时候,通常是根据不同的蛋白来选择不同的分析手段,如凝胶电泳、化学荧光染色、质谱等等。但是目前已经研制出的蛋白分析工具的种类繁多,从这一方面也在一定程度上反映了蛋白分析的复杂性。以下是一些近期推出的蛋白分析系统,希望能帮助您轻松完成研究工作。
我今年研一,做的乳清蛋白方面的研究,分离是利用凝胶层析柱,分离得到的蛋白用高效液相还是走电泳测定蛋白纯度精确,求大神支招
一、实验目的了解等电聚焦的原理。通过蛋白质等电点的测定,掌握聚丙烯酰胺凝胶垂直管式等电聚焦电泳技术。二、实验原理等电聚焦(Isoelectric focusing,简称IEF)是六十年代中期出现的新技术。近年来等电聚焦技术有了新的进展,已迅速发展成为一门成熟的近代生化实验技术。目前等电聚焦技术已可以分辨等电点(pI)只差0.001pH单位的生物分子。由于其分辨力高,重复性好,样品容量大,操作简便迅速,在生物化学、分子生物学及临床医学研究中得到广泛的应用。蛋白质分子是典型的两性电解质分子。它在大于其等电点的pH环境中解离成带负电荷的阴离子,向电场的正极泳动,在小于其等电点的pH环境中解离成带正由荷的阳离子,向电场的负极泳动。这种泳动只有在等于其等电点的pH环境中,即蛋白质所带的净电荷为零时才能停止。如果在一个有pH梯度的环境中,对各种不同等电点的蛋白质混合样品进行电泳,则在电场作用下,不管这些蛋白质分子的原始分布如何,各种蛋白质分子将按照它们各自的等电点大小在pH梯度中相对应的位置处进行聚焦,经过一定时间的电泳以后,不同等电点的蛋白质分子便分别聚焦于不同的位置 。这种按等电点的大小,生物分子在pH梯度的某一相应位置上进行聚焦的行为就称为“等电聚焦”。等电聚焦的特点就在于它利用了一种称为两性电解质载体的物质在电场中构成连续的pH梯度,使蛋白质或其他具有两性电解质性质的样品进行聚焦,从而达到分离、测定和鉴定的目的。两性电解质载体,实际上是许多异构和同系物的混合物,它们是一系列多羧基多氨基脂肪族化合物,分子量在300~1000之间。常用的进口两性电解质为瑞典Pharmacia-LKB公司生产的Ampholine 和Pharmalyte,价格昂贵。国产的有中国军事医学科学院放射医学研究所和上海生化所生产的两性电解质,价格便宜,质量尚佳。两性电解质在直流电场的作用下,能形成一个从正极到负极的pH值逐渐升高的平滑连续的pH梯度。若不同的pH值的两性电解质的含量与pI值的分布越均匀,则pH梯度的线性就越好。对Ampholine两性电解质的要求是缓冲能力强,有良好的导电性,分子量要小,不干扰被分析的样品等。在聚焦过程中和聚焦结束取消了外加电场后,如保持pH梯度的稳定是极为重要的。为了防止扩散,稳定pH梯度,就必须加入一种抗对流和扩散的支持介质,最常用的这种支持介质就是聚丙烯酰胺凝胶。当进行聚丙烯酰胺凝胶等电聚焦电泳时,凝胶柱内即产生pH梯度,当蛋白质样品电泳到凝胶柱内某一部位,而此部位的pH值正好等于该蛋白质的等电点时,该蛋白质即聚焦形成一条区带,只要测出此区带所处部位的pH值,即为其等电点。电泳时间越长,蛋白质聚焦的区带就越集中,越狭窄,因而提高了分辨率。这是等电聚焦的一大优点,不像一般的其他电泳,电泳时间过长则区带扩散。所以等电聚焦电泳法不仅可以测定等电点,而且能将不同等电点的混合的生物大分子进行分离和鉴定。早期的等电聚焦电泳是垂直管式的,其特点是体系是封闭的,不与空气接触,可防止样品氧化。近年来,又发展了超薄层水平板式等电聚焦电泳。此法的优点是加样数量多,节省两性电解质,电泳后固定、染色、干燥都十分迅速简便,其最大优点是防止了电极液的电渗作用而引起正负两极pH梯度的漂变。测定pH梯度的方法有四种:1.将胶条切成小块,用水浸泡后,用精密pH试纸或进口的细长pH复合电极测定pH值,然后作图。2.用表面pH微电极直接测定胶条各部分的pH值,然后作图。3.用一套已知不同的pI值的蛋白质作为标准,测定pH梯度的标准曲线。4.将胶条于-70℃冰冻后切成1mm的薄片,加入0.5ml 0.01M KCl,用微电极测其pH。三、仪器和用具1.电泳仪2.垂直管式园盘电泳槽一套3.注射器与针头4.移液管:10ml、5ml、2ml、1ml、0.1ml5.小烧杯若干6.培养皿一套7.直尺8.小刀9.精密pH试纸和带细长复合pH电极的pH计10.塑料薄膜和橡皮筋
我现在在做蛋白和核酸的结合.我的蛋白和核酸可以结合. 蛋白是400多KDa的 核酸很小, 是30bp的dsDNA. 我现在的检测条件下只跑蛋白是可以跑出来的, 当我蛋白和核酸一起跑的时候, 也会在跟只跑蛋白在差不多的位置出峰. (我用的双波长检测,蛋白和核酸分别标记,所以都能看到.)问题就是,一起跑的时候, 出的所有峰, 都是既有蛋白又有核酸, 不管我加的比例是多少.我就很困惑. 如果我加的核酸量很小的话,不是应该有很多游离的蛋白吗,就是说应该有的蛋白峰对应的地方是没有核酸出峰才对的啊, 为什么没有这样的峰呢, 我什么地方理解错了吗?~ 请大家帮忙.谢谢~~~~!BTW, 我用的是bare fused silica capillary, 是CZE, 不是凝胶的 谢谢~~~
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=46149]蛋白质电泳[/url]
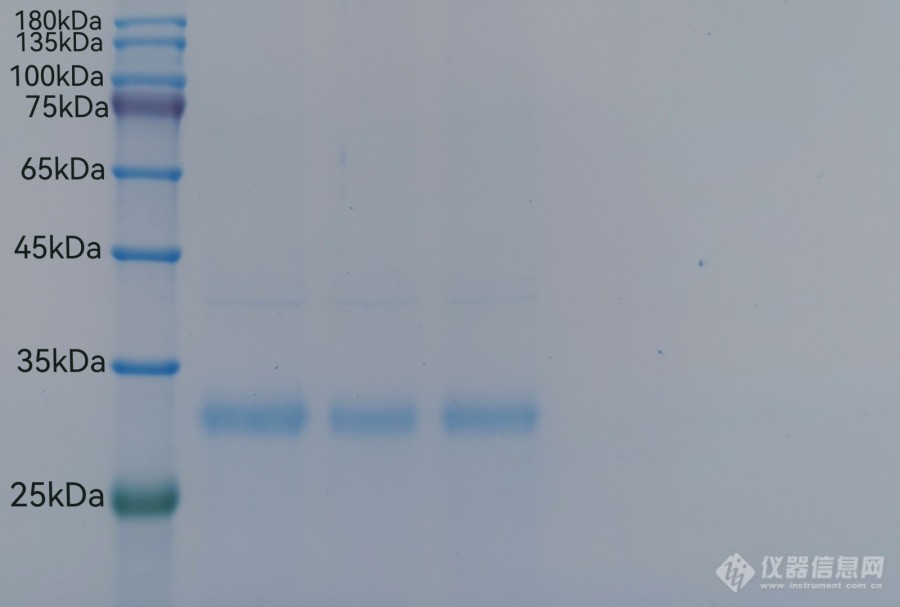
提取纯化了一种植物糖蛋白,凝胶电泳之后分别对蛋白和多糖进行染色,在25-35kDa有一条带是糖蛋白,但是多糖的条带有很严重的拖影,是因为物质不纯吗,还是这种电泳的方法不适用于多糖?[img=,690,465]https://ng1.17img.cn/bbsfiles/images/2022/07/202207141602541824_6299_5405797_3.jpg!w690x465.jpg[/img][img=,690,470]https://ng1.17img.cn/bbsfiles/images/2022/07/202207141603025571_1576_5405797_3.jpg!w690x470.jpg[/img]
荧光素忒贵,老板让省着用,那蛋白质的浓度一定要下降,不知道区带电泳对蛋白质浓度有要求不?
13. 垂直电泳时,可在电泳糟中放入青霉素小瓶等,可自然使液面提高而不影响电泳,又很节约电泳缓冲液。(管家哥没试过,慎用)14. 配胶时不要反复用枪混,稍微摇混就可以了,用枪混多次会导致胶凝不好影响电泳图的分辨率。15. AP分装成500微升一管保存放-20度,避免AP用太久失效。16. 倒胶时把玻璃板中的水用滤纸尽量吸干,因为微量的水存在会影响配的胶浓度。17. 电泳完撬胶时根本不需要用撬胶板,在一平皿里装好水,把有胶一面的放在水中晃动几次胶很容易就脱落下来,一点没有问题,方便的很。
[em06] ,大豆蛋白很不容易溶解,用缓冲液溶解处理后,静止一段时间后上机,分离的效果不好,但是我之前用过同样的方法,却能分离出峰,可现在分离不开,只是出现小馒头峰,明显是分不开, 求助,前处理的方法(较具体些)!!!
Q:SDS-PAGE电泳的基本原理?A:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
7. 做SDS-PAGE跑胶通常都是现配现用,但配胶要1h,所以如果想第二天睡个懒觉而又不耽误跑胶可以于前一天晚上做好浓缩胶和分离胶,待凝聚后不要拔下梳子,把含胶玻璃板从制胶槽取下,用保鲜膜包上,注意玻璃板上下两边缘会有气体,所以需要加一点电泳缓冲液以避免胶内水分蒸发.然后放4度过夜.第二天直接拔下梳子行后续.国外好多公司出售脚既是如此,可以保存上星期。8. 配置分离胶或者非变性胶时因胶凝时收缩可导致加样孔变浅.可以将加剩的胶放入4度以降低凝聚速度,而将凝胶放入37度促聚,并随时用4度加剩的胶补充下降的胶面。
1994年,Marc Wilkins在Siena双向凝胶电泳(two-dimensional electrophoresis,2-DE)会议上最早提出了蛋白质组(proteome)概念,并于1995年7月的Electrophoresis杂志上发表。随着高通量、高灵敏度、高分辨率生物质谱技术的出现,蛋白质组学技术取得飞速发展,人们不再满足于对一个细胞或组织的蛋白质进行定性研究,而是着眼于蛋白质量的研究,于是蛋白质组学概念就被提出,并得到了广泛的应用。蛋白质组学(Proteomics)是蛋白质(protein)与 基因组学(genomics)两个词的组合体,表示“一种基因组所表达的全套蛋白质”,即包括一种细胞乃至一种生物所表达的全部蛋白质。蛋白质组学研究,就是要把一个基因组表达的绝大多数蛋白质或一个复杂的混合体系中绝大多数蛋白质进行精确的定量和鉴定。蛋白质组本质上指的是在大规模水平上研究蛋白质的特征,包括蛋白质的表达水平,翻译后的修饰,蛋白与蛋白相互作用等,由此获得蛋白质水平上的关于疾病发生,细胞代谢等过程的整体而全面的认识。蛋白质组学是一门以全面的蛋白质性质研究为基础,在蛋白质水平对疾病机理、细胞模式、功能联系等方面进行探索的科学。目前最新的iTRAQ蛋白定量分析技术在此基础上被提出,并被得到广泛应用。仅仅知道蛋白质的身份并不足以对蛋白质给出最终定论,因为蛋白质的浓度对于实现其在细胞中的功能来说极其重要,一种特殊蛋白质在浓度上的变化,就能预示细胞的突变过程。因此,科学家能够对蛋白质的相对和绝对浓度进行测量,是很重要的事情。过去,科学家通常先进行二维(2D)凝较电泳,切断条带,再用质谱方法测量条带中的蛋白质。可是,这种方法不是很理想:既不是非常敏感,也不是非常精确。新泽西医学及牙科大学的蛋白组学研究中心主任Hong Li说:“当我们开始蛋白组学研究时,就采用2D凝胶技术,但得出的信息量却让大伙很失望,因为许多蛋白质已经改变了自身的代谢过程,如热休克蛋白或者是管家蛋白。”蛋白组学中的方法一直在不断提高。基于高度敏感性和精确性的串联质谱方法,不需要凝胶,就可以获得相对和绝对定量的蛋白质结果。iTRAQ和iCAT是这些新进展中的两大主力,但是,新技术也有不尽如人意的地方,需要不断改进。iTRAQ技术是由美国应用生物系统公司(Applied Biosystems Incorporation,ABI)2004年开发的同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术,是一种新的、功能强大的可同时对四种样品进行绝对和相对定量研究的方法,这种方法是建立在iTRAQ试剂的基础上。上海舜百生物公司目前所采用的就是这种iTRAQ技术。该技术的主要特点在于:1. 分离能力强、分析范围广;2. 定性分析结果可靠,可以同时给出每一个组分的分子量和丰富的结构信息;3. MS具备高灵敏度、检测限低;4. 分析时间快,分离效果好;5. 自动化程度高;6. iTRAQ技术不仅可发现胞浆蛋白,还有膜蛋白、核蛋白、胞外蛋白。iTRAQ技术可检测出低丰度蛋白、强碱性蛋白、小于10KD或大于200KD的蛋白。上海舜百生物使用的液相色谱仪的型号是日本岛津公司2D-nano-HPLC,质谱仪型号是美国ABI公司的MALDI-TOF-TOF 4700,标记试剂盒是美国ABI公司的ITRAQ标记试剂盒。舜田生物所采用的iTRAQ试剂是一种小分子同重元素化学物质,包括三部分:一端是报告部分(reporter group ),另一端是肽反应部分(peptide reactive group),中间部分是平衡部分(balance group)。 其中,reporter group:质量为114Da、115 Da、116 Da、117 Da,因此iTRAQ试剂共四种。 peptide reactive group:将reporter group与肽N端及赖氨酸侧链连接,几乎可以标记样本中所有蛋白质。 balance group:质量为31 Da、30 Da、29 Da、28 Da,使得四种iTRAQ试剂分子量均为145 Da,保证iTRAQ标记的同一肽段m/z相同。舜百生物公司iTRAQ的操作程序如下:将蛋白质裂解为肽段,然后用iTRAQ试剂进行差异标记。再将标记的样本相混合,这样就可以对其进行比较。与样本结合后,通常用MudPIT多维蛋白质鉴定技术进行下一步的操作,用2D液相色谱串联质谱进行分析。在质谱分析鉴定特殊肽离子片断结构的基础上,采用美国应用生物系统公司的软件包MASCOT和Protein Pilot对每一个肽段进行鉴定。其具体操作如下图所示: http://img.dxycdn.com/trademd/upload/userfiles/image/2013/11/A1383890263png_small.jpgiTRAQ技术对检测标本也有一定要求。舜百生物要求检测蛋白量最低不少于50 ug,浓度最低不少于5 ug/uL,否则同位素无法标记。而对蛋白提取试剂也要求使用普通的组织、细胞裂解液即可,切忌不要使用二维电泳试剂提取。iTRAQ技术区别与以往二维电泳技术具有更明显的优势,两者比较如下:1. 二维电泳所检测的发生表达变化的蛋白都位于细胞浆内,而iTRAQ可检测到蛋白有胞浆蛋白外,还有线粒体蛋白、膜蛋白和核蛋白。2. 二维电泳观察到的蛋白变化在2倍以上,而用iTRAQ计算出的蛋白变化在1.3-1.6倍之间。3. iTRAQ技术在鉴定大分子和小分子蛋白方面也有优势。4. 二维电泳是通过切断条带,再用质谱方法测量条带中的蛋白质,但该方法既不是非常敏感,也不是非常精确,获取的信息量很少。 而itraq技术是基于高度敏感性和精确性的串联质谱方法,不需要凝胶,就可以获得相对和绝对定量的蛋白质结果。5. iTRAQ可以对任何类型的蛋白质进行鉴定,包括高分子量蛋白质、酸性蛋白质和碱性蛋白质,而二维电泳对这些蛋白质都束手无策。由此,舜百生物得出结论:iTRAQ技术比二维电泳技术能发现更多数量和种类的蛋白,但在比较胞浆蛋白及蛋白量的变化方面,二维电泳技术有一定长处,对iTRAQ的实验结果有互补作用。
请问,使用毛细管电泳技术检测复杂体系中的某种微量蛋白(如食品、饲料等)是否可行?检测限和重现性如何?敬请有关专家给出指导。谢谢!
这是一本由郭尧君编著,1999年版本的,可能有些老了,希望对大家还是有些 帮助。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=16890]蛋白质电泳实验技术[/url]来源:食品伙伴网。
我是个新手,现有一个蛋白复合体,用凝胶电泳分析三个部分:名称 分子量 pI1st band 18.0KD 6.682nd band 13.5KD 5.473rd band 12.2KD 8.2没有标品,如何用毛细管电泳分离并相对定量。不用毛细管凝胶电泳行不行。我的e-mail: htx761229@sina.com谢谢!