有没有谁有比较好的检测酶抑制剂抑制效率的方法,也就是测Ki值的方法?谢谢
我国“替尼类”(酪氨酸激酶抑制剂)抗肿瘤药的市场现状2012年1月FDA批准辉瑞公司小分子酪氨酸激酶抑制剂阿西替尼上市,开始了又一轮抗肿瘤靶向药物研究的新高潮。酪氨酸激酶在肿瘤的发生、发展过程中起着非常重要的作用,以酪氨酸激酶为靶点进行药物研发已成为国际上抗肿瘤药物研究的热点。酪氨酸酶抑制剂在临床上通过抑制肿瘤细胞的损伤修复、使细胞分裂阻滞在G1期、诱导和维持细胞凋亡、抗新生血管形成等多途径实现抗肿瘤效果;其抗癌谱广,已经成为治疗各种癌症疾病的一线用药。伊马替尼是基于癌细胞分子作用机理而开发的第一个抗癌新药,开创了肿瘤分子靶向治疗的时代。目前我国已有8个酪氨酸激酶抑制剂上市,包括伊马替尼、厄洛替尼、舒尼替尼等,此类药物的市场情况如下表,其中只有埃克替尼一个为国产产品,其它均为进口产品。表1:酪氨酸激酶抑制剂靶向抗肿瘤药在中国上市情况通用名 商品名 中国上市年份 在中国上市的首家公司 伊马替尼 格列卫 2002 诺华 吉非替尼 易瑞莎 2004 阿斯利康 厄洛替尼 特罗凯 2006 罗氏 索拉非尼 多吉美 2006 拜耳 舒尼替尼 索坦 2007 辉瑞 尼洛替尼 达希纳 2009 诺华 达沙替尼 施达赛 2011 百时美施贵宝 埃克替尼 凯美纳 2011 浙江贝达药业有限公司 靶向治疗,是在细胞分子水平上,针对已经明确的致癌位点(该位点可以是肿瘤细胞内部的一个蛋白分子,也可以是一个基因片段),来设计相应的治疗药物,药物进入体内会特异地选择致癌位点来相结合发生作用,使肿瘤细胞特异性死亡,而不会波及肿瘤周围的正常组织细胞。由于靶向制剂可以提高药效、降低毒性,从而增强了药品的安全性、有效性和病人用药的顺应性,所以日益受到国内外医药界的广泛重视。从2011年各大公司年报数据了解到,诺华的伊马替尼销售额最大,超过46亿美元,罗氏的厄洛替尼和辉瑞的舒尼替尼销售额都超过10亿美元。表2:2011年各大药企的酪氨酸激酶抑制剂产品全球销售额通用名 企业 2011年销售额 伊马替尼 诺华 46.59亿美元 厄洛替尼 罗氏 12.51亿瑞士法郎 舒尼替尼 辉瑞 11.87亿美元 索拉非尼 拜耳 7.25亿欧元 达沙替尼 达沙替尼 8.03亿美元 尼洛替尼 诺华 7.16亿美元 吉非替尼 阿斯利康 5.54亿美元 拉帕替尼 葛兰素史克 2.31亿英镑
有没有针对乳酸菌的抑制剂?像脱氧剂能抑制细菌和霉菌等的生长,乳酸菌有这样的抑制剂吗
请教高手,样品为复方硫酸盐溶液,含高浓度的钠3.5%、钾0.8%、镁0.2%,[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]怎样选择抑制剂,是否浓度太大,需要稀释多少倍合适?
信号转导通路仍然是肿瘤研究、心脑血管疾病研究和免疫系统疾病研究的主要方向之一。该文章描绘了八个经常研究到的信号转导通路,并标出相关靶点的经典抑制剂,以便研究人员能更容易地判断自己所需的抑制剂。导读: 第一页 细胞凋亡信号转导通路第二页 DNA损伤信号转导通路第三页 JAK-STAT信号转导通路第四页 MAPK信号转导通路第五页 PI3K信号转导通路第六页 受体酪氨酸激酶信号转导通路第七页 TGF-beta/SMAD信号转导通路第八页 其他信号转导通路和因子对Wnt通路的影响
最近听说国外有一种新型的抑制剂,只要添加了无论牛奶中加入多少氯霉素,用什么试剂盒都检测不出来,深受牛奶商家的欢迎,诸位对于这个有没有了解啊。
新人做论文,检测丁烯二酸的顺反异构体,由于峰形问题,要加入磷酸,作为离子抑制剂,但是老师要求换其他的试试,以便说明选择磷酸的好处,请教一下,还有哪些是属于竞争性抑制剂或变性剂??
[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]仪器,测金属铷离子已知浓度。测试时的吸光度保证其在0.3~0.4 可是测出来是的数据却不是已知浓度的值,10测得为6mg/L,发现不准后调节电解抑制剂,增大电解抑制剂的浓度量,结果测得的浓度高于原始浓度,现在不知道该怎么办。要求的电解抑制剂是2000mg/L,现在已经加倍为20000才能 测出的值是已知浓度,不知道这样做对吗,按照要求的电解抑制剂浓度的话,得不到已知浓度的值。怎么办呢,摸索了很久了.....
甜味抑制剂可以降低人对糖的感觉,不使人感觉不腻(有的产品如果糖的含量低,外观就不好看)。降糖剂一般用于用于月饼,糖果等产品。只是什么一类化合物?
中国科技网讯 最近出版的国际肿瘤学权威期刊《美国国立癌症研究所杂志》发表了题为《转化生长因子β受体Ⅰ抑制剂高效安全抑制乳腺癌转移》的研究论文。该研究由国家“千人计划”入选者、华东师大生命医学研究所、上海市调控生物学重点实验室刘明耀教授领衔的课题组研发,发现了新型抗肿瘤体内生长和转移抑制剂。 随着全球肿瘤发病率的提高,我国已成为世界上肿瘤发病和死亡的大国。预计到2030年,世界上将有1320万人死于癌症,其中1/4在中国。针对这一严峻现状,近年来,学者一直在致力于战胜这个“恶魔”。分子靶向治疗,特别是寻找肿瘤转移的分子靶向治疗是近年来肿瘤治疗研究最为活跃的领域。肿瘤分子靶向治疗药物是一种小分子靶向治疗药物,就像子弹一样,可以直接命中癌细胞,而尽可能不损伤正常细胞,因其高效安全而备受瞩目。 课题组利用计算机模拟技术,构建了以抑制转化生长因子β受体活性为抗肿瘤药物靶点的虚拟筛选模型。利用该模型,从40万个小分子化合物库中筛选确定了100个左右的小分子。这些虚拟筛选出来的小分子在实际中是否真的能抑制癌细胞生长和迁移?这就需要再通过细胞抗癌功能筛选,从中找到1—2个抗癌效果最好的小分子。结合药物化学结构改造,这些小分子就改造成了能强烈抑制乳腺癌细胞迁移的新型转化生长因子β受体Ⅰ抑制剂。 课题组把实验小鼠分为乳腺癌原位转移组、乳腺癌肺转移组和骨转移组3种转移模型,利用治疗和预防两种给药方案,把这种抑制剂用于3种不同的动物模型。实验结果均表明,该抑制剂几乎能完全抑制乳腺癌的体内转移,并且对实验动物没有毒性。 专家认为,该项研究发现了一类新型转化生长因子β受体Ⅰ抑制剂,从多个角度证明其具有良好的抑制肿瘤转移效果,尤其在多种肿瘤转移动物模型中得到了令人印象深刻的结果。(张惠虹 记者王春) 《科技日报》(2013-02-18 一版)
问题描述:RNA 中含有逆转录抑制剂时,怎么处理?解答:[font=宋体]逆转录抑制剂包括:[/font][font=&]SDS[/font][font=宋体]、[/font][font=&]EDTA[/font][font=宋体]、甘油、焦磷酸钠、亚精胺和胍盐,可将质控[/font][font=&] RNA [/font][font=宋体]与样品核酸混合作为实验组(同时质控[/font][font=&] RNA [/font][font=宋体]同比稀释做为对照组),对比对照组与实验组[/font][font=&] Ct [/font][font=宋体]值以检测是否存在[/font][font=&]RNA [/font][font=宋体]抑制剂;若质控[/font][font=&] RNA [/font][font=宋体]与样品核酸混合后[/font][font=&] Ct [/font][font=宋体]变大([/font][font=&]ΔCt[/font][font=宋体]>[/font][font=&]2[/font][font=宋体]),则说明样品中存在逆转录抑制剂,可用[/font][font=&] 70%[/font][font=宋体]([/font][font=&]v/v[/font][font=宋体])乙醇对[/font][font=&] RNA [/font][font=宋体]沉淀进行清洗,以除去抑制剂。[/font]以上内容来自仪器信息网《PCR实战宝典》
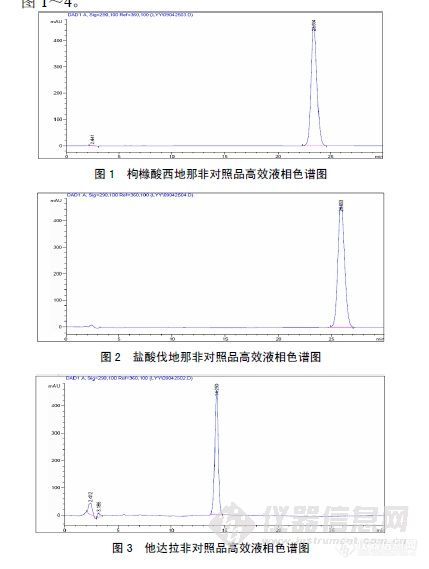
作者:倪晨;陈汀波;梁远园;王倩;(广东广州中医药大学;)摘要:目的建立快速、准确的检测中药保健品中非法添加磷酸二酯酶5(PDE5)抑制剂的方法。方法采用高效液相色谱法(HPLC)检测,DiamonsilC18色谱柱;流动相:乙腈-0.05mol·L-1三乙胺(用磷酸调PH至6.0)=40:60,流速1.0mL·min-1,检测波长290nm。结果该保健酒中未检出PDE5抑制剂:枸橼酸西地那非、盐酸伐地那非、他达拉非。结论该方法灵敏度高,重复性好,可用于PDE5抑制剂的定性检查。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208131450_383525_1606903_3.jpg
冶金冷轧中使用的抑制剂使用哪种测量仪表好啊 好着急啊
待测物质为弱酸性物质,用缓冲溶液和混酸做为离子抑制剂有什么区别?谢谢[em0815]
[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]测纯水抑制剂饱和再生液200mmol/l磷酸淋洗液5.0mmol/l碳酸钠+5.0mmol/l碳酸氢钠万通[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]色谱柱A5-250[img]https://ng1.17img.cn/bbsfiles/images/2022/12/202212060913444953_2987_5377725_3.png[/img]
谢谢,有谁可以告知本人BOD测量中的硝化抑制剂(ATH)的成分是什么。
之前用原吸火焰测钾、钠,按行业标准规定的方法,加5%CsCl作为抗电离剂。现想用ICP-MS测试,因相关的行标还未发布,所以请教各位有经验的老师,ICP-MS测钾、钠需要加电离抑制剂吗?
使用安捷伦 6410 三重串连四级杆质谱仪快速定量血液中的免疫抑制剂 http://www.chem.agilent.com/scripts/Literaturepdf.asp?iWHid=50828[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=52157]使用安捷伦 6410 三重串连四级杆质谱仪快速定量血液中的免疫抑制剂 [/url]
甜味抑制剂"2-(4-甲氧基苯氧基)-丙酸钠"如何检测?用HPLC可以检测,用GC或GCMS如何检测,如何衍生化?先酸化吗?在衍生化?
[b]【序号】:1【作者】:[url=https://search.cnki.com.cn/Search/Result?author=%E6%9D%8E%E6%85%A7%E6%95%8F]李慧敏[/url][font=宋体][size=12px] [/size][/font][url=https://search.cnki.com.cn/Search/Result?author=%E6%9D%8E%E5%AE%8F]李宏[/url][font=宋体][size=12px] [/size][/font][url=https://search.cnki.com.cn/Search/Result?author=%E7%BD%97%E7%90%B4]罗琴[/url][font=宋体][size=12px] [/size][/font]【题名】:[b]免疫检查点抑制剂治疗相关静脉血栓栓塞症的研究进展[/b]【期刊】:现代肿瘤医学【年、卷、期、起止页码】:2023年13期 [font=&][size=12px][/size][/font]页码: 2546-2552 【全文链接】:http://www.xdzlyx.com/oa/DArticle.aspx?type=view&id=202313032[/b]
急需下列标准GB-T 11143-1989 加抑制剂矿物油在水存在下防锈性能试验法GB-T 12579-2002 润滑油泡沫特性测定法SH-T 0663-1998 汽油中某些醇类和醚类测定法([url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法SH-T 0308-1992 润滑油空气释放值测定法SH/T 0124-2000 含抗氧剂的汽轮机油氧化安定性测定法望哪位给上传一下,不胜感激,谢谢!
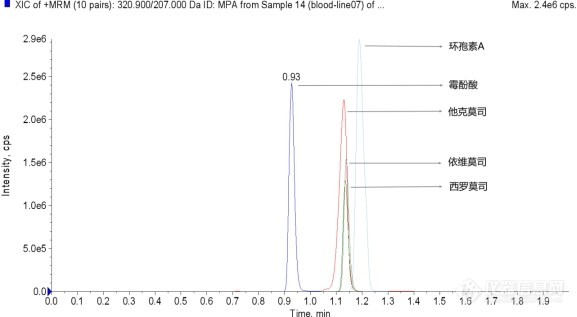
[align=center][b][font=Arial][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]MS[font=宋体]法同时分析血液中五种免疫抑制剂浓度[/font][/font][/b][/align][b][font=Arial]1[font=宋体]、项目背景:[/font][/font][/b][font=Arial][font=宋体]免疫抑制剂通过抑制淋巴细胞的功能,减少移植物排斥反应的发生,延长移植物存活时间。但由于不良反应较多,常常需要在低剂量发生移植物排斥和高剂量产生毒性之间取得平衡。临床常用的免疫抑制剂如环孢素A([/font]Cyclosporin A[font=宋体])、霉酚酸酯([/font][font=Arial]Mycophenolate mofetil[/font][font=宋体])、他克莫司([/font][font=Arial]Tacrolimus[/font][font=宋体])、西罗莫司([/font][font=Arial]Sirolimus[/font][font=宋体])、依维莫司([/font][font=Arial]Everolimus[/font][font=宋体])等,由于其治疗窗窄,其药动学存在明显的个体间差异,因此需要密切监测药物浓度,以确保处于安全有效的治疗范围。[/font][/font][font=Arial] [/font][b][font=Arial]2[font=宋体]、实验部分[/font][/font][font=Arial]2.1 [font=宋体]实验仪器[/font][/font][/b][font=Arial][font=宋体][url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]质谱检测系统:[/font]AB SCIEX Triple Quad[/font][sup][font=Arial]TM [/font][/sup][font=Arial]4500MD[/font][font=Arial][font=宋体]高速冷冻离心机:[/font]D1524R[/font][b][font=Arial]2.2[font=宋体]样本制备[/font][/font][/b][font=Arial][font=宋体]取[/font]100 μL[font=宋体]全血样本,加入[/font][font=Arial]100 μL[/font][font=宋体]硫酸锌水溶液,再加入[/font][font=Arial]300 μL[/font][font=宋体]含内标工作液,涡旋混匀[/font][font=Arial]1 min[/font][font=宋体],将样品于[/font][font=Arial]4 [/font][/font][font=宋体]℃[/font][font=Arial][font=宋体]条件下[/font]14000 rmp [font=宋体]离心[/font][font=Arial]10 min[/font][font=宋体],取[/font][font=Arial]200 μL[/font][font=宋体]上清于进样小瓶中,进行[/font][font=Arial][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]MS[/font][font=宋体]分析。[/font][/font][b][font=Arial]2.3[font=宋体]分析方法[/font][/font][/b][font=Arial]Column: [/font][font=Arial]ChromCore BR C18[/font][font=宋体] [/font][font=Arial]3μm[/font][font=宋体],[/font][font=Arial]2.1×50mm[font=宋体]([/font][font=Arial]Part No.A301-030018-02105S[/font][font=宋体])[/font][/font][font=Arial]Mobile Phase:[/font][font=Arial]A[/font][font=宋体][font=Arial])[/font][/font][font=Arial] 0.1%[font=宋体]甲酸[/font][font=Arial]-2 mM[/font][font=宋体]乙酸铵[/font][font=Arial]-[/font][font=宋体]水[/font][/font][font=Arial]B[/font][font=宋体][font=Arial])[/font][/font][font=Arial] [font=宋体]甲醇[/font][/font][font=Arial]Gradient:[/font][font=Arial]2 min 40% B[/font][font=Arial]Flow Rate:[/font][font=Arial]0.7 mL/min [/font][font=Arial]Temperature:[/font][font=Arial]45 [/font][font=宋体]℃[/font][font=Arial]Injection:[/font][font=Arial]5 μL[/font][font=Arial] [/font][font=Arial]3、[/font][b][font=Arial][font=宋体]实验结果[/font][/font][font=Arial]3.1[font=宋体]色谱图[/font][/font][/b][img=,461,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081606114692_9457_3237657_3.jpg!w577x317.jpg[/img][img=,482,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081606269328_9094_3237657_3.jpg!w603x336.jpg[/img][font=Arial] [/font][img=,482,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081606409213_8305_3237657_3.jpg!w603x336.jpg[/img][font=Arial] [/font][img=,484,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081606522770_8442_3237657_3.jpg!w605x337.jpg[/img][img=,507,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081607038290_6320_3237657_3.jpg!w634x353.jpg[/img][img=,507,]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081607189938_5889_3237657_3.jpg!w634x353.jpg[/img][b][font=Arial]3.2[font=宋体]标准曲线[/font][/font][/b][img=,690,377]https://ng1.17img.cn/bbsfiles/images/2023/02/202302081608314281_2289_3237657_3.png!w690x377.jpg[/img][font=Arial][font=宋体]霉酚酸(线性范围[/font]50~5000 ng/mL[font=宋体])、环孢素[/font][font=Arial]A[/font][font=宋体](线性范围[/font][font=Arial]10~1000 ng/mL[/font][font=宋体])、他克莫司(线性范围[/font][font=Arial]1~100 ng/mL[/font][font=宋体])、依维莫司(线性范围[/font][font=Arial]1~100 ng/mL[/font][font=宋体])、西罗莫司(线性范围[/font][font=Arial]1~100 ng/mL[/font][font=宋体])在其线性范围内呈现良好的[/font][/font][font=Arial][font=宋体]线性关系,[/font]r[font=宋体]值均在[/font][font=Arial]0.99[/font][font=宋体]以上。[/font][/font][b][font=Arial]4[font=宋体]、结论[/font][/font][/b][font=Arial][font=宋体]本文建立了全血样本中霉酚酸、他克莫司、依维莫司、西罗莫司、环孢素[/font]A[font=宋体]五种免疫抑制剂的[/font][font=Arial][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]MS[/font][font=宋体]测定方法。采用色谱柱[/font][/font][font=Arial]ChromCore BR C18[/font][font=Arial][font=宋体]分析霉酚酸、他克莫司、依维莫司、西罗莫司、环孢素[/font]A[font=宋体],结果显示,目标物保留强,峰形良好,分析时间短,满足日常检测需求。[/font][/font][font=Arial][font=宋体]色谱柱信息:纳谱分析[/font]ChromCore BR C18[/font][font=宋体] [/font][font=Arial]3μm[/font][font=宋体][font=Arial],[/font][/font][font=Arial] 2.1×50mm[/font]
【序号】:1【作者】:廖杰; 刘娜; 刘春胜【题名】:DART-MS/MS法直接实时检测保健食品中非法添加的6个PDE5抑制剂的应用研究【期刊】:药物分析杂志【年、卷、期、起止页码】:2011年03期 【全文链接】:http://www.cnki.net/kcms/detail/detail.aspx?dbcode=cjfq&dbname=cjfq2011&filename=ywfx201103005&uid=&p=【序号】:2【作者】:waters【题名】:ASAP/四极质谱联用:实现对食品中香料成分的快速指纹检测【期刊】:食品安全导刊【年、卷、期、起止页码】:2010年08期 【全文链接】:http://www.cnki.net/kcms/detail/detail.aspx?dbcode=cjfq&dbname=cjfq2010&filename=spaq201008014&uid=&p=
请问各位高手; [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url]中, 抑制器的作用是什么? 书上只说可以提高灵敏度, 降低背景,但没有说清楚怎样发挥作用的
脂质体包覆的COX-2抑制剂纳米颗粒的靶向化疗脂质体确 (liposome) 是一种磷脂和胆固醇组成的双层膜球形囊泡. 脂质体可以用天然的磷脂和磷脂乙醇胺 (phosphatidylethanolamine, 源于鸡蛋) 或纯表面活性剂, 如 DOPE (dioleolylphosphatidylethanolamine) . 脂质体通常含有一个核心的水溶液 (但这并非脂质体定义). 不含有水溶性物质的脂质双膜体被称为胶束(miscell).脂质体 (Liposome) 是由两个希腊词'脂'和 '体' 的意思构成. 脂质体本身并不表明任何大小之特点, 因此不同于纳米体 (nanosome). 1961年英国剑桥大学巴巴拉汉姆学院血液学家Bangham先生首次描述脂质体. Bangham先生与其同事Horne为了测试研究所新到的电子显微镜, 加负染色剂(三氯醋酸,TCA)于干磷脂中, 随后他们观察到一种类脂双层结构, 酷似质膜, 这就是首次显微镜照片展示的细胞膜实质性证据. 由于其独特的性能脂质体可用于药物载体, 这是由于亲水溶解溶质不能轻易通过脂质双膜, 而疏水性化学物质,可以溶解到脂质体膜内, 所以脂质体既可携带疏水性分子, 也可亲水性分子. 脂质体双层可以与其他细胞膜双层融合, 从而传递携带内含物. 用脂质体来投递DNA (lipofection) 比 单独用DNA感染细胞要有效的多. 低(或高) pH脂质体中的水溶解药物都带有电荷 (即pH值是药物的等电点范围以外) . 随着pH值自然抵销 (质子能通过膜), 因药物能自由穿过细胞膜, 中和后的脂质体药物也会自由扩散, . 这一投递是借脂质体双层膜与细胞接触来扩散脂质体药物, 而不是直接的融合. 所以这种脂质体药物的生产与使用受到时间上的限制.另一种脂质体药物投递的方式是借巨吞噬细胞作用. 一定大小范围内的脂质体可被人体中巨噬细胞吞噬. 脂质体药物在脂质体被巨噬细胞的胞溶体溶解后释放出来.加上陪体 的脂质体更易激活这种内吞噬作用.另一脂质体的好处是它的癌细胞靶向能力, 所有健康人的血管内皮都是由内皮细胞所包裹, 严密阻止任何大颗粒从血液中漏出. 但肿瘤血管则不具有相同水平的密封效果,通常小于400nm的脂质体可可迅速从患者的血液进入肿瘤. 抗癌药物如阿霉素(Doxorubicin, Doxil) 和柔红霉素 (Daunorubicin, Daunoxome ) 就是利用脂质体给药系统. 脂质体可用磷脂水经超声波而制成. 低剪切率超声波制成像洋葱多层状脂质体, 如持续用高剪切超声波则倾向于形成较小的单层脂质体 (unilamellar). 超声波法被普遍认为是"毛, 粗"的制备方法, 较新的方法, 如挤出法(extrusion)制成的脂质体药物可供人类使用.当前研究已经能够使脂质体能躲避人体的免疫系统, 成为"隐形脂质体", 即脂质体外挂上惰性聚乙二醇( PEG ), PEG脂质体延长循环中的药物运送. 但是 目前的困难是PEG涂的厚度. 太厚则阻止脂质体与细胞的接合. 为了特异性接合脂质体可挂上单克隆抗体, 或特异性抗原. 这样脂质体药物只送到病变组织.
酶制剂的酶活测定方法及影响因素随着我国畜牧业的发展和生物工程技术的不断进步,酶制剂在饲料工业中的应用越来越普遍。由于酶制剂能够消除饲料中的某些抗营养因子的负面作用,提高饲料消化率,改善动物生产性能,降低生产成本,因此日益受到饲料界的重视。但是,由于酶制剂来源比较复杂、分子结构不明确,分离提纯困难等多种原因,使这类产品有国家标准的不多,即使有国标也存在一些问题。给广大养殖用户和生产企业带来很大不便。本文简要介绍一下常用的酶活测定方法及测定过程的影响因素,仅供广大饲料工作者提供参考。1 酶制剂的定义及分类所谓的酶制剂就是通过产酶微生物发酵工程或含酶的动、植物组织提取技术生产加工而成,具有一种或多种底物清楚的酶催化活性,有助于改善动物对饲料营养成分的消化、吸收等,并有功效的生物学评定依据,符合安全性要求,作饲料添加剂用的酶制剂产品(NY/T 722-2003)。工业上应用的酶制剂大多为水解酶,按作用底物的不同,可分为淀粉酶、蛋白酶、脂肪酶、植酸酶、木聚糖酶、果胶酶、葡聚糖酶、纤维素酶等。按动物体内是否分泌,分为消化酶和非消化酶两大类。消化酶指动物自身能够分泌的淀粉酶、蛋白酶和脂肪酶等,在幼龄动物或特殊生理阶段时,动物也存在消化酶分泌不足需要外源供给的情况。非消化酶是指动物自身不能够分泌或很少分泌,必须由外源供给的酶,这类酶能消化动物自身不能消化的物质或降解一些抗营养因子,主要有植酸酶、木聚糖酶、果胶酶、葡聚糖酶、纤维素酶等。2 常见的酶活测定方法通常酶制剂活性的检测是采用实验室分析手段来进行评价,它可以用来筛选优质酶制剂、确定复合酶制剂的最佳组方及确定产品的最佳添加量等,酶制剂实验室评价技术是目前饲料厂家应用最为广泛的一种方法。其操作相对简单,检测所用时间短,便于生产实践应用。酶活测定结果虽不能完全反映酶的使用效果,但通过检测至少可以避免使用劣质的酶制剂。我国饲料工业标准中已经确立了饲用植酸酶(GB/T 18634)、纤维素酶(NY/T912)、β-葡聚糖酶(NY/T 911)的测定方法。另外,许多企事业单位为了生产研究的需要也制定了很多用于各种酶制剂活力的测定方法。目前测定酶制剂活性的方法主要有:2.1 比色法比色法是以反应生成有色化合物的显色反应为基础,通过比较或测量有色物质溶液颜色深度来确定待测组分含量的方法,根据原理不同可分为还原糖法和色原底物法。2.1.1 还原糖法 这种方法是通过酶作用于化学合成或从自然界提取出来的底物来进行测定的。非淀粉多糖酶与底物在特定的条件(温度、pH值和底物浓度)下反应,反应产物为还原糖,在与显色剂反应后,通过比色确定还原糖的生成量,同时制作标准曲线。酶的活性表示为单位时间产生一定浓度的产物所需要的酶量(mg 或mL)。该法可适用于大部分酶活力的测定,如淀粉酶、蛋白酶、脂肪酶、植酸酶、木聚糖酶、果胶酶、β-葡聚糖酶、纤维素酶等的测定。根据显色剂的不同又可分为DNS 法、钒钼酸铵法和地衣酚法。其中DNS 法由于操作简单、显色稳定,是目前众多实验室和饲料企业在测定非淀粉多糖酶时应用最多的测定方法。2.1.2 色原底物法 原理是利用人工合成的含色原基团的底物在酶的作用下释放出有色物质,利用分光光度计比色测定有色物质的含量计算酶活。如木聚糖酶活力的测定。该法操作简单、重现性好,但酶作用于合成底物与天然底物的效果有一定区别,用合成底物测定的酶活并不能代表酶制剂在应用于天然饲料时所能发挥的酶活大小。2.2 黏度法这种方法是根据酶能够降低一定浓度的标准底物(控制pH值、温度等条件)的黏度的能力来确定酶的活性。利用的底物主要有化学合成的底物(如CMC 用于纤维素酶的测定) 和自然提取的底物(如小麦阿拉伯木聚糖用于木聚糖酶的测定)。测定的酶的活性值是通过与同时测定的标准酶活性的比较,来确定酶的活性。该法可用于木聚糖酶、β-甘露聚糖酶、β-葡聚糖酶等酶活测定。这种方法的特点是通过降低底物的粘度来反映酶的活性,这也正是酶在体内起作用的重要特征。该法虽然灵敏度较高,但重现性差,操作复杂费时,应用难于普及。2.3 免疫学法用于酶活性分析的免疫学法包括ELISA 法和免疫凝胶扩散法。这两种方法是根据酶与抗体之间发生反应,然后ELISA 法通过第二步反应,凝胶扩散法则通过印染过程来确定酶的活性。这些方法非常灵敏,能够检测到极低水平的酶蛋白。但它们的缺点是对于每个产品的酶需要特殊的抗体,另外抗体能够与非酶蛋白质发生反应。由于抗体本身所用的蛋白质是特定的,因此,由不同生产者生产的同种类型的酶之间是没有交叉性的。另外,采用实验动物的敏感性也值得探讨。2.4 凝胶扩散法这种方法是将酶作用的底物与某种凝胶混合后倒入培养皿中,凝固之后,在凝胶上切开一条凿,倒入标准酶液和测试酶液。培养一定时间后,在切开的凝胶周围能够看到水解区域,区域的大小与酶的含量成正比。在某些情况下,还可以再加入其他试剂来显示水解的区域。如木聚糖酶活力的测定。这种方法虽然简单,但培养时间长。因为这种方法是根据区域的大小来确定酶的活性,所以其准确性要低于其他非扩散的方法。2.5 比浊法以酵母或酵母细胞壁在缓冲溶液中的浊度或吸光度的降低来表示酶活力,如β-葡聚糖酶活力的测定。2.6 体外模拟消化技术酶活测定毕竟不能反映外源酶在机体内真实的作用效果,因此,对于体外法评定饲料营养价值的研究不断增加。体外法评定饲料营养价值是通过模拟消化道内温度、pH、消化酶分泌、胃肠运动和养分吸收等参数,在体外建立一套与畜禽消化道内环境接近的操作程序,对饲料及酶制剂进行营养价值预测和评定。常用的体外模拟消化技术包括:①胃蛋白酶—胰酶法;②胃蛋白酶—小肠液法;③胃蛋白酶—胰酶—瘤胃液法;④胃蛋白酶—胰酶—碳水化合物酶法。由于不同的饲料用酶是不同的微生物通过发酵过程产生的,酶产品的酶学性质差别较大。并且各种微生物所分泌的酶的最佳pH 值、温度和对底物的亲和性都不相同。而目前,饲用酶除植酸酶、纤维素酶、木聚糖酶和β-葡聚糖酶有正式颁布的国标或行标酶活测定方法外,其他饲用酶制剂目前都还没有一个统一的定义及检测标准。因此,饲料厂家在比较不同厂家的酶制剂时,在没有统一的测定方法情况下,应首先确定自己认可的检测方法,然后在完全相同的测定条件进行检测,这样得出的结论才具有可比性。3 酶制剂活性测定影响因素的分析饲用酶制剂活性测定的主要影响因素有温度、pH、作用时间、底物等4大要素以及一些非定义要素,如酶液稀释度、标准曲线、显色剂、缓冲液等,下面就这几方面进行归纳分析一下:3.1 影响饲用酶制剂活性测定的四大要素所谓的酶活性就是指在特定的系统和条件下测到的反应速度。为了确保酶制剂测定结果的一致性,饲用酶制剂活性单位定义中对影响酶活大小的主要条件进行了规定,其中包括温度、pH 值、时间和底物,这些都是酶活力测定系统中最重要的因素,对酶促反应速度影响很大。3.1.1 温度对酶活测定的影响 酶制剂对温度非常敏感,在检测过程中对温度的控制则显得非常重要。温度对酶活性影响主要表现在两个方面:一方面,是当温度升高时,酶与底物的反应速率加快;另一方面,由于随着温度的升高将使酶的稳定性下降,部分酶蛋白分子逐渐变性而失去活性,引起酶反应速率下降。温度的这两种影响的综合作用而产生酶反应的“最适温度”。对于不同的酶制剂在不同的情况下最适温度是有一定的差别。研究木聚糖酶时发现,在30℃~40℃条件下酶活较稳定,50℃后随着温度的升高,酶活力开始下降,90℃时基本失活。研究纤维素酶最适酶解条件时发现,在36℃~58℃之间纤维素酶相对酶活随着温度升高而升高,当温度在58℃~62℃之间时,相对酶活性没有明显变化,曲线近似呈水平状态,在40℃、45℃、50℃条件下,其相对酶活分别为56%、70%、80%,而当温度大于58℃以上时相对酶活不再升高。同时,酶在不同条件下适宜温度也可能要受到酶的纯度、底物、激活剂、抑制剂以及酶促反应时间等因素的影响。3.1.2 pH 对酶活测定的影响 pH 值在酶活测定时对测定结果影响很大,各种酶制剂在一定条件下都有其特定的最适酶解pH,酶的最适pH 会随着底物种类和浓度、缓冲液种类和浓度的不同而改变,因此最适pH 也只有在一定条件下才有意义。pH 影响酶活力的原因可能有以下几个方面:① 过酸或过碱可以使酶的空间结构破坏,引起酶构象的改变,也影响酶活性部位催化基团和结合基团的解离状态,酶活性丧失;② 当pH 改变不是很剧烈时,酶虽未变性,但酶活受到了影响。pH 影响了底物的解离状态,或者使底物不能和酶结合,或者结合后不能生成产物。pH 影响酶分子活性部位上有关基团的解离,从而影响与底物的结合或催化,使酶活性降低可能影响到中间络合的解离状态,不利于酶解生成产物;③ pH 影响维持酶分子空间结构的有关基团解离,从而影响了酶活性部位的构象,进而影响酶的活性;④ pH 影响底物的带电状态。这些都直接影响酶和底物的亲和力,影响酶解反应速度。有文献报道,很多酶最适酶解pH 都在3.0~6.0。研究不同pH 值对嗜热毛壳菌木聚糖酶活性的影响发现,在pH 值3.6 以下,随着pH 值的增大,木聚糖酶的活性逐渐升高;pH 值为3.6 时,木聚糖酶的活性最高,且在3.
类胡萝卜素的制剂化研究 类胡萝卜素长期被认为是一类色素,但着色功能仅是类胡萝卜素功能方面很小的一部分,其用途更主要地体现在其生物功能方面,这方面的研究文献很多,主要有作为维生素A原、清除自由基、防癌抗癌及眼保健等,从某种意义上讲,类胡萝卜素是具有维生素功能的类维生素类。 类胡萝卜素制剂化的必要性 增强类胡萝卜素的稳定性 类胡萝卜素分子中至少存在9个双键,是非常不稳定的物质,易受光、氧、水分、重金属、氧化剂或还原剂的作用而降解,而且条件改变时易产生活性不高的异构体。但通过制剂化处理后能大大提高其对环境的适应能力,增强其稳定性。 扩大类胡萝卜素的应用范围 由于类胡萝卜素的脂溶性,其在食品及饮料中的直接应用受到很大的限制。目前类胡萝卜素晶体在食品和饲料及药物上都不直接使用,因为结晶形式的类胡萝卜素吸收很差,且几乎没有着色效果。因此为了增加着色效果并增强吸收性,改变溶解能力,扩大其应用范围,必须将类胡萝卜素制剂化。 增加类胡萝卜素的生物利用度 影响类胡萝卜素生物利用率的因素有很多,它们或者影响到类胡萝卜素的吸收,如类胡萝卜素的结构形式、在食物中的物理结合状态、膳食中脂肪和蛋白质的含量、动物体内的pH值的变化、胆汁中胆酸和胆酸盐的浓度、肠道中胰酶以及体内维生素A的营养状况等,都影响到类胡萝卜素的转化,或者直接影响类胡萝卜素加双氧酶的活性,有些抑制剂也会降低类胡萝卜素的吸收。
我现在在用氯仿做支持电解质进行循环伏安测定,实验需要除氧,通氮气时氯仿挥发的非常厉害。老板说有什么抑制剂可以阻碍氯仿挥发。有没有大侠知道的?
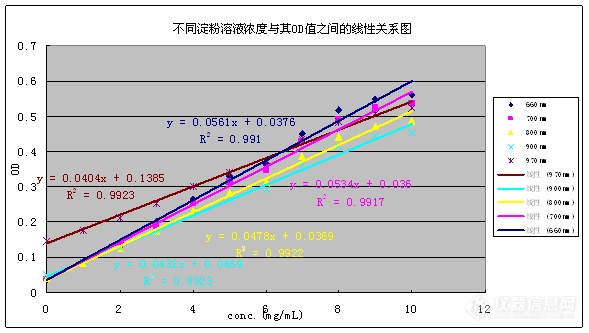
[align=center][b]使用酶标仪测定α-淀粉酶抑制率方法的研究[/b][/align][align=left][b]1.实验原理[/b][/align][align=left] 淀粉的消化主要有α-淀粉酶与α-葡萄糖苷酶的参与,α-淀粉酶水解α-1,4-连接键,消化的产物主要有麦芽糖、麦芽三糖、α-糊精,这些物质的进一步消化要在小肠上靠α-葡萄糖苷酶进行,α-葡萄糖苷酶主要包含麦芽-葡糖淀粉酶与蔗糖-异麦芽糖酶,α-葡萄糖苷酶水解的产物是葡萄糖。因此,通过抑制淀粉酶或葡萄糖苷酶的活性,阻碍食物中碳水化合物的水解与消化,减少糖分的吸收,以达到控制体内血糖浓度水平。[/align][align=left] 本实验是针对淀粉酶水解淀粉溶液而导致溶液中浑浊度的变化,测定溶液吸光度值的变化,以抑制剂阿卡波糖作为参照标准,抑制淀粉酶的能力以阿卡波糖当量来表达。[/align][align=left][b]2.实验方法与数据处理[/b] 将空白、样品或标准抑制剂Acarbose(阿卡波糖)与α-淀粉酶溶液混合均匀,37℃保温孵育15min,然后再加入淀粉溶液,快速振荡后在660nm迅速开始测定,利用酶标仪配备软件记录吸光度OD,初始吸光度值记为f1,以后每隔一段时间测定一个点,吸光度分别记为f1, f2 …,抑制剂作用下衰减曲线下的积分面积,扣除无抑制剂的空白曲线下面积,得出抑制剂的曲线下净面积(Net AUC)。衰退曲线下面积AUC可以近似看作各梯形面积之和,可以表达为:AUC=0.5×(f[sub]1[/sub]+f[sub]2[/sub])×ΔT+0.5×(f[sub]2[/sub]+f[sub]3[/sub])×ΔT+...+0.5×(f[sub]x[/sub]+f[sub]x+1[/sub])×ΔT+...+0.5×(f[sub]n-1[/sub] +f[sub]n[/sub])×ΔT=0.5×[2×(f[sub]1[/sub] +f[sub]2[/sub] +...+ f[sub]n-1[/sub] +f[sub]n[/sub])-f[sub]1[/sub] -f[sub]n[/sub]]×ΔT其中f[sub]n[/sub]代表第n个测定点时的吸光度,ΔT为相邻两个测定点之间的时间间隔,因本实验测定方法中ΔT设定为2min,一共有61测定点,因此该公式可以简化为:AUC=2×(f[sub]2[/sub]+f[sub]3[/sub]+...+f[sub]60[/sub])+ f[sub]1[/sub] + f[sub]61[/sub]以Acarbose当量μmol Acarbose equivalent/g (μmol AE/g)表达。[/align][align=left][b]3.试剂溶液的制备3.1 磷酸盐缓冲溶液3.1.1 CaCl[sub]2[/sub]溶液[/b]准确称取CaCl[sub]2[/sub]2H[sub]2[/sub]O粉末0.25g溶于100 mL ddH[sub]2[/sub]O,即为CaCl[sub]2[/sub]溶液2500mg/L。[b]3.1.2缓冲溶液工作液[/b]分别称取8.9g Na[sub]2[/sub]HPO[sub]4[/sub]2H[sub]2[/sub]O与6.9g NaH[sub]2[/sub]PO[sub]4[/sub]H[sub]2[/sub]O于1000 mL容量瓶中,再量取CaCl[sub]2[/sub]溶液20 mL,混合后用ddH[sub]2[/sub]O定容至1000 mL,这样得到0.1M,pH 6.9的缓冲溶液,冰箱下贮存。[b]3.2 玉米淀粉溶液[/b]玉米淀粉储备液:准确称取约1.0000g大米淀粉,加入50mL缓冲液,磁力搅拌数分钟后置于78℃左右水浴10分钟,于磁力搅拌器中搅拌自然冷却至室温,即为2%的淀粉溶液(20mg/mL);玉米淀粉工作液:将储备液用缓冲溶液依次分别稀释至1.0-10mg/mL的工作液。[b]3.3 α-淀粉酶溶液[/b]准确称取α-淀粉酶固体粉末(23U/mg)40mg,用缓冲溶液定容至10 mL,即为4mg /mL的α-淀粉酶储备液,再依次稀释至0.2、0.1、0.05、0.04、0.025 mg /mL的α-淀粉酶工作液。[b]3.4 Acarbose标准溶液的配制[/b]0.1g acarbose定容到100 mL磷酸缓冲液中,得到1mg /mL贮备液,然后用磷酸缓冲溶液依次稀释成的工作液0.01、0.02、0.03、0.04、0.05 mg /mL。[b]4.研究步骤[/b][/align][align=left][b]4.1 淀粉溶液的线性范围[/b] 由于本实验是对样品中浑浊度的变化来进行,而对浑浊度的测量不像紫外-可见分光光度计那样有理想的波长以及会出现明显的特征峰,根据文献大多数浑浊度的测量波长在620-700nm之间。为了确定玉米淀粉溶液的线性,我们选择玉米淀粉溶液的浓度在0-10mg/mL,波长选择660、700、800、900、970nm进行比较。使用玉米淀粉工作液0-10mg/mL,分别在660nm、700nm、800nm、900nm、970nm波长下测定其吸光度,重复测定3次。不同波长下淀粉溶液浓度与其OD值之间的线性关系图如下:[/align][align=left][img=,589,333]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171420555396_7331_1613776_3.png!w589x333.jpg[/img][/align][align=left][table][tr][td][align=center]波长/nm[/align][/td][td][align=center]线性相关系数R[sup]2[/sup][/align][/td][td][align=center]线性斜率[/align][/td][td][align=center]空白OD值[/align][/td][td][align=center]LOD检测限[/align][/td][td][align=center]LOQ定量限[/align][/td][/tr][tr][td][align=center]660[/align][/td][td][align=center]0.9910[/align][/td][td][align=center]0.0561[/align][/td][td][align=center]0.038±0.001[/align][/td][td][align=center]0.048[/align][/td][td][align=center]0.159[/align][/td][/tr][tr][td][align=center]700[/align][/td][td][align=center]0.9917[/align][/td][td][align=center]0.0534[/align][/td][td][align=center]0.038±0.001[/align][/td][td][align=center]0.052[/align][/td][td][align=center]0.174[/align][/td][/tr][tr][td][align=center]800[/align][/td][td][align=center]0.9922[/align][/td][td][align=center]0.0478[/align][/td][td][align=center]0.041±0.002[/align][/td][td][align=center]0.093[/align][/td][td][align=center]0.310[/align][/td][/tr][tr][td][align=center]900[/align][/td][td][align=center]0.9923[/align][/td][td][align=center]0.0432[/align][/td][td][align=center]0.051±0.002[/align][/td][td][align=center]0.108[/align][/td][td][align=center]0.361[/align][/td][/tr][tr][td][align=center]970[/align][/td][td][align=center]0.9923[/align][/td][td][align=center]0.0404[/align][/td][td][align=center]0.145±0.002[/align][/td][td][align=center]0.138[/align][/td][td][align=center]0.458[/align][/td][/tr][/table]从上图及上表中可以知道,玉米淀粉浓度在0-10mg/mL时的线性关系均较好,相关系数均在0.99以上。虽然线性相关系数较低,但在波长660nm下的线性斜率高于其他波长下的线性斜率,且LOD检测限与LOQ定量限均是最小,因此选择波长660nm作为测定波长。[/align][align=left][b]4.2 淀粉酶的活力[/b] 将20μL的缓冲溶液与20μL的不同浓度α-淀粉酶溶液混合均匀,37℃保温孵育15min,然后再加入60μL的2%淀粉溶液,快速振荡后在660nm迅速开始测定其吸光度值。以不同浓度的淀粉酶浓度0.4、0.2、0.1、0.05、0.04、0.025 mg /mL,底物选择20mg/mL的淀粉溶液进行试验,在660nm下测定其吸光度值的变化曲线。660nm下其吸光度值的衰退曲线图:[/align][align=left][img=,672,359]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171423163167_2471_1613776_3.png!w672x359.jpg[/img][/align][align=left]从上图,在660nm波长下,不同淀粉酶浓度使淀粉溶液的吸光度下降,而且淀粉酶浓度越大,吸光度下降的越快。AUC与淀粉酶浓度成负相关关系,随着酶浓度的增大,曲线下面积AUC逐渐减小。[/align][align=left][b]4.3 抑制剂阿卡波糖活力[/b] 采用不同浓度的阿卡波糖浓度0.01、0.02、0.03、0.04、0.05 mg /mL分别进行试验(n=3),淀粉溶液的浓度选择20mg/mL,淀粉酶浓度选择0.2mg /mL。通过试验,各个不同浓度的阿卡波糖抑制曲线图如下:[/align][align=left][img=,687,390]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171426550249_8100_1613776_3.png!w687x390.jpg[/img][img=,668,320]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171426580379_7253_1613776_3.png!w668x320.jpg[/img][/align][align=left]从上图看出,阿卡波糖浓度 在0.01-0.05 mg /mL之间与其曲线下净面积Net AUC的线性较好,相关系数R[sup]2[/sup]=0.9972。[/align][align=left][b]4.4 线性研究[/b] 以不同浓度的阿卡波糖0.01、0.02、0.03、0.04、0.05、0.06、0.07mg /mL分别进行试验,淀粉溶液的浓度选择20mg/mL,淀粉酶浓度选择0.2mg /mL。通过试验,各个不同浓度的阿卡波糖抑制曲线图如下:[/align][align=left][img=,690,359]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171427557847_1976_1613776_3.png!w690x359.jpg[/img][/align][align=left]不同浓度的阿卡波糖与其曲线下净面积Net AUC的线性关系图如下(重复试验7次):[/align][align=left][img=,690,359]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171427580179_2403_1613776_3.png!w690x359.jpg[/img][/align][align=left][table][tr][td][align=center]n[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][td][align=center]7[/align][/td][td][align=center]av[/align][/td][td][align=center]SD[/align][/td][td][align=center]%RSD[/align][/td][/tr][tr][td][align=center]R[sup]2[/sup][/align][/td][td][align=center]0.9909[/align][/td][td][align=center]0.9806[/align][/td][td][align=center]0.9788[/align][/td][td][align=center]0.9942[/align][/td][td][align=center]0.9934[/align][/td][td][align=center]0.991[/align][/td][td][align=center]0.9932[/align][/td][td][align=center]0.9889[/align][/td][td][align=center]0.0064[/align][/td][td][align=center]0.6477[/align][/td][/tr][tr][td][align=center]SLOPE[/align][/td][td][align=center]4433.9[/align][/td][td][align=center]4850.1[/align][/td][td][align=center]4500[/align][/td][td][align=center]4219.3[/align][/td][td][align=center]5675.1[/align][/td][td][align=center]4468[/align][/td][td][align=center]5110.9[/align][/td][td][align=center]4751[/align][/td][td][align=center]503.27[/align][/td][td][align=center]10.593[/align][/td][/tr][/table]从上表看出,不同浓度的阿卡波糖与其曲线下净面积Net AUC之间的线性相关系数R[sup]2[/sup]在0.9889±0.0064之间,相对标准偏差0.65%;斜率在4751±503.3之间,相对标准偏差10.6%。[/align][align=left][b]4.5 提取溶剂的影响[/b]对提取溶剂(丙酮:乙醇:水的混合溶剂)进行研究,即以提取溶剂代替缓冲溶液进行试验,并与缓冲溶液进行比较。[/align][align=left][img=,609,340]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171437196510_7149_1613776_3.png!w609x340.jpg[/img][/align][align=left]其中:BLK——20μL缓冲溶液+20μL淀粉酶+60μL淀粉;BLK1——20μL提取溶剂+20μL淀粉酶+60μL淀粉;Emp——40μL缓冲溶液+60μL淀粉;Emp1——40μL提取溶剂+60μL淀粉。[/align][align=left]通过对提取溶剂稀释10、100、1000、10000倍后再进行同样试验(如下图):[/align][align=left][img=,657,362]https://ng1.17img.cn/bbsfiles/images/2018/10/201810171438035079_1244_1613776_3.png!w657x362.jpg[/img][/align][align=left]从图上看出,通过对提取溶剂稀释10、100、1000、10000倍后试验,基本对测定无影响。[/align][align=left][b][b]4.6 样品检测[/b][/b][/align][align=left][b] 将[/b]样品提取液代替阿卡波糖加入到淀粉酶溶液中,37℃保温孵育15min,然后再加入淀粉溶液,快速振荡后在660nm迅速开始测定。通过计算得出样品中的AE(阿卡波糖当量)。也可以通过比较抑制率IC50,来判断样品中的淀粉酶抑制率强弱。[/align][align=left][b]5.小结[/b] 通过以上对α-淀粉酶抑制率试验方法进行研究,实验表明,该方法适用于样品中α-淀粉酶抑制率的筛选。[/align][align=left]注意事项:[/align][align=left]1. 标准溶液或者样品与淀粉酶溶液混合后需在37℃保温孵育15min,再加入淀粉溶液;[/align][align=left]2. 加入淀粉溶液让后需要快速振荡后在660nm迅速开始测定;[/align][align=left][b]6.参考文献[/b]1. LEE WAH KOH, LIN LING WONG, YING YAN LOO, STEFAN KASAPIS, AND DEJIAN HUANG. J. Agric. Food Chem. 2010, 58, 148-1542. ALVIN ENG KIAT LOO AND DEJIAN HUANG. J. Agric. Food Chem. 2007, 55, 9805-98103. Elena Lo Piparo, Holger Scheib,Nathalie Frei, Gary Williamson, Martin Grigorov, and Chieh Jason Chou. J. Med. Chem. 2008, 51, 3555-35614. TOSHIRO MATSUI, TAKASHI TANAKA, SATOMI TAMURA, ASAMI TOSHIMA,KEI TAMAYA,YUJI MIYATA,KAZUNARI TANAKA, AND KIYOSHI MATSUMOTO. J. Agric. Food Chem. 2007, 55, 99-105[/align]
想买一点酶制剂,但是看了1688上的厂商的酶活力的数字,不知哪个是虚标的。因为最近格力的董总揭漏了某克斯空调就是虚标,于是猜想酶制剂行业是否也有虚标?还有,作为消费者如何判断酶制剂的质量好坏?本人没有太多的专业知识。是不是外国的酶制剂比较质量可靠些?但是好像比国产贵很多。谢谢。