反相液相色谱和HILIC对奶制品中三聚氰胺的检测.pdf
DIDP 用反向高效液相色谱检测波长是多少? 请速回,谢谢
我有一台液相色谱,岛津的,碳十八,键合硅胶相的反相柱,紫外检测器,单泵.做一种物质时很难确定检测条件,应从哪几个方面着手工作?另外,我买了一本的.粗略看了看,其中例子不少,但选择条件的指导性不多,是否有更好的书?请指导:
[b]反相高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法检测黄酒中嘌呤类物质[/b]https://er.szlib.org.cn/rwt/331/https/NNYHGLUDN3WXTLUPMW4A/kcms/detail/detail.aspx?dbcode=SNAD&dbname=SNAD&filename=SNAD000001919681&uniplatform=NZKPT&v=TjRX_0fSS4t4lpfUkbvVyagcQNIchfIYmSqndMLuZU1-v47-xRmQImyTkDQDPhcMNP5q-vDzq3Y%3d[font=&]成果完成人:[/font]刘镇 诸葛庆 张瑛 曾金红 胡建刚 孟燕青 章姗姗 俞超华 夏炜芳 王灵芝

最近有人问我液相添加三氟乙酸是为什么或者别的方法中添加甲酸是为什么,这个问题解释起来当然比较理论,一句话回答就是改善峰形或增强保留。反相C18柱能解决液相色谱80%的分离,但是大部分化合物都需要加入一些改性剂来改善分离,可以参考公众号以前发的文章中有提到极性化合物在反相色谱中的分析方法。这些改性剂起的作用主要是增强保留、消除次级保留效应、提高质谱中离子化效率等。增强保留化学中“相似相溶”几乎是通用的准则,极性化合物在反相柱保留很差,没有保留谈何分离呢,极性化合物在水相溶剂中是质子化的,加入弱酸或弱碱可以抑制解离,这样就增强保留了,对于酸性化合物,如果流动相的pka值低于分析物的pka值,是可以有效抑制解离的。下表是常见的一些用于液相的酸、碱及其缓冲盐。液相色谱推荐使用的缓冲盐添加物/缓冲盐pka缓冲范围挥发性备注三氟乙酸0.3 有离子对添加物,会引起质谱信号的离子抑制,在0.02%~0.1%的范围内使用乙酸4.76 有在0.1%~1.0%范围使用甲酸3.75 有在0.1%~1.0%范围使用乙酸/乙酸铵4.763.76~5.76有1~50mM范围使用甲酸/甲酸铵3.752.75~4.75有1~50mM范围使用磷酸盐2.151.15~3.15无 磷酸盐7.26.20~8.20无PH7以上,最好降低温度和浓度且使用保护柱氨水9.28.20~10.2有浓度保持在10mM以下,温度保持在30℃以下碳酸氢铵10.3(HCO3-)6.8~11.3有5-10mM范围,用于质谱时,源温度要大于150℃,用氢氧化铵或醋酸调节PH,在PH10有很好的缓冲能力9.2(NH4+)6.3(H2CO3) 减少或消除次级保留效应硅胶键合柱中会有部分残留硅羟基,这些硅羟基对某些化合物产生次级保留效应,次级保留效应会引起峰拖尾。次级保留效应主要有两种,一种是是由质子化的样品分子和质子化了的硅羟基发生离子交换产生,另一种是反相填料被金属如铜、铁污染,能与金属离子螯合的化合物也会产生次级保留效应。关于次级保留效应,推荐感兴趣的可以找到“色谱仪器维护与故障排除”这本书来看,解决好次级保留效应可以解决很多拖尾峰的问题。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191715_01_1610895_3.jpg尤第一种对弱碱性化合物影响比较大,这时需要加入一些改性剂来消除次级保留效应,消除原理和之前提到抑制化合物质子化是一样,一般是碱性化合物加入1~20mM胺类(三乙胺),酸性化合物加入1%乙酸来作为改性剂;对于金属的影响,需要用金属螯合剂来冲洗色谱柱来消除干扰。此外,现在有很多全封端的色谱柱,对于这类化合物可以选用全封端的色谱柱来避免残留硅羟基的影响。增强检测器响应检测器是整个分析过程中的眼睛,前面分离再好,眼睛看不到也是白瞎的,而使用质谱作为检测器的时候,在质谱中有没有响应是很关键的问题,在定量过程中质谱响应高意味着检测灵敏度就高。质谱检测的第一步是使目标物离子化,极性弱的化合物在质谱中的响应很多都不高,甚至有的都没响应,一般有经验的分析员都会说加点酸试试吧。加入一些弱酸、弱碱或者甲酸铵、乙酸铵等,会使目标化合物响应提高,这里需要注意三氟乙酸加入量不宜超过1%,超过会大大抑制电离,尤其是在负离子模式下。其它需要注意的问题使用改性剂需要注意加入量,普通硅胶柱能耐受的PH值是2~8,PH8.5,会引起基体硅胶的溶解。在碱性条件下,色谱柱柱效下降是非常明显的(小编在这方面是有过沉痛的教训的)。需要考虑对检测器的影响,如不挥发的盐和酸不适合用在液相-质谱联用系统上;紫外检测器时,需要考虑改性剂的截止波长,截止波长最好低于选用的检测波长。
安捷伦高效液相,用异丙醇;水=1:1冲反相色谱柱,并过检测限。现在甲醇水梯度洗脱,基线不直是为什么?
孔雀石绿(MG)和结晶紫(CV)具有高毒素、高残留和致癌、致畸、致突变等特点,当其进入生物体内,就会产生具有更强危害的隐性孔雀石绿(LMG)和隐性结晶紫(LCV)。鉴于孔雀石绿和结晶紫的危害性,包括我国在内的许多国家都将它们列为水产养殖中的禁用药物。是进出口水产品必检项目之一。 《GB/T 19857-2005 水产品中孔雀石绿和结晶紫残留量的测定》和《SN/T 1479-2004 进出口水产品中孔雀石绿残留量检验方法》中均采用有机溶剂提取后经固相萃取柱净化,然后采用高效液相色谱法或液相色谱-串联质谱法测定。 迪马科技在参考上述两个标准的基础上开发出中性氧化铝和阳离子交换固相萃取柱串联净化后,反相高效液相色谱柱检测。该方法准确可靠,重复性好,回收率高,可作为水产品中孔雀石绿和结晶紫及代谢物的检测方法。水产品中孔雀石绿和结晶紫及其代谢物的检测 (参考《SN/T 1479-2004进出口水产品中孔雀石绿残留量检验方法》和 《GB/T 19857-2005 水产品中孔雀石绿和结晶紫残留量的测定》)1 适用范围 本方法适用于水产品中孔雀石绿和结晶紫及其代谢物的检测。2 样品准备 / 提取 1、称取已粉碎(已均质)的样品1 g于15 mL离心管中,加入1 mL 0.05 mol/L苯磺酸溶液、1 mL0.25 g/mL盐酸羟铵溶液、0.4 mL0.1 mol/L乙酸铵溶液(pH4.5)和8 mL乙腈,涡旋混合2 min,4000 rpm离心1 min;2、将上清液转移至50 mL离心管中,残渣按照步骤1重复提取一次;3、合并两次提取液,并加入6 mL三氯甲烷和7 mL水,涡旋混合1 min,4000 rpm离心1 min;4、取下层清液于旋蒸瓶中,向上层清液加入6 mL三氯甲烷,重复提取一次;5、合并两次下层三氯甲烷溶液,40℃减压蒸至近干,加入5 mL乙腈待净化。3 SPE 柱净化—— ProElut Al-N ( 1 g /6 mL )( Cat.# : 65306 )上层ProElut SCX ( 500 mg/3 mL )( Cat.# : 63604 )下层(1)活 化:加入10 mL乙腈,流出液弃去;(2)上 样:将待净化液加入小柱,流出液弃去;(3)淋 洗:加入5 mL乙腈淋洗小柱,流出液弃去,并去掉上层Al-N小柱;(4)洗 脱:加入5 mL5%氨水乙腈,收集洗脱液;(5)重新溶解:将洗脱液在40 ℃下减压蒸干,1 mL定容液*溶解残渣,过微孔滤膜供HPLC分析。*定容液:乙酸铵缓冲液:盐酸羟铵溶液=2:1乙酸铵缓冲液:乙腈:0.05 mol/L乙酸铵溶液(pH4.5)=75:25;盐酸羟铵溶液:取1 mL0.25 g/mL盐酸羟铵溶液用水定容至100mL。4 分析条件 色谱柱:Platisil ODS , 250 x 4.6 mm , 5 μm ( Cat.# 99503 ) 流 速:1.0 mL/min 检测器:UV 591 nm和UV 266 nm柱 温:30 ℃进样量:20 μL 流动相:A:乙腈 B:0.05 mol/L乙酸铵溶液(pH4.5)梯度:时间/ min05.511.011.0120B%28882828
检测空气中的氮丙啶标准中的条件是这样的:原理:氮丙啶与1,2-萘醌-4-磺酸钠反应生成4-(1-氮丙啶基)-1,2-萘醌,经氯仿提取后,用Lichrosorb Diol 柱分离,紫外检测器检测。色谱柱:Lichrosorb Diol 柱 长250,内径4.6流动相:正己烷:氯仿:异丙醇=59.5:40:0.5流速:1.3ml/min本实验室条件:A1100二元高压泵配紫外检测器,色谱柱只有一只:zorbax C18 150*4.6*5,氮丙啶中提到的标准品,色谱纯试剂均无。问题:1.如不购买Lichrosorb Diol 柱,用zorbax C18 ,是否可行?(衍生物能否在zorbax C18 保留,分离) 2.反相转正相需要注意些什么问题? 没做过正相,公司不想买柱子,如不行,此项目就放弃了,还望各位高人赐教。
活化酯液相分析我的样品极性较强,不溶于水、甲醇,溶于乙腈,该用什么色谱柱检测,正相还是反相
这里大家都在讨论三聚氰胺的检测问题。我也来发表一些拙见。大家都知道,单纯反相色谱上三聚氰胺大多在死时间流出,给分离带来一定的困难。对于极性小分子在液相色谱上检测往往采用反相离子对色谱或者离子交换,这些都不适合于液相色谱质谱的esi源,会严重影响负离子的离子化效率。如果大家有很多台[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]的话,可以一个专门做正离子,然后就可以用加卤代酸的方法形成离子对色谱然后就可以改善三聚氰胺的保留行为。如果只有一台的话,最好采用hilic色谱的方法。HILIC色谱,简单来说就是正相色谱上采用含水的流动相,一般含水量在5~40%就可以实现hilic色谱。这种方法不需要添加离子对试剂,而且三聚氰胺的k'在5.5左右(很好的保留),而且可以同时检测三聚氰酸和三聚氰胺(一个用正离子,一个用负离子),三聚氰胺的检出限在100ppt左右。
大家好! 我以前都是用的反相色谱柱,配对的是紫外分光光度计,现在开始要用正相色谱柱拉,可是用紫外分光光度计时,溶剂对它有干扰作用,请问大家谁知道应该用什么样的检测器,或者不换检测器就能消除干扰啊!你们有用正相色谱柱的踊跃发言啊![em26] [em26][em27] [em40]
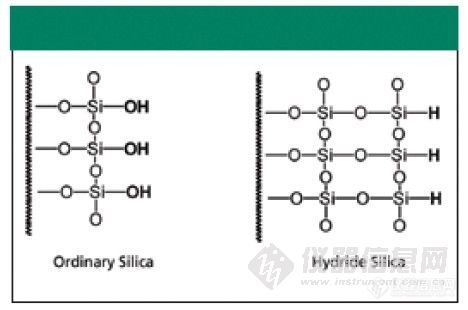
好不容易翻译过来的,如果有错,请大家原谅。两种分离模式的比较:亲水相互作用色谱HILIC 与反反相色谱ANPJoseph Pesek,Maria T. MatyskaDepartment of Chemistry, San Jose State University, San Jose, CaliforniaPlease direct correspondence to Joseph Pesek at pesek@sjsu.eduhttp://ng1.17img.cn/bbsfiles/images/2011/04/201104121803_288425_1604317_3.jpg在文献(1)及其他很多文献中,经常可以看到两种相似的色谱分离机理的色谱柱,一种是亲水相互作用色谱(hyd rophilic interaction liquid chromatography,HILIC),另外一种是水相正相色谱(aqueous normal phase,ANP,也称反反相色谱)。但是,事实上这两种色谱柱在保留模式上是不一样的。 本文旨在对HILIC 和ANP 色谱机理做一个准确的定义并对何时使用哪种色谱柱做一个明确的指导。实验部分实验所使用的色谱柱为UDC Cholesterol(75mm×4.6mm)及Bidentate C18(BD C18,150mm×4.6 mm 或20 mm×2.0 mm)来自于MicroSolv Technology (Eatontown,New Jersey)。流动相中的乙腈来自于B&J(Muskegon,Michigan),水使用来自Milli-Q 仪器(Millipore,Bedford,Massachusetts)。甲酸购自Spectrum Chemical(Gardena,California)。HPLC为安捷伦1050 型,配有自动进样器和二极管阵列检测器(Wilmington,Delaware)。样品浓度范围为0.1-1mg/mL,进样量为1-5μL。反反相实验中的流动相含有0.1%甲酸。结果与讨论HILIC: 亲水色谱是专为保留和分离极性-离子型化合物所设计的一类色谱柱。 在反相色谱中极性-离子型化合物是在死体积附近被洗脱的,即不在反相柱上保留,所以对此类物质的分析是很困难的。在反相色谱上开发方法时,很重要的需求就是物质要在固定相上有保留,并且防止/减少硅胶表面硅羟基对化合物的吸附。为了使极性-离子型化合物能在反相柱上保留,我们经常会对化合物进行衍生(2)或使用离子对试剂(3)。在前一种方法中需要将极性-离子型化合物化学衍生为疏水性物质,而在后一种方法中则在流动相中加入带相反电荷的物质,使极性-离子型化合物变为中性物质。这两种技术不但比较繁琐和费时,特别是离子对技术会导致反相色谱不能与质谱(MS)及光散射检测联用,对实验造成很大限制。最近发展出来的硅胶制造技术可以使得固定相更适合极性化合物的保留(1)。硅羟基能在一定流动相条件下对极性化合物产生保留。另外一种方法就是对硅胶表面进行化学修饰,如图1 所示。http://ng1.17img.cn/bbsfiles/images/2011/04/201104121805_288426_1604317_3.jpg如果R 基团具有极性,如氰基(-CN),氨基(-NH2) 或二醇(-CH(OH)-CH2-OH),这样固定相就具有保留亲水化合物的能力。使用前一种典型的HILIC 柱对极性化合物的保留性质如图2a 所示。 在低有机相比例(高水相比例)时,亲水性化合物没有保留,因为亲水化合物更倾向于留在流动相中。当流动相的非极性最够强时(足够的有机相比例),极性化合物才会有保留。但是,典型的疏水化合物在HILIC 柱子上却没有保留。因此HILIC 柱可以分析一些极性化合物的混合样,但是当样品中既有极性化合物,又有非极性化合物时,极性化合物就会因没有保留而分不开。http://ng1.17img.cn/bbsfiles/images/2011/04/201104121806_288427_1604317_3.jpg一个用HILIC 柱子分离极性化合物的例子如图2c 所示(4)。显然这两种极性化合物在普通C18 柱上是没有保留的(Figure 2b)。如果分析对象只有极性化合物HILIC 柱子是很合适的选择,就像我们在图2b 和2c 中看到的一样。http://ng1.17img.cn/bbsfiles/images/2011/04/201104121807_288428_1604317_3.jpgANP,反反相: 尽管HILIC 柱通常能解决极性-离子型化合物的保留问题,但是却不能满足样品中同时有亲水和疏水物质存在的分析要求。事实上,反相柱也一样不能解决亲水、疏水同时存在的情况。但是,反反相(ANP)的柱子就可以解决亲水、疏水物质同时分离的难题,使色谱工作者不至于在反相与HILIC 柱之间做二选一的选择。“水相正相色谱,反反相”反映了这种柱子具有两种分离机制,这个名字说明反反相(ANP)具有流动相中含水的性质(反相分离机理),同时也具有正相色谱的保留机理(在流动相极性更弱情况下保留增加)。HILIC 柱只提供类似于正相的效果,单没有反相色谱的功能。事实上,ANP 的保留机理与反相与HILIC 有很大差异,接下来的章节就ANP 的分离效果进行论述。ANP 1: 图3a 展示了两种物质在ANP 柱上的保留图(一个在反相上有保留,一个在正相上有保留)。在此例中,两种保留机理显示的很清楚,并且区域是两种化合物都有保留的。在这种情况下,只要改变流动相就可以在反相色谱与正相色谱间进行转换。流动相中水的比例高,疏水物质被保留,而亲水物质不保留;流动相中有机溶剂比例高,亲水物质被保留,而疏水物质不保留。http://ng1.17img.cn/bbsfiles/images/2011/04/201104121808_288429_1604317_3.jpg图3b 显示了3 种化合物在高水相比例中的分离(反相机理)。在这个例子里,ANP 柱的分离行为就如同一根普通的反相柱。ANP 2: 图4a 显示了ANP 柱从两种物质得到的保留图的另外一种性质,在这种情况下,流动相的组成使得两类化合物都有很强的保留能力,这样极性和非极性化合物就可以同时在ANP 柱上实现分离。另外一种操作就是我们可以在分析亲水和疏水化合物时使用梯度洗脱的方法。与HILIC 柱相比(只有极性化合物在高有机相情况下保留)或者ANP1 情况(化合物的保留取决于有机相比例)ANP2 则提供了独特的分离能力,这种分离能力在商品化柱子中是很少见的。图4b 显示了在ANP2 洗脱模式下分离混合物的例子,两个化合物,一个是极性的(甲福明二甲双胍,Metformin),另外一个是非极性的(格列本脲,Glyburide)在Si-H 基础上的C18柱上的分离。在上图中流动相为50:50(乙腈:水),反相机理起主要作用,格列本脲的保留比极性化合物甲福明二甲双胍更强。中间的图是流动相比例为80:20(乙腈:水),正相机理强于反正机理,甲福明二甲双胍在格列本脲之后被洗脱(使用LCMS 确认)。当乙腈比例继续提高到85%,正相机理就会起主要作用,强极性的甲福明二甲双胍保留时间会比格列本脲长更多。http://ng1.17img.cn/bbsfiles/images/2011/04/201104121810_288430_1604317_3.jpgANP 3: 第三种分离模式如图5 所示,分析物为两性物质,这类物质多为大分子物质,而且同时含有一个/多个疏水及亲水基团,例如一些多肽或蛋白。在这种情况下,色谱工作者可以根据混合物中分析物的性质选择使用反相还是ANP 模式来进行分离。这一非同一般的能力为实验条件提供了很大的改变空间。图5b 提供的是一个化合物在不同流动相组成比例条件下按反相和正相机理进行保留的结果。这一系列色谱图的结果和图5a 中所预示的结果是一致的。与预期一致的是,当乙腈比例增加时,保留时间由一个最小值,这个最小值就是保留机理从反相变为ANP 的临近点。http://ng1.17img.cn/bbsfiles/images/2011/04/201104121811_288431_1604317_3.jpg具有ANP 保留性质的色谱柱: 最近,已经有使用Si-H 表面的固定相色谱柱开始使用(MicroSolv 公司的TYPE-C Silica 柱),这种色谱柱显示出具有我们之前所论述的ANP 性质和分离能力,如图3b,4b 和5b 所示,也同时被文献(5,6)所报道。TYPE-C Silica 色谱柱固定相表面的组成与普通色谱柱的差异如图6 所示(Si-H 键的覆盖率为95%)。目前,与HILIC 柱一样,反反相的机理还不是完全清楚。TYPE-C Silica 这种Si-H 型固定相还具有其他优异性质:可以不需要从流动相中完全去除水就可以进行正
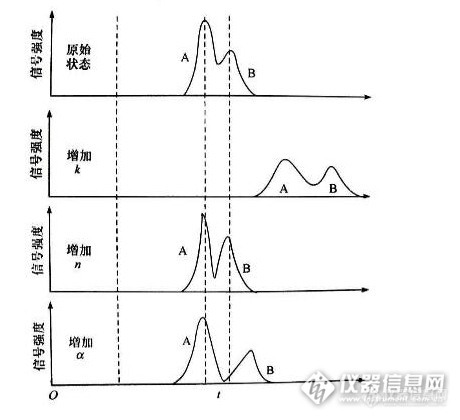
在试样反相高效液相色谱分析中,条件的优化与选择尤其重要,改变不同的仪器操作条件会得到不同的效果,下面是本人在液相色谱分析中得到的一点心得,分享一下,不妥之处请各位版友多多指教!1:试样品分析对反相色谱柱的选择 不同的反相色谱柱,在柱温 波长 流速以及流动相配比 相同的条件下:分离度不同----表现为各组分的保留时间不同。灵敏度不同----表现为峰高和峰面积不同。(下图引用自“中国药科大学色谱分析课程”)http://ng1.17img.cn/bbsfiles/images/2014/12/201412190919_527878_2960432_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412190919_527879_2960432_3.png2:试样品反相色谱分析对波长的选择 同一个反相色谱柱,在柱温 流速 流动相配比相同而波长不同的条件下:分离度不同-----表现为波长越大,分离度越大;波长越小,分离度越小,基线噪音越大。灵敏度不同-----表现为波长越大,灵敏度越低;波长越小,灵敏度越高。试样的保留时间不随波长的改变发生变化。 说明:1:在反相液相色谱分析中,分离度大小与反相色谱柱的性能 柱温 流速 流动相的性质和配比有关系,与试样品的性质有关系。试样各组分在通过色谱柱而没有通过紫外检测器之前,保留时间以及分离度的大小就已经确定了,只是在通过紫外检测器时,由于紫外检测器波长发生了变化,紫外检测器的灵敏度(即单位浓度或单位质量的试样品通过紫外检测器检测到的信号强度)发生了变化,致使试样品各组分的峰高 峰面积发生变化,在表现形式上表现为分离度不同 灵敏度不同。2:尽管波长发生了不同的变化,但是,各组分的保留时间没有发生变化。这充分说明了各组分被洗脱的强度只与自身的性质(极性的强弱)以及色谱柱的性质(反相色谱柱)和柱温 流速 流动相的配比(流动相的极性)有关系。3:同种物质在不同的波长下紫外吸收不同,最大紫外吸收的波长为这种物质的截止波长,在反相液相色谱分析中,波长的设置都是流动相没有紫外吸收的波长,流动相如果有紫外吸收就会造成基线噪音和基线漂移。4:规定的范围内,波长越大,灵敏度越低,可以理解为:由于波长的增大,被测物的紫外吸收减弱,当被测物通过紫外检测器时,紫外检测器检测到的被测物的信号强度减弱,表现为峰高变低,峰面积变小,灵敏度降低。http://ng1.17img.cn/bbsfiles/images/2014/12/201412140931_527108_2960432_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412140931_527109_2960432_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412140932_527110_2960432_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412140954_527112_2960432_3.png3:试样品反相液相色谱分析对流动相配比浓度的选择 同一个反相色谱柱,在柱温 波长 流速相同,而流动相配比浓度(极性大小)不同的条件下:分离度不同(极性较小的试样)-----表现为流动相浓度增大(流动相极性减小),分离度降低,试样(极性较小的试样)保留时间缩短;流动相浓度减小(流动相极性增大),分离度增大,试样(极性较小的试样)保留时间延长。灵敏度不同(极性较小的试样)-----表现为流动相浓度增大(流动相极性减小),灵敏度增大;流动相浓度减小(流动相的极性增大),灵敏度减小。 说明:在反相液相色谱分析中,流动相浓度的改变就会造成流动相极性的改变。流动相浓度降低,流动相的极性增强,在反相色谱柱中的洗脱能力减弱------极性较大的试样先被洗脱,出峰时间早,保留时间变小;极性较小的试样后被洗脱,出峰时间晚,保留时间变大。流动相浓度增大,流动相的极性减小,在反相色谱柱中的洗脱能力增强-----极性大的试样后被洗脱,出峰时间晚,保留时间变大;极性较小的试样先被洗脱,出峰时间早,保留时间变小。http://ng1.17img.cn/bbsfiles/images/2014/12/201412140931_527108_2960432_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412141009_527114_2960432_3.png4:试样品反相液相色谱分析对流速的选择 同一个反相色谱柱,在柱温 波长 流动相配比相同而流速不同的条件下:分离度不同(极性较小的试样)-----表现为流速增加,分离度减小,试样保留时间减小;流速减小,分离度增加,试样保留时间增大。灵敏度不同(不明显)-------表现为流速增大,灵敏度减小;流速减小,灵敏度增大。http://ng1.17img.cn/bbsfiles/images/2014/12/201412141028_527118_2960432_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412141028_527120_2960432_3.png

【作者】 郄冰冰; 郭瑞锋; 何建峰;【机构】 河北省药品检验所; 河北省邯郸市中医院 河北石家庄050011; 河北石家庄050011; 河北邯郸056001;【摘要】 目的鉴别中药保健品中掺入的激素类成分。方法色谱柱为Diamonsil C18柱(200mm×4.6mm,5μm),流动相为乙腈-水,梯度洗脱,流速1.0mL/min,检测波长240nm,柱温为室温,进样量10μL。结果8种激素类成分分离效果良好,保留时间合理。结论反相高效液相色谱法可检测出中药保健品中掺入的8种激素类成分。 更多还原【关键词】 激素; 中药; 保健品; 反相高效液相色谱法; 检测; http://ng1.17img.cn/bbsfiles/images/2012/08/201208271630_386502_2352694_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208271631_386504_2352694_3.jpg
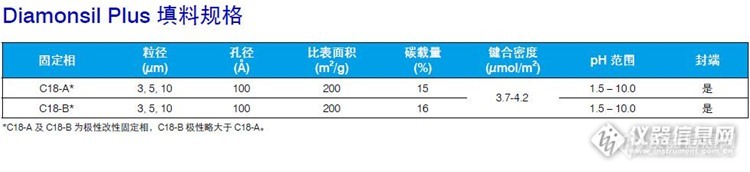
常规C18 色谱柱在高水相条件下长时间操作,经常会出现“柱塌陷” 现象,造成分析物的保留时间和分离度骤降。极性改性反相色谱柱由于采用独特的极性改性技术,通过引入极性基团使其表面更容易被水润湿,从而有效地避免了该现象的发生。此外,极性改性反相液相色谱柱在高有机相下表现同样出色,能在LC-MS 测试中加快去溶剂化的过程,从而有效提高LC-MS 的检测灵敏度。极性改性反相液相色谱柱的流动相适用范围可以从100% 水相到100% 有机相,使方法开发更加简单易行。极性改性反相色谱柱是以高纯硅胶为基质,采用独特的极性改性技术生产的色谱柱。这个系列的色谱柱不但保留了传统硅胶基质反相色谱柱的性能,而且又增加了一些新的特性:• 填料表面具有极性基团,适合于高水相条件下的分离• 增强了对亲水性、极性化合物的保留能力• 独特的选择性和优异的分离度• 降低了碱性化合物与残余硅羟基的相互作用,提高了色谱峰的对称性• pH 范围更宽,适合于分析酸、碱化合物迪马科技极性改性反相液相色谱柱有两个系列:一个是Spursil(思博尔)系列,包括Spursil C18 和Spursil C18-EP,二者的结构差异如下http://ng1.17img.cn/bbsfiles/images/2015/06/201506021619_548446_1610895_3.jpg一个是Diamonsil Plus 系列,包括Diamonsil Plus C18-A 及 Diamonsil Plus C18-B,Diamonsil Plus C18-B的极性略大约Diamonsil Plus C18-Ahttp://ng1.17img.cn/bbsfiles/images/2015/06/201506021624_548450_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/06/201506021624_548451_1610895_3.jpg
[color=#444444]请问各位有没有用液相色谱检测过像丁二酸,戊二酸这种二元有机酸的?用的是什么柱子和检测器呢?我在文献上也看到过几篇检测这种二元酸的文献,我使用的流动相,柱温检测器条件都和文献相同,只有柱子不一样,但是最后分离效果不好,会不会是我用的C18反相色谱柱就是不适合检测这种物质呢?现在设想的解决办法是流动相的水相使用低浓度磷酸溶液调节pH,如果这样也不行暂时就想不到其他办法了。真心希望各位牛人能给些指导和建议[/color]
在液相色谱仪使用过程中,我们经常遇到液相色谱仪用户正反相色谱系统互相现象,但由于使用操作不当,常常不注意间损坏了色谱柱,同时加重了液相色谱系统的污染,导致分析工作出现麻烦,现在将置换工作的基本流程列出,供用户参考:1. 首先用正己烷(硅胶柱)将色谱系统包括正相柱平衡好(保证20分钟内基线平直,无峰出现);2. 卸掉硅胶柱,封好保存;3. 将进样阀与检测器短路,用异丙醇冲洗色谱系统10分钟(流速1ml/min).在这期间空拨进样阀三次;4. 换甲醇(或已睛)冲洗系统20分钟(流速2ml/min) ,此期间空拨进样阀三次;5. 安上反相色谱柱, 流速调到1ml/min,用甲醇(或已睛)冲洗系统,直到系统平衡;6. 进三针标准品,检验面积 ﹑保留时间是否重复,若不重复,继续冲洗直到重复。
[color=#444444]我想用反相[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]测溶剂与溶质的相互作用参数。[/color][color=#444444]如果我的溶剂沸点大于250度,那么进样温度是不是要大于250度 但是我色谱柱种的溶质在250就热解了, 那还能用反相[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]吗??[/color]
反相高效液相色谱缓冲体系PH的选定反相高效液相色谱中缓冲体系PH值的选择在反相高效液相色谱分析中,选择正确的缓冲液PH值,对可离解的化合物分析的重现性十分重要,不恰当的PH值可能导致不对称峰,宽峰,分裂峰或肩峰,而尖锐的,对称的峰是定量分析中获得低的检测限以,两次分析之间较低的相对标准偏差(RSD)和保留时间的高重现性的前提。我们将讨论在使用缓冲液时如何选择缓冲液的PH值,以及如何选择正确的缓冲体系。什么时候需要缓冲溶液?在反相液相色谱分析中,流动相的PH值一般在2.5-7之间,当被分析物在反相条件下可离解,或样品的PH值在2.5-7之外时,就需要缓冲液。在反相条件下可离解的化合物一般都有氨基和羧基,他们的Pka在1-11之间,选择正确的缓冲液PH值可保证可离解的官能团以一种形式存在,离子形式或中性化合物的形式。如果样品的PH值对柱子有伤害,则缓冲溶液可使其变温和从而减小其危害。如何选择缓冲液PH值在选择缓冲液PH值之前,应先了解被分析物的Pka,高于或低于Pka两个PH值单位的,有助于获得好的、尖锐的峰,从HH公式:PH=Pka+log([A-]/[A])得知,溶液PH值高于或低于Pka两个单位,化合物中99%以一种形式存在,而一种形式存在的化合物才能获得好的尖锐的峰。如果选择不到合适的,样品的pKa与流动相的pH非常接近,那么流动相pH微小的变化,都会引起样品保留时间较大的变动。当化合物只有氨基时,缓冲体系的选择十分简单,大多数氨基化合物在PH值小于9时都被质子化,所以所有PH值在7或更低的溶液均适合应用,你也许会问水的PH值大约是7,为什么还用缓冲盐,因为缓冲盐有助于增加方法的可靠性,以及色谱峰的尖锐性,PH值的降低有助于氨基化合物保留的减弱,减小化合物与硅胶表面硅羟基的作用,而使峰更尖锐,从表1 可值,任何缓冲液均可应用于氨基化合物的分析,但我们认为PH值等于3的磷酸钾盐最适合用于氨基化合物的分析。在上面两个例子中,PH=3的磷酸钾盐都能获得良好的应用,在一般情况下,它是含羧基和氨基化合物分析中最好的缓冲液,并且我们认为在氨基化合物分析中钾盐比钠盐更好。为离子对试剂选择缓冲液为应用离子对试剂的方法选择缓冲液的过程是相似的,离子对试剂例如四丁基铵的盐,十四烷基磺酸钠等,在流动相中可与化合物中可离解的官能团配对,在缓冲液中以离子形式存在的化合物就需要应用离子对试剂。应用缓冲液PH值来调节方法选择性如前面提到的,氨基化合物的保留随PH的减小而降低,这个特性可以用来调节方法的选择性,如果两个化合物共流出,一个含有氨基,适当改变PH值就可以用来分离这一物质对。由于可离解化合物的选择性依靠PH值,所以变化PH值也可以用来鉴别未知化合物的官能团,如果PH值变小,出峰便快,则化合物中可能存在氨基,当PH变大,化合物出峰很快,或流出在死时间处,化合物可能是一种羧酸,因为羧基离子化后流出大大快于比质子化的中性化合物。总结正确选择缓冲溶液在反相液相色谱方法中对于优化尖峰,捡出限,以及获得稳定的保留时间十分重要,如果你知道化合物官能团信息和化合物的Pka值这一过程将十分简单。[em01] [em01]
[b][font=宋体]问题描述:[back=white]按照[/back][/font][back=white]HJ/T 72-2001[/back][font=宋体][back=white]方法对标准曲线溶液处理后上机后没有出峰,是什么原因?改用[/back][/font][back=white]C[sub]18[/sub][/back][font=宋体][back=white]色谱柱,流动相采用甲醇,甲醇做溶剂,标准曲线线性非常好。明显用反相色谱柱分离效果好,为什么标准选择了正相色谱分离,正相色谱的优势在哪里?[/back][/font][font=宋体]解答:[/font][/b][font=宋体][back=white]([/back][/font][back=white]1[/back][font=宋体][back=white])由于[/back][/font][back=white]HJ/T 72-2001[/back][font=宋体][back=white]《水质[/back][/font][font=宋体][back=white]邻苯二甲酸二甲(二丁、二辛)酯的测定[/back][/font][font=宋体][back=white]液相色谱法》中在配制标准物质工作溶液时,是将甲醇中的标液用正己烷进行萃取,在萃取的过程中可能导致标准物质损失,可以尝试不萃取进样,如果出峰,则基本可以断定是萃取的问题。[/back][/font][font=宋体][back=white]([/back][/font][back=white]2[/back][font=宋体][back=white])实际上检测[/back][/font][font=宋体]水中邻苯二甲酸二甲酯的方法有很多种,包括[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法、液相色谱法、液相色谱串联质谱法等。根据文献记载,液相色谱法[back=white]检测[/back]水中邻苯二甲酸二甲酯,正相色谱法和反相色谱法都可以满足检测要求。[/font][font=宋体][back=white]([/back][/font][back=white]3[/back][font=宋体][back=white])该标准方法测定的是水和废水中邻苯二甲酸酯,包含了[/back][/font][font=宋体]邻苯二甲酸二甲酯等[/font][back=white]4[/back][font=宋体][back=white]个组分,而非[/back][/font][font=宋体]邻苯二甲酸二甲酯单个组分[back=white]。当然,如果在实际检测过程中,使用反相色谱分离[/back]邻苯二甲酸二甲酯[back=white]效果比较好,完全可以采用反相色谱法来检测,但需要对该方法进行评估和验证。[/back][/font][font='微软雅黑','sans-serif'][color=black][back=white]领取更多《实战宝典》请进:[url]http://instrument-vip.mikecrm.com/2bbmrpI[/url][/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white] [/back][/color][/font]
微囊检测与色谱优化实验部分原理: 水样过滤后,水样滤液经富集萃取,浓缩,定容,注入高效液相色谱仪分离、检测、分析计算。设备高效液相色谱仪,配紫外检测器或DAD检测器,柱温箱SPE仪固相萃取仪,包括C18反相萃取小柱样品浓缩仪,氮吹仪试剂MC-LR和MC-RR标准品三氟乙酸TFA(色谱纯)甲醇(色谱纯)乙酸乙酯(色谱纯)硫代硫酸钠(分析纯)高纯氮气超纯水试样制备 取适量水样,过滤,水样滤液经固相萃取装置富集萃取,氮吹浓缩,定容、过滤、冷藏备用。 这个过程说简单也简单,主要就是过滤、富集萃取、浓缩、定容、最后过滤等过程,也都是常见的样品前处理过程。说复杂也是非常复杂的。由于这个检测限量非常低,水样的富集程度就非常高,经常取几升甚至几十升水,多次富集萃取、浓缩至近干,费时费力,并且还得保证被测物尽量不损失。色谱条件色谱柱:Venusil XBP C18((250 mm × 4.6mm, 5μm)高效液相色谱柱流动相:甲醇:水(含0.05%三氟乙酸)=45:55(V/V),使用前微膜过滤,超声脱气流速1.0mL/min柱温:40℃紫外检测波长:238nm样品进样量:20uL标准品色谱图:http://ng1.17img.cn/bbsfiles/images/2013/12/201312221825_484009_2369266_3.png1.MC-RR 2.MC-LR 以上是个人对样品分析及色谱优化的一点总结,仅供参考,希望能对大家有益!欢迎各位仁兄前来评价、指点!
在正相色谱中,一般采用极性键合固定相,硅胶表面键合的是极性的有机基团,键合相的名称由键合上去的基团而定。最常用的有氰基(-CN)、氨基(-NH2)、二醇基(DIOL)键合相。流动相一般用比键合相极性小的非极性或弱极性有机溶剂,如烃类溶剂,或其中加入一定量的极性溶剂(如氯仿、醇、乙腈等),以调节流动相的洗脱强度。通常用于分离极性化合物。一般认为正相色谱的分离机制属于分配色谱。组分的分配比K值,随其极性的增加而增大,但随流动相中极性调节剂的极性增大(或浓度增大)而降低。同时,极性键合相的极性越大,组分的保留值越大。该法主要用于分离异构体,极性不同的化合物,特别是用来分离不同类型的化合物。 在反相色谱中,一般采用非极性键合固定相,如硅胶-C18H37(简称ODS或C18)硅胶-苯基等,用强极性的溶剂为流动相,如甲醇/水,乙腈/水,水和无机盐的缓冲液等。 正相色谱和反相色谱的区别: 本质上是填料(固定相)的不同,正相色谱柱填料极性强,洗脱顺序由弱到强 反相色谱柱填料极性弱,洗脱顺序由强到弱。 1、正相色谱 正相色谱用的固定相通常为硅胶(Silica)以及其他具有极性官能团胺基团,如(NH2,APS)和氰基团(CN,CPS)的键合相填料。由于硅胶表面的硅羟基(SiOH)或其他极性基团极性较强,因此,分离的次序是依据样品中各组分的极性大小,即极性较弱的组份最先被冲洗出色谱柱。正相色谱使用的流动相极性相对比固定相低,如正已烷(Hexane),氯仿(Chloroform),二氯甲烷(Methylene Chloride)等。 2、反相色谱 反相色谱用的填料常是以硅胶为基质,表面键合有极性相对较弱官能团的键合相。反相色谱所使用的流动相极性较强,通常为水、缓冲液与甲醇、乙腈等的混合物。样品流出色谱柱的顺序是极性较强的组分最先被冲洗出,而极性弱的组分会在色谱柱上有更强的保留。 常用的反相填料有:C18(ODS)、C8(MOS)、C4(Butyl)、C6H5(Phenyl)等。
三 清洗硅胶基质的色谱柱 恢复一根已受污染的高效液相色谱柱的关键在于了解污染物的性质,然后寻找一种合适的溶剂将其去除。如果污染物是由于一些强保留物质的多次进样积聚而产生,一个除去这些污染物的简单的冲洗过程往往会使色谱柱恢复性能。有时,在经过了等度操作之后,用20个柱体积的90%~100%的溶剂B(二元反相体系中较强的溶剂)将会除去这些污染物。(表二列出了各种型号的高效液相色谱柱的柱体积,所以读者可以很轻易地确定色谱柱的冲洗体积。)例如,脂质类的化合物可以使用一些非水性的溶剂来去除,如甲醇、乙睛、四氢呋喃。如果你正在使用含水的缓冲流动相,则千万不能将流动相直接跳到强溶剂中。将流动相猛然间改到高比例有机相的举动会导致高效液相色谱流动体系的缓冲沉淀,这将会造成更加严重的问题,如使筛板堵塞,接口管路堵塞,泵的密封垫失效,刮伤泵的柱塞杆,使进样阀转子失灵。相反,应使用非缓冲的流动相来冲洗色谱柱(就是用水来代替缓冲液)。在经过了5~10个柱体积的非缓冲溶剂冲洗之后才能允许较强的溶剂流经色谱柱。 有时,流动相中的强溶剂组分是不能充分去除色谱柱中的污染物的。必须另外使用一种更强的溶剂或一系列的溶剂才能清洗色谱柱。假如污染物是非生物性的,则使用者可以通过一种或更多的其他有机溶剂来去除不需要的化合物。可以使用许多种的溶剂和溶剂组合方式。访问一些色谱柱生产厂商的网站可以浏览到一些推荐使用的溶剂系统。 一般来说,所有的清洗都会遵循一个相似的模式。清洗过程中的溶剂浓度是增加的,通常最后都是使用一些非极性的溶剂(例如:乙酸乙酯,乃至碳氢化合物),它将会有助于溶解一些脂质类和油类化合物。重要的是要确保这一系列的每个溶剂都能与所使用的下一个溶剂互溶。一个清洗循环的结论是,在回到初始的流动相系统之前,可通过中间的可互溶的溶剂反向走。例如,异丙醇就是这个中间步骤的一个极好的溶剂,因为它能够同有机溶剂互溶,如正己烷和二氯甲烷,而且同样也能够和水相溶剂互溶。因为异丙醇有很大的粘度,所以必须确保清洗时流速不能太高,否则会引起泵的压力过载。同样,如果使用了紫外检测器,则需避免使用在紫外光谱区有吸收的溶剂,因为这样会需要大量的清洗溶剂才能去除所有吸收的溶剂以得到一个稳定的基线。对于典型的键合硅色谱柱和无缓冲液的流动相的一个推荐使用的清洗系统就是:l100%甲醇;l100%乙睛;l75%乙睛——25%异丙醇;l100%异丙醇;l100%二氯甲烷;l100%正己烷; 当使用了二氯甲烷或正己烷作为冲洗溶剂后,由于溶剂的不互溶性,需要先用异丙醇冲洗色谱柱,而后才能使用含水的流动相。冲洗色谱柱的清洗溶剂的体积最小为柱体积的十倍。对于一根250mm×4.6mm的色谱柱,分析者可以使用经典的1~2mL/min的高效液相色谱流量。为了要回到原来的流动相,色谱工作者可以跳过颠倒使用该系列的清洗溶剂。推荐使用异丙醇为中间的清洗溶剂,然后用不含缓冲液的流动相冲洗,最后再用最初使用的流动相进行冲洗。四氢呋喃是另一个使用广泛的溶剂,它可以被用来清洗受污染的色谱柱。如果使用者怀疑色谱柱受到了比较严重的污染,则可以用二甲亚砜或二甲基甲酰胺与水以50:50的比例,以小于0.5mL/min的流速进行清洗。成功的反向液相色谱柱的再生需要花费相当多的时间,使用溶剂进行冲洗可以设置梯度程序来进行通宵操作。* 在清洗过程中产生了是否应该将色谱柱颠倒过来冲洗的问题。因为大部分的强保留的污染物都会留在色谱柱的前端,将色谱柱颠倒过来清洗会减少已被溶解的污染物流出色谱柱的迁移距离。就填料层的稳定性而言,大部分的现代高效液相色谱柱都是用比普通操作压要高得多的压力装填的;因此,色谱柱的填料层应该不会受到反向的流速的干扰。然而,如果色谱柱顶端的筛板的空隙要比底部的来得大,这种反向的方式则是有害的。比如说,如果底部筛板的空隙为2µ m,则足够容纳装填有平均填料粒径为5µ m的色谱柱。(含有粒径5±2µ m的尺寸分布)。然而生产商往往在色谱柱的顶端安装空隙度比较大的筛板,以防止其被样品或流动相颗粒所堵塞。如果这种筛板的空隙度要比粒径大小分布的最小微粒大,部分填料会经筛板而流出色谱柱,这样就会产生中空。如果色谱柱上有一个箭头来提醒色谱柱的流向,我觉得应该在反向使用色谱柱之前参考说明使用书,浏览生产商的网站,或与技术支持组进行商讨,以确定这是否是一个安全的举动。无论你是否将色谱柱反向使用,最好要将色谱柱同高效液相色谱检测器断开,使污染物或者颗粒留在筛板上而不流经检测池,因为这些物质会污染检测池。 清洗污染的反相色谱柱的频率依懒于有多少不明物质被注射到柱子中,因为反相色谱柱有时在分辨率损失和外来物质的洗脱前可以忍受大量的污染物, 使用者往往等到他们观察到一些异常现象才对柱子进行清洗。然而,长时间累积的污染物会使色谱柱的清洗工作变得更难。正因为如此,如果你知道自己的色谱柱很容易受到脏的样品基体的污染时,我建议定期清洗你的色谱柱。清洗的次数越多,清洗条件也就越简单。反相硅胶基质色谱柱中残留蛋白质的清洗 如果一些如血浆、血清的生物物质留在了反相液相色谱柱上,色谱工作者必须使用一些不同的清洗程序。在大部分情况下,一些比较纯的有机试剂如乙睛或甲醇是不能溶解肽和蛋白质的,所以它们不能有效清洗反相液相色谱柱。然而加入了缓冲液、酸或者一些离子对试剂的混合有机溶剂能够有效清洗这些物质。起初,可以尝试含比较高浓度的溶剂B的流动相来冲洗色谱柱。Freiser和他的同事(4)发现来回反复地梯度洗脱,使用三氟乙酸的水溶液和三氟乙酸—正丁醇可以使污染的反相液相色谱柱再生。Bhadway和Day(5)建议进样100µ L的三氟乙醇到250mm×4.6mm色谱柱可以达到清洗的目的。如果这些方案都失败了的话,推荐使用Cunico和他的同事们(6)的强洗脱液和溶解性的试剂(见表三)。然而,在用这些试剂冲洗色谱柱之前,应该参考色谱柱的手册,或和生产商进行商议,以确保其不会破坏色谱柱的填料。硅键合色谱柱的填料往往能够与这些试剂共存,而聚合物色谱柱可能会因为与特定溶剂结合而使填料产生膨胀或收缩,从而影响到色谱柱的性能。表三 用于HPLC反相色谱柱蛋白质物质除去的清洗溶剂溶剂组成乙酸1%的水溶液三氟乙酸1%的水溶液0.1%三氟乙酸-异丙醇40:60(V:V)(粘稠的,通常降低流速)TEA-异丙醇40:60(V:V)(在三乙胺混合前用0.25N的磷酸调节pH到2.5)尿素或胍的水溶液5-8M(调节pH到6-8)NaCl,Na3PO4,Na2SO4水溶液0.5-1.0M (Na3PO4 pH 7.0)DMSO-水 或 DMF-水50:50(V:V)来自参考文献6。如果使用了早期的一系列溶剂,则必须确保表三中的溶剂与这个系列中的溶剂都是互溶的。异丙醇是一个良好的中间冲洗溶剂。在体系中的清洗体积最少为20个柱体积。由于一些溶剂清洗系统具有一定的粘滞性,所以必须调整冲洗流速以避免产生超压。在清洗完一根含有胍和尿素的色谱柱后,需要用至少40~50柱体积的色谱级的水进行冲洗。对于反相高效液相色谱柱来说使用一些如十二烷基磺酸钠(SDS)和Triton的清洗剂来清洗是不妥的,因为这些化合物会强烈地吸附在硅胶基质的表面而难以去除。这些试剂会影响填料表层,改变填料的性质。然而,分离小组的研究发现,肽合成过程中保护基团和净化剂产物对柱子的污染,可以通过在流动相中注射500µ L的1%SDS溶液以1mL/min的流速进行冲洗(7)。如果接下来使用含0.1%(V/V)三氟乙酸的5%~95%乙睛的梯度,在开始的条件下进行平衡,多肽的分离效果则可恢复。
反相液相色谱的选择,使用及维护1. 柱子的PH值使用范围 反相柱优点是固定相稳定,应用广泛,可使用多种溶剂。但硅胶 为基质的填料,使用时一定要注意流动 相的PH范围。一般的C18柱PH值范围都在2-8,流动相的PH值小于2时,会导致键合相的水解;当PH值大于7时硅胶易溶解;经常使用缓冲液固定相要降解。一旦发生上述情况,色谱柱人口处会塌陷。同样填料各种不同牌号的色谱柱不尽相同。如果流动相PH较高或经常使用缓冲液时,建议选择PH范围大的柱子,例如戴安公司的Acclaim柱PH 2-9或Zorbax的PH 2-11. 5的柱子。2.填料的端基封尾(或称封口) 把填料的残余硅羟基采用封口技术进行端基封尾,可改善对极性化合物的吸附或拖尾;含碳量增高了,有利于不易保留化合物的分离;填料稳定性好了,组分的保留时间重现性就好。如果待分析的样品属酸性或碱性的化合物,最好选用填料经端基封尾的色谱柱。二、液相色谱柱的使用 色谱柱在使用前,最好进行柱的性能测试,并将结果保存起来,作为今后评价柱性能变化的参考。在做柱性能测试时要按照色谱柱出厂报告中的条件进行(出厂测试所使用的条件是最佳条件),只有这样,测得的结果才有可比性。但要注意:柱性能可能由于所使用的样品、流动相、柱温等条件的差异而有所不同。1、样品的前处理a、最好使用流动相溶解样品。b、使用预处理柱除去样品中的强极性或与柱填料产生不 可逆吸附的杂质。c、使用0.45µm的过滤膜过滤除去微粒杂质。2、流动相的配制 液相色谱是样品组分在柱填料与流动相之间质量交换而达到分离的目的,因此要求流动相具备以下的特点:a、流动相对样品具有一定的溶解能力,保证样品组分不会沉淀在柱中(或长时间保留在柱中)。b、流动相与样品不产生化学反应c、流动相的黏度要尽量小,以便得到好的分离效果;降低柱压降,延长泵的使用寿命(可运用提高温度的方法降低流动相的黏度)。d、流动相的物化性质要与使用的检测器相适应。如使用UV检测器,最好使用对紫外吸收较低的溶剂配制。e、流动相沸点不要太低,否则容易产生气泡,导致实验无法进行。f、在流动相配制好后,一定要进行脱气。除去溶解在流动相中的微量气体既有利于检测,还可以防止流动相中的微量氧与样品发生作用。3、流动相流速的选择 因柱效是柱中流动相线性流速的函数,使用不同的流速可得到不同的柱效。对于一根特定的色谱柱,要追求最佳柱效,最好使用最佳流速。对内径为4.6mm的色谱柱,流速一般选择 1ml/min,对于内径为4.0mm柱,流速0.8ml/min为佳。 当选用最佳流速时,分析时间可能延长。可采用改变流动相的洗涤强度的方法以缩短分析时间(如使用反相柱时,可适当增加甲醇或乙腈的含量)。注意:a.含水流动相最好在实验前配制,尤其是夏天使用缓冲 溶液作为流动相不要过夜。最好加入叠氮化钠,防止细菌生长。b.流动相要求使用0.45 µm滤膜过滤,除去微粒杂质。c.使用HPLC 级溶剂配制流动相,使用合适的流动相可延长色谱柱的使用寿命,提高柱性能。三. 色谱柱的维护1. 色谱柱的平衡 反相色谱柱由工厂测试后是保存在乙腈/水中的。新柱应先使用10-20倍柱体积的甲醇或乙腈冲洗色谱柱。请一定确保您分析样品所使用的流动相和乙腈/水互溶。 每天用足够的时间以流动相来平衡色谱柱,您就会在处理问题方面获得最大的”补偿”,而且您的色谱柱的寿命也会变得更长!操作步骤:a. 平衡开始时将流速缓慢地提高,用流动相平衡色谱柱直到获得稳定的基线(缓冲盐或离子对试剂流速如果较低,则需要较长的时间来平衡)b. 如果使用的流动相中含有缓冲盐,应注意用纯水”过渡”即每天分析开始前必须先用纯水冲洗30分钟以上再用缓冲盐流动相平衡; 分析结束后必须先用纯水冲洗30分钟以上除去缓冲盐之后再用甲醇冲洗30分钟保护柱子。2. 色谱柱的再生 长期使用的色谱柱,往往柱效会下降(柱子的理论塔板数减低)。可以对色谱柱进行再生,在有条件的实验室应使用一个廉价的泵进行柱子的再生。 建议用来冲洗柱子的溶剂体积色谱柱尺寸 柱体积 所用溶剂的体积125-4mm 1.6ml 30ml250-4 mm 3.2ml 60ml250-10mm 20ml 400ml选择再生方法:极性固定相(如Si,NH2* ,DIOL基色谱填料)的再生:正庚烷→氯仿→乙酸乙酯→ 丙酮→乙醇→水**非极性固定相(如反相色谱填料RP-18,RP-8,CN等)的再生: 水→乙腈→氯仿(或异丙醇)→乙腈→水注意:a. 在对NH2改性的色谱柱进行再生时,由于NH2可能以铵根离子的形式存在,因此应该在水洗后用0.1M的氨水冲洗,然后再用水冲洗至碱溶液完全流出。b. 0.05M稀硫酸可以用来清洗已污染的色谱柱,如果简单的用有机溶剂/水的处理不能够完全洗去硅胶表面吸附的杂质,在水洗后加用0.05M稀硫酸冲洗非常有效。3. 色谱柱的维护a.使用预柱保护分析柱(硅胶在极性流动相/离子性流动相中有一定的溶解度)b.大多数反相色谱柱的 pH稳定范围是2-7.5,尽量不超过该色谱柱的pH范围c.避免流动相组成及极性的剧烈变化d.流动相使用前必须经脱气和过滤处理e.如果使用极性或离子性的缓冲溶液作流动相,应在实验完毕柱子冲洗干净,并保存于甲醇或乙腈中f.氯化物的溶剂对其有一定的腐蚀性,故使用时要注意,柱及连接管内不能长时间存留此类溶剂,以避免腐蚀。

[align=center][img=,600,327]https://ng1.17img.cn/bbsfiles/images/2019/09/201909251615106962_8511_932_3.jpg!w655x357.jpg[/img][/align]小伙伴们,在做反相液相色谱模式时,有没有发现强极性化合物(如多糖类、生物碱类、寡糖类等)的保留很弱,甚至没有保留。一些碱性的药物分子的分离效果也不理想,亲水性强且不带任何电荷的溶质在反相液相色谱或者离子交换色谱中均不被保留,这些给我们的实验造成了很大的挑战。这种情况下,亲水作用色谱(HILIC)是一种很好的选择。HILIC是正相色谱的变化,与反相色谱相反,流动相中的水相部分是较强的洗脱剂,而有机部分则是很弱的洗脱剂。也就是说,增加有机相的比例会使得保留增强。基于此月旭科技成功推出了一种两性离子键合的全多孔球形硅胶HILIC色谱柱,其两性离子(amphion)是指在一个分子中同时存在正电荷中心和负电荷中心。该色谱柱具有良好的亲水性,适合分离极性、亲水性的小分子目标物以及碱性药物分子。与传统的硅胶和氨基柱等HILIC色谱柱相比,其可提供更好的重现性和更为稳定的HILIC模式分离能力。[b]Ultimate HILIC Amphion色谱柱的特点[/b]🔸 同时与阴、阳离子产生弱静电作用,对目标物具有不同选择性;🔸 提供氢键、分子以及静电引力的多重作用;🔸 能为强极性的目标物提供合适的保留;🔸 采用水溶性有机相作为流动相,能够显著改善样品在流动相中的溶解度;🔸 分离极性、亲水性的小分子目标物以及碱性药物分子。行文至此,太多的理论皆是空洞,那就用两个分离案例来展现这款柱子独特的分离选择性吧。[b]🔷 四种杂质的分离(5-氮杂胞嘧啶、二氰二胺、三聚氰胺、三聚氰酸二氢铵):色谱条件色谱柱:[/b]Ultimate HILIC SiO2(5μm,4.6x250mm)Ultimate HILIC Amphion Ⅱ(5μm,4.6x250mm)[b]流动相:[/b]乙腈-水(80:20)[b]检测波长:[/b]240nm[b]柱温:[/b]30°C[b]流速:[/b]1.0ml/min[b]进样量:[/b]10μl[b]Ultimate HILIC SiO2混合对照图[/b][align=center][img=,600,291]https://ng1.17img.cn/bbsfiles/images/2019/09/201909251615140496_8491_932_3.jpg!w672x326.jpg[/img][/align][align=center][img=,600,119]https://ng1.17img.cn/bbsfiles/images/2019/09/201909251615173239_8617_932_3.png!w690x137.jpg[/img][/align][b]Ultimate HILIC Amphion Ⅱ混合对照图[/b][align=center][img=,600,279]https://ng1.17img.cn/bbsfiles/images/2019/09/201909251615203382_5685_932_3.jpg!w681x317.jpg[/img][/align][align=center][img=,600,119]https://ng1.17img.cn/bbsfiles/images/2019/09/201909251615236185_9267_932_3.png!w690x137.jpg[/img][/align]从上面的数据可以看到:HILIC模式下Ultimate HILIC Amphion Ⅱ色谱柱比Ultimate HILIC SiO2保留更强,具有明显的选择性差异。[b]🔷 三种脂肪酸氨基酸(亮氨酸、丙氨酸、甘氨酸)的分离色谱条件色谱柱:[/b]Ultimate HILIC Amphion Ⅱ(5μm,4.6x150mm)[b]流动相:[/b]乙腈-水(70:30)[b]检测波长:[/b]206nm[b]柱温:[/b]30°C[b]流速:[/b]0.5ml/min[b]进样量:[/b]5μl[b]对照溶液色谱图[/b][align=center][img=,600,241]https://ng1.17img.cn/bbsfiles/images/2019/09/201909251615273019_9281_932_3.png!w677x273.jpg[/img][/align][align=center][img=,600,104]https://ng1.17img.cn/bbsfiles/images/2019/09/201909251615310033_9661_932_3.png!w690x120.jpg[/img][/align]从上面的数据可以看出,使用Ultimate HILIC Amphion Ⅱ(5μm,4.6*150mm)色谱柱检测亮氨酸、丙氨酸和甘氨酸,分离度满足要求。HILIC Amphion 是基于正相和反相色谱上的一种独特的分离模式,决定了其独特的选择分离性,同样地,也会带给您独特的体验。
作者:朱 军1, 黄伟侨2, 刘伟忠3, 刘文宪3, 王华成3, 林育华3( 1.中山大学附属第二医院药学部, 广州 510120 ; 2 . 中山大学附属第一医院药学部,广州 510080 ; 3 . 广州市精神病医院国家药品临床研究基地, 510370)摘要:目的建立反相高效液相色谱法测定人血浆中奋乃静的浓度。方法以钻石C18反相柱(150 mm×4.6 mm,5μm)为色谱柱,流动相为0.03 mol.L-1醋酸铵-甲醇(23:77);流速:1.0 mL.min-1;柱温:40℃;检测波长:254 nm。以醋酸乙酯与二氯甲烷(80:20)为提取剂。结果奋乃静的高、中、低(1 000.0,400.0,10.0μg.L-1)3种浓度平均回收率分别为104.28%,97.60%,98.40%,日内、日间差RSD均7%(n=5);分析方法的检测限为5.0μg.L-1;线性范围为10.0~1 000.0μg.L-1。结论该方法灵敏、准确、简单、快速,可用于临床血药浓度监测和药动学研究。目的建立反相高效液相色谱法测定人血浆中奋乃静的浓度。方法以钻石C18反相柱(150 mm×4.6 mm,5μm)为色谱柱,流动相为0.03 mol.L-1醋酸铵-甲醇(23:77);流速:1.0 mL.min-1;柱温:40℃;检测波长:254 nm。以醋酸乙酯与二氯甲烷(80:20)为提取剂。结果奋乃静的高、中、低(1 000.0,400.0,10.0μg.L-1)3种浓度平均回收率分别为104.28%,97.60%,98.40%,日内、日间差RSD均7%(n=5);分析方法的检测限为5.0μg.L-1;线性范围为10.0~1 000.0μg.L-1。结论该方法灵敏、准确、简单、快速,可用于临床血药浓度监测和药动学研究。谱图:没有
方法是按照GB/T 5009-167-2003做的.原理是在流动相中加入邻苯二甲酸产生高的背景吸收,当无吸收的阴离子通过检测器时,吸收的降低导致色谱信号.阴离子包括:氟,氯,溴,硝酸根,硫酸根等...有两个疑问:1.标准里面的邻苯二甲酸是以ml为单位就是说,这个试剂是液体的,但是我们购买的邻苯二甲酸是固体的.2.里面用到的柱子是反相柱(阴离子柱).这个是不是普通的C18或者C8柱呢?
正相色谱柱与反相色谱柱的区别本质上是填料(固定相)的不同,正相色谱柱填料极性强,洗脱顺序由弱到强;反相色谱柱填料极性弱,洗脱顺序由强到弱。以下是详细说明: 1、正相色谱 正相色谱用的固定相通常为硅胶(Silica)以及其他具有极性官能团胺基团,如(NH2,APS)和氰基团(CN,CPS)的键合相填料。由于硅胶表面的硅羟基(SiOH)或其他极性基团极性较强,因此,分离的次序是依据样品中各组分的极性大小,即极性较弱的组份最先被冲洗出色谱柱。正相色谱使用的流动相极性相对比固定相低,如正已烷(Hexane),氯仿(Chloroform),二氯甲烷(Methylene Chloride)等。 2、反向色谱 反向色谱用的填料常是以硅胶为基质,表面键合有极性相对较弱官能团的键合相。反向色谱所使用的流动相极性较强,通常为水、缓冲液与甲醇、乙腈等的混合物。样品流出色谱柱的顺序是极性较强的组分最先被冲洗出,而极性弱的组分会在色谱柱上有更强的保留。常用的反向填料有:C18(ODS)、C8(MOS)、C4(Butyl)、C6H5(Phenyl)等。
用0.1%三伏乙酸乙腈和水的反相液相可以检测变性蛋白和未变性蛋白的区别么? 我试了一下,结果未发现两张图谱有什么区别,保留时间没有变化。 变性是通过水煮和尿素变性2中方法分别处理的。 大家有什么好的区分变性非变性蛋白的方法么,求教~~~~~~~[em09508]
[b][font=宋体]问题描述:一个起始物料的结构带有硼酸酯,试过不同[/font]pH[font=宋体]值的缓冲液,液相走出来均是不成形的峰,是什么原因?有没有合适的色谱条件?[/font][font=宋体]解答[/font]:[/b][font=宋体]([/font]1[font=宋体])先了解硼酸酯在液相中为什么走不出来,因为硼酸酯化合物遇水和醇后都极易水解,而我们常规反相色谱使用的流动相为水(或酸[/font]/[font=宋体]碱[/font]/[font=宋体]盐溶液)[/font]+[font=宋体]有机相,所以在检测硼酸酯样品的时候很容易出现峰不成形。[/font][font=宋体]([/font]2[font=宋体])根据硼酸酯的特性我们得知,液相正相色谱可以很好的检测,并且根据查询文献可知,已经有研究表明硼酸酯类化合物可以采用非水的反相检测方法。其实只要采用有机溶剂检测硼酸酯类化合物的出峰时间不是太靠前,完全可以采用反相色谱配普通[/font]C[sub]18[/sub][font=宋体]色谱柱进行检测。[/font][font='微软雅黑','sans-serif'][color=black][back=white]领取更多《实战宝典》请进:[url]http://instrument-vip.mikecrm.com/2bbmrpI[/url][/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white] [/back][/color][/font][color=red] [/color]