一、实验原理稀释平板测数是根据微生物在高度稀释条件下固体培养基上所形成的单个菌落是由一个单细胞繁殖而成这一培养特征设计的计数方法,即一个菌落代表一个单细胞。计数时,首先将待测样品制成均匀的繁殖稀释液,尽量使样品中的微生物细胞分散开,使其成单个细胞存在,否则一个菌落就不只是代表一个细胞,再取一定稀释度、一定量的稀释液接种到平板中,使其均匀分布于平板中的培养基内。经培养后,由单个细胞生长繁殖形成菌落,统计菌落数目,即可计算出样品中的含菌数。此记数方法所计算的菌数是培养基上长出来的菌落数,故又称活菌计数。一般用于某些产品检定,如根瘤菌剂等产品检定,生物制品检验,土壤含菌量测定及食品、水源的污染程度的检验。自然条件下,微生物常以群落状态存在,这种群落往往是不同种类微生物的混合体。为了研究某种微生物的特性或者要大量培养和使用某种微生物,必须从这些混杂的微生物群落中获得纯培养,这种获得纯培养的方法称为微生物的分离与纯化。在自然界中,土壤是微生物生活的良好环境,其中生活的微生物数量和种类都是极其丰富的,因此土壤是人类开发利用微生物资源的重要基地。土壤中的微生物数量、种类与土壤肥力有关,肥沃的土壤中多,贫瘠土壤中少。其生理类群则与土壤的其它理化性质,如通气、pH有关,例如在通气良好的菜园土中,好气性微生物占有绝对优势。本实验以菜园土为材料分离土壤中的好气性细菌,并进行数量测定。分离微生物时,一般是根据该微生物对营养、pH、氧气等要求的不同,供给它们适宜的生活条件,或加入某种抑制剂造成只利于该菌种生长,不利于其它菌种生长的环境,从而淘汰不需要的菌种。分离微生物常用的方法有稀释平板分离法和划线分离法,根据不同的材料,可以采用不同方法,其最终目的是要在培养基上出现欲分离微生物的单个菌落,必要时再对单个菌落进一步分离纯化。在用稀释平板分离微生物时,还可以同时测定待分离的微生物的数量。放线菌与细菌同属原核微生物,是重要的抗生素产生菌,在土壤中的数量仅次于细菌,尤其是在有机质丰富、透气性好的中性到微碱性土壤中的数量较多。本实验采用高氏一号琼脂培养基分离和计数菜园土中的放线菌。真菌在土壤中的数量次于细菌和放线菌,主要在有机质丰富、透气性好的偏酸性土壤中较多。分离土壤中的真菌并不难,但由于其菌落大,容易扩展,计数准确性较低。本实验采用加有氯霉素或庆大霉素和孟加拉红的马丁氏培养基分离及计数菜园土中的真菌。按一般资料介绍为链霉素,但此种抗生素要先配成一定浓度的溶液,且应于倒平板前才加入培养基中。在此培养基上,放线菌和细菌被氯霉素或庆大霉素和孟加拉红所抑制,但大多数真菌能够生存,且其菌落受孟加拉红的抑制而较小,从而避免了某些真菌的扩散蔓延而带来的数量上的误差。
CNAS PT0035 2017年8月16的乳粉样品,微生物,菌落计数,有结果出来的告诉下哈,
各位同仁大家好: 小女子我刚进入食品检测这一行业,还望大家多多指教! 昨天我们实验室在做菠萝丁的微生物检测,发现检测细菌总数的培养皿中出现大量的红色菌落,想请问下,这红色菌落是什么物质,你们有没有遇见过这样的情况呢? 微生物实验会不会有被感染之类的危险呢?望大家多多指教!谢谢!
食品微生物检测,菌落总数限量标准规定样品中蛋白质含量大于40%时,菌落总数限量为40000,如果是氨基酸含量大于40%是否适用于这一限量标准呢?(正常情况下的限量标准是1000)
微生物只做空气菌落总数,阳性菌不做,对微生物实验室有什么要求?需要显微镜吗?需要阳性对照间吗?需要生物安全柜吗?最基本需要什么?欢迎大家讨论。
为什么甜面酱微生物的检测测菌落总数时,-1的比-2的菌落数少?而且做了好几个样都这样。不知道为什么?哪位高手帮帮忙啊?
微生物检验中菌落总数的不确定度评定[~76563~]
各位专家们,今天做的微生物菌落总数实验,培养基在培养48h后,出现培养基表面出现细菌生长,但是在倾注培养基的时候,我有在凝固的培养基表面又覆盖了一层培养基,请教这是什么原因造成的?
[color=#444444]酸奶检测菌落总数为[/color][color=#444444]0[/color][color=#444444],还需要做商业无菌检测吗?菌落总数包括所有微生物,那没有菌落生长是不是就代表无菌?[/color]
食品卫生微生物学检测菌落总数测定测量结果的不确定度评定依据JJF1059-1999《测量不确定度评定与表示》、CNAL/AG06《测量不确定度政策实施指南》和CNAL/AR11《测量不确定度政策》分析一、测量方法按照国家标准GB/T4789.2-2003《食品卫生微生物学检验菌落总数测定》规定的检测程序进行。检测过程为:1) 以无菌操作将检样25g(mL)剪碎放于含有225mL灭菌生理盐水或其它稀释液灭菌玻璃瓶内(瓶内预置适当数量的玻璃珠)或灭菌乳钵内,经充分振摇或研磨做出1:10的均匀稀释液。固体检样在加入稀释液后,最好置均置器中以8000r/min~10000r/min的速度处理1min,做出1:10的均匀稀释液。2) 用1mL灭菌吸管吸取1:10稀释液1mL,沿管壁徐徐注入含有9mL灭菌生理盐水或其它稀释液的试管内(注意吸管尖端不要触及管内稀释液),振摇试管,混合均匀,做出1:100的稀释液。3) 另取1mL灭菌吸管,按上条操作方法,做10倍递增稀释,如此每递增稀释一次,即换用1支1mL灭菌吸管。4) 根据食品卫生标准要求或对标本污染情况的估计,选择2个~3个适宜稀释度,分别在做10倍递增稀释的同时,即以吸取该稀释度的吸管移1mL稀释液于灭菌培养皿内,每个稀释度做两个培养皿。5) 稀释液移入培养皿后,应及时将凉至46℃营养琼脂培养基(可放置于46℃±1℃水浴保温)注入培养皿约15mL,并转动培养皿使混合均匀。同时将营养琼脂培养基倾入加有1mL稀释液灭菌培养皿内作空白对照。6) 待琼脂凝固后,翻转平板,置36℃±1℃温箱内培养48h±2h。7) 作平板菌落计数时,可用肉眼观察,必要时用放大镜检查,以防遗漏。在记下各平板的菌落数后,求出同稀释度的各平板平均菌落总数。8) 选取菌落数在30~300之间的平板作为菌落总数测定标准。一个稀释度使用两个平板,应采用两个平板平均数,其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数,若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘2以代表全皿菌落数。平板内如有链状菌落生长时(菌落之间无明显界线),若仅有一条链,可视为一个菌落;如果有不同来源的几条链,则应将每条链作为一个菌落计。同一样品重复测量10次,取其平均值作为测量结果。10次重复测量的结果见表1。表1 单一样品重复测量的计算过程序号测量结果xilgxilgxi- (lgxi- )21350004.5441-0.030670.0009412880004.94450.369730.136731000005.00000.425230.18082142000005.30100.726230.527415650004.81290.238130.056706696003.9823-0.592470.3510217500004.69900.124230.015433898003.9912-0.583570.340554990003.9542-0.620570.38510710330004.5185-0.056270.003166平均值599404.5748二、数学模型从数据看,由于测量结果发散极大,与之相比其它不确定度来源(人员、标准、设备、环境、方法等)无疑均可以忽略不计,这也是微生物测量的特点。因此仅考虑由测量结果发散引入的不确定度分量。于是数学模型可以简单地写为y=x三、测量不确定度评定由于重复测量结果中最大值和最小值相差20倍。因此用常规的直接根据平均值得到标准偏差的方法显得有些不合理。通常的做法是取对数以后在用常规的贝塞尔方法进行计算。具体计算过程如下:1) 测量结果xi(表1第2列);2) 取对数lgxi,得到对数lgxi的平均值为: =4.5748(表1第3列);3) 求残差lgxi- (表1第4列)4) 求残差的平方(lgxi- )(表1第5列),得到残差平方和为 =1.9978595) 合成标准不确定度测量结果为10次重复测量的平均值,故平均值的标准不确定度为 =0.14906) 扩展不确定度由于置信概率p=95%,自由度ν=10-1=9,由t分布表可得k=2.26。于是 7) 取反对数,由lgx坐标回到x坐标由于lgx与x之间的非线性关系,不能直接求扩展不确定度U的反对数,只能给出微生物含量的可能区间。因此首先确定lgx的取值范围为:lgx=4.5748±0.3367,或写成4.2381≤lgx≤4.9115取反对数后可得 1.7×104≤x≤8.2×104四、不确定度报告由于微生物测量结果的特殊性,所以其测量结果的不确定度表示也与其他专业不同。按照国家标准GB/T4789.2-2003《食品卫生微生物学检验菌落总数测定》规定的检测程序进行,被测样品微生物菌落总数(十次测量平均值)在1.7×104和8.2×104之间。[img]http://bbs.instrument.com.cn//images/affix.gif[/img][url=http://bbs.instrument.com.cn/download.asp?ID=194237]食品卫生微生物学检测菌落总数测定测量结果的不确定度评定.doc[/url][color=#DC143C][size=4][font=黑体]应疯子哥的要求,把公式及图片贴上来,在5楼-7楼有版主ROGERSW的完整佳作。[/font][/size][/color]
[color=#333333]在食品安全微生物学检验中,为什么要以菌落总数为指标[/color]
GB 4789.2-2010 食品微生物学检验 菌落总数
今天出报告时遇到一个这样的问题,我用1000-2018做细菌总数,但地下水的标准钟又叫菌落总数,我想问这个是不是相同的,是不是只是叫法不同而已,我看地下水上的方法也是平皿计数法,那我测出来的是叫细菌总数还是菌落总数呢?我们资质附表中只有细菌总数,客户指明要测菌落总数,那我能不能出这个报告呢?
做菌落计数时有的点很小,要计吗?有的在表面,有的在培养基下面,这些菌有区别吗,是否和氧的需求有关,都要计数吗?因为听过一种理论说抹不掉的就不要计。以上,烦请指教。
目的: 通过对食品中菌落总数测定方法进行验证,证明我公司采用标准GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》规定的方法对食品中菌落总数的测定满足检测要求。[b]1 实验室基本情况[/b][align=center]表1-1参加验证的人员情况表[/align] [table][tr][td] [align=center]姓名[/align] [/td][td] [align=center]性别[/align] [/td][td] [align=center]职务[/align] [/td][td] [align=center]所学专业[/align] [/td][td] [align=center]从事相关分析工作年限[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]女[/align] [/td][td] [align=center]微生物主管[/align] [/td][td] [align=center]食品科学与工程[/align] [/td][td] [align=center]8年[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]女[/align] [/td][td] [align=center]微生物组长[/align] [/td][td] [align=center]食品科学与工程[/align] [/td][td] [align=center]5年[/align] [/td][/tr][/table][align=center]表1-2使用仪器情况登记表[/align] [table][tr][td] [align=center]仪器名称[/align] [/td][td] [align=center]仪器型号[/align] [/td][td] [align=center]制造厂商[/align] [/td][td] [align=center]备注[/align] [/td][/tr][tr][td] [align=center]生化培养箱[/align] [/td][td] [align=center]SPX-250B-Z[/align] [/td][td] [align=center]上海博迅实业有限公司医疗设备厂[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]立式压力蒸汽灭菌器[/align] [/td][td] [align=center]YXQ-LS-75SⅡ[/align] [/td][td] [align=center]上海博迅实业有限公司医疗设备厂[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]净化工作台[/align] [/td][td] [align=center]SW-CJ-2D[/align] [/td][td] [align=center]苏州博莱尔净化设备有限公司[/align] [/td][td] [align=center] [/align] [/td][/tr][/table][align=center]表1-3使用试剂登记表[/align] [table][tr][td] [align=center]试剂名称[/align] [/td][td] [align=center]批号[/align] [/td][td] [align=center]生厂商[/align] [/td][td] [align=center]备注[/align] [/td][/tr][tr][td] [align=center]氯化钠[/align] [/td][td] [align=center]160913[/align] [/td][td]西陇科学股份有限公司[/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]平板计数琼脂(PCA)[/align] [/td][td] [align=center]171223[/align] [/td][td]北京陆桥技术股份有限公司[/td][td] [align=center] [/align] [/td][/tr][/table][b]2 方法验证过程[/b]2.1 菌液制备:挑取一粒大肠埃希氏菌(ATCC25922)瓷珠置于BHI液体培养基中,24h过夜培养,使之菌悬液浓度在10[sup]9[/sup] CFU/mL,用无菌生理盐水按照10倍系列稀释法,稀释至10[sup]-6[/sup]~10[sup]-7[/sup]。2.2 样品制备:2.2.1 试验组:取25 mL2.1中制备的菌液,加入到225 mL无菌盐水中,制成每毫升10 CFU~100 CFU的样品原液,作为试验组。2.2.2 供试品组:不添加任何菌的相同样品。2.3 培养基/试剂制备:2.3.1按GB4789.28-2013食品微生物学检验 培养基和试剂的质量要求配制。2.3.2根据供应商提供的配制说明进行配制。2.4 实验操作:2.4.1 接种及培养:选择3个稀释度的样品匀液,在进行10倍递增稀释时,每个稀释度分别吸取1 mL样品匀液于无菌平皿中,每个稀释度做两个平皿。同时,分别吸取1 mL空白稀释液加入两个无菌平皿内做空白对照。及时将15-20 mL冷却至46℃的PCA倾注平皿,并转动平皿使其混合均匀。待琼脂凝固后,36℃±1℃倒置培养48 h±2 h。为防止蔓延,可在琼脂凝固后在表面覆盖一层约4 mL的琼脂。2.4.2验证试验采用空白对照、人员比对进行试验,并分别计算实验结果及人员比对结果。2.5 测试数据: [table][tr][td=1,2] [align=center]人员[/align] [/td][td=1,2] [align=center]实验组别[/align] [/td][td=4,1] [align=center]稀释度[/align] [/td][td] [align=center]检测结果[/align] [/td][td] [align=center]平均结果[/align] [/td][/tr][tr][td=2,1] [align=center]10[sup]0[/sup][/align] [/td][td=2,1] [align=center]10[sup]-1[/sup][/align] [/td][td] [align=center]CFU/mL[/align] [/td][td] [align=center]CFU/mL[/align] [/td][/tr][tr][td=1,4] [align=center]A[/align] [/td][td] [align=center]试验组-1[/align] [/td][td] [align=center]47[/align] [/td][td] [align=center]43[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]45[/align] [/td][td=1,2] [align=center]46[/align] [/td][/tr][tr][td] [align=center]试验组-2[/align] [/td][td] [align=center]45[/align] [/td][td] [align=center]48[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]5[/align] [/td][td] [align=center]47[/align] [/td][/tr][tr][td] [align=center]供试品组-1[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]<1[/align] [/td][td=1,2] [align=center]<1[/align] [/td][/tr][tr][td] [align=center]供试品组-2[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]<1[/align] [/td][/tr][tr][td=1,4] [align=center]B[/align] [/td][td] [align=center]试验组-1[/align] [/td][td] [align=center]38[/align] [/td][td] [align=center]45[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]42[/align] [/td][td=1,2] [align=center]41[/align] [/td][/tr][tr][td] [align=center]试验组-2[/align] [/td][td] [align=center]43[/align] [/td][td] [align=center]35[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]39[/align] [/td][/tr][tr][td] [align=center]供试品组-1[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]<1[/align] [/td][td=1,2] [align=center]<1[/align] [/td][/tr][tr][td] [align=center]供试品组-2[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]<1[/align] [/td][/tr][/table][align=center] [/align][align=center]r(A)=log[sup]47[/sup]—log[sup]45[/sup]=0.02<0.25[/align][align=center]r(B)=log[sup]42[/sup]—log[sup]41[/sup]=0.03<0.25[/align]重复性:单人两次独立的单次实验结果的绝对差值,不应大于重复性限r=0.25,以10为底每g(或ml)中微生物计数的对数。[align=center]R=log[sup]46[/sup]—log[sup]41[/sup]=0.05<0.45[/align]复现性:人员比对结果符合标准要求,两人单次试验结果的绝对差值,不应大于复现性限R=0.45,以10为底每g(或ml)中微生物计数的对数。2.7是否对方法偏离? □是 ■否2.8 结论根据GB 4789.2-2016 《食品安全国家标准 食品微生物学检验 菌落总数测定》要求依法检测,试验人员比对结果符合规定。故我公司对食品中菌落总数的测定符合标准GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》的要求。
[font=SimSun, STSong, &]微生物实验:空气的培养皿有菌落,这次实验的数据还可以用吗?还是说要重新做? [/font]
菌落总数为什么在非无菌环境中也能正常检测???
微生物小白又要提问了,菌落(colony forming units)是微生物培养后,由一个或几个微生物繁殖而形成的微生物集落,简称CFU。通常用个数表示。 那么在培养皿上刚开始显示出的菌落的形状,是不是都是圆形的呢? 因为看书看到微生物有杆状、纺锤状、葫芦状。所以看到两个圆珠状的东西联接在一起,犹豫这是一个菌落呢还是两个菌落呢? 如果菌落刚开始的形状都是圆形的,那么就好奇多问一句:为何都是圆形呢??
ISO 13559-2002 黄油、发酵奶和新鲜干酪污染微生物的计数30 度下菌落计数法计数培养基
同样的三个样品,自己实验室和其他实验室差别非常大,是反过来的,哪个数据可信啊???数据如下对方样品1,菌落总数:31 CFU/ml,总大肠:1400 MPN/100ml自己样品1,菌落总数:940 CFU/ml,总大肠:9 MPN/100ml对方样品2,菌落总数:24 CFU/ml,总大肠:1702 MPN/100ml自己样品2,菌落总数:730 CFU/ml,总大肠:22 MPN/100ml对方样品3,菌落总数:31 CFU/ml,总大肠:1369 MPN/100ml自己样品3,菌落总数:16300 CFU/ml,总大肠:6 MPN/100ml求大神科普一下,感谢感谢
一、菌落总数介绍: 菌落是指细菌在固体培养基上生长繁殖而形成的能被肉眼识别的生长物,它是由数以万计相同的细菌集合而成。当样品被稀释到一定程度,与培养基混合,在一定培养条件下,每个能够生长繁殖的细菌细胞都可以在平板上形成一个可见的菌落。 菌落总数就是指在一定条件下(如需氧情况、营养条件、pH、培养温度和时间等)每克(每毫升)检样所生长出来的细菌菌落总数。按国家标准方法规定,即在需氧情况下,37℃培养48h,能在普通营养琼脂平板上生长的细菌菌落总数,所以厌氧或微需氧菌、有特殊营养要求的以及非嗜中温的细菌,由于现有条件不能满足其生理需求,故难以繁殖生长。因此菌落总数并不表示实际中的所有细菌总数,菌落总数并不能区分其中细菌的种类,所以有时被称为杂菌数,需氧菌数等。 菌落总数测定是用来判定食品被细菌污染的程度及卫生质量,它反映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。菌落总数的多少在一定程度上标志着食品卫生质量的优劣。二、检验方法 菌落总数的测定,一般将被检样品制成几个不同的10倍递增稀释液,然后从每个稀释液中分别取出1mL置于灭菌平皿中与营养琼脂培养基混合,在一定温度下,培养一定时间后(一般为48小时),记录每个平皿中形成的菌落数量,依据稀释倍数,计算出每克(或每ml)原始样品中所含细菌菌落总数。 基本操作一般包括:样品的稀释--倾注平皿--培养48小时--计数报告。 国内外菌落总数测定方法基本一致,从检样处理、稀释、倾注平皿到计数报告无何明显不同,只是在某些具体要求方面稍有差别,如有的国家在样品稀释和倾注培养进,对吸管内液体的流速,稀释液的振荡幅度、时间和次数以及放置时间等均作了比较具体的规定。 检验方法参见: GB4789.2-94 《中华人民共和国国家标准 食品卫生微生物学检验 菌落总数测定》 SN0168-92 《中华人民共和国进出口商品检验行业标准 出口食品菌落计数》三、说明(一)样品的处理和稀释: 1.操作方法:以无菌操作取检样25g(或25ml),放于225mL灭菌生理盐水或其他稀释液的灭菌玻璃瓶内(瓶内预置适当数量的玻璃珠)或灭菌乳钵内,经充分振要或研磨制成1:10的均匀稀释液。 固体检样在加入稀释液后,最好置灭菌均质器中以8000~10000r/min的速度处理1min,制成1:10的均匀稀释液。 用1ml灭菌吸管吸取1:10稀释液1ml,沿管壁徐徐注入含有9ml灭菌生理盐水或其他稀释液的试管内,振摇试管混合均匀,制成1:100的稀释液。 另取1ml灭菌吸管,按上项操作顺序,制10倍递增稀释液,如此每递增稀释一次即换用1支1ml灭菌吸管。 2.无菌操作:操作中必须有“无菌操作”的概念,所用玻璃器皿必须是完全灭菌的,不得残留有细菌或抑菌物质。所用剪刀、镊子等器具也必须进行消毒处理。样品如果有包装,应用75%乙醇在包装开口处擦拭后取样。 操作应当在超净工作台或经过消毒处理的无菌室进行。琼脂平板在工作台暴露15分钟,每个平板不得超过15个菌落。 3.采样的代表性:如系固体样品,取样时不应集中一点,宜多采几个部位。固体样品必须经过均质或研磨,液体样品须经过振摇,以获得均匀稀释液。 4.样品稀释误差:为减少样品稀释误差,在连续递次稀释时,每一稀释液应充分振摇,使其均匀,同时每一稀释度应更换一支吸管。 在进行连续稀释时,应将吸管内液体沿管壁流入,勿使吸管尖端伸入稀释液内,以免吸管外部粘附的检液溶于其内。 为减少稀释误差,SN标准采用取10mL稀释液,注入90mL缓冲液中。 5.稀释液:样品稀释液主要是灭菌生理盐水,有的采用磷酸盐缓冲液(或0.1%蛋白胨水),后者对食品已受损伤的细菌细胞有一定的保护作用。如对含盐量较高的食品(如酱油)进行稀释,可以采用灭菌蒸馏水。(二)倾注培养 1.操作方法:根据标准要求或对污染情况的估计,选择2~3个适宜稀释度,分别在制10倍递增稀释的同时,以吸取该稀释度的吸管移取1ml稀释液于灭菌平皿中,每个稀释度做两个平皿。 将凉至46℃营养琼脂培养基注入平皿约15ml,并转动平皿,混合均匀。同时将营养琼脂培养基倾入加有1ml稀释液(不含样品)的灭菌平皿内作空白对照。 待琼脂凝固后,翻转平板,置36±1℃温箱内培养48±2h,取出计算平板内菌落数目,乘以稀释倍数,即得每克(每毫升)样品所含菌落总数。 2.倾注用培养基应在46℃水浴内保温,温度过高会影响细菌生长,过低琼脂易于凝因而不能与菌液充分混匀。如无水浴,应以皮肤感受较热而不烫为宜。 倾注培养基的量规定不一,从12~20ml不等,一般以15ml较为适宜,平板过厚可影响观察,太薄又易于干裂。倾注时,培基底部如有沉淀物,应将底部弃去,以免与菌落混淆而影响计数观察。 3.为使菌落能在平板上均匀分布,检液加入平皿后,应尽快倾注培养基并旋转混匀,可正反两个方向旋转,检样从开始稀释到倾注最后一个平皿所用时间不宜超过[
GB/T 4789.2-2008 食品卫生微生物学检验 菌落总数测定 计数好像有问题,不知道大家如何理解新国标中7.1.2 若有两个稀释度的两个平板都在计数范围内时,按次计算公式计算:N=∑C/(n1+0.2n2)d,式中的n1是第一个适宜稀释度平板上的菌落数,n2是第二适宜稀释度平板上的菌落数。两个稀释度长的菌落数分别是:1:100(第一稀释度):232、244.1:1000(第二稀释度):33、35 公式:N=∑C/(n1+0.1n2)d =232+244+33+35÷【2+(0.1×2)】×10-2=544÷0.022=24727式中:N——样品中的菌落数。 ∑C——平板(含适宜范围内菌落数的平板)菌落数之和。 n1——第一个适宜稀释度平板上的菌落。 n2——第二个适宜稀释度平板上的菌落。 d——稀释因子(第一个稀释度)。不知大家对n1\n2如何理解!!
[font=SimSun, STSong, &]最近几次产品做的菌落总数,总是出现蔓延状态,同时做几组不同产品,固定的一种产品出现这种情况(之前没有出现蔓延的情况),麻烦大家分析一下,谢谢![/font]
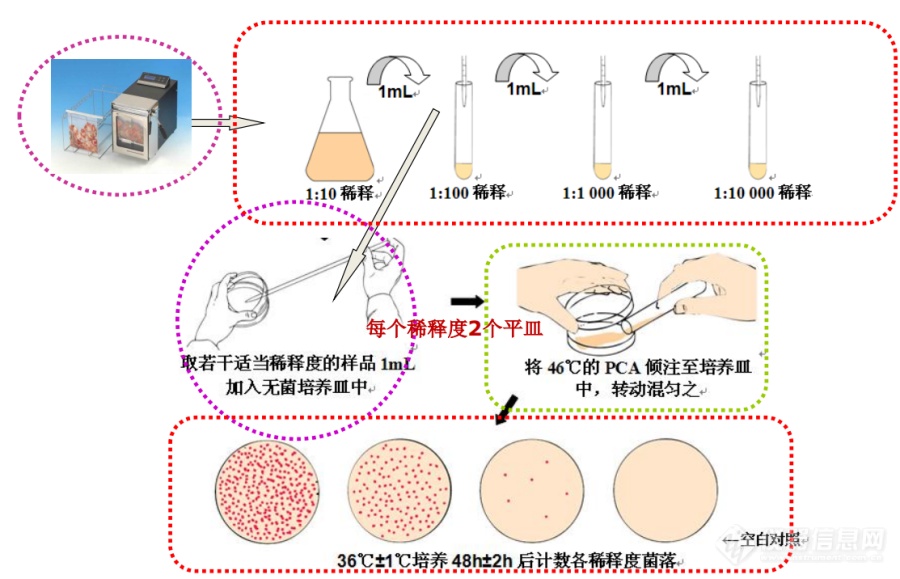
[align=center][font=宋体]菌落总数的检验讨论[/font][/align][align=center][font=宋体] [/font][/align][font=宋体][font=宋体]概念理解[/font] [/font][font=宋体]1、菌落总数英译实为需氧菌平板计数,并不表示实际样品中的所有细菌总数。由于倾注平板法的局限,会有一部分细菌在该实验条件下不生长,故计数结果要比实际值低。 [/font][font=宋体]2、菌落总数并不能区分其中细菌的种类。实际上是把检样中的致病菌、非致病菌、酵母 菌、霉菌都计算在内的微生物杂菌总数。 [/font][font=宋体]3、菌落总数的卫生学意义:用于判定样品受污染的程度、微生物生长存活动态,对样品进行综合卫生评价。反映食品被细菌污染的程度 预测食品耐放程度和时间 估测食品腐败 状况。[/font][font=宋体]菌落:[/font][i][font=宋体]Colony[/font][/i][font=宋体][font=宋体],单个微生物在适固体培养基表面或内部生长繁殖到一定程度;形成肉眼可见有一定细菌群落。[/font] [font=宋体]CFU: [/font][/font][i][font=宋体]Colony Forming Units[/font][/i][font=宋体][font=宋体],菌落形成单位[/font] [/font][font=宋体][font=宋体]鉴于食品的细菌细胞是以单个、成双、链状、葡萄状或成堆的形式存在,因而在平板上出现的菌落可以来源于细胞块,也可以来源于单个细胞,因而平板上所得菌落的数字不应报告活菌数,而应以单位重量、容积或表面积内的菌落数或菌落形成单位([/font][font=宋体]colony forming units,CFU)报告。 [/font][/font][font=宋体] [/font][font=宋体]4.检验步骤直接上图[/font][img=,690,443]https://ng1.17img.cn/bbsfiles/images/2023/08/202308011004578351_4999_6113937_3.png!w690x443.jpg[/img][font=宋体] [/font][font=宋体]5.培养温度: [/font][font=宋体]? 一般食品:36℃±1℃,培养48h ±2h [/font][font=宋体]? 水产品: 30℃±1℃,培养72h ±3h[/font][font=宋体][font=宋体]注意呀:未加工水产品受到海洋和陆地细菌的污染,[/font] [font=宋体]水产品的培养温度,由于其生活环境水温较低,检验时应采用[/font][font=宋体]30℃±1℃。水产品定义见GB 2760或GB2762 [/font][/font][font=宋体]此处并非指水产制品[/font][font=宋体] [/font][font=宋体]6.[/font][font=宋体]操作注意事项:[/font][font=宋体][font=宋体]每个样品从开始稀释到倾注平皿所用的时间不得超过[/font][font=宋体]15min,主要为 [/font][/font][font=宋体][font=宋体]防止细菌增殖和产生片状菌落。(因肠杆菌科繁殖一代所需的时间为[/font] [/font][font=宋体]20min,故选择在15min内) [/font][font=宋体]? 样液与琼脂应充分混合,避免将混合物溅到平皿壁和皿盖上。平皿内 [/font][font=宋体][font=宋体]琼脂凝固后,不要长时间放置,然后倒置培养,可避免菌落蔓延生长。[/font] [/font][font=宋体]? 检样过程中应用稀释剂做空白对照,用以判定稀释液、培养基、平皿或吸管可能存在的污染。应为吸取1mL空白稀释液加入到两个无菌平皿内,可表示为空白对照平皿结果0/0。[/font][font=宋体][color=#000090] [/color][/font][font=宋体][font=宋体]选取菌落数在[/font][font=宋体]30~300CFU之间,无蔓延生长的平板计数 [/font][/font][font=宋体][font=宋体]低于[/font][font=宋体]30的记录具体菌落数,大于300的 可记录为多不可计,每个稀释度采用两个平行的均数。 [/font][/font][font=宋体][font=宋体]有较大片状菌落生长者不宜采用,若片状小于平板一半时且余部均匀分布,则以半个平板菌落数[/font][font=宋体]2倍报告 [/font][/font][font=宋体][font=宋体]无明显界限链状菌落每条单链视为一个菌落[/font] [font=宋体](可采用覆盖方式减少菌落蔓延,如对水产、蜂蜜样品时)[/font][/font][font=宋体] [/font]
看饮用水国标里微生物指标的检测方法好像都是用显微镜,肉眼计数,大家都用的都是什么牌子的显微镜?另外,肉眼计数太痛苦,用菌落计数器可不可以?另外,检测“两虫”的仪器哪些厂商有?
GB 4789.2-2010 食品安全国家标准 食品微生物学检验 菌落总数测定.pdf
求助下列标准的英文版本,急用啊[em09509]食品卫生微生物学检验 菌落总数测定 GB/T 4789.2-2008食品卫生微生物学检验 大肠菌群计数 GB/T 4789.3-2008食品中有机氯农药多组分残留量的测定 GB/T 5009.19-2008植物性食品中有机氯和拟除虫菊酯类农药多种残留的测定 GB/T 5009.146-2008发酵酒及其配制酒卫生标准的分析方法 GB/T 5009.49-2008粮油检验 磷脂含量的测定 GB/T 5537-2008
[em61] 全自动菌落计数仪是利用光学成像系统获得培养皿或者一次性培养测试纸片(如3M菌落测试纸)的图像。 图像显示的作用首先是放大,放大后看菌落就轻松许多; 图像的第二个好处是可点击鼠标进行标记; 图像的第三个好处是可以借助软件自动统计,几百个菌落在1秒内数完。 所谓的全自动菌落是指菌落计数的自动完成,成像还是要手动完成的。另外,软件的自动统计准确率受各种因素的影响,一般情况下,都不能完成100%计数。但是,在菌落生长正常,大小基本一致,无大面积粘连的情况下,可实现95%左右的识别。此准确度完全满足一般的菌落计数统计要求,可用于微生物培养研究,食品卫生检测等。 博黛生物科技 BioDit 专业开发全自动菌落计数仪
香港消委会近日的一份“测试瓶装水卫生程度”的调查结果将几个高端水品牌纷纷拉下马。昨天,在调查中被检出菌落数超标的依云水向本报发来声明表示,其产品符合国际标准,微生物菌落总数并非检测项目,而是检测致病菌数。 香港消委会在其官方网站公布“测试瓶装水卫生程度”的调查结果。报告中称,香港消费会对40款瓶装水进行了测试,包括11款蒸馏水、4款矿物质饮品和25款天然矿泉水。其中8款天然矿泉水样本存在含菌情况,每毫升含有2至550个菌落。这其中就包括作为依云水。 依云水生产商达能集团昨天向本报发来声明称,在水中存在微生物菌落是天然矿泉水产品的固有特征,国际食品法典和中国国家质量监督检验检疫总局均不将微生物菌落总数纳入检测项目,而是检测致病菌数。 依云方面称,目前在中国市场和香港地区销售的依云天然矿泉水均符合以上检验机构发布的所有标准。
[color=#333333]食品微生物检测中出现一些半透明的菌落也要计数吗?为什么会出现这样的情况,正常吗?[/color]