根据国标,总硬度里配制的缓冲溶液(称取16.9g氯化铵,溶于143ml氨水。加入适量MgEDTA)。根据这个方法配置出来的缓冲溶液,怎么确保ph=10。如果用试纸粗略测的ph偏大怎么办?
PH缓冲溶液校正时,一般要求,第一点用中性缓冲溶液校正,第二点用接近待测液值的PH缓冲溶液校正!接近待测液值的PH,怎确定的?
请问一下,IEC方法 里面用比色法测定六价铬时为什么只用了0.5 ml 0.5mol• L-1 K2HPO4 & 0.5 mol• L-1KH2PO4 缓冲溶液??只有0.5ml 能起什么作用呢?我察看了ISO3613的方法,是加入25ml缓冲溶液有没有人能够帮忙解答一下这个长期困扰我的问题?
缓冲剂及缓冲溶液 能抵抗外加的少量酸、碱或稀释而保持本身的 PH 值基本不变的溶液叫做缓冲溶液,用来配制缓冲溶液的试剂又称缓冲剂。 缓冲溶液一般是具有同离子效应的弱酸和弱酸盐或弱碱和弱碱盐组成的。例如:乙酸 - 乙酸钠、氨 - 氯化铵、碳酸氢钠 - 硫酸钠、硼砂 - 硼酸、磷酸二氢钾 - 磷酸氢二钠等都可以配成缓冲溶液,缓冲溶液根据用途不同分成几种。
pH需要使用ph测试仪检测,测定方法也较为简单,早先需要自已动手配置标准缓冲溶液,对应的碱标、中标、酸标缓冲溶液可以分别表达为:pH 9.18,pH 6.86 及 pH 4.00。缓冲液应装在玻璃瓶或聚乙烯瓶中,存放在冰箱中低温保存,如发现混浊或沉淀等现象,应重新配制。每次使用时,取出适量,待恢复至室温再使用,使用后不能再倒回原溶液中,以免污染。现在已经有了小包装的标准试剂,可以随配随用。
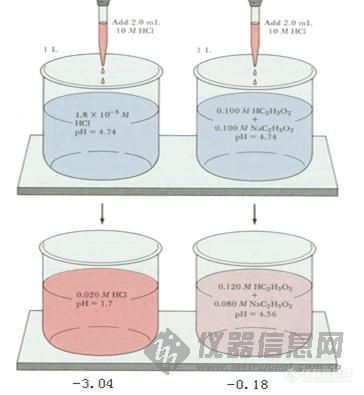
缓冲溶液与缓冲作用原理 (一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4molL-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4 molL-1),若将1滴氢氧化钠溶液(12.4molL-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7 molL-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用 具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。 3.弱碱及其对应的盐 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。 (三)缓冲溶液的作用原理 现以HOAc-NaOAc缓冲溶液为例,说明缓冲溶液之所以能抵抗少量强酸或强碱使PH稳定的原理。醋酸是弱酸,在溶液中的离解度很小,溶液中主要以HOAc分子形式存在,OAc-的浓度很低。醋酸钠是强电解质,在溶液中全部离解成Na+和OAc-,由于同离子效应,加入NaOAc后使HOAc离解平衡向左移动,使 HOAc的离解度减小,[HOAc]增大。所以,在HOAc-NaOAc混合溶液中,存在着大量的HOAc和OAc-。其中HOAc主要来自共轭酸HOAc,OAc-主要来自NaOAc。这个溶液有一定的[H+],即有一定的PH值。在HOAc-NaOAc缓冲溶液中,存在着如下的化学平衡: 在缓冲溶液中加入少量强酸(如HCL),则增加了溶液的[H+]。假设不发生其他反应,溶液的PH值应该减小。但是由于[H+]增加,抗酸成分即共轭碱OAc-与增加的H+结合成HOAc,破坏了HOAc原有的离解平衡,使平衡左移即向生成共轭碱HOAc分子的方向移动,直至建立新的平衡。因为加入H+较少,溶液中OAc-浓度较大,所以加入的H+绝大部分转变成弱酸HOAc,因此溶液的PH值不发生明显的降低。 在缓冲溶液中加入少量强碱(如NaOH),则增加了溶液中OH-的浓度。假设不发生其他反应,溶液的PH值应该增大。但由于溶液中的H+立即加入的OH-结合成更难离解的H2O,这就破坏了HOAc原有的离解平衡,促使HOAc的离解平衡向右移动,即不断向生成H+和OAc-的方向移动 ,直至加入的OH-绝大部分转变成H2O,建立新的平衡为止。因为加入的OH-少,溶液中抗碱成分即共轭酸HOAc的浓度较大,因此溶液的PH值不发生明显升高。 在溶液稍加稀释时,其中[H+]虽然降低了,但[OAc-]同时降低了,同离子效应减弱,促使HOAc的离解度增加,所产生的H+可维持溶液的PH值不发生明显的变化。所以,溶液具有抗酸、抗碱和抗稀释作用。 多元酸的酸式盐及其对应的次级盐的作用原理与前面讨论的相似。例如,在NaH2PO4-Na2HPO4溶液中存在着离解平衡: HPO2-4是抗酸成分,通过平衡移能对抗外加酸的影响。H2PO2-4是抗碱成分,通过平衡右移能对抗外加碱的影响。 弱碱及其对应盐的缓冲作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能对抗外加酸的影响是抗酸成分,NH+4能对抗外加碱的影响是抗碱成分。前者通过下述平衡向右移动而抗酸,后者通过平衡向左移动而抗碱,从而使溶液的PH值稳定。
配制氨-氯化铵缓冲溶液是不添加哪个镁二钠盐行不行?乙二胺四乙酸镁二钠盐和乙二胺四乙酸二钠镁盐是一个东西吗
最近有一个样品PH值测试为3.52,因为PH值偏碱性不合格较常见,所以对测试结果怀疑,送样到第三方检测机构,检测结果PH值5.6感觉自己实验室测试有误差,就进行反复试验,找原因,最后确定缓冲溶液的精确度有问题,但又不知道怎么验证PH缓冲溶液精确度,大家有没有什么好方法?
缓冲溶液是生命体的一项重要特征,你眼中的缓冲溶液是什么?谈谈对缓冲容量的看法。
对溶液的酸度起稳定作用的溶液叫缓冲溶液。缓冲溶液能调节和控制备稳定溶液的PH值,其PH值不因加入酸、碱,或稀释而产生显著变化。如测硬度时,使用NH3.H2O-NH4Ci缓冲溶液,当溶液中产生少量H-时,H++OH- H2O,使溶液中﹝OH-﹞减少,NH3.H2O NH4+-OH-的反应向右进行,溶液中的OH-含量不会显著的减少。当溶液中产生少量OH-时,OH-+ NH4+ NH3.H2O的反应向右进行,溶液中的OH-含量不会显著增加,当溶液稀释时,H+、OH-浓度虽减少,但电离度增加,PH值亦不会发生显著变化。所以缓冲溶液能够起到稳定溶液PH值的作用
一、缓冲容量 (一)缓冲容量的概念 为了定量地表示缓冲溶液缓冲能力的大小,采用缓冲容量(也称缓冲指数或缓冲值)β来衡量。 定义:使1L或1ml缓冲溶液的pH值改 变一个单位所需加入一元强酸或一元 强碱的物质的量(mol或mmol), 称为该缓冲溶液的缓冲容量。
①样品的制备湖水和河水样品中加入浓度为25ng/L的各种喹诺酮抗生素,pH 调至4,在固相萃取前,样品要经过一个0.45μm的微孔滤膜以除去样品中的悬浮杂质。②固相萃取(SPE)C18柱(2×1 ml甲醇,1×1 ml纯水,1×1 ml醋酸钠缓冲溶液Ph4);水样的pH调至4,然后用大体积取样器离心管取250mL水样渗透过C18柱,然后用3×500μL的pH 4的醋酸钠缓冲溶液(含15%乙腈)洗C18柱,再真空干燥5分钟。然后,取3×1 ml的甲醇溶液(含6%氨)洗分析物,最后,样品提取物用氮蒸干然后溶解在250μL的pH2.5的甲酸中用于HPLC分析。③液相色谱法液相色谱分离物用200μL注射剂线性梯度洗脱,如下:从96% A(稀释的甲酸 pH2.5)和4% B(乙腈)到50% A和50% B,在25分钟内,检测波长为275nm。以上是我的实验步骤,具体想问问:1、在河水中取样后,怎样将水的pH 调至4?2、pH 4的醋酸钠缓冲溶液怎么配?3、稀释的甲酸 pH2.5 怎么弄?4、取3×500μL的pH 4的醋酸钠缓冲溶液(含15%乙腈),这个取法是什么意思?15%是质量分数吗?意思是pH 4的醋酸钠缓冲溶液取3×500μL,在此基础上满足含15%乙腈?是这样吗?问题有点多,希望好心人耐心讲解下哦!!先谢谢了!
缓冲溶液是怎么一回事每次做能力验证,都怕通过不了发愁,有的人为了方便通过,就选择一个简单的项目,比如pH等等。pH值是很难稳定的,经典的滴定分析中误差千分之一,所造成的突跃范围为4.30到9.70,达到了5.4个浓度单位。所以在这种体系中,想要测酸度也是很难的。所谓缓冲溶液,是指对溶液的酸度有稳定性作用的溶液。当向其中加入少量的酸碱的时候,或者稀释一定量的时候,其溶液的酸度基本上是保持不变的。我们常用的缓冲溶液是在酸度计的校正过程中使用的混合磷酸盐和邻苯二甲酸氢钾缓冲,他们的pH分别是6.86和4.00。配制该缓冲溶液的时候,你一不小心洒了一点,其实对这个体系没有什么影响。缓冲溶液的特性决定了体系的稳定性。作为缓冲溶液,本身有一个缓冲范围,只有pH在这个范围内,缓冲溶液才有缓冲效果,即其pKa值正负1的范围内。有一次,一位同事要配制4.0的错酸铵缓冲溶液,其酸度调节剂是醋酸,她加了几滴没反应,再加还是没反应,我就用分析化学的原理和她说,缓冲溶液非常稳定,是比值的对数关系,你只管加就行了。最后加了很多酸,才达到需要的酸度。按照缓冲溶液的基本公式,只是和缓冲溶液离子对的浓度比值有关系,和浓度没有关系,这个就错了。还有个缓冲容量的问题,不可能一滴缓冲溶液滴到大海里,整个大海的pH都随其发生改变。什么情况下缓冲溶液的缓冲效果最好呢?就是要在缓冲容量的范围内,通常情况下缓冲组分的浓度值在0.01-1mol/L之间。缓冲溶液浓度过大会增加离子的强度,对体系还是有副作用的。生命体本身是一个稳定的体系,也是一个缓冲体系。所以我们体内的各项生理指标相对稳定,目前缓冲溶液在生物化学的研究中具有重要的研究意义。我们单位检测的番茄酱产品,其pH也大多数情况下稳定在4.2左右。说到这块,我又想到当年的一个笑话,就是用pH试纸测定5%盐酸的酸度,其结果肯定是酸性结果。试纸只能测定正常生命体系的pH,化学条件下的酸度,还是要依赖于酸度计进行检测。试纸可以测测自来水的酸度,也可以测测苹果的酸度
有2点疑问:(1)硼酸缓冲溶液是指硼砂-氢氧化钠缓冲溶液还是硼酸-硼砂缓冲液(2)要配置含有0.005mol/L的巯基乙醇的0.05mol/L硼酸盐缓冲溶液(PH 8.8)该如何配置,重点就是这个巯基乙醇。由于未接触过这些,只是查了些常用缓冲溶液的配置方法,未查到含有巯基乙醇的配置方法,还望各位大侠帮帮忙,谢谢了
[img]http://ng1.17img.cn/bbsfiles/images/2009/08/200908310830_168620_1610969_3.jpg[/img]缓冲溶液 简介 缓冲溶液(英文:buffer solution)是[color=#DC143C]一种能在加入少量酸或碱和水时大大减低pH变动的溶液[/color]。pH缓冲系统对维持生物的正常pH值和正常生理环境起到重要作用。
缓冲溶液经常作为流动相使用,其为系统提供了稳定的PH范围,改善了分离和峰形。那么,在使用缓冲溶液作流动相时,应注意哪些方面?作为本期讨论话题,大家可从配制、使用、清洗、维护、色谱柱、泵等各个方面说下自己的观点。[color=#DC143C]小结:[/color]1、配制时注意调节PH值。2、使用前注意过滤和脱气。3、流动相切换时注意含有少量有机相的水充分置换、过渡,不可直接用有机相替换,防止盐析出。4、做好不要让含有缓冲盐的流动相在系统或色谱柱中过夜,使用后应置换成有机相。5、泵头用纯水清洗干净;进样阀也需清洗。6、配好的缓冲盐溶液不要长时间使用,最好2--3天重新更换(易滋生微生物)。7、磷酸盐、乙酸盐缓冲液很易长霉,应临用现制。8、容器应定期清洗,以除去底部的杂质沉淀和可能生长的微生物。9、应选择具有与流动相的pH相近的pKa 的缓冲液(浓度稀也具有较强能力的缓冲液)10、 即使确认检测波长下缓冲液是否有大的吸收(在波长210nm附近进行检测时,不能用醋酸和柠檬酸的缓冲液)
高效液相色谱测三聚氰胺的离子对缓冲溶液国标国标要求PH3.0,我用氢氧化钠溶液调节PH,不小心调到了3.08,,,这个缓冲溶液还能用吗?对后续的三聚氰胺的检测有影响吗?求回复!!
1.碱性缓冲溶液有哪些?2.哪些缓冲溶液能更好的稳定PH?3.有哪些缓冲溶液同时能做掩蔽剂的?
(一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使增加5000倍左右(由1.0×10-7增至5×10-4 mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,的增加不到百分之一(从1.00×10-7增至1.01×10-7 mol·L-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)[font=Arial
我们做络合滴定时经常要用到缓冲溶液,比如我做锌时用乙酸-乙酸钠缓冲溶液(PH5.6),一般是称取300克无水乙酸钠,溶解后倒入2000ml的容量瓶中,加入100ml36%的乙酸,加水稀释至刻度,摇匀,即得。 那如果我们称取无水乙酸钠100克+33.3ml36%乙酸,pH一样,但缓冲容量与上述的相差多少?这样是否可行?或许更低呢?一般对这个有怎样的要求?
电泳分离时,电渗流不断向负极涌动,理论上是不是应该放在负极这边的缓冲溶液瓶里会液体越来多,而放在正极这边的缓冲溶液瓶里的液体会越来越少?但我试过,跑了5个小时却看不出液面变化?阳离子向负极跑,阴离子向正极跑,电泳完了是不是放在正极这边的缓冲溶液瓶里负电荷就多了,而放在负极这边的缓冲溶液瓶里阳离子就多了呢?跑CE时用的分离缓冲溶跑多久后换新的更好呢?
文章中没有显示公式啥的 http://simg.instrument.com.cn/bbs/images/brow/em09508.gif想下载的可以找到链接 进行下载资料库————缓冲溶液的配制与性能http://www.instrument.com.cn/download/shtml/204329.shtmlhttp://simg.instrument.com.cn/bbs/images/brow/em09505.gif缓冲溶液的配制与性能一 实验目的(1)学习缓冲溶液的配制方法,加深对缓冲溶液性质的理解(2)了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系:(3)练习吸量管的使用方法。二 实验原理 能抵抗外来少量强酸、强碱或适当稀释而保持pH值基本不变的溶液叫缓冲溶液。缓冲溶液一般是由弱酸及其盐、弱碱及其盐、多元弱酸的酸式盐及其次级盐组成。缓冲溶液的pH值可用下式计算: 或 缓冲溶液pH值除主要决定于pKb(pKb)外,还与盐和酸(或碱)的浓度比值有关,若配制缓冲溶液所用的盐和酸(或碱)的原始浓度相同均为C,酸(碱)的体积为Va(Vb),盐的体积为Vs总体积为V,混合后酸(或碱)的浓度为 ,盐的浓度为 ,则 所以缓冲溶液pH值可写为 或 配制缓冲溶液时,只要按计算值量取盐和酸〔或碱)溶液的体积,混合后即可得到一定pH值的缓冲溶液。缓冲容量是衡量缓冲溶液的缓冲能力大小的尺度。为获得最大的缓冲容量,应控制 (或 )=1,酸[font
配制的缓冲溶液一般可用多长时间?缓冲溶液可以回收使用么?
pH缓冲溶液是一种能使pH值保持稳定的溶液。如果向这种溶液中加入少量的酸或碱,或者在溶液中的化学反映产生少量的酸或碱,以及将溶液的pH值基本上稳定不变,这种能对抗少量酸或碱或稀释,而使pH值不易发生变化的溶液就称为pH缓冲溶液。pH标准缓冲溶液具有以下特点:1.标准溶液的pH值是已知的,并达到规定的准确度。2.标准溶液的pH值具有良好的复现性和稳定性,具有较大的缓冲容量,较小的稀释值和较小的温度系数。3.溶液的制备方法简单。
常用PH缓冲溶液 Common pH Buffer Solutions 在化学中,有一类能够减缓因外加强酸或强碱以及稀释等而引起的pH急剧变化的作用的溶液,此种溶液被称为pH缓冲溶液。pH缓冲溶液一般都是由浓度较大的弱酸及其共轭碱所组成,如HAc-Ac-,NH4+-NH3等,此种缓冲溶液具有抗外加强酸强碱的作用,同时还有抗稀释的作用。在高浓度的强酸或强碱溶液中,由于H+或OH-浓度本来就很高,外加少量酸或碱基本不会对溶液的酸度产生太大的影响。在这种情况下,强酸(pH12)也是缓冲溶液,但此类缓冲溶液不具有抗稀释的作用。 在分析化学中用到的缓冲溶液,大多数是用于控制溶液的pH,也有一部分是专门用于测量溶液的pH值时的参照标准,被称为标准缓冲溶液。
这里开给题目,大伙儿来聊聊HPLC中使用缓冲溶液的情况:When/Why:什么时候/为什么加入缓冲溶液;How:如何配制缓冲溶液;实验后如何清楚缓冲溶液。。。。。。理论的、实践的都可以说说
都知道缓冲溶液是液相色谱流动相应用最多的,那你知道缓冲溶液的流动相体系对被测组分的洗脱原理是什么吗?
[color=#444444]求问:测紫外光谱在文献中,配pH=2.5的缓冲溶液用的是磷酸三乙胺缓冲溶液,为什么不用磷酸和胺的缓冲溶液或者其他pH可以达到2.5的缓冲溶液,想问问磷酸三乙胺有什么好处呢?[/color]
维权声明:本文为zlhuang0132原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。pH缓冲溶液的组成、作用及计算zlhuang0132 pH缓冲溶液是分析测试中应用最为广泛的试剂溶液。其作用是用来稳定溶液的pH值,以满足测试中对恒定pH的要求。虽然pH缓冲溶液的组成并不复杂,但关于pH缓冲溶液的计算却是酸碱滴定分析中计算最为复杂的内容。下面介绍一下pH缓冲溶液的组成和各种类型的化学计算方法。1 pH缓冲溶液的组成和作用1.1 pH缓冲溶液的类型与作用 pH缓冲溶液包括两大类:标准缓冲溶液和普通缓冲溶液。 标准缓冲溶液主要用在酸度计测量溶液pH值时的仪器校正和定位,要求数值准确、精确。因此对试剂纯度、浓度准确性、温度等都有严格要求,这类缓冲溶液有专门的化学试剂商品,可以购买配制,也可以用优级纯试剂按资料的配比配制。 普通缓冲溶液主要用于化学分析和仪器分析中要控制一定pH值的测定过程中。几乎所有的EDTA络合滴定都必须在一定的pH范围内进行,因此,需要加入pH缓冲溶液,例如,测定铅、锌用到HAc缓冲溶液,测定钙、镁、锌用到氨缓冲溶液。又如,氧化还原滴定中,碘量法测铜要用到NH4HF2,碘量法测砷、锑要加NaHCO3。 普通缓冲溶液的配制并不需要像标准缓冲溶液配制那样严格和苛刻,因为对缓冲溶液的pH值要求并不需要非常精确,因此,可以用分析纯试剂来配制,也可以用已有的酸、碱、盐溶液来“搭配”(后述)。1.2 普通pH缓冲溶液的类型 普通pH缓冲溶液按组成不同可分三大类:弱酸-弱碱型缓冲溶液(即共轭酸碱缓冲溶液)、酸式盐缓冲溶液、强酸或强碱溶液。在一些特殊情况下也使用混合体系的缓冲溶液(两种pKa相近的共轭酸碱缓冲溶液混合而成)。大家比较熟悉的是共轭酸碱缓冲溶液,例如,HAc-NaAc、HF-NH4F、NH3-NH4Cl。其实,酸式盐也可作为缓冲溶液,因为酸式盐的pH值大多是恒定的,随其浓度增减的变化不大,例如,NaHCO3溶液在1.0M至0.01M之间,其pH值几乎都在8左右(理论值为8.3),同样可以抵抗溶液中产生的少量强酸、强碱(或外加),保持溶液的pH值恒定或变化微小。强酸、强碱溶液也能缓冲滴定过程中产生的少量强酸或强碱,保持溶液的pH值变化很小,故强酸强碱也可作为广义的pH缓冲溶液(以前的分析化学教材就是这样分的),例如,EDTA络合滴定铋,需另外加入一定量的0.1mol/L硝酸溶液,就是为了增强溶液对滴定中产生的H+的缓冲作用。下面重点介绍最常用的共轭酸碱缓冲溶液的相关知识。 弱酸-弱碱型缓冲溶液的构成与配制。这类缓冲溶液的组成为:弱酸+弱酸盐(即共轭碱)、弱碱+弱碱盐(即共轭酸)。常见的实例有:HAc-NaAc、[font=Tim
前一阵子再做一个项目时发现分别用用磷酸、高氯酸、磷酸二氢钾、庚烷磺酸钠配制的缓冲溶液效果不一致。只有用庚烷磺酸钠配制的缓冲溶液在分析该产品时出峰较为正常。现想咨询下各位前辈,在分析哪类产品时适用哪类缓冲盐,有没有诀窍啊,希望各位来谈谈经验!