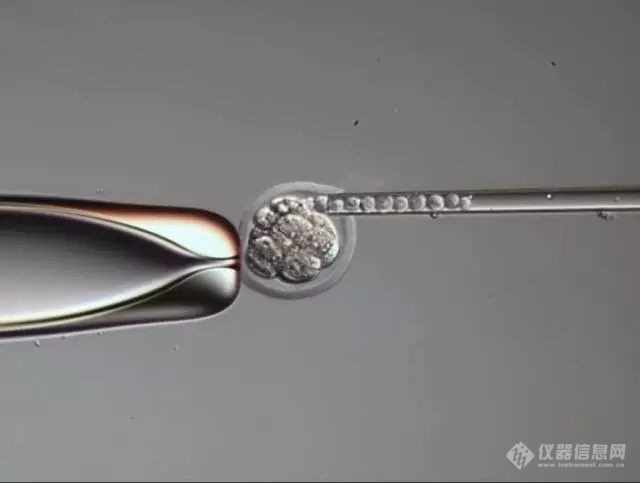
多功能单细胞显微操作技术在病毒研究中的应用 ——在单病毒粒子--单细胞水平上研究病毒的感染
病毒的感染研究通常是在大量细胞实验中进行的,一般要将许多培养细胞同时暴露于病毒中,这就使得研究单个病毒侵入事件和研究病毒在单个细胞之间的感染传播十分困难。多功能单细胞显微操作FluidFM技术通过温和的、微通道和力反馈控制的探针,将单个病毒粒子突破性的沉积在选定的单个细胞上,从而实现前所未有的控制,在单个病毒粒子--单个细胞水平上研究病毒感染。FluidFM技术可以帮助阐明关于毒性、病毒复制或宿主免疫应答的基本问题,从而促进新型抗病毒药物和疫苗的开发。放置单个病毒粒子单个病毒粒子可以被放置在您选择的细胞上的确切位置注入单个病毒粒子直接将单个病毒粒子注入特定细胞的细胞质或细胞核中测量生物量的变化测量细胞硬度的变化和单细胞力谱对感染细胞进行分离、提取和分析分离被感染的细胞,或进行单细胞活细胞提取,进而进行测序、质谱等分析观察和监测通过集成的成像系统和追踪软件对细胞进行长时间连续监测 FluidFM技术如何提升您的病毒学实验? 1. 在病毒感染方面获得全新的视角FluidFM技术为病毒学研究引入了新的实验可能性,允许在贴壁细胞培养中控制病毒粒子与您所选择的细胞进行的相互作用。这为我们提供了全新的视角:细胞进入和感染机制方面;细胞反应、病毒协同性和病毒生命周期阶段;增殖,扩散率和细胞间感染方面FluidFM操作病毒的工作原理 2. 量化宿主防御和病毒协同性通过在细胞上放置一定数量的病毒粒子,宿主细胞对病毒的防御就可以被量化。因此,可以研究感染概率、宿主防御的局限性以及病毒粒子之间的合作关系。1个病毒粒子通过FluidFM微管的空心悬臂准备放置。图片由苏黎世联邦理工学院P. Stiefel提供。4个病毒粒子沉积在一个选定的单细胞上。图片由苏黎世联邦理工学院P. Stiefel提供。 3. 监测病毒在细胞间传播FluidFM技术一体机集成了CO2和温度控制的活细胞模块,同时也集成了成像模块。这保证了受感染细胞的细胞培养环境,并与软件支持的自动追踪功能一起,允许长时间观察受感染或操纵受感染细胞。这使得我们可以详细了解病毒感染是如何从宿主细胞传播到邻近细胞乃至传播到其他培养细胞的。 4. 将单个受感染细胞导入正常培养基,或将单个正常细胞导入处理培养基轻柔地从贴壁或悬浮培养中取出单个细胞,以高的精度定位地将其放入另一个孔板中,这样的操作可以充分保证细胞的活力。使得将单个感染细胞引入健康培养基后的进一步研究成为可能。同样的方法也可以用于将健康细胞、耐药细胞或药物处理后的细胞放置于受感染的培养基中。分离单个细胞 5. 单细胞活细胞的提取,以便进一步分析FluidFM技术可以根据形态学或荧光标记从培养物中分离出单个细胞。在保持完全存活的情况下,这些感兴趣的细胞可以在新的培养皿中扩增,或进行进一步的蛋白质组学或转录组学分析。甚至可以进行单细胞活细胞检测,如Live-Seq、TOF等。 6. 从感染的单细胞中获得单细胞力谱FluidFM探针集成了力学反馈功能,允许定量的机械相互作用,可达pN别的力学分辨率。测量由单个细胞感染引起的生物物理变化,如硬度的变化,粘附力的变化,甚至质量的变化。因此,FluidFM可以将病毒在宿主细胞上引起的形态变化与机械变化联系起来。单个细胞从完全贴壁、融合的培养状态中被拽离出来,并记录单细胞力谱。视频由德国Würzburg大学医药与牙医科学院A. Sancho和J. Groll提供参考文献:[1]. Koehler, M., Petitjean, S.J.L., Yang, J., Aravamudhan, P., Somoulay, X., Lo Giudice, C., Poncin, M.A., Dumitru, A.C., Dermody, T.S. & Alsteens, D. Reovirus directly enganges integrin to recruit clathrin for entry into host cells. (2021) Nature communications, 12, 2149.[2]. J. Yang, J. Park, M. Koehler, J. Simpson, D. Luque, J.M. Rodriguez & D. Alsteens. Rotavirus Binding to Cell Surface Receptors Directly recruiting a-integrin. (2021). Advanced Nanobiomed Research.[3]. Guillaume-Gentil, O., Rey, T., Kiefer, P., Ibáñez, A. J., Steinhoff, R., Brönnimann, R., Dorwling-Carter, L., Zambelli, T., Zenobi, R., & Vorholt, J. A. (2017). Single-Cell Mass Spectrometry of Metabolites Extracted from Live Cells by Fluidic Force Microscopy. Analytical Chemistry, acs.analchem.7b00367.[4]. Guillaume-Gentil, O., Grindberg, R. V., Kooger, R., DorwlingCarter, L., Martinez, V., Ossola, D., Pilhofer, M., Zambelli, T., & Vorholt, J. A. (2016). Tunable Single-Cell Extraction for Molecular Analyses. Cell, 166(2), 506–516.[5]. Guillaume-Gentil, O., Zambelli, T., & Vorholt, J. A. (2014). Isolation of single mammalian cells from adherent cultures by fluidic force microscopy. Lab on a Chip, 14(2), 402–414.[6]. Guillaume-Gentil, O., Potthoff, E., Ossola, D., Dörig, P., Zambelli, T., & Vorholt, J. A. (2013). Force-controlled fluidic injection into single cell nuclei. Small, 9(11), 1904–1907.[7]. P. Stiefel, F.I. Schmidt, P. Dörig, P. Behr, T. Zambelli, J. A. Vorholt, and J. Mercer. Cooperative Vaccinia Infection Demonstrated at the Single-Cell Level Using FluidFM. Nano Letters, 2012.