在研究新药过程中,由于实验医学的存在,尤其在新药毒性评价方面,用动物进行试验减少了许多人的牺牲。虽然动物实验做的再多,也无法完全预测人用后的结果,但是,如果能做的工作不尽心去做,那么新药在人身上使用的风险将会更大。在药效学研究和非临床安全性研究过程中,正确选择实验动物对实验结果判断、对新药评价结论是至关重要的。 在新药注册申报资料中,因为选用实验动物出现一些问题,影响了对实验结果的判断、妨碍了对申报资料的评价。有时因此不得不重新进行实验。这样,不仅造成经济上的损失,更重要的是减慢了新药的注册速度,延长了产品的上市时间。如何减少这些因为实验选择不当的实验动物而出现的错误,是一个值得关注的问题。怎样做才能减少或者避免这类错误呢?针对这些在注册资料中经常出现不正确选择实验动物的问题,进行一下相关的讨论是十分必要的。下面从三方面进行讨论,首先应该由从事药理实验工作的人员进行实验设计和实施动物实验,其次要了解实验动物的特点和实验的要求,第三要理解新药注册申报资料要求的目的和意义。一、应由专门从事药理实验工作的人员进行实验设计和实施实验。 这个问题似乎不应是个问题,但它的确是个现实问题。在1993年“西药临床前研究指导原则”总则、“1993年中药新药研究指南”药效内容和毒理内容对实验人员都有明确的基本要求;2005年“药物研究技术指导原则”中虽然没有类似内容,但在《药品注册管理办法》第三章第十六条、第十七条都涉及了实验人员资质问题,并对非临床安全性研究执行GLP规范进行了明确,其中包括对参与实验人员资质的要求。在申报资料中出现过不能排除是不具有药理毒理实验资质人员进行的实验之类的问题,比如出现一些动物常规指标的错误、选择动物性别的错误、选择不适宜实验动物的错误、超出动物药容积的错误……,这些不是理解层面的问题,也不是实践经验积累的问题。还有一些实验需要专门的技能和长期实践积累人员进行,比如特殊毒理实验、病理组织检查实验、放射免疫测定实验……,如果实验人员不符合要求,出现的问题常常是无法解决的,实验结果也是不可信的。只有符合要求的人员设计实验、实施实验,才能保证选择实验动物的科学性,为开展正式的实验打下基础。
实验动物房是指适宜于饲养、繁育实验动物的建筑物。相对于其他类型的实验室环境,实验动物房对环境的稳定性、舒适性和安全性的要求都更加严格,以保证动物的品质和实验研究的准确可靠性。实验动物微生物控制标准,可将实验动物分为四级:一级——普通动物(CV):系指微生物不受特殊控制的一般动物。要求排除人兽共患病的病原体和极少数的实验动物烈性传染病的病原体;二级——清洁动物(CL):要求排除人兽共患病及动物主要传染病的病原体;三级——无特殊病原体动物(SPF):要求到二级外,还要排除一些规定的病原体;四级——无菌动物(GF)或栖生动物(GN):无菌动物要求不带有任何用现有方法可检出的微生物。栖生动物要求在无菌动物体上植入一种或数种已知的微生物。实验动物房一般由饲养室、健康观察室、隔离检疫室、各种实验室(外科手术、实验处理解剖、术后管理、疾病诊断、治疗、生理生化检查、微生物检疫、饲料营养分析和特殊饲料的调制室等),以及贮藏室、清洁准备室、洗涤消毒室、工作人员用房(包括办公室、淋浴室、更衣室等)、走廊(清洁区和污染区)、废弃物处理设施、机房和变电所等组成。实验动物房的布置,应使人、动物和物品的流动路线合理,作业方便。严格区分屏障区域和阻隔区域,对于阻隔区和屏障区要进行专门设计灭菌、消毒和保护规程,以保证人和动物的健康,确保实验的准确性。实验动物房内部空间的建筑材料和表面涂料通常要达到生物安全2级建筑标准的要求。主要内墙所用的建筑材料要兼顾动物的各种需要和清洁卫生要求。内墙建筑材料要平滑、耐久、耐腐蚀、防火、防潮,不会轻易出现破碎、裂缝、生锈等状况。地面要平而不滑,不渗水、不漏水、耐药液腐蚀和耐磨损。对环境要求严格的房间,还要考虑选择发尘低的材料。墙地交角应圆滑无棱角。墙与墙、墙与顶棚或梁的夹角应圆滑无棱角。顶棚一般不承受压力,使用涂有防水材料的薄水泥板,能经受水冲和消毒水腐蚀。饲养室通常不设外窗,饲养室之间也不设内窗,以避免干扰。饲养室的门,宜采用铝合金密封门,开启方向须注意室内外压差。屏障与非屏障之间的门,应设置非满足一定条件不能开启的装置。在动物实验室中,采用设置压力区的方法来控制空气污染物和过敏源的路径。一般情况下,屏障区要维持正压,阻隔区要维持相对负压。不同的设施,如动物饲养室与走廊之间的压差大小是变化的,多数情况下采用的压力范围是0.03到0.075英寸水柱,并且在压差过低的时候报警。在温度及相对湿度控制方面,实验动物房也需要一套稳定的通风控制系统来维持正确的环境参数,温度要求非常关键,要控制到设定值的±1℃,温度设定值为16-29℃之间。空调系统须长年运行,否则将带来灾难性后果,因此,必须设有备用的空调机组。大多数情况下,相对湿度控制的目标位30%-70%之间,其设定值在50%-55%。对于一些非主要房间,可以多房间系统可以作为一个单独区域来控制,以节省成本。一点建议,欢迎大家补充说明!原文链接
[font=&][size=16px][color=#333333]点击链接查看更多:[url]https://www.woyaoce.cn/service/info-39892.html[/url]服务背景[/color][/size][/font][font=&][color=#333333][/color][/font][font=宋体][size=16px]中广测动物实验检测领域主要从事食品及保健食品、洗涤消毒产品、化妆品、化学品的毒理学检测工作,可出具CMA认证检测报告。[/size][/font][font=宋体][size=16px][/size][/font][font=宋体][size=16px]实验室位于中山市火炬高技术开发区,场地面积800m2,其中动物实验区域400m2,其他实验区域400m2。动物实验饲养区域包括屏障设施(180m2)及普通设施(90m2)。配套有细胞实验室、微生物实验室、分子生物学实验室、临床病理检验室等。实验动物房建成于2018年,经广东省科技厅验收合格后投入使用。2019年取得广东省科学技术厅颁发的《实验动物使用许可证》,许可使用实验动物种类包括SPF级大、小鼠,普通级兔、豚鼠。[/size][/font][font=&][size=16px][color=#333333]检测内容[/color][/size][/font][font=&][color=#333333][/color][/font][align=center][font=宋体][size=16px][img=000.jpg]https://img2.17img.cn/pic/kind/20220706/20220706155246_0476.jpg[/img][/size][/font][/align][font=宋体][size=16px][/size][/font][font=宋体][size=16px]服务范围[/size][/font][font=宋体][size=16px]毒理学试验项目主要有:急性吸入毒性试验、急性经口毒性试验、急性经皮毒性试验、眼刺激试验、皮肤刺激试验、皮肤致敏试验、光毒性试验,也可开展Ames试验、哺乳动物骨髓细胞微核试验、小鼠精子畸形试验、哺乳动物骨髓细胞染色体畸变试验、致畸试验等体内体外遗传毒性试验,以及亚慢性、慢性毒性试验。同时可开展药品的成药性评价(非GLP)工作。[/size][/font][font=宋体][size=16px]在科学研究方面,可开展中医药特色动物模型的构建与中药药效评价工作,为各大药企、科研院所及高校提供动物实验科研辅助管家服务。[/size][/font][font=宋体][size=16px] [/size][/font][font=宋体][size=16px]设备仪器[/size][/font][font=宋体][size=16px]全身全相态动态染毒柜、烟熏箱、吸入麻醉机、高压灭菌器、高速离心机、超净工作台、生物安全柜、全自动生化分析仪、全自动凝血分析仪、动物五分类血液细胞分析仪、肺功能检测仪,全套自动化病理设备、生化培养箱、光照培养箱、CO2培养箱 、万级洁净室、超低温冰箱、正倒置显微镜、冷冻离心机、冷冻研磨仪、台式恒温震荡摇床、超微量紫外分光光度计、荧光定量[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]仪等设备。[/size][/font][font=&][size=16px][color=#333333]检测标准[/color][/size][/font][font=&][color=#333333][/color][/font][table][tr][td]产品名称[/td][td]检测项目[/td][td]检测标准[/td][/tr][tr][td]动物实验[/td][td]动物实验[/td][td]动物实验[/td][/tr][/table]
请教各位!各位有没有参加过动物实验室认可的?认可准则是CNAS-CL06《实验动物饲养和使用机构质量和能力认可准则》。现在已经有CNAS的资质了,申请这个资质的话是在原来的四级文件中加入这一部分还是要重新建立一个四级文件?谢谢!

在生命科学、医学和药学研究领域,对一些难以在人身上进行的工作,需要使用动物来代替人类进行实验研究。为了保证实验科学、准确和重复性,我们需要将研究的生理或病理活动相对稳定地显现在标准化的实验动物身上。这些标准化的动物就称之为实验动物。常见的实验动物包含:秀丽线虫(caenorhabditis elegans),果蝇(drosophila melanogaster),斑马鱼(zebrafish),小鼠(mouse),大鼠(rat)等。为达到满意的实验效果,实验动物需要通过科学的方法进行饲养,尤其是对其食用的食物和饮水都有非常严格的规定。国务院于1988年批准《实验动物管理条例》,要求一级实验动物的饮水,应当符合城市生活饮水的卫生标准。二、三、四级实验动物的饮水,应当符合城市生活饮水的卫生标准并经灭菌处理。一般的自来水的质量,无法完全满足这一要求,而且水质也不稳定。目前饲养实验动物主要使用RO纯水。RO水完全满足城市生活饮水的卫生标准,经过管道运输的RO水,可以在管道内安装254 nm紫外灯和0.2 μm囊式滤器进行除菌。如果有需要,可以对RO水进行高温高压再次灭菌或添加盐酸(或次氯酸钠)进行酸化。实验动物的饮水器具也很重要。饮水器具包括自动饮水器和饮水瓶:前者需要供水管路,自动化程度高;后者简单廉价,需要加强管理。饮水器具确保安全卫生,材料必须无毒害,要经常查看以避免微生物繁殖。特别需要注意的是,斑马鱼等水生实验动物的饲养需要并且仅仅需要RO水即可。电导率小于 1 μS/cm的纯水含氧量过低,不利于水生实验动物呼吸;超纯水去除了金属离子过于干净,使得鱼生长所必须的一些痕量元素也同时被去除,这对鱼的生长和健康都是有害的;另外,斑马鱼对水的pH变化非常敏感,而超纯水很容易吸收空气中的二氧化碳,形成碳酸pH值容易降低到5.6左右;纯度过高的超纯水,还会导致水生实验动物渗透压变化,使细胞破裂死亡。
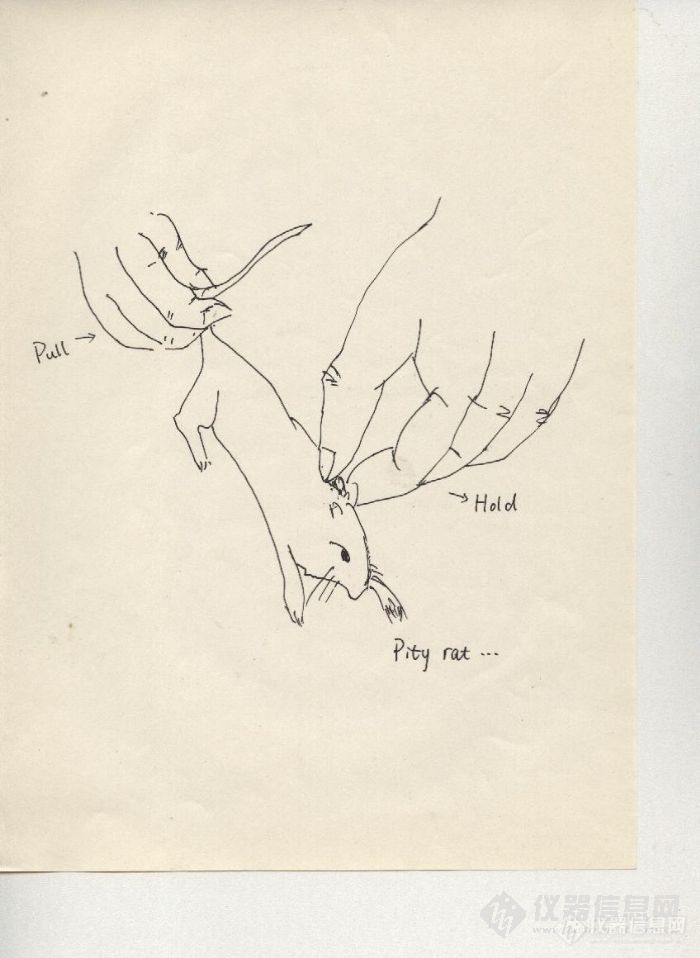
1.实验动物的抓取和固定小鼠性情较温顺,一般不会咬人,比较容易抓取固定。通常用右手提起小鼠尾巴将其放在鼠笼盖或其它粗糙表面上,在小鼠向前挣扎爬行时,用左手拇指和食指捏住其双耳及颈部皮肤,将小鼠置于左手掌心、无名指和小指夹其背部皮肤和尾部,即可将小鼠完全固定。在一些特殊的实验中,如进行尾静脉注射时,可使用特殊的固定装置进行固定,如尾静脉注射架或粗的玻璃试管。如要进行手术或心脏采血应先行麻醉再操作,如进行解剖实验则必须先行无痛处死后再进行。2.实验动物的麻醉方法麻醉(anesthesia)的基本任务是消除实验过程中所至的疼痛和不适感觉,保障实验动物的安全,使动物在实验中服从操作,确保实验顺利进行。(一)常用局部麻醉剂:普鲁卡因,此药毒性小,见效快,常用于局部浸润麻醉,用时配成0.5%~1%;利多卡因,此药见效快,组织穿透性好,常用1%~2%溶液作为大动物神经干阻滞麻醉,也可用0.25%~0.5%溶液作局部浸润麻醉。(二)常用全身麻醉剂:1. 乙醚 乙醚吸入法是最常用的麻醉方法,各种动物都可应用。其麻醉量和致死量相差大,所以其安全度大。但由于乙醚局部刺激作用大,可刺激上呼吸道粘液分泌增加;通过神经反射还可扰乱呼吸、血压和心脏的活动,并且容易引起窒息,在麻醉过程中要注意。但总起来说乙醚麻醉的优点多,如麻醉深度易于掌握,比较安全,而且麻醉后恢复比较快。其缺点是需要专人负责管理麻醉,在麻醉初期出现强烈的兴奋现象,对呼吸道又有较强的刺激作用,因此,需在麻醉前给予一定量的吗啡和阿托品(基础麻醉),通常在麻醉前20-30分钟,皮下注射盐酸或硫酸吗啡(每公斤体重5~10mg)及阿托品(每公斤体重0.1mg)。3.实验小鼠的给药方法在动物实验中,为了观察药物对机能功能、代谢及形态引起的变化,常需将药物注入动物体内。给药的途径和方法是多种多样的,可根据实验目的、实验动物种类和药物剂型等情况确定。 (一)给药方法1.注射给药(1)皮下注射给药皮下注射给药是将药液推入皮下结缔组织,经毛细血管、淋巴管吸收进入血液循环的过程。作皮下注射常选项背或大腿内侧的皮肤。操作时,常规消毒注射部位皮肤,然后将皮肤提起,注射针头取一钝角角度刺入皮下,把针头轻轻向左右摆动,易摆动则表示已刺入皮下,再轻轻抽吸,如无回血,可缓慢地将药物注入皮下。拔针时左手拇、食指捏住进针部位片刻,以防止药物外漏。注射量约为0.1-0.3ml/10g体重。(2)皮内注射给药是将药液注入皮肤的表皮河真皮之间,观察皮肤血管的通透性变化或皮内反应,接种、过敏实验等一般作皮内注射。先将注射部位的被毛剪掉,局部常规消毒,左手拇指和食指按住皮肤使之绷紧,在两指之间,用结核菌素注射器连接4.5针头穿刺,针头进入皮肤浅层,再向上挑起并梢刺入,将药液注入皮内。注射后皮肤出现一白色小皮丘,而皮肤上的毛孔极为明显。注射量为0.1ml/次。(3)肌肉注射给药小鼠体积小,肌肉少,很少采用肌肉注射。当给小鼠注射不溶于水而混悬于油或其他溶剂中的药物时,采用肌肉注射。操作时1人保定小鼠,另一人用左手抓住小鼠的1条后肢,右手拿注射器。将注射器与半腱肌呈90°角迅速插入1/4,注入药液.用药量不超过0.1ml/10g体重.
实验室在很多行业里面起到了巨大的作用,在很多产品发展之初都在相关实验室里面进行过上百甚至上千次的试验。所以我们在实验室的设计规划之初,就应该对实验室的类型和配套仪器进行准备构思,设计出一个缜密、实用、美观的实验室。实验动物房是近年来比较热的话题,很多人对此有很多的不了解之处,并希望咨询相关问题,上海简朗系统为您解答实验动物房的净化方式。A.空气净化系统因为动物房是实验动物较长时间活动的场所,室内不可能在饲育条件下经常用薰蒸冲洗的方式灭菌,一般只能用药力较弱的消毒液檫洗,在这种情况下为了避免微生物侵染,保证空气净化则是首要条件;B.全新风 防止污染和除臭是两个难题,为此,净化空调系统大部分必须采用全新风方式,但由于净化系统换气次数大,又是全新风,所以能耗问题突出;C.除臭这不仅是对外部环境和工作人员所必须,而且也是实验动物本身所必须。因为室内除外界微生物污染外,动物本身排泄物和微生物二次转化生成的氨、硫化氢、醇等气体,也是重要的污染物质,这些气体臭味愈浓烈,说明动物本身的洁净度愈低。目前还无臭气允许值的定量资料和测定方法,但对于氨浓度应进行控制。除臭一般有增加新风和活性炭吸附两种方法。上海简朗工程技术公司,十多年实验室工程设计与施工承包能力,为您的实验室建设提供全程专业优质服务。咨询电话:021-36537836 网址:http://www.jlsystem.com.cn/
请教各位如下几个问题: 1、从事动物实验的技术人员其待遇福利有没有哪个相关的法规上规定的? 2、如果没有,你所在的单位或你所了解的单位从事动物实验的人员有些什么福利?例如岗位补贴、健康补贴、加班值班补贴或者其他什么的补贴??有的话大概有多少? 3、如果你对动物实验行业或毒理方面有所了解,你认为从事这行业的人员应该得到什么样的福利? 请各位解答以上问题或发表你的看法,解答或意见一经采纳或被认为有帮助,即刻洒分~~先谢谢各位了。
广东省中医院(广州中医药大学第二附属医院)目前已发展成拥有一家总院及四家三甲级分院的大型区域辐射型中医医院,是一间集医疗、教学、科研为一体的现代化综合性中医院。新成立的广东省中医药科学院挂靠在我院并由我院组织筹建。中心实验室是广东省中医急症重点实验室、广东省中医证候临床研究重点实验室、证候分子生物学实验室、中药制剂学实验室、全国中药制剂和剂型改革基地、国家食品药品监督管理局GCP研究中心等专业实验室的重要组成部分。其中中医急症重点实验室、中药药理实验室和中药制剂学实验室又是国家中医药管理局三级实验室。 实验动物实验中心隶属于我院中心实验室,于1996年7月建成,10月份经广东省实验动物监测所检测符合清洁级标准,当年投入使用,是我省首批取得实验动物使用许可证的单位之一。当时的动物实验室约120m2,可以同时容纳200只大鼠、200只小鼠和30只兔子。根据广东省科技厅粤科财字[2003]26号和广东省实验动物监测所粤检测所函字[2005]13号文,本院清洁级实验动物实验室2005年曾经降低等级使用,由适用范围为清洁级变更为普通级。为适应医院“建设现代化综合性中医院典范”的发展战略要求和贯彻落实省委省政府关于建设中医药强省战略部署要求,2004年医院党委决定在广东省中医院大学城分院科技楼八层新建1个1247m2(不含九楼机组和净化水用房)的大型SPF级动物实验中心。2008年9月SPF级动物实验中心经过广东省实验动物学会的严格论证,高分获得通过,取得了广东省实验动物设施使用许可证【SYXK(粤)2008-0094】并正式投入使用。
各位大神,有事请教[img]https://simg.instrument.com.cn/bbs/images/brow/em61.gif[/img] 本中心欲扩项猪和水貂项目,CNAS对猪和水貂的供应商及采购要求与SPF鸡一样吗? 比如:SPF鸡的供应商要有营业执照、生产许可证等,采购后有合格证,猪跟SPF鸡一样属于实验动物,猪的需要准备哪些证件?;而水貂属于特种动物,又需要准备哪些证件呢? 迷茫中,请各位大神不吝指教!
一、前言 为增进动物福祉,人类对于应用动物于科学目的应具备3Rs:替代(Replacement)、减量(Reduction)及改进(Refinement)的认知。这当今国际认证的3Rs即行动试验(animal experimentation)的研究人员应有的道德观念。将动物试验标准化除可增进试验的重复性(reproducibility),是遵循3Rs原则中减量与精致化的最基本策略,而将实验动物房舍设施标准化则是使动物试验标准化的最基本硬设备。近20年来,国内的许多研究教学单位逐渐发现缺乏标准化实验动物设施所衍生的问题,进而陆续兴建这类设施,但截至目前(2000年初)呈更的案例并不多,本章以规划标准化实验动物房舍设施所应注意的原则为主轴,期有助于拟兴建这类设施的单位进行规划。 (一)细心规划乃至于建造实验动物房舍设施,方可能经恰当的经营理,确保不得不运用动物科学目的的意义,且较易避免发生公害。故进行实验动物设施规划时,应先确定1. 设立的研究及/或教学目的, 2. 拟饲育物种与环境清洁要求, 3. 设立单位在维持实验动物设施运作上的相关接口设备与人力, 4. 设施建筑之地理为等。 (二)有效率的实验动物设施规划团队则应包含 1. 具备相关经验的建筑师 2. 实验动物设施经营者 3. 将运用实验动物设施进行研究教学等科学目的代表 4. 实验动物设施所属单位之营缮人员代表

[font=宋体] 实验室设施需要考察到实验动物的安全与健康,并以降低实验上的变异性为目标,以达到最佳的研究环境。以此,实验动物笼子大小、寝垫、喂食、环境因子(光线、温度、湿度、空[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质[/color][/url]量)都应小心控管。[/font][font=宋体] 虽在某些时候自来水可用于实验动物饮用,但因自来水的成份可能随着时间或季节而不同[/font][font=宋体]和[/font][font=宋体]不同地域的自来水可能造成实验室结果的差异。因此,为了得到具再现性及[/font][font=宋体]可靠[/font][font=宋体]的实验结果,提供质量稳定的实验动物饮用水便相当重要。另外,有些实验动物(如免疫实验用动物),或是用于疾病模型的动物,其对于生长环境更加敏感,更[/font][font=宋体]需要[/font][font=宋体]高纯度的动物饮用水。[/font][font=宋体]实验动物饮用水应去除以下污染物:[/font][font=宋体]有机物质[/font][font=宋体]有些有机物质,如杀虫剂、内分泌破坏剂,可能存在于自来水中,不但会影响实验动物的健康,更会干扰研究的进行。另外,若水中还有氯,有机物可能形成,进而有致癌或影响动物生殖的后果。有机物有时可能成为细菌的养份,进而促进细菌的生长。通常,有机物可以用活性碳或[/font][font=宋体]反[/font][font=宋体]渗透的方法加以去除。[/font][font=宋体]细菌[/font][font=宋体]细菌可能造成实验动物的严重健康问题,故为实验动物相关设备最注重的考察因素。免疫不全动物及基因克隆动物尤其对细菌污染特别敏感。举例来说,一株常发现存在于水中的菌种,即会危害较脆弱动物的健康状况。水中的细菌含量亦可靠[/font][font=宋体]反[/font][font=宋体]渗透的方式降低。[/font][font=宋体]重金属[/font][font=宋体]高浓度的重金属(如铜、铁、锌、铅等),对健康不全实验动物可能是有毒性的。这些重金属可能由管线中释出。水中的离子及金属可由[/font][font=宋体]反[/font][font=宋体]渗透的方式大幅去除。[/font][font=宋体]硬水及水中颗粒[/font][font=宋体]硬水及水中的颗粒可能破坏自动供水系统的阀门,并造成动物笼内的漏水。供水系统的保养维护需求相对也会提高。[/font][font=宋体]氯消毒[/font][font=宋体][font=宋体]此法被普遍的采用,但是需要控制纯水的[/font]pH值,因为氯消毒在高pH值的环境中效果较低。在氯消毒时,可被接受的自由氯浓度为介于5~12 ppm之间。[/font][font=宋体]酸化消毒[/font][font=宋体][font=宋体]相较于氯消毒,酸化是一个较稳定且可于系统中持续较久的方法,然而缺点是需要一并使用抗腐蚀剂。另外,[/font]pH值需调整为2.6~3才能有较佳效果,不过,动物可能因味道不佳而抗拒饮用pH值低于2~5以下的水。[/font][font=宋体] 总之,在实验动物饮用水的纯化上,[/font][font=宋体]反[/font][font=宋体]渗透[/font][font=宋体]纯水[/font][font=宋体]是最被推荐的,因为此方法可去除水中大部分的有机物及离子,进而提供一稳定的纯水质量。自来水中的污染物成份会随时间及季节有所不同,故不宜用于实验动物的饮用水。经离子交换树脂纯化的去离子水,可能仍然含有有机物及微生物,故亦不建议使用于实验动物饮用水。[/font][font=宋体]艾柯[/font][font=宋体]实验室[/font][font=宋体]纯水机可提供[/font][font=宋体]达到动物饮用水标准[/font][font=宋体]的纯水系统,让实验动物[/font][font=宋体]拥有[/font][font=宋体]符合研究期望的生长状态。了解更多请关注公众号“艾柯超纯水机”或通过19113222630咨询详情[img=,690,368]https://ng1.17img.cn/bbsfiles/images/2022/04/202204260923156807_8752_1005_3.jpg!w690x368.jpg[/img][/font]
动物实验在新药的评价和筛选过程中有着十分重要的作用。古人云“在其位,谋其政”,正因为动物实验在研发中的这个关键作用,当研发产出不理想时,我们应该首先反思是否这些影响研发决定的关键实验是否使用得当。动物和人虽然有97%的基因相同,但在很多方面有巨大的差别,尤其在免疫反应和行为方面。最近斯坦福大学的科学家发现人和小鼠在受伤时启用的免疫应激基因几乎没有任何相关性。另一方面,疾病本身和疾病模型也有巨大差别。多数疾病我们尚不知其起因,而疾病模型的起因则非常明确,动物没有您的帮助成不了模型。从动物到人,从疾病模型到疾病本身是两个巨大的跨越,很多研发项目在这个过程中迷失了方向。现在通过动物实验的候选药物有10%能最后上市,但考虑到不少药物是结伴而行(同一靶点),真正能通过动物模型预测人体治疗效果的首创药物成功率要远低于10%,能和已有药物有足够区分的首创药物更是寥若晨星。任何实验如果想得到有用的信息,最重要的是问正确的问题,其次是实验设计的严格程度要和所研究问题的复杂程度匹配,而目前新药研发的动物实验在这两方面存在不小的差距。动物是很好的人类生物,生理模型,但不是好的病理模型。疗效则是更复杂的事情,因为疗效取决于如何定义,即观察终点。所以动物实验最有用的地方是观测药物对生物途径的调控,即药物在生命体内,有血流,营养,各种正负反馈和动态平衡的真实世界条件下对所关心的生物过程的影响,观测指标最好是比较客观的机理和功能的生物标记变化,比如下游蛋白的表达。病理模型有些有一定的预测性,但现在我们问的很多问题对这些可怜的小鼠来说实在太难了。小鼠没有心理疾病和小鼠不说话一样是自然界的本性。神经分裂小鼠模型和口吃小鼠模型一样与人类疾病没有太大关系。人类需要60,70年才能得的阿尔茨海默症如何能让小鼠几十天内得上?虽然很少但小鼠的确可以自然患上癌症,但我尚未看到小鼠自然患上阿尔茨海默症的报道,令人怀疑小鼠是否能被患上这类疾病。第二个大毛病是既然你问这些动物如此复杂的问题(即疗效),就应该用和这个复杂问题匹配的实验程序。三期临床实验几乎必须是双盲,对照,随机,多中心,多基因背景病人,多种生活习惯和并发症,但在动物实验这些控制因素都不存在。小鼠是实验室繁殖的同一基因背景的近亲,生活习性和能量摄入完全一样,并和普通小鼠都有很大区别,别说病人了。以前认为限制能量摄入能延长小鼠寿命,后来发现是因为这些实验小鼠平时吃的太多了。双盲,对照,随机这些控制机理在动物实验中极少使用,显然增加了动物实验结果的不可靠性,大量的发表动物实验结果无法重复就是证明之一。多中心虽然在研发全球化的今天可能更普遍一点,但一旦两个不同实验室得出不一致结果时多数人的解决办法不是改进动物模型,而是把实验集中到其中一个实验室,“以保证一致性”,掩耳盗铃啊。所以正确的解决办法是,问模型能回答的问题,问动物能回答的问题,而不是把你所有无法解决的问题都交给动物模型,然后对数据严刑拷打,得出想得到的结论。如果你问复杂的问题,看在老天爷的份上严格你的实验设计,不要挑最敏感的模型,用最容易产生假阳性的实验设计。新药研发的未来依靠整个社会在临床研究的更大投入。在人体确证靶点在疾病中的作用,在动物考察药物是否能调控这个靶点的生物功能,而不是所谓动物模型的治疗效果。在很多情况下,这和水中捞月没有太大区别。
动物实验室的生物安全防护设施应参照BSL-1-BSL-4实验室的相应要求,还应考虑对动物呼吸、排泄、毛发、抓咬、挣扎、逃逸、动物实验(如染毒、医学检验、取样、解剖、检验等)、动物饲养、动物尸体及排泄物的处置等过程产生的潜在生物危险的防护。应特别注意对动物源性气溶胶的防护,例如对感染动物的剖检应在负压剖检台上进行。应根据动物的种类、身体大小、生活习性、实验目的等选择具有适当防护水平专用于动物并符合国家相关标准的生物安全柜、动物饲养设施、动物实验设施、消毒设施和清洗设施等。实验室建筑应确保实验动物不能逃逸,非实验动物(如野鼠、昆虫等)不能进入。实验室设计(如空间、进出通道等)应符合所用动物的需要。
实验动物饮用水并无非常明确的水质要求,通常遵循中华人民共和国国家标准《实验动物 环境及设施》GB14925-2001 所要求的:1. 普通实验动物饮用水水质符合GB5749的要求;2. 屏蔽和隔离环境内饲养的实验动物饮用水需经灭菌处理。常用的实验动物饮用水制取方式有以下几种:1. 高压消毒优点:灭菌效果可靠,无污染,无残留物。缺点:1)操作复杂,劳动强度大;2)灭菌时间长;3)产水量有限;4)消耗大量能源和水,成本高;5)长期消毒水会使瓶内结成水碱,脱落后易堵塞瓶口;6)仅杀灭微生物,对其它污染物不能有效去除。2. 膜过滤法优点:1)水质优良,可去除水中的色度,臭味,消毒副产物前体及其它微生物,有机物;2)水质稳定;3)无需加药或剂量极少,不使用化学药剂;4)占地面积小,易于实现自动化;5)出水量大。缺点:1)初期基建投资和运行费用高;2)滤膜有使用期限,到一定时期需更换;3)膜的运行周期取决于预处理和合理的工作条件设定,受工艺差异影响较大;4)产生的废水相对干净,直接排放浪费资源。3. 饮用水加酸碱法优点:1)有效控制绿脓杆菌和金葡菌生长(洁净级动物常见污染); 2)防止饮用水在动物实验室的二次污染。缺点:长期喂养加酸饮用水会导致繁殖率下降客户通常都会选择使用膜过滤法来制备实验动物饮用水,
我们单位打算搞个毒理实验室,我想找个理由给做动物实验的人员加点工资,例如什么什么补贴之类的,但找不到任何有关做动物实验人员的利福这方面的法规/规定,也不清楚其他有开展动物实验的机构是怎么规定这些福利的。 兄弟们,有没有什么理由可以把这些补贴“正名”一下,或者有据可依?好让这些做动物实验的兄弟们可以名正言顺地拿这个补贴。 如果有了解这方面的朋友,补贴一般会给多少? 请各位英雄赐良策~涕谢~[em0807]
动物实验室应该建成什么样子??动物的来源是采购呢?还是自己养殖呢?
1、 组建设计团队:包括建筑设计师、实验动物专家、动物实验室使用者代表、动物实验室管理者。2、 信息收集:对将要建设的动物实验室准备进行的动物种类及数量、微生物类型、试验性质等进行详细的前期调研工作。实验动物科学正逐步走入正规化和法制化,因此,设计团队一定要熟读有关实验动物的国标、行标及生物安全等有关规范。3、 参观考察:有目的有重点的参观同类相关设施,采纳经验、吸取教训。甚至可以通过因特网(Internet)了解当今国外先进的动物实验设施。 4、 微生物危害评估[b][i]Risk Assessment:[/i][/b]当建设使用传染性或有潜在传染性材料的动物实验室前,必须进行微生物危害评估。评估内容包括:微生物的致病性(致病方式、致病程度)、致病途径、稳定性、致病剂量、操作时的浓度,除此以外,目标微生物是否有有效的预防和治疗方法、操作者的专业水平及技能也是评估内容。根据微生物危害评估结果,参照国际或国家的《微生物危害分类标准》,确定目标微生物应在哪一级的生物安全防护实验室中进行。

[size=16px][b]仪器信息网[/b]网络讲堂将于[/size][size=18px][color=#6666CC][b]2021年6月16日[/b][/color][/size][size=16px]召开[/size][b][size=18px] [color=#FF6666]“动物实验技术”主题网络研讨会(2021)[/color][/size][/b][size=12px],携手该领域的专家和一线工作者带来精彩的分享。[/size][url=https://insevent.instrument.com.cn/t/zh][size=18px][color=#000099][b]点击报名[/b][/color][/size][/url][size=12px](本次会议旨在为同行提供在线学习机会,实现教育资源共享,并搭建互动平台,增进学术交流,促成项目合作。)[/size][align=center]=======================================================================[/align][align=center][size=16px][url=https://insevent.instrument.com.cn/t/zh][img=,690,230]https://ng1.17img.cn/bbsfiles/images/2021/06/202106041015031905_9463_2507958_3.jpg!w690x230.jpg[/img][/url] [/size][/align][size=16px] [/size][size=16px]每一个新药诞生的背后,都有大量默默牺牲的实验动物。医药研究领域之外,在农业、食品等研究领域,实验动物也有很广泛的应用。每年有大量用于研究的实验动物,包括大鼠、小鼠、蜜蜂、蚕、比格犬、兔、斑马鱼、鸽子,以及恒河猴等。因此,动物福利组织提出了“3R”原则,即“Replace替代”、“Reduce减少”、“Refine优化”。人们在思考如何利用实验动物更好地进行研究。合理使用实验动物并加强实验动物技术意义重大。[/size][size=16px][/size][size=16px] 为广大从事动物实验工作者提供学术、技术交流平台,传播知识,仪器信息网将于[b]2021年6月16日[/b]举办“动物实验技术”主题网络研讨会。[/size][size=16px][/size][size=16px]【报名链接】:[url=https://insevent.instrument.com.cn/t/zh]点击打开链接[/url][/size][align=center][url=https://insevent.instrument.com.cn/t/zh][img=,300,300]https://ng1.17img.cn/bbsfiles/images/2021/06/202106041010369010_7782_2507958_3.png!w400x400.jpg[/img][/url][/align][align=center]=======================================================================[/align][align=center] [url=https://insevent.instrument.com.cn/t/zh][img=,690,320]https://ng1.17img.cn/bbsfiles/images/2021/06/202106041102385003_4200_2507958_3.png!w690x320.jpg[/img][/url][/align][size=16px][url=https://insevent.instrument.com.cn/t/zh]点击打开链接[/url][/size]
针对近日热议的化妆品动物实验禁令,欧美和日本的科学家表示他们更支持欧洲替代方法验证中心(ECVAM)的谨慎立场,ECVAM的观点认为,截至2013年化妆品测试替代方法仍不能完全取代动物实验。有关各方呼吁欧美法规当局加强合作,努力为化妆品动物实验的未来走向提供一幅清晰的解决图景。在圣霍普金斯大学动物实验替代方法中心,由Thomas Hartung领导的一组多国科研人员称,ECVAM中心虽然忽略了“一大批重要的可选方案”,但他们仍然赞成ECVAM的最后结论,即“目前完全替代动物实验缺乏实际可行性,尤其是在重复剂量毒性、致癌性测试和生殖毒性领域”。不过,他们也承认,短期内致敏性和毒代动力学领域存在动物实验替代方案的极大可能。这个小组的一位科学家评论说,现在的困难是在重复剂量毒性、致癌及生殖毒性的毒理学节点上,没法预测何时才能完全取代动物实验。Thomas Hartung研究团队为欧盟会的替代方案报告做出了众多评议,包括时间框架和重要里程碑、全球合作、政府支持以及其他工业行业的参与。作为对学界意见的回复,欧委会称正在对本周早期发布的《化妆品领域动物替代方法年度报告》进行动物实验市场禁令所有可选方案的评估。
现在原创征集前处理的方法,免疫试验中的确有一些比较特殊的前处理,所以我会尽量抽空整理一些进行分享和说明!看到我们生命科学版块原创很少啊,壮大下我们的人气!http://simg.instrument.com.cn/bbs/images/brow/emyc1002.gifhttp://simg.instrument.com.cn/bbs/images/brow/emyc1002.gifhttp://simg.instrument.com.cn/bbs/images/brow/emyc1002.gifhttp://simg.instrument.com.cn/bbs/images/brow/emyc1002.gifhttp://simg.instrument.com.cn/bbs/images/brow/emyc1002.gif做实验的时候常常要到动物的新鲜的脾脏、胸腺、肝脏等器官,所以需要将动物处死,并且准确而迅速取出来相关的脏器进行试验。这么说有一些残忍,但是为了科学,只能让我们可爱的实验动物们献身了。试验用过的动物不能再用以其他的用途,我们会按照掩埋或者火葬的方式处理掉得,所以还是很人道的~刚开始做这样的试验前处理就会手忙脚乱的,也常常看到比较可爱的小动物会不忍心下手,有一次还和搭档一起将小兔子藏起来,成功的带出去,这种刀下留“动物”的事情不是每次都能成功的,所以还是老老实实练好基本功啦!一般实验室中会根据动物的品种、需要采集的部位、还有实验的不同要求有不同的处理方法。一般都是以小动物为试验对象,常常使用的是:大白鼠、小白鼠、家兔和豚鼠(大动物一般成长周期较长,另外饲养难度比较大,所以更中意这几类)。下面我会配合一些图示简单说明下处理的方法,只是试验技术交流,切勿在生活中随意模仿!真爱生命啊!所有的处理方法原则是让动物在短时间无痛苦的死去,我尽量说的简明扼要,不说明细节,再次声明只做交流,切勿模仿!!!首先是针对于大白鼠和小白鼠的方法:1、颈椎脱臼法这种方法是通过对动物的颈椎脱臼,断离脊髓。方法很简单用右手抓住白鼠的尾巴,注意要抓在较为靠近根部的一端, 防止用力不当将鼠尾拉断;用左手拇指和食指用力向下按压鼠头及颈部,右手抓住鼠尾根部用力拉向后上方,造成颈椎脱臼,使得脊髓与脑干断离即可。http://ng1.17img.cn/bbsfiles/images/2011/11/201111291011_333811_1817351_3.jpg2、断头法这种方法只适用于小的实验动物。用左手按住动物的背部,拇指夹住动物右腋窝,食指和中指夹住左前肢,右手用剪刀在颈部垂直将头剪断…http://ng1.17img.cn/bbsfiles/images/2011/11/201111290954_333800_1817351_3.jpg3、击打法用手抓住动物尾部并提起,用力摔击其头部,或者用工具击打,使大脑中枢遭到破坏。http://ng1.17img.cn/bbsfiles/images/2011/11/201111290955_333802_1817351_3.jpg4、急性失血法将实验动物的股动脉、颈动脉、腹主动脉剪断或剪破、刺穿实验动物的心脏放血,导致急性大出血、休克。常用的还有去眼球放血的方法急性失血。http://ng1.17img.cn/bbsfiles/images/2011/11/201111290955_333803_1817351_3.jpg5、化学法将动物放入含0.2%-0.5%的co或者大量的乙醚、氯仿的容器中http://ng1.17img.cn/bbsfiles/images/2011/11/201111290955_333805_1817351_3.jpg豚鼠和家兔的体形相比比较大,所以也有一些特殊的方法:1.[color=#484848
哪位大神有兽医实验动物检测领域的不确定度模板/样张供参考下?CNAS扩项需要提交不确定度报告,虽然动物实验的方法会有差异,如果有样张也可以调整的,请问哪位大神老师有啊?先跪谢啦
欧洲测试替代方法验证中心(ECVAM)近日发布报告指出,化妆品测试替代方法完全取代动物实验可能要持续到2013年以后。欧盟2003年曾投票决定禁止2013年以后对化妆品成分做动物实验。 尽管替代方法的研究近年来取得实质性发展,但五类重复剂量毒性实验(包括皮肤致敏性实验和致癌性实验)、生殖毒性和毒性动力学的替代测试方法还无法做到2年后完全取消动物实验。 科研人员预估皮肤致敏替代方法的研究还要经历7-9年时间,因此最早实现完全淘汰动物实验,包括更强致敏剂的弱化差异性实验,也要等到2017年。

检疫实验室的设计,必须符合安全的要求。在从事高危险性病原微生物工作的实验室,建筑周围应有宽60cm、深60cm的防鼠沟,实验室建筑内不能有野生啮齿动物窜入。实验动物房必须严防动物逃逸,要求门窗严密,动物笼和实验室动物房门均需扣死或加锁,特别对于禽类和猴类实验动物尤其应有完善的防护措施。实验动物房内还需设有可靠的排气消毒设施、高压灭菌装置和独立的污水处理系统和专门的动物焚尸炉,处理动物尸体及强毒实验室内的一切垃圾。 无菌室是无菌实验操作室,应设置在最里面,防止空气流动引起污染。除设置无菌室外,也可利用洁净工作台和无菌操作箱进行无菌操作。 无菌操作室包括操作间、缓冲室和更衣间。操作室不宜过大或过小,缓冲室主要目的是保护操作室的无菌环境,避免因空气对流使外界空气直接进入操作室。同时,还可以放置恒温培养箱和离心机等实验仪器,使实验在相对无菌条件下完成,而不必携出室外。更衣间主要是隔离衣的着装处。作强毒检疫的实验应设置淋浴设施,进出都要淋浴,以保证安全。无菌操作室内密闭不透风,温湿度和二氧化碳浓度较高,易滋生细菌,而且损害工作人员的身体健康,应装置过滤空气的恒温恒湿调节器。 设计无菌操作室时应注意以下几点: 1.为防止室内温度增高,要选择阳光不能直接照射到的位置,最好设在阴面。 2.天花板高度不要超过2m,以保证紫外线灯的有效消毒效果。 3.室内要防止空气流动,宜安装横拉门和双层密闭毛玻璃窗。 4.天花板、地板和四周墙壁要光滑无死角,宜镶瓷砖或涂油漆,以便于清洁和消毒。 5.恒温恒湿调节器应采用空气室内回流和补充少量滤过新空气系统。 目前普遍采用洁净工作台代替无菌操作室。洁净工作台具有使用方便、占据空间少、清理消毒方便等优点。洁净工作种类很多,有平行气流和垂直气流,有整机和组合式,有单人和双人操作之分。洁净工作台工作原理是利用鼓风机,使经高效过滤的空气徐徐通过台面形成无菌的正气压,使外周有菌的空气不易流入洁净台,达到操作区无菌的目的。因此,在使用时,周围不能有较大的气流,最好洁净台放置在清洁无尘的房间,防止灰尘堵塞滤器,延长使用时间。
在做动物实验加标时,加完标以后,是立即加提取溶液还是等上一会再加,如果等,等多长时间,有没有依据。
[align=center][size=24px]动物疫病实验室检验采样方法[/size][/align][font=宋体][size=16px]1[/size][/font][font=宋体][size=16px]范围[/size][/font]本方法适用动物疫病诊断实验室的样品采集方法,适用于病因(原)学、病理组织学、血清学、免疫学等实验室检验所需样品的采集。2样品采集的一般原则和采集前的准备2.1 样品采集所遵循的一般原则2.1.1 凡发现患畜(包括马、牛、羊及猪等)有急性死亡时,如怀疑是炭疽,则不可随意解剖,应采取患畜的血液,万不得已时局部解剖作脾脏触片的显微镜检查。只有在确定不是炭疽后,方可进行剖检。2.1.2 采取病料的种类,根据不同的疾病或检验目的,采其相应的脏器、内容物、分泌物、排泄物或其他材料;进行流行病学调查、抗体检测、动物群体健康评估或环境卫生检测时,样品的数量应满足统计学的要求。采样时应小心谨慎,以免对动物产生不必要的刺激或损害和对采样者构成威胁。在无法估计病因时,可进行全面的采集。检查病变与采集病料应统筹考虑。2.1.3 内肌病料的采取,如患畜已死亡,应尽快采集,最迟不超过6h。2.1.4 血液样品在采集前一般禁食8h。2.1.5 采样时应考虑动物福利,应做好人身防护,采样人员必须穿戴必要的个人防护用品,严防人畜共患病感染。2.1.6 应防止污染环境,防止疫病传播,做好环境消毒和病害肉尸的处理。2.1.7 采样人员必须是兽医技术人员,熟悉采样器具的使用,掌握正确采样方法。2.2 器械2.2.1 所用器械2.2.1.1 动物检疫器械箱,保温箱或保温瓶,解剖刀,剪刀,镊子,酒精灯,酒精棉,碘酒棉,注射器及针头等。2.2.1.2 样品容器(小瓶、平皿、离心管及易封口样品袋、塑料包装袋等)。2.2.1.3 试管架,铝盒,瓶塞,无菌棉拭子,胶布,封口膜,封条,冰袋等。2.2.1.4 记录和防护材料不干胶标签、签字笔、圆珠笔、记号笔、采样单、记录本等;口罩、一次性手套、乳胶手套、防护服、防护帽、胶靴等。2.2.1.5 采样刀剪等器具和样品容器须无菌。2.2.2 所用器械的消毒刀、剪、镊子等用具煮沸消毒30min,使用前用酒精擦拭,用时进行火焰消毒。器皿(玻制、陶制等)经103kPa高压30min,或经160C干烤2h灭菌;或放于0.5%~1%的碳酸氢钠(NaHCr~)水中煮沸10min~15min,水洗后,再用清洁纱布擦干,保存于酒精、乙醚等溶液中备用。注射器和针头放于清洁水中煮沸30min。一般要求使用“一次性”针头和注射器。采取一种病料,使用一套器械与容器,不可用其再采其他病料或容纳其他脏器材料。采过病料的用具应先消毒后清洗。检查过传染性海绵状脑病的器械要放在2mol/L的氢氧化钠(NaOH)溶液中浸泡2h以上,才可再使用。3 样品的采集3.1 血液3.1.1 采血部位大的哺乳动物可选用颈静脉或尾静脉采血,也可采胫外静脉和乳房静脉血。毛皮动物小量采血可穿刺耳尖或耳壳外侧静脉,多量采血可在隐静脉采集,也可用尖刀划破趾垫0.5cm深或剪断尾尖部采血。啮齿类动物可从尾尖采血,也可由眼窝内的血管丛采血;猪可从耳缘静脉、前腔静脉或心脏采血,牛可从尾静脉、颈静脉采血,羊可从颈静脉采血,兔可从耳背静脉、颈静脉或心脏采血。禽类通常选择翅静脉采血,也可通过心脏采血。3.1.2 采血方法对动物采血部位的皮肤先剃毛(拔毛),75%的酒精消毒,待干燥后采血,采血可用针管、针头、真空管或用三棱针穿刺,将血液滴到开口的试管内。禽类等的少量血清样品的采集,可用塑料管采集。用针头刺破消毒过的翅静脉,将血液滴到直径为3mm~4mm的塑料管内,将一端封口。3.1.3 采血种类3.1.3.1 全血样品进行血液学分析,细菌、病毒或原虫培养,通常用全血样品,样品中加抗凝剂。抗凝剂可用0.1%肝素、阿氏液(见第A.1章)(阿氏液为红细胞保存液,使用时,以1份血液加2份阿氏液),或枸橼酸钠(3.8%~4%的枸橼酸钠0.1mL,可抗1mL血液)。采血时应直接将血液滴人抗凝剂中,并立即连续摇动,充分混合。也可将血液放人装有玻璃珠的灭菌瓶内,震荡脱纤维蛋白。3.1.3.2 血清样品进行血清学试验通常用血清样品。用作血清样品的血液中不加抗凝剂,血液在室温下静置2h~4h(防止曝晒),待血液凝固,有血清析出时,用无菌剥离针剥离血凝块,然后置4℃冰箱过夜,待大部分血清析出后取出血清,必要时经低速离心分离出血清。在不影响检验要求原则下可因需要加入适宜的防腐剂。做病毒中和试验的血清避免使用化学防腐剂(如硼酸、硫柳汞等)。若需长时间保存,则将血清置20℃以下保存,但要尽量防止或减少反复冻融。样品容器上贴详细标签。3.1.3.3 血浆的采集采血试管内先加上抗凝剂(每10mL血加柠檬酸钠0.04g~0.05g),血液采完后,将试管颠倒几次,使血液与抗凝剂充分混合,然后静止,待细胞下沉后,上层即为血浆。3.2 一般组织3.2.1 采样方法用常规解剖器械剥离死亡动物的皮肤,体腔用消毒的器械剥开,所需病料按无菌操作方法从新鲜尸体中采集。剖开腹腔后,注意不要损坏肠道。作病原分离用:进行细菌、病毒、原虫等病原分离所用组织块的采集,可用一套新消毒的器械切取所需器官的组织块,每个组织块应单独放在已消毒的容器内,容器壁上注明日期、组织或动物名称。注意防止组织间相互污染。3.2.2 采样种类3.2.2.1 病原分离样品的采集用于微生物学检验的病料应新鲜,尽可能的减少污染。用于细菌分离的样品的采集,首先以烧红的刀片烫烙脏器表面,在烧烙部位刺一孔,用灭菌后的铂耳伸人孔内,取少量组织或液体,作涂片镜检或划线接种于适宜的培养基上。3.2.2.2 组织病理学检查样品的采集采集包括病灶及临近正常组织的组织块,立即放人10倍于组织块的10%福尔马林溶液中固定。组织块厚度不超过0.5cm,切成1cm2~2cm2(检查狂犬病则需要较大的组织块)。组织块切忌挤压、刮摸和用水洗。如作冷冻切片用,则将组织块放在0℃~4℃容器中,尽快送实验室检验。3.3 肠内容物或粪便 肠道只需选择病变最明显的部分,将其中的内容物弃去,用灭菌生理盐水轻轻冲洗;也可烧烙肠壁表面,用吸管扎穿肠壁,从肠腔内吸取内容物,将肠内容物放人盛有灭菌的30%甘油盐水缓冲保存液(见第A.2章)中送检。或者,将带有粪便的肠管两端结扎,从两端剪断送检。从体外采集粪便,应力求新鲜。或者,用拭子小心地插到直肠粘膜表面采集粪便,然后将拭子放人盛有灭菌的30%甘油盐水缓冲保存液中送检。3.4 胃液及瘤胃内容物3.4.1 胃液采集胃液可用多孔的胃管抽取。将胃管送入胃内,其外露端接在吸引器的负压瓶上,加负压后,胃液即可自动流出。3.4.2 瘤胃内容物采集反刍动物在反刍时,与食团从食道逆人口腔时,立即开口拉住舌头,另一只手深入口腔即可取出少量的瘤胃内容物。3.5 呼吸道应用灭菌的棉拭子采集鼻腔、咽喉或气管内的分泌物,蘸取分泌物后立即将拭子浸入保存液中,密封低温保存。常用的保存液有pH7.2~7.4的灭菌肉汤(见第A.3章)或磷酸盐缓冲盐水,如准备将待检标本接种组织培养,则保存于含0.5%乳蛋白水解物的汉克氏(Hanks)液中。一般每支拭子需保存液5mL。3.6 生殖道可采集阴道或包皮冲洗液,或者采用合适的拭子,有时也可用尿道拭子采集。3.7 眼睛眼结膜表面用拭子轻轻擦拭后,放在灭菌的30%甘油盐水缓冲保存液中送检。有时,也采取病变组织碎屑,置载玻片上,供显微镜检查。3.8 皮肤病料直接采自病变部位,如病变皮肤的碎屑、未破裂水泡的水泡液、水泡皮等。3.9 胎儿将流产后的整个胎儿,用塑料薄膜、油布或数层不透水的油纸包紧,装入木箱内,立即送往实验室。3.10 小家畜及家禽将整个尸体包人不透水塑料薄膜、油纸或油布中,装入木箱内,送往实验室。3.11 骨需要完整的骨标本时,应将附着的肌肉和韧带等全部除在,表面撒上食盐,然后包入浸过5%石炭酸溶液的纱布中,装入不漏水的存器内送往实验室。3.12 脑、脊髓3.12.1 全脑、脊髓的采集如采取脑、脊髓做病毒检查,可将脑、脊髓浸入30%甘油盐水液中或将整个头部割下,包人浸过消毒液的纱布中,置于不漏水的容器内送往实验室。3.12.2 脑、脊髓液的采集3.12.2.1 采样前的准备采样使用特制的专用穿刺针,或用长的封闭针头(将针头稍磨钝,并配以合适的针芯);采样前,术部及用具均按常规消毒。3.12.2.2 采样方法3.12.2.2.1 颈椎穿刺法:穿刺点为环枢孔。将动物实施站立或横卧保定,使其头部向前下方屈曲,术部经剪毛消毒,穿刺针与皮肤面呈垂直缓慢刺入。将针体刺入蛛网膜下腔,立即拔出针芯,脑脊髓液自动流出或点滴状流出,盛人消毒容器内。3.12.2.2.2 腰椎穿刺法:穿刺部位为腰荐孔。实施站立保定,术部剪毛消毒后,用专用的穿刺针刺入,当刺入蛛网膜下腔时,即有脑脊髓液滴状滴出或用消毒注射器抽取,盛入消毒容器内。3.12.2.3 采样数量大型动物颈部穿刺一次采集量35 mL~70mL,腰椎穿刺一次采集量15mL~30mL。3.13 液体病料采集胆汁、脓、粘液或关节液等样品时,用烫烙法消毒采样部位,用灭菌吸管、毛细吸管或注射器经烫烙部位插入,吸取内部液体材料,然后将材料注入灭菌的试管中,塞好棉塞送检。也可用接种环经消毒的部位插入,提取病料直接接种在培养基上。供显微镜检查的脓、血液及粘液抹片的制备方法:先将材料置玻片上,两用一灭菌玻棒均匀涂抹或另用一坡片推抹。组织块、致密结书及脓汁等亦可在两张玻片中间,然后沿水平面向两端推移。用组织块作触片时,持小镊将组织块的游离面在玻片上轻轻涂抹即可。3.14 乳汁乳房先用消毒药水洗净(取乳者的手亦应事先消毒),并把乳房附近的毛刷湿,最初所挤的3~4滴乳汁弃去,然后再采集10mL左右乳汁于灭菌试管中。进行血清学检验的乳汁不应冻结、加热或强烈震动。3.15 精液精液样品用人工方法采集,所采样品应包括“富精”部分,并避免加入防腐剂。3.16 尿液的采集在动物排尿时,用洁净的容器直接接取。也可使用塑料袋,固定在雌畜外阴部或雄畜的阴茎下接取尿液。采取尿液,宜早晨进行。3.17 环境为监测环境卫生或调查疾病,可从遗弃物、通风管、下水道、孵化厂或屠宰场采集有代表性样品。4 送检样品的记录送往实验室的样品应有一式三份的送检报告,一份随样品送实验室,一份随后寄去,另一份备案。样品记录至少应包括以下内容:a) 畜主的姓名和畜禽场的地址;b) 畜(农)场里饲养的动物品种及其数量;c) 被感染的动物种类;d) 首发病例和继发病例的日期及造成的损失;e) 感染动物在畜群中的分布情况;f) 死亡动物数、出现临床症状的动物数量及其年龄;g) 临床症状及其持续时间,包括口腔、眼睛和腿部的情况,产奶或产蛋的记录,死亡情况和时间,免疫和用药情况等;h) 饲养类型和标准,包括饲料种类;i)送检样品清单和说明,包括病料的种类、保存方法等;j)动物治疗史;k) 要求做何种试验;1) 送检者的姓名、地址、邮编和电话;m) 送检日期。5 样品的运送 所采集的样品以最快最直接的途径送往实验室。如果样品能在采集后24h内送抵实验室,则可放在4℃左右的容器中运送。只有在24h内不能将样品送往实验室并不致影响检验结果的情况下,才可把样品冷冻,并以此状态运送。根据试验需要决定送往实验室的样品是否放在保存液中运送。 要避免样品泄漏。装在试管或广口瓶中的病料密封后装在冰瓶中运送,防止试管和容器倾倒。如需寄送,则用带螺口的瓶子装样晶,并用胶带或石蜡封口。将装样品的并有识别标志的瓶子放到更大的具有坚实外壳的容器内,并垫上足够的缓冲材料。空运时,将其放到飞机的加压舱内。制成的涂片、触片、玻片上注名号码,并另附说明。玻片两端用细木条分隔开,层层叠加,底层和最上一片,涂面向内,用细线包扎,再用纸包好,在保证不被压碎的条件下运送。所有样品都要贴上详细标签。
实验室最近在新地址修建了动物房,已开始使用,最近接受检查,CNAS检查老师提出我们的体系文件应涵盖本部及分部,这个不知道该怎么去理解和修改,因为感觉程序文件和质量手册并没有具体说只针对本部啊,请大家赐教
如题。我是学食品安全的,主要还是为了节约成本,所以打算用722可见分光光度计做动物残留实验(兽药、农药、重金属、矿物质等均可)。请大家给点意见,哪些药可直接通过可见分光光度计较准确的检出呢?
欧洲化妆品协会(Colipa)在其大会上坚持认为欧洲还没有做好准备在2013年前停止动物实验,这与欧洲联盟关于停止动物实验(ECEAE)的结论是完全相反的,而欧洲联盟上周刚发布了一篇文章关于化妆品在不使用动物实验的情况下如何安全投放市场。Colipa的总裁Fabio Franchina表示关于2013年欧盟市场化妆品禁止动物实验的提议给欧洲化妆品行业带来了很大的压力,他表示相关部门已经花费了大量的时间和财力来寻找三个动物实验问题严重部分的替代品,包括重复给药动物实验、皮肤过敏性测试和致癌性评估,但是目前还没有找到。他认为他们的工作需要更多的投资,同时他们会继续探索,以求能尽快解决问题。
动物试验是科研尤其是医学研究中的常用手段。在研究人体组织、细胞的科学活动中,猴子又是最常见的试验品。但用猴子进行试验已经引起了科学界的担忧:对可能会制造出会像人类一样思考和说话的猴子的担忧?等等目前英国已经禁止使用大型灵长目动物进行科学试验,但这种试验在美国等很多国家是被允许的。你认为这类试验是否需要禁止?还是说有控制的进行?或者继续当前的状况,没有限制。