产品中含有荧光增白剂多少,能用定量的检测方法检测出来吗?
能用岛津的荧光检测器做定量分析吗? 听说不准确. 不知道是不是.
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=154965]特征荧光光谱法定量检测水质的研究[/url]
[em09506] 安捷伦1200 荧光、紫外检测器 对应的定性 定量 哪个比较相对准确些 忘详细的说明一下。谢谢
粮食的质量对于食品安全至关重要,然而,在粮食的生产供应链中,储存与运输环节如果处理不当,容易导致粮食质量问题,尤其是真菌毒素的污染。真菌毒素对人体健康的危害不可低估,因此我们迫切需要可靠的粮食真菌毒素检测仪,以快速获取相关数据,更好地管理粮食的贮存与销售。[align=center][img=1.jpg,500,500]https://img1.17img.cn/17img/images/202311/uepic/ceeefdda-1af1-47a1-9755-b12da24f5544.jpg[/img][/align]粮食真菌毒素检测仪采用荧光定量快速检测原理,是一种先进的仪器设备,主要应用于粮油谷物、饲料等样品中真菌毒素的有效、准确检测。以下是该检测仪的两个重要特点:一、荧光定量原理:粮食真菌毒素检测仪采用荧光定量技术,通过读取荧光定量检测卡,对比检测区(T线)、质控区(C线)与背景区的荧光信号强度。根据检测卡内置的标准曲线,计算出样品中真菌毒素的含量。这一原理保证了检测的准确性和可靠性,为粮食安全提供了可靠的数据支持。该仪器可检测粮油、谷物、饲料等中的真菌毒素,如黄曲霉毒素B1、黄曲霉毒素M1、玉米赤霉烯酮、呕吐毒素、伏马毒素等。二、随到随检:粮食真菌毒素检测仪具有随到随检的特点,不受检测样本量的限制。它可以灵活地单个或少量样本进行即时检测,也能够高效地处理大量样本,实现现场检测。这一特性使其在粮食生产、仓储、销售等各个环节都能够迅速投入使用,提高了检测的效率与便捷性。1、可应用于粮库、谷物生产企业等粮食行业,确保存储和销售的粮食产品安全。2、在养殖业中,对饲料原料进行检测,预防真菌毒素对畜禽的危害。3、在食品生产和加工行业,保障食品制品质量。4、用于政府监管、第三方检测机构等,加强对真菌毒素的监测和管理。在确保粮食质量安全的同时,粮食真菌毒素检测仪的应用为粮食行业提供了强有力的技术支持,为保障食品安全做出了重要贡献。[来源:山东优云谱光电科技有限公司][align=right][/align]
各位老师好,我现在需要定量检测一个样品里的硅含量,但是联系多家单位后均表示只能做定性或者半定量的测定,不能做定量检测,因为定量测定需要标注品,有没有哪个检测单位能定量测定硅含量呢?
[url=https://www.instrument.com.cn/netshow/SH116147/C541443.htm][b][color=#000000]粮食真菌毒素检测仪[/color][/b][/url][color=#000000]采用荧光定量快速检测原理,主要应用于粮油、谷物、饲料等多种领域,对多种真菌毒素进行准确检测,为确保食品安全贡献力量。[/color][color=#000000]荧光定量快速检测原理即粮食真菌毒素检测仪通过特定的荧光信号,准确、快速地识别和测量样品中的真菌毒素含量。这项技术具有高效、灵敏度高、操作简便等特点,使得检测过程更加迅速和可靠。[/color][align=center][color=#000000][img=10.jpg,450,450]https://img1.17img.cn/17img/images/202401/uepic/67aa6330-9564-4eb4-9bbb-e6f3071189ee.jpg[/img][/color][/align][b][color=#000000]核心特性及优势[/color][/b][color=#000000]全方位检测:涵盖多种真菌毒素,包括黄曲霉毒素B1、黄曲霉毒素M1、玉米赤霉烯酮等,实现全面监测。[/color][color=#000000]任意样品数量:粮食真菌毒素检测仪允许用户既可单个或少量样本随到随检,也可大量样本同时检测。[/color][color=#000000]内置定量标准曲线:在检测过程中无需使用外部标准品进行校准,避免了操作人员与呕吐毒素直接接触的可能,从而提高了操作的安全性。[/color][color=#000000]随到随检:检测仪器的便携性使其适用于现场检测,无论是在生产线上、仓库中,还是在野外环境中,都能轻松进行检测操作。[/color][color=#000000]多领域应用:适用于粮库、谷物生产企业、饲料厂、畜牧养殖企业、食品加工厂、第三方检测机构等多个行业。[/color][b][color=#000000]应用场景[/color][/b][color=#000000]保障粮库质量:对存储的粮食进行定期检测,预防真菌毒素污染。[/color][color=#000000]提升饲料质量:对饲料原料进行检测,确保畜牧养殖健康生长。[/color][color=#000000]食品生产控制:在食品生产过程中对油脂、面粉等原材料进行检测,确保成品质量。[/color][color=#000000]第三方检测服务:为各行业提供真菌毒素检测服务,为食品安全保驾护航。[/color][color=#000000]通过使用粮食真菌毒素检测仪,我们能够更全面地了解食品和饲料的安全状况,从而更好地保障我们的健康。[/color][来源:山东优云谱光电科技有限公司][align=right][/align]
[font=宋体][size=14.0pt]荧光定量[/size][/font][size=14.0pt]PCR[/size][font=宋体][size=14.0pt]实验失败原因分析 ——荧光信号检测出了问题[/size][/font][font=宋体][size=14.0pt]近日某实验室来电,反映其荧光定量[/size][/font][size=14.0pt]PCR[/size][font=宋体][size=14.0pt]仪在成功检测了一次病毒核酸后,连续几次检测均失败,表现为阳性对照也无[/size][/font][size=14.0pt]Ct[/size][font=宋体][size=14.0pt]值,请求给予技术支持。[/size][/font][size=14.0pt]1[/size][font=宋体][size=14.0pt]背景[/size][/font][font=宋体][size=14.0pt]该实验室荧光定量[/size][/font][size=14.0pt]PCR[/size][font=宋体][size=14.0pt]仪系进口品牌,今年[/size][/font][size=14.0pt]4[/size][font=宋体][size=14.0pt]月份安装调试,当时检测结果较理想。[/size][/font][size=14.0pt]5[/size][font=宋体][size=14.0pt]月份该实验室进行了一次病毒核酸检测,提取采用柱式[/size][/font][size=14.0pt]DNA[/size][font=宋体][size=14.0pt]提取试剂盒,未设阴性对照和阳性对照;扩增采用配套的核酸扩增试剂,设置了阴性对照和阳性对照,检测结果较理想。但在后续的检测工作中,却连续多次实验失败,表现为整个扩增过程荧光信号均为一条几乎无起伏的直线。[/size][/font][size=14.0pt]2[/size][font=宋体][size=14.0pt]思路[/size][/font][font=宋体][size=14.0pt]影响荧光定量[/size][/font][size=14.0pt]PCR[/size][font=宋体][size=14.0pt]检测结果的因素可分为三个阶段,一是核酸提取,二是核酸扩增,三是荧光信号检测。为了分析是哪个阶段出了问题,我们设计了以下方案:[/size][/font][font=宋体][size=14.0pt]第一步:利用已知结果的核酸[/size][/font][size=14.0pt]+[/size][font=宋体][size=14.0pt]该实验室的扩增试剂,看有无检测结果。如有则说明核酸提取环节存在问题,如无则说明可能是核酸扩增环节或荧光信号检测存在问题,继续进行第二步分析;[/size][/font][font=宋体][size=14.0pt]第二步:利用已知结果的核酸[/size][/font][size=14.0pt]+[/size][font=宋体][size=14.0pt]经验证可以得到结果的扩增试剂(本实验室在用的扩增试剂及引物探针),看有无检测结果。如有则说明核酸提取环节存在问题,如无则说明可能是荧光信号检测存在问题。[/size][/font][size=14.0pt]3[/size][font=宋体][size=14.0pt]分析验证[/size][/font][font=宋体][size=14.0pt]方案确定后,带上本实验室已知结果的核酸(包括[/size][/font][size=14.0pt]Ct[/size][font=宋体][size=14.0pt]值[/size][/font][size=14.0pt]25[/size][font=宋体][size=14.0pt]、[/size][/font][size=14.0pt]28[/size][font=宋体][size=14.0pt]、[/size][/font][size=14.0pt]31[/size][font=宋体][size=14.0pt]、[/size][/font][size=14.0pt]34[/size][font=宋体][size=14.0pt]及阴性),以及本实验室在用的扩增试剂及引物探针,到该实验室开展分析验证。[/size][/font][font=宋体][size=14.0pt]第一步:利用已知结果的核酸[/size][/font][size=14.0pt]+[/size][font=宋体][size=14.0pt]该实验室的扩增试剂上机检测,结果荧光信号仍为一条几乎无起伏的直线。说明可能是核酸扩增环节或荧光信号检测存在问题。为明确究竟是何原因造成实验失败,继续开展第二步分析验证。[/size][/font][font=宋体][size=14.0pt]第二步:利用已知结果的核酸[/size][/font][size=14.0pt]+[/size][font=宋体][size=14.0pt]经验证可以得到结果的扩增试剂上机检测,结果荧光信号还为一条几乎无起伏的直线。因本次使用的扩增试剂和引物探针是本实验室一直在用的,已知可以得到正确的扩增结果,所以初步判断可能是荧光信号检测存在问题。[/size][/font][font=宋体][size=14.0pt]到此,分析验证告一段落,实验失败极有可能是荧光定量[/size][/font][size=14.0pt]PCR[/size][font=宋体][size=14.0pt]仪出现故障,最大可能是荧光信号检测存在问题。目前,该实验室已电告设备厂家,要求派工程师上门维修。[/size][/font][size=14.0pt]4[/size][font=宋体][size=14.0pt]思考[/size][/font][font=宋体][size=14.0pt]荧光定量[/size][/font][size=14.0pt]PCR[/size][font=宋体][size=14.0pt]实验失败看似非常头痛,实则不然。只要理清思路,逐一分析验证核酸提取、核酸扩增、荧光信号检测各个环节,即可快速判断问题所在。[/size][/font][font=宋体][size=14.0pt]另外还有一点不吐不快的感受,作为一个世界著名品牌产品,实验室选择它的出发点就是该设备的准确性和稳定性,但这台设备只进行过一次检测就出现故障,实属不该。[/size][/font][font=宋体][size=14.0pt][font=&]5[/font]续[/size][/font][font=宋体][size=14.0pt]最新消息,据该实验室反馈,厂方工程师上门检修,发现是作为荧光光源的灯泡坏了。更换灯泡后,该实验室已能检测出正确结果。[/size][/font]
求问各位大神,用什么分析方法检测面膜液中的荧光剂含量,最好能定性还能定量。谢谢了。
第一次用waters e2695荧光检测组织中药物及其代谢物残留。因为第一次用荧光,同时第一次用empower软件,有些问题想请教论坛里的液相高手们。首先说明仪器硬件配置及软件,waters e2695,配置有2475荧光检测器。软件为win7版系统的empower工作站。问题是:1、做荧光检测时,gain和EUFS该如何设置?有没有要求?2、我的样品为10 ug/mL时,检测器提示说饱和,那么荧光检测器对于样品的浓度有没有上限要求呢?3、进样前要检测基线平稳,但纵坐标是自动增益变化的,变化范围在多大的水平内算是基线平稳,可以进样了呢?4、有文献提到做荧光检测时可稀释样品,但稀释会不会影响样品的检测限和定量限呢? 亟待问题答案,请论坛里高手们赐教,不甚感激,谢谢!

使用安捷伦1260荧光检测器做一个方法:分离三个物质,采用梯度洗脱,流动相乙腈水。三个物质的荧光响应不同,所以使用了荧光的时间表,设置不同时间段不同的荧光的激发和发射波长。前两个月这个方法一直好好的,最近一进标样,第二个物质的后基线马上下降,导致不能准确定量。咨询工程师说可能样品或系统污染原因,重新配制样品,并将系统冲洗,但是问题还是没有解决。后来改变了梯度程序,正常了,但是其中两个物质的峰面积变成原来的一半(荧光响应也随梯度改变,即每个物质的响应波长还是和原来一样)请问这是什么原因?http://ng1.17img.cn/bbsfiles/images/2015/12/201512221131_578992_1470916_3.jpg

[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/10/202310111002363579_4863_5604214_3.jpg!w690x690.jpg[/img] 便携式ATP荧光检测仪可以用于检测餐具的卫生情况。ATP荧光检测仪的原理是检测样本中的生物活性分子ATP,通常与细菌和微生物的存在相关联。当餐具表面存在有机残留物、细菌、霉菌或其他微生物时,这些生物会释放出ATP。检测仪会测量样品中的ATP浓度,从而提供有关卫生情况的信息。 使用便携式ATP荧光检测仪来检测餐具的卫生具有以下优点: 快速:这种仪器通常能够在几分钟内提供结果,因此适用于快速检测。 实时:便携式ATP检测仪可提供实时数据,使餐馆或食堂能够立即采取措施,如果发现卫生问题。 定性和定量:检测仪可以提供有关卫生问题的定性和定量信息,帮助餐厅工作人员了解问题的严重程度。 高灵敏度:这些仪器通常非常敏感,能够检测到微生物水平的变化,即使微生物数量很少也能被检测到。 虽然便携式ATP荧光检测仪对餐具卫生的检测是有用的,但它主要用于表面卫生的初步评估。如果检测结果显示卫生问题,进一步的卫生措施,如清洗、消毒和曝晒,通常是必要的。这种设备不能替代传统的餐具清洁和消毒程序,但可以作为一个附加的工具,帮助确保餐具的卫生标准得到遵守。
动物疫病荧光定量PCR检测方法的模块化构建及实践1 背景近几十年来,动物疫病的发生与发展越来越趋向频繁、复杂,造成的危害也不断加重。究其原因:一是动物数量大幅度增加,集约化程度不断提高。据《中国统计年鉴》:1990年底全国猪、羊存栏分别为5668万头、11362万头,2015年底则分别为45803万头、31174万头,分别增加7.08倍、1.74倍;二是动物调运频繁、距离不断延长。以前动物调运仅限省内或周边省市,现在动辄上千公里甚至数千公里。据报道:“从2013年底到2014年的上半年,我国新疆、甘肃、内蒙古、宁夏等省区接连爆发了较为严重的小反刍兽疫疫情,而后疫情逐渐扩展地全国20余个省份,造成了严重的经济、社会影响”(《中国畜牧业》2014年第21期《小反刍兽疫爆发对我国肉羊产业发展的影响》)。三是人畜共患病种类不断增加。2012年6月加拿大Haroling教授报告,目前人类已发现1000多种动物病原体,其中有600种存在于家畜之中,在这600种病原体中有40%的病原体为人畜共患病。从国内情况看,进入21世纪以来,禽流感(H5亚型、H7N9)、甲型H1N1流感、SARS、猪链球菌病2型、布氏杆菌病、结核、乙脑、狂犬病等人畜共患病不断发生。为确保公共卫生安全,以及畜牧业健康发展,有必要实施动物疫病的核酸监测,尽早发现疫情隐患并予以及时处置,避免重大动物疫情及公共卫生安全事件发生。2 常用试剂盒的缺点目前,动物疫病(主要指病毒病)核酸检测一般采用商品化荧光PCR试剂盒,多由双组分组成且独立保存,使用前按一定比例(一般PCR反应液与酶混合液体积比为9:1)混匀后用于检测。这种试剂盒存在几个缺点:一是只能用于某一特定的动物疫病检测,如果检测任务中途发生大幅度削减,则试剂盒只能作报废处理;二是试剂盒中有的组分容易缺斤少两,尤其是酶混合液更是如此。每个样品约需酶混合液1.2μL,一般10T试剂盒装量为15μL,50T试剂盒酶混合液装量为70[font=宋体-方正超大字符集][size=18px]μL[/size][/font],按理说应该足够使用。但实际检测中会出现10T试剂盒酶混合液只能检测7T,50T试剂盒酶混合液只能检测40T,严重影响检测工作的正常开展。分析其原因,可能与容器密闭不严、酶混合液中的水分在冰冻状态升华等有关;三是试剂盒中的引物探针信息缺失。出于保护商业秘密考虑,几乎所有试剂盒均对引物探针的具体序列进行保密。作为第三方检测机构,在开展检测工作时,应优先使用标准方法,并确保使用标准的有效版本。在使用标准方法前,应进行证实。在使用非标准方法(含自制方法)前,应进行确认。但由于试剂盒厂家不提供引物探针序列,检测机构无法判定使用试剂盒开展的检测是否符合标准方法的要求。另外,商品化试剂盒一般免费附带核酸提取试剂,但提取试剂根据检测项目的不同,一般为DNA专用提取试剂或RNA专用提取试剂。当一批样品要检测多种DNA及RNA病毒项目时,需要同时进行两次核酸提取,不仅费时费力且浪费试剂。由于上述缺点的存在,给动物疫病检测带来了不少麻烦。3 模块化检测方法的构建思路针对商品化试剂盒存在的缺点,进行了模块化检测方法的构建。总体思路是:将动物疫病荧光定量PCR检测分为三个模块,核酸提取采用DNA/RNA共提试剂,核酸扩增采用预混液+引物探针方式,质控品利用抗原或商品化疫苗自制。具体思路如下:——核酸提取采用DNA/RNA共提试剂;——引物探针严格按照标准方法,委托生物工程公司合成;——反应体系中其他成分,采购商品化qPCR预混液或RT-qPCR预混液(含逆转录酶);——质控品:阳性对照采用病毒抗原、商品化疫苗等,测定结果后按一定比例稀释,保存备用。——反应体系:一律固定为20μL,具体如下:[table][tr][td]DNA扩增[/td][td]RNA扩增[/td][/tr][tr][td=1,2]qPCR预混液(2×) 10μL[/td][td]RT-qPCR预混液(2×) 10μL[/td][/tr][tr][td]逆转录酶 1μL[/td][/tr][tr][td]ROX 0.4μL[/td][td]ROX 0.4μL[/td][/tr][tr][td]引物探针 适量[/td][td]引物探针 适量[/td][/tr][tr][td]水 补足18μL[/td][td]水 补足18μL[/td][/tr][tr][td]DNA模板 2μL[/td][td]RNA模板 2μL[/td][/tr][/table]——反应条件首先按照标准中的条件开展摸索,如达到预期效果则予以固定;如效果不佳则参照预混液及引物探针推荐条件进行适当调整。根据上述思路,一个实验室只需配备DNA/RNA共提试剂、qPCR预混液、RT-qPCR预混液共3种试剂,加上特定的引物探针,即可开展多种动物疫病的检测。此配置有以下优点:一是试剂通用性强。实验室只需配备DNA/RNA共提试剂、qPCR预混液(针对DNA病毒)、RT-qPCR预混液(针对RNA病毒)三种主要试剂,以及不同的引物探针,即可开展几种甚至几十种检测项目;二是灵活方便。根据动物疫病的发生发展,实验室可以随时调整检测项目和检测数量。以RT-qPCR预混液为例,不仅可以用于检测禽流感,也可以用于检测口蹄疫、猪瘟、蓝耳病等项目。实验室常备一定数量的预混液,当某个项目检测量突然增加时,可利用预混液的通用特性,迅速完成检测任务,尔后再采购预混液进行补充。当某个项目因故取消时,也可将预混液用于其他项目的检测,不致于造成大量浪费。三是方便开展项目检测。当突发新的重大疫情,上级有关部门公布引物探针序列及扩增程序后,可以委托生物工程公司紧急合成引物探针,利用现有的预混液,在几天内即可具备新方法的检测能力,而这一点是成品试剂盒很难做到的。4 质控品制备对于病毒核酸荧光定量PCR检测,每次实验都必须设立阴性对照和阳性对照。一般情况下,在核酸提取和核酸扩增,需分别设立阴性对照和阴性对照,也就是说每次检测至少需要设立E-(核酸提取阴性对照)、E+(核酸提取阳性对照)、R-(核酸扩增阴性对照)、R+(核酸扩增阳性对照)共4个质控。在开展多次检测,结果稳定后,可以仅使用E-/E+或R-/R+。阴性对照可用DEPC水,阳性对照是否可以利用商品试剂盒附带的质控品?经过部分项目的检测,证明大部分商品试剂盒附带的质控品,均无法作为实验室自制的准标准方法的阳性对照。原因可能是商品试剂盒质控品系根据其专有的引物探针(与检测标准不一致)扩增片段制成质粒,只能使用其特有的引物探针才能检测到。因此,需要自制阳性对照用于质控。对于基层实验室来说,制备质粒或者假病毒非常困难,较可靠的办法是直接利用全病毒来制备阳性对照,具体思路如下:——对于禽流感、新城疫、口蹄疫等项目,由于商品化试剂盒附带有全病毒抗原,可以尝试使用这些抗原来制备阳性对照;——对于蓝耳病、伪狂犬、圆环病毒、小反刍兽疫等项目,由于已经有商品化疫苗上市,可以尝试使用商品化疫苗来制备;——对于部分既无全病毒抗原又无商品化疫苗的检测项目,在不违反法律法规及部门规定的情况下,可以利用已确认阳性的病毒核酸,适当稀释后作为核酸扩增阳性对照(R+);或者将病毒核酸用已灭活的阴性血浆作适当稀释,复原成模拟阳性样品,作为核酸提取阳性对照(E+)。5 应用根据上述思路,进行了相关实验,取得了初步成果。现简要汇报如下:——核酸提取采用FastPure Viral DNA/RNA Mini Kit试剂盒,南京诺维赞生产,可以实现多种样品的DNA/RNA共提;——引物探针按照相应国家标准提供的序列,委托上海生工合成,引物稀释成10μmol/L、探针稀释成5μmol/L,分装成小包装冷冻保存备用;——qPCR预混液采用AceQ Universal U+ Probe Master Mix V2,RT-qPCR预混液采用2× One Step Q Probe Mix,逆转录酶采用One Step Q Probe Enzyme Mix,均为南京诺维赞生产;——质控品:禽流感选用血凝抑制抗原,口蹄疫选用液相阻断ELISA抗原,其他选用商品化疫苗,测定结果后用灭菌水稀释至Ct值约25~30,冷冻保存备用;——反应体系:设置为20μL,预混液(2×)10μL、逆转录酶1μL、ROX 0.4μL为固定量,引物探针加入量根据检测标准中的终浓度予以换算,加灭菌水补足18μL,DNA或RNA模板为2μL;——反应条件:绝大多数项目直接套用检测标准中的反应条件,效果良好不需要调整。6 讨论6.1 检测工作更加简捷高效模块化检测方法,极大地方便了检测工作的开展。目前实验室经常开展的检测项目有10余个,如果采用商品化试剂盒,则每个检测项目需专用的试剂盒,采购、保存和使用等各个环节,均显得很不方便。改用模块化检测方法后,只需要1种核酸提取试剂和2种扩增试剂,加上各检测项目专用的引物探针,即可开展多个项目的检测。6.2 适用性有待进一步验证尽管在构建新方法时,对适用性进行了尽可能多的验证,如对于动物A型流感,就验证了H5亚型Re-4、Re-5、Re-6、Re-7、Re-8、Re-10、Re-11、Re-12,以及H7亚型、H7N9、H7N9Re-1、H7N9Re-2等毒株的抗原,均证实有效。但对于其他毒株,尤其是较新型的变异株是否有效,尚有待进一步观察和验证。6.3 关于质控品质控品在某个检测方法中,起到非常重要的作用。E-出现阳性结果可能是核酸提取过程中受到污染,E+出现阴性结果可能是核酸提取试剂失效或提取过程出现问题,R-出现阳性结果可能是核酸扩增试剂受到污染,R+出现阴性结果可能是核酸扩增试剂失效。根据E-/E+/R-/R+的扩增结果,大致可以判断核酸提取和核酸扩增过程是否出现问题。阴性对照一般可用灭菌水代替,阳性对照可选用扩增效果较好的抗原或疫苗。6.4 规范操作避免污染由于阳性对照使用的是全病毒抗原或疫苗,一旦造成实验室内部环境污染,更换引物探针等方法无法有效消除污染。因此在实验操作各环节均要严格规范,阳性对照要事先经过可靠灭活,并尽可能降低其使用浓度,扩增产物、实验废弃物需进行无害化处理,以避免引起实验室内部环境污染和其他生物安全事故。6.5 严格依法依规操作农业农村部于2020年8月27日发布《关于非洲猪瘟病毒诊断制品生产经营使用有关事宜的通知》(农办牧〔2020〕42号),要求:自2021年1月1日起,各有关部门和单位在动物检疫或疫病监测、诊断中,对生猪及其产品开展非洲猪瘟病毒检测,应当使用已取得我部核发的产品批准文号的非洲猪瘟病毒诊断制品,确保检测结果准确。按照此规定,实验室自行构建的非洲猪瘟检测方法将不能继续使用,必须改用获得兽药批准文号的商品化非洲猪瘟检测试剂盒。

[font=arial, helvetica, sans-serif][color=#3333ff][b] [/b][/color][/font][align=center][font=arial, helvetica, sans-serif][b][size=24px]什么是荧光定量PCR[/size][/b][/font][/align][align=center][font=arial, helvetica, sans-serif][b][size=24px][/size][/b][/font][/align][font=arial, helvetica, sans-serif][color=#3333ff][color=#3333ff][b] [url=http://www.woyao17.com.cn/chanpinzhanshi/peitaoxiantiao/24.html]荧光定量PCR[/url][/b][/color][/color]又称qPCR,[color=#333333]是一种在DNA扩增反应中,以荧光化学物质测每次[/color]聚合酶链式反应[color=#333333]([/color][url=http://www.woyao17.com.cn/chanpinzhanshi/peitaoxiantiao/][color=#3333ff][b]PCR[/b][/color][/url][color=#333333])循环后产物总量的方法。通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法。[/color][/font][size=16px][b][font=微软雅黑, sans-serif]荧光定量PCR的由来[/font][/b][/size][color=#333333] [/color][url=http://www.woyao17.com.cn][img=,690,460]https://ng1.17img.cn/bbsfiles/images/2020/09/202009270913440814_9803_4137464_3.jpg!w690x460.jpg[/img][/url] 2020年,一场突如其来的新冠疫情,让“[url=http://www.woyao17.com.cn/chanpinzhanshi/peitaoxiantiao/24.html][color=#0000ff][b]核酸检测[/b][/color][/url]”这一疾病检测方法一夜间为大家所公知。它在这次疫情防控中发挥了重大作用,成为临床诊断的 “金标准”。而实时荧光定量PCR则是此次核酸检测的主要应用方法,用以检测、判定临床样本中是否含有新冠病毒。今天小编先带大家初步了解一下什么是实时荧光定量PCR。 它的由来是这样的从20世纪90年代初开始,许多实验室开始致力于相对准确的定量PCR技术的研究。在这一过程中,应用较多的是半[url=http://www.woyao17.com.cn/chanpinzhanshi/peitaoxiantiao/24.html][color=#0000ff][b]定量PCR技术[/b][/color][/url]。引入管家基因,通过电泳后比较目的基因和管家基因的产物相对量,得到起始模板在量的差异。随后,为了进一步提高定量的准确性,人们开始设想在PCR过程中加入荧光物质,荧光物质会参与到第一轮PCR循环中,随着循环的进行和产物的增加,检测到的荧光物质也在发生变化,从而通过对荧光物质的检测实现全程监控PCR进程,最终可以计算出初始的模板量。1993年Higuchi等人将这一设想付诸实现!它的定义是这样的实时荧光定量PCR (Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法。通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法。由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。 [b][font=微软雅黑, sans-serif][size=16px]荧光定量PCR的原理[/size][/font][/b] 它检测的原理是这样的原理,包括探针类和非探针类两种。探针类是利用与靶序列特异杂交的探针来指示扩增产物的增加;非探针类则是利用荧光染料或者特殊设计的引物来指示扩增产物的增加。探针法由于增加了探针的识别步骤,特异性更高,而非探针类则简便易行。例如: 1.SYBRGreenⅠ法:SYBRGreenⅠ是一种结合于小沟中的双链DNA结合染料。在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。特点:非特异性,需检测熔解曲线;单通道检测;使用方便,经济便宜;常用于实验室研究。 2.TaqMan探针法:TaqMan探针是一种寡核苷酸探针,它的荧光与目的序列的扩增相关。它设计为与目标序列上游引物和下游引物之间的序列配对。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物的形成完全同步。特点: 特异性好;可以多通道检测;单独设计探针;价格较高;常用于临床检测。随着荧光检测[url=http://www.woyao17.com.cn/chanpinzhanshi/peitaoxiantiao/24.html][color=#3333ff][b]PCR仪[/b][/color][/url]的商品化,实时荧光定量PCR进入了一个特异性强、灵敏度高、重复性好、定量准确、速度快、全封闭反应和由计算机软件进行快速统计的全新时代,实现了PCR从定性或半定量到准确定量的飞跃。它的特点和优势是这样的 1)特异性强:引物和探针的“双保险”,避免检测的假阳性。 2)灵敏度高:分析PCR产物的对数期,自动化仪器收集荧光信号,避免了许多人为因素干扰。 3)避免污染:全封闭反应,无须PCR后处理。 4)实现定量:运用标准品获得标准曲线,结合Ct值进行准确定量。 5)高效低耗:可实现一管多检。 6)操作简便:在线式实时监测扩增结果,不必接触有害物质。 7)快速:反应时间1.5小时。[size=16px][b][font=微软雅黑, sans-serif]在分子生物学领域的研究应用[/font][/b][/size][list=1][*]定量核酸浓度:传统方法是用琼脂糖凝胶电泳或者分光光度计测定核酸浓度,其结果不准确而且易污染,实时荧光定量PCR可以解决这些问题,它的准确性、灵敏度高且无污染,对一些传染性疾病进行定量分析、病原微生物和病毒含量检测,此项技术都是首选 。[*]研究基因表达:应用实时定量PCR技术可以对基因时间、空间表达水平差异进行比较。例如,对特定基因用物理、化学、药物等不同方法处理后的差异进行比较,为人们的科学研究提供依据 。[*]用于单核苷酸多态性(SNP)检测分析:人们对疾病的易感性和对同一种药物治疗同一种疾病的效果是有差异性的,遗传物质DNA的多态性RELP,STR,ABO血型和SNP是个体差异的遗传基础。SNP在人类基因组中广泛存在,是人类可遗传变异中最常见的一种,在遗传性疾病的研究中具有重要意义 。[*]DNA甲基化检测:DNA甲基化是表观遗传学重要的标记信息,通过实时荧光定量PCR技术获得基因组甲基化水平数据对表观遗传学的时空特异性研究具有重要意义。[/list][url=http://www.woyao17.com.cn/chanpinzhanshi/][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2020/09/202009270916423385_1359_4137464_3.jpg!w690x517.jpg[/img][/url]
荧光定量PCR简介荧光定量PCR检测技术诞生至今已10多年的时间,而其应用一直都没广泛展开,究其原因,无外乎受制于相关仪器、试剂和技术的发展。近期,尤其是08年以来,仪器和试剂是遍地开花,这也使科研人员均跃跃欲试,都想借此技术使自己的研究能突飞猛进,发展势头通过查找每年所发表的文章数可一目了然。据有关统计,在 Medline 数据库中,用“Taqman” 或 ”real time PCR” 作为关键词检索,1996 年是19 篇,1999 年157 篇,到2003 年就高达2984 篇,2009年会是多少呢?我们不得而知。但其迅猛的发展势头却是不可更改的,本公司真诚希望能和众多研究人员共同努力,抓住这一大好时机,为科研事业的发展贡献自身的力量。基于这一目标,本公司长期以来对荧光定量PCR,无论是技术还是多年来的产品,均进行了深入地研究,并及时推出更加优异的荧光定量 PCR技术服务。荧光定量PCR原理荧光定量PCR最早称TaqMan PCR,后来也叫Real-Time PCR,是美国PE(Perkin Elmer)公司1995年研制出来的一种新的核酸定量技术。该技术是在常规PCR基础上加入荧光标记探针或相应的荧光染料来实现其定量功能的。其原理:随着PCR反应的进行,PCR反应产物不断累计,荧光信号强度也等比例增加。每经过一个循环,收集一个荧光强度信号,这样我们就可以通过荧光强度变化监测产物量的变化,从而得到一条荧光扩增曲线图。一般而言,荧光扩增曲线可以分成三个阶段:荧光背景信号阶段,荧光信号指数扩增阶段和平台期。在荧光背景信号阶段,扩增的荧光信号被荧光背景信号所掩盖,无法判断产物量的变化。而在平台期,扩增产物已不再呈指数级的增加,PCR 的终产物量与起始模板量之间没有线性关系,根据最终的 PCR 产物量也不能计算出起始 DNA 拷贝数。只有在荧光信号指数扩增阶段, PCR产物量的对数值与起始模板量之间存在线性关系,我们可以选择在这个阶段进行定量分析。为了定量和比较的方便,在实时荧光定量 PCR 技术中引入了两个非常重要的概念:荧光阈值和 CT值(如下图所示)。荧光域值(threshold)是在荧光扩增曲线上人为设定的一个值,它可以设定在荧光信号指数扩增阶段任意位置上,但一般荧光域值的缺省设置是PCR反应前3-15个循环荧光信号标准偏差的10倍,即:threshold。http://www.biomart.cn/upload/asset/2011/01/25/1295364674.jpgCt 值:是指每个反应管内的荧光信号到达设定域值时所经历的循环数。Ct值与起始模板的关系:研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct值越小。利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代表Ct值如下图所示。因此,只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。http://www.biomart.cn/upload/asset/2011/01/25/1295364675.jpg荧光定量检测荧光定量检测根据所使用的标记物不同可分为荧光探针和荧光染料。荧光探针又包括Beacon技术(分子信标技术,以美国人Tagyi为代表)、 TaqMan探针(以美国ABI公司为代表)和FRET技术(以罗氏公司为代表)等;荧光染料包括饱和荧光染料和非饱和荧光染料,非饱和荧光染料的典型代表就是现在最常用的SYBR GreenⅠ;饱和荧光染料有EvaGreen、LC Green等。嵌合荧光染料法(SYBR GreenⅠ)SYBR Green I是荧光定量PCR最常用的DNA结合染料,与双链DNA非特异性结合。在游离状态下,SYBR Green I发出微弱的荧光,但一旦与双链DNA结合,其荧光增加1000倍。所以,一个反应发出的全部荧光信号与出线的双链DNA量呈比列,且会随扩增产物的增加而增加。http://www.biomart.cn/upload/asset/2011/01/25/1295364672.gifSYBR Green I荧光染料与DNA双链的结合双链DNA结合染料的优点:实验设计简单,仅需要2个引物,不需要设计探针,无需设计多个探针即可以快速检验多个基因,且能够进行熔点曲线分析,检验扩增反应的特异性,低的初始成本,通用性好,因此国内外在科研中使用比较普遍。荧光探针法(Taqman 技术):PCR扩增时,加入一对引物的同时再加入一个特异性的荧光探针。该探针为一直线型的寡核苷酸,两端分别标记一个荧光报告基团和一个荧光淬灭基团,探针完整时,报告基团发射的荧光信号被淬灭基团吸收,PCR 仪检测不到荧光信号; PCR扩增时(在延伸阶段),Taq 酶的 5' - 3' 切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条 DNA 链,就有一个荧光分子形成,实现了荧光信号的累积与 PCR 产物形成完全同步,这也是定量的基础所在。其过程如下图所示http://www.biomart.cn/upload/asset/2011/01/25/1295364673.gif荧光定量PCR的应用分子生物学研究1、核酸定量分析。 对传染性疾病进行定量定性分析,病原微生物或病毒含量的检测 , 比如近期流行的甲型H1N1流感, 转基因动植物基因拷贝数的检测,RNAi 基因失活率的检测等。2 、基因表达差异分析。 比较经过不同处理样本之间特定基因的表达差异 ( 如药物处理、物理处理、化学处理等 ) ,特定基因在不同时相的表达差异以及cDNA芯片或差显结果的确证3 、SNP 检测。检测单核苷酸多态性对于研究个体对不同疾病的易感性或者个体对特定药物的不同反应有着重要的意义,因分子信标结构的巧妙性,一旦SNP 的序列信息是已知的,采用这种技术进行高通量的 SNP 检测将会变得简单而准确。4、 甲基化检测。甲基化同人类的许多疾病有关,特别是癌症, Laird 报道了一种称作 Methylight的技术,在扩增之前先处理 DNA ,使得未甲基化的胞嘧啶变成尿嘧啶,而甲基化的胞嘧啶不受影响,用特异性的引物和 Taqman探针来区分甲基化和非甲基化的 DNA ,这种方法不仅方便而且灵敏度更高。医学研究1、 产前诊断:人们对遗传性物质改变引起的遗传性疾病还无法治疗,到目前为止,还只能只能通过产前监测,减少病婴出生,以防止各类遗传性疾病的发生,如为减少X连锁遗传病患儿的出生,从孕妇的外周血中分离胎儿DNA,用实时荧光定量PCR检测其Y性别决定区基因是一种无创伤性的方法,易为孕妇所接受。2、 病原体检测:采用荧光定量PCR检测技术可以对淋球菌、沙眼衣原体、解脲支原体、人类乳头瘤病毒、单纯疱疹病毒、人类免疫缺陷病毒、肝炎病毒、流感病毒、结核分枝杆菌、EB病毒和巨细胞病毒等病原体进行定量测定。与传统的检测方法相比具有灵敏度高、取样少、快速简便等优点。3、 药物疗效考核:对乙型肝炎病毒 (HBV)、丙型肝炎病毒 (HCV) 定量分析显示:病毒量与某些药物的疗效关系。HCV高水平表达,干扰素治疗作用不敏感,而HCV低滴度,干扰素作用敏感;在拉米夫定治疗过程中,HBV- DNA的血清含量曾有下降,随后若再度上升或超出以前水平,则提示病毒发生变异。4、 肿瘤基因检测:尽管肿瘤发病的机理尚未清楚,但相关基因发生突变是致癌性转变的根本原因已被广泛接受。癌基因的表达增加和突变,在许多肿瘤早期就可以出现。实时荧光定量 PCR不但能有效地检测到基因的突变,而且可以准确检测癌基因的表达量。目前用此方法进行过端粒酶hTERT基因、慢性粒细胞性白血病WT1基因、肿瘤 ER基因、前列腺癌PSM基因、肿瘤相关的病毒基因等多种基因的表达检测。
[font=宋体][font=宋体]实时荧光定量聚合酶链式反应([/font][font=Calibri]q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体])是一种革命性的技术,能够在[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增过程中实时监测反应进程,从而实时收集数据。与传统的[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]方法不同,[/font][font=Calibri]q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]不依赖于[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]循环结束后的产物量,而是通过观察循环中首次检测到目标扩增的时间点来确定结果。这种方法的灵敏度极高,目标核酸的起始拷贝数越高,荧光的显著增加就越快被观察到。相比之下,终点法检测(也称为“读板检测”)则仅测量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]循环结束时的产物累积量。[/font][/font][font=宋体] [/font][font=宋体]那么[/font][font=宋体][b][font=宋体]荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]是检查什么的?荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]利用具有热循环功能及荧光染料筛查能力的仪器,检测反应过程中荧光的变化。[/font][/b][/font][font=宋体] [/font][font=宋体][font=宋体]荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]是分子生物学实验中的一项重要手段,同时也是检验科常用的技术。其原理是利用具有热循环功能及荧光染料筛查能力的仪器,检测反应过程中荧光信号的变化,从而对核糖核酸、[/font][font=Calibri]DNA[/font][font=宋体]、[/font][font=Calibri]RNA[/font][font=宋体]等目标分子进行定量检测。在妇科领域,[/font][font=Calibri]HPV[/font][font=宋体]检测是荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]的常用应用之一。通过荧光显影技术,可以方便地监测[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]过程,并准确地计算出体内[/font][font=Calibri]HPV[/font][font=宋体]感染的量。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]通过荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]检测[/font][font=Calibri]HPV[/font][font=宋体],不仅可以观察阳性或阴性的结果,还可以精确地测量[/font][font=Calibri]HPV[/font][font=宋体]感染的量以及拷贝数。这对于筛查宫颈癌等妇科疾病具有重要意义。除了[/font][font=Calibri]HPV[/font][font=宋体]检测外,荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]还可广泛应用于其他领域,如病毒筛查、基因表达分析等。总之,荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]技术的出现为分子生物学实验和医学诊断带来了革命性的变革,极大地提高了检测的准确性和效率。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]的应用[/font][/font][/b][font=宋体]分子生物学研究[/font][font=宋体] [/font][font=宋体][font=Calibri]1 [/font][font=宋体]核酸定量分析 对传染性疾病进行定量定性分析,病原微生物或病毒含量的检测 [/font][font=Calibri], [/font][font=宋体]比如近期流行的甲型[/font][font=Calibri]H1N1[/font][font=宋体]流感, 转基因动植物基因拷贝数的检测,[/font][font=Calibri]RNAi [/font][font=宋体]基因失活率的检测等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2 [/font][font=宋体]基因表达差异分析 比较经过不同处理样本之间特定基因的表达差异 [/font][font=Calibri]( [/font][font=宋体]如药物处理、物理处理、化学处理等 [/font][font=Calibri]) [/font][font=宋体],特定基因在不同时相的表达差异以及[/font][font=Calibri]cDNA[/font][font=宋体]芯片或差显结果的确证[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3 SNP [/font][font=宋体]检测 检测单核苷酸多态性对于研究个体对不同疾病的易感性或者个体对特定药物的不同反应有着重要的意义,因分子信标结构的巧妙性,一旦[/font][font=Calibri]SNP [/font][font=宋体]的序列信息是已知的,采用这种技术进行高通量的 [/font][font=Calibri]SNP [/font][font=宋体]检测将会变得简单而准确。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4 [/font][font=宋体]甲基化检测 甲基化同人类的许多疾病有关,特别是癌症, [/font][font=Calibri]Laird [/font][font=宋体]报道了一种称作 [/font][font=Calibri]Methylight[/font][font=宋体]的技术,在扩增之前先处理 [/font][font=Calibri]DNA [/font][font=宋体],使得未甲基化的胞嘧啶变成尿嘧啶,而甲基化的胞嘧啶不受影响,用特异性的引物和 [/font][font=Calibri]Taqman[/font][font=宋体]探针来区分甲基化和非甲基化的 [/font][font=Calibri]DNA [/font][font=宋体],这种方法不仅方便而且灵敏度更高。[/font][/font][font=宋体] [/font][font=宋体]医学研究[/font][font=宋体] [/font][font=宋体][font=Calibri]5 [/font][font=宋体]产前诊断 人们对遗传性物质改变引起的遗传性疾病还无法治疗,到目前为止,还只能只能通过产前监测,减少病婴出生,以防止各类遗传性疾病的发生,如为减少 [/font][font=Calibri]X[/font][font=宋体]连锁遗传病患儿的出生,从孕妇的外周血中分离胎儿[/font][font=Calibri]DNA[/font][font=宋体],用实时荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]检测其[/font][font=Calibri]Y[/font][font=宋体]性别决定区基因是一种无创伤性的方法,易为孕妇所接受。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6 [/font][font=宋体]病原体检测 采用荧光定量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]检测技术可以对淋球菌、沙眼衣原体、解脲支原体、人类乳头瘤病毒、单纯疱疹病毒、人类免疫缺陷病毒、肝炎病毒、流感病毒、 结核分枝杆菌、[/font][font=Calibri]EB[/font][font=宋体]病毒和巨细胞病毒等病原体进行定量测定。与传统的检测方法相比具有灵敏度高、取样少、快速简便等优点。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7 [/font][font=宋体]药物疗效考核 对乙型肝炎病毒 [/font][font=Calibri](HBV)[/font][font=宋体]、丙型肝炎病毒 [/font][font=Calibri](HCV) [/font][font=宋体]定量分析显示:病毒量与某些药物的疗效关系。[/font][font=Calibri]HCV[/font][font=宋体]高水平表达,干扰素治疗作用不敏感,而[/font][font=Calibri]HCV[/font][font=宋体]低滴度,干扰素作用敏感;在拉米夫定治疗过程中,[/font][font=Calibri]HBV- DNA[/font][font=宋体]的血清含量曾有下降,随后若再度上升或超出以前水平,则提示病毒发生变异。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8 [/font][font=宋体]肿瘤基因检测 尽管肿瘤发病的机理尚未清楚,但相关基因发生突变是致癌性转变的根本原因已被广泛接受。癌基因的表达增加和突变,在许多肿瘤早期就可以出现。实时荧光定量 [/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]不但能有效地检测到基因的突变,而且可以准确检测癌基因的表达量。目前用此方法进行过端粒酶[/font][font=Calibri]hTERT[/font][font=宋体]基因、慢性粒细胞性白血病[/font][font=Calibri]WT1[/font][font=宋体]基因、肿瘤 [/font][font=Calibri]ER[/font][font=宋体]基因、前列腺癌[/font][font=Calibri]PSM[/font][font=宋体]基因、肿瘤相关的病毒基因等多种基因的表达检测。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/real-time-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]-service][b]实时荧光定量[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/real-time-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]-service][b][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/real-time-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]-service][b]技术服务[/b][/url],服务详情可查看[/font][font=Calibri]https://cn.sinobiological.com/services/real-time-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]-service[/font][font=宋体]。更多关于生物方面的问题也可以点击咨询。[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
在基因扩增仪的几种类型中,荧光定量PCR 因操作方便、运行速度快、实验结果准确,受到越来越多的分子生物学研究者青睐。 实验者要购买一款合适的荧光定量PCR,需要考虑各方面的因素,首先要分析实验室目前乃至将来的需求、平衡实验室的预算,更要详细研究各种各样的宣传资料。 面对各种不同性能的产品,我们该如何选择呢? 首先建议大家走出认识荧光定量PCR的两个误区: 误区一:荧光定量PCR仪无需梯度功能 对于使用染料法的定量PCR反应,虽然有各种各样的PCR引物设计软件或者经验公式计算熔解温度(Tm值),但运用的公式不同、引物序列不同,Tm值的差异会很大。 引物的熔解温度决定了退火温度。而且模版中碱基的组合千变万化,对于特殊片断,经验公式得到的数据不一定能得出准确的结果,退火温度细微的差异对结果都可能产生决定性的影响,因而“摸条件”一度是让人很头疼的问题。 梯度PCR的出现部分解决了一些问题——在反应过程中每个孔的温度控制条件可以在指定范围内按照梯度变化,根据结果,一步就可以摸索出最适合的反应条件。 不单是退火温度,连变性温度和延伸温度都可以优化——对于多种聚合酶混合酶扩增如Invitrogen、Clontech、Promega的多数高保真Taq酶来说这个非常重要,因为Taq和校正酶的最佳反应温度可能有显著差异,优化延伸温度就显得很重要。 使用有梯度功能的荧光定量PCR可以一次完成以往多次实验才能完成的优化过程,简化了摸索 PCR反应条件的繁琐实验,既节省实验时间提高效率,又节省实验成本。 误区二:仪器通道越多越好 随着PCR技术的成熟运用,多重扩增越来越热闹,荧光定量PCR仪也不能幸免。 从最初ABI公司推出的单通道荧光定量PCR仪发展到如今各个厂家都推出4通道、5通道甚至6通道荧光定量PCR仪,眼花缭乱的选择让人无所适从,就有人一不小心走进了“通道越多越好”的误区。 在使用有些厂家5通道的荧光定量仪时,为了确保实验结果的精确性和准确性都要在实验中使用ROX(一种荧光染料)或专用的Reference dye ,这些荧光染料都必须单独使用一个检测通道。 所以,真正能检测多重PCR荧光信号的有效通道只有4个,而且使用校正染料可能会增加后期的使用成本。 有的荧光定量PCR的检测通道是只为自已厂家的专用的荧光染料或试剂开放的,有效检测通道也绝非像宣传资料中宣称的那么多。 在购买前确认荧光定量PCR仪器的有效检测通道尤为重要,不能单单只听宣传。 考虑多重荧光定量PCR的通道数的时候也应该从实验室实际情况出发,多重PCR并非人人适用、人人可用,因为它使实验复杂化了。 当我们看清误区,在选择一款最适合自己需求的荧光定量PCR仪时,我们又该关注些什么呢?
ATP荧光检测仪在食品行业中有广泛的应用,主要用于食品卫生和质量控制方面。ATP(腺苷三磷酸)荧光检测仪可以快速检测样品中的微生物活性,通过测量样品中的ATP含量来评估食品表面的清洁程度、卫生状况以及卫生程序的有效性。以下是ATP荧光检测仪在食品行业中的一些具体用途: 卫生监测: ATP检测仪可以用于监测食品加工设备、生产线和工作台等表面的卫生状况。通过检测表面的ATP含量,可以迅速判断卫生程度,及时采取清洁措施,确保食品加工环境的卫生安全。 清洁验证: 在食品加工过程中,设备和工具的清洁是防止交叉污染和食品安全问题的关键。ATP荧光检测仪可以用于验证设备和工具的清洁程度,确保它们在使用前达到卫生要求。 卫生程序监控: 食品加工企业通常有卫生操作程序(SOPs)来确保卫生标准得到遵守。ATP检测仪可以用于监控这些卫生程序的有效性,确保清洁和卫生措施的落实情况。 食品安全管理: 使用ATP荧光检测仪可以迅速识别食品加工环境中可能存在的微生物污染源。这有助于提前发现潜在食品安全风险,并及时采取措施进行管理和控制。 质量控制: 通过定期使用ATP检测仪,食品生产企业可以监测生产过程中可能影响产品质量和食品安全的环境因素。这有助于提高产品质量的一致性。 设备维护: ATP荧光检测仪还可以用于监测设备的维护情况。设备的正常维护可以减少污染源和交叉污染的风险。 总的来说,ATP荧光检测仪在食品行业中的应用有助于保障食品加工环境的卫生安全,预防食品污染,确保产品的质量和安全。它能够提供快速、定量的信息,帮助食品企业更好地管理卫生风险,提高食品生产的可靠性和合规性。

[img=,412,404]http://ng1.17img.cn/bbsfiles/images/2017/07/201707061725_01_3194653_3.png[/img] SaCycler-96 [url=http://www.fameinstrument.com.cn/Product/1543022830.html]荧光定量PCR仪[/url]系统特点:- 4个或5个检测通道可以同时检测样孔中5色荧光;- 灵活性强,适于96孔板、试管和测试条等- 最先进的系统,保证最高的灵敏度- 独特设计保证优化的信噪比和消除信号串扰- LED灯寿命超过100,000小时,无需维护- 使用综合曝光方法实现光谱检测,优化了信号配准,大大简化甚至避免了荧光配准;- 人性化的软件系统对于新手上手容易,对于熟练人员可以开启全功能模式- 使用户在程序运行中可以查看之前的分析结果- 断电保护,程序可以自动恢复运行- 数据输出兼容标准的图标或文本形式,方便数据分析- 可以联机使用,最多一台电脑可以控制8台荧光定量PCR仪技术参数:1. 测样品量: 96个样品2. 样品管类型: 0.2ml3. 光学系统: 四或五通道,具备同时检测5色荧光的能力4. 光源: LED5. 检测器: CCD6. 检测通道: 4或57. 检测灵敏度: 0.05*10E-12M8. 温度分辨率: 0.1℃9. 升温速率: 最大3.5℃/s10.降温速率: 最大2.5℃/s11.温度均一性: ±0.15℃ at 95℃12.温控准确性: ±0.2℃ at 95℃13.功率: 500W14.模块温度范围: 0-105℃15.热盖温度: 105℃±1℃16.热驱动: 半导体原件17.电脑接口: USB接口发射/检测荧光组合 470/520,530/570,585/633,633/670,690/750仪器重量 27kg仪器尺寸 210 x 540 x 540mm(W x H x D)PLoS ONE 9(1): e86047. doi:10.1371/journal.pone.0086047
全反射X荧光仪,用的探头SSD是EDAX的,比较老,捆绑个液氮罐做冷却的那种。现在遇到点问题请教:W靶源信号强度正常,28万cps左右。 可检测样品的时候所有元素均无信号,计数全部为0。示波器检测SSD无任何信号,噪音信号都没有啊。。。这是啥情况呢?有明白人不?前置放大器坏了?AM,A/D转化器还是FET。。。要如何确定故障源头,维修有啥建议?另请问哪里接收对外的有偿样品检测?12寸硅片表面的金属定量。pg-ng级的?有谁有老的SSD备件出售意愿的也可联系啊。。。急死我了
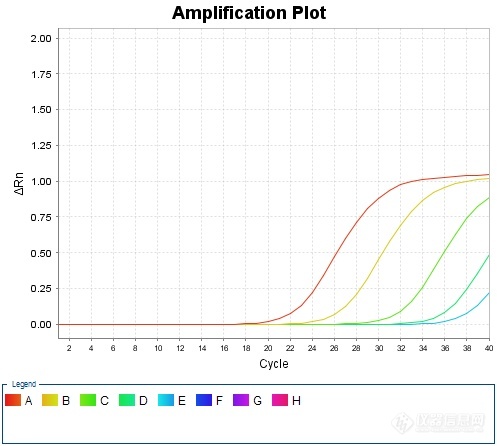
[color=black]猪圆环病毒荧光定量[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测方法的模块化构建及实践[/color][color=black]1 前言[/color][color=black]猪圆环病毒(porcine circovirus,PCV)在分类学上属圆环病毒科圆环病毒属,为已知的最小的动物病毒之一。病毒粒子直径14~17nm,呈20面体对称结构,无囊膜,含有共价闭合的单股环状负链DNA,基因组大小约为1.76kb。[/color][color=black]PCV对外界理化因子的抵抗力相当强,即便在PH3的酸性环境及72℃的高温环境中也能存活一段时间,氯仿作用不失活,无血凝活性。现已知PCV有两个血清型,即PCV1和PCV2。PCV1为非致病性的病毒,PCV2为致病性的病毒,是断奶仔猪多系统衰竭综合征(Postweaning Multisystemic Wasting Syndrome,PMWS)、皮炎与肾病综合征(Porcine Dermatitis and Nephropathy Syndrome,PDNS)的主要病原。猪对PCV2具有较强的易感性,感染猪可自鼻液、粪便等废物中排出病毒,经口腔、呼吸道途径感染不同年龄的猪。[/color][color=black]在病猪鼻黏膜、支气管、肺脏、扁桃体、肾脏、脾脏和小肠中有PCV2粒子存在。胸腺、脾、肠系膜、支气管等处的淋巴组织中均有该病毒,其中肺脏及淋巴结中检出率较高。表明PCV2严重侵害猪的免疫系统:病毒与巨噬细胞/单核细胞、组织细胞和胸腺巨噬细胞相伴随,导致患猪体况下降,形成免疫抑制。因此,有必要对猪圆环病毒进行检测,对感染PCV2的商品猪进行疫苗免疫,对PCV2长期阳性的种猪予以淘汰。[/color][color=black]2 模块化检测方法思路[/color][color=black]总体思路是:将动物疫病荧光定量[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测分为三个模块,核酸提取采用DNA/RNA共提试剂,核酸扩增采用预混液+引物探针方式,质控品利用抗原或商品化疫苗自制。具体思路如下:[/color][color=black]——核酸提取采用DNA/RNA共提试剂;[/color][color=black]——引物探针严格按照标准方法,委托生物工程公司合成;[/color][color=black]——反应体系中其他成分,采购商品化q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液;[/color][color=black]——质控品:阳性对照采用商品化疫苗,测定结果后按一定比例稀释,保存备用。[/color][color=black]——反应体系:设为20μL,其中包含:预混液(2×)10μL、ROX 0.4μL为固定量,引物探针加入量根据检测标准中的终浓度予以换算,加灭菌水补足18μL,RNA模板为2μL;[/color][color=black]——反应条件首先按照标准中的条件开展摸索,如达到预期效果则予以固定;如效果不佳则参照预混液及引物探针推荐条件进行适当调整。[/color][color=black]3 材料和方法[/color][color=black]3.1 病毒[/color][color=black]猪圆环病毒疫苗。[/color][color=black]3.2 试剂[/color][color=black]DNA/RNA共提试剂盒:FastPure Viral DNA/RNA Mini Kit试剂盒,南京诺维赞生产;[/color][color=black]q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液:AceQ Universal U+ Probe Master Mix V2,南京诺维赞生产。[/color][color=black]3.3 引物探针[/color][color=black]按照GB/T 35901-2018 《猪圆环病毒2型荧光[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测方法》提供的序列,委托上海生工合成,引物稀释成10μmol/L、探针稀释成5μmol/L,分装成小包装冷冻保存备用。具体序列如下:[/color][color=black]正向引物:5’-GGAGTCTGGTGACCGTTGC-3’[/color][color=black]反向引物:5’-CCAATCACGCTTCTGCATTTT-3’[/color][color=black]探 针:5’-FAM-CCGCTCACTTTCAAAAGTTCAGCCA-BHQ1 -3’[/color][color=black]3.4 反应体系[/color][color=black]根据GB/T 35901-2018 《猪圆环病毒2型荧光[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测方法》所载反应体系,按照终浓度一致原则予以转化。具体转换方法:[/color][color=black]——反应体系总体积设定为20μL;[/color][color=black]——将标准中反应体系的10×[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] Buffer、MgCl2、dNTPs、Taq酶等成分转换为q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液10μL(推荐量);[/color][color=black]——因使用ABI7500荧光[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]仪,故在体系中加入ROX 0.4μL;[/color][color=black]——标准中正向引物、反向引物、探针的终浓度分别为0.2μmol/L、0.2μmol/L和0.12μmol/L,故在修改后的体系中加入量为0.4μL、0.4μL和0.48μL;[/color][color=black]——总DNA加入量修改为2μL(根据经验该加入量已经足够);[/color][color=black]——根据上述各成分用量,补充体积的无核酸酶水修改为6.32μL。[/color][table][tr][td][color=black]标准方法[/color][/td][td][/td][td][/td][td][color=black]修改方法[/color][/td][td][/td][/tr][tr][td][color=black]10Χ [url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] Buffer[/color][/td][td][align=center][color=black]5.0[/color][/align][/td][td][/td][td][color=black]2Χ q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液[/color][/td][td][align=center][color=black]10[/color][/align][/td][/tr][tr][td][color=black]Taq酶(5U/μL)[/color][/td][td][align=center][color=black]2.0[/color][/align][/td][td][/td][td][color=black]ROX[/color][/td][td][align=center][color=black]0.4[/color][/align][/td][/tr][tr][td][color=black]dNTPs(100mmol/L)[/color][/td][td][align=center][color=black]1.5[/color][/align][/td][td][/td][td][color=black]正向引物(10μmol/L)[/color][/td][td][align=center][color=black]0.4[/color][/align][/td][/tr][tr][td][color=black]MgCl2[/color][/td][td][align=center][color=black]0.25[/color][/align][/td][td][/td][td][color=black]反向引物(10μmol/L)[/color][/td][td][align=center][color=black]0.4[/color][/align][/td][/tr][tr][td][color=black]正向引物(10μmol/L)[/color][/td][td][align=center][color=black]1.0[/color][/align][/td][td][/td][td][color=black]探针(5μmol/L)[/color][/td][td][align=center][color=black]0.48[/color][/align][/td][/tr][tr][td][color=black]反向引物(10μmol/L)[/color][/td][td][align=center][color=black]1.0[/color][/align][/td][td][/td][td][color=black]无核酸酶水[/color][/td][td][align=center][color=black]6.32[/color][/align][/td][/tr][tr][td][color=black]探针(10μmol/L)[/color][/td][td][align=center][color=black]0.6[/color][/align][/td][td][/td][td][color=black]总DNA[/color][/td][td][align=center][color=black]2.0[/color][/align][/td][/tr][tr][td][color=black]无核酸酶水[/color][/td][td][align=center][color=black]26.95[/color][/align][/td][td][/td][td][color=black]总体积[/color][/td][td][align=center][color=black]20[/color][/align][/td][/tr][tr][td][color=black]内参质粒[/color][/td][td][align=center][color=black]0.2[/color][/align][/td][td][/td][td][/td][td][/td][/tr][tr][td][color=black]总DNA[/color][/td][td][align=center][color=black]10[/color][/align][/td][td][/td][td][/td][td][/td][/tr][tr][td][color=black]总体积[/color][/td][td][align=center][color=black]50[/color][/align][/td][td][/td][td][/td][td][/td][/tr][/table][color=black]3.5 反应条件[/color][color=black]参照GB/T 35901-2018 《猪圆环病毒2型荧光[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测方法》推荐的扩增程序,结合ABI7500荧光采集时间不能少于34s的要求,进行预试验。扩增程序如下:[/color][color=black]50℃2min →95℃2min →(95℃15s → 60℃34s)*40[/color][color=black]如扩增结果理想,则不做修改直接采纳,否则进行适当调整。[/color][color=black]4 试验结果[/color][color=black]对猪圆环病毒疫苗(SH株)进行核酸检测,结果较理想。扩增曲线如下:[/color][align=center][img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009251444312083_9380_1627156_3.jpg[/img][/align][color=black]5 阳性质控的制备[/color][color=black]根据GB/T 35901-2018 《猪圆环病毒2型荧光[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测方法》规定,阳性对照应Ct≤30。对猪圆环病毒疫苗(SH株)适当稀释后进行再次检测,结果如下:[/color][table][tr][td][align=center][color=black]稀释倍数[/color][/align][/td][td][align=center][color=black]1:10^0[/color][/align][/td][td][align=center][color=black]1:10^1[/color][/align][/td][td][align=center][color=black]1:10^2[/color][/align][/td][td][align=center][color=black]1:10^3[/color][/align][/td][/tr][tr][td][align=center][color=black]PCV-2疫苗[/color][/align][/td][td][align=center][color=black]20.99[/color][/align][/td][td][align=center][color=black]25.17[/color][/align][/td][td][align=center][color=black]30.68[/color][/align][/td][td][align=center][color=black]34.80[/color][/align][/td][/tr][/table][color=black]经综合判定,最后采用猪圆环病毒疫苗(SH株)作1: 10^1稀释,分装为200μL/管作为阳性质控,Ct值约25,-70℃冻存备用。[/color][color=black]6 讨论[/color][color=black]6.1 检测工作更加方便高效[/color][color=black]一是在核酸提取环节采用了DNA/RNA共提试剂,待检样品经一次提取核酸,除可应用于圆环病毒、非洲猪瘟等DNA病毒项目检测外,还可应用于口蹄疫、蓝耳病等RNA病毒项目检测;[/color][color=black]二是由于实验室储备了足够量的q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液,在开展检测时,不必担心部分检测量较少的项目由于试剂组分不足而罢工事件的发生;[/color][color=black]三是由于q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液适用于多数DNA病毒项目的检测,在检测任务发生重大变化时,可以方便地调整检测项目,不必担心试剂不足或浪费情况的发生。[/color][color=black]6.2 阳性质控品制备方便[/color][color=black]猪圆环病毒疫苗是较常用的动物免疫用疫苗,只需对疫苗进行含量测定,进行一定比例的稀释即可作为实验室内部的阳性质控品。[/color][color=black]6.3 适用性有待进一步验证[/color][color=black]尽管在构建新方法时,对适用性进行了验证,但对于其他毒株,尤其是较新型的变异株是否有效,尚有待进一步观察和验证。[/color][color=black]6.4 严格依法依规操作[/color][color=black]如果有关法律法规或上级有关部门出台政策,要求采用获批准的成品试剂盒用于检测,则实验室必须及时停止自建方法的使用。[/color]
用荧光光谱分析法进行RoHS检测RoHS禁令简介 RoHS是《电气、电子设备中限制使用某些有害物质指令》(the Restriction of the use of certain hazardous substances in electrical and electronic equipment)的英文缩写,主要限制电气、电子产品中的铅Pb、镉Cd、汞Hg、六价铬Cr(VI)、多溴联苯PBB、多溴联苯醚PBDE6种有害物质含量。产品中各物质的最大容许含量分别为:Cd为100ppm,Pb、Hg、Cr(VI)、PBB和PBDE为1000ppm。该指令由欧洲议会及理事会提出,欧盟成员国已于2006年7月1日起强制实施。我国七部委联合发布第 39 号令《电子信息产品污染控制管理办法》自2007年3月1日起施行。 电子信息产品,是指采用电子信息技术制造的电子雷达产品、电子通信产品、广播电视产品、计算机产品、家用电子产品、电子测量仪器产品、电子专用产品、电子元器件产品、电子应用产品、电子材料产品等产品及其配件。在电子信息产品中限制使用铅、汞、镉、六价铬、多溴联苯(PBB)和多溴二苯醚(PBDE)等六种有害物质。 荧光光谱分析法进行RoHS检测的主要特点 检测上述6种物质的方法有两种:一种是采用合适的混合酸进行全消解,必要时对有机物进行微波加温加压消解后,使用等离子体发射光谱仪/质谱仪(ICP)、[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱仪[/color][/url](AAS)、紫外分光光度计(UV-VIS)以及[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]/质谱联用仪(GC-MS)等进行定量分析,这种方法主要优点是可对样品进行定量分析,缺点是制样复杂且周期长,样品需要破坏,制样要求高和设备投资大等。 另一种为荧光光谱分析法(XRF),其又可分为波长散射(WD-XRF)和能量散射(ED-XRF)两种。原理是通过X射线照射样品,撞击原子使外层电子产生能级迁跃,低能级电子获得能量向高能级迁跃,并在原来的地方留下空位,而部分高能级的电子则填补到这些空位中。在填补的这个过程中,高能级的电子失去能量,这些能量以荧光X射线的方式释放。根据原子不同以及发生的迁跃层(shell)不同,这些荧光X射线的能量也不一样。检测设备有一探测器,对这些荧光X射线粒子进行收集。然后根据能量来判别元素的种类,根据收集到的粒子的强度来计算元素的含量。该方法有半定量分析和定量分析之分。半定量分析叫FP(Fundamental Parameter)方法,原理是先进行定性分析,然后根据检出的荧光X线强度以及元素的比率等理论计算各成分的含有量。定量分析一般采用检量线法,首先对多个标准试料进行测试,做成基准的检量线,然后测试实际的样品,并和检量线进行比较,从而确定实际样品中元素的含有量。 用荧光光谱分析法(XRF)检测RoHS,主要特点是不需复杂的样品前处理,可对金属、树脂、粉体、液体等任何形态的样品进行无损直接测定,能快速简单地测定镉(Cd)、铅(Pb)、汞(Hg)、总铬(Cr)和总溴(Br)。检测RoHS的主要依据是SJ/T11365-2006《电子电气产品中有毒有害物质的检测方法》,用X射线荧光光谱仪对电子信息产品中有毒有害筛选的测试方法。 荧光光谱分析法(XRF)能够检测铬,只是不能区别样品中是有毒的六价铬,还是三价铬形态。如果样品中总铬含量低于限定范围(≤700ppm),表明六价铬较低(小于1000ppm),如果不存在此状况,就需要进行有害性化学分析。可以采用SJ/T11365-2006《电子电气产品中有毒有害物质的检测方法》中比色法测试六价铬,或采用分光光度法(UV-VIS)进行定量分析。 一般样品中含有的溴化物并不局限于PBB、PBDE 或是四溴双酚这些物质,自然界中存在的溴化物有几百万种,但是用荧光光谱分析法(XRF)进行检测无法分辨样品中含有的是哪一种溴化物,只能判断含有溴,因此荧光光谱分析法(XRF)的检测结果是总溴的含量。同样的规则,如果PBB和PBDE中的总溴含量低于限定值(≤300ppm)范围的话,就可判定PBB和PBDE不超标,否则可用[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]/质谱联用仪(GC-MS)进行定量分析。 用荧光光谱分析法(XRF)检测RoHS,对检测样品的形状大小有一定要求,面积应大于2mm2,金属样品的厚度应大于0.2mm ,非金属品的厚度应大于2mm,样品的形状和大小对测试结果有很大影响。检测表面光滑、材质均一的样品时,精度比较高,因此检测中可适当考虑改善样品。因电子产品的成品和半成品由多种材料组成,首先必须进行拆解,直至得到无法进一步机械拆解的最小均质材料检测单元,并使其符合检测要求。 测试时不能只看数据,同时还要看谱图,因元素之间存在相互干扰。典型的干扰有铑、锑干扰镉,溴、砷干扰铅,As干扰PbLa ,Br干扰PbLb。尤其是在测试结果超出标准值时,一定要注意观察谱线图上被测元素是否受其他可能干扰元素的影响。 在使用荧光光谱分析法(XRF)作检测时,需要注意的是,它只是用来做筛选的,而且只是测试样品一定厚度的表层,这一结果不能和ICP等定量分析结果相比较。如果测试样品是比较均质的材质,只要调整好其参数,用其来分析的无标线结果也很不错,对于通过筛选测试的材料,可不再进行确证测试,节省时间和成本。 材料分类 电子电气产品及部件的材料分类如下: 1.聚合物类:塑料、橡胶、泡棉等; 2.金属类:金属板材、支架等; 3.电子元器件类:线路板、电阻、电容等; 4.其他类:添加剂、涂料、颜料、绝缘漆、玻璃、搪瓷、胶木、墨水、瓷等。 对于无法拆解(重量≤10mg或体积≤1.2mm3)的非均质组件,须使用低温破碎、研磨等方式制成均质检测单元,再进行检测。 六种有毒有害物质存在的高风险区域及替代物 1.铅主要存在于塑料添加剂、颜料、稳定剂、电池、焊接材料、镀层材料、玻璃、灯泡、电子元器件、橡胶、固体润滑剂、陶瓷制品、印制线路板、包装材料等。 其中线路板的焊锡是由63%的锡和37%的铅组成的共晶焊锡,这种焊锡的熔点是183 ℃。目前可以采用无铅焊接技术和工艺来取代常规的焊接工艺,由于焊接设备的不同,无铅焊接的材料也不同。手工焊一般采用 Sn-Cu、Sn-Ag或Sn-Ag-Cu,浸焊和波峰焊可采用Sn-Cu,回流焊可采用Sn-Ag和Sn-Ag-Cu。 此外可使用新型无铅塑料热稳定剂来替代,如金属皂类热稳定剂、有机锡类热稳定剂、有机锑热稳定剂、稀土热稳定剂等。 2.镉主要存在于塑料稳定剂、低压电器触点的镀层、电池、安定剂、电镀、塑料制品之色粉、防腐剂、消毒剂、粘结剂、包装材料、半导体光电感应器等。 低压电器领域中镉,可用银氧化锡、氧化铟(AgSnO2、In2O3)来代替银氧化镉(AgCdO)。 其他可替代物还有锡-锡合金、锌-锌合金、铝涂层、镍、环氧化物、可塑剂涂层等。 3. 汞主要存在于塑料添加剂、温控器、传感器、继电器、日光灯、金属蚀刻剂、电池、防腐剂、消毒剂、粘结剂等。可以使用氢镍和锂离子等可充电电池来替代含汞电池,使用不含汞的新型温控器和传感器等。 4. 铬(六价)主要存在于金属防腐蚀涂层、颜料、合金、包装材料、防锈剂、防腐蚀剂、陶瓷釉、皮革部件等。可以采用含丙烯酸树指、钼酸盐/磷酸盐的钝化液,或碱性镀锌来替代镀铬,用Cr3+ 代替 Cr6+ 来减轻对环境的危害程度,或不使用电镀件。 5. 多溴联苯和多溴二苯醚主要存在于阻燃剂、PCB、连接器、塑料外壳等。可以使用磷系、锑系阻燃剂代替溴系阻燃剂,或使用无机阻燃剂氢氧化镁、氢氧化铝等。
荧光定量PCR(也称TaqMan PCR,以下简称FQ-PCR)是美国PE(Perkin Elmer)公司1995年研制出来的一种新的核酸定量技术,该技术是在常规PCR基础上加入荧光标记探针来实现其定量功能的,与变通PCR相比,FQ-PCR具有许多优点。本文拟就该技术的特点、原理和方法以及应用作一简要叙述。一、特点FQ-PCR不仅具有普通PCR的高灵敏性,而且由于荧光探针的应用,可以通过光电传导系统直接探测PCR扩增过程中荧光信号的变化以获得定量结果,所以还具有DNA杂交的高特异性和光谱技术的高精确性,克服了常规PCR的许多缺点。如一般PCR产物都需通过琼脂糖凝胶电泳和溴化乙锭染色紫外光观察结果或通过聚丙烯酰胺凝胶电泳和银染检测,不仅需要多种仪器,而且费时费力,所使用的染色剂溴化乙锭对人体又有害,这些繁杂的实验过程又给污染和假阳性提供了机会。而FQ-PCR只须在加样时打开一次盖子,其后的过程完全是闭管操作,不需要PCR后处理,避免了常规PCR操作中的诸多弊端。实验一般使用PE公司研制的ABI7100型PCR扩增仪。该仪器具有以下特点:①应用广泛:可用于DNA和RNA的PCR产物定量、基因表达研究、病原体检测及PCR条件的优化等。②独特的定量原理:采用荧光标记探针,经激光激发后荧光量随PCR循环而累积,从而达到定量目的。③工作效率高:内置9600型PCR扩增仪,电脑控制1~2小时全自动同步完成96个样品的扩增及定量。④无须凝胶电泳:无须对样品进行稀释和电泳,只须通过特殊探头在反应管内直接检测。⑤无管道内污染:采用独特全封闭反应管及光电传导系统,无须顾及污染。⑥结果重现性好:定量动态范围高达五个数量级。所以自从此项技术研制成功以来,受到许多科研工作者的重视并在多个领域得到应用。二、原理和方法FQ-PCR的工作原理是利用Taq酶的5’→3’外切酶活性,在PCR反应系统中加入一个荧光标记探针。该探针可与引物包含序列内的DNA模板发生特异性杂交,探针的5’端标以荧光发射基因FAM(6-羧基荧光素,荧光发射峰值在518nm处),靠近3’端标以荧光淬灭基团TAMRA(6-羧基四甲基若丹明,荧光发射峰值在582nm处),探针的3’开端被磷酸化以防止探针在PCR扩增过程中被延伸。当探针保持完整时,淬灭基团抑制发射基团的荧光发射。发射基团一旦与淬灭基团发生分离,抑制作用被解除,518nm处的光密度增加而被荧光探测系统检测到。复性期探针与模板DNA发生杂交,延伸期Taq酶随引物延伸沿DNA模板移动,当移动到探针切断,淬灭作用被解除,荧光信号释放出来(见图)。模板每复制一次,就有一个探针被切断,伴随一个荧光信号的释放。由于被释放的荧光基团数目和PCR产物数量是一对一的关系,因此用该技术可对模板进行准确定量。实验仪器一般使用PE公司研制的ABI7100型 PCR扩增仪,也可用其它PCR仪。如果用ABI7700型反应型反应系统进行实验,反应结束后,通过电脑分析,可直接给出定量结果。如果用其他PCR仪,则需要同时使用荧光探测仪测量反应管中的荧光信号,计算出RQ+、RQ-、△RQ。RQ+代表样品管荧光发射基团发光强度与淬灭基团发光强度的比率,RQ-代表空白管中二者的比率,△RQ(△RQ=RQ+-RQ-)代表PCR过程中荧光信号变化量,经过数据处理,即可得出定量结果。由于荧光探针的引入,显著提高了实验的特异性。探针设计一般应符合以下条件:①探针长度应在20~40个碱基左右,以保证结合的特异性。②GC碱基含量在40%~60%,避免单核苷酸序列的重复。③避免与引物发生杂交或重叠。④探针与模板结合的稳定程度要大于引物与模板结合的稳定程度,因此探针的Tm值要比引物的Tm值至少高出5℃。另外,探针的浓度、探针与模板序列的同源性,探针与引物的距离都对实验结果有影响。 http://www.biomart.cn/upload/asset/2008/07/21/1216476450.gif图.TaqMan PCR反应模式 (A)聚合反应;(B)链置换;(C)裂解; (D)聚合完成(R:FAM;Q:TAMRA,FP:上游引物;RP:下游引物)
现在很多超市和农贸市场以及工商检测都用上了快速检测设备,那么我们就来讨论一下,为什么要用快速检测,快检测的优势是什么,不足是什么?,定量检测的有点有哪些,不足是什么? 快速检测,就是在检测时速度较快,比常规的定量检测速度快,这个没有一个比较明确的定义。快速检测最大优势就是速度快,但是缺点也一样的明显,准确度差。但是在食品检测中有很多时候,要求检测速度要快,准确度可以不要求那么高。如果检测速度慢了,等检测结果出来,可能被检测产品已经灭失了,检测结果也就失去了检测的意义。用快速检测可以快速筛选出不合格产品,在交由定量检测,进行准确定量。这样可以加快检测的速度,扩大检测范围。快速检测需要定量检测的配合,没有定量检测的配合,快速检测的结果不具备执法凭据的功能。 定量检测,胜在检测结果准确,但是相对速度较慢,一般需要两个小时以上,有的检测结果可能需要几天或几周,限制了检测范围的扩大。而且定量检测需要的设备多,价格昂贵,要求操作人员有较高的文化水平及技能,限制的定量检测的推广。综上所述,我觉得,快速检测可以大面积的推广,定量检测重点检查。相互配合,一起把好食品质量检测关。检测方法,我觉得没有孰高孰低的区别,只要运用得当就是好的检测方法。欢迎各位一起来讨论,共同完善。
[b]上个世纪90年代原美国Perkin Elmer( PE)公司开发出了Taqman荧光探针定量技术,将定量PCR带入了更广阔的应用空间。Taqman探针法的出现是定量PCR技术的重要里程碑,之后在此基础上发展出了杂交探针法,以及荧光引物法,是对探针法的不断改进和简化。如果希望全面掌握定量PCR技术的研究人员就不能错过这些定量检测技术。[/b]
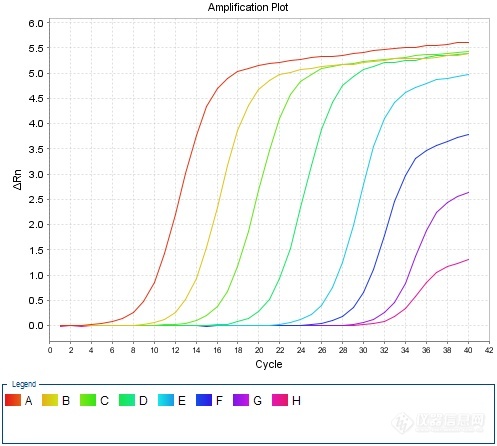
动物A型流感荧光定量[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测方法的模块化构建及实践1 前言流感病毒(influenza virus)属正粘病毒科,根据抗原特性及其基因特性的不同,流感病毒分为甲型(A型)、乙型(B型)、丙型(C型)。乙型变异性较弱、丙型抗原性比较稳定,仅感染人类;甲型(A型)抗原变异性最强,感染人类和其他动物,常引起世界性大流行。甲型流感病毒中至今发现能直接感染人的禽流感病毒亚型有:甲型H1N1、H5N1、H7N1、H7N2、H7N3、H7N7、H7N9、H9N2和H10N8。其中H1、H5、H7亚型为高致病性,H1N1、H5N1、H7N9尤为值得关注。甲型流感病毒根据H和N抗原不同,又分为许多亚型,H可分为18个亚型(H1~H18),N有11个亚型(N1~N11)。其中仅H1N1、H2N2、H3N2主要感染人类,其它许多亚型的自然宿主是多种禽类和动物。其中对禽类危害最大的为H5、H7和H9亚型毒株。一般情况下,禽流感病毒不会感染鸟类和猪以外的动物。但1997年香港首次报道发生18例H5N1人禽流感感染病例,其中6例死亡,引起全球广泛关注。1997年以后,世界上又先后几次发生了禽流感病毒感染人的事件。具有高致病性的H5N1、H7N7、H7N9、H9N2等禽流感病毒,一旦发生变异而具有人与人的传播能力,会导致人间禽流感流行,预示着禽流感病毒对人类已具有很大的潜在威胁。为确保公共卫生安全,以及畜牧业健康发展,有必要实施A型动物流感核酸监测,尽早发现疫情隐患并予以及时处置,避免重大动物疫情及公共卫生安全事件发生。2 模块化检测方法思路总体思路是:将动物疫病荧光定量[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测分为三个模块,核酸提取采用DNA/RNA共提试剂,核酸扩增采用预混液+引物探针方式,质控品利用抗原或商品化疫苗自制。具体思路如下:——核酸提取采用DNA/RNA共提试剂;——引物探针严格按照标准方法,委托生物工程公司合成;——反应体系中其他成分,采购商品化RT-q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液(含逆转录酶);——质控品:阳性对照采用病毒抗原、商品化疫苗等,测定结果后按一定比例稀释,保存备用。——反应体系:设为20μL,其中包含:预混液(2×)10μL、逆转录酶1μL、ROX 0.4μL为固定量,引物探针加入量根据检测标准中的终浓度予以换算,加灭菌水补足18μL,DNA或RNA模板为2μL;——反应条件首先按照标准中的条件开展摸索,如达到预期效果则予以固定;如效果不佳则参照预混液及引物探针推荐条件进行适当调整。3 材料和方法3.1 病毒禽流感血凝抑制抗原,包括H5亚型Re-4、Re-6、Re-7、Re-8、Re-11、Re-12等毒株,以及H7、H7N9、H7N9Re-2等毒株。3.2 试剂DNA/RNA共提试剂盒:FastPure Viral DNA/RNA Mini Kit试剂盒,南京诺维赞生产;RT-q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液:2× One Step Q Probe Mix,南京诺维赞生产;逆转录酶:One Step Q Probe Enzyme Mix,南京诺维赞生产。3.3 引物探针按照GB/T27539-2011《动物流感检测 A型流感病毒通用荧光RT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测方法》提供的序列,委托上海生工合成,引物稀释成10μmol/L、探针稀释成5μmol/L,分装成小包装冷冻保存备用。具体序列如下;正向引物:5’-GTC TTC TAA CCG AGG TCG AAA C-3’反向引物:5’-AAG ATC TGT GTT CTT TCC T[url=https://insevent.instrument.com.cn/t/Mp]gc[/url] AAA-3’探 针:5’-FAM-CCC TCA AAG CCG AGA TCG C-TAMRA-3’3.4 反应体系根据GB/T27539-2011所载反应体系,按照终浓度一致原则予以转化。具体转换方法:——反应体系总体积设定为20μL;——将标准中反应体系的10×[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] Buffer、M[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]l2、dNTPs、Taq酶、反转录酶等成分转换为RT-q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液10μL、逆转录酶1μL(推荐量);——因使用ABI7500荧光[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]仪,故在体系中加入ROX 0.4μL;——标准中正向引物、反向引物、探针的终浓度分别为0.2μmol/L、0.2μmol/L和0.16μmol/L,故在修改后的体系中加入量为0.4μL、0.4μL和0.64μL;——总RNA加入量修改为2μL(根据经验该加入量已经足够);——根据上述各成分用量,补充体积的无核酸酶水修改为5.16μL。[table][tr][td=2,1][align=center][color=black]GB/T27539-2011[/color][/align][/td][td] [/td][td=2,1][align=center][color=black]修改方法[/color][/align][/td][/tr][tr][td][color=black]10× [url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] Buffer[/color][/td][td][align=center][color=black]1.25[/color][/align][/td][td] [/td][td][color=black]2× RT-q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液[/color][/td][td][align=center][color=black]10[/color][/align][/td][/tr][tr][td][color=black]正向引物(10μmol/L)[/color][/td][td][align=center][color=black]0.5[/color][/align][/td][td] [/td][td][color=black]酶混合液[/color][/td][td][align=center][color=black]1[/color][/align][/td][/tr][tr][td][color=black]反向引物(10μmol/L)[/color][/td][td][align=center][color=black]0.5[/color][/align][/td][td] [/td][td][color=black]ROX[/color][/td][td][align=center][color=black]0.4[/color][/align][/td][/tr][tr][td][color=black]探针(5μmol/L)[/color][/td][td][align=center][color=black]0.8[/color][/align][/td][td] [/td][td][color=black]正向引物(10μmol/L)[/color][/td][td][align=center][color=black]0.4[/color][/align][/td][/tr][tr][td][color=black]M[url=https://insevent.instrument.com.cn/t/Mp]gc[/url]l2[/color][/td][td][align=center][color=black]0.75[/color][/align][/td][td] [/td][td][color=black]反向引物(10μmol/L)[/color][/td][td][align=center][color=black]0.4[/color][/align][/td][/tr][tr][td][color=black]dNTPs[/color][/td][td][align=center][color=black]0.1[/color][/align][/td][td] [/td][td][color=black]探针(5μmol/L)[/color][/td][td][align=center][color=black]0.64[/color][/align][/td][/tr][tr][td][color=black]Taq酶(5U/μL)[/color][/td][td][align=center][color=black]0.25[/color][/align][/td][td] [/td][td][color=black]总RNA[/color][/td][td][align=center][color=black]2[/color][/align][/td][/tr][tr][td][color=black]反转录酶[/color][/td][td][align=center][color=black]0.25[/color][/align][/td][td] [/td][td][color=black]无核酸酶水[/color][/td][td][align=center][color=black]5.16[/color][/align][/td][/tr][tr][td][color=black]无核酸酶水[/color][/td][td][align=center][color=black]10.6[/color][/align][/td][td] [/td][td][color=black]总体积[/color][/td][td][align=center][color=black]20[/color][/align][/td][/tr][tr][td][color=black]总RNA[/color][/td][td][align=center][color=black]10[/color][/align][/td][td] [/td][td] [/td][td] [/td][/tr][tr][td][color=black]总体积[/color][/td][td][align=center][color=black]25[/color][/align][/td][td] [/td][td] [/td][td] [/td][/tr][/table]3.5 反应条件参照GB/T27539-2011推荐的扩增程序,结合ABI7500荧光采集时间不能少于34s的要求,进行预试验。扩增程序如下:42℃30min→92℃3min→(92℃10s→45℃30s→72℃1min)*5→(92℃10s→60℃34s)*40如扩增结果理想,则不做修改直接采纳,否则进行适当调整。4 试验结果对禽流感病毒包括H5亚型Re-4、Re-6、Re-7、Re-8、Re-11、Re-12等毒株,以及H7、H7N9、H7N9Re-2等毒株均进行了核酸检测,结果均较理想。部分扩增曲线如下:[img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009111821171194_5020_1627156_3.jpg[/img]H5亚型Re-8抗原扩增曲线[img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009111821173647_113_1627156_3.jpg[/img]H5亚型Re-11抗原扩增曲线[img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009111821176118_9242_1627156_3.jpg[/img]H5亚型Re-12抗原扩增曲线[img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009111821177169_9932_1627156_3.jpg[/img]H7N9抗原扩增曲线[img]https://ng1.17img.cn/bbsfiles/images/2020/09/202009111821178224_1520_1627156_3.jpg[/img]H7N9 Re-2抗原扩增曲线5 阳性质控的制备根据GB/T 27539-2011 《动物流感检测 A型流感病毒通用荧光RT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测方法》规定,阳性对照应Ct28。结合各抗原扩增情况,挑选了H5亚型Re-8、Re-11、Re-12三种抗原适当稀释后进行再次检测,结果如下:[table][tr][td][align=center]稀释倍数[/align][/td][td][align=center]1:10^3[/align][/td][td][align=center]1:10^4[/align][/td][td][align=center]1:10^5[/align][/td][td][align=center]1:10^6[/align][/td][/tr][tr][td][align=center]H5Re-8抗原[/align][/td][td][align=center]16.81[/align][/td][td][align=center]22.18[/align][/td][td][align=center]25.39[/align][/td][td][align=center]28.97[/align][/td][/tr][tr][td][align=center]H5Re-11抗原[/align][/td][td][align=center]15.75[/align][/td][td][align=center]20.79[/align][/td][td][align=center]24.82[/align][/td][td][align=center]28.31[/align][/td][/tr][tr][td][align=center]H5Re-12抗原[/align][/td][td][align=center]14.75[/align][/td][td][align=center]19.72[/align][/td][td][align=center]22.90[/align][/td][td][align=center]26.8[/align][/td][/tr][/table]经综合判定,最后采用H5亚型Re-11抗原作1: 10^5稀释,分装为200μL/管作为阳性质控,Ct值约25,-70℃冻存备用。6 讨论6.1 检测工作更加方便高效一是在核酸提取环节采用了DNA/RNA共提试剂,待检样品经一次提取核酸,除可应用于A型流感等RNA病毒项目检测外,还可应用于非洲猪瘟、圆环病毒等DNA病毒项目检测;二是由于实验室储备了足够量的qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液及逆转录酶,在开展检测时,不必担心部分检测量较少的项目由于试剂组分不足而罢工事件的发生;三是由于qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]预混液及逆转录酶适用于多数RNA病毒项目的检测,在检测任务发生重大变化时,可以方便地调整检测项目,不必担心试剂不足或浪费情况的发生;6.2 阳性质控品制备方便动物疫病监测实验室常备禽流感血凝抑制抗原,并可根据病毒变异情况及时更新。只需对贮存的抗原进行含量测定,取合适的抗原进行一定比例的稀释即可作为实验室内部的阳性质控品。6.3 适用性有待进一步验证尽管在构建新方法时,对适用性进行了尽可能多的验证,但对于其他毒株,尤其是较新型的变异株是否有效,尚有待进一步观察和验证。6.4 严格依法依规操作如果有关法律法规或上级有关部门出台政策,要求采用获批准的成品试剂盒用于检测,则实验室必须及时停止自建方法的使用。
请问不同点在哪里?高通量实时荧光定量PCR系统:瑞士,Roche,型号是Ligtcler 480全自动荧光法微生物鉴定药敏分析系统:英国,SENSITITRE,型号是ARIS是不是前者可用于致病菌,微生物的定性定量检测,而后者只能是定性的筛选快速检测啊?并且想具体问下PCR如何用于致病菌、转基因食品的检测?大概原理,因为我本身不是读这个专业的,单位决定买这两台仪器,但是单位派我去开个什么购买仪器专家听证会之类的,所以想问问,因为资料上我看得不是很明白
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=18px] 多功能食品安全检测仪可以实现试纸条的定量测定,多功能食品安全检测仪确实可以实现试纸条的定量测定,其主要特点和功能如下: 快速定量检测:多功能食品安全检测仪能在短时间内迅速检测出食品中的各种有害物质或污染物,如农药残留、重金属、致病菌等。利用特定的试纸条,如胶体金试纸条或荧光定量试纸条,可以快速获得检测结果。 定量分析:这些检测仪器不仅能够检测食品中是否存在有害物质,还能够对其进行定量分析,确定其浓度水平。例如,胶体金试纸条定量分析仪通过反射光谱测试法,获取层析试纸T线和C线上光吸收峰信号,计算出两个峰面积之比(Dr),然后根据标准浓度和峰面积的比值制作标准曲线,从而求得待检项目的定量结果。 多种指标检测:多功能食品安全检测仪通常能够检测多种食品安全指标,包括但不限于农药残留、重金属含量、食品添加剂、转基因成分、致病菌、毒素等。试纸条作为其中的一种检测手段,可以用于特定指标的快速定量测定。 便携式设计:一些多功能食品安全检测仪具有便携式设计,可以方便地携带和使用。这使得食品生产企业、农户或者食品检测机构可以在不同场所进行现场检测,快速获取食品安全信息。 数据管理和分析:多功能食品安全检测仪通常具备数据管理和分析功能,可以记录和存储检测结果,并生成相关的报告。这有助于进行食品安全的跟踪和监测,提供数据支持用于食品质量控制和风险评估。 在技术参数方面,多功能食品安全检测仪通常具有高度的重复性、稳定性和准确性。例如,重复性可能达到±0.1%(A),稳定性可能小于或等于0.003A/3min,线性误差可能在±1.0%以内。此外,一些高级型号可能还具有多通道光路系统,能够同时快速检测多个样品,提高检测效率。 总的来说,多功能食品安全检测仪通过其快速、准确、便携的特点,结合试纸条的定量测定功能,为食品安全检测提供了强有力的技术支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/06/202406261107055380_3743_6098850_3.jpg!w690x690.jpg[/img][/size][/color][/font]
技术参数 酶标板类型 1、6、12、24、48、96和384孔酶标板(包括Terasaki板) 也可以为特定的板型编程 。最大尺寸:90mm×134mm×25mm 检测速率 96孔酶标板作动力学研究需最低时间为15秒 摇床 轨迹摇床,转速60-1200rpm,直径1-50mm 进样器 1-3个加样器 处理体积 5-1000ul ,5ul增量 进样速度 25秒/板(96孔板,5ul/孔) 孵育温度范围 室温+3℃—45℃ 光学系统 光源 石英卤素灯 检测器 PMT 激发波长 320nm—700nm 发射波长 360nm—800nm 滤器 高质量杂波滤器 激发光滤器 320nm,355nm,390nm,444nm,485nm,530nm,544nm,584nm 发射光滤器 405nm,460nm,485nm,510nm,527nm,538nm,555nm,590nm,612nm,620nm (其它过滤器可定制) 理论灵敏度 0.01 pmol Flurescein/孔,黑色96孔Comiplate 动力学范围 5 数量级(5 decades) -------------------------------------------------------------------------------- 技术文章此仪器没有任何技术文章 -------------------------------------------------------------------------------- 主要特点用户友好,操作简易的软件界面 市场上占领先地位的自动进样系统利于快速动力学检测 读取从1孔到384孔多种板型的酶标板 从板上、下两个方向读取荧光数据 内置温育功能,便于细胞和酶动力学研究 内置可调速轨迹摇床混匀样品 可与自动机械臂联用,处理高通量样品 高性能的光学系统 Floskan Ascent系列荧光分析的光学系统通过反射镜和棱镜系统,能产生高度会聚的光束,消除交叉影响。两种可选光束系统用于读取1-96孔板和384孔板。一般光束直径为3mm,狭窄光束直径为1.5mm.系统可以采取从板上下两方向读取数据。对细胞生物学应用,从板底部读取数据能更贴近细胞,提供更高的精度。从上部读取数据能减少交叉影响,降低背景信号,提高信噪比。 独特的进样系统 对Ca2+检测、酶动力学 分析和其它对时间要求严格的研究,系统可以配置多至3个自动进样器。自动进样器能精确加入试剂,可调范围为5-1000ul。 易与自动机械臂联用 Floskan Ascent系列荧光分析仪能多种自动机械臂联用。可选配酶标板托架便于与自动机械臂联用。Ascent软件具有与自动和HIS/LIMS系统联用的功能。预先设定的分析过程可以远距离控制,Ascent软件能够实现数据自动输入/输出。 功能强大的软件 Ascent软件为荧光应用专门设计,它能够根据研究的需要设定运行程序,也可以更改内设的固定程序。例如以下两个典型的实验: 检测细胞内Ca2+浓度 为满足Ca2+浓度检测对时间优化的严格要求,以在独特的进样器,系统能够加样和检测同时进行。Ascent软件便于灵活的分析设置,允许在加入活性物质和读取实际数据前检测荧光基线(每孔一次)。每块板均能获得对于最大和最小钙信号,所有的数据均放在同一个工作表内以进行数据分析和报告。 细胞增殖和细胞毒性分析 Floskan Ascent系列荧光分析仪能够检测置于多种型号的培养板中的细胞培养物—从板的上方或下方读取数据。每个读取点可以方便地选定或删除。为获得最佳的结果而不影响细胞,信号读取速率可以根据板的类型和溶液的粘度进行调整。在细胞毒性测试中,系统计算Survival Index以获得每个病人的灵敏度分布图。 Floroskan Ascent系列荧光分析仪应用领域: 细胞内Ca2+检测(Intracellular Ca2+) 细胞增殖 (Cell proliferation) 细胞毒性 (Cytotoxicity) 多药物耐药性 (Multi-drug resisent) 细胞粘附 (Cell adhesion) DNA定量(DNA quantitatilon) 报告基因分析(Reporter gene assay) 杂交分析(Hybridization assay) 免疫分析(Immunoassays) 酶活性分析(Enzyme activity) 细菌定量(Bacterial quantitation) 细胞溶解作用(Phagocytosis)
在看环境标准时,只有写检出限和检测下限,没有定量限,检测下限和定量限可以认为是一样的么??检测下限是检出限的4倍,是不是环境的标准都用的检测下限,不用定量限啊??