把蛋白完全水解成氨基酸,可以在pmol到nmol水平上分离和定量。虽然氨基酸的序列信息已经无法得到,但是组成蛋白的氨基酸种类及含量信息可以得到,利用氨基酸的指纹信息可以鉴定蛋白。
请教一下该图为一角蛋白材料,请问能分析出有哪些氨基酸成分吗?根据文献内应含约17种,请问应如何分析?能否定量测出各种氨基酸含量?http://ng1.17img.cn/bbsfiles/images/2012/10/201210230158_398636_2032315_3.jpg
有没有人做过质谱绝对定量蛋白的?
问问各位大神,有没有能在血液样品(血清,血浆)中做皮克级pg/mL蛋白的定量经验?特别想听的是利用AB的QTRAP4500(其他QQQ类也行)定量血浆低丰度蛋白的经验。我主要对低丰度的各种细胞因子和免疫因子感兴趣。各位推荐什么高丰度蛋白去除方法?试剂盒好还是柱子好?希望激起各位大神的围观和讨论。谢谢!http://simg.instrument.com.cn/bbs/images/brow/em01.gif
大豆蛋白纤维也是一种复合纤维,是大豆蛋白和聚乙烯醇复合纤维,牛奶蛋白也有一种牛奶蛋白和聚乙烯醇复合的纤维,其中大豆蛋白纤维在市场上比较普遍,但最近两年牛奶蛋白聚乙烯醇纤维在市场上也比较多见,其中显微镜和燃烧法,大豆蛋白纤维和牛奶蛋白聚乙烯醇纤维都比较相似,化学性质也相似,不知大家有没有遇到这两种纤维,怎么来定性,定量?
[em0715]Bradford法蛋白定量溶液配制过程中,工作液已经过滤多次了,颜色还是发蓝。想问问各位高人是不是滤纸的问题?用什么样的滤纸过滤这种溶液呢?什么牌子的滤纸质量比较好?多谢!
乳与乳制品中动物水解蛋白鉴定—L(-)-羟脯氨酸含量测定法1 主题内容与适用范围本方法规定了乳与乳制品制品中L(-)-羟脯氨酸含量的测定方法。本方法适用于乳与乳制品中L(-)-羟脯氨酸含量的测定。本方法通过对L(-)-羟脯氨酸含量的测定,可判定是否为动物水解蛋白。2 引用标准GB9695.23-90 肉与肉制品L(-) - 羟脯氨酸含量测定 3 原理试样经酸水解,释放出羟脯氨酸。经氯胺T氧化,生成含有吡咯环的氧化物。用高氯酸破坏过量的氯胺T。羟脯氨酸氧化物与对二甲氨基苯甲醛反应生成红色化合物,在波长558nm处进行比色测定。4 试剂所用试剂均为分析纯,水为蒸馏水或同等纯度的水。4.1 氯化亚锡(GB638):0.75%溶液。将氯化亚锡7.5g溶于500mL水中,再加入500ml浓盐酸(GB 622)。 4.2 盐酸(GB622):6mol/L溶液。4.3 氢氧化钠(GB629);1mol/L、10mol/L溶液。4.4 缓冲液:将50g柠檬酸,26.3g氢氧化钠和146.1g结晶乙酸钠(GB694)溶于水,稀至1L,此溶液与200mL水和300mL正丙醇混合。4.5 氯胺T(HG3-972)溶液:将1.41g氯胺T,溶于10mL水中,依次加入10mL正丙醇和80mL缓冲溶液(用时现配)。4.6 显色剂:称取10g对二甲氨基苯甲醛,用35mL高氯酸(GB623)溶解,缓慢加入65mL异丙醇。4.7 L(-)-羟脯氨酸(C5H9NO3)标准溶液。4.7.1 标准储备液500μg/mL:称取50.0mg/L(-)-羟脯氨酸用少量水溶解,加一滴6mol/L盐酸,定容至100mL容量瓶中。4.7.2 标准工作液5μg/mL:吸取标准储备液5.00mL于500mL容量瓶中,定容。5.1 实验室常规设备。5.2 配有冷凝管的三角瓶:250mL。5.3 恒温水浴。5.4 试管加热器或水浴,可控温于60℃。5.5 分光光度计。 6 试样处理:6.1 方法1:准确称取样品2-5g(液体样品5-10g)放入250mL磨口三角瓶中。加几粒沸石。加入氯化亚锡溶液100mL,置于水浴上加热回流16h。趁热将水解溶液过滤于200mL容量瓶中,用6moL/L热盐酸10mL反复三次冲洗三角瓶和滤纸,冷却,用水定容到刻度,混匀。吸取5~25mL(V1)水解液于100mL烧杯中,用10mol/L、1mol/L氢氧化钠溶液调节pH为8±0.2,过滤于250mL容量瓶中,用30mL水冲洗烧杯和滤纸上的氢氧化亚锡沉淀,反复三次,把洗液并入滤液中,以水洗至刻度,摇匀备用。6.2 方法2:准确称取一定量样品,精确到0.0001g。使样品蛋白质含量在10~20mg范围内;将称好的样品放于水解管中。在水解管内加6mol/L盐酸10~15mL(视样品蛋白质含量而定)或加入12mol/L盐酸10~15mL,含水量高的样品(如牛奶)可加入等体积的浓盐酸,加入新蒸馏的苯酚(3.3)3~4滴,再将水解管放入冷冻剂中,冷冻3~5min,再接到真空泵的抽气管上,抽真空(接近0 psi),然后充入高纯氮气;再抽真空充氮气,重复三次后,在充氮气状态下封口或拧紧螺丝盖将已封口的水解管放在110±1℃的恒温干燥箱内,水解24h后(如加入12mol/L盐酸,水解时间可缩短至6h)后,取出冷却。 打开水解管,趁热将水解溶液过滤于100mL三角瓶中,用6moL/L热盐酸10mL反复三次冲洗试管和滤纸,冷却,用水定容到刻度,混匀。吸取5~25mL(V1)水解液于100mL三角瓶中,用10mol/L、1mol/L氢氧化钠溶液调节pH为8±0.2,过滤于50mL容量瓶中,用水冲洗烧杯和滤纸上的氢氧化亚锡沉淀,反复三次,把洗液并入滤液中,以水洗至刻度,摇匀备用。 7 分析步骤7.1 测定7.1标准曲线的绘制吸取L(-)-羟脯氨酸标准工作液0.00,10.00,20.00,30.00,40.00mL,分别置于100mL容量瓶中,定容摇匀。浓度分别为0.0,0.5,1.0,1.5,2.0μg/mL。取不同浓度的上述溶液4.00mL,分别加入20mL具塞试管中,加氯胺T溶液2mL,摇匀后于室温放置20min。加入显色剂2mL,摇匀,塞上塞子于60℃试管加热器(或恒温水浴)中保温20min后取出,迅速冷却,在波长558±2nm处测定吸光值,绘制标准曲线。7.2 试样测定从待测液中吸取已制备好的样液4.00mL于20mL具塞试管中,以下按7.1步骤进行,同时作空白试验。8 分析结果的计算C•V1•AX= ───————×100m×1000式中:X——样品中L(-)-羟脯氨酸的含量,%;C——从标准曲线上查得相应的L(-)-羟脯氨酸量,μg;m——称取试样的质量,g;V1——样液体积,mL。A——稀释倍数当符合允许差所规定的要求时,取两次测定结果的算术平均值作为结果,结果精确到0.01%。9 允许差同一分析者同时或相继进行的两次测定结果之差不得超过平均值的5%。10 判定方法因L(-)-羟脯氨酸为胶原蛋白中的特有组分,其含量占10%以上;而乳蛋白中不含有此成分,如若样品中含有L(-)-羟脯氨酸,可判定添加了动物水解蛋白。
乳与乳制品中动物水解蛋白鉴定—L(-)-羟脯氨酸含量测定法1 主题内容与适用范围本方法规定了乳与乳制品制品中L(-)-羟脯氨酸含量的测定方法。本方法适用于乳与乳制品中L(-)-羟脯氨酸含量的测定。本方法通过对L(-)-羟脯氨酸含量的测定,可判定是否为动物水解蛋白。2 引用标准GB9695.23-90 肉与肉制品L(-) - 羟脯氨酸含量测定 3 原理试样经酸水解,释放出羟脯氨酸。经氯胺T氧化,生成含有吡咯环的氧化物。用高氯酸破坏过量的氯胺T。羟脯氨酸氧化物与对二甲氨基苯甲醛反应生成红色化合物,在波长558nm处进行比色测定。4 试剂所用试剂均为分析纯,水为蒸馏水或同等纯度的水。4.1 氯化亚锡(GB638):0.75%溶液。将氯化亚锡7.5g溶于500mL水中,再加入500ml浓盐酸(GB 622)。 4.2 盐酸(GB622):6mol/L溶液。4.3 氢氧化钠(GB629);1mol/L、10mol/L溶液。4.4 缓冲液:将50g柠檬酸,26.3g氢氧化钠和146.1g结晶乙酸钠(GB694)溶于水,稀至1L,此溶液与200mL水和300mL正丙醇混合。4.5 氯胺T(HG3-972)溶液:将1.41g氯胺T,溶于10mL水中,依次加入10mL正丙醇和80mL缓冲溶液(用时现配)。4.6 显色剂:称取10g对二甲氨基苯甲醛,用35mL高氯酸(GB623)溶解,缓慢加入65mL异丙醇。4.7 L(-)-羟脯氨酸(C5H9NO3)标准溶液。4.7.1 标准储备液500μg/mL:称取50.0mg/L(-)-羟脯氨酸用少量水溶解,加一滴6mol/L盐酸,定容至100mL容量瓶中。4.7.2 标准工作液5μg/mL:吸取标准储备液5.00mL于500mL容量瓶中,定容。5.1 实验室常规设备。5.2 配有冷凝管的三角瓶:250mL。5.3 恒温水浴。5.4 试管加热器或水浴,可控温于60℃。5.5 分光光度计。6 试样处理:6.1 方法1:准确称取样品2-5g(液体样品5-10g)放入250mL磨口三角瓶中。加几粒沸石。加入氯化亚锡溶液100mL,置于水浴上加热回流16h。趁热将水解溶液过滤于200mL容量瓶中,用6moL/L热盐酸10mL反复三次冲洗三角瓶和滤纸,冷却,用水定容到刻度,混匀。吸取5~25mL(V1)水解液于100mL烧杯中,用10mol/L、1mol/L氢氧化钠溶液调节pH为8±0.2,过滤于250mL容量瓶中,用30mL水冲洗烧杯和滤纸上的氢氧化亚锡沉淀,反复三次,把洗液并入滤液中,以水洗至刻度,摇匀备用。6.2 方法2:准确称取一定量样品,精确到0.0001g。使样品蛋白质含量在10~20mg范围内;将称好的样品放于水解管中。在水解管内加6mol/L盐酸10~15mL(视样品蛋白质含量而定)或加入12mol/L盐酸10~15mL,含水量高的样品(如牛奶)可加入等体积的浓盐酸,加入新蒸馏的苯酚(3.3)3~4滴,再将水解管放入冷冻剂中,冷冻3~5min,再接到真空泵的抽气管上,抽真空(接近0 psi),然后充入高纯氮气;再抽真空充氮气,重复三次后,在充氮气状态下封口或拧紧螺丝盖将已封口的水解管放在110±1℃的恒温干燥箱内,水解24h后(如加入12mol/L盐酸,水解时间可缩短至6h)后,取出冷却。 打开水解管,趁热将水解溶液过滤于100mL三角瓶中,用6moL/L热盐酸10mL反复三次冲洗试管和滤纸,冷却,用水定容到刻度,混匀。吸取5~25mL(V1)水解液于100mL三角瓶中,用10mol/L、1mol/L氢氧化钠溶液调节pH为8±0.2,过滤于50mL容量瓶中,用水冲洗烧杯和滤纸上的氢氧化亚锡沉淀,反复三次,把洗液并入滤液中,以水洗至刻度,摇匀备用。7 分析步骤7.1 测定7.1标准曲线的绘制吸取L(-)-羟脯氨酸标准工作液0.00,10.00,20.00,30.00,40.00mL,分别置于100mL容量瓶中,定容摇匀。浓度分别为0.0,0.5,1.0,1.5,2.0μg/mL。取不同浓度的上述溶液4.00mL,分别加入20mL具塞试管中,加氯胺T溶液2mL,摇匀后于室温放置20min。加入显色剂2mL,摇匀,塞上塞子于60℃试管加热器(或恒温水浴)中保温20min后取出,迅速冷却,在波长558±2nm处测定吸光值,绘制标准曲线。7.2 试样测定从待测液中吸取已制备好的样液4.00mL于20mL具塞试管中,以下按7.1步骤进行,同时作空白试验。8 分析结果的计算C•V1•AX= ───————×100m×1000式中:X——样品中L(-)-羟脯氨酸的含量,%;C——从标准曲线上查得相应的L(-)-羟脯氨酸量,μg;m——称取试样的质量,g;V1——样液体积,mL。A——稀释倍数当符合允许差所规定的要求时,取两次测定结果的算术平均值作为结果,结果精确到0.01%。9 允许差同一分析者同时或相继进行的两次测定结果之差不得超过平均值的5%。10 判定方法因L(-)-羟脯氨酸为胶原蛋白中的特有组分,其含量占10%以上;而乳蛋白中不含有此成分,如若样品中含有L(-)-羟脯氨酸,可判定添加了动物水解蛋白。
本文引用自cheney《蛋白胨和胰蛋白胨简介》蛋白胨是将肉、酪素或明胶用酸或蛋白酶水解后干燥而成的外观呈淡黄色的粉剂,具有肉香的特殊气息。蛋白质经酸、碱或蛋白酶分解后也可形成蛋白胨。蛋白胨富含有机氮化合物,也含有一些维生素和糖类。它可以作为微生物培养基的主要原料,在抗生素、医药工业、发酵工业、生化制品及微生物学科研等领域中的用量均很大。不同的生物体需要特定的氨基酸和多肽,因此存在着各种蛋白胨,一般来说,用于蛋白胨生产的蛋白包括动物蛋白(酪蛋白、肉类)和植物蛋白(豆类)等两种。能为微生物提供C源、N源、生长因子等营养物质。因此,蛋白胨从来源上可分为动物性蛋白胨和植物性蛋白胨。胰胨、肉胨、骨胨等都是动物性蛋白胨,而大豆蛋白胨等则是植物性蛋白胨。动物性来源的蛋白胨还有:蚕蛹蛋白胨、血液蛋白胨等。 不同来源的蛋白质和不同的水解条件,其水解物中组成可千差万别。所以胨往往是一个复杂的多肽混合物。可溶于水,过热不凝固,在饱和硫酸铵中不发生沉淀但可为蛋白质沉淀剂所沉淀。可用作微生物和动物细胞培养基、特种功能性食品和化妆品的配料,也有用作啤酒等产品的稳定剂。胰蛋白胨,又称胰酪蛋白胨(Casein Tryptone)、胰酶消化酪蛋白胨(Pancreatic digest of casein),是一种优质蛋白胨,是以新鲜牛肉和牛骨经胰酶消化,浓缩干燥而成的浅黄色粉末。具有色浅、易溶、透明、无沉淀等良好的物理性状。含有丰富的氮源、氨基酸等,可配制各种微生物培养基,用于细菌的培养、分离、增殖、鉴定,以及无菌试验培养基、厌氧菌培养基等细菌生化特性试验用培养基的配置。胰蛋白胨还广泛应用于高品质的抗生素、维生素、医药工业,氨基酸、有机酸、酶制剂、黄原胶等发酵工业,生化制品及微生物学科研等领域中的用量均很大,临床用于抗炎消肿,工业上用于皮革制造,生丝处理,食品加工。在国际市场上,胰蛋白胨也属于货紧价昂的短线品种之一。 胰酪蛋白胨质量标准及其检验标准: 常规各项理化指标: 1. 澄清度(磷酸盐、碱性沉淀):无沉淀、澄清 2. 2%水溶液:透明 3. 酸碱度:6-7 4. 氨基氮:≥3% 5. 色氨酸:≥0.8% 6. 胨含量:≥80% 7. 总氮:≥13% 8. 水份:≤5% 9. 灰份:≤6% 10. 氯化钠:≤0.2%胰蛋白胨特指用胰蛋白酶酶解酪蛋白生成的蛋白胨产物,与一般蛋白胨的区别在于酶解工艺处理上,属于水解度更高、胨分子量更小更均衡的蛋白胨。
http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378379551.jpg 氨基酸是蛋白质的基础组成单位,通过研究蛋白质中氨基酸的性质和组成来预测蛋白质的结构和功能,蛋白质氨基酸残基组成分析主要是通过氨基酸分析仪来完成的,本文推荐了2个基于氨基酸组成进行蛋白质预测软件。基于氨基酸组成的蛋白质预测软件根据组成蛋白质的20种氨基酸的物理和化学性质可以辨析电泳等实验中的未知蛋白质,也可以分析已知蛋白质的物化性质。ExPASy工具包包涵的程序:AACompIdent:与把氨基酸序列在SWISS-PROT库中搜索不同,AACompIdent工具利用未知蛋白的氨基酸组成去确认具有相同组成的已知蛋白。该程序分析时需提交的相关信息包括:蛋白质的氨基酸组成、等电点pI和分子量(如果知道)、正确的物种分类及特别的关键词。此外,用户还需在六种氨基酸“组合”中作出选择,这影响到分析如何进行。例如,某种“组合”会把残基Asp/Asn(D/N)和Gln/Glu(Q/E)组合成 Asx(B)和Glx(Z);或者某种残基会在分析中被完全除去。对数据库中的每一个蛋白序列,算法会对其氨基酸组成与所查询的氨基酸组成的差异打分。由电子邮件返回的结果被组织成三级列表:第一张列表中的蛋白都基于特定的物种分类而不考虑pI和分子量;第二张列表包含了不考虑物种分类、pI和分子量的全体蛋白;第三张列表中的蛋白不但基于特定物种分类,并且将 pI和分子量也考虑在内。虽然计算所得结果各不相同,但零分表明了该序列与提出的组成完全相符。AACompSim:AACompIdent的一个变种,AACompSim提供类似的分析,但与前者以实验所得的氨基酸组成为依据进行搜索不同,后者使用SWISS-PROT中的序列为依据。有报道称,氨基酸组成在物种之间是十分保守的(Cordwell等,1995),并且通过分析氨基酸的组成,研究者能从低于25%序列相似性的蛋白之间发现弱相似性(Hobohm和Sander,1995)。因此,在“传统的”数据库搜索基础上辅以组成分析,能为蛋白质之间关系提供更多见解。PROSEARCH:PROPSEARCH也提供基于氨基酸组成的蛋白质辨识功能。用144种不同的物化性质来分析蛋白质,包括分子量、巨大残基的含量、平均疏水性、平均电荷等,把查询序列的这些属性构成的“查询向量”与SWISS-PROT和PIR中预先计算好的各个已知蛋白质的属性向量进行比较。这个工具能有效的发现同一蛋白质家族的成员。可以通过Web使用这个工具,用户只需输入查询序列本身。分子量搜索(MOWSE)分子量搜索(MolecularWeightSearch,MOWSE)算法利用了通过质谱(MS)技术获得的信息。利用完整蛋白质的分子量及其被特定蛋白酶消化后产物的分子量,一种未知蛋白质能被准确无误地确认,给出由若干实验才能决定的结果。由于未知蛋白无需再全部或部分测序,这一方法显著地减少了实验时间。MOWSE的输入是一个纯文本文件,包含一张实验测定的肽段列表,分子量范围在0.7到4.0Kda之间。计算过程基于在OWL非冗余蛋白质序列库中包含的信息。打分基于在一定分子量范围内蛋白中一个片段分子量出现的次数。输出的结果是得分最佳的30个蛋白的列表,包括它们在OWL中的条目名称、相符肽段序列、和其它统计信息。模拟研究得出在使用5个或更少输入肽段分子量时,准确率为99%。该搜索服务可通过向mowse@daresburg.ac.uk发送电子邮件实现。为获得更多关于查询格式的细节信息,可以相该地址发送电子邮件,并在消息正文中写上“help”这个词。蛋白质氨基酸组成分析用盐酸在110 ℃将蛋白或多肽水解成游离的氨基酸,用氨基酸分析仪测定各氨基酸的含量。采用经典的阳离子交换色谱分离、茚三酮柱后衍生法,对蛋白质水解液及各种游离氨基酸的组分含量进行分析。仪器基本结构同普通HPLC相似,但针对氨基酸分析进行了细节优化(例如氮气保护、惰性管路、在线脱气、洗脱梯度及柱温梯度控制等等)通常细分为两种系统:蛋白水解分析系统(钠盐系统)和游离氨基酸分析系统(锂盐系统),利用不同浓度和pH值的柠檬酸钠或柠檬酸锂进行梯度洗脱。其中钠盐系统一次最多分析约25种氨基酸,速度较快,基线平直度好;锂盐系统一次最多分析约50种氨基酸,速度较慢,基线一般不如钠盐系统好。分析效果:从目前已知的氨基酸分析方法比较来看,除灵敏度(即最低检测限)比HPLC柱前衍生方法稍低以外(HPLC:0.5 pmol;氨基酸分析仪:10 pmol),其他如分离度、重现性、操作简便性、运行成本等方面,都优于其他分析方法。蛋白质氨基酸残基组成分析的主要步骤包括:首先是蛋白被水解为氨基酸,其次是采用离子色谱等方法进行游离的氨基酸含量和组成的分析。总之利用蛋白可以分析氨基酸,利用氨基酸也可以研究蛋白质。
[font=宋体, SimSun][size=15px]蛋白质按来源可以分为动物蛋白和植物蛋白,两者所含的氨基酸是不同的。[/size][/font][font=宋体, SimSun][size=15px][/size][/font][font=宋体, SimSun][size=15px]一般说,植物蛋白和动物蛋白从本质上没有太大的区别,但是在氨基酸组成和数量上有一定的不同。[/size][/font][font=宋体, SimSun][size=15px][/size][/font][font=宋体, SimSun][size=15px]尽管植物蛋白取材来源广泛,但其蛋白的种类和相对数量与人体的要求有一定差距。[/size][/font][font=宋体, SimSun][size=15px][/size][/font][font=宋体, SimSun][size=15px]例如,植物蛋白中缺乏免疫球蛋白[i][/i],谷类中则相对缺乏赖氨酸等。植物蛋白的消化、吸收要比动物蛋白差,但是植物蛋白的优势是不含有胆固醇。动物蛋白相对与人类的营养结构比较吻合,其蛋白质的种类和结构更加接近人体的蛋白结构和数量,而且一般都含有人体必需的8种氨基酸(特别是蛋制品和奶制品),所以动物蛋白质比植物蛋白质营养价值高。[/size][/font]
随着常规分子生物学研究的深入,越来越多的生物实验室日常需要测量的核酸、蛋白样品量也在不断地加大。传统的分光光度计虽然已经非常普及,但由于需要在测量后清洗比色杯,实际上消耗了不少宝贵的研究时间。同时,由于核酸样品的体积较小,即使使用昂贵的微量石英比色杯(容积数十ul左右),也往往需要对原始样品进行稀释,从而带来可能的操作偏差。对于一些稀有的样品来说,稀释即意味着测量后无法回收,同样也会对后续研究带来更高成本。因此,无需比色杯,仅需数ul即可测定样品浓度的超微量分光光度计现在受到很多实验室的关注和欢迎。NanoVue是GE Healthcare公司于2008年最新推出超微量分光光度计。GE Healthcare公司的分光光度计品牌Ultrospec和GeneQuant在市场上已经有了十多年的历史,在用户中有着很好的信誉和口碑。NanoVue在该系列仪器的基础上延续了出众的检测性能,同时大大改进了检测的光路设计,通过专利的检测技术使检测样品的体积最小仅需0.5ul, 190-1100nm的宽范围连续波长设计较市场上同类仪器宽了一倍左右,使得能够轻松检测核酸、蛋白样品和Cydye荧光染料标记物的浓度。仪器内置了RNA、DNA 和寡核苷酸浓度和纯度测定方法;寡核苷酸转换因子,分子量,理论Tm计算功能;包括一般紫外、Bradford、 Biuret、BCA、Lowry的蛋白定量法;以及波长扫描,动力学,标准曲线,多波长测定等扩展功能。除了强大的检测性能外,NanoVue还在许多操作性能上进行了精心的设计,能够给用户带来众多全新的体验,主要包括以下方面:1 唯一不需电脑就能在仪器面板上直接检测的超微量分光光度计。仪器配置了一块大面积高分辨率的背光液晶屏和操作面板。相对于点样后转去电脑控制,再回去仪器清洁的过程,NanoVue不仅节省了购买电脑的支出,同时点样,按键测量,擦拭一气呵成。可以通过整合的打印机直接打印分析数据。当然,如果需要在电脑上保存分析数据,NanoVue同样支持USB或蓝牙连接电脑,将珍贵的实验数据永久记录下来。2 通过特别设计的疏水点样表面,能够很容易回收稀有的样品,并且有效避免多个测量间的样品交叉污染,提高测量的准确性。NanoVue的点样表面具有专利设计,表面坚固而且光滑。不管是样品回收还是测量完直接擦去都非常简易,不会有任何样品粘附残留在点样面上。而且点样面耐用性也非常出众,保守估计可以至少测量20000个样品以上。3 最快的检测速度。NanoVue通过独特的光路设计,使得所有样品的检测都能够在5秒钟之内完成,把微量分光光度计的测量时间提升到了一个新的高度。而且NanoVue具备即开即用功能,避免了许多分光光度计开机需要预热的麻烦,真正做到省时省力。由此可见,NanoVue不仅性能出众,其易用性和灵活性也是目前超微量分光光度计中出类拔萃的。通过试用NanoVue的体验,使用者可以完全感受到,原来,核酸蛋白的测定可以这么简单,这么快速!目前,NanoVue已经正式在中国推出,欲了解更多的信息,请直接联系GE公司。
硫酸沉血样中的蛋白,浓度多大,加多少量?
【中文名称】腐殖酸蛋白饲料【英文名称】humic acid-protein fodder【性状】 黑色固体。【用途】 用作饲料添加剂,促进禽畜生长,提高繁殖能力,减少疾病,助消化。【制备或来源】 将风化的煤粉碎后,用氢氧化钠综合提取,加尿素、硫酸铵等经混合、灭菌,然后,接种发酵、浓缩、干燥即得成品。【其他】 除含动物所需的蛋白质(≥48%)外,还含有动物生长激素。【生产单位】 黑龙江鹤岗市蛋白饲料厂
大豆蛋白复合纤维和锦纶混纺的面料用哪种方法定性?成分定量标准中有一个冰乙酸法,要冰乙酸沸腾才行,我们只有水浴锅,根据冰乙酸沸点,达不到沸腾的温度,大家有没有其他方法进行成分定量分析?
“不同饱和度硫酸铵沉淀中的蛋白浓度测定结果表明血红蛋白主要集中于50%和60%饱和度的硫酸铵沉淀中,杂蛋白主要集中在10%~40%饱和度的硫酸铵沉淀中。”这是文献中的原话,我想知道怎么知道哪部分是杂蛋白呢?怎么分辨哪部分的沉淀是自己的目标蛋白,哪部分的沉淀是杂蛋白呀[img]https://simg.instrument.com.cn/bbs/images/default/em09509.gif[/img]

讲座题目:Top Down用于完整蛋白定性定量 主讲老师:田志新 同济大学教授 “青年千人”入选者 1997年于湖南师范大学获得化学本科学位,2000年于湖南师范大学获得化学硕士学位,2003年于中国科学院化学研究所化学博士学位。2004-2008年于明尼苏达大学化学系跟Steven R. Kass教授做合作研究。2008-2011年于太平洋西北国家实验室跟Richard D. Smith教授做合作研究。2011年入选青年千人计划,被聘为中国科学院大连化学物理研究所研究员,高分辨质谱技术研究组组长。2013年被聘为同济大学化学系教授。 主要内容: 随着质谱技术的发展,在肽段层次的分析已经满足不了对蛋白质的认识,在整体蛋白水平分析能获得蛋白质更加全面的信息,这项技术称之为Top down蛋白质组学。 赛默飞在Top down完整蛋白分析方面有完整的解决方案,从样品制备耗材、液相-色谱到Prosight PC分析软件。其中Orbitrap已经成为Top down分析唯一的质谱仪,相关文献已经发表了多篇CNS文章。 此次讲座邀请国内Top down领域的权威专家同济大学田志新教授为我们讲授Top down完整蛋白分析的基础与前沿。该讲座分为4个部分: 第一部分介绍Top down蛋白质组学技术介绍 第二部分介绍Orbitrap用于完整蛋白分析 第三部分介绍Top down蛋白分析常用软件和算法 第四部分介绍Top down应用 举行时间:2017-05-11 14:00 报名链接: http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/2307http://ng1.17img.cn/bbsfiles/images/2017/03/201703101003_01_2507958_3.jpg手机扫码,快速报名http://exmail.qq.com/cgi-bin/viewfile?type=signature&picid=ZX0717-9QlCeoL%7EVb5UZDdhPeiRO6f&uin=1407973628
讲座题目:Top Down用于完整蛋白定性定量 主讲老师:田志新 同济大学教授 “青年千人”入选者 1997年于湖南师范大学获得化学本科学位,2000年于湖南师范大学获得化学硕士学位,2003年于中国科学院化学研究所化学博士学位。2004-2008年于明尼苏达大学化学系跟Steven R. Kass教授做合作研究。2008-2011年于太平洋西北国家实验室跟Richard D. Smith教授做合作研究。2011年入选青年千人计划,被聘为中国科学院大连化学物理研究所研究员,高分辨质谱技术研究组组长。2013年被聘为同济大学化学系教授。 主要内容: 随着质谱技术的发展,在肽段层次的分析已经满足不了对蛋白质的认识,在整体蛋白水平分析能获得蛋白质更加全面的信息,这项技术称之为Top down蛋白质组学。 赛默飞在Top down完整蛋白分析方面有完整的解决方案,从样品制备耗材、液相-色谱到Prosight PC分析软件。其中Orbitrap已经成为Top down分析唯一的质谱仪,相关文献已经发表了多篇CNS文章。 此次讲座邀请国内Top down领域的权威专家同济大学田志新教授为我们讲授Top down完整蛋白分析的基础与前沿。该讲座分为4个部分: 第一部分介绍Top down蛋白质组学技术介绍 第二部分介绍Orbitrap用于完整蛋白分析 第三部分介绍Top down蛋白分析常用软件和算法 第四部分介绍Top down应用 举行时间:2017-05-11 14:00 报名链接: http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/2307http://ng1.17img.cn/bbsfiles/images/2017/03/201703101003_01_2507958_3.jpg手机扫码,快速报名http://exmail.qq.com/cgi-bin/viewfile?type=signature&picid=ZX0717-9QlCeoL%7EVb5UZDdhPeiRO6f&uin=1407973628
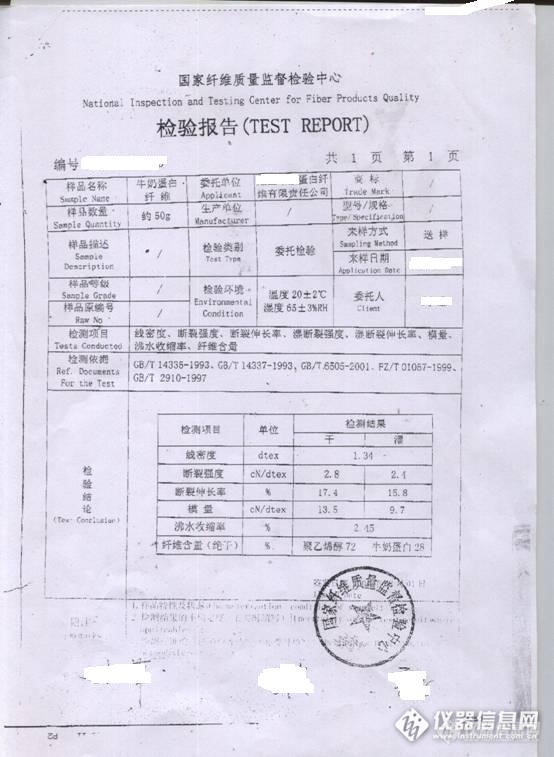
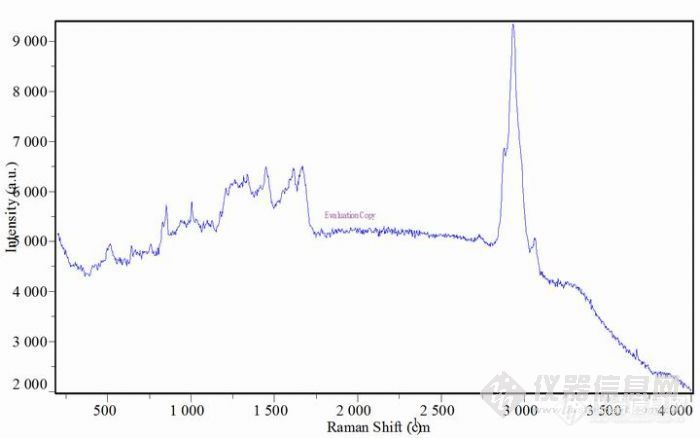
维纶基牛奶蛋白纤维和维纶基大豆蛋白纤维定性分析的方法研究 维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维都是由聚乙烯醇和蛋白共混制得,所以化学性质及其相似,一直以来由于维纶基牛奶蛋白纤维没有相关的检测方法,检测机构对维纶基牛奶蛋白纤维出具的检测报告都是维纶基大豆蛋白纤维 维纶基大豆蛋白纤维的成分定量分析方法是先用次氯酸钠溶液溶解掉蛋白质,然后用盐酸溶解聚乙烯醇,同样维纶基牛奶蛋白纤维也是可以用这种方法进行溶解,下面看看常规的检测方法能不能分析出这两种纤维1.维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维,其纤维成分定性的基本方法:①.显微镜法: 在显微镜下观察维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维的横截面呈腰圆形或哑铃形,纵向有沟槽;②.燃烧: 维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维靠近火焰时现象都是熔融并卷曲;进入火焰,熔融、卷曲并燃烧;离开火焰,燃烧,有时会自然熄灭。燃烧过程中散发出蛋白质燃烧时所特有的臭味;③.溶解法:共同的维纶基,加上都是蛋白质,化学性质非常接近,在75%硫酸、浓硫酸、浓硝酸和0.1MOL/L次氯酸钠溶液中,溶解现象和状态都是一样的,都无法将两者定性2.个人通过研究和分析认为,只有通过两者氨基酸的组分不同进行定性,从而确定纤维牛奶中氨基酸的组成表”取自《乳与乳制品的生理功能特征》一书。“大豆蛋白质的氨基酸组成表”取自《大豆制品工艺学》一书。大豆蛋白质的氨基酸组成可以参考“全酸沉淀蛋白”的氨基酸组成,做为比较的依据。因为大豆蛋白纤维使用的是大豆分离蛋白,即是酸沉蛋白。http://ng1.17img.cn/bbsfiles/images/2013/09/201309121130_463904_2154459_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/09/201309121130_463905_2154459_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/09/201309121130_463907_2154459_3.jpg3.维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维的通过测其氨基酸的组成不同,可以定性出大豆蛋白与牛奶蛋白,如果是大豆蛋白复合纤维,然后用GB/T2910.101-2009大豆蛋白复合纤维和其他纤维的混合物-定量化学分析进行测试。完全溶解,则为维纶基大豆蛋白纤维,如果是维纶基牛奶蛋白纤维,也可以用此方法进行定量法定性,相关详细步鄹如下:3.1 试验3.1.1试验材料、仪器和试剂万分之一电子天平;SHA-B水浴振荡器;鼓风恒温烘箱;索氏萃取器,离心机,具塞三角瓶,1MOL/L次氯酸钠溶液,氢氧化钠,20%盐酸溶液等3.1.2目前行业内认为定性牛奶蛋白纤维的最好方法:牛奶蛋白纤维在2.5%NaOH 溶液下,100℃恒温加热30分钟,即可出现牛奶蛋白特有的现象。状态:在整个溶解的过程下,纤维体积膨胀渐呈冻胶状,颜色会从本色逐渐变成深红色,然后再有深红色褪色至浅黄色。此方法经试验,并不是所有的牛奶蛋白复合纤维都出现此特有现象,有时不是很明显,只能作为判断的一种辅助方法,不能作为定性的标准方法。3.1.3在显微镜下观察牛奶蛋白复合纤维或大豆蛋白复合纤维,能确定是其中的一种,然后用1MOL/L次氯酸钠溶液,常温下振荡溶解30分钟,此时,蛋白全部溶解,剩余纤维抽滤,冲洗干净,取少量纤维在显微镜下查看,初步判定为聚乙烯醇,然后燃烧,根据味道和燃烧现象,确定其为维纶基蛋白纤维3.2需要确定蛋白质纤维为何种纤维,经初步试验分析,常规方法无法准确定性,下面是维纶基牛奶纤维的专利拥有者在相关国家检测机构取得的检测报告http://ng1.17img.cn/bbsfiles/images/2013/09/201309121131_463909_2154459_3.jpg以上报告可能确定是维纶和牛奶蛋白复合,但其报告检测依据个人不是特别认同,也咨询过相关人员,没有给予明确答复,检测的具体方法没有明确,国家并没有发布相关的检测标准,不能作为判断纤维的依据,所以目前情况下仍然不能使该纤维大面积推广使用。3.3个人认为,只有通过两者氨基酸的组分不同进
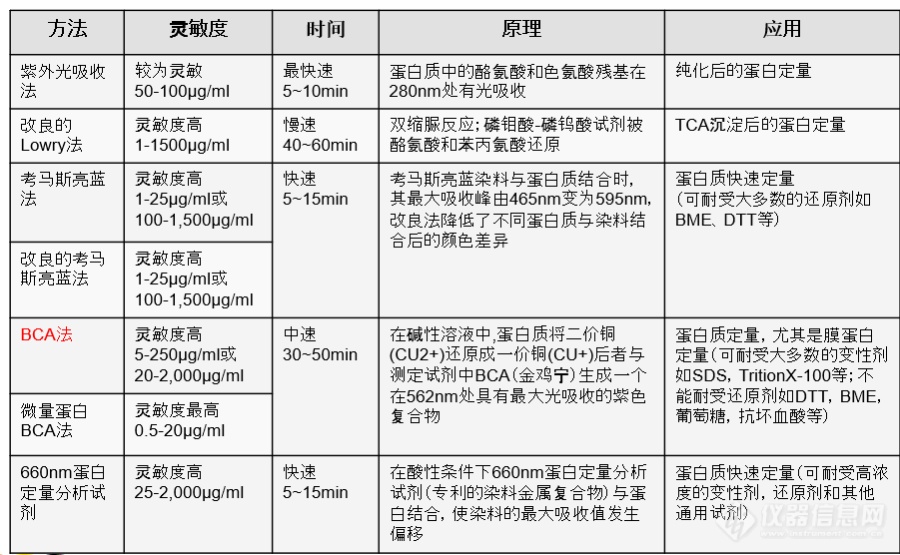
[font=arial, 宋体, sans-serif][color=#333333]蛋白定量是生物学实验常见实验之一,方法也有很多,这里帮大家总结了几种方法的比较结果。[/color][/font][font=arial, 宋体, sans-serif][color=#333333][img=,690,425]https://ng1.17img.cn/bbsfiles/images/2021/01/202101261158042333_5444_2985407_3.png!w690x425.jpg[/img][/color][/font]
[color=#00008B][em0715] 大家好!帮帮忙! 在分离酪蛋白中α-酪蛋白、β-酪蛋白、κ-酪蛋白时,流动相:溶剂A:95%乙睛+0.1%三氟乙酸,溶剂B:100%水+0.1%三氟乙酸!采用梯度洗脱,基线跑不平,往上飘的。应该怎么办啊? 还有样品用流动相A:B(体积比70:30)混合溶液溶解效果也不好,这样就没法定量啊!请大家指教[/color]
想了解蛋白蛋白氨基酸是否有食品级标准
现在人们是越来越注重食品健康了,于是任何关于某种食品不健康的说法都能吸引一堆眼球。有人说自己买的乳清蛋白粉不容易溶在水中,立刻有人跳出来说千万不能用热水,蛋白质会变性。于是有一堆看起来对蛋白质有一点了解的人纷纷附和,大谈如何保持蛋白不变性。 很多人看到“蛋白变性”这个词,就望文生义地想到“变质”“变坏”,仿佛“变性”了就有害健康了。最常见的还有一个例子,反对微波炉的人总是说微波炉会导致蛋白质的变性。 蛋白质通常是由20种不同的氨基酸组成的,不同的蛋白质只是各种氨基酸的组成和连结方式不同。因为各种氨基酸的理化特性不同,它们会互相影响,最后会像积木一样形成一定的空间结构。通常也就说是蛋白质的天然构象。如果因为某种原因,蛋白质分子失去了它的天然构象,被称为变性。而蛋白质被吃到肚子里,首先要被水解(消化)成一个个的氨基酸分子,才能被吸收。而在多数情况下,变性的蛋白更容易被水解。可见,蛋白质变性对于食物来说,不仅不是“变质”,而且是好事。 我们所吃的所有蛋白,比如肉、鱼、鸡蛋、牛奶、豆浆、豆腐,作熟的过程就是蛋白质变性的过程。豆浆中的蛋白质不变性是变不成豆腐的。而作为商品出售的各种蛋白粉,多数都经过了高温灭菌和干燥处理,早已经变性了。对于某些产品而言,适当的工业处理甚至能够提高蛋白质的品质。比如大豆中的蛋白,其蛋白质质量指数(蛋白质消化校正计分)是0.91 ,但是经过分离纯化高温干燥等处理之后,就能达到1了。还有相当多的蛋白质产品甚至经过了酶解处理,以获得更好的理化特性。那些蛋白质,不仅是空间构象,连化学结构都变了,更是“变性”得深入。
GB 5009.169-2016中,用乙酸锌和亚铁氰化钾沉淀蛋白,对于添加的量,会不会影响到牛磺酸的检测,同样,硫酸锌加入的量会不会影响泛酸
[size=16px]素食者在蛋白质摄入上一直面临着挑战,尽管素食食品富含多种营养成分,但素食者在蛋白质摄入方面存在不足。首先,植物性食品中的蛋白质含量相对较低,且氨基酸组成不如动物性蛋白完整,素食者需要摄入更多的植物性食品才能满足蛋白质的需求。然而,过多的植物性食品摄入可能导致热量过剩、膳食纤维过多等问题。其次,一些素食者可能存在对某些植物性食品的过敏或不耐受情况,例如大豆、坚果等食品中的蛋白质可能引发人体过敏反应,而谷物中的麸质[i][/i]则可能引起不耐受反应等。此外,植物性蛋白质的生物利用率较低,需要素食者通过合理搭配食物来提高蛋白质的摄入效率。[/size][size=16px]在传统素食者蛋白质摄入不足的背景下,素食蛋白棒产品正逐渐在素食者中普及起来。[/size][size=16px]素食蛋白棒是一种高蛋白、低脂肪、便携的零食,能够方便素食者在日常饮食中补充蛋白质,满足素食者对蛋白质的需求。素食蛋白棒的热量和脂肪含量相对较低,使得素食者可以在控制热量摄入的同时,获得足够的蛋白质补充。[b]一是丰富的营养价值[/b]:作为素食蛋白棒中重要蛋白来源的酵母蛋白,是一种来源于酿酒酵母的优质完全蛋白,拥有高蛋白质含量与优质氨基酸配比,其蛋白质含量高达80%以上,富含人体所需的全部8种必需氨基酸,且其氨基酸配比合理,易被人体吸收利用。酵母蛋白除了赋予素食蛋白棒高蛋白质含量外,还提供B族维生素和矿物质等多种营养成分,有助于维持身体的正常代谢和健康状态。研究表明,酵母蛋白中的活性成分能够调节肠道菌群平衡,促进有益菌的增殖,抑制有害菌的生长,从而改善肠道环境,提高肠道健康水平。[b]二是环保与可持续性和性价比优势[/b]:酵母蛋白来源于微生物发酵,相比动物源蛋白和植物源蛋白更加环保和可持续,它不需要大量的土地、水和饲料资源,也不产生温室气体排放。目前,酵母蛋白的生产已完全工业化,生产效率高、成本低,使得酵母蛋白与乳清蛋白等动物蛋白相比在价格上具有一定的优势,同时避免了动物源蛋白和植物源蛋白可能带来的过敏源问题。[/size]
用硝酸汞沉淀除去乳酪蛋白,但水解蛋白不会被除去,与饱和苦味酸产生沉淀反应。 试剂配制 除蛋白试剂:硝酸汞14g,加入100mL蒸馏水,加浓硝酸约2.5mL,加热助溶,待试剂全部溶解后加蒸馏水至500mL。溶液出现混浊等污染现象停止使用。 饱和苦味酸溶液:称取2 克固体苦味酸于烧杯中,用冷却的蒸馏水定容至100mL,后将定容好的溶液倒入烧杯中煮沸(沸腾即可),然后将液体冷却,待结晶析出后将上清液倒入试剂瓶中。 样品处理奶粉样品的处理: (1)将样品旋转振荡,使之充分混合; (2)准确称取6g 样品,加入50ml 中性温水(60℃左右),充分溶解样品。 原料奶样品:将样品充分混合即可。 操作方法 取5mL 待检处理过的样品,放入干净干燥的平皿或其他容器内,加除蛋白试剂5mL 混合均匀,边加边摇动,不可产生大体积蓄状物,将摇匀的液体用快速定量滤纸过滤于试管中,收集滤液约3mL左右。 然后沿试管壁慢慢加入饱和苦味酸溶液约0.5mL(每加0.5mL约需要30-40秒),切勿使滤液与苦味酸混合(加入的苦味酸溶液层不超出总液体体积的1/3)。 结果判断 方法判定一(沉淀圈判定):加入苦味酸后,在10 秒内逆光或在黑色背景下)上下左右移动不同方位观察产生沉淀圈情况,无沉淀圈判定为阴性,有明显沉淀圈判定为阳性。 按产生沉淀圈情况进行“阴性、阳性”判定:
传统的蛋白鉴定方法,如免疫印迹法、内肽的化学测序、已知或未知蛋白的comigration分析,或者在一个有机体中有意义的基因的过表达通常耗时、耗力,不适合高流通量的筛选。 目前,所选用的技术包括对于蛋白鉴定的图象分析、微量测序、进一步对肽片段进行鉴定的氨基酸组分分析和与质谱相关的技术。1 图象分析技术(Image analysis)“满天星”式的2-DE图谱分析不能依靠本能的直觉,每一个图象上斑点的上调、下调及出现、消失,都可能在生理和病理状态下产生,必须依靠计算机为基础的数据处理,进行定量分析。 在一系列高质量的2-DE凝胶产生(低背景染色,高度的重复性)的前提下,图象分析包括斑点检测、背景消减、斑点配比和数据库构建。 首先,采集图象通常所用的系统是电荷耦合CCD(charge coupled device)照相机;激光密度仪(laser densitometers)和Phospho或Fluoroimagers,对图象进行数字化。 并成为以象素(pixels)为基础的空间和网格。 其次,在图象灰度水平上过滤和变形,进行图象加工,以进行斑点检测。 利用Laplacian,Gaussian,DOG(difference of Gaussians) opreator使有意义的区域与背景分离,精确限定斑点的强度、面积、周长和方向。图象分析检测的斑点须与肉眼观测的斑点一致。 在这一原则下,多数系统以控制斑点的重心或最高峰来分析,边缘检测的软件可精确描述斑点外观,并进行边缘检测和邻近分析,以增加精确度。 通过阈值分析、边缘检测、销蚀和扩大斑点检测的基本工具还可恢复共迁移的斑点边界。 以PC机为基础的软件Phoretix-2D正挑战古老的Unix为基础的2-D分析软件包。 第三,一旦2-DE图象上的斑点被检测,许多图象需要分析比较、增加、消减或均值化。 由于在2-DE中出现100%的重复性是很困难的,由此凝胶间的蛋白质的配比对于图象分析系统是一个挑战。 IPG技术的出现已使斑点配比变得容易。 因此,较大程度的相似性可通过斑点配比向量算法在长度和平行度观测。 用来配比的著名软件系统包括Quest,Lips,Hermes,Gemini等,计算机方法如相似性、聚类分析、等级分类和主要因素分析已被采用,而神经网络、子波变换和实用分析在未来可被采用。 配比通常由一个人操作,其手工设定大约50个突出的斑点作为“路标”,进行交叉配比。 之后,扩展至整个胶。例如:精确的PI和MW(分子量)的估计通过参考图上20个或更多的已知蛋白所组成的标准曲线来计算未知蛋白的PI和MW。 在凝胶图象分析系统依据已知蛋白质的pI值产生PI网络,使得凝胶上其它蛋白的PI按此分配。 所估计的精确度大大依赖于所建网格的结构及标本的类型。 已知的未被修饰的大蛋白应该作为标志,变性的修饰的蛋白的PI估计约在±0。25个单位。 同理,已知蛋白的理论分子量可以从数据库中计算,利用产生的表观分子量的网格来估计蛋白的分子量。 未被修饰的小蛋白的错误率大约30%,而翻译后蛋白的出入更大。 故需联合其他的技术完成鉴定。2 微量测序(microsequencing)蛋白质的微量测序已成为蛋白质分析和鉴定的基石,可以提供足够的信息。 尽管氨基酸组分分析和肽质指纹谱(PMF)可鉴定由2-DE分离的蛋白,但最普通的N-末端Edman降解仍然是进行鉴定的主要技术。 目前已实现蛋白质微量测序的自动化。 首先使经凝胶分离的蛋白质直接印迹在PVDF膜或玻璃纤维膜上,染色、切割,然后直接置于测序仪中,可用于subpicomole水平的蛋白质的鉴定。 但有几点需注意:Edman降解很缓慢,序列以每40 min 1个氨基酸的速率产生;与质谱相比,Edman降解消耗大;试剂昂贵,每个氨基酸花费
原理 用硝酸汞沉淀除去乳酪蛋白,但水解蛋白不会被除去,与饱和苦味酸产生沉淀反应。 试剂配制 除蛋白试剂:硝酸汞14g,加入100mL蒸馏水,加浓硝酸约2.5mL,加热助溶,待试剂全部溶解后加蒸馏水至500mL。溶液出现混浊等污染现象停止使用。 饱和苦味酸溶液:称取2 克固体苦味酸于烧杯中,用冷却的蒸馏水定容至100mL,后将定容好的溶液倒入烧杯中煮沸(沸腾即可),然后将液体冷却,待结晶析出后将上清液倒入试剂瓶中。 样品处理奶粉样品的处理: (1)将样品旋转振荡,使之充分混合; (2)准确称取6g 样品,加入50ml 中性温水(60℃左右),充分溶解样品。 原料奶样品:将样品充分混合即可。 操作方法 取5mL 待检处理过的样品,放入干净干燥的平皿或其他容器内,加除蛋白试剂5mL 混合均匀,边加边摇动,不可产生大体积蓄状物,将摇匀的液体用快速定量滤纸过滤于试管中,收集滤液约3mL左右。 然后沿试管壁慢慢加入饱和苦味酸溶液约0.5mL(每加0.5mL约需要30-40秒),切勿使滤液与苦味酸混合(加入的苦味酸溶液层不超出总液体体积的1/3)。 结果判断 方法判定一(沉淀圈判定):加入苦味酸后,在10 秒内逆光或在黑色背景下)上下左右移动不同方位观察产生沉淀圈情况,无沉淀圈判定为阴性,有明显沉淀圈判定为阳性。 按产生沉淀圈情况进行“阴性、阳性”判定:
[font=宋体][font=宋体]泛素化是一种细胞内的蛋白质标记系统,蛋白质泛素化是指将小的蛋白质泛素共价地连接到其他蛋白质分子上的过程。泛素([/font][font=Calibri]ubiquitin[/font][font=宋体])是一种高度保守的蛋白质,其结构由[/font][font=Calibri]76[/font][font=宋体]个氨基酸残基组成。泛素连接到目标蛋白质上的过程,经历了泛素激活、泛素转移和靶蛋白接受三个主要步骤。[/font][/font][font=宋体] [/font][font=宋体]蛋白质泛素化具有多种特点,例如它是高度选择性的,不同蛋白质泛素化的位置和数量可以影响其功能;它是可逆的,通过去泛素化反应可以调控蛋白质的泛素化状态;它还是动态调控的,受到多种因素的调控,如细胞信号通路和环境刺激。[/font][b][font=宋体]泛素化蛋白大小:[/font][/b][font=宋体] [/font][font=宋体][font=宋体]蛋白泛素化是指将小蛋白颗粒泛素([/font][font=Calibri]Ubiquitin[/font][font=宋体])与其他蛋白质共价结合的修饰过程。 泛素化修饰通常会导致泛素共价连接在蛋白质的赖氨酸残基上形成多重泛素链。 这种蛋白质泛素化增加了蛋白质的分子量,因为每个泛素分子的质量大约为[/font][b][font=Calibri]8.5[/font][font=宋体]千达尔顿([/font][font=Calibri]kDa[/font][/b][font=宋体][b])[/b]。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]泛素化蛋白质组学在许多领域有重要的应用,主要包括:[/font][/b][font=宋体] [/font][font=宋体]①疾病机制研究:泛素化是一种广泛存在于细胞中的蛋白质修饰方式,参与了细胞的生长、分化、修复和调控等多个生命活动。泛素化蛋白质组学的研究可以帮助我们了解泛素化修饰的生物学功能和调控机制,为疾病发生机制和治疗策略的研究提供重要线索。例如,在癌症、代谢综合征、神经退行性疾病等疾病中,则会出现异常泛素化。[/font][font=宋体]②药物研发:通过分析药物对泛素化蛋白质的影响,可以评估药物的效力和选择性,为药物研发提供指导。[/font][font=宋体]③临床诊断:泛素化蛋白质组学鉴定与定量分析技术可以揭示细胞调控的机制,通过分析泛素化蛋白质的组学数据,可以确定泛素化修饰在细胞信号转导、蛋白质降解和细胞周期调控等过程中的重要作用。此外,通过比较病态和正常样品中泛素化蛋白质的差异,可以鉴定与疾病发生发展相关的泛素化修饰靶点,并进一步理解疾病的分子机制。因此,这些技术也可用于临床诊断。[/font][font=宋体]④蛋白质降解调控:在癌症、神经退行性疾病和免疫相关疾病等病症中,蛋白质降解调控出现异常。而泛素化蛋白组在调控蛋白质降解中发挥重要作用。通过与泛素连接,目标蛋白质被送入蛋白酶体或蛋白酶体样体中进行降解。这个过程是细胞清除异常、老化或受损蛋白质的重要途径。[/font][font=宋体]⑤高通量技术应用:高通量泛素化蛋白质组学鉴定与定量分析技术的发展包括质谱鉴定和抗体鉴定两种方法。质谱鉴定技术利用质谱仪的高灵敏度和分辨率,能够鉴定泛素化修饰的蛋白质及其泛素化位点。抗体鉴定技术则通过特异性抗体的使用,可以富集和鉴定泛素化修饰的蛋白质。这些技术为全面了解泛素化在细胞中的作用机制和调控网络提供了可能。[/font][font=宋体]总的来说,泛素化蛋白质组学在多个领域都有重要的应用价值,推动了我们对生命过程的深入理解以及疾病治疗的创新发展。[/font][font=宋体] [/font][font=宋体]更多详情关于[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白资源[/b][/url]详情可以参看:[/font][url=https://cn.sinobiological.com/resource/protein-review][u][font=宋体][color=#0000ff][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/color][/font][/u][/url][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
食品中真蛋白与氨基酸有什么关系?