推荐厂家
暂无
暂无
 400-809-9706
400-809-9706
 留言咨询
留言咨询
 400-860-5168转5974
400-860-5168转5974
 留言咨询
留言咨询
 留言咨询
留言咨询

 400-831-3689
400-831-3689
 留言咨询
留言咨询

 400-891-5989
400-891-5989
 留言咨询
留言咨询

 400-860-5168转4449
400-860-5168转4449
 留言咨询
留言咨询

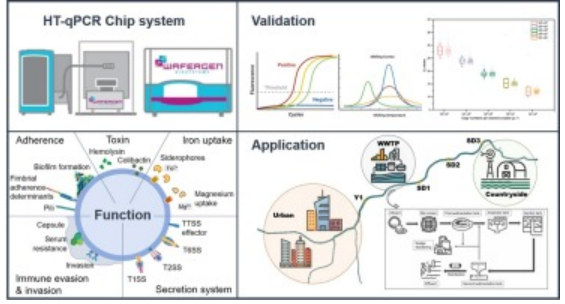
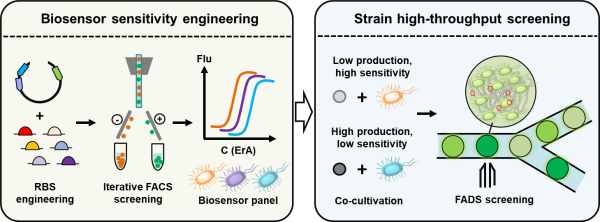



何为菌种的“高通量”,如何理解。谢谢!
简单介绍一下关于药物高通量筛选技术的知识一.概念高通量筛选(High throughput screening,HTS)技术是指以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统执行试验过程,以灵敏快速的检测仪器采集实验结果数据,以计算机对实验数据进行分析处理,同一时间对数以千万样品检测,并以相应的数据库支持整个体系运转的技术体系。二. 高通量筛选技术体系的组成1. 化合物样品库化合物样品主要有人工合成和从天然产物中分离纯化两个来源。其中,人工合成又可分为常规化学合成和组合化学合成两种方法。2.自动化的操作系统自动化操作系统利用计算机通过操作软件控制整个实验过程。操作软件采用实物图像代表实验用具,简洁明了的图示代表机器的动作。自动化操作系统的工作能力取决于系统的组分,根据需要可配置加样、冲洗、温解、离心等设备以进行相应的工作。3.高灵敏度的检测系统检测系统一般采用液闪计数器、化学发光检测计数器、宽谱带分光光度仪、荧光光度仪等。4.数据库管理系统数据库管理系统承担4个方面的功能: 样品库的管理功能;生物活性信息的管理功能; 对高通量药物筛选的服务功能; 药物设计与药物发现功能。三. 高通量筛选模型常用的筛选模型都在分子水平和细胞水平,观察的是药物与分子靶点的相互作用,能够直接认识药物的基本作用机制。1. 分子水平的药物筛选模型:受体筛选模型;酶筛选模型;离子通道筛选模型1.1受体筛选模型:指受体与放射性配体结合模型。以受体为作用靶的筛选方法,包括检测功能反应、第二信使生成和标记配体与受体相互作用等不同类型。1.2酶筛选模型:观察药物对酶活性的影响。根据酶的特点,酶的反应底物,产物都可以作为检测指标,并由此确定反应速度。典型的酶筛选包括1) 适当缓冲液中孵化;(2)控制反应速度,如:温度,缓冲液的pH值和酶的浓度等;(3)单时间点数器, 需测量产物的增加和底物的减少。1.3离子通道筛选模型: (1)贝类动物毒素的高通量筛选,其作用靶为Na+通道上的蛤蚌毒素结合位点,用放射性配体进行竞争性结合试验考察受试样品。(2)用酵母双杂交的方法高通量筛选干扰N型钙通道β3亚单位与α1β亚单位相互作用的小分子,寻找新型钙通道拮抗剂。2.细胞水平药物筛选模型观察被筛样品对细胞的作用,但不能反映药物作用的具体途径和靶标,仅反映药物对细胞生长等过程的综合作用。包括: 内皮细胞激活; 细胞凋亡; 抗肿瘤活性; 转录调控检测; 信号转导通路; 细菌蛋白分泌; 细菌生长。四.问题及展望高通量筛选技术与传统的药物筛选方法相比有以下几个优点:反应体积小;自动化;灵敏快速检测;高度特异性。但是,高通量筛选作为药物筛选的一种方法,并不是一种万能的手段,特别是在中药研究方面,其局限性也是十分明显的。首先,高通量筛选所采用的主要是分子、细胞水平的体外实验模型,因此任何模型都不可能充分反映药物的全面药理作用;其次,用于高通量筛选的模型是有限的和不断发展的,要建立反映机体全部生理机能或药物对整个机体作用的理想模型,也是不现实的。但我们应该相信,随着对高通量筛选研究的不断深入,随着对筛选模型的评价标准、新的药物作用靶点的发现以及筛选模型的新颖性和实用性的统一,高通量筛选技术必将在未来的药物研究中发挥越来越重要的作用。
[b][font=宋体]前言[/font][/b][font=宋体]在当今的生物技术领域,高通量重组蛋白表达技术在基础研究和商业应用中扮演着非常重要的角色。随着后基因组时代的到来,研究人员对大规模蛋白表达和纯化的需求日益增长,大肠杆菌因其易于遗传操作、低成本、生长迅速成为生产重组蛋白的首选微生物宿主。本文将综述大肠杆菌中高通量重组蛋白表达的现状和未来展望,探讨从目的基因获取到蛋白表达和纯化的先进技术,并讨论如何克服[/font][url=https://cn.sinobiological.com/resource/protein-review/protein-expression][u][font=宋体][color=#0000ff]重组蛋白表达[/color][/font][/u][/url][font=宋体]过程中的挑战。[/font][font=Calibri] [/font][b][font=宋体]高通量重组蛋白表达技术[/font][/b][font=宋体][font=宋体]高通量研究是一种能够同时检测数千个生物分子,使大规模重复成为可能的研究。[/font][font=Calibri]20[/font][font=宋体]世纪[/font][font=Calibri]90[/font][font=宋体]年代初,第一台[/font][font=Calibri]DNA[/font][font=宋体]测序仪被开发出来,人类基因组计划随之开启,高通量技术在[/font][font=Calibri]DNA[/font][font=宋体]、[/font][font=Calibri]RNA[/font][font=宋体]、蛋白质、脂质和代谢物检测的需求也急剧增加。自该技术提出以来,大肠杆菌中高通量重组蛋白表达和纯化已经得到了广泛的应用。[/font][/font][font=Calibri] [/font][font=Calibri]1. [/font][b][font=宋体]目的基因的制备[/font][/b][font=宋体][font=宋体]获取目的基因是重组蛋白表达的第一步。传统的方法是从[/font][font=Calibri]cDNA[/font][font=宋体]文库中直接克隆基因,但这种方法存在局限性,如从库中筛选基因较为费时以及难以添加融合标签等。高通量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]技术是目前获取目的基因最常用的技术,设计引物并调整好参数后,即可在[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]仪中自动完成目的基因的制备。[/font][/font][font=Calibri] [/font][font=Calibri] [/font][font=Calibri]2. [/font][b][font=宋体]表达载体的高通量构建[/font][/b][font=宋体][font=宋体]研究人员开发了多种构建表达载体的克隆方法,包括基于限制性内切酶的克隆、重组克隆和不依赖于连接反应的克隆等。这些方法各有优势和局限性,但在近年来都有显著改进。例如,基于限制性内切酶的克隆因其简单、高效、通用和成本效益而备受关注。一个理想的大肠杆菌表达载体应具备选择标记、复制起点、转录启动子、[/font][font=Calibri]5'[/font][font=宋体]非翻译区([/font][font=Calibri]5'UTR[/font][font=宋体])和翻译起始位点。此外,融合标签的添加对于目的基因的转录和蛋白表达同样至关重要。[/font][/font][b][font=Calibri] [/font][/b][font=Calibri]3. [/font][b][font=宋体]大肠杆菌表达菌株的选择和细胞培养[/font][/b][font=宋体][font=宋体]为保证蛋白质表达成功及其表达质量,应选择合适的大肠杆菌菌株,如[/font][font=Calibri]BL21[/font][font=宋体]及其衍生菌株是较常用的重组蛋白生产菌株。培养大肠杆菌比较简单的方法是分批培养,但此方法对生长的控制比较有限。近年来,高通量培养技术使研究人员能够在一系列发酵条件下处理大量样品,大大加快了生产时间。[/font][/font][b][font=Calibri] [/font][/b][font=Calibri]4. [/font][b][font=宋体]高通量蛋白表达和纯化[/font][/b][font=宋体][font=宋体]高通量平台可以快速克隆基因、挑选菌落、分离质粒[/font][font=Calibri]DNA[/font][font=宋体]、转化细菌、表达和纯化蛋白质。这些平台虽然成本高昂,但为复杂的分子生物学实验操作提供了极大的便利。[/font][/font][font=Calibri] [/font][b][font=宋体]结论与展望[/font][/b][font=宋体]大肠杆菌中的[/font][url=https://cn.sinobiological.com/services/high-throughput-antibody-production-service][u][font=宋体][color=#0000ff]高通量重组蛋白表达技术[/color][/font][/u][/url][font=宋体][font=宋体]极大的推进了重组蛋白的表达进程。尽管存在挑战,但通过不断优化和创新,研究人员正在朝着更高效可靠的蛋白质生产系统改进。未来的发展方向包括进一步优化克隆方法、开发新的融合标签、改进表达载体和菌株,以及利用高通量技术实现从[/font][font=Calibri]DNA[/font][font=宋体]到大规模蛋白质生产的快速转变等。[/font][/font][font=Calibri] [/font][font=宋体]参考文献:[/font][font=Calibri]Jia B, Jeon CO. High-throughput recombinant protein expression in Escherichia coli: current status and future perspectives. Open Biol. 2016 6(8):160196. doi:10.1098/rsob.160196[/font]