[font=宋体][font=宋体]稳定细胞,又被称为静止细胞,是那些在生理状态下增殖不明显,处于细胞增殖周期静止阶段的细胞([/font][font=Calibri]G0[/font][font=宋体]期)。然而,当它们受到组织损伤的刺激时,这些稳定细胞会迅速反应,进入[/font][font=Calibri]DNA[/font][font=宋体]合成前期([/font][font=Calibri]G1[/font][font=宋体]期),展现出强大的再生能力。它们是维持组织和器官稳态的关键因素。[/font][/font][font=宋体] [/font][font=宋体]稳定表达细胞株,也被称为稳定转染细胞株,是一种特殊的细胞株。这些细胞能够持续、稳定地表达特定的基因或干扰特定基因的表达。在生物学和医学研究中,稳定表达细胞株被广泛应用于基因功能研究、药物筛选和疾病模型建立等领域。[/font][b][font=宋体] [/font][font=宋体]稳定细胞株平台的常见问题解答[/font][/b][font=宋体] [/font][font=宋体]①若想做稳定细胞株,需提供哪些信息?[/font][font=宋体][font=宋体]客户仅需提供目标蛋白的序列信息和希望表达的目标蛋白的区段,义翘神州技术人员会根据客户要求进行表达风险评估和制定表达纯化策略。常见蛋白序列信息来源包括[/font][font=Calibri]UniProt[/font][font=宋体]和[/font][font=Calibri]NCBI[/font][font=宋体]等数据库。客户也可直接提供编码目标蛋白的核苷酸序列。[/font][/font][font=宋体] [/font][font=宋体]②稳定株细胞如何交付?[/font][font=宋体]采用干冰运输,尽可能减少温度波动对细胞造成的影响。[/font][font=宋体] [/font][font=宋体][font=宋体]③单克隆和[/font][font=Calibri]pool[/font][font=宋体]怎么选择?[/font][/font][font=宋体][font=宋体]成药蛋白需要单克隆,以便溯源。如只需拿到蛋白[/font][font=Calibri]/[/font][font=宋体]抗体的话,[/font][font=Calibri]pool[/font][font=宋体]即可满足。需要提醒的是,通常情况下,[/font][font=Calibri]pool[/font][font=宋体]产量较单克隆低。[/font][/font][font=宋体] [/font][font=宋体]④稳定细胞株做重组蛋白,能否根据蛋白活性进行克隆筛选?[/font][font=宋体][font=宋体]是可以的,只要客户有完整的活性检测方法,我们可以提供[/font][font=Calibri]minipool[/font][font=宋体]供客户进行活性检测(或由义翘进行活性检测)。符合客户对活性的要求后再进行后续的实验。[/font][/font][font=宋体] [/font][font=宋体]⑤为什么要构建稳定细胞株?[/font][font=宋体]稳定株一个很大的优势是减小重组表达蛋白的批间差异,并且表达量通常比瞬转高。对于成药性抗体来说,构建稳定细胞株是十分必要的。[/font][font=宋体] [/font][font=宋体]⑥为什么稳定细胞株构建周期较长?[/font][font=宋体]稳定株的构建周期长,很大程度是由于要筛选出阳性克隆,并需要对细胞株的稳定性进行检测。[/font][font=宋体] [/font][font=宋体]⑦制备稳定株表达蛋白的周期大致如何?[/font][font=宋体][font=宋体]如只需要[/font][font=Calibri]pool[/font][font=宋体]即可,从基因合成到得到纯化后的蛋白,周期一般在[/font][font=Calibri]7[/font][font=宋体]周左右。如需引入多步纯化方案,标签切除,以及额外检测服务则周期会根据具体项目情况有所延长。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/stable-cell-line-development-service][b]稳定细胞系构建服务[/b][/url],同时提供[url=https://cn.sinobiological.com/services/platform/stable-cell-line-development][b]稳定细胞株构建平台[/b][/url],详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/platform/stable-cell-line-development[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
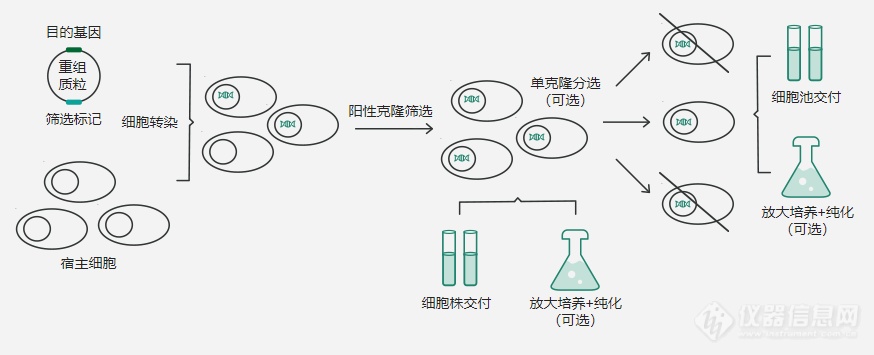
[font=宋体]稳定细胞株可组成型表达外源基因。因其稳定性高,适用于各种研究应用,包括重组蛋白、抗体生产、结构生物学和功能性研究等。[/font][font=宋体] [/font][font=宋体]义翘神州在重组表达方面不断深耕,积累了大量稳定株开发的相关经验,在提高稳定细胞株的生产能力,改善稳定细胞株的细胞状态等方面有着丰富的经验。义翘神州可提供从基因合成到稳定细胞株交付的一站式服务,为客户的研究提供助力。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州拥有[/font][font=Calibri]GS[/font][font=宋体]系统和可用于药品申报的整套系统,能够完成各类稳定细胞株的开发筛选工作。稳定株的开发首先是将外源基因导入宿主细胞,随后通过抗性基因进行筛选,得到稳定表达目的基因的细胞株。从转染后的细胞池中挑选优质克隆,通过测定目标蛋白的表达情况筛选大的细胞群,以发现高亲和力或高产量的细胞。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]稳定细胞株重组表达流程图[/font] [font=宋体]:[/font][/font][align=center][font=宋体] [/font][img=稳定细胞株重组表达流程图,690,280]https://ng1.17img.cn/bbsfiles/images/2023/08/202308291536242843_9813_5907840_3.png!w690x280.jpg[/img][/align][font=宋体] [/font][font=宋体] [/font][font=宋体][b][url=https://cn.sinobiological.com/services/platform/stable-cell-line-development]稳定细胞株构建平台[/url]常见问题解析:[/b][/font][font=宋体] [/font][font=宋体]①若想做稳定细胞株,需提供哪些信息?[/font][font=宋体][font=宋体]客户仅需提供目标蛋白的序列信息和希望表达的目标蛋白的区段,义翘神州技术人员会根据客户要求进行表达风险评估和制定表达纯化策略。常见蛋白序列信息来源包括[/font][font=Calibri]UniProt[/font][font=宋体]和[/font][font=Calibri]NCBI[/font][font=宋体]等数据库。客户也可直接提供编码目标蛋白的核苷酸序列。[/font][/font][font=宋体] [/font][font=宋体]②稳定株细胞如何交付?[/font][font=宋体]采用干冰运输,尽可能减少温度波动对细胞造成的影响。[/font][font=宋体] [/font][font=宋体][font=宋体]③单克隆和[/font][font=Calibri]pool[/font][font=宋体]怎么选择?[/font][/font][font=宋体][font=宋体]成药蛋白需要单克隆,以便溯源。如只需拿到蛋白[/font][font=Calibri]/[/font][font=宋体]抗体的话,[/font][font=Calibri]pool[/font][font=宋体]即可满足。需要提醒的是,通常情况下,[/font][font=Calibri]pool[/font][font=宋体]产量较单克隆低。[/font][/font][font=宋体] [/font][font=宋体]④稳定细胞株做重组蛋白,能否根据蛋白活性进行克隆筛选?[/font][font=宋体][font=宋体]是可以的,只要客户有完整的活性检测方法,我们可以提供[/font][font=Calibri]minipool[/font][font=宋体]供客户进行活性检测(或由义翘进行活性检测)。符合客户对活性的要求后再进行后续的实验。[/font][/font][font=宋体] [/font][font=宋体]⑤为什么要构建稳定细胞株?[/font][font=宋体]稳定株一个很大的优势是减小重组表达蛋白的批间差异,并且表达量通常比瞬转高。对于成药性抗体来说,构建稳定细胞株是十分必要的。[/font][font=宋体] [/font][font=宋体]⑥为什么稳定细胞株构建周期较长?[/font][font=宋体]稳定株的构建周期长,很大程度是由于要筛选出阳性克隆,并需要对细胞株的稳定性进行检测。[/font][font=宋体] [/font][font=宋体]⑦制备稳定株表达蛋白的周期大致如何?[/font][font=宋体][font=宋体]如只需要[/font][font=Calibri]pool[/font][font=宋体]即可,从基因合成到得到纯化后的蛋白,周期一般在[/font][font=Calibri]7[/font][font=宋体]周左右。如需引入多步纯化方案,标签切除,以及额外检测服务则周期会根据具体项目情况有所延长。[/font][/font]
现在准备做实验,用的是mouse的成纤维细胞株。想检测其表面的抗原,如果选择抗体的话,有什么要求吗?什么是来源种属?什么是反应种属?具体什么意思,比如mouse anti rat Ab。那个是反应种属啊?我选抗体的时候是不是一定要选择抗mouse的抗体。还是选择mouse 产生的抗体?很搞不明白,请指点,谢谢
[font=宋体]随着生物技术的快速发展,稳定转染细胞株的构建在基础研究和应用研究中变得越来越重要。这一技术涉及到将外源基因稳定整合到宿主细胞基因组中,从而实现基因的长期表达。然而,这一过程也伴随着一系列的挑战和常见问题。本文将深入探讨稳转细胞株构建的方法,以及在实践过程中可能遇到的问题,旨在为研究者提供实用的指导和建议。[/font][font=宋体] [/font][font=宋体][b]稳定转染细胞株构建方法:[/b][/font][font=宋体] [/font][font=宋体]一、慢病毒感染细胞[/font][font=宋体] [/font][font=宋体][font=宋体]慢病毒因为可以感染大多数的分裂细胞和非分裂细胞,包装技术成熟,[/font][font=Calibri]II[/font][font=宋体]代和[/font][font=Calibri]III[/font][font=宋体]代慢病毒包装系统均能包装高滴度的慢病毒,是稳转细胞系构建的首选系统。但是因为慢病毒有包装容量限制,不适合转录本区域比较长的基因,对较大的基因有局限性。另外由于慢病毒是逆转录病毒,病毒表达载体中,是由[/font][font=Calibri]WPRE[/font][font=宋体]元件代替[/font][font=Calibri]PolyA[/font][font=宋体]稳定以达到稳定[/font][font=Calibri]mRNA[/font][font=宋体]的作用,对部分基因的翻译有一定影响。[/font][/font][font=宋体] [/font][font=宋体]二、转座子介导的稳转细胞系构建[/font][font=宋体] [/font][font=宋体][font=宋体]转座子是存在于各种生命细胞内的可移动遗传信息元件,能实现[/font][font=Calibri]DNA[/font][font=宋体]片段在染色体内部[/font][font=Calibri]/[/font][font=宋体]之间的转移。工程化的转座子由[/font][font=Calibri]ITR[/font][font=宋体]和转座酶编码基因组成,通过转座酶与[/font][font=Calibri]ITR[/font][font=宋体]结合实现基因转移。将转座子的两个元件分别构建在两个独立载体上,并将目的基因序列替换转座酶序列,与另一个载体共转染目的细胞,实现目的基因在宿主基因组上的整合。与其他技术不同,目的基因在整合酶存在下会持续处于切割—整合状态,实现连续跳跃。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]三、[/font][font=Calibri]CRISPR/Cas9 [/font][font=宋体]基因敲入[/font][/font][font=宋体] [/font][font=宋体][font=宋体]利用[/font][font=Calibri]CRISPR/Cas9[/font][font=宋体]系统,通过[/font][font=Calibri]NHEJ[/font][font=宋体]和[/font][font=Calibri]HDR[/font][font=宋体]修复机制,可将目的基因(如抗性基因和荧光标志)定点敲入细胞基因组。在哺乳动物细胞中,[/font][font=Calibri]NHEJ[/font][font=宋体]的效率高于[/font][font=Calibri]HDR[/font][font=宋体]。设计特定[/font][font=Calibri]sgRNA[/font][font=宋体]和[/font][font=Calibri]donor[/font][font=宋体]载体,可在[/font][font=Calibri]AAVS1[/font][font=宋体]位点(人基因组安全港)实现基因定点敲入。此方法稳定、安全,但敲入概率在不同细胞和位点中有所差异,需筛选单克隆以获得稳定细胞系。随着编辑效率提高,此方法将更省时省力。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]四、[/font][font=Calibri]CRISPR SAM[/font][font=宋体]系统,通过融合[/font][font=Calibri]VP64[/font][font=宋体]、[/font][font=Calibri]MS2-P65-HSF1[/font][font=宋体]系统对基因进行过表达和干扰[/font][/font][font=宋体][font=Calibri]CRISPR SAM[/font][font=宋体]通过[/font][font=Calibri]dCas9-VP64[/font][font=宋体]、[/font][font=Calibri]MS2-P65-HSF1[/font][font=宋体]激活蛋白实现了多数细胞内源基因的特异性激活,不受基因大小限制。主要优势是应用广泛,但需要三种不同抗性病毒逐次或同时感染细胞。[/font][font=Calibri]CRISPR SAM[/font][font=宋体]将[/font][font=Calibri]sgRNA[/font][font=宋体]序列构建在[/font][font=Calibri]lenti[/font][font=宋体]载体中,配合其他两种慢病毒可激活任何基因。主要缺点是筛选细胞时需要三种不同抗性的病毒,部分细胞筛选后表型变化明显。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]稳转细胞系构建中常见问题解析:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]是否需要进行密码子优化?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]由于氨基酸密码子的简并性和[/font][font=Calibri]tRNA[/font][font=宋体]的种类多样性、数量的差异,密码子优化对长基因稳转细胞系的构建有很强的必要性,可以大幅提高目标蛋白的表达量。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. Kozak[/font][font=宋体]序列是必须要添加的吗?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Kozak[/font][font=宋体]序列(通常是[/font][font=Calibri]GCCACCatgG[/font][font=宋体]),真核生物[/font][font=Calibri]mRNA[/font][font=宋体]真正的起始密码子位于[/font][font=Calibri]Kozak[/font][font=宋体]序列的保守序列中,其共有序列是[/font][font=Calibri]CCRCCAUGG[/font][font=宋体],几乎所有[/font][font=Calibri]mRNA[/font][font=宋体]的翻译起始都依赖于[/font][font=Calibri]5[/font][font=宋体]’帽子结构募集小亚基,少数通过内部核糖体进入位点[/font][font=Calibri](IRES)[/font][font=宋体]募集小亚基。[/font][font=Calibri]Kozak[/font][font=宋体]序列通过与翻译起始因子[/font][font=Calibri]eIF[/font][font=宋体]形成翻译起始复合物,起始蛋白的翻译。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]启动子应如何选择?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]CMV[/font][font=宋体](巨细胞病毒)启动子除了在干细胞外,其他大多数细胞类型中均可以获得高表达活性。悬浮细胞中[/font][font=Calibri]SFFV[/font][font=宋体]启动子表达活性相对较高。而[/font][font=Calibri]EF1a[/font][font=宋体](延伸因子[/font][font=Calibri]-1[/font][font=宋体]α)启动子更适用于表达长片段的基因。[/font][font=Calibri]CMV[/font][font=宋体];[/font][font=Calibri]EF1A[/font][font=宋体];[/font][font=Calibri]CAG[/font][font=宋体];[/font][font=Calibri]CBh[/font][font=宋体];[/font][font=Calibri]SFFV[/font][font=宋体],等均属于强启动子,都可作为稳转细胞系构建可选启动子。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]稳转细胞系培养体系[/font][/font][font=宋体] [/font][font=宋体][font=宋体]稳转细胞系一般建议用半抗性筛选浓度维持细胞生长,如[/font][font=Calibri]hepG2[/font][font=宋体]细胞[/font][font=Calibri]puro[/font][font=宋体]抗性筛选浓度为[/font][font=Calibri]2[/font][font=宋体]μ[/font][font=Calibri]g/ml[/font][font=宋体],则建议用[/font][font=Calibri]1ug/mL+[/font][font=宋体]完全培养基维持生长;部分基因过表达后会影响细胞代谢,尤其肿瘤细胞,糖酵解代谢速率受影响,细胞生长缓慢,可相应添加葡萄糖或者[/font][font=Calibri]HEPES[/font][font=宋体]调节细胞细胞代谢水平,维持细胞增殖。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5. [/font][font=宋体]标签放在[/font][font=Calibri]N[/font][font=宋体]端还是[/font][font=Calibri]C[/font][font=宋体]端好?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]如果[/font][font=Calibri]N[/font][font=宋体]端有信号肽,建议放在[/font][font=Calibri]C[/font][font=宋体]端;蛋白如果较小,建议放在[/font][font=Calibri]C[/font][font=宋体]端,减少蛋白降解;如果下游有[/font][font=Calibri]P2A[/font][font=宋体],[/font][font=Calibri]T2A[/font][font=宋体]等自剪切肽,建议放在[/font][font=Calibri]C[/font][font=宋体]端。如果为了添加[/font][font=Calibri]Kozak[/font][font=宋体]序列,建议加在[/font][font=Calibri]N[/font][font=宋体]端。如果纯化中需要酶切标签,建议放在[/font][font=Calibri]N[/font][font=宋体]端。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6. [/font][font=宋体]是否可以构建稳转敲除的细胞系?[/font][/font][font=宋体] [/font][font=宋体]一般不建议,因为敲除元件稳定持续的表达在细胞中,累积脱靶效应明显,影响细胞状态。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/stable-cell-line-development-service][b]稳定细胞系构建服务[/b][/url],包含过表达细胞系构建服务和[/font][font=Calibri]CHO[/font][font=宋体]稳定细胞株开发服务,其服务内容详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/services/stable-cell-line-development-service[/font][/font]
市场上供应的大多数培养液的配方非常接近,这使得细胞很容易适应新的培养液。这里我将详细介绍一个方法,这个方法是保守的,在大多数情况下可以进行删减一些步骤。最简单最节省时间的情况是把细胞直接分装到新的培养液中,观察几代以保证细胞的生长参数是可以接受的。这个方法适于悬浮细胞,不过也很容易扩展到贴壁细胞。细胞的生长参数1. 翻倍时间( Doubling Time )细胞的翻倍时间在评价昆虫细胞健康程度的参数中是最容易测量的。翻倍时间应该在细胞处于对数期复制时测量,对于 Sf9 和 Sf21 细胞来说通常是介于 16-24 小时之间,不过大多数在 20-22 小时。dt=t × ln2/ln(Ct/Co) ,其中 dt 为翻倍时间, Co 为起始细胞数目, Ct 为经过时间 t 后的细胞数目, t 为 Co 和Ct 两次计数之间的间隔时间,所有的时间都以小时为单位。2. 细胞大小( Cell Size )细胞的大小是监测细胞健康程度的一个非常有用的参数。如果细胞是健康的,细胞的大小均一,都处于该细胞株体积正常变化范围的下限。细胞的大小在不同的细胞株变化是很大的。对于我用过的 Sf9 和 Sf21 ,典型的直径是 16-18 m m ,不过我知道有些细胞株小至 14 m m 或者大至 19 m m 仍然很健康。3. 滞后期( Duration of Lag )当细胞的密度较低时,会有一个滞后期,其长短取决于分装或者传代后细胞的密度。一般说来,该密度越低,滞后期越长。对于一个特定的细胞株来说,当这个密度高出一个阈值时,滞后期的长短与密度无关;而低于一个阈值时,滞后期无限长,细胞不再增殖。4. 低密度分装极限( Low Density Split Tolerance )能够在一个较短的滞后期(小于 12 小时)复苏的细胞形状较好。不过这是细胞株的特性,需要进行实验来确定你的细胞株的密度极限。我的细胞株有些在分装成密度为 5 × 104 细胞 /ml 时仍然可以很好复苏,有些细胞株分装成 5 × 105 细胞 /ml 就不能复苏了。5. 高密度极限( High Density Maximum )这是你的细胞能生长的最大密度,高于这个密度你的细胞将进入平台期。这个指标既和细胞株有关,又和使用的培养液有关。我建议先把你的细胞株培养至平台期,然后把一些分装到新鲜的培养液中以后,使剩下的继续生长至平台期,同时密切监测细胞状况。一般来说,细胞的培养要避免密度超过高密度极限的 80% 。对于我培养的细胞,这个极限值从 2 × 106 至 12 × 106 细胞 /ml 不等。实验步骤第一阶段:1. 准备合适体积的由 25% 体积新培养液和 75% 旧培养液(即细胞原先适应的培养液)组成的混合培养液 I。2. 将细胞以通常分装时使用的最低分装密度的两倍分装到混合培养液 I 中。3. 使细胞生长到通常培养时的较高密度,监测细胞生长参数。4. 继续以步骤 2 中的密度分装细胞到新鲜的混合培养液 I 中,直到生长参数达到可以接受的水平。有时候分装一次就可达到要求。5. 一旦细胞稳定下来,以通常使用的最低分装密度分装细胞至新鲜的混合培养液 I 中,同样监测细胞参数。6. 细胞达到较高密度后,继续以步骤 5 中的分装密度把细胞分装到新鲜的混合培养液 I 中,直到细胞的生长参数达到可以接受的水平。7. 如果细胞恢复到正常状态,进行第二阶段的实验。8. 如果细胞不能达到正常状态,新培养液可能不适于培养这种细胞。9. 如果细胞在新培养液中的生长参数达到平衡状态,虽然与正常状态不同,但是可以为实验接受,也可进行第二阶段的实验。第二阶段:1. 准备适量的由 50% 新培养液和 50% 旧培养液组成的混合培养液 II 。2. 将细胞以两倍最低分装密度分装至混合培养液 II 中。3. 如第一阶段一样,监测细胞生长指数,使细胞达到稳定状态。然后将分装密度降到最低分装密度,再使细胞达到稳定状态。第三阶段:步骤同第一阶段和第二阶段,使细胞适应混合培养液 III ( 75% 新培养液和 25% 旧培养液)。第四阶段:1. 步骤同第一阶段、第二阶段和第三阶段,使细胞适应新培养液。2 . 当细胞在新培养液中达到稳定后,监测细胞的生长指数,看是否波动过大。
细胞培养FAQ: 1 冷冻管应如何解冻? 取出冷冻管后, 须立即放入37 °C 水槽中快速解冻, 轻摇冷冻管使其在1 分钟内全部融化, 并注意水面不可超过冷冻管盖沿, 否则易发生污染情形。另冷冻管由液氮桶中取出解冻时, 必须注意安全, 预防冷冻管之爆裂。 2 细胞冷冻管解冻培养时, 是否应马上去除DMSO? 除少数特别注明对DMSO 敏感之细胞外, 绝大部分细胞株(包括悬浮性细胞), 在解冻之后, 应直接放入含有10-15ml新鲜培养基之培养角瓶中, 待隔天再置换新鲜培养基以去除DMSO 即可, 如此可避免大部分解冻后细胞无法生长或贴附之问题。 3 可否使用与原先培养条件不同之培养基? 不能。每一细胞株均有其特定使用且已适应之细胞培养基, 若骤然使用和原先提供之培养条件不同之培养基, 细胞大都无法立即适应, 造成细胞无法存活。 4 可否使用与原先培养条件不同之血清种类? 不能。血清是细胞培养上一个极为重要的营养来源, 所以血清的种类和品质对于细胞的生长会产生极大的影响。来自不同物种的血清, 在一些物质或分子的量或内容物上都有所不同,血清使用错误常会造成细胞无法存活。 5 何谓FBS, FCS, CS, HS ? FBS (fetal bovine serum) 和FCS (fetal calf serum) 是相同的意思, 两者都是指胎牛血清, FCS 乃错误的使用字眼, 请不要再使用。CS (calf serum) 则是指小牛血清。HS (horseserum) 则是指马血清。 6 培养细胞时应使用5 % 或10% CO2?或根本没有影响? 一般培养基中大都使用HCO3-/CO32-/H+ 作为pH 的缓冲系统, 而培养基中NaHCO3 的含量将决定细胞培养时应使用的CO2 浓度。当培养基中NaHCO3 含量为每公升3.7 g 时,细胞培养时应使用10 % CO2;当培养基中NaHCO3 为每公升1.5 g 时, 则应使用5 % CO2 培养细胞。 7 何时须更换培养基? 视细胞生长密度而定, 或遵照细胞株基本数据上之更换时间,按时更换培养基即可。 8 培养基中是否须添加抗生素? 除于特殊筛选系统中外, [font=宋
细胞培养知识1 冷冻管应如何解冻? 取出冷冻管后, 须立即放入37 °C 水槽中快速解冻, 轻摇冷冻管使其在1 分钟内全部融化, 并注意水面不可超过冷冻管盖沿, 否则易发生污染情形。另冷冻管由液氮桶中取出解冻时, 必须注意安全, 预防冷冻管之爆裂。 2 细胞冷冻管解冻培养时, 是否应马上去除DMSO? 除少数特别注明对DMSO 敏感之细胞外, 绝大部分细胞株(包括悬浮性细胞), 在解冻之后, 应直接放入含有10-15ml新鲜培养基之培养角瓶中, 待隔天再置换新鲜培养基以去除DMSO 即可, 如此可避免大部分解冻后细胞无法生长或贴附之问题。 3 可否使用与原先培养条件不同之培养基? 不能。每一细胞株均有其特定使用且已适应之细胞培养基, 若骤然使用和原先提供之培养条件不同之培养基, 细胞大都无法立即适应, 造成细胞无法存活。 4 可否使用与原先培养条件不同之血清种类? 不能。血清是细胞培养上一个极为重要的营养来源, 所以血清的种类和品质对于细胞的生长会产生极大的影响。来自不同物种的血清, 在一些物质或分子的量或内容物上都有所不同,血清使用错误常会造成细胞无法存活。 5 何谓FBS, FCS, CS, HS ? FBS (fetal bovine serum) 和FCS (fetal calf serum) 是相同的意思, 两者都是指胎牛血清, FCS 乃错误的使用字眼, 请不要再使用。CS (calf serum) 则是指小牛血清。HS (horseserum) 则是指马血清。
[url=http://www.hexiyiqi.com/]离心机[/url]是一种结构复杂的高速旋转机械,它是利用离心力,不同物质在离心场中沉淀速度的差异,对混合溶液进行快速分离的专门设备,是一种将装有样品溶液的离心管、瓶或袋通过离心机转子置于离心轴上,利用转头绕轴高速旋转所产生的强大离心力,使样品中不同性质颗粒相互分离的特殊装置。可以实现样品的分析、分离。从转速看,台式离心机基本属于低速、高速离心机的范畴,因此,具有低速、高速离心机的特点。与落地式离心机相比,只不过只是尺寸和容量小一些。[align=center][url=http://www.hexiyiqi.com/hexi2012chanpinzhongxin/taishigaosulengdonglixinji/2012-10-17/69.html][b][img]http://www.hexiyiqi.com/d/file/hexi2012chanpinzhongxin/taishigaosulengdonglixinji/2012-10-17/0e080cd46b2ee061b55caabaaee8cbf2.jpg[/img][/b][/url][/align][align=center][b]台式低速离心机TD5A[/b][/align]离心机的式样和型号很多,有国产的和进口的,按用途可分为分析式离心机和制备式离心机;按转速可划分为:普通离心机(低速)80000r/min;特定细胞株的功能、行为和生化特性的分析在现有技术水平上只能通过相对纯的细胞株才能弄清,然而从组织、血液和其它体液标本中获得的细胞都是不同类型细胞的混合物,并且不同细胞或同一细胞株的不同周期与其它细胞相比,其代谢过程、生物特性和理化参数大多都有差异。细胞分离技术包括离心技术、流式细胞术和细胞电泳。离心是研究如细胞核、线粒体、高尔基体、溶酶体和微体,以及各种大分子基本手段。流式细胞术是对单个细胞进行快速定量分析与分选的一门技术。细胞电泳是指在一定PH 值下细胞表面带有净的正或负电荷,能在外加电场的作用下发生泳动。分离不同细胞株的方法概括起来可分为两大类:一是:根据细胞的物理学特性差异分离,包括低速离心机分离法、物理吸附法、凝胶色谱法和细胞电泳法等 二是:根据细胞的生物学特性差异分离,包括花环形成法和单层细胞免疫吸收法等。在诸多分离方法中,[url=http://www.hexiyiqi.com/hexi2012chanpinzhongxin/taishigaosulengdonglixinji/]低速离心机[/url]分离法根据细胞大小和密度进行分离,分离介质选择广泛,原理简单,对细胞损伤小,可适用于各种不同的研究目的,已成为生物学实验室最常规的分离工具。[align=center][url=http://www.hexiyiqi.com/hexi2012chanpinzhongxin/disulengdonglixinji/2013-06-15/228.html][b][img=台式低速冷冻离心机,550,550]http://www.hexiyiqi.com/d/file/hexi2012chanpinzhongxin/taishigaosulengdonglixinji/2019-05-14/73cd477dd28d613eb3c077a58b94614a.jpg[/img][/b][/url][/align][align=center][b]台式低速冷冻离心机TDL5M[/b][/align]
注意事项: 1.配制溶液时必须用新鲜的蒸馏水。2.安装蔡式滤器时通常使用孔径 0.45 微米 和 0.22 微米滤膜各一张,放置位置为 0.45 的位于 0.22 微米的滤膜上方,并且要特别注意滤膜光面朝上。 3.配制 RPMI1640 培养基时因为还要加入小牛血清,而小牛血清略偏酸性,为了保证培养液 PH 值最终为 7.2 ,可在配制时调 PH 至 7.4 。 细胞培养的一般过程 一、准备工作准备工作对开展细胞培养异常重要,工作量也较大,应给予足够的重视,推备工作中某一环节的疏忽可导致实验失败或无法进行。准备工作的内容包括器皿的清洗、干燥与消毒,培养基与其他试剂的配制、分装及灭菌,无菌室或超净台的清洁与消毒,培养箱及其他仪器的检查与调试,具体内容可参阅有关文献。二、取材在无菌环境下从机体取出某种组织细胞(视实验目的而定),经过一定的处理(如消化分散细胞、分离等)后接入培养器血中,这一过程称为取材。如是细胞株的扩大培养则无取材这一过程。机体取出的组织细胞的首次培养称为原代培养。R 理论上讲各种动物和人体内的所有组织都可以用于培养,实际上幼体组织(尤其是胚胎组织)比成年个体的组织容易培养,分化程度低的组织比分化高的容易培养,肿瘤组织比正常组织容易培养。取材后应立即处理,尽快培养,因故不能马上培养时,可将组织块切成黄豆般大的小块,置 4℃的培养液中保存。取组织时应严格保持无菌,同时也要避免接触其他的有害物质。取病理组织和皮肤及消化道上皮细胞时容易带菌,为减少污染可用抗菌素处理。由组织并分离分散细胞的方法可参阅有关文献。 三、培养将取得的组织细胞接入培养瓶或培养板中的过程称为培养。如系组织块培养,则直接将组织块接入培养器皿底部,几个小时后组织块可贴牢在底部,再加入培养基。如系细胞培养,一般应在接入培养器皿之前进行细胞计数,按要求以一定的量(以每毫升细胞数表示)接入培养器皿并直接加入培养基。细胞进入培养器皿后,立即放入培养箱中,使细胞尽早进入生长状态。正在培养中的细胞应每隔一定时间观察一次,观察的内容包括细胞是否生长良好,形态是否正常,有无污染,培养基的 PH是否太酸或太碱(由酚红指示剂指示),此外对培养温度和 CO2浓度也要定时检查。一般原代培养进入培养后有一段潜伏期(数小时到数十天不等),在潜伏期细胞一般不分裂,但可贴壁和游走。过了潜伏期后细胞进入旺盛的分裂生长期。细胞长满瓶底后要进行传代培养,将一瓶中的细胞消化悬浮后分至两到三瓶继续培养。每传代一次称为“一代”。二倍体细胞一般只能传几十代,而转化细胞系或细胞株则可无限地传代下去。转化细胞可能具有恶性性质,也可能仅有不死性(Immortality)而无恶性。培养正在生长中的细胞是进行各种生物医学实验的良好材料。四、冻存及复苏为了保存细胞,特别是不易获得的突变型细胞或细胞株,要将细胞冻存。冻存的温度一般用液氮的温度?-196℃,将细胞收集至冻存管中加入含保护剂(一般为二甲亚砜或甘油)的培养基,以一定的冷却速度冻存,最终保存于液氮中。在极低的温度下,细胞保存的时间几乎是无限的。复苏一般采用快融方法,即从液氮中取出冻存管后,立即放入 37℃水中,使之在一分钟内迅速融解。然后将细胞转入培养器皿中进行培养。冻存过程中保护剂的选用、细胞密度、降温速度及复苏时温度、融化速度等都对细胞活力有影响。
植物细胞原生质体制制备与融合2006-11-20 17:14植物细胞原生质体制制备与融合1、原生质体常现的杂交育种由于物种间难以逾越的天然屏障而举步维艰。科学家们受细胞全能性理论及组织培养成功的启示,逐渐将眼光转向细胞融合,试图用这种崭 图3-2新的手段冲破自然界的禁钢。1937年michel率先实施植物细胞融合的试验。如何去除坚韧的细胞'接成了牛物学工作者必须解决的首要难题。196O年该领域终于出现了重大突破。由英国诺丁汉大学Cocking教授领导的小组率先利用真菌纤维素酶,成功地制备出了大量具有高度活性可再生的番茄幼根细胞原生质体,开辟了原生质体融合研究的新阶段。植物细胞原生质体是指那些已去除全部细胞壁的细胞。2、原生质体制备(1)取材与除菌 为了让制得的原生质体一般都生活力较强,再生与分生比例较高。常用的外植体包括:种子根。子叶、下胚轴、胚细胞、花粉母细胞、悬浮培养细胞和嫩叶。对外植体的除菌要因材而异。悬浮培养细胞一般无需除菌。对较脏的外植体往往要先用肥皂水清洗再以清水洗2~3次,然后浸人 70%酒精消毒后,再放进 3%次氯酸钠处理。最后用无菌水漂洗数次,并用无菌滤纸吸干。(2)酶解 现以叶片为例说明如何制备植物原生质体。①配制酶解反应液:反应液应是一种PH值在5·5~5·8的缓冲液,内合纤维素酶0.3%~3.0%以及渗透压稳定剂、细胞膜保护剂和表面活性剂等,②酶解:除菌后的叶片 撕去下表皮 切块放人反应液 不时轻摇 (条件25℃~30℃,2~4h)反应液转绿。反应液转绿是酶解成功的一项重要指标,说明已有不少原生质体游离在反应液中。经镜检确认后应及时终止反应,避免脆弱的原生质体受到更多的损害。(3) 分离 在反应液中除了大量的原生质体外,尚有一些残留的组织块和破碎的细胞。为了取得高纯度的原生质体就必需进行原生质体的分离。可选取200~400目的不锈钢网或尼龙布j叭i过滤除渣,也可采用低速离心法或比重漂浮法直接获取原生质体。(4) 洗涤刚分离得到的原生质体往往还含有酶及其他不利于原生质体培养。再生的试剂,应以新的渗透压稳定剂或原生质体培养液离心洗涤2~4次。 (5) 鉴定 只有经过鉴定确认已获得原生质体后才能进行下阶段的细胞融合工作。由于已去除全部或大部分细胞壁,此时植物细胞呈圆形。如果把它放人低渗溶液中,则很容易胀破。也。'厂月荧光增白剂染色后置紫外显微镜下观察,残留的细胞壁呈现明显荧光。通过以上观测,基本上可判别是否原生质体及其百分中 此外,尚可借助台盼蓝活细胞染色、胞质环流观察以及测定人、作用、呼吸作用等参数定量检测原生质体的活力。4、 原生质体的融合(1)化学法诱导融合 化学法诱导融合无需贵重仪器,试剂易于得到,因此一直是细胞融合的主要方法。尤其是聚乙二醇(PEG)纳合成钙高pH诱导融合法已成为化学法诱导细胞融合的主流。以下简介此方法(在无菌条件下进行):按比例混合双亲原生质体-----滴加 PEG溶液,摇匀,静置----滴加高钙高pH值溶液,摇匀,静置-----滴加原生质体培养液洗涤数次-----离心获得原生质体细胞团一筛选、再生杂合细胞。(2)物理法诱导融合 1979年Senda等发明了微电极法诱导细胞融合。1981年Zi。。mann等提出了改进的平行电极法,现简介如下:将双亲本原生质体以适当的溶液悬浮混合后,插入微电极,接通一定的交变电场。原生质体极化后顺着电场排列成紧密接触的珍珠串状。此时瞬间施以适当强度的电脉冲,则使原生质体质膜被击穿而发生融合。电激融合不使用有毒害作用的试剂,作用条件比较温和,而且基本上是同步发生融合。只要条件摸索适当,亦可获得较高的融合率。上述操作实际上是供体与受体原生质体对等融合的方法。由于双方各具几万对基因,要筛选得到符合需要且能稳定传代的杂合细胞是相当困难的。最近,有人提出以X射线、伽玛射线。纺锤体毒素或染色体浓缩剂等对供体原生质体进行前处理。轻剂量处理可造成染色体不同程度的丢失、失活、断裂和损伤,融合后实现仅有少数染色体甚至是DNA片段的转移;致死量处理后合u可能产生没再仅体万染色体w划她旋余种。利用这种价值不对称融合方法,大大提高了融合体的生存率和可利用率。经过上述融合处理后再生的细胞株将可能出现以下几种类型.2) 亲本双方的细胞核和细胞质能融洽地合为一体,发育成为完全的杂合植株。这种例子不多。3) 融合细胞由一方细胞核与另一方细胞质构成,可能发育为核质异源的植株。亲缘关系越远的物种,某个亲本的染色体被丢失的现象就越严重。 4) 融合细胞由双方胞质及一方核或再附加少量他方染色体或DNA片段构成。④原生质体融合后两个细胞核尚未融合时就过早地被新出现的细胞壁分开。以后它们各自分生长成嵌合植株。5、 杂合体的鉴别与筛选双亲本原生质体经融合处理后产生的杂合细胞,一般要经含有渗透压稳定剂的原生质体培养基培养(液体或固体),再生出细胞壁后转移到合适的培养基中。待长出愈伤组织后按常规方法诱导其长芽、生根、成苗。在此过程中可对是否杂合细胞或植株进行鉴别与筛选。 (1) 杂合细胞的显微镜鉴别 根据以下特征可以在显微镜下直接识别杂合细胞:若一方细胞大,另一方细胞小,则大。小细胞融合的就是杂合细胞;若~方细胞基本无色,另一方为绿色,则自绿色结合的细胞是杂合细胞;如果双方原生质体在特殊显微镜下或双方经不同染料着色后可见不同的特征,则可作为识别杂合的标志;发现h述杂合细胞后可借助显微操作仪在显微镜下直接取出,移置再牛培养基培养。(2)以互补法筛选杂合细胞 显微鉴别法虽然比较可信,但实验者有时会受到仪器的限制,工作进度慢且未知其能否存活与个长 遗传互补法则可弥补以上不足。 遗传互补法的前提是获得各种遗传突变细胞株系。白化互补:不同基山叨的白化突变株出aBxAh,可互补为绿色细胞株AaBb。生长互补:甲细胞株缺外源激素A不能生长,乙细胞株需要提供外源激素B才能生长,则甲株与乙株融合,杂合细胞在不含激素A、B的选择培养基上可能生长。抗性互补筛选:假如某个细胞株具某种抗性(抗青霉素)另一个细胞株具另一种抗性(如抗卡那霉素),则它们的杂合株将可在含上述两种抗生素的培养基上再生与分裂。这种筛选方式即所谓的抗性互补筛选。代谢互补筛选:根据碘代乙酚胺能抑制细胞代谢的特点,用它处理受体原生质体,只有融合后的供体细胞质才能使细胞活性得到恢复,等等。 (3)采用细胞与分子生物学的方法鉴别杂合体 经细胞融合后长出的愈伤组织或植株,可进行染色体核型分析、染色体显带分析、同功酶分析以及更为精细的核酸分子杂交、限制性内切酶片段长度多态性(RFLP,见8.2.2.2)和随机扩增多态性DNA(RAPD)分析,以确定其是否结合了双亲本的遗传素质。(4)根据融合处理后再生长出的植株的形态特征进行鉴别质。
植物细胞原生质体制制备与融合1、原生质体常现的杂交育种由于物种间难以逾越的天然屏障而举步维艰。科学家们受细胞全能性理论及组织培养成功的启示,逐渐将眼光转向细胞融合,试图用这种崭 图3-2新的手段冲破自然界的禁钢。1937年michel率先实施植物细胞融合的试验。如何去除坚韧的细胞'接成了牛物学工作者必须解决的首要难题。196O年该领域终于出现了重大突破。由英国诺丁汉大学Cocking教授领导的小组率先利用真菌纤维素酶,成功地制备出了大量具有高度活性可再生的番茄幼根细胞原生质体,开辟了原生质体融合研究的新阶段。植物细胞原生质体是指那些已去除全部细胞壁的细胞。2、原生质体制备(1)取材与除菌 为了让制得的原生质体一般都生活力较强,再生与分生比例较高。常用的外植体包括:种子根。子叶、下胚轴、胚细胞、花粉母细胞、悬浮培养细胞和嫩叶。对外植体的除菌要因材而异。悬浮培养细胞一般无需除菌。对较脏的外植体往往要先用肥皂水清洗再以清水洗2~3次,然后浸人 70%酒精消毒后,再放进 3%次氯酸钠处理。最后用无菌水漂洗数次,并用无菌滤纸吸干。(2)酶解 现以叶片为例说明如何制备植物原生质体。①配制酶解反应液:反应液应是一种PH值在5·5~5·8的缓冲液,内合纤维素酶0.3%~3.0%以及渗透压稳定剂、细胞膜保护剂和表面活性剂等,②酶解:除菌后的叶片 撕去下表皮 切块放人反应液 不时轻摇 (条件25℃~30℃,2~4h)反应液转绿。反应液转绿是酶解成功的一项重要指标,说明已有不少原生质体游离在反应液中。经镜检确认后应及时终止反应,避免脆弱的原生质体受到更多的损害。(3) 分离 在反应液中除了大量的原生质体外,尚有一些残留的组织块和破碎的细胞。为了取得高纯度的原生质体就必需进行原生质体的分离。可选取200~400目的不锈钢网或尼龙布j叭i过滤除渣,也可采用低速离心法或比重漂浮法直接获取原生质体。(4) 洗涤刚分离得到的原生质体往往还含有酶及其他不利于原生质体培养。再生的试剂,应以新的渗透压稳定剂或原生质体培养液离心洗涤2~4次。 (5) 鉴定 只有经过鉴定确认已获得原生质体后才能进行下阶段的细胞融合工作。由于已去除全部或大部分细胞壁,此时植物细胞呈圆形。如果把它放人低渗溶液中,则很容易胀破。也。'厂月荧光增白剂染色后置紫外显微镜下观察,残留的细胞壁呈现明显荧光。通过以上观测,基本上可判别是否原生质体及其百分中 此外,尚可借助台盼蓝活细胞染色、胞质环流观察以及测定人、作用、呼吸作用等参数定量检测原生质体的活力。4、 原生质体的融合(1)化学法诱导融合 化学法诱导融合无需贵重仪器,试剂易于得到,因此一直是细胞融合的主要方法。尤其是聚乙二醇(PEG)纳合成钙高pH诱导融合法已成为化学法诱导细胞融合的主流。以下简介此方法(在无菌条件下进行):按比例混合双亲原生质体-----滴加 PEG溶液,摇匀,静置----滴加高钙高pH值溶液,摇匀,静置-----滴加原生质体培养液洗涤数次-----离心获得原生质体细胞团一筛选、再生杂合细胞。(2)物理法诱导融合 1979年Senda等发明了微电极法诱导细胞融合。1981年Zi。。mann等提出了改进的平行电极法,现简介如下:将双亲本原生质体以适当的溶液悬浮混合后,插入微电极,接通一定的交变电场。原生质体极化后顺着电场排列成紧密接触的珍珠串状。此时瞬间施以适当强度的电脉冲,则使原生质体质膜被击穿而发生融合。电激融合不使用有毒害作用的试剂,作用条件比较温和,而且基本上是同步发生融合。只要条件摸索适当,亦可获得较高的融合率。上述操作实际上是供体与受体原生质体对等融合的方法。由于双方各具几万对基因,要筛选得到符合需要且能稳定传代的杂合细胞是相当困难的。最近,有人提出以X射线、伽玛射线。纺锤体毒素或染色体浓缩剂等对供体原生质体进行前处理。轻剂量处理可造成染色体不同程度的丢失、失活、断裂和损伤,融合后实现仅有少数染色体甚至是DNA片段的转移;致死量处理后合u可能产生没再仅体万染色体w划她旋余种。利用这种价值不对称融合方法,大大提高了融合体的生存率和可利用率。经过上述融合处理后再生的细胞株将可能出现以下几种类型.2) 亲本双方的细胞核和细胞质能融洽地合为一体,发育成为完全的杂合植株。这种例子不多。3) 融合细胞由一方细胞核与另一方细胞质构成,可能发育为核质异源的植株。亲缘关系越远的物种,某个亲本的染色体被丢失的现象就越严重。 4) 融合细胞由双方胞质及一方核或再附加少量他方染色体或DNA片段构成。④原生质体融合后两个细胞核尚未融合时就过早地被新出现的细胞壁分开。以后它们各自分生长成嵌合植株。5、 杂合体的鉴别与筛选双亲本原生质体经融合处理后产生的杂合细胞,一般要经含有渗透压稳定剂的原生质体培养基培养(液体或固体),再生出细胞壁后转移到合适的培养基中。待长出愈伤组织后按常规方法诱导其长芽、生根、成苗。在此过程中可对是否杂合细胞或植株进行鉴别与筛选。 (1) 杂合细胞的显微镜鉴别 根据以下特征可以在显微镜下直接识别杂合细胞:若一方细胞大,另一方细胞小,则大。小细胞融合的就是杂合细胞;若~方细胞基本无色,另一方为绿色,则自绿色结合的细胞是杂合细胞;如果双方原生质体在特殊显微镜下或双方经不同染料着色后可见不同的特征,则可作为识别杂合的标志;发现h述杂合细胞后可借助显微操作仪在显微镜下直接取出,移置再牛培养基培养。(2)以互补法筛选杂合细胞 显微鉴别法虽然比较可信,但实验者有时会受到仪器的限制,工作进度慢且未知其能否存活与个长 遗传互补法则可弥补以上不足。 遗传互补法的前提是获得各种遗传突变细胞株系。白化互补:不同基山叨的白化突变株出aBxAh,可互补为绿色细胞株AaBb。生长互补:甲细胞株缺外源激素A不能生长,乙细胞株需要提供外源激素B才能生长,则甲株与乙株融合,杂合细胞在不含激素A、B的选择培养基上可能生长。抗性互补筛选:假如某个细胞株具某种抗性(抗青霉素)另一个细胞株具另一种抗性(如抗卡那霉素),则它们的杂合株将可在含上述两种抗生素的培养基上再生与分裂。这种筛选方式即所谓的抗性互补筛选。代谢互补筛选:根据碘代乙酚胺能抑制细胞代谢的特点,用它处理受体原生质体,只有融合后的供体细胞质才能使细胞活性得到恢复,等等。 (3)采用细胞与分子生物学的方法鉴别杂合体 经细胞融合后长出的愈伤组织或植株,可进行染色体核型分析、染色体显带分析、同功酶分析以及更为精细的核酸分子杂交、限制性内切酶片段长度多态性(RFLP,见8.2.2.2)和随机扩增多态性DNA(RAPD)分析,以确定其是否结合了双亲本的遗传素质。(4)根据融合处理后再生长出的植株的形态特征进行鉴别质。
1. 如何选用特殊细胞系培养基?培养某一类型细胞没有固定的培养条件。在MEM中培养的细胞,很可能在DMEM或M199中同样很容易生长。总之,首选MEM做粘附细胞培养、RPMI-1640做悬浮细胞培养是一个好的开始。2. 何时须更换培养基?视细胞生长密度而定, 或遵照细胞株基本数据上之更换时间,按时更换培养基即可。3. 可否使用与原先培养条件不同之培养基?不能。每一细胞株均有其特定使用且已适应之细胞培养基, 若骤然使用和原先提供之培养条件不同之培养基, 细胞大都无法立即适应, 造成细胞无法存活。4. 可否使用与原先培养条件不同之血清种类?不能。血清是细胞培养上一个极为重要的营养来源,所以血清的种类和品质对于细胞的生长会产生极大的影响。来自不同物种的血清, 在一些物质或分子的量或内容物上都有所不同,血清使用错误常会造成细胞无法存活。5. 何谓FBS, FCS, CS, HS ?FBS (fetal bovine serum) 和FCS (fetal calf serum) 是相同的意思, 两者都是指胎牛血清, FCS 乃错误的使用字眼, 请不要再使用。CS (calf serum) 则是指小牛血清。HS (horseserum) 则是指马血清。6. 培养细胞时应使用5% 或10% CO2?或根本没有影响?一般培养基中大都使用HCO3-/CO3 2-/H+ 作为pH 的缓冲系统, 而培养基中NaHCO3 的含量将决定细胞培养时应使用的CO2 浓度。当培养基中NaHCO3 含量为每公升3.7 g 时,细胞培养时应使用10% CO2;当培养基中NaHCO3 为每公升1.5 g 时, 则应使用5% CO2 培养细胞。7.Hank's 平衡盐溶液(HBS)要在空气中使用,不需要CO2培养箱。原因是什么?Hank's 平衡盐溶液(HBS)和Earle's平衡盐溶液(EBS)有什么本质的功能差别?HBS和 EBS 的主要差别在于碳酸氢钠的水平,在Eagles (2.2 g/L)中比在Hanks (0.35 g/L) 中高。碳酸氢钠需用高水平的CO2平衡,以维持溶液的PH值。Eagles液在空气水平的CO2 中,溶液会变碱,Hanks液在CO2培养箱中会变酸。如果希望在CO2培养箱中保存组织,需要用Eagles液,。如果仅仅是清洗将要在细胞培养基中储存的组织,用Hanks液就可以了。8. 细胞之接种密度为何?依照细胞株基本数据上之接种密度或稀释分盘之比例接种即可。细胞数太少或稀释的太多亦是造成细胞无法生长之一重要原因。9. 悬浮性细胞应如何继代处理?一般仅需持续加入新鲜培养基于原培养角瓶中, 稀释细胞浓度即可, 若培养液太多时, 可将培养角瓶口端稍微抬高, 直到无法容纳为止。分瓶时取出一部份含细胞之培养液至另一新的培养角瓶, 加入新鲜培养基稀释至适当浓度, 重复前述步骤即可。10. 冷冻管应如何解冻?取出冷冻管后, 须立即放入37℃水槽中快速解冻, 轻摇冷冻管使其在1 分钟内全部融化, 并注意水面不可超过冷冻管盖沿, 否则易发生污染情形。另冷冻管由液氮桶中取出解冻时, 必须注意安全, 预防冷冻管之爆裂。11. 细胞冷冻管解冻培养时, 是否应马上去除DMSO?除少数特别注明对DMSO 敏感之细胞外, 绝大部分细胞株(包括悬浮性细胞), 在解冻之后, 应直接放入含有10-15 ml新鲜培养基之培养角瓶中, 待隔天再置换新鲜培养基以去除DMSO 即可, 如此可避免大部分解冻后细胞无法生长或贴附之问题。12. 附着性细胞继代时所使用之trypsin-EDTA 浓度?应如何处理?一般使用之trypsin-EDTA 浓度为0.05% trypsin-0.53 mM EDTA Na4。第一次开瓶后应立即少量分装于无菌试管中, 保存于-20 ℃,避免反复冷冻解冻造成trypsin 之活性降低, 并可减少污染之机会。13. 欲将一般动物细胞离心下来,其离心速率应为多少转速?欲回收动物细胞, 其离心速率一般为300xg (约1 000 rpm),5-10 分钟, 过高之转速, 将造成细胞死亡。14. 细胞冷冻培养基之成份为何?动物细胞冷冻保存时最常使用的冷冻培养基是含5-10% DMSO (dimethyl sulfoxide) 和90-95% 原来细胞生长用之新鲜培养基均匀混合之。注意:由于DMSO 稀释时会放出大量热能, 故不可将DMSO 直接加入细胞液中, 必须使用前先行配制完成。15. DMSO 之等级和无菌过滤之方式为何?冷冻保存使用之DMSO 等级, 必须为Tissue culture grade之DMSO (如Sigma D2650), 其本身即为无菌状况, 第一次开瓶后应立即少量分装于无菌试管中, 保存于4℃, 避免反复冷冻解冻造成DMSO 之裂解而释出有害物质, 并可减少污染之机会。若要过滤DMSO, 则须使用耐DMSO 之Nylon 材质滤膜。16. 冷冻保存细胞之方法?冷冻保存方法一: 冷冻管置于4℃30~60 分钟→ (-20℃ 30 分钟*) → -80℃16~18 小时(或隔夜) → 液氮槽vaporphase 长期储存。冷冻保存方法二: 冷冻管置于已设定程序之可程序降温机中每分钟降1-3 ℃至-80℃以下, 再放入液氮槽vapor phase长期储存。*-20℃不可超过1 小时, 以防止冰晶过大,造成细胞大量死亡,亦可跳过此步骤直接放入-80℃冰箱中,惟存活率稍微 降低一些。17. 细胞欲冷冻保存时, 细胞冷冻管内应有多少细胞浓度?冷冻管内细胞数目一般为1x106 cells/ml vial, 融合瘤细胞则以5x106 cells/ml vial 为宜。
单细胞凝胶电泳步骤:1. 分离制备单细胞悬液:(1) 体外培养的细胞株:用胰酶消化,最后用PBS悬浮吹打成单细胞悬液,细胞要计数,具体的量我前边已经说过。(2) 体内脏器细胞:处死动物,取出脏器,于Hanks’液中制备成单个细胞悬液。2. 胶板制备:(1) 取100μl于45℃水浴中保温的0.5%NMA,铺于磨沙载玻片上,形成底胶。盖玻片推匀,不能有气泡,4度凝固5至8分钟。(2) 水平取下盖片,取100μl于37℃水浴中保温的0.5%LMA与20μl细胞悬液(约400个细胞)混匀,立即铺片,加上盖玻片,4度凝固5至8分钟。3. 细胞裂解与电泳:(1) 将制备好的胶板去掉盖玻片后,浸于4℃预冷的细胞裂解液中,在4℃下裂解2.5到3小时。(2) 取出胶板,用双蒸水浸没漂洗后放入电泳槽中,浸泡在4℃预冷的电泳液中解旋20分钟。(3) 玻片水平放置阳极端附近,4℃电泳20到25分钟(25V,300mA)。可在电泳槽周围加冰块以保持低温。4. 中和与染色:(1) 电泳结束,将胶板浸泡于中和液中,每次10分钟,共中和3次,每次要更换中和液。最后晾干。(2) 取出胶板,置于染色缸中,在2μg/ml的EB染色液中,暗处染色5到10分钟。(3) 蒸馏水漂洗2次,每次5分钟。稍晾干,滤纸吸去多余水分,尽快在荧光显微镜下观察。从胶板制备开始到最后都应该在暗光下操作。先讲这些,你们可以先开始摸索,真正做了才能发现具体的问题,到时我们再探讨。
[font=宋体]慢病毒构建稳转细胞系的原理主要是利用慢病毒载体将外源基因导入宿主细胞,并实现外源基因的稳定表达。具体来说,构建稳转细胞系的核心是将慢病毒矢量载体导入宿主细胞中,慢病毒载体通常包含病毒的复制和包装组件,以及外源基因的表达调控序列。当慢病毒载体被导入宿主细胞后,它可以利用细胞的复制和转录机制将外源基因插入宿主细胞的染色体中,从而实现外源基因的稳定表达。[/font][font=宋体] [/font][font=宋体][b]构建稳定的慢病毒转染细胞系是在细胞中稳定表达外源基因的一种有效方法。下面是一般慢病毒构建稳定转染细胞系的步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、选择慢病毒载体: 选择适当的慢病毒载体,通常是一个包含[/font][font=Calibri]LTR[/font][font=宋体]、包装信号、引导[/font][font=Calibri]RNA[/font][font=宋体]序列和多功能质粒载体的质粒。这个载体应该包含要表达的外源基因。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、转染慢病毒包装细胞: 使用慢病毒包装细胞系,例如[/font][font=Calibri]293T[/font][font=宋体]或其他适合的细胞系。这些细胞通常被选择因为它们能够支持慢病毒复制和包装。将慢病毒载体与包装蛋白的表达质粒一同转染进这些细胞中。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、病毒产生和收集: 慢病毒包装细胞会开始产生慢病毒颗粒,这些颗粒包含了慢病毒载体和外源基因。培养一定时间后,收集细胞培养上清液,这是富含病毒的液体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、测定病毒滴度: 对采集的上清液进行病毒滴度的测定,通常可以通过转染一定数量的目标细胞,然后测定这些细胞的感染率来确定病毒的滴度。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、转染目标细胞: 将上一步获得的病毒用于转染目标细胞。这些目标细胞可以是要建立稳定转染细胞系的细胞。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、筛选稳定细胞系: 添加适当的筛选物质,例如抗生素,以选择表达了外源基因的细胞。这可以通过在培养基中添加抗生素,使得只有表达了外源基因的细胞能够存活下来。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7[/font][font=宋体]、单克隆分离: 对稳定表达细胞群进行单克隆分离,以确保每个克隆都来自单一细胞。这有助于保持表达的一致性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8[/font][font=宋体]、验证表达: 对所得的单克隆细胞系进行验证,确认外源基因的表达水平和稳定性。这可以通过[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]、[/font][font=Calibri]Western blotting[/font][font=宋体]等分子生物学技术来实现。[/font][/font][font=宋体] [/font][font=宋体]通过这些步骤,可以建立一个稳定表达外源基因的慢病毒转染细胞系,为后续的实验和研究提供了有力的工具。这种方法常用于基因功能研究、药物筛选和基因治疗等领域。[/font][font=宋体] [/font][font=宋体][b]慢病毒构建稳转细胞系的优点:[/b][/font][font=宋体] [/font][font=宋体]与常用的转染方法相比,慢病毒构建稳转细胞系有以下几个优点:[/font][font=宋体] [/font][font=宋体]①高效性:慢病毒能够将外源基因整合到宿主细胞基因组中,实现稳定的外源基因表达。[/font][font=宋体] [/font][font=宋体]②特异性:由于慢病毒的感染和复制比较特异,只会影响一定类型的细胞,因此可以实现对具体细胞的选择性转染。[/font][font=宋体] [/font][font=宋体]③安全性:慢病毒的基因转移速度较缓慢,对宿主细胞和人体的损伤较小,因此具有较高的安全性。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/stable-cell-line-development-service][b]稳转细胞株构建服务[/b][/url],包含过表达细胞系构建服务和[/font][font=Calibri]CHO[/font][font=宋体]稳定细胞株开发服务,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/stable-cell-line-development-service[/font][/font]
铂类药物是一类重要的肿瘤化疗药物,在临床中得到广泛的应用,成为治疗包括肺癌、胃癌、结肠癌、卵巢癌、睾丸癌等常见恶性肿瘤的一线药物。然而,目前临床使用的铂类抗癌药物对肿瘤细胞缺乏选择性,在杀死肿瘤细胞的同时,对正常细胞也有较大伤害,导致明显的临床毒副作用。同时,肿瘤病人容易对铂类药物产生耐药性,导致化疗失败。 针对铂类药物存在的以上两大问题,中国科学院昆明植物研究所李艳研究组与昆明贵金属研究所刘伟平研究组合作,发现mixed-NH3/cyclopentamine和不对称的3-X-1,1-cyclobutanedicarboxylato与Pt(II)配合物对肿瘤细胞显示出明显的选择性,能选择性诱导肿瘤细胞的凋亡,而对正常细胞影响很小,同时对顺铂耐受的非小细胞肺癌和卵巢癌细胞株有较高的杀伤活性,显示出重要的研究开发前景。 近日,这类化合物的结构和用途已经获得国家发明专利授权(ZL20101027465.2)。
关键词:单细胞凝胶电泳目的:为便于各室单细胞凝胶电泳试验结果的可比性背景知识:略原理:在细胞核中,DNA是环状附着在核基质上,细胞裂解过程中,核基质被溶解、抽提,DNA的结构则未发生变化。如果DNA链上存在缺口,则使DNA超螺旋变的松弛,DNA环向外展,同时由于暴露了阴电荷,在电场力的作用下,松动的DNA环向阳极迁移,但是由于这种松动的DNA环一端仍附着于核DNA,其迁移距离受到限制,因此尾长并不总是真实反映链缺口的多少。实际应当依靠尾长与尾部的荧光强度同时来进行分析。主体内容:操作步骤见下文主要参考文献:略操作步骤:1. 分离制备单细胞悬液:(1) 体外培养的细胞株:用胰酶消化,吹打成单细胞悬液(2) 体内脏器细胞:处死动物,取出脏器,于Hanks’液中制备成单个细胞悬液。2. 胶板制备:(1) 取20~50μl于56℃水浴中保温的0.5%普通熔点琼脂糖,铺于磨沙载玻片上,形成底胶。(2) 取100~150μl 0.5%普通熔点琼脂糖加在底胶上,再于其上加盖玻片,4℃冷凝10分钟。(3) 取下盖片,取50~100μl于37℃水浴中保温的1.0%的低熔点琼脂糖与50~100μl细胞悬液(105个细胞/ml)混匀,立即铺片,加上盖玻片,4℃冷凝10分钟。(4) 去掉盖玻片,取70~100μl于37℃水浴中保温的0.5%的低熔点琼脂糖铺片,加盖玻片,4℃冷凝。3. 细胞裂解与电泳:(1) 将制备好的胶板去掉盖玻片后,浸于4℃预冷的细胞裂解液中,4℃裂解1小时。(2) 取出胶板,放入电泳槽中,浸泡在电泳液中解旋20分钟。(3) 4℃电泳20分钟(25V,300mA)。4. 中和与染色:(1) 电泳结束,将胶板浸泡于中和液中,每次15分钟,共中和两次,注意更换中和液。(2) 取出胶板,置于染色架上,滴加5μg/ml的PI,暗处染色20分钟。(3) 蒸馏水脱色15分钟。5. 镜检和分析:(1) 在荧光显微镜下观察,绿光激发吸收滤片590nm。必要时照相记录。(2) 记数观察的细胞,记录彗星细胞出现的频率,用目镜测微尺测头长与全长,计算核DNA迁移距离。* * * * *使用两层凝胶法,经裂解、DNA解旋、电泳和中和得到湿琼脂糖凝胶片。将湿琼脂糖凝胶片置于冰冷无水乙醇中脱水10分钟,后置于空气中自发干燥。每人制备2张琼脂糖凝胶片。全部操作在采血后8小时内完成,操作过程中注意避光。脱水干燥的琼脂糖凝胶片装于含有干燥剂的载片盒中运回实验室。使用50μl 30μM的溴乙锭溶液染色、照相。使用单细胞凝胶电泳软件分析所有照片,每人随机测量100个以上细胞的尾长和olive尾矩,以尾长和olive尾矩的算术均数代表个体DNA损伤情况。
美国典型物保藏中心,又称美国模式典型物收集中心(ATCC),ATCC是位于马里兰洲洛克菲勒的一家私营的,非赢利性组织。目前它可以提供以下物品:细胞系(3000种);细菌和噬菌体(15000种);动植物病毒(2500种);原生动物 1200种以及重组物品等。北京时代新光TEl: 010-87875910 010-87875015 13371681771 E-mail: zfyu@ bio-life.cnweb: www.bio-life.cn
很多培养细胞的实验室对无菌的要求都有细微不同,关于紫外灯的照射时间大体上可以分为两派,一派开始前照射30分钟,一派是只要没有实验紫外灯就一直开着,直到下次实验开始前关闭,这两种哪种方式好呢?当然不能一概而论,当然从节能上看是第一种好,但是第一种能不能达到好的杀菌效果?那么一般来说是没有问题的,但是如果对于人数比较多的实验室,建议采用第二种方法,当然紫外不是避免污染的唯一方法,还要配合酒精擦拭和酒精灯消毒等。下面我们来看一般的消毒方法。实验进行前,超净台以紫外灯照射 30 分钟灭菌,以 75 % 酒精擦拭无菌操作台面,并开启超净工作台吹风5分钟以上分钟后,开始实验操作。每次操作只处理一株细胞株,以避免失误混淆或细胞间污染。实验完毕后,将实验物品带出工作台,以 75 % 酒精擦拭无菌操作台。无菌操作工作区域应保持清洁及宽敞,必要物品,例如支架、吸管等公用物品可以暂时放置,其它个人实验用品用完应立即拿出。实验用品以 75% 酒精擦拭后才带入无菌操作台内。实验操作应在中央无菌区域,一般勿在边缘区域操作。小心取用无菌之实验物品,避免造成污染。勿碰触吸管尖头部或是容器瓶口,亦不要在打开之容器正上方操作实验。容器打开后,以手夹住瓶盖并握住瓶身,倾斜约 45° 角取用,尽量勿将瓶盖盖口朝上放置桌面。注:由于大多数实验室酒精不是先用现配,由于酒精的挥发性较强,一般建议配置80%的酒精备用。
液氮槽vaporphase长期储存。-20℃不可超过1小时,以防止胞内冰晶过大,造成细胞大量死亡,亦可跳过此步骤直接放入-80℃冰箱中,惟存活率稍微降低一些。(2)程序降温:利用已设定程序的等速降温机以-1~-3℃/分钟之速度由室温降至(-80℃以下)-120℃,再放在液氮槽vaporphase长期储存。适用于悬浮型细胞与hybridoma之保存。3、步骤:(1)冷冻前24-48小时更换半量或全量培养基,使细胞处于指数生长期。(2)配制冷冻保存溶液(使用前配制):另取一离心管,加入培养基、血清,逐滴加入二甲基亚砜(DMSO)至20%浓度,即制成双倍的冻存液,置于室温下待用。(3)离心收集培养之细胞,用加血清的培养基重悬起细胞,取少量细胞悬浮液(约0.1ml)计数细胞浓度及冻前存活率。(4)取与细胞悬液等量的冻存液,缓慢逐滴加入细胞悬液,并晃动试管,制成细胞冻存悬液(DMSO最后浓度为5~10%),使细胞浓度为1~5×106cells/ml,混合均匀,分装于已标示完全之冷冻保存管中,1~2ml/vial,并取少量细胞悬浮液作污染检测。严密封口后,注明细胞名称、代数、日期。然后进行冻存。4、注意事项:(1)欲冷冻保存之细胞应在生长良好(logphase)且存活率高之状态,约为80~90%致密度。冷冻前检测细胞是否仍保有其特有性质,例如hybridoma应在冷冻保存前一至二日测试是否有抗体之产生。(2)细胞在液氮中可长期冻存无限时间,而不会影响细胞活力;在-70度可保存数月。(3)注意冷冻保护剂之品质。DMSO应为试剂级等级,无菌且无色(以0.22micron FGLP Telflon过滤或是直接购买无菌产品,如Sigma D-2650),以5~10ml小体积分装,4℃避光保存,勿作多次解冻。Glycerol亦应为试剂级等级,以高压蒸汽灭菌后避光保存。在开启后一年内使用,因长期储存后对细胞会有毒性。本方法中先制备双倍冻存液,可避免DMSO直接加入时释放的热量对细胞的损伤。缓慢逐滴加入细胞悬液是使细胞逐步适应高渗,可降低细胞受损。DMSO可能引起部分白血病细胞株的分化,可换用10%甘油冻存。(4)冷冻保存之细胞浓度:①normal human fibroblast:1~3×106cells/ml②hybridoma:1~3×106cells/ml,细胞浓度不要太高,某些hybridoma会因冷冻浓度太高而在解冻24小时后死去。③adherent tumor lines:5~7×106,依细胞种类而异。Adenocarcinoma解冻后须较高之浓度,而HeLa只需1~3×106cells/ml④other suspensions:5~10×106cells/ml,human lymphocyte须至少5×106cells/ml。(5)冷冻保护剂浓度为5或10%DMSO,若是不确定细胞之冷冻条件,在做冷冻保存之同时,亦应作一个backup culture,以防止冷冻失败。(6)冻存可用10%~90%的血清,一般高浓度血清有助于维护细胞活力,此处介绍20%终浓度有利于细胞悬浮而少沉积(4度时),复苏存活率在80%~90%以上,对原代培养细胞,以90%血清冻存更为有效。二、冷冻细胞活化1、冷冻细胞之活化原则为快速解冻,以避免冰晶重新结晶而对细胞造成伤害,导致细胞之死亡。2、细胞活化后,约需数日,或继代一至二代,其细胞生长或特性表现才会恢复正常(例如产生单株抗体或是其它蛋白质)。3、材料37℃恒温水槽、新鲜培养基、无菌吸管/离心管/培养瓶、液氮或干冰容器4、步骤:(1)操作人员应戴防护面罩及手套,防止冷冻管可能爆裂之伤害。(2)自液氮或干冰容器中取出冷冻管,检查盖子是否旋紧,由于热胀冷缩过程,此时盖子易松掉。(3)将新鲜培养基置于37℃水槽中回温,回温后喷以70%酒精并擦拭之,移入无菌操作台内。(4)取出冷冻管,立即放入37℃水槽中快速解冻,轻摇冷冻管使其在1分钟内全部融化,以70%酒精擦拭保存管外部,移入无菌操作台内。(5)取出解冻之细胞悬浮液,缓缓加入有培养基之培养容器内(稀释比例为1:10~1:15),混合均匀,放入CO2培养箱培养。取0.1ml解冻细胞悬浮液作存活测试。(6)解冻后是否立即去除冷冻保护剂(例如DMSO或glycerol),依细胞种类而异,一般而言,大都不需要立即去除冷冻保护剂。惟若要立即去除,则将解冻之细胞悬浮液加入含有5-10ml培养基之离心管内,离心1000rpm,5分钟,移去上清液,加入新鲜培养基,混合均匀,放入CO2培养箱培养。(7)若不需立即去除冷冻保存剂,则在解冻培养后隔日更换培养基。三、细胞计数与存活测试1、原理:(1)计算细胞数目可用血球计数盘或是Coultercounter粒子计数器自动计数。(2)血球计数盘一般有二个chambers,每个chamber中细刻9个1mm2大正方形,其中4个角落之正方形再细刻16个小格,深度均为0.1mm。当chamber上方盖上盖玻片后,每个大正方形之体积为1mm2×0.1mm=1.0x10-4ml。使用时,计数每个大正方形内之细胞数目,乘以稀释倍数,再乘以104,即为每ml中之细胞数目。(3)存活测试之步骤为dyeexclusion,利用染料会渗入死细胞中而呈色,而活细胞因细胞膜完整,染料无法渗入而不会呈色。一般使用蓝色之trypan blue染料,如果细胞不易吸收trypan blue,则用红色之Erythrosin bluish。计算细胞活率:活细胞数/(活细胞数+死细胞数)×100%。计数应在台盼兰染色后数分钟内完成,随时间延长,部分活细胞也开始摄取染料;因为台盼兰对蛋白质有很强的亲和力,用不含血清的稀释液,可以使染色计数更为准确。2、材料:0.4%w/v trypan blue(GibcoBRL15250-061);Erythosin bluish stain;取0.1gram Erythrosin bluish(SigmaE-9259)及0.05gram preservative methyl paraben(SigmaH-3647)溶于100mlCa++/Mg++freesaline;血球计数盘及盖玻片(Hemocytometerandcoverslip);计数器(counter);低倍倒立显微镜;粒子计数器(Coultercounter,CoulterElectronics)。白细胞稀释液(4%乙酸溶液)。3、步骤:(1)取50μl细胞悬浮液与50μl trypan blue(orErythrosinbluish)等体积混合均匀于1.5ml小离心管中。(2)取少许混合液(约15μl)自血球计数盘chamber上方凹槽加入,盖上盖玻片,于100倍倒立显微镜下观察,活细胞不染色,死细胞则为蓝色(或红色-Erythrosin bluish)。(3)计数四个大方格之细胞总数,再除4,乘以稀释倍数(至少乘以2,因与trypanblue等体积混合),最后乘以104,即为每ml中细胞悬浮液之细胞数。若细胞位于线上,只计上线与右线之细胞(或计下线与左线之细胞)。注:4大格细胞总数×稀释倍数×104/4=细胞数/ml;每一大格的体积=0.1cm×0.1cm×0.01cm=10-4ml计数板计数时,最适浓度为5~10×105细胞/ml,此范围外计数误差偏大。高浓度细胞悬液,可取出部分作稀释或连续稀释后计数。5、范例:T75 monolayer culture制成10ml细胞悬浮液,取0.1ml溶液与0.1ml trypan blue混合均匀于试管中,取少许混合液加入血球计数盘,计数四大方格内之细胞数目。活细胞数/方格:55,62,49,59;死细胞数/方格:5,3,4,6;细胞总数=243平均细胞数/方格=60.75;稀释倍数=2;细胞数/ml:60.75×104×2(稀释倍数)=1.22×106;细胞数/flask(10ml):1.22×106×10ml=12.2×106存活率:225/243﹦92.6%
液氮?-70℃冰箱?-20℃冰箱?2-8℃冰箱?有无做过验证保存期限?
【背景】CIK是“Cytokine-Induced Killer Cells”的缩写,中文全称为“细胞因子诱导的杀伤细胞”。 CIK是单个核细胞在CD3单抗和多种细胞因子(包括IFN-g, IL-2等)的作用下培养获得的一群以CD3+CD56+细胞为主要效应细胞的异质细胞群, 其既具有T淋巴细胞强大的抗肿瘤活性,又具有NK细胞(自然杀伤细胞)的非MHC(主要组织相容性抗原)限制性肿瘤杀伤能力。CIK细胞具有杀瘤活性高、杀瘤谱广,对正常组织毒性低,体外可高度扩增等特点,是目前临床上广泛使用的过继性免疫治疗细胞。【培养原理】CIK培养用细胞因子和抗体:nCD3激发型单抗:T细胞活化的第一信号来自于T细胞表面的受体,即T细胞抗原受体(T cell antigen receptor, TCR)与APC提呈的抗原的特异性结合,也就是T细胞对抗原的特异性识别。TCR是由2条不同肽链构成的异二聚体,在T细胞表面,其与CD3分子通过非共价键结合,形成TCR/CD3复合体。TCR识别特异性抗原后会引起CD3和T细胞表面的辅助受体CD4或CD8分子的胞浆尾部聚集,进而激活与胞浆尾部相连的酪氨酸激酶(Lck, Fyn和ZAP-70等),促使CD3分子胞浆区的免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif, ITAM)中的酪氨酸(Y)磷酸化。磷酸化的酪氨酸(pY)进一步磷酸化下游含酪氨酸的蛋白,从而引起激酶活化的级联反应(磷脂酰肌醇途径或MAP激酶途径等),最终通过激活转录因子,使其进入细胞核内,结合于调控T细胞增殖和活化的靶基因(如IL-2和IFN-g等),引起基因的表达和转录,T细胞因而由静止状态转为增殖和活化状态。由上可见,CD3分子在T细胞活化信号的转导中起着极其关键的作用。CD3激发型单抗与T细胞表面CD3分子特异性结合后,可引起CD3分子胞浆区ITAM基序中酪氨酸的磷酸化,进而导致T细胞增殖和活化的下游信号的激活,从而使T细胞增殖和活化。也就是说,CD3激发型单抗能够模拟抗原与TCR/CD3复合物的识别和激活过程,从而引起T细胞的增殖与活化,因此是CIK细胞培养中不可或缺的刺激因素。此外,CD3激发型单抗在选用时一定要注意克隆号。研究表明,仅克隆号为OKT-3的CD3激发型单抗可以刺激所有人的T细胞的增殖,而其它克隆号的CD3激发型单抗仅能刺激一部分人的T细胞。因此,在进行CIK培养时,最好选用OKT-3克隆,以保证每个患者的T细胞均能被激活。nIL-2 (白细胞介素-2)IL-2最初发现时被称为T细胞生长因子(T cell growth factor, TCGF),是引起T细胞增殖最重要的细胞因子。IL-2既是自分泌细胞因子,也是旁分泌细胞因子,其通过与T细胞表面的IL-2受体(IL-2R)的特异性结合而促使T细胞活化,并进入细胞分裂状态。此外,IL-2还可刺激NK细胞的生长并增强其杀伤能力。因此CIK细胞培养中须添加IL-2,以促进T细胞的增殖与活化。nIFN-g (干扰素-g)IFN-g 具有上调外周血淋巴细胞表面IL-2R表达的作用,因此会增强T细胞对IL-2促增殖反应的敏感度和强度。在诱导CIK细胞形成的过程中加入IFN- g ,可降低IL-2的用量。研究发现,IFN-g加入的顺序与CIK的细胞毒活性密切相关。先加入IFN- g,培养24后再加入IL-2,可明显提高CIK的细胞毒活性。nIL-1a(白细胞介素-1a)IL-1a也可以介导外周血淋巴细胞表面上调表达IL-2R。当IL-1a与IFN-g和激发型CD3单抗合用时,可以明显提高CIK 的细胞毒作用。【细胞制备】1.外周血单个核细胞的采集1.1用血细胞分离机采集患者自身的外周血单个核细胞50-100mL;1.2淋巴细胞分离液密度梯度离心法进一步纯化单个核细胞(PBMC);1.3无血清培养液洗涤2次,获得纯度在90%以上的PBMC。2.CIK细胞的培养及鉴定2.1将PBMC按1-2 x 106/ml的浓度悬浮于无血清培养液中,加入1,000 U/ml 的重组人IFN-g,37oC,5%CO2培养箱中培养;2.224h 后加入50ng/ml 的CD3 单克隆抗体和300 U/ml 的重组人IL-2,刺激CIK 细胞的生长和增殖;注:此时也可同时加入100 U/ml的重组人IL-1a。2.3每3天半量换液或扩瓶一次,并补加重组人IL-2 300 U/ml;2.4在培养的第14d,收获CIK细胞。2.5CIK细胞质控:2.9.1台盼蓝染色检测:活细胞应在80%以上;2.9.2流式细胞仪检测细胞表面CD3、CD8、CD56等分子的表达:CD3+CD56+细胞的比例应在20%以上。2.9.3细胞杀伤实验:以CIK细胞为效应细胞,以肿瘤细胞(可为原代肿瘤细胞或肿瘤细胞株)为靶细胞,将效应细胞与靶细胞按10 : 1(数目比) 的比例加入96 孔U 型板中,每孔含靶细胞1 x 104个,终体积为200 ml,设3个复孔。培养4h,然后取培养上清,用乳酸脱氢酶(LDH) 试剂盒检测效应细胞对靶细胞的杀伤率。2.9.4收获细胞前,取少量培养物进行细菌、真菌培养,并检测支原体、衣原体,及内毒素(标准:病原学检测阴性,内毒素5 Eu)。【步骤简图】http://img.dxycdn.com/trademd/upload/userfiles/image/2013/04/B1366873006_small.jpg 【推荐试剂】http://img.dxycdn.com/trademd/upload/userfiles/image/2013/04/B1366873008_small.jpg 注:Animal Free意为无动物成分。无动物成分的重组细胞因子在生产过程中不会有任何动物源性物质,尤其是牛蛋白的混入,使得最终获得的重组人蛋白中不含任何动物成分。这样可避免动物病原体(如疯牛病,克雅氏病等)的污染及外源蛋白引起的机体异种排斥和过敏反应,因此细胞治疗的体外细胞培养过程中最好使用无动物成分的重组细胞因子。【其它相关试剂】 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/04/B1366873009_small.jpg【参考文献】 Li R, Wang C, et al. Autologous cytokine-induced killer cell immunotherapy in lung cancer: a phase II clinical study. Cancer Immunol Immunother. 2012; 61:2125-2133
细胞冻存是细胞培养的关键步骤,一般推荐的冻存液比例为:1:3:6(或1:2:7) 配冻存液1份DMSO3份血清和6份培养基(养细胞时用什么培养基冻存时就用什么培养基)。取生长状态良好的细胞进行冻存处理,小编实验室有一个秘密配方,就是10%DMSO和90%的纯血清,这个冻存液有一些奢侈,但是对于一些比较脆弱的细胞,或者是一些冻存条件比较差的实验室(例如没有-80冰箱)有非常良好的效果。除此之外和大家分享六大注意事项1、错误的时机:细胞状态不好(长的太过了,培养液已经很黄;细胞可疑污染;细胞已经开始凋亡或崩解;连续培养超过二个月,细胞性状已有改变改变)。解决:最佳时机:细胞增殖旺盛,情况稳定,试验效果良好,复苏后两周内。2、细胞太少:冻存时细胞浓度低于1-5×1000,000/ml。(复苏很难成功)。解决:离心后调整细胞浓度。(不要重新洗细胞)。3、盖子不紧:冻存管的盖子一定要拧紧,否则复苏水浴时会渗水,造成污染。解决:选择原配的管子和盖子(不同牌子/型号的颜色会有差别)。4、单薄的冻存盒:放在-80度的冻存盒,壁太薄,细胞在被迅速降温。解决:选择厚壁泡沫塑料盒,或塞入大量干棉花。(冻存的原则:缓降!)。5、-80度太久:放在-80度冰箱的时间超过半年。(冰箱的温度难以恒定:开门/关门,电压不稳等)解决:尽快转入液氮。6、液氮不足:液面不能漫过所有细胞。解决:定期测量液氮储备,保证细胞全部浸在液面下。
细胞冻存是细胞培养的关键步骤,一般推荐的冻存液比例为:1:3:6(或1:2:7) 配冻存液1份DMSO3份血清和6份培养基(养细胞时用什么培养基冻存时就用什么培养基)。取生长状态良好的细胞进行冻存处理,小编实验室有一个秘密配方,就是10%DMSO和90%的纯血清,这个冻存液有一些奢侈,但是对于一些比较脆弱的细胞,或者是一些冻存条件比较差的实验室(例如没有-80冰箱)有非常良好的效果。除此之外和大家分享六大注意事项1、错误的时机:细胞状态不好(长的太过了,培养液已经很黄;细胞可疑污染;细胞已经开始凋亡或崩解;连续培养超过二个月,细胞性状已有改变改变)。解决:最佳时机:细胞增殖旺盛,情况稳定,试验效果良好,复苏后两周内。2、细胞太少:冻存时细胞浓度低于1-5×1000,000/ml。(复苏很难成功)。解决:离心后调整细胞浓度。(不要重新洗细胞)。3、盖子不紧:冻存管的盖子一定要拧紧,否则复苏水浴时会渗水,造成污染。解决:选择原配的管子和盖子(不同牌子/型号的颜色会有差别)。4、单薄的冻存盒:放在-80度的冻存盒,壁太薄,细胞在被迅速降温。解决:选择厚壁泡沫塑料盒,或塞入大量干棉花。(冻存的原则:缓降!)。5、-80度太久:放在-80度冰箱的时间超过半年。(冰箱的温度难以恒定:开门/关门,电压不稳等)解决:尽快转入液氮。6、液氮不足:液面不能漫过所有细胞。解决:定期测量液氮储备,保证细胞全部浸在液面下。
如题,哪位大神知道1%猪红细胞的配制方法?跟1%鸡红细胞配制方法一样吗?本中心扩项急用,跪求各位老师指点一二[img]https://simg.instrument.com.cn/bbs/images/brow/em63.gif[/img]
现在国家药典对宿主细胞DNA残留要求 要小于100P克,儿童用疫苗更是要求严格限制在几十P克。现在国内对宿主细胞DNA残留去除技术似乎成为一个企业存亡的关键点啦。很多企业用凝胶4FF或者6FF柱子 ,单是都不能达到药典要求。个人认为:先通过离子交换柱,然后再通过凝胶柱可以去除大部分宿主细胞DNA。请从事这方面的同行讨论一下。
请问下, 我现在想用离子交换柱来将细胞中复杂多肽样品,简化为多个样品进行分析,怎么选择柱子,洗脱液等,麻烦指教下
[font=宋体][font=Calibri][url=https://cn.sinobiological.com/category/car-t-cell-immunotherapy][b]CAR-T[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/category/car-t-cell-immunotherapy][b]细胞疗法[/b][/url]([/font][font=Calibri]Chimeric Antigen Receptor T-Cell Therapy[/font][font=宋体]),全称为嵌合抗原受体[/font][font=Calibri]T[/font][font=宋体]细胞疗法,是近年来发展非常迅速的一种细胞治疗技术。与传统药物不同,[/font][font=Calibri]CAR-T[/font][font=宋体]疗法是一种“活的”、定制的细胞治疗方法,利用患者自身的免疫[/font][font=Calibri]T[/font][font=宋体]细胞来攻击癌细胞。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]CAR-T[/font][font=宋体]疗法的整个流程大致可以分为五步:[/font][/font][font=宋体][font=宋体]①从患者(或同种异体的供体)采集外周血并分离[/font][font=Calibri]T[/font][font=宋体]细胞;[/font][/font][font=宋体][font=宋体]②利用基因工程技术转导[/font][font=Calibri]T[/font][font=宋体]细胞,给[/font][font=Calibri]T[/font][font=宋体]细胞装上一个“[/font][font=Calibri]GPS[/font][font=宋体]导航系统”,即[/font][font=Calibri]CAR[/font][font=宋体],这样[/font][font=Calibri]T[/font][font=宋体]细胞就“变身”为[/font][font=Calibri]CAR-T[/font][font=宋体]细胞;[/font][/font][font=宋体][font=宋体]③将[/font][font=Calibri]CAR-T[/font][font=宋体]细胞进行体外培养和扩增,使其达到符合治疗要求的细胞数量;[/font][/font][font=宋体][font=宋体]④对[/font][font=Calibri]CAR-T[/font][font=宋体]细胞进行质量检测;[/font][/font][font=宋体][font=宋体]⑤把制备好的高质量[/font][font=Calibri]CAR-T[/font][font=宋体]细胞回输到患者体内,靶向杀死癌细胞,同时避免对正常组织的损伤。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]针对[/font][font=Calibri]CAR-T[/font][font=宋体]细胞疗法,义翘神州可提供从[/font][font=Calibri]CAR[/font][font=宋体]开发、[/font][font=Calibri]T[/font][font=宋体]细胞激活、慢病毒包装、[/font][font=Calibri]CAR-T[/font][font=宋体]细胞扩增到[/font][font=Calibri]CAR-T[/font][font=宋体]细胞质量控制的完整解决方案,全面支持药企进行[/font][font=Calibri]CAR-T[/font][font=宋体]研究。[/font][/font][font=宋体][font=宋体]下面是对[/font][font=Calibri]CAR[/font][font=宋体]开发具体介绍:[/font][/font][font=宋体] [/font][font=宋体][font=宋体]一、[/font][font=Calibri]CAR[/font][font=宋体]开发[/font][/font][font=宋体][font=Calibri]CAR[/font][font=宋体]是[/font][font=Calibri]CAR-T[/font][font=宋体]的核心部件,如何获得特异性识别肿瘤抗原的[/font][font=Calibri]CAR[/font][font=宋体]是开发的关键。义翘神州拥有噬菌体抗体库、杂交瘤、流式单[/font][font=Calibri]B[/font][font=宋体]细胞、[/font][font=Calibri]BeaconB[/font][font=宋体]细胞筛选的四大抗体开发技术平台,同时我们提供多种高品质[/font][font=Calibri]CAR-T[/font][font=宋体]靶点蛋白和专业的[/font][font=Calibri]SPR/BLI[/font][font=宋体]亲和力检测服务满足[/font][font=Calibri]scFv[/font][font=宋体]筛选、[/font][font=Calibri]CAR[/font][font=宋体]亲和力测定及后续步骤的需求,加速研究进程。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、[/font][font=Calibri]CAR[/font][font=宋体]候选分子开发:[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州可提供多样化的[/font][font=Calibri]scFv[/font][font=宋体]开发平台,覆盖从抗原设计与制备、动物免疫到获得[/font][font=Calibri]scFv[/font][font=宋体]分子的全部流程,帮助药企客户获得自主知识产权的[/font][font=Calibri]scFv[/font][font=宋体]序列。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]①[/font][url=https://cn.sinobiological.com/services/platform/phage-display][b][font=Calibri]scFv[/font][font=宋体]抗体库构建平台[/font][/b][/url][/font][font=宋体] [/font][font=宋体][font=宋体]直接获得[/font][font=Calibri]scFv[/font][font=宋体]序列[/font][/font][font=宋体][font=宋体]高通量筛选[/font][font=Calibri]scFv[/font][font=宋体]分子[/font][/font][font=宋体] [/font][font=宋体][font=宋体]②[/font][url=https://cn.sinobiological.com/services/platform/beacon-b-cell-screening][b][font=Calibri]Beacon[/font][font=宋体]单[/font][font=Calibri]B[/font][font=宋体]细胞筛选平台[/font][/b][/url][/font][font=宋体][font=宋体]最快[/font][font=Calibri]35[/font][font=宋体]天获得[/font][font=Calibri]scFv[/font][font=宋体]序列[/font][/font][font=宋体][font=宋体]一次筛选[/font][font=Calibri]10,000[/font][font=宋体]个以上的[/font][font=Calibri]B[/font][font=宋体]细胞[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]③流式单[/font][font=Calibri]B[/font][font=宋体]细胞筛选平台[/font][/font][font=宋体][font=Calibri]1[/font][font=宋体]天内完成所有[/font][font=Calibri]B[/font][font=宋体]细胞分选[/font][/font][font=宋体][font=宋体]保留天然配对的[/font][font=Calibri]scFv[/font][font=宋体]分子[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]④杂交瘤技术平台[/font][font=宋体][font=宋体]项目成功率[/font][font=Calibri]90%[/font][/font][font=宋体][font=宋体]成熟技术获得高特异性[/font][font=Calibri]scFv[/font][font=宋体]分子[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、[/font][font=Calibri]CAR[/font][font=宋体]候选分子筛选[/font][/font][font=宋体] [/font][font=宋体][font=宋体]①[/font][url=https://cn.sinobiological.com/services/spr-bli-assay-services][b][font=Calibri]scFv[/font][font=宋体]亲和力检测([/font][font=Calibri]SPR/BLI[/font][font=宋体])[/font][/b][/url][/font][font=宋体] [/font][font=宋体][font=Calibri]scFv[/font][font=宋体]是[/font][font=Calibri]CAR-T[/font][font=宋体]细胞特异性识别肿瘤细胞的关键,其对抗原的亲和力和特异性影响着[/font][font=Calibri]CAR-T[/font][font=宋体]的有效性和安全性。义翘神州[/font][font=Calibri]SPR/BLI[/font][font=宋体]检测平台可高效筛选[/font][font=Calibri]scFv[/font][font=宋体]分子,支持[/font][font=Calibri]CAR-T[/font][font=宋体]药物研发。[/font][/font][font=宋体] [/font][font=宋体]②蛋白表达服务[/font][font=宋体] [/font][font=宋体][font=宋体]靶抗原的选择决定了[/font][font=Calibri]CAR[/font][font=宋体]的特异性及有效性等。义翘神州可提供定制化抗原制备服务,包括从基因合成、载体构建到蛋白表达、纯化的一站式服务,充分支持[/font][font=Calibri]CAR-T[/font][font=宋体]细胞治疗研发。[/font][/font][font=宋体] [/font][font=宋体]③检测用过表达细胞株构建[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州可提供过表达细胞株构建服务,利用慢病毒载体构建靶抗原过表达稳转株,可以根据客户需要携带多种标记,满足客户流式筛选[/font][font=Calibri]scFv[/font][font=宋体]分子的需求。[/font][/font][font=宋体] [/font][font=宋体]④[url=https://cn.sinobiological.com/category/car-t-cell-therapy-target-protein-elite][b]靶点蛋白[/b][/url][/font][font=宋体] [/font][font=宋体][font=Calibri]scFv[/font][font=宋体]筛选是[/font][font=Calibri]CAR[/font][font=宋体]开发的关键步骤,义翘神州可提供丰富的高质量[/font][font=Calibri]CAR-T[/font][font=宋体]相关热门靶点蛋白产品,全面支持您的[/font][font=Calibri]CAR-T[/font][font=宋体]研究。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]二、[/font][font=Calibri]CAR-T[/font][font=宋体]细胞制备 [/font][font=Calibri]T[/font][font=宋体]细胞激活[/font][/font][font=宋体] [/font][font=宋体][font=宋体]从患者外周血中收集、分离得到的[/font][font=Calibri]T[/font][font=宋体]细胞用于改造之前需要先进行活化。最常见的用于[/font][font=Calibri]T[/font][font=宋体]细胞体外活化的是[/font][font=Calibri]CD3[/font][font=宋体]抗体和[/font][font=Calibri]CD28[/font][font=宋体]抗体 。义翘神州已开发[/font][font=Calibri]GMP[/font][font=宋体]级别的[/font][font=Calibri]CD3[/font][font=宋体]以及[/font][font=Calibri]CD28[/font][font=宋体]单克隆激活抗体,纯度高,活性高,超低内毒素([/font][font=Calibri]0.5 EU/mg[/font][font=宋体]),经细胞水平验证,可有效激活培养[/font][font=Calibri]T[/font][font=宋体]细胞,更好地助力[/font][font=Calibri]CAR-T[/font][font=宋体]细胞治疗药物开发和生产。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]三、[/font][font=Calibri]CAR-T[/font][font=宋体]细胞制备 慢病毒包装[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]T[/font][font=宋体]细胞分离活化完成后,慢病毒包装是进行[/font][font=Calibri]CAR-T[/font][font=宋体]细胞制备的一个关键环节,慢病毒滴度是决定[/font][font=Calibri]CAR[/font][font=宋体]转染阳性率的关键因素。义翘神州可以提供慢病毒包装的关键原材料如[/font][font=Calibri]Sinofection[/font][font=宋体]转染试剂、无血清[/font][font=Calibri]HEK293[/font][font=宋体]培养基和质粒生产,以及慢病毒纯化工艺过程中用于去除宿主核酸的[/font][font=Calibri]GMP[/font][font=宋体]级核酸酶等。另外,我们也可提供全面的[/font][font=Calibri]HEK293[/font][font=宋体]细胞库检定服务,充分保障[/font][font=Calibri]CAR-T[/font][font=宋体]药物的安全性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]四、[/font][font=Calibri]CAR-T[/font][font=宋体]细胞扩增[/font][/font][font=宋体][font=Calibri]CAR-T[/font][font=宋体]细胞可以特异性识别肿瘤抗原来发挥其抗肿瘤活性。相关研究显示联合或单独使用细胞因子,可以增强[/font][font=Calibri]CAR-T[/font][font=宋体]细胞增殖,提高[/font][font=Calibri]CAR-T[/font][font=宋体]细胞抗肿瘤活性。因此,选取不同细胞因子组合或合适的细胞因子来培养[/font][font=Calibri]CAR-T[/font][font=宋体]细胞,可显著增加[/font][font=Calibri]CAR-T[/font][font=宋体]免疫细胞疗效。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]五、[/font][font=Calibri]CAR-T[/font][font=宋体]细胞质量控制[/font][/font][font=宋体][font=Calibri]CAR-T[/font][font=宋体]细胞可以特异性识别肿瘤抗原来发挥其抗肿瘤活性。相关研究显示联合或单独使用细胞因子,可以增强[/font][font=Calibri]CAR-T[/font][font=宋体]细胞增殖,提高[/font][font=Calibri]CAR-T[/font][font=宋体]细胞抗肿瘤活性。因此,选取不同细胞因子组合或合适的细胞因子来培养[/font][font=Calibri]CAR-T[/font][font=宋体]细胞,可显著增加[/font][font=Calibri]CAR-T[/font][font=宋体]免疫细胞疗效。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]关于[/font][font=Calibri]CAR-T[/font][font=宋体]细胞疗法整体解决方案详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/category/car-t-cell-immunotherapy[/font][font=宋体],上面有更详细的介绍,[/font][font=Calibri]CAR-T[/font][font=宋体]细胞疗法,助力人类发展。[/font][/font]
细胞传代注意事项:1、 避免污染肯定是首位的,包括,1.细胞间的灭菌,培养基和血清都要经过过滤,2每个操作都不能在未盖盖的培养皿上面进行。3.吸取吹打PBS或者培养基的枪头都不可以与废液缸直接接触。2、 另一件重要的事情就是胰酶消化的程度了。消化太过会使细胞形态改变,消化不充分会使细胞会滞留在培养基上。3、 当然离心的转速和时间也很重要,这要视细胞的种类而定。具体操作步骤如下:1.用5%酒精擦试超净台和双手,2.备好培养瓶,取出细胞,喷酒精,消毒后放入超净台3.吸走旧培养基,用PBS清洗,加入适量 胰酶消化液,注意消化液的量, 最佳消化温度37% ,一般消化Imin.4. 显微镜下观察消化细胞,若细胞质回缩,细胞之间连接成片,表明此时消化完成,5.加入培养液终止消化,吹打均匀,放入15mL离人管,离心时1300rpm,5min,新的培养基加入培养液,植入新的培养皿, 吹打均匀,继续培养.
细胞冻存是长期保存、运输和共享生物材料的重要手段,对于各种生物医学研究领域具有重要的作用。然而,不同的细胞冻存方法可能会影响细胞的质量和存活率。本文将探讨不同厂家提供的细胞冻存方法,并分析它们对细胞质量的影响。 厂家差异及其对细胞质量的影响 目前,市面上有许多细胞冻存试剂盒供应商,其中一些主要的厂家包括Thermo Fisher Scientific、Sigma-Aldrich、Qiagen和Promega等。这些厂家提供的细胞冻存试剂盒都有其独特的优点和缺点。 以细胞存活率为例,Thermo Fisher Scientific公司提供的CryoStor冻存剂的细胞存活率达到了98.5%,而Sigma-Aldrich公司提供的CryoSure-DMSO冻存剂的细胞存活率仅为85%。这表明,不同厂家提供的细胞冻存试剂盒对细胞存活率的影响存在差异。 此外,不同的冻存方法也可能影响细胞的质量。例如,在使用Thermo Fisher Scientific公司的CryoStor 冻存剂时,冷冻速率、先冷冻后复温的步骤和使用的液氮均对细胞的冻存质量产生影响。另外,Sigma-Aldrich公司的CryoSure-DMSO冻存剂需要在冷冻过程中将细胞悬浮于冻存剂中,并使用20%的DMSO作为保护剂,以确保细胞质量。 因此,选择细胞冻存试剂盒时,需要注意不同厂家提供的细胞冻存试剂盒的差异,以及冷冻的方法是否适合特定类型的细胞。 关注:[url=http://www.yedanguan365.com/]液氮罐[/url] [url=http://www.mvecryoge.com/]金凤液氮罐[/url] [url=http://www.mvecryo.com/]mve液氮罐[/url]
各国争相发展的重点项目 iPS技术,即诱导性多能干细胞技术,是一种将成体成熟、分化的体细胞重编程获得类似胚胎干细胞的新兴技术。2007年11月美国和日本科学家分别独立宣布可将人类皮肤细胞转化为iPS细胞。这一发现被《自然》和《科学》杂志分别评为2007年第一和第二大科学进展。之后,iPS细胞研究迅猛发展,不同的国家和实验室纷纷报道了多种方法建立的iPS细胞系。就连世界第一只体细胞克隆动物多利羊的培育者伊恩·威尔莫特也宣布放弃人类胚胎干细胞克隆研究,转而进行 iPS 细胞研究,因为他认为这种细胞比胚胎干细胞更具潜在优势。 我国连续多年将干细胞研究列入“863”、“973”、国家自然基金重点项目。国务院2006年发布的《国家中长期科学和技术发展规划纲要(2006-2020年)》中,干细胞作为五项生物技术之一成为未来15年我国前沿技术的重点研究领域。 致瘤风险浮出水面 Yamanaka研究组在《自然·生物技术》上发表的文章显示,用iPS细胞诱导的神经干细胞,即使不含c-Myc(曾被认为是导致肿瘤的主要原因),在植入NOD/SCID免疫缺陷小鼠后仍有很强的致瘤性,甚至高于胚胎干细胞。 他们共研究了36个iPS细胞克隆,在诱导方式上,有些诱导剂配方中含有c-Myc基因,有些没有,因此具有较好的代表性。同时他们选择了3株胚胎干细胞作为对照。在45周的观察中,移植胚胎干细胞来源神经干细胞的34只小鼠有4只长出肿瘤。在100只移植胚胎成纤维细胞来源的iPS神经干细胞小鼠中34只发现肿瘤,概率和胚胎干细胞相当。在55只移植成人成纤维细胞来源的iPS神经干细胞小鼠中46只发现肿瘤,概率远高于胚胎干细胞。在36只移植肝细胞来源的iPS神经干细胞小鼠中10只发现肿瘤,概率高于胚胎干细胞。8只移植胃上皮细胞来源的iPS神经干细胞小鼠中未发现肿瘤。病理学检查证实肿瘤均为畸胎瘤,部分为恶性畸胎瘤。 研究还发现,以前认为致瘤性很强的c-Myc在去掉后并没有减少iPS神经干细胞的致瘤性,相反以前认为没有致瘤性的Nanog基因却可以明显增强iPS神经干细胞的致瘤性。 这次试验的另一个意外结果是并未发现在生成的肿瘤细胞中有c-Myc或其他基因的激活。以前的观点认为,转入的癌基因是iPS致瘤性的基础,只要在iPS细胞诱导成功后通过各种方法去除已完成使命的癌基因即可使iPS细胞免于致瘤性。这次试验的结果无疑给这些想法留下了阴影,而且使iPS致瘤的机制更加扑朔迷离。