Nature子刊:酗酒为什么对人体有害? 29种基因变异可以解释
耶鲁大学医学院的研究人员报告称:对超过435,000人的全基因组分析发现了29种与不良饮酒有关的遗传变异。这一发现公布在5月25日Nature Neuroscience杂志上。耶鲁大学基金会精神病学教授,遗传学和神经科学教授Joel Gelernter说:“新数据使已知的与酗酒有关的遗传风险基因座的数量增加了三倍。”该研究包括对四个独立生物库或数据集中包含的欧洲血统人群的全基因组分析。研究人员在符合酒精使用问题标准的人群中寻找共享的遗传变异,包括酒精使用障碍和有医疗后果的酒精使用。这些疾病是导致世界范围内各种医学问题的主要原因。研究人员分析发现了19个以前未知的独立的与酗酒有关的遗传危险因素,并确认了10个先前确定的危险因素。对生物库数据的荟萃分析还包括有关几种精神疾病的遗传危险因素的信息。这些信息使研究人员能够研究有问题的饮酒与诸如抑郁症和焦虑症等疾病之间的共同遗传关联。他们还发现这些突变的遗传力在大脑和基因组的进化保守调节区中表现丰富,证明了它们在生物学功能中的重要性。同时,研究人员还采用了孟德尔随机化法(Mendelian randomization),分析研究一个受遗传影响的性状如何影响另一个与遗传相关的性状。这项研究的主要作者,耶鲁大学精神病学副研究员Yhang Hang说:“这项研究使我们能够理解有问题的饮酒特征(如精神状态,冒险行为和认知表现)之间的因果关系。”“有了这些结果,我们还可以更好地评估个人饮酒问题的风险了。”
厂商
2020.05.26
Cell新发现“瘦”的基因:为什么有些人吃得多,但不会胖?
为什么有些人可以吃得很多,而且仍然维持身材苗条呢?来自英属哥伦比亚大学的一组研究人员最新研究发现了这其中的奥秘:“瘦”的基因,这一基因在代谢健康的人群中抵抗体重增加。这一研究研究发现公布在5月21日的Cell杂志上,由英属哥伦比亚大学生命科学研究所所长Josef Penninger博士领导完成。在这项研究中,研究人员研究了爱沙尼亚生物银行(Estonian Biobank)的数据,其中包括47102名年龄在20至44岁之间的人。研究小组将健康的瘦的人群DNA样本和临床数据与体重正常的人进行了比较,并发现了一种名为ALK(间变性淋巴瘤激酶)的基因在抵抗体重增加中发挥着作用。Penninger教授说:“我们都知道这样的人,他们可以吃任何他们想要吃的东西,他们也不运动,但是他们就是不增重。这一人群占人口的大约1%。”研究人员想要弄清楚其中的原因,“大多数研究者研究肥胖症和肥胖症的遗传学,我们反其道而行之,研究瘦的原因,开始新的研究领域。”这个基因其实之前发现在几种类型的癌症中经常突变,并且已被确定为肿瘤发展的致癌基因。但是在这项研究中,研究人员发现ALK在大脑中起作用,它通过整合和控制能量消耗来调节新陈代谢。当Penninger研究小组在果蝇和小鼠中删除ALK基因时,两者都对饮食引起的肥胖症具有抵抗力。尽管食用相同的饮食并且具有相同的活动水平,没有ALK的小鼠体重减轻且体内脂肪减少。由于ALK在大脑中高度表达,因此在体重增加抵抗中的潜在作用使其成为开发肥胖疗法的有吸引力靶标。Penninger教授表示,“ALK抑制剂已经在癌症治疗中使用。这是有针对性的,我们可能也会抑制ALK,”研究人员将做进一步的研究,查看这些抑制剂是否对此有效。该团队还计划进一步研究表达ALK的神经元如何在分子水平上调节大脑,从而平衡新陈代谢并促进瘦身。这项研究选取的爱沙尼亚生物库是理想的选择,因为它的年龄范围广且具有强大的表型数据。但是复制这些发现的一个局限性在于,收集生物学或医学数据以及组织样本的生物库在数据收集方面没有统一的标准,这使可比性成为一个挑战。研究人员说,他们将需要通过GWAS分析与其他数据库确认他们的发现。“可以从生物库中学到很多东西。但是这不是生命的最终答案,不过它们也是确认的起点,是与人类健康非常重要的联系。”这项工作是独特的,因为它结合了对种群和全基因组范围内罕见遗传基础的探索,与小鼠体内活体分析以及该基因功能的结合。“将不同的群体聚集在一起真是太好了,从营养到生物储备,再到小鼠和果蝇遗传学。总的来说,这是一个故事,包括新陈代谢中的进化树,ALK的进化作用,以及提供因果证据的核心生物化学和遗传学。”
厂商
2020.05.25
口服一种脂质逆转了线粒体的衰老
随着年龄增长,人们经常感到精力不足、行动不便或缺乏活力。导致这些问题的根源可能是由于线粒体的减少。事实上,线粒体不仅在人类,而且在许多物种中都随着年龄的增长而减少。它们为什么会这样?科学家们还不清楚。Max Planck衰老生物学研究所的科学家们正在研究线粒体功能是如何随着年龄的增长而减弱的,并寻找阻止这一过程的因素。他们发现线粒体和细胞其他部分之间的通讯起着关键作用。由于心磷脂和神经酰胺对人体线粒体也是必不可少的,可能意味着,通过了解这些分子如何促进细胞不同部分之间的通讯,可以改善人类的健康和衰老。这项工作最近发表在《Nature Metabolism》杂志上。科学家们使用了简单的秀丽隐杆线虫作为模型,线虫是非常重要的衰老研究模型系统。这种动物有一半以上的基因与人类相似,而且它们的线粒体也随着年龄的增长而减少。在他们的研究中,科学家们发现了一种叫做NFYB-1的核蛋白,它能打开和关闭影响线粒体活性的基因,而且在衰老过程中,这种蛋白本身会下降。在缺乏这种蛋白质的突变蠕虫中,线粒体不起作用,线虫也活不长。出乎意料的是,科学家们发现NFYB-1通过溶酶体控制线粒体的活动,溶酶体是一个基本分子被分解并作为营养物质循环利用的地方。“我们认为溶酶体利用心磷脂和神经酰胺这些特殊的脂质与线粒体对话,脂质对线粒体的活动至关重要,”Adam Antebi说,他的实验室领导了这项研究。“值得注意的是,仅仅喂NFYB-1突变线虫心磷脂就能恢复这些突变线虫的线粒体功能和它们的健康。”
厂商
2020.05.21
Cell:生酮饮食改变人体的肠道微生物组
低碳水化合物,高脂肪的生酮饮食由于能减轻炎症,促进体重减轻和心脏健康方面的益处,近年来引起了公众的关注。近日由加州大学旧金山分校完成的一项研究表明,这些分子对人类肠道中的微生物产生了巨大影响,这一研究成果公布在Cell杂志上。小鼠的其他研究表明,所谓的“酮体”(一种以生酮饮食命名的分子副产物)可能最终以抑制炎症的方式直接影响肠道微生物组,这提示了酮体可以作为治疗糖尿病的潜在手段。在生酮饮食中,碳水化合物的消耗量显著减少,迫使人体改变代谢方式,以使用脂肪分子而不是碳水化合物作为其主要能源,产生的副产物是酮体。“我对这个问题很感兴趣,因为我们先前的研究表明,高脂饮食会引起肠道微生物组的变化,促进小鼠的代谢和其他疾病,但脂肪含量更高的生酮饮食则已被提议作为一种方法,预防或治疗疾病,”文章作者,加州大学旧金山分校Peter Turnbaugh博士说,“为此我们决定探索这个令人费解的矛盾问题。”在发表于Cell的新研究中,研究人员招募了17名超重或肥胖的非糖尿病成年男性,在代谢病房住院两个月,他们的饮食和运动水平均在仔细监控中。在研究的前四周,研究人员为参与者提供了由50%碳水化合物,15%蛋白质和35%脂肪组成的“标准”饮食或由5%碳水化合物,15%蛋白质和80%脂肪组成的生酮饮食。四个星期后,两组参与者开始改变饮食,以便研究人员研究两种饮食之间的转换如何改变参与者的微生物组。对参与者粪便样本中发现的微生物DNA的分析表明,在标准饮食和生酮饮食之间的转换显著改变了参与者肠道中常见肠道微生物门放线菌,拟杆菌和厚壁菌的比例,19个不同细菌属的显著变化。研究人员专注于特定的细菌属:常见的益生菌双歧杆菌在生酮饮食的减少量最多。为了更好地了解生酮饮食中的微生物变化如何影响健康,研究人员将小鼠肠道暴露于遵循生酮饮食的人类微生物组的不同组成部分,结果发现这些改变的微生物种群特别减少了Th17免疫细胞的数量。 T细胞类型对抵抗传染病至关重要,但也可促进自身免疫疾病的炎症。在小鼠中进行的后续饮食实验中,研究人员逐步在低脂,高脂和低碳水化合物生酮饮食之间转换动物的饮食,证实了高脂和生酮饮食对肠道微生物组的作用相反。这些发现表明,随着动物饮食中脂肪水平增加到在无碳水化合物的情况下促进酮体产生的水平,微生物组的反应也有所不同。研究人员观察到,随着动物饮食从标准饮食向更严格的碳水化合物限制转变,它们的微生物也开始转变,这与酮体的逐渐增加有关。“这让我有些惊讶,”Turnbaugh说,“作为刚接触酮体研究的研究人员,我曾假设一旦摄入足够低的碳水化合物,生产酮体是一种全有或全无的作用。但这表明会很快出现一些酮体的影响效果。”研究人员测试了单独的酮体是否可以通过直接向小鼠喂食,来驱动肠道微生物生态系统中已观察到的转变。他们发现,即使是在吃了正常量碳水化合物的小鼠中,添加酮的存在也足以引起生酮饮食中许多特定的微生物变化。Turnbaugh说:“这真是一个令人着迷的发现,因为它表明生酮饮食对微生物组的影响不仅与饮食本身有关,而且还与饮食如何改变人体的代谢有关,从而对微生物组产生下游影响。” “对于许多人来说,维持严格的低碳水化合物饮食或生酮饮食是极具挑战性的,但是如果未来的研究发现,酮体自身引起的微生物转移对健康有好处,那么这可能会使治疗方法更加‘可口’。”
厂商
2020.05.21
Nature新技术:一种可以让组织拉伸数倍,并多次使用的新技术
针对许多生物医学研究实验中遇到的问题,来自麻省理工学院的研究人员设计了一种解决方案,可以使大脑和其他大型组织中的细胞和分子成像更容易,同时样品也足够坚韧,可以在实验室中进行多次处理,这种技术提出了一种化学过程,帮助组织拉伸,压缩,且坚固。这一新技术公布在Nature Methods杂志上。这种被称为“ ELAST”技术为科学家提供了一种非常快速的方法来荧光标记大脑,肾脏,肺,心脏和其他器官内的细胞,蛋白质,遗传物质和其他分子。麻省理工学院Kwanghun Chung实验室在一项由国家卫生研究院资助,为期五年的项目中,开发了ELAST ,绘制出人类整个大脑最全面的图谱。要完成这样的图谱,要求能够在最厚的组织中标记和扫描每个精细的细胞和分子细节,这也意味着实验室必须能够将样本完整地保持多年。Chung说:“当人们捐赠大脑时,就像在捐赠图书馆一样。每个图书馆都包含有价值的信息,但我们不能同时访问该图书馆中的所有书籍,必须在不损坏它地重复访问的情况下利用该图书馆。这些大脑中的每一个都是极其宝贵的资源。”为此,研究人员改变了思维方式:如果我们的目标不是成像生活事件,而是成像外观,就可以在保持外观的同时改变组织的物质类型。新配方在这项研究中,研究人员对凝胶状化学品聚丙烯酰胺配方进行了改进,文章作者Webster Guan说,在过去,大家用一种与交联化学物质不同的形式,使组织坚固,但不能保存时间长,现在改进配方了,所以当该配方注入组织时,细胞和分子将直接附着在网格状的网格上。在新配方中,该团队使用了高浓度的丙烯酰胺,而交联剂和引发剂却少得多。结果表明是长的聚合物链与能够缠结的链环缠结在一起,使凝胶结构完整,且具有更大的柔韧性。不仅如此,组织的细胞和分子并没有附着在链上,而是纠缠在其中,进一步增加了注入丙烯酰胺组织承受拉伸或挤压的能力,而不会在组织中造成任何撕裂或永久移位。在该研究中,研究小组报告了将人或小鼠的脑组织同时拉伸至其宽度和长度的两倍,或者将其厚度压缩10倍,恢复到正常大小后几乎没有变形。这些结果表明,ELAST能够实现完全可逆的组织形状转换,同时保留组织中的结构和分子信息。将聚丙烯酰胺完全整合到大量组织中,达到弹性可能需要长达21天的时间,但是从那时起,任何单独的标记步骤(例如标记特定类型的细胞确定其丰度)或特定的蛋白质来查看其表达方式,其过程比以前的方法要快得多。比如研究人员通过反复压缩人脑的5毫米厚的横截面,只需24小时就可以完全贴上标签。早在2013年,Chung及其同事曾首次推出了“ CLARITY”,这是一种使脑组织透明并用丙烯酰胺凝胶固定的方法,研究人员需要24小时才能将切片标记为厚度的十分之一。由于标记时间是通过平方探针必须穿透的深度来估算的,因此计算表明,使用ELAST进行标记的速度比使用CLARITY进行速度快100倍。Chung说,尽管他们实验室主要集中在大脑,但对其他器官也具有适用性,可以帮助进行其他细胞定位工作。即使标记组织根本不是靶标,拥有一种简单的新方法来制造耐用的弹性凝胶也可以有其他应用,例如在创建软机器人方面。
厂商
2020.05.19
《Cell》活的、整只哺乳动物单细胞谱系追踪
对单独的有机个体来说,如果每个细胞都有属于自己的传记信息和所在的位置,那么,研究人员就能从中学到许多关于发育、衰老和疾病的知识。坏消息是,侵入性的细胞评估技术会令追踪组织或有机体发育的家谱仅限于一小群细胞,或者结果扭曲的让人不敢确信。好消息是,一项新技术已经开发出来了,它承诺可以将细胞的详细分子读数(例如转录指纹)与细胞的祖先信息结合起来。这项技术被称为CRISPR列阵修复血统追踪(CRISPR Array Repair Lineage tracing,CARLIN),由波士顿儿童医院干细胞研究项目和Dana Farber癌症研究所/哈佛医学院的科学家开发,可追踪体内每一个细胞,从胚胎期到成年期。有关这项技术的详细信息发表在《Cell》杂志,题目为“An Engineered CRISPR-Cas9 Mouse Line for Simultaneous Readout of Lineage Histories and Gene Expression Profiles in Single Cells”,结合“条形码”和CRISPR基因编辑技术,CARLIN可识别不同的细胞类型,以及每种类型的基因是什么。文章的作者写道:“利用CRISPR技术,在发育期或成年期的任何时候以可诱导的方式生成多达44000个转录条形码,与顺序排列的条形码兼容,并且完全由基因决定。我们利用CARLIN确定了胎儿肝造血干细胞(HSC)克隆的内在活性偏差,并揭示了HSCs在损伤反应中一个以前未被重视的克隆瓶颈。”几十年来,发育生物学家做梦都想创造一种重建每一个细胞谱系的方法,“一个细胞一个细胞地,随着胚胎的发育,或者组织的建立,”Fernando Camargo博士说。他是干细胞研究项目的高级研究员,与哈佛医学院系统生物学助理教授Sahand Hormoz博士是本文的共同通讯作者。“我们可以用这个小鼠模型来跟踪它的整个开发过程。”Camargo、Hormoz和他们各自实验室的共同第一作者Sarah Bowling博士和Duluxan Sritharan使用CARLIN方法创建了一个小鼠模型。该模型可以揭示细胞谱系,即父细胞创建不同类型子细胞的“家族树”,以及随着时间的推移,每个细胞中的哪些基因被打开或被关闭。此前,科学家们只能用染料或荧光标记在小鼠身上追踪一小群细胞。也有使用标记或条形码的方法,但以前的方法需要已知标记以分离不同的细胞类型,或者需要耗时的细胞提取和操作,这可能会影响细胞的特性。CRISPR的出现使研究人员能够在不干扰细胞的情况下对细胞进行条码识别,同时跟踪数千个细胞的血统。使用一种可诱导的CRISPR,研究人员能够在小鼠一生中的任何时间点创建多达44000个不同的识别条码。然后,使用另一种名为单细胞RNA测序的技术读取条形码,从而收集每个条形码细胞中开启的数千个基因的信息。这反过来又提供了有关细胞身份和功能的信息。作为一个测试案例,研究人员利用这个新方法揭示了胚胎发育过程中血液发育的未知细节,并观察了成年小鼠化疗后的血液补充动态。研究人员相信,CARLIN也可以用来了解疾病和衰老期间细胞谱系树的变化。此外,该系统还可用于记录对环境刺激的反应,如病原体暴露和营养素摄入。Camargo说:“绘制哺乳动物组织的单细胞谱系图是一项前所未有的壮举!除了在研究发育生物学方面的许多应用外,我们的模型还将提供有关生物对损伤和疾病作出反应时所受影响的细胞类型和层次结构的重要见解。”
厂商
2020.05.19
Science:先天免疫信号“同声传译”新成员
包括人类在内,任何物种的细胞识别病原体并迅速向免疫系统发出警报都是非常重要的基本过程。细胞是如何处理病原体信号的呢?一个名为病原体适配器(adapters)的细胞内小分子平台是关键。在这里病原体探测器检测到的信号被整合在一起,确保安全性和准确性,然后被传送给用于激活主要“红色警报”基因(例如干扰素)的持续信号。现在,来自奥地利科学院CeMM分子医学研究中心的Giulio Superti-Furga实验室与Boehringer Ingelheim合作,确定了一个新的关键要素,与处理病原体严重性有关。这种新蛋白被命名为TASL,是内含体中Toll样受体(TLR)信号传导所必需的,能激活某些免疫细胞中的IRF5基因。病毒适配器的敏感性“微调”非常重要,因为过多输出也会导致炎症,就像自身免疫疾病一样。新发现的机制似乎与系统性红斑狼疮(SLE)等疾病有关,凸显了一个治疗某些自身免疫性疾病的潜在新目标,可能对病毒和其他感染反应过度也有帮助。文章发表在著名的科学杂志《Science》。免疫系统是人体的自然防御系统,由细胞、分子、组织和器官组成的网络共同作用,保护人体免受病毒、细菌或致病真菌等传染源的侵害。免疫系统配备了一套复杂的感知机制,用于检测不同的病原体并协调适当的免疫反应。先前的研究表明,SLC15A4是人体最大的转运蛋白家族的一员,被认为是TLRs正常功能所必需的重要成分。CeMM学术主任Giulio Superti Furga的小组成员着手研究SLC15A4如何影响TLR对病原体的感应能力,进一步了解其在自身免疫性疾病,特别是系统性红斑狼疮中的意义。在他们的研究中,第一作者Leonhard Heinz和包括Boehringer Ingelheim的研究团队进行了一项精确的调查工作,结果SLC15A4与TLRs的关联并不像他们怀疑的那样。于是,他们通过生物化学和质谱技术艰苦地确定了与SLC15A4存在相互作用的分子。结果发现了由CXorf21基因编码的TASL,这是一个功能孤立的基因,到目前为止它仅有一个编号和染色体位置。这个基因未曾被认为与SLE有什么关系。TASL蛋白和SLC15A4之间的相互作用对于TASL蛋白的定位和功能至关重要。TASL含有一个对IRF5的募集和激活特定基序。CeMM高级博士后研究员、研究项目负责人Manuele Rebsamen说,新蛋白TASL是继STING、MAVS和TRIF之后第四个关键的先天免疫配适器,作为IRF家族激酶和基因激活剂的接洽平台。这些发现增加了一种可能性,即在药理学上干扰SLC15A4/TASL复合物可以调节TLR反应,从而调节体内的炎症反应。“SLC15A4在TLR功能中起关键作用,与疾病有关,但其作用机制尚不清楚,”CeMM科学主任、负责这项研究的Giulio Superti-Furga补充道。“这些正是令我们兴奋的科学问题。Boehringer Ingelheim建议将溶脂载体视为一组值得研究的疾病相关蛋白,分享合作是这项研究取得成功的基础。”
厂商
2020.05.15
Cell:微生物组如何控制免疫系统?
一组研究人员发现了微生物组如何帮助实现免疫系统能够对病原体做出反应的重要机制。研究指出,如果缺少这种调控,那么相关的介质就不会释放,无法激活某些免疫细胞的代谢过程。这一发现公布在Cell杂志上。人体上皮组织位于环境界面中,代表了病原体的潜在通道。这些组织也自然地会被细菌,病毒,真菌和寄生虫的复杂群落定殖,这被称为微生物组。在进化过程中,与这些微生物的永久性相互作用可能会导致形成强有力的信号通路,有助于保护人体。由柏林大学附属夏里特医院免疫学研究所所长Andreas Diefenbach博士领导的一组研究人员一直在分析微生物组在机体对有害病原体的免疫应答中的作用及其对信号通路的影响。感染会触发人体的免疫反应。 经典树突状细胞(cDC)在此过程中起关键作用,它们构成人体先天免疫系统的一部分,携带一系列模式识别受体,能够快速检测出入侵的病原体。细胞的初始反应涉及细胞因子的释放,信号蛋白将免疫细胞吸引到感染部位。同时,这些细胞还利用吞噬作用吞噬和消化入侵的病原体,然后它们在细胞表面呈递单个颗粒作为抗原。反过来,这导致T细胞的活化(形成适应性免疫系统的一部分)并导致靶向免疫反应。如果呈递内源性抗原的cDCs触发T细胞活化时,这会导致错误的不良免疫反应,并导致自身免疫性疾病。在最新研究中,研究小组发现,在无菌条件下(即在无菌小鼠中),cDCs不能触发免疫反应。研究人员得出结论,当细胞处于“基础状态”(以没有感染为特征)时,cDC必须接收信息,并且该信息必须来自微生物组。这些微生物组来源的信号可引发cDC,应对未来的病原体。Diefenbach教授说:“我们想了解微生物组对cDC功能的持续影响。” “在这项研究中,我们证明了,在其基础状态下,这些专业免疫细胞受到I型干扰素(IFN-I)的微生物组控制的不间断信号传递。”干扰素是细胞因子,即已知在抗病毒活性中起作用的特殊信号分子。“到目前为止,我们对IFN-I在基础状态中的作用了解甚少。在基础状态中未接受IFN-I信号传导的cDC不能履行其作为人体一部分的生理功能——与病原体作斗争。”研究结果表明,微生物组控制着我们免疫系统的适应性。它通过使免疫系统处于“就绪”状态来施加这种控制,从而加快其对病原体的反应。研究人员的这一发现有助于开发新的治疗方法。 许多自身免疫性疾病,例如系统性红斑狼疮,是由IFN-I产生增加引起的。其他研究表明,微生物组会影响检查点抑制剂在癌症免疫治疗中的有效性。Diefenbach教授说:“这些现象引起了我们的极大兴趣。例如,是否有可能改变微生物组的组成,减少IFN-1的利用率,从而对自身免疫性疾病产生积极影响?或者有可能通过发挥作用来改善对癌症免疫疗法的反应,对潜在的IFN-I产生积极影响?” 研究人员小组现在计划进行进一步的研究,探讨这些问题。
厂商
2020.05.13
CAR-T新型细胞疗法应用:选择性清除白血病干细胞
急性髓细胞白血病(AML)是一种侵袭性的造血系统肿瘤,它影响造血干细胞生成的各种白细胞、红细胞和血小板。白血病干细胞可迅速在骨髓和血液中扩散,并攻击其他器官。接受骨髓移植的患者在手术之前通常需要接受强化疗,有时还有强放疗,这种预处理并不适合许多病人。选择性清除白血病造血干细胞化疗和放疗不仅会破坏癌细胞和造血干细胞,还会影响所有分裂细胞,即几乎所有组织。苏黎世大学(UZH)、苏黎世大学医院(USZ)和苏黎世以太医院(ETH Zurich)的科学家和医生组成的团队目前已成功地在动物模型中选择性地消除了白血病和造血干细胞,保留了成熟的血细胞和其他组织。研究人员使用了CAR-T新型细胞疗法,这种疗法通过基因改造人体免疫细胞具备一种受体,通过这种受体,他们可以系统地仅与白血病干细胞和健康造血干细胞对接并将其摧毁。这为移植新的供体细胞创造了空间。为了避免转基因免疫细胞同时攻击捐赠者的造血干细胞,通过使用抗CAR-T细胞表面标记的抗体,CAR-T细胞在完成工作后和移植前被停用。供体干细胞移植后,它们在骨髓中占据了一席之地,开始重建造血和免疫系统。选择性免疫介导清除计划的临床应用这一结果是通过在实验室中进行细胞培养以及在小鼠体内进行人血和癌细胞培养而获得的。但项目领导人Markus Manz相信,这种治疗方法对人类也是有效的:“原理是一样的,高精度地消除活生物体内的白血病和造血干细胞。”研究人员目前正在测试这种方法是否仅适用于CAR-T细胞,还是也适用于更简单的结构,如T细胞激活抗体。一旦临床前工作完成,Manz希望他们能在一项人类临床研究中测试这种新的免疫疗法。“如果我们的方法也适用于人类,它可以避免化疗严重的副作用,这对急性髓系白血病或其他造血干细胞疾病患者将是一个巨大的好处。”
厂商
2020.05.12
癌症治疗革命性研究方法
在Josep Carreras白血病研究所主任Manel Esteller博士领导下,科学界第一次用3D模型(类器官)描述了人类癌症的表观遗传指纹。文章发表在《Epigenetics》杂志。Esteller博士解释道:“通常,有希望的癌症治疗方法在实际的临床环境中都会失败。尽管有许多新治疗方法在实验室临床前阶段显示出了有希望的结果,但这种情况还是经常发生。一种解释是,早期研究阶段使用的许多肿瘤模型都是在二维(2D)培养瓶中建立的细胞系,这些细胞系已经生长了几十年。这些癌细胞可能不完全类似于从病人身上扩展到三维(3D)的真实肿瘤的特征。直到最近,我们才开始在实验室里‘种植’癌症,这种3D结构被称为类器官(organoids)。我们对这些细胞知之甚少,它们是否真能模仿体内肿瘤的构象,特别是DNA的化学行为(我们称为修饰),表观遗传学,如DNA甲基化。“我们的文章解决的是癌症研究领域未满足的生物医学需求:人类癌症器官的表观遗传指纹特征。已开发的研究表明,这些肿瘤模型对生物医学研究界和制药公司开发抗癌药物非常有用。”Esteller教授专门研究了25种人类癌症器官,这些器官来自美国类型培养收集(ATTC),他说,在他们的研究过程中,研究小组围绕癌细胞的特性做出了一些有趣的发现。“首先,我们发现每一种癌的类器官都保留了原发组织的特性,因此这表明,如果样本是从结肠癌或胰腺癌手术中获得的,类器官与原发肿瘤非常相似。“其次,我们发现正常细胞没有受到污染,因此,可以在没有干扰的情况下分析纯转化的恶性细胞。最后,与常用的二维细胞系相比,三维类器官癌更接近患者的肿瘤。他们现在正应用这项研究形成大数据,以便其他研究人员从易于访问的公共数据库中共享,促进更多的合作研究。Esteller博士解释说:“通过数据挖掘,使用不同的生物测定方法或专注特定基因,这将进一步促进新的癌症发现。“而且最重要的是,癌症类器官可以方便地从可靠的提供者(例如ATCC)获得。研究人员可以利用这些可共享样本的表观遗传信息来开展他们自己的研究。”
厂商
2020.05.12
Nature子刊:植物物种多样性调控植物与昆虫互作的生态机制
来自复旦大学李博教授团队与上海市农业科学院蒋杰贤研究员团队,联合我国、丹麦、德国、美国、意大利科研人员,合作揭示植物物种多样性调控植物与昆虫互作的生态机制,5月4日在Nature Plants上以Articles形式发表了题为“Global synthesis of effects of plant species diversity on trophic groups and interactions”长篇研究论文。该文分析了全球2900余组多种与单/纯种植物种植的比较试验数据,结果显示:在农业、草原和森林系统,添加其他植物物种,提高了捕食性天敌的丰度和捕食率、寄生性天敌的丰度和寄生率,降低了植食性昆虫的丰度和危害程度,提升了作物产量与品质以及植物生产力;并发现添加一种植物与添加多种植物对增加农业生态系统中的天敌数量并没有显著影响。因此,在农业生态系统,只需在主栽作物田块通过种植诱集植物、间套作、果园生草等措施添加1种植物,便可明显增加主栽作物上天敌的数量和多样性。进一步通过配对和路径数学模型分析,量化营养级功能群之间关系,结果显示在多样化种植的系统里,捕食性和寄生性天敌的增加,导致植食性昆虫的下降,而植食性昆虫数量下降有利于植物的生长发育、繁殖和品质提升。有趣的是,在陆地生态系统,增加植物物种多样性有促成植食性昆虫、天敌和植物三营养级联动的倾向;尤其在多样化种植的农业系统,营养级功能群之间的联动效应更加明显。该成果提示,种植者、管理决策者可通过植物物种多样化种植,充分利用天敌提供的生态服务功能;同时,呼吁政府管理部门应该制定相关政策,在生产实践中广泛应用与推广植物物种多样性种植体系,以便更好造福全人类及其居住的地球。本文第一作者为上海市农业科学院生态环境保护研究所害虫生态防控研究组万年峰研究员,上海市农业科学院蒋杰贤研究员、蔡友铭研究员和复旦大学生物多样性科学研究所李博教授为共同通讯作者;合作单位包括:上海市农业科学院、复旦大学、浙江农林大学、丹麦哥本哈根大学、德国康斯坦茨大学、美国斯坦福大学、意大利阿尔卑斯环境研究所、美国匹兹堡大学、美国明尼苏达大学。
厂商
2020.05.11
Cell子刊:人类视网膜发育过程中的重要分子机制
视觉是我们人类获取外界信息的主要方式,其主要通过位于眼球后壁的视网膜将光信号转换为电信号,最后将信号通过视神经传递到大脑。人类视网膜中有一个灵长类特异的区域称为黄斑区,主要负责明视觉和色觉,任何累及黄斑区的病变都会导致非常明显的视力丧失。因此,了解人视网膜细胞组成及其发育的分子机制,解析黄斑发育的特征,对治疗先天性视网膜疾病至关重要。一组研究人员发表了题为“Single-cell analysis of human retina identifies evolutionarily conserved and species-specific mechanisms controlling development”的研究论文,通过对16个时间点的人胚胎视网膜和4个发育阶段的人视网膜类器官进行高通量单细胞测序,建立了人类视网膜发育的转录组数据库,阐述了视网膜在发育过程中各种细胞类型命运决定以及黄斑形成的分子调控机制,并通过跨物种分析,揭示了人与小鼠的视网膜在发育过程中的进化保守性以及物种特异性。这一研究发现公布在Developmental Cell杂志上。在该研究中,研究人员利用高通量单细胞转录组技术对人视网膜类器官、胚胎期到成体期的20个时间点的118555个单细胞进行了测序,分成了126个细胞亚群,并根据已知的细胞类型标记基因将这些亚群注释为11种细胞类型,并且描绘了视网膜细胞的发育轨迹。同时,利用不同发育阶段细胞类型的组成揭示了人视网膜主要细胞类型出现的先后顺序以及发生的具体时间。为了进一步探究视网膜细胞命运决定的基因表达调控网络,研究人员对每一种细胞类型及其相关的视网膜祖细胞进行了拟时间分析,并且找到了相关细胞类型命运决定的调控基因。此外,为了研究黄斑区域发育的特殊性,研究人员收集了人胚胎期20周和出生后8天的黄斑区和外周区的样品,通过分析区域差异基因,最终找到了10个与黄斑生成相关的基因,其中CYP26A1可以减低视黄酸的浓度,而低浓度的视黄酸可以促进类似黄斑区域的形成,通过原位杂交实验证明CYP26A1是在黄斑区的视网膜祖细胞和穆勒细胞中特异性地表达。另一个基因CTGF,是Hippo信号通路的下游靶基因,也在黄斑区的穆勒细胞中特异性地表达。虽然Hippo通路在在早期黄斑区发育过程中的具体作用还有待研究,但是这些结果表明黄斑区特异的视网膜祖细胞以及穆勒胶质细胞对黄斑区的形成至关重要。原文标题:Single-cell analysis of human retina identifies evolutionarily conserved and species-specific mechanisms controlling development
厂商
2020.05.11
看大脑有没有老化?就看这个指标
日本RIKEN生物系统动力学研究中心的研究人员发现了大脑衰老与血液循环有关的变化。这项发表在《Brain》科学杂志上的研究显示,与年龄相关的脑室增大(ventriculomegaly)与大脑某一特定深部区域的血液引流滞后有关。核磁共振可以很容易地检测到这种滞后,也就是说,这是一条预测脑室扩大和大脑老化的潜在生物标志,可以帮助患者和医生迅速得到治疗。脑室扩大是不正常的,在这种情况下,液体在脑室积聚,没有得到适当引流使脑室扩大了。虽然正常范围的脑室扩大不是一种疾病,但如果不加以控制,就会导致巨脑室和脑积水引起的痴呆。“我们发现了一种与年龄有关的大脑静脉系统疏导时间改变,这种改变与寿命曲线非常相似,但比出现脑室扩大症状稍早一点,”文章第一作者Toshihiko Aso说。血液流经大脑,提供必要的氧气,脱氧血液必须通过我们的静脉回到心脏,它主要通过两条途径,一条是在靠近大脑表面的区域排出血液,另一条是从大脑深处排出血液。通过核磁共振成像来测量血流变化,研究小组发现,随着年龄的增长,血液通过这两条途径的时间变得不同步,其结果是,随着年龄增长,深部排血通道和表层排血通道之间存在时间差。新研究发现,在健康的衰老过程中,血液循环的时滞增长速度几乎与脑室扩大的速度相同,但开始的时间更早。核磁共振成像可以测量一个人两种引流途径之间的滞后程度,这可能是一个预测脑老化的很好的生物标志物。他们对创伤性脑损伤患者进行了检查,这些患者往往伴随脑室扩大,大脑似乎已经过早老化。分析显示,血液引流有一个与疾病相关的时间差,这种影响取决于患者的受伤年龄,对年轻人的影响很大,对晚年受伤的人的影响要小的多。“深静脉和浅静脉引流之间的时间不同步可能是两种原因导致的脑室增大的共同机制,作为新的生物标志可能有助于诊断和监测与年龄有关的活由脑损伤引起的常压脑积水。”由于脑积水引起的痴呆可以通过清除脑室内积聚的液体来逆转,因此早期诊断至关重要。核磁共振是一种非侵入性的检查,“我们希望,利用这一生物标志物检测大脑老化,能够成为日本人年度检查检查体系的一部分。”
厂商
2020.05.09
新技术准确呈现高速运动的精子细胞,有助体外受精
以色列特拉维夫大学的研究人员近日开发出一种安全又准确的3D成像方法,可以鉴定高速移动的精子细胞。这项研究由特拉维夫大学生物医学工程系的Natan Shaked教授领导,发表在《Science Advances》杂志上。有了这项新技术,医生能够在体外受精(IVF)的治疗过程中选择质量最高的精子,并采用显微操作技术直接将精子注射到卵细胞胞浆内,使卵子受精,从而增加女性怀孕和诞下健康婴儿的机会。体外受精技术的发明大大解决了生育问题。Shaked教授表示:“目前,最常见的体外受精类型是胞浆内精子注射(ICSI),这需要由临床胚胎学家选择精子并注射到女性卵子中。为此,人们精心挑选精子细胞,以便形成健康的胚胎。”在自然受精的情况下,最快到达卵子的精子通常被认为有着高质量的遗传物质。前向运动(progressive movement)使得“最佳”精子能够克服女性生殖系统的真正障碍。然而,胚胎学家却无法利用这种自然选择的过程。Shaked解释说:“精子细胞不仅行动迅速,而且在常规的光学显微镜下大多是透明的,而体外受精过程也不能够对细胞进行染色。现有的成像技术可能导致胚胎损伤,因此也是禁止的。在这种情况下,精子细胞的选择主要是依据其外部特征和运动活力,这与女性体内的自然环境有很大不同。”为此,研究人员希望开发出一种全新的成像技术,能够提供单个精子细胞的尽可能多的信息,并且不需要细胞染色来增强对比度。他们的目标是选择出最佳的精子,用于体外受精治疗。最终,他们选择了计算机断层扫描(CT)技术来完成精子细胞成像的独特任务。标准的计算机断层扫描是围绕对象旋转并发出X射线,产生多个投影,最终形成人体的3D图像。不过,精子的情况更复杂一点,因为无法围绕这个微小的物体旋转。于是研究人员就依靠精子本身的自然特征:它的头部在向前运动期间不断旋转。Shaked教授介绍,他们采用了弱光,而不是X射线,因此不会对细胞造成损伤。他们在超快运动的过程中记录了精子细胞的全息图,并根据其折射率确定了各种内部成分。这样,不需要染色,也能创建准确的动态图像。精子细胞的4D重建(图片来自原文)利用这种技术,研究人员能够以极高的分辨率获得精子的清晰CT图像。“我们能够在精子头部快速移动时对其进行高分辨率成像,而无需使用可能会影响胚胎的染色方法。这项新技术大大改善了体外精子细胞的选择,从而增加了女性怀孕和诞下健康婴儿的机会,”Shaked教授说。他打算利用这项技术来阐明精子的3D运动、结构和成分与受精能力和妊娠能力之间的关系,以帮助诊断男性的不育问题。他认为,这种成像技术未来有望应用在其他医学领域
厂商
2020.05.09
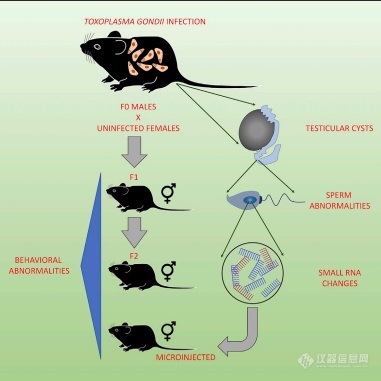
父亲感染弓形虫也会影响后代的大脑和行为健康
研究者在感染弓形虫的小鼠体内发现,精子携带的变化的“表观遗传”特征影响了后代的大脑,精子中的小RNA似乎会对后代的大脑发育和行为产生重大影响。《Cell Reports》上的最新研究向我们提出了一个问题,男性在生育前感染弓形虫(甚至是其他寄生虫感染)是否会影响后代健康?这项研究由Walter and Eliza Hall研究所的Shiraz Tyebji博士和Chris Tonkin副教授领导,并与Florey神经科学和心理健康研究所的Anthony Hannan教授合作。澳大利亚的研究人员发现,雄性小鼠感染弓形虫后,其精子中的小RNA水平发生变化,从而可能改变后代的基因表达。此前有报道称男性创伤导致精子表观遗传改变,与儿孙精神神经改变有关,这项研究增进了男性可能将寄生虫感染相关的改变传播给子女的可能性。弓形虫是全世界最常见的寄生虫之一,估计25%至80%的全球人口携带弓形虫,但大多数人的弓形虫感染病状很轻,相反,孕妇、婴儿和免疫力低下的人会经历更严重的感染。Tonkin副教授说,人们甚至可以携带弓形虫数十年,这与精神分裂症和双相情感障碍等精神障碍症状的出现有关。弓形虫感染已被证明会导致身体一系列细胞的长期表观遗传变化,这些变化不会影响和改变DNA序列,但会影响基因表达。“父亲的表观遗传变化,如创伤或吸烟,可能会影响他们的孩子,”Tyebji博士说。“通过研究感染弓形虫的雄性小鼠,研究人员将研究范围缩小到通过精子传递的表观遗传信息。”弓形虫在不同细胞内的形态“我们发现,弓形虫感染也会改变精子携带的DNA样分子(我们成为小RNA)的水平,”他说。“小RNA水平变化影响基因表达,乃至后代的大脑发育和行为。”“最让我们震惊的是,最初感染的雄性的孙子或孙女也会表现出行为上的变化,”Tyebji博士说。对公共卫生的影响Hannan教授说,我们首次找到证据表明,男性感染可导致表观遗传变化并传播给后代。虽然我们是在小鼠身上进行研究的,但它提出了一个重要的问题,即人类父亲在怀孕前的感染是否也会影响他们的孩子。“我们通常会更多地考虑女性感染性疾病对胎儿发育的影响,但也许男性的某些感染也会对后代的健康产生长期影响。“我们还在继续调查,包括研究人类的情况,以及弓形虫以外的感染SARS-CoV-2病毒的动物模型的情况,”Hannan教授说。“我们结合了十多年来对弓形虫感染及其对大脑发育影响的研究,Hannan教授的团队已经建立了专门知识,以了解表观遗传学在大脑发育和行为中的作用,”Tonkin副教授说。
厂商
2020.05.06
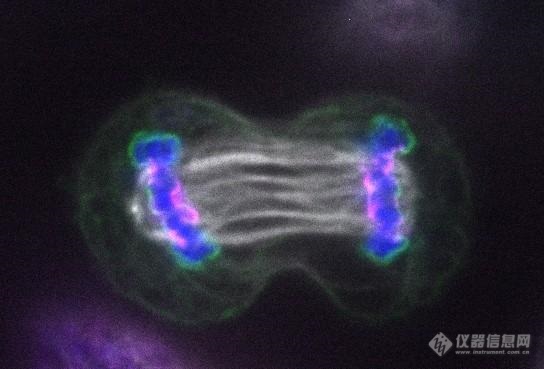
Nature深入有丝分裂过程,揭秘LEM2蛋白的作用
有丝分裂(mitosis)的过程,想必每个学(you)生(wen)物(hua)的人都不陌生吧。在此过程中,细胞必须将DNA片段(染色体)精确地分配到两个子细胞中。如果一个细胞的DNA拷贝不完整,或者DNA受损,则会导致遗传性疾病。近日,犹他大学Huntsman癌症研究所和加州大学旧金山分校的研究人员在《Nature》杂志上发表了一项成果,加深了我们对有丝分裂这个复杂过程的认识。Huntsman癌症研究所的Katharine Ullman博士和加州大学旧金山分校的Adam Frost领导了这项研究。他们发现,核膜蛋白LEM2在细胞分裂过程中发挥两个重要功能。首先,LEM2在细胞核的保护层上形成密封,让两组DNA免受损伤。其次,LEM2招募因子,来解聚那些负责分离DNA的微丝。为了观察LEM2在有丝分裂中的作用,研究人员利用彩色荧光标志物来标记不同组分:LEM2、微丝和DNA。他们对LEM2蛋白与微丝结合一直到微丝解聚的整个过程进行了拍摄。他们还观察到,LEM2蛋白集中在微丝穿过细胞核保护层的小孔处,并与其他蛋白质(内吞体分选转运复合物)形成凝胶状密封。这种LEM2参与形成的“O形环”有效密封了重新形成的核膜,防止每组DNA受到细胞核周围物质的损伤。Huntsman癌症研究所的Dollie LaJoie博士称:“利用我们的成像方法,我们能够观察到有丝分裂期间一个仅仅五分钟的过程,而这在以往是很难实现的。”她指出,这种新型的凝胶状结构可能对LEM2参与的其他细胞功能也很重要,包括高级的DNA结构。“两个团队利用不同的方法来解释LEM2的作用,从而使得项目更加高效,”Ullman说道。“我的研究小组专注于活细胞中的分裂过程,而Frost的研究小组则侧重于了解蛋白质本身的更多信息。”研究人员还发现,这些事件的破坏阻止了下游ESCRT的招募,并破坏了纺锤体的解聚,导致核完整性的缺陷和DNA损伤,这可能影响正常的细胞功能,甚至促进癌症的发展。“这项工作为确定DNA被破坏的新途径打开了一扇大门,”Ullman说。未来,两个实验室将继续研究细胞核的不正确形成和DNA损伤之间有何关联。他们将探索癌细胞缺乏哪些调节机制,进而影响细胞核的组装和修复。
厂商
2020.05.06
一把“双刃剑”插入两大细菌防御系统
细菌VS噬菌体,它们之间存在着永无止境的战争,为了保护自己免受恶意入侵,细菌学会了在基因组特定位置甲基化来标记自己的遗传物质,而未被标记的DNA(如噬菌体DNA)就会被一大群核酸内切酶识别、切割,最终降解,即细菌的限制修改(restriction modification,RM)系统。反过来,噬菌体也学会了利用DNA模拟蛋白来逃避RM系统,一种在化学上“看起来”像DNA的蛋白质可以与细菌限制性复合物结合,阻止其与真正的噬菌体DNA结合。Skoltech科技研究所的博士生Artem Isaev和来自特拉维夫大学(Tel Aviv University)和菲利普莫里斯国际研发中心(Philip Morris International R&D)的同事在《Nucleic Acids Research》上发表文章,证明T7噬菌体DNA模拟蛋白质Ocr实际上具有多面性,除了能抑制RM I 系统,还可以保护噬菌体免受另一套名为BREX(BacteRiophage EXclusion)的细菌防御机制影响。“5年前,我们就知道RM、CRISPR和毒素-抗毒素(Toxin-Antitoxin,TA)系统,但直到最近生物信息学告诉我们,这些只是细菌应对噬菌体感染所采取的多样性防御策略的一小部分。而BREX则属于一系列新被发现的防御系统,在微生物界它的占比约为十分之一,每十种微生物中就有一种含有BREX,在细菌中甚至比CRISPR更广泛。然而,BREX的基因功能还有六分之五有待解锁,”Isaev说。BREX对噬菌体DNA是简单地进行摧毁还是以某种方式抑制其复制,这些还不得而知,但几乎所有BREX机制都使用BrxX甲基转移酶,这种酶是标记细菌DNA以自我识别的酶,噬菌体的Ocr蛋白能与这种甲基转移酶结合,从而阻止BREX系统对宿主DNA的甲基化和对非甲基化噬菌体基因组的攻击。“我们证明了Ocr与甲基转移酶相互作用,并抑制了宿主DNA甲基化。理论上这会导致自身免疫反应:宿主DNA不再被标记为自身,那么BREX复合物就会攻击这些宿主DNA。然而,实际情况是Ocr表达后并没有出现自身毒性,说明Ocr也抑制了这些清缴复合物。BREX和RM系统之间还有其他相似之处,我们希望它们能帮助我们理解BREX的功能,”Isaev解释。其他DNA模拟蛋白似乎无法克服BREX防御,细菌防御系统主要处理DNA识别和操作,它们可以成为分子生物学和医学的有力工具——因为有了RM系统的发现和描述,分子克隆成为可能;CRISPR让人们跨入基因组编辑的革命时代。进一步研究Ocr究竟如何发挥作用将有可能招募这些新型抗菌剂来对抗耐药细菌。
厂商
2020.04.29
Cell Rep:细胞自主性调节皮层神经元极化的新机理
神经元(神经细胞)是神经系统的基本结构和功能单元。它们通常具有多根短而粗的树突以及一根长而细的轴突分别用于接收和输出生物信号。因此,神经元不论在形态还是功能上都是高度极性化的。神经元发育异常会导致精神或运动性疾病。树突-轴突极性的建立过程被称为神经元的极化。在小鼠胚胎大脑皮层发育的中晚期阶段,绝大多数皮层神经元 (锥体神经元)在脑室区经由放射状胶质细胞的不对称分裂诞生,并会沿着胶质细胞的径向突起朝外周皮层特定区域迁移。迁移过程中,它们会经历一个由“多极性”到“双极性”的形态转变,进而发育出树突与轴突。体外分离培养的皮层神经元同样可以发育形成多根树突和单根轴突,说明其具有一套细胞自主性的机制来建立和维持极性。微管的动态变化是神经元极化过程中细胞形态转变的效应器,改变微管动态性或排列方式足以影响神经元的极化过程。然而,目前只有少数微管调节因子能够在体内和体外的神经元极化中都发挥作用,它们在细胞内如何协作也不清楚。进一步研究提示Wdr47通过影响微管骨架来调控神经元极化:其基因缺失降低了极化早期神经突起末端朝向的微管的动态性,而在野生型神经元中过表达会抑制神经突起的伸长与轴突的分化,还能中和低剂量的微管稳定剂紫杉醇(Taxol)所诱导的神经突起过度生长和轴突的过度产生。中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)朱学良研究组发表了题为“Wdr47 controls neuronal polarization through the Camsap family microtubule minus-end-binding proteins”的研究论文,发现Wdr47蛋白通过影响Camsap家族蛋白的亚细胞定位选择性地调节微管动态性,从而调控胚胎发育过程中皮层神经元的极化。这一研究成果公布在4月21日的Cell Reports杂志上。Wdr47是一种具有WD40重复结构域的、高表达于中枢神经系统的蛋白质。在本研究中,结合基因敲除、子宫内胚胎电转以及体外神经元培养技术,研究人员证明了Wdr47是皮层神经元极化的关键细胞自主性调节因子。Wdr47基因缺失会在个体水平导致新生小鼠呼吸窘迫与死亡;在组织水平造成脑白质纤维束发育不全、侧脑室扩张及皮层分层紊乱;在细胞水平抑制皮层神经元的径向迁移与“多极性-双极性”转变,并使体外培养的神经元长出多根轴突。为探明其中机理,研究人员利用免疫共沉淀与质谱技术研究分析了Wdr47的相互作用蛋白质组,发现Wdr47可与微管负端结合蛋白Camsap家族相互作用,并可与Camsap3共同组织微管网络结构,而Camsap3的基因缺失也曾被报道会引起神经元生长多根轴突。Wdr47的缺失不会造成Camsap家族总体蛋白表达量的变化,但却在亚细胞定位水平影响了极化早期神经突起中Camsap3的积累。而且,Camsap1或3的过表达可在体内外系统中挽救Wdr47缺失造成的神经元极化缺陷表型。以上结果表明,在神经元极化的早期阶段,Wdr47通过与Camsap蛋白家族相互作用,精细调控细胞局部区域微管的动态性和网络结构,促进神经突起恰当的动态重塑,从而保障极化过程的顺利进行。该发现将有助于深入认识神经元轴突生长与分化的控制机理,以及新生儿呼吸窘迫症和相关神经疾病的发病机理。
厂商
2020.04.27
Science子刊:让卡路里燃烧得更快
德克萨斯州和宾夕法尼亚州的科学家发现了一种限制我们的细胞在饥饿期间转化糖和脂肪为能量的蛋白质传感器。科学家们说,这种传感器有可能被微调,以促进糖尿病、肥胖症和心血管疾病等代谢疾病患者的糖和脂肪转化,而这些患者需要干预降低体重,才能过上更健康的生活方式。这项研究发表在4月21日的《Science Signaling》杂志上。转换速度圣安东尼奥德克萨斯大学健康科学中心的Madesh Muniswamy博士是线粒体功能和特性研究的专家。这些细胞结构将糖和脂肪转化为化学能ATP。Muniswamy博士说:“我们希望为全世界数百万人面临的代谢危机提供解决方案。数以百万计的人吃太多的食物,而其他数以百万计的人则处于贫困之中,靠太少的食物为生。我们正在研究这两种情况下的分子水平,目的是开发一种药物进行干预。”我们的身体不断地用类似于公路和汽车的东西运输物质,脂肪和糖转化所需的载体名为线粒体钙单向传递体(MCU)。就像交通工具运输乘客到目的地一样,MCU移动能量的速度是精确计算的,如果速度太慢,就会出现肥胖等情况。如果太快,就会导致营养不良。Muniswamy博士说,为了身体健康,在任何时候都要按规定的速度行驶。道路看守人在《Science Signaling》文章中,Muniswamy博士和他的同事描述了另一个关键的组成部分,就像一名交警,控制着这条道路的活动。“我们发现了一种叫做MICU1的线粒体蛋白,它在这条道路上起着看门人的作用,”Muniswamy说。当营养水平较低时,MICU1会抑制通道活动,以防止过度的能量交易。“当你挨饿的时候,你为了活得更长,你不想燃烧掉你所有的糖和脂肪,所以MICU1减缓了活动,”Muniswamy说。相反的情况也是如此——如果道路交通开得太慢,MICU1就会加速。解除条件Muniswamy博士说:“在未来,我们可能计划设计一种新的药物来控制这种途径,从根本上缓解许多心血管和代谢综合征相关疾病。”他补充说:“当你加快通道的速度时,所有的糖和脂肪都会被燃烧,你就会瘦下来。”
厂商
2020.04.27
成年人学习和记忆的关键在于星形胶质细胞
贝勒医学院的研究人员揭示,大脑中最丰富的细胞星形胶质细胞在调节学习和记忆中涉及的神经回路中起着直接作用。这一发现发表在《Neuron》杂志上。“越来越清楚的是,在健康成人大脑中,星形胶质细胞远不止是支持细胞。它们在许多复杂和基本的功能中起着直接的作用,包括通过突触的神经元通讯和神经回路功能的调节,”文章通讯作者、贝勒干细胞和再生医学中心成员、神经外科教授Benjamin Deneen博士说。“在这项研究中,我们展示了星形胶质细胞在正常脑功能中的新作用。”以往的研究表明,星形胶质细胞具有独特的细胞、分子和功能特性。它们占据不同的大脑区域,显示出区域特殊性。有证据表明转录因子——参与控制基因表达的蛋白质——调节星形胶质细胞的多样性。Deneen和他的同事们希望更好地了解一种已知的星形胶质细胞发育调节因子NFIA在成年小鼠脑功能中的作用。研究人员使用了一种小鼠模型,通过基因工程在整个大脑缺失成年星形胶质细胞NFIA基因。然后分析了几个大脑区域,寻找星形胶质细胞形态学、生理学和基因表达特征的改变。“我们发现NFIA缺陷的星形胶质细胞呈现出缺陷的形状和功能改变,”Deneen说。“令人惊讶的是,尽管NFIA基因在所有脑区都被清除了,但只有海马区的星形胶质细胞发生了严重的改变。其他区域,如大脑皮层和脑干,没有受到影响。”海马中的星形胶质细胞也有较少的钙活性——钙是星形胶质细胞功能的指标——以及识别神经元释放的神经递质的能力降低。NFIA缺陷的星形胶质细胞与神经元的联系也不如正常的星形胶质细胞。,所有这些形态和功能的改变都与动物学习和记忆能力的缺陷有关,这提供了第一个证据,证明星形胶质细胞在某种程度上控制了介导学习和记忆的神经回路。“大脑中的星形胶质细胞在生理上接近神经元,并与神经元交流。神经元释放出星形胶质细胞能够检测和响应的分子,我们认为NFIA缺陷的星形胶质细胞不能像正常的星形胶质细胞一样‘听’神经元,因此,它们不能通过提供有效的记忆电路功能和神经元传递所需的支持来做出适当的反应。因此,电路中断,导致学习和记忆受损。”
厂商
2020.04.26
方法并不难,在实验室中轻松生成角膜组织
目前,全球大约有2000万因角膜病致盲的患者,而我国就有400-500万,且这个数字还在逐年增加。角膜移植就是用正常的角膜替换病变的角膜,使患者复明或控制角膜病变。然而,角膜资源很紧张,患者往往需要等待较长时间。日本大阪大学的研究人员近日开发出一种新方法,能够在实验室中更轻松地生成角膜组织。这项发表在《Stem Cell Reports》上的研究表明,他们能够在特定的蛋白质上培养人诱导多能干细胞(hiPSC),获得纯的角膜上皮细胞(iCEC),并生成有望用于治疗的角膜组织。理论上说,hiPSC有望发育成人体内的任何细胞。然而,利用hiPSC进行的组织发育仍会模拟胚胎发育的过程。这就意味着,hiPSC将定向发育成由不同类型细胞构成的组织,也就是形成混合物。眼睛是由角膜、神经元、视网膜等细胞组成的。因此,通过培养hiPSC很难形成纯的角膜。近年来,尽管利用hiPSC的再生医学已经取得了很大进展,但仍然缺乏借助hiPSC生成角膜的可靠方法。这篇文章的通讯作者Ryuhei Hayashi表示:“角膜是眼睛内极其重要的部分,可以帮助我们清晰地看到世界。不幸的是,由于受伤或发炎造成的角膜损伤很难治疗。我们的目标是开发一种新颖的方法来生成用于治疗的角膜薄片,而无需使用昂贵的设备。”为了实现该目标,研究人员利用hiPSC生成眼细胞,并在五种类型的层粘连蛋白(laminin)上培养它们。他们发现,角膜上皮细胞对五种层粘连蛋白中的三种(LN332/411/511)有很强的粘附力,而非角膜上皮细胞倾向于结合LN211这种特定类型的层粘连蛋白。他们随后发现,各种眼细胞之间的差异来源于整合素(integrin)的差异,这种在细胞表面表达的蛋白质将细胞与外界蛋白质(如层粘连细胞)相关联。LN332这种层粘连蛋白除了能够促进角膜上皮细胞的结合,还促进其增殖,使得角膜上皮细胞在培养中处于优势地位,从而提高其纯度。“尽管LN332似乎是角膜上皮细胞生长的最佳底物,但不足以达到生产治疗用角膜的高纯度,”第一作者Shun Shibata谈道。图片来自原文于是,研究人员转向了磁珠细胞分选(MACS)。他们首先去除了产生CD200蛋白的细胞,然后从CD200- 细胞群体中选择了带有表面标志物SSEA-4的细胞。通过这种方式,他们分离出大部分的角膜上皮细胞((SSEA-4+/ITGB4+/CD200-)。为了获得高纯度的细胞,他们接着在LN221和LN332底物上培养这些细胞,以便进一步去除非角膜上皮细胞。最终,他们获得了高纯度的角膜细胞薄片。“这些结果表明,我们的新方法再加上MACS技术,可从人类干细胞中轻松产生角膜组织,”Hayashi表示。“我们的愿望是在临床环境中推动再生医学的发展
厂商
2020.04.26
Nature:早出现的一个癌症驱动基因突变
Sanger研究所,剑桥大学等处完成的一项新研究表明,子宫内壁的许多细胞都有携带“驱动癌症”的突变,这些突变在生命的早期就经常出现。该研究小组对健康的人类子宫内膜进行了全基因组测序,全面概述了该组织中DNA变化的速率和模式。这一成果公布在今天(2020年4月23日)的Nature杂志上,提出了有关子宫癌发展最早阶段的新见解。子宫内膜简而言之就是子宫的内部,通常称为endometrium。它受到雌激素和孕激素等激素的调节,在童年,生殖年,怀孕和绝经后进入不同的状态。研究人员首先使用激光捕获显微镜从28名19至81岁女性捐赠的子宫组织样品中分离出292个子宫内膜腺体,然后对每个腺体的DNA进行全基因组测序,接着研究小组将它们与来自同一个体其他组织的全基因组序列进行比较,在每个腺体中搜索体细胞突变。所有癌症的发生都是由于DNA的变化(称为体细胞突变)引起的,这种变化在我们的整个生命周期中,所有细胞中不断的发生。这些体细胞突变中的一小部分可导致正常细胞转变为癌细胞,被称为“驱动基因”突变,这个过程发生在“癌症”基因子集中。这项研究使用全基因组测序,更好地了解健康的子宫内膜组织的遗传变化。该团队开发了对子宫内膜上皮中单个腺体少量细胞基因组进行测序的技术,子宫内膜上皮是在女性月经周期中脱落并再生的组织层。研究人员发现,即使在显微镜下看起来完全正常的细胞,也有很高比例会带有驱动突变。这些驱动突变中有许多似乎是在生命早期出现的,在许多情况下是在儿童时期。Sanger研究所的Luiza Moore博士说:“人类子宫内膜是一种高度动态的组织,在女性生殖年期间经历了许多重塑周期。我们发现正常子宫内膜中经常发生癌症驱动突变,并显示出许多此类事件这些突变干细胞会在生命的早期发生,有时甚至在青春期之前。随着时间的流逝,这些突变干细胞会进一步积累驱动程序突变。”尽管最早出现了第一个癌症驱动基因突变,但是细胞要花几十年的时间才能积累剩余的驱动基因,导致浸润性癌症。通常,在同一细胞中需要三到六个驱动突变才能形成癌症。因此,绝大多数具有驱动突变的正常细胞从未转化为浸润性癌症。几十年来,子宫癌的发病率一直在稳步上升,因此知道何时以及为什么遗传变化与之相关癌症的发生对于帮助扭转这一趋势至关重要。这项研究中采用的正常组织中DNA突变的新技术和方法为深入研究将正常细胞转化为癌细胞的遗传变化提供了深刻的见解。结果表明,尽管大多数癌症都发生在相对较高的年龄,但构成其基础的基因改变可能早于生命开始,而且我们一生的大部分时间都在伏着正在发展的癌症。”
厂商
2020.04.23
Nature子刊:细菌Ⅵ型分泌系统作用新机制
微生物广泛存在于自然环境中或寄主体内,相应也进化出了多种与其他物种竞争的策略。Ⅵ型蛋白分泌系统(T6SS)是大多数革兰氏阴性致病菌与环境中其他微生物竞争及感染宿主的重要“武器”。T6SS 能够通过直接接触将具有抗菌活性或细胞毒性的效应蛋白注射到受体细胞内。T6SS效应蛋白往往具有不同的大小、结构和功能特性,因此对其分泌机制的解析一直是领域内的热点和难点。近日来自上海交通大学生命科学技术学院、微生物代谢国家重点实验室董涛团队发表了题为“Intramolecular chaperone-mediated secretion of an Rhs effector toxin by a type VI secretion system”的文章,发现细菌Ⅵ型分泌系统(T6SS)可以分泌一种新型的具有分子内伴侣的核酸酶毒素,并揭示了该毒素蛋白的分泌和自剪切机制。这一研究发现公布在Nature Communications杂志上,文章通讯作者为董涛研究员,一作为上海交通大学博士研究生裴同同、李浩和硕士研究生梁小夜。本文是董涛团队自2019年11月在PNAS和2020年2月在Nature Microbiology上发表的研究结果的延续和扩展,深化了领域对效应蛋白的分泌机制和功能的研究,并为下一步对T6SS进行合成生物学工具化改造和应用有重要的推动作用。在这篇文章中,研究人员在致病性气单胞菌Aeromonas dhakensis中发现了首个能够自我剪切的T6SS效应蛋白TseI。通过多种生化和遗传突变实验,作者发现TseI表达时能够自剪切为三个片段(N、 Rhs 和 C)。C端是一个核酸酶毒素,而N端和 Rhs在剪切后能够作为伴侣蛋白与C端毒素非共价结合。在N端和Rhs的辅助作用下,C端毒素能够通过T6SS分泌到受体细菌内至其死亡。此外,该研究还在包括铜绿假单胞菌、丁香假单胞菌和副溶血弧菌等多种病原微生物中发现了具有类似特性的T6SS效应蛋白。因此,作者将TseI及其同源蛋白定义为一类新型的含分子内伴侣的自剪切效应蛋白。
厂商
2020.04.22
PNAS:Mito-Fu或能延长人类健康寿命
人类健康寿命(Health Span)是指他健康的时间长度,而不仅仅是活着的时间。近期来自上海交通大学药学院傅磊课题组阶段性地完成了“通过化学手段干预线粒体活性”的研究,在PNAS杂志上刊出文章 “Moderation of mitochondrial respiration mitigates metabolic syndrome of aging” 。在这篇文章中,上海交通大学和斯坦福大学的科学家们设计了一类新化合物,2-(2-(4-甲基噻唑-5-基)乙氧基)-2-氧乙基三唑的三苯基膦衍生物(简称TPP-噻唑,是Mito-Fu家族的成员)。在小鼠体内,这类化合物能精准地靶向线粒体,缓解衰老相关的疾病,阻止年龄相关性肥胖和血糖并发症的发生,并延长小鼠健康寿命。该论文的通讯作者、上海交通大学药学院傅磊教授说,“我们发现了一种独特的作用机制,它可以提高模型动物的线粒体数量和质量。从小鼠身上观察到的这些令人信服的结果表明,基于这种独特的机制,这类化合物值得进一步研究,并会有许多潜在的临床应用。”斯坦福大学的Collman教授强调:“这项研究报道了一种新型、无害的药物,它能抑制小鼠的呼吸,大大降低衰老的不利影响,并促进新的线粒体产生。线粒体是所有依赖空气生存动物的能量工厂。Mito-Fu是一类水溶性化合物,还可以用来治疗II型糖尿病和炎症相关的疾病。”线粒体存在于真核细胞,它将营养物质转化为能量,但线粒体的功能会随年龄增加而衰退。该研究论文的第一作者,傅磊课题组的博士研究生M. Tavallaie解释道:“线粒体就像体内的发电机,提供细胞运行所需的能量,但同时也会产生有害的‘副产物’。这些副产物会加速衰老,引起年龄相关性疾病。因此,我们通过干预细胞器,诱导有规律的停顿,使它们恢复活力。”这项研究源自于一类仿生化合物的合成,该化合物模拟线粒体中的细胞色素c氧化酶(CcO)。基于这种模拟酶,斯坦福大学Collman教授的研究团队发现了一系列新的化合物[2-6]。在这篇PNAS文章中,傅磊教授的研究小组将60只雄性小鼠随机分为给药组和对照组,在18个月的给药过程中,研究人员检测了线粒体的多项功能,如呼吸能力、线粒体生物能量和生物合成,以及一些与衰老相关的指标,包括小鼠的活性氧化物(ROS)生成、葡萄糖异常和肥胖。研究结果表明,慢性中度抑制CcO可减少ATP合成,促进线粒体生成和线粒体自噬,从而减少ROS生成和线粒体衰退,调控重要的细胞能量代谢调节因子;因此,该化合物可以有效地调节能量平衡,抑制肥胖和与衰老相关的葡萄糖异常。“我们已经证明,Mito-Fu系列的一个成员可以促进新陈代谢,缓解衰老并发症。新的衍生化合物正在进一步的研究中。未来的研究会在更大的动物身上测试这些药物,并最终用到人身上。”傅磊教授说到,“目前我们已经合成了大量具有活性的低毒性小分子化合物,还发现了提高这类新药活性的简单策略。深入了解其作用机制使我们能够开发出活性更好的化合物,针对特定疾病予以临床干预。”
厂商
2020.04.21
Science:生成和销毁同样重要
mRNAs是细胞蛋白质合成的程序,其功能和寿命都是动态调节的。慕尼黑路德维希马克西米利安斯大学(LMU)的研究人员现在证明,为什么那些更难破译的mRNAs比其他的寿命更短。基因表达调控是生命系统的基本组成部分,它决定了每个细胞DNA基因组中编码的遗传信息如何被选择性地转录成信使RNA(mRNAs),然后被核糖体翻译成蛋白质。因为在细胞中合成的一组蛋白质决定了它的结构和生化能力,所以这个过程中的每一步都必须受到严格的调控。该管理系统的一个模块专门用于根据不断变化的条件及时销毁mRNAs。由LMU基因中心的Roland Beckmann教授领导的一个国际研究小组,与Jeff Coller(美国凯斯西储大学)和Toshifumi Inada(日本东北大学)合作,研究出了一种参与mRNA降解的蛋白质复合物的详细结构,并剖析了它的行为方式。这项新的研究成果发表在《Science》杂志上,它解释了mRNA分子的寿命如何以及为什么与它所编码的蛋白质的合成速度有关。Beckmann研究小组的博士生、这篇新论文的主要作者Robert Buschauer说:“统计数据已经表明,mRNA的寿命与核糖体蛋白质合成的速度有关。但这种关系的分子基础是完全未知的。”蛋白质合成的效率很大程度上取决于核糖体对mRNAs核苷酸序列中编码指令的阅读能力。这些程序是用遗传密码的语言编写的。核苷酸的密码子指定组成蛋白质的不同氨基酸连接在一起的顺序。每一组必需的氨基酸通过一种叫做tRNA的衔接分子传递到核糖体。每个tRNA还配备了一个核苷酸三联体(反密码子),它能识别mRNA中的对应物,这种相互作用使其氨基酸货物能够被插入到生长着的蛋白的正确位置。遗传密码是多余的:几乎所有的氨基酸都是由几个核苷酸三联体指定的,这些核苷酸三联体由核糖体以不同的效率读取。如果一个给定的三联体很难阅读,核糖体需要更长的时间来选择合适的含有所需氨基酸的tRNA。新的研究确定了这种延迟与mRNAs降解之间联系的机制基础。“借助低温电子显微镜,我们能够证明,只有在tRNA结合位点不被占据的情况下,mRNA降解所需的关键蛋白质复合物才能与核糖体相互作用。”这一发现解释了为什么mRNA分子在核糖体上被降解的概率随着其所含低效率解码密码子的比例而增加。“这种新发现的相互作用对mRNA降解和核糖体效率之间的耦合至关重要,”Beckmann说。“mRNAs的销毁是一个重要的过程,其核心成分在酵母和人类细胞中差别很小。任何错误都可能导致神经退行性疾病、癌症或其他严重疾病。因此,更好地理解潜在的机制是开发更有效的治疗方法的先决条件。”
厂商
2020.04.21
光闻味就会胖?新研究揭示嗅觉与脂肪代谢之间的关系
贝勒医学院衰老研究中心的Ayse Sena Mutlu博士提出了一个有趣的问题:有没有可能在不改变饮食习惯的情况下改变身体脂肪储备?Mutlu和她的同事对实验室线虫进行了一次大范围的筛选,以研究神经元是否能够在不影响饮食习惯的情况下,主动地发送信号,从而改变脂质代谢。“我们原本期望结果与味觉或与饮食有关,但非常令人惊讶的是,脂质代谢实际上与嗅觉有关,”Mutlu说,她在分子和人类遗传学教授Meng Wang博士的实验室工作。气味如何影响脂肪储存?嗅觉和脂肪代谢之间的联系并不新鲜,但其内在机制仍不清楚。Mutlu解释说,嗅觉感知是复杂和高度调节的。“环境中有许多气味可以被特定的嗅觉神经元通过特定的受体检测到。嗅觉神经元将这些信息传递给中间神经元,中间神经元将这些信息解释为指令指挥其他神经元和外周组织。秀丽隐杆线虫的嗅觉感知比人类等大型生物更简单,这有助于Mutlu和她的同事研究嗅觉如何调节身体过程。实验室线虫有三对嗅觉神经元,它们能探测各种空气气味。一些气味能选择性地激活或抑制一个嗅觉神经元,而另一些气味则能刺激一组神经元。研究人员测试了几种气味,发现某些气味通过特定的受体与特定的嗅觉神经元相互作用来动态调节脂肪的运动。利用光遗传学实验室方法,用光激活或抑制这些神经元,研究人员能够分别促进脂肪储存的减少或增加。他们还证明了神经元通过选择性神经回路和神经内分泌途径直接调节脂肪代谢。“我们的发现为脂质代谢的调节带来了一个新的视角,可能有助于理解为什么有些人对代谢问题的抵抗力更强,而另一些人则更脆弱,”Wang说。此外,这些发现与嗅觉、脂肪代谢和神经退行性疾病之间的某些观察结果有关。Mutlu说:“例如,我们知道阿尔茨海默病患者往往有代谢问题。我们的研究表明,每个人所能感知到的气味与他或她的肥胖易感性之间存在联系。”“虽然还需要更多的研究,我们的发现表明某些气味可能会引发脂肪代谢的变化,从而导致体重下降,”Wang说。“未来,我们可能不仅要注意吃什么,还要注意闻什么。”
厂商
2020.04.20
男性自闭症为什么比女性多?
斯克里普斯(Scripps)研究所的科学家们的一项新研究表明,许多自闭症谱系障碍(ASD)病例可能是由于免疫细胞问题造成的,这些免疫细胞不能很好地完成修剪早期不需要的大脑连接任务。这项研究发表《Nature Communications》杂志上,报道了一系列基因突变的影响,尽管这些突变在自闭症中所占比例很小。已知突变会导致脑细胞中许多蛋白质的普遍过量生产,但过量生产如何导致自闭症行为一直是个谜。证据表明,蛋白质过多产生最相关的影响发生在小胶质细胞中。随着儿童时期大脑的发育,这些细胞通常会剪除不需要的大脑连接或突触。科学家们在老鼠身上研究发现,蛋白质的过度分泌会损害小胶质细胞,从而妨碍它们的突触修剪功能,但只在雄性老鼠身上导致类似自闭症的社交行为缺陷。这一发现与长期以来的观察结果相吻合,即男性自闭症的发病率是女性的4到5倍。这也与最近的证据一致,即患有自闭症的人,大脑通常比正常人有更多的突触。“我们的研究表明,至少在某些情况下,小胶质细胞的损伤在自闭症行为的发展中起着关键作用,可能有助于解释男性孤独症发病率更高的原因,”本文通讯作者、斯克里普斯研究所神经科学系教授Baoji Xu博士说。“这反过来表明,小胶质细胞可能是预防或治疗自闭症谱系障碍药物的良好靶点。”估计有2.4%的男孩和0.5%的女孩患有自闭症。患者涉及各种异常,包括社交技能缺陷、重复行为以及对声音和光线的过敏。研究表明,这些疾病主要是遗传性的,但可能是由多种不同基因单独或联合作用引起的。迄今为止,已有超过100个基因突变和变异与自闭症有关。一组自闭症相关基因异常——包括PTEN、TSC1、TSC2和FMR1基因突变——约占ASD病例的3%。这些异常的共同作用是破坏一条通常调节细胞内蛋白质生成水平的途径,从而使蛋白质生成增加。Xu和他的团队试图确定大脑中是否存在一种特殊的细胞类型,解释高蛋白的产生和类ASD行为之间的联系。他们一次只让老鼠在一种细胞中制造出一种异常高水平的eIF4E蛋白质生产因子。高水平的eIF4E被认为是连接PTEN、TSC1和其他增加蛋白质生产的自闭症突变的常见事件之一。研究小组发现,当小胶质细胞中出现高水平的eIF4E时,老鼠在社交行为中会出现ASD样异常,以及认知缺陷和重复行为。奇怪的是,尽管雄性和雌性老鼠的小胶质细胞中的蛋白质产量都有所增加,但ASD样异常只发生在雄性老鼠身上。当高eIF4E水平出现在神经元或辅助细胞(称为星形胶质细胞)中时,同样的行为异常根本没有出现,尽管高eIF4E水平的老鼠表现出更多的焦虑样行为。研究人员检查了受影响的小胶质细胞,寻找这些细胞中蛋白质合成增加如何导致类似自闭症的行为改变的线索。他们发现,在年轻的雄性老鼠中,重要脑区(包括内侧前额叶皮质、海马和纹状体)的小胶质细胞明显更大,数量也更多,而在雌性老鼠中,这些变化更为微妙和短暂。大脑发育过程中的小胶质细胞通常会剪除未使用或不需要的突触。Xu和同事发现,在小胶质细胞高eIF4E的雄性ASD样老鼠中,突触数量比正常老鼠多,这表明存在剪枝缺陷——这种模式也被认为广泛存在于自闭症患者中。实验还显示,这些细胞缺乏通常的运动能力,这将影响它们执行突触修剪功能。Xu和同事怀疑,小胶质细胞运动能力的降低可能是最重要的因素,因此总的来说,这些细胞的突触修剪能力受损,导致类似ASD的大脑改变。研究人员现在正在跟进研究,以准确地发现为什么蛋白质增加对雄性小胶质细胞的影响比雌性大得多。这一发现最终可能解释自闭症的性别差异之谜,并可能为自闭症治疗提供新的靶点。
厂商
2020.04.17
《Cell》干细胞专家发现了慢性阻塞性肺病的致病元凶
两位国际知名干细胞专家发现,生物和生物化学教授、干细胞中心主任Frank McKeo和该中心研究副教授Wa Xian,利用肺干细胞的单细胞克隆技术发现慢性阻塞性肺病(COPD)患者的肺部有大量异常干细胞。如今,研究人员可以把这些细胞作为新疗法的靶点,从而挽救全球无数患者性命。“我们发现,在所有COPD患者中,有三种变异细胞驱动了疾病的所有关键特征:一种产生大量的粘液蛋白,堵塞小气道,而另外两种则导致纤维化和炎症,共同降低肺功能,”最新发表的《Cell》文章作者,Xian副教授写道。“尽管这些患者有正常的干细胞,虽然数量不多,但还是受这三种变异细胞驱动导致了疾病。”慢性阻塞性肺病(COPD)是一种以慢性支气管炎、小气道阻塞、炎症、肺泡纤维化和破坏为特征的肺部进行性炎症性疾病,肺泡内的微小气囊负责交换血液中的氧和二氧化碳分子。全球疾病负担研究报告显示,2016年全球共有2.51亿例COPD病例。“这是一种令人沮丧的疾病。我们可以尝试改善症状,但我们没有任何东西可以治愈疾病或防止死亡,”UConn Health的肺科医生和重症监护医生Mark Metersky说,他在这项研究中负责在进行支气管镜检查时从肺液中收集干细胞。尽管慢性阻塞性肺病比地球上任何一种疾病的死亡率都要高,但对其根本原因的研究却相对较少。在过去的十年,Xian和McKeo开发了克隆肺和气道干细胞的技术,并从那时起一直在研究,他们注意到气道的不同部分会产生不同的干细胞,这些干细胞相互关联但又可以区分。“真了不起,”McKeo说。“在肺的深处,远端气道干细胞产生了远端气管和肺泡,我们的研究表明,这些干细胞使肺部能够自行再生。”2011年,Xian和McKeon在受H1N1感染后的患者体内发现了肺的再生。与正常肺相比,慢性阻塞性肺病的肺被三种异常变异的肺干细胞所淹没,这些细胞致力于形成一种已知存在于慢性阻塞性肺病肺中的化生病变,但许多人认为这是一种与慢性阻塞性肺病的病理学没有因果关系的继发效应。研究小组的博士后研究员Wei Rao将每一个COPD克隆体移植到免疫缺陷的模型身上后,研究小组发现它们不仅引起了COPD明显的化生损害,而且还分别引发了包括粘液高分泌、纤维化和慢性炎症在内的COPD三联病变。“事实上,长期被忽视的慢性阻塞性肺病的化生损害是导致这种疾病的原因,而不仅仅是疾病的次要后果,”McKeon说。现在,研究小组终于找到了引起炎症、纤维化和小气道阻塞的细胞的特性,他们正在努力对这些细胞进行药物样分子库筛选,以发现新的治疗方法。Xian说:“我们现在知道导致COPD病理的特定细胞,我们可以用特定的药物来靶向它们,就像靶向癌症一样,选择性地杀死它们,让正常细胞再生正常的肺组织。”
厂商
2020.04.17
神奇的糖!Nature发现糖如何通过肠道-大脑通路让人上瘾
糖也许对不少人来说是致命的诱惑,从饼干到调味品再到奶油摩卡咖啡,但是迄今为止,科学家们还不清楚这种神奇分子为何会对人体产生如此大的吸引力。糖和其它味觉因子一样,都能在舌头上引发特殊的神经反射,最新一项研究发现了一条完全独立的,开始于肠道的神经系统途径,指出糖具有通往大脑的反向通道。这一发现公布在4月15日的Nature杂志上,由霍华德休斯医学研究所研究员Charles Zuker领导完成。研究小组在小鼠身上进行的实验表明,在肠道中有到达大脑的信号传播,这种肠道到大脑的通路途径似乎很挑剔,仅对糖分子反应,而对人造甜味剂不反应。早期科学家已经知晓糖对大脑具有独特的控制作用。例如,2008年的一项研究表明,没有品尝甜味能力的小鼠仍会选择糖。而Zuker团队发现了一种糖感应途径,这有助于解释为什么糖很特别,从而有助于我们找到停止其上瘾的方法。哥伦比亚大学的神经科学家Zuker说:“我们需要将甜和糖的概念区分开来。前者让人喜欢,而后者则是被需要的。这项新工作揭示了偏好糖的神经基础。”甜的东西糖这一词很笼统,涵盖了我们身体用作燃料的多种物质。吃糖会激活大脑的奖励系统,使人和小鼠都感觉良好。然而,在一个精制糖丰富的世界中,这种食欲可能并不利于我们的健康——研究已将过量的糖消耗与许多健康问题(包括肥胖症和2型糖尿病)联系了起来。此前,Zuker的工作表明糖和人造甜味剂可能开启了相同的味觉系统上。一旦进入口腔,这些分子就会激活味蕾上的甜味受体,从而引发信号,传递至处理甜味的大脑部分。但是糖与人工甜味剂的行为影响并不相同。研究人员针对甜味剂Acesulfame K进行了测试,小鼠先喝了含有甜味剂或糖的水,但两天内几乎全部换成了糖水。糖通路研究人员发现通过可视化观察小鼠食用糖、人造甜味剂或水时的大脑活动,首次确定了有一部分大脑区域仅对糖有反应:孤束核尾部(caudal nucleus of the solitary tract,cNST)。 cNST位于大脑干中,与小鼠加工味觉的地方不同,是有关人体状态信息的枢纽。研究小组确定,通向cNST的通路始于肠壁。在那里,传感器分子发出通过迷走神经传播的信号,该信号提供了从肠道到大脑的直接信息。这种肠道到大脑的通路喜欢糖的一种形式:葡萄糖和类似的分子。它忽略了人造甜味剂,这也许可以解释为什么这些添加剂似乎不能完全复制糖的吸引力。它还忽略了水果中发现的其他一些类型的糖,尤其是果糖。葡萄糖是所有生物的能量来源。以前,科学家推测糖的能量或卡路里可以解释其吸引力,因为许多人造甜味剂都缺乏卡路里。但是,Zuker的研究表明情况并非如此,因为不含卡路里的类葡萄糖分子也可以激活肠到脑的糖通量途径。为了更好地理解大脑对糖的强烈偏爱是如何发展的,研究小组分析了这种肠-脑糖通路与其他大脑系统(例如涉及奖励,进食和情感的系统)之间的联系。尽管他的研究是在小鼠中进行的,但Zuker认为,人体中也存在相同的葡萄糖传感途径。“发现这种通路有助于解释糖是如何直接影响我们的大脑的。这也提出了新的潜在靶标,可以帮助减少我们对糖的上瘾需求。”
厂商
2020.04.16
Nature:跳过干细胞中间步骤,直接重编程恢复视力的新技术
来自北德克萨斯大学等处的研究人员发现了一种将皮肤细胞直接重编程为可用于恢复视觉的光敏细胞的新技术,研究证实实验室制造的细胞能使失明小鼠检测到光线。这一成果公布在4月15日Nature杂志上。迄今为止,研究人员已经通过在皮肤或血细胞中构建干细胞,将这些干细胞编程为感光细胞,然后将其移植到眼中。而在这项新研究中,科学家表明可以跳过干细胞的中间步骤,直接将皮肤细胞重编程为感光细胞,然后移植到视网膜中。“这是第一项表明直接重编程可以产生视网膜样细胞的研究,提供了一种新的,更快的策略来开发针对年龄相关性黄斑变性和其他由光感受器丢失引起的视网膜疾病的疗法。” 文章作者Anand Swaroop博士说。在过去的十年中,科学家对诱导性多能干细胞(iPS)进行了广泛研究。 这种细胞是在实验室中由成年细胞开发而来,可用于制造几乎任何类型的替代细胞或组织。但是,iPS细胞重编程方案可能需要六个月的时间才能将细胞或组织准备好进行移植。相比之下,最新研究中描述的直接重编程将皮肤细胞转变为功能性光感受细胞,仅需10天即可移植。文章通讯作者Sai Chavala博士说:“我们的技术直接从皮肤细胞转变为感光细胞,无需两者之间的干细胞。”直接重编程技术是将皮肤细胞浸入五种小分子化合物的混合物中,这些小分子化合物化学上介导与视杆细胞有关的分子途径。之后研究人员进行了基因表达谱分析,结果表明新细胞表达的基因与真实视杆细胞表达的基因相似。同时,与皮肤细胞功能有关的基因也被下调。研究人员将这些细胞移植到视网膜变性的小鼠中,然后测试它们的瞳孔反射,这是移植后光感受器功能的一种检测方式。在弱光条件下,瞳孔收缩取决于视杆感光器功能。在移植的一个月内,与未经治疗的对照组相比,在低光下14只动物中有6只(43%)表现出强烈的瞳孔收缩。而且,与没有瞳孔反应和未治疗的对照组的治疗小鼠相比,瞳孔收缩的小鼠明显可以在暗处生活。偏爱黑暗空间是一种需要视觉的行为,反映了小鼠自然寻找安全,黑暗位置而不是明亮位置的自然趋势。“即使是视网膜严重退化的小鼠,几乎没有保留活的感光细胞,也能对移植产生反应。这些发现表明,观察到的视觉改善是由于实验室制造的感光细胞,而不是由于宿主健康辅助作用。”移植后三个月,免疫荧光研究证实了实验室制造的感光细胞存活,以及它们与内视网膜神经元产生了突触连接。重要的是,研究人员研究了这种直接重编程是如何在细胞水平上介导的。这些见解将帮助研究人员不仅将该技术应用于视网膜,而且应用于许多其他细胞类型。作者指出,如果能够提高这种直接转化的效率,那么这可能会大大减少开发潜在的细胞疗法产品或疾病模型所花费的时间。
厂商
2020.04.16