搜全站
搜展位
血管生成protocol|利用层粘连蛋白-胶原蛋白进行成管实验
当在内皮细胞上接种到类似基底膜的表面时,它们在体外形成类似毛细血管的结构,再现了血管生成的过程。这种管形成实验被用作血管生成的体外模型系统,以研究特定物质的促血管生成或抗血管生成效果。
Matrigel®是从Engelbreth-Holm-Swarm小鼠肉瘤中提取的,并作为标准的基底膜样(BM)表面。然而,Matrigel®的一个缺点是其多种BM蛋白的成分定义不清且可变。这导致不同批次之间的机械和生化性质波动,阻碍了可靠的重现性和可比性。
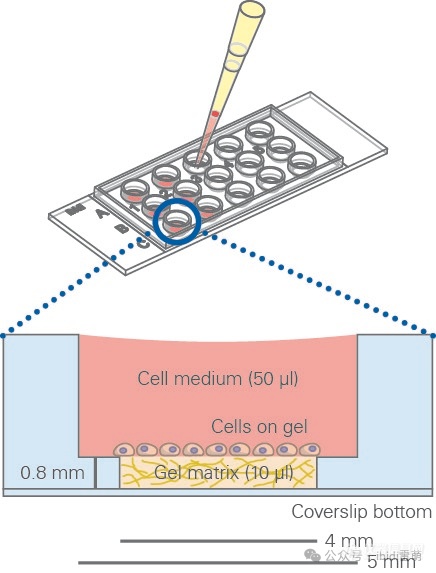
µ-Slide 15 Well 3D的示意图。ibidi 的“孔中孔” 技术避免了凝胶弯液面的形成,从而形成了一个平坦的细胞生长区域.
本实验应用描述了一种使用层粘连蛋白-I型胶原凝胶(代替Matrigel®)在µ-Slide 15 Well 3D中进行管形成试验的实验方案。这种定义明确的双组分层粘连蛋白-I型胶原凝胶能够可靠地重复形成类似毛细血管的结构,可以作为Matrigel®的替代品。本应用不讨论凝胶之间差异的详细分析。欲了解更多信息,请阅读相关文件和文献。
相关文献:
•Rüdiger D, Kick K, Goychuk A, et al. Cell-Based Strain Remodeling of a Nonfibrous Matrix as an Organizing Principle for Vasculogenesis. Cell Rep.2020 Aug 11; 32(6):108015.doi:10.1016/j.celrep.2020.108015.
1、材料
1.1.试剂和缓冲液
• 人脐静脉内皮细胞(HUVEC, C-12203, PromoCell)
• 内皮细胞生长培养基(C-22010, PromoCell)
• Collagen I, Rat Tail, 非胃蛋白酶化,5 mg/ml(50201, ibidi)
• Collagen I, Bovine, 非胃蛋白酶化,5 mg/ml(50301, ibidi)
• Cultrex 3-D 培养基质层粘连蛋白I 6 mg/ml(3446-005-01, R&D Systems)
• 10x PBS(70011-044, Gibco)
• NaOH在超纯水中,1.25 M和7 M
• 乙酸,0.1 M和17.5 mM
1.2.设备

• µ-Slide 15 Well 3D, ibiTreat(81506, ibidi)
• µ-Slide Rack 载玻片支架(80003, ibidi)
• 用于检查最佳凝胶体积的刻度纸
• 冰和冷却架
• 标准细胞培养设备(移液器、试管、无菌工作台、细胞培养箱、培养瓶、血球计数器等)
• 倒置显微镜
• 可选:多通道移液器
2.制备3D凝胶
在无菌条件下执行以下所有实验步骤。
可以使用Collagen Type I, Rat Tail 或 Collagen Type I, Bovine来制备层粘连蛋白-I型胶原凝胶。对于两者,首先必须制备4 mg/ml的I型胶原凝胶(见2.1)。
关于移液凝胶的重要注意事项
始终使用预冷的吸头(4°C)来移液凝胶。
由于层粘连蛋白和I型胶原的高粘度,建议在所有涉及层粘连蛋白和I型胶原的步骤中使用反向移液。将移液管压至第二个压力点并完全填充吸头。只在达到第一个压力点时才分配凝胶。这会在吸头中留下一定量的凝胶残余物,但体积更准确。或者,您可以使用专为高粘度溶液设计的移液管。我们推荐使用Eppendorf Visco Tips或Gilson Microman E等产品。
请注意,即使在4°C下,凝胶混合物最多只能在部分凝胶化前使用5分钟。
1.实验前一天,将层粘连蛋白放在冰箱中的冰上于4°C缓慢解冻过夜。按照说明书制备I型胶原。
2.在实验当天,将所有用于凝胶的材料和足够容量的无菌管放入层流罩内的冷却架上。在制备凝胶期间,始终将材料和凝胶放在在冷却架上。
2.1.制备I型胶原凝胶
关于I型胶原浓度的重要说明
由于批次特定的偏差,瓶中的I型胶原蛋白浓度可能会有所不同。
在制备最终工作溶液4 mg/ml之前,将I型胶原调整为4.5 mg/ml的储备溶液。
在CoAtab的I型胶原蛋白产品页面上查看单个批次特定胶原蛋白浓度的分析证书(CoA)。
1.稀释前,必须通过上下移液几次积极混合瓶中的原始I型胶原凝胶。这确保创建了均匀的溶液。
制备I型胶原储备溶液
2.将I型胶原稀释至4.5 mg/ml。对于Collagen Type I, Rat Tail,使用17.5 mM乙酸,对于Collagen Type I, Bovine,使用0.1 M乙酸。在分析证书(CoA)中找到单个批次特定的I型胶原蛋白浓度。
制备4 mg/ml I型胶原工作溶液
3.按照下表中列出的顺序,将所有成分(除了I型胶原)移液到一个预冷的管中。在保持管子在冷却架中的同时彻底混合。
4.将胶原储备溶液加入混合物中,得到最终的工作溶液为4 mg/ml。在保持管子在冷却架中的同 时,通过移液彻底混合。
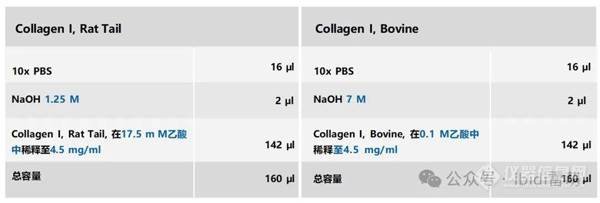
使用预稀释的4.5 mg/ml Collagen I, Rat Tail (左侧)或Collagen I, Bovine (右侧)的储备溶液,配制最终4 mg/ml Collagen I工作溶液的移液方案。请注意,为了正确设置pH值,对于Collagen I, Rat Tail(左侧)使用1.25 M NaOH溶液,而对于Collagen I, Bovine (右侧)使用7 M NaOH溶液。所有成分按移液顺序列出。浓度的差异用蓝色突出显示。
2.2.制备层粘连蛋白-I型胶原凝胶
1.层粘连蛋白与I型胶原的混合比例为4:1(例如,将400 µl层粘连蛋白与100 µl I型胶原工作溶液混合)。
2.在保持管子在冷却架中的同时,通过移液彻底混合。现在凝胶已准备好可以移液到µ-Slide 15 Well 3D的内孔中(见2.3)。
2.3.凝胶应用
1.在层流罩中放置一个µ-Slide支架。从无菌包装中取出µ-Slide 15 Well 3D并将其放在µ-Slide支架上。
2.在µ-Slide下方的罩子中放入一张刻度纸以调整体积。确保载玻片和刻度纸之间的距离约为1-2厘米。
3.始终使用预冷的吸头(4°C)来移液凝胶。
4.为了避免凝胶中出现气泡,请确保在填充到孔中之前凝胶溶液已经充分混合。因此,在将吸头留在凝胶中时,用移液器(10 µl)进行三次上下移动。
5.向µ-Slide 15 Well 3D的每个内孔加入10 µl的凝胶。将移液器吸头直立保持在孔的中间,以防止凝胶泄漏到上部孔中。
6.用盖子盖住µ-Slide载玻片。
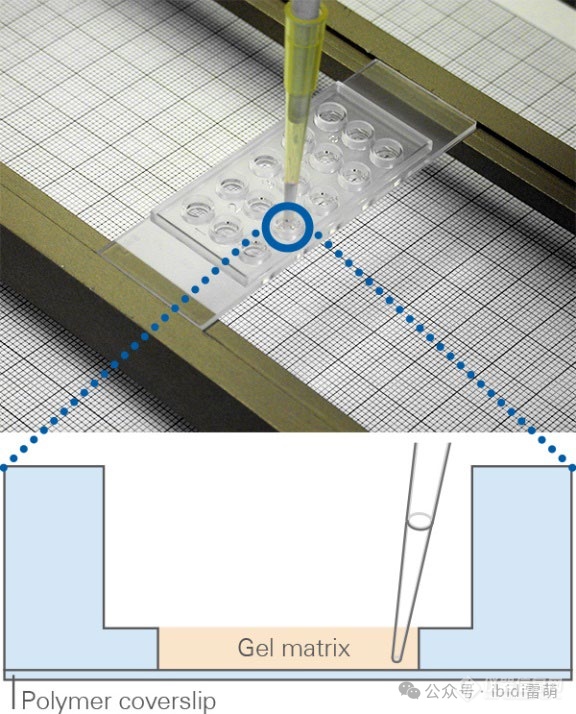
µ-Slide 15 Well 3D 放在带有刻度纸的µ-Slide支架上,用于调整凝胶体积。
调整凝胶体积
无凹凸的凝胶表面对于最佳成像至关重要。为了实现这一点,每个内孔的凝胶体积必须精确为10 µl。由于凝胶的高粘度,可能需要将移液器调整到大于或小于10 µl。
要准确调整凝胶体积,请将载玻片放在µ-Slide支架中的刻度纸上方1-2厘米处。现在将移液器调至10 µl并将凝胶填充到一个内孔中。通过填充的孔观察纸上的标记。如果可以看到放大或缩小效应,则以±1 µl的步骤改变体积,直到你不再观察到放大效应为止。
如果刻度纸的网格看起来较小,则必须增加移液量。如果网格放大了,则必须减少移液量。
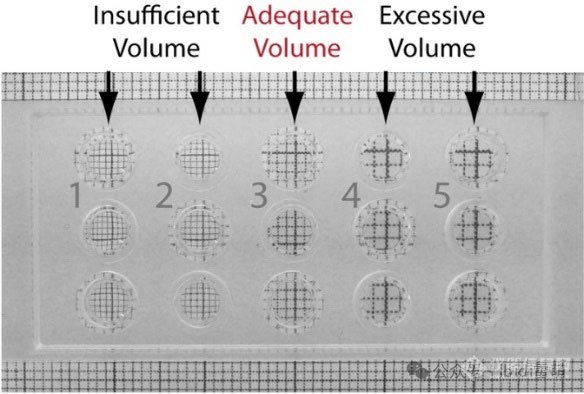
凝胶体积不足会导致刻度纸网格的外观变小,而过量的凝胶体积则会使刻度纸网格的外观增大。
2.4.凝胶化
1.准备一个浸有水的纸巾的培养皿作为湿度室。2. 将µ-Side放入培养皿中并盖上盖子。
3.为了聚合,将整个组件放入培养箱中60分钟。
4.同时,准备细胞悬浮液(见3)。
µ-Slide 15 Well 3D 在湿度室中进行凝胶聚合。
3.细胞接种
凝胶表面接种的细胞数量是获得管形成测定可靠结果的关键参数。细胞数量的偏差会强烈影响管状网络的形成。细胞类型和大小决定了细胞接种数量,并且在开始一系列实验之前必须进行优化。HUVEC应使用低代数(最多到P6)。
在整个操作过程中迅速工作以防止孔干燥是非常重要的。除非另有说明,否则所有给出的体积均为每个孔体积,所有孵育步骤均在室温下进行。
1.收获HUVEC,离心,并在少量的培养基中稀释细胞沉淀(取决于所需的细胞浓度)以进行计数。
2.计数细胞。计数应尽可能准确,并且始终以相同的方式执行,以便在所有孔中都有相同数量的细胞。对于每个孔5000个细胞的最终细胞数,调整它们在培养基中的最终浓度为1 x 105个细胞/ml。
3.从培养箱中取出装有聚合凝胶的µ-Slide 15 Well 3D,并将其放在层流罩下的µ-Slide支架上。
4.在将细胞悬浮液加入孔中之前,通过多次上下移液彻底混合。向每个上部孔加入50 µl。保持移液器吸头直立,不要用移液器吸头触碰凝胶。在此步骤中使用多通道移液器可能很有帮助。
5.用提供的盖子盖住µ-Slide。可选地,可以使用ibiSeal 22 x 48(10872),一种自粘性盖膜,覆盖孔以改善相差显微镜观察
6.µ-Slide 15 Well 3D现在已经准备好进行观察。细胞将通过被动沉降过程沉积到凝胶表面顶部。随后,管形成开始,可以在一个焦平面上成像且无弯液面。
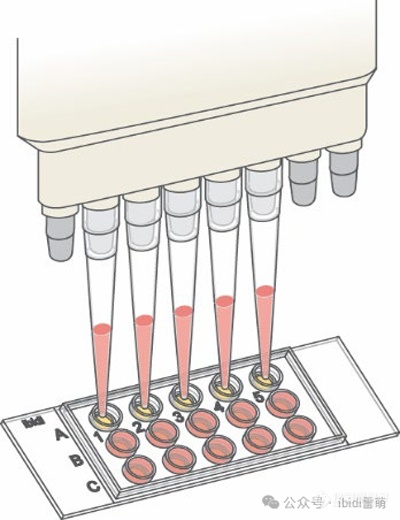
使用多通道移液器将细胞移入µ-Slide 15 Well 3D中
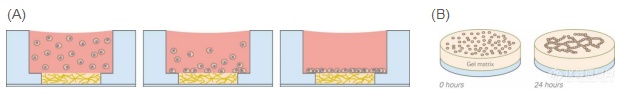
(A) 细胞的被动沉降过程。几分钟后,所有细胞都位于底部。
(B) µ-Slide 15 Well 3D中管形成的示意图(仅显示了凝胶上带有细胞的内孔)。
4.图像采集
管形成可以使用明场、相差或荧光显微镜成像(例如,使用活细胞染料如钙黄绿素染色时)。
显微镜上的数据采集可以手动或自动进行。特别是当首次进行管形成测定实验时,我们建议通过录制延时视频来自动采集数据,以确定时间依赖性和曲线特征(例如,最大值和稳定相位)。在后续实验中,单次手动测量通常足以研究物质对管形成的影响。
对于HUVECs,我们建议使用4倍或10倍放大,并在至少5小时内每5分钟拍摄一次单个帧。为了量化管形成,可以根据不同的参数分析图像,如管长度、环路、细胞覆盖面积或分支点。
5.结果
大鼠尾部和牛层粘连蛋白-I型胶原凝胶均能诱导管状网络的形成。2小时后,管、环和分支点将可见。与Matrigel®相比,网络的结构和网络形成的动态有所不同。本应用说明中不讨论凝胶之间的差异及其原因的进一步详细分析。然而,两种凝胶都可以用来研究特定物质的促血管生成或抗血管生成作用对管形成网络可检测关键参数的影响。
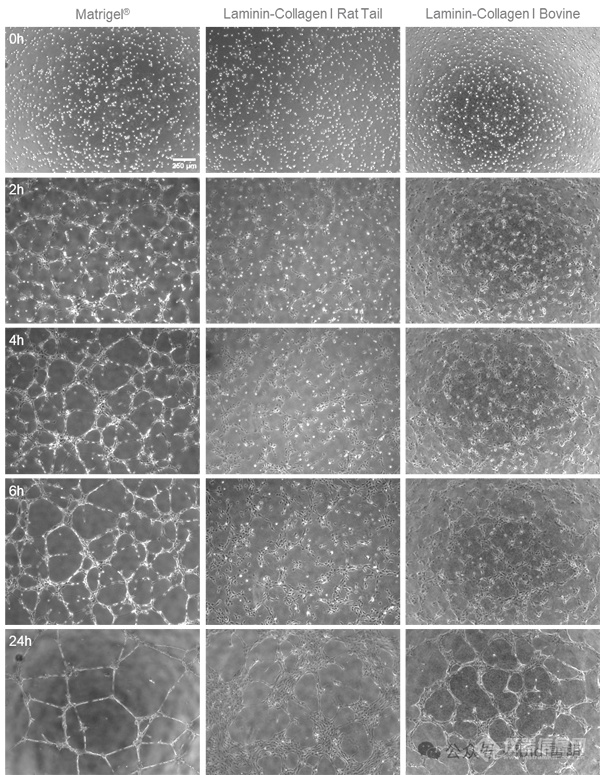
µ-Slide 15 Well 3D中使用HUVECs进行管形成测定的延时图像。在Matrigel®(左侧)、层粘连蛋白-I型胶原大鼠尾部凝胶(中间)和层粘连蛋白-I型胶原牛凝胶(右侧)上,接种细胞0小时、2小时、4小时、6小时和24小时后的相差显微镜观察,使用4倍物镜。
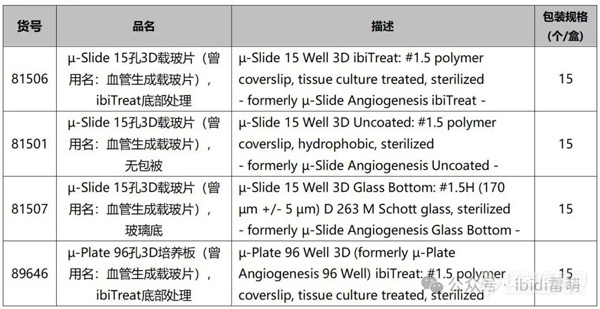
订购信息:
最新动态
更多![]()
新手必看--研磨仪适配器的快速入门指南
厂商
2024.10.24
ibidi,双十一优惠享不停,最高立省30%
厂商
2024.10.22
真空离心浓缩仪的高效浓缩技术篇:浓缩蛋白溶液
厂商
2024.10.17
【共庆十年】德国代表团莅临上海净信,续写中德合作新篇章
厂商
2024.10.11
推荐产品
推荐产品
供应产品













